胶原肽重组产品的制备及其应用
文献发布时间:2023-06-19 12:14:58
技术领域
本发明涉及生产含有重组胶原肽的胶原肽制剂的方法,通过这些方法生产得到的胶原肽制剂,包含所述胶原肽制剂的产品以及上述制剂和产品的应用。
背景技术
胶原是一种发现于动物体内的细胞外结构蛋白,如哺乳动物、鸟类和鱼类。通常发现于结缔组织中,特别是作为细胞外基质的一部分。肌腱、韧带、软骨和骨骼中的胶原尤为丰富。然而,在植物和单细胞生物体中未发现胶原。
胶原存在着结构和功能不同的类型,并且在结构、功能和来源等方面也有所差异。构成胶原的多肽链在细胞中以较大前体分子的形式在内质网的核糖体上单独合成,并具有大量的重复(Gly-X-Y)
这些前体多肽链在内质网中多肽链的脯氨酸和赖氨酸残基上发生翻译后羟基化,同时形成羟脯氨酸和羟赖氨酸残基。羟基化用于稳定细胞中形成的右旋三螺旋的相邻胶原多肽链,其中每条链由三条前体多肽链(前胶原)组成。
如此形成的前胶原在细胞内糖基化,由细胞以糖基化的三螺旋形式(原胶原)分泌,随后通过肽酶介导的末端残基切割形成胶原。在原纤维形成过程中,其积累形成胶原纤维丝,然后胶原纤维丝共价交联形成胶原纤维。
胶原通常以变性形式(即明胶)或水解产物形式使用。
如果将明胶和胶原进行水解处理,特别是酶法水解,则可产生具有多种组分和应用范围的胶原水解产物,这取决于所用胶原的类型、来源和酶促条件。这些胶原水解产物代表肽的混合物,其分子量分布在一定的范围内。这种胶原水解产物的用途,例如,作为食品补充剂或作为美容助剂,早已为人所知,尤其是用于预防和/或治疗与骨骼、关节或结缔组织相关的不适症。
因此,WO 2012/065782描述了从猪皮明胶获得的胶原水解产物,其被用于刺激皮肤细胞的细胞外基质蛋白的生物合成,并且特别适用于美容目的。
WO 2012/117012公开了平均分子量为1500~8000Da的来自牛裂解物的酶水解胶原,其可与益生元一起用于预防和/或治疗骨质疏松症。
尽管从动物材料获得的胶原水解产物的使用对于许多应用和消费者群体具有优势,但考虑到某些消费者群体和应用概况,使用以这种方式获得的胶原水解产物也可能不太理想。某些消费者群体从根本上排斥或反对从动物材料中获得的原材料,无论是担心污染(包括微生物或对健康有害的试剂,例如工艺助剂)或不必要的免疫反应,还是出于宗教或道德原因。此外,用于获得从动物材料获得的胶原水解产物的制造工艺通常包括复杂且昂贵的开发、纯化和进一步加工过程。最后,对于某些应用来说,提供一种胶原水解产物可能是有用的,该水解产物在其来源和组成方面是标准化的、精确的和可靠的,该胶原水解产物也可以有利地以工业规模廉价的生产。
在这种背景下,不出意外的使用重组基因工程的方法开发出了生产明胶和胶原及其水解产物的方法。
因此,WO 2006/052451 A2公开了在同样表达人脯氨酰羟化酶的毕赤酵母菌株中生产重组III型胶原。
WO 2005/012356 A2公开了从人I型胶原和个体50kDa、65kDa和100kDa胶原肽品种生产明胶,每种分别是完全羟基化、部分羟基化和非羟基化的形式。
WO 01/34646 A2同样公开了单个重组明胶品种的生产,每个品种具有由重组生产途径得到的确定分子量,其可以以非羟基化、部分羟基化或完全羟基化的形式存在。
然而,生产重组胶原或其水解产物是有问题的,所述重组胶原或其水解产物的特征在于其结构和功能特性与从天然来源获得的胶原或胶原水解产物相同或至少相似。部分原因是因为胶原的自然形成是一个相对复杂的生理过程,其特征是存在许多细胞内和细胞外影响因素,其中也包括翻译后合成步骤,如糖基化和羟基化。这些翻译后的合成步骤,特别是脯氨酸和赖氨酸的特定定位和羟基化程度,确保了提供稳定的原胶原,其最终结合形成原纤维和纤维。由此可见,从Wang等人(工程生物学,2017(1),18-23)公开的文献来看,本领域公知的是,当前胶原的重组生产的特征在于低产量、高成本,特别是在天然胶原的形成中发生的缺失或偏离的翻译后合成步骤。还已知正是这些翻译后修饰对于胶原的天然结构和功能以及使用胶原或胶原水解产物的应用都是必需的。
因此,迄今为止,已知没有重组产生的胶原或胶原水解产物具有与天然胶原或由其获得的胶原水解产物相同的结构,特别是翻译后修饰的质量和数量,特别是羟基化和糖基化的程度以及羟基化和糖基化位置。
除其他原因外,由于上述情况,特别是原料和生产方法的差异,不可能提供具有传统生产的胶原或胶原水解物的特性潜力的重组生产的胶原和胶原水解物。特别是在本身适合于工业生产重组蛋白的原核生物中,重组胶原的生产在其他原因中是有问题的,因为一般来说,翻译后合成步骤也必须通过使用重组技术将其引入细胞中,从而导致了额外的代谢负担,使得所需胶原肽的表达和生产变得困难和不可能。此外,外源蛋白的表达可能对宿主细胞产生毒性,在宿主细胞中或从宿主细胞中回收重组产生的蛋白可能被证明在技术上或经济上是不可行的,因为获得的表达产物的稳定性可能太低,或可能发生其他效应如宿主细胞的生长和生殖障碍。
因此,目前仍然有大量对重组产生的胶原水解产物的需求,用于各种领域的应用,特别是也用于治疗目的,特别是用于预防或治疗影响人和动物的肌肉、关节、骨骼和皮肤的病症或疾病。
因此,本发明是基于提供用于生产胶原肽制剂的方法和由此获得的重组胶原肽制剂的技术问题,其克服了上述的缺点,特别地,其可以以标准化的、可靠的和精确定义的形式、也以更大的工业规模和具成本效益的规模进行重组生产,并且其特别地显示出更好的性质,特别地,具有与从动物材料获得的相应胶原水解产物相当的效力,特别是在维持肌肉、关节、骨骼和皮肤的健康以及预防或治疗影响人和动物的肌肉、关节、骨骼和皮肤的疾病方面生物有效性的发展。
发明内容
本发明通过提供独立权利要求的教导,特别也是在说明书中的优选实施方式和从属权利要求的教导下,解决了上述潜在的技术问题。
本发明尤其涉及一种生产含有重组胶原肽的胶原肽制剂的方法,包括如下步骤:
a)提供包含至少一个表达盒的表达系统,所述表达盒包含至少一个可编码分子量为8~100kDa胶原肽的核苷酸序列;
b)在允许胶原肽表达的条件下孵育所述表达系统;
c)得到所述胶原肽;
d)在胶原肽制剂生产的条件下水解所述胶原肽,所述胶原肽制剂包含平均分子量为1~7kDa且分子量为0.1~13.5kDa的胶原肽;
e)得到所述胶原肽制剂。
根据本发明提供的用于生产胶原肽制剂的方法,其特征尤其在于以下事实:重组生产的胶原肽制剂通过从至少一种(优选精确定义的)特定大小为8~100kDa的重组生产的胶原肽水解来提供,所述胶原肽具有有利地由用于水解的重组特定胶原肽种类和由随后的步骤产生的分子量分布和结构,特别是水解步骤,特别是羟基化范围,并且尽管其是重组生产的,但其特征在于直接和无需进一步制备步骤的有利的生物活性。
本发明提供的胶原肽制剂由于其重组生产方法,特别是关于通过翻译后合成步骤(例如羟基化和糖基化)对从天然来源获得的胶原水解产物引入的修饰,导致其结构表现出显著差异。令人惊讶的是,它们可以以多种表达系统提供,甚至以工业规模提供,而没有不希望存在的污染,同时具有有利的生物有效性,特别是在用于维持和改善骨、软骨、皮肤、毛发和指甲的健康的应用方面。
本发明发现的、此处提供的重组胶原肽制剂的生物有效性已经适用于直接水解获得的制剂,而不需要进一步的加工步骤。
根据本发明发现的生物有效性和本发明的重组产生的胶原肽制剂可以特别地使用体外试验来测定,所述体外试验用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白的合成,优选地使用体外试验来刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白或编码这些蛋白的mRNA的合成,特别地使用实施例3~7、特别是实施例3~5中所示的体外试验来刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白的合成。
在一个优选的实施方式中,本发明制备的含有重组胶原肽的胶原肽制剂在至少一种用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白合成的体外试验中,特别是在实施例3~7(特别是实施例3~5中)所示的至少一种,优选至少两种,优选所有用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白合成的体外试验中,显示出生物活性。
本发明制备的含重组胶原肽的胶原肽制剂在至少一种刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白合成的体外试验中,特别是实施例3~7(特别是,在实施例3~5中)所示的在至少一个、优选至少两个、优选在所有用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白合成的体外试验中,与从天然来源分离的胶原肽制剂(特别是非重组产生的胶原肽制剂)具有相同的生物学效力。
本发明制备的含重组胶原肽的胶原肽制剂特别优选在至少一种用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白合成的体外试验中,特别是在实施例3~7(特别是,在实施例3~5中)所示的在至少一个、优选至少两个、优选在所有用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白合成的体外试验中,与从天然来源分离的胶原肽制剂(特别是非重组产生的胶原肽制剂)相比,具有更好的生物有效性。
在本发明的一个优选实施方式中,步骤a)中提供的表达系统是基于细胞的或无细胞的表达系统。
步骤a)中提供的表达系统,特别是基于细胞的表达系统,优选是宿主细胞,特别是原核或真核细胞。
所述表达系统,特别是基于细胞的表达系统,优选是选自细菌细胞、酵母细胞、真菌细胞、哺乳动物细胞、昆虫细胞和植物细胞的宿主细胞。
所述表达系统,特别是基于细胞的表达系统,优选是细菌细胞,特别是大肠杆菌或枯草芽孢杆菌。
在另一个优选的实施方式中,所述表达系统,特别是基于细胞的表达系统,是酵母细胞,特别是酿酒酵母、毕赤酵母或Ogataea angusta(多形汉逊酵母)的种。
所述表达系统,特别是基于细胞的表达系统,优选是真菌细胞,特别是黑曲霉种的真菌细胞。
在本发明的另一个优选实施方式中,所述表达系统,特别是基于细胞的表达系统是哺乳动物细胞,特别是CHO细胞、HeLa细胞或HEK293细胞。
所述表达系统,特别是基于细胞的表达系统,优选是昆虫细胞,特别是Sf-9、Sf-21或Tn-5细胞。
所述表达系统,特别是基于细胞的表达系统,优选是植物细胞,特别是玉米或烟草细胞。
在本发明的另一个优选实施方式中,步骤a)中提供的表达系统是能够使表达的胶原肽的脯氨酸残基、赖氨酸残基或脯氨酸残基和赖氨酸残基羟基化的表达系统,特别是基于细胞的表达系统。步骤a)中提供的表达系统优选是能够将表达的胶原肽的脯氨酸残基、赖氨酸残基或脯氨酸残基和赖氨酸残基羟基化的宿主细胞。
步骤a)中提供的表达系统优选是表现出脯氨酰羟化酶活性和/或赖氨酰羟化酶活性的表达系统,特别是基于细胞的表达系统。步骤a)中提供的表达系统优选是显示脯氨酰羟化酶活性和/或赖氨酰羟化酶活性的宿主细胞。
在一个优选的实施方式中,步骤a)中提供的表达系统是基于细胞的表达系统,其包括至少一个表达盒,所述表达盒包含编码脯氨酰4-羟化酶的多核苷酸序列。步骤a)中提供的表达系统特别优选是包括至少一个表达盒的基于细胞的表达系统,所述表达盒包含编码脯氨酰4-羟化酶的多核苷酸序列,从而在步骤e)中获得体内羟基化胶原肽制剂。
在一个优选的实施方式中,步骤a)中提供的表达系统是基于细胞的表达系统,其包括至少一个表达盒,所述表达盒包含编码赖氨酰羟化酶的多核苷酸序列。步骤a)中提供的表达系统特别优选是包括至少一个表达盒的基于细胞的表达系统,所述表达盒包含编码赖氨酰羟化酶的多核苷酸序列,从而在步骤e)中获得体内羟基化胶原肽制剂。
在本发明的另一个优选实施方式中,步骤a)中提供的表达系统是基于细胞的表达系统,其包括至少一个包含脯氨酰-4-羟化酶编码多核苷酸序列的表达盒和至少一个包含赖氨酰羟化酶编码多核苷酸序列的表达盒。步骤a)中提供的表达系统特别优选是基于细胞的表达系统,其包括至少一个包含脯氨酰-4-羟化酶编码多核苷酸序列的表达盒和至少一个包含赖氨酰羟化酶编码多核苷酸序列的表达盒,从而在步骤e)中获得体内羟基化胶原肽制剂。
因此,本发明还包括一种生产含有重组胶原肽的胶原肽制剂,特别是体内羟基化胶原肽制剂的方法,包括以下步骤:
a)提供包含至少一个表达盒的基于细胞的表达系统,其中所述表达盒包含至少一个编码分子量为8~100kDa的胶原肽的核苷酸序列,并且其中所述基于细胞的表达系统能够使所表达的胶原肽的脯氨酸残基、赖氨酸残基或脯氨酸和赖氨酸残基羟基化;
b)在所述胶原肽能够表达和羟基化的条件下孵育所述表达系统,特别是培养基于细胞的表达系统;
c)获得胶原肽,特别是体内羟基化的胶原肽;
d)在可产生胶原肽制剂的条件下水解胶原肽,特别是体内羟基化的胶原肽,所述胶原肽,特别是体外羟基化的胶原肽,具有1~7kDa的平均分子量和0.1~13.5kDa的分子量;
e)得到胶原肽制剂,特别是体内羟基化胶原肽制剂,以下也称胶原肽制剂A。
借助于上述方法,因此有利地可能获得具有体内羟基化的重组产生的胶原肽的胶原制剂,所述胶原肽具有特定的分子量和特定的平均分子量,这取决于所用的基于细胞的表达系统,其特征在于翻译后修饰的特定模式,特别是羟基化和糖基化。以这种方式,特别有利地可以获得具有生物有效性的胶原肽制剂,即,无需对胶原肽制剂的胶原肽进行随后的修饰。
在一个优选的实施方式中,含有本发明制备的重组胶原肽的体内羟基化胶原肽制剂,即胶原肽制剂A,在至少一种用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白合成的体外试验中,特别是在实施例3~7(特别是实施例3~5中)所示的至少一个、优选至少两个、优选所有用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白合成的体外试验中,显示具有生物活性。
含有本发明制备的重组胶原肽的体内羟基化胶原肽制剂,即胶原肽制剂A,优选在至少一种用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白的合成的体外试验中,特别是在实施例3~7(特别是在实施例3~5中)中所示的至少一个、优选至少两个、优选在所有用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白的合成体外试验中,表现出与从天然来源分离的胶原肽制剂,特别是非重组产生的胶原肽制剂具有相同的生物学效力。
含有本发明制备的重组胶原肽的体内羟基化胶原肽制剂,即胶原肽制剂A,特别优选地在至少一个体外试验中,用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白的合成,特别是在实施例3~7(特别是在实施例3~5中)中所示的至少一个、优选至少两个、优选在所有用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白的合成的体外试验中,显示出比分离自天然来源的胶原肽制剂,特别是非重组产生的胶原肽制剂更好的生物有效性。
本发明的另一个实施方式,步骤a)中提供的表达系统是不能使表达的胶原肽的脯氨酸残基、赖氨酸残基或脯氨酸和赖氨酸残基羟基化的表达系统,特别地,步骤a)中提供的表达系统并未展现出脯氨酰羟化酶活性和赖氨酰羟化酶活性。
因此,本发明包括生产含重组胶原肽的胶原肽制剂,特别是非羟基化胶原肽制剂的方法,该方法包括以下步骤:
a)提供包含至少一个表达盒的基于细胞的表达系统,其中所述表达盒包含至少一个编码分子量在8~100kDa的胶原肽的核苷酸序列,并且其中所述表达系统不能使所表达的胶原肽的脯氨酸残基、赖氨酸残基或脯氨酸和赖氨酸残基羟基化;
b)在允许胶原肽表达的条件下孵育所述表达系统;
c)获得胶原肽,特别是非羟基化的胶原肽;
d)在可产生胶原肽制剂的条件下水解胶原肽,特别是非羟基化的胶原肽,所述胶原肽制剂包括平均分子量为1~7kDa且分子量为0.1~13.5kDa的胶原肽;
e)获得胶原肽制剂,特别是非羟基化的胶原肽,以下也称为胶原肽制剂B。
在一个优选的实施方式中,含有本发明制备的重组胶原肽的非羟基化胶原肽制剂,即胶原肽制剂B,在用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白合成的至少一种体外试验中,特别是在实施例3~7(特别是实施例3~5中)所示的用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白合成的至少一个、优选至少两个、优选所有体外试验中,显示具有生物活性。
优选地,本发明制备的含有重组胶原肽的非羟基化胶原肽制剂,即胶原肽制剂B,在至少一个用于表现出刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白合成的体外试验中,特别是在实施例3~7(特别是实施例3~5)所示的至少一个,优选至少两个、优选所有用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白的合成的体外试验中,具有与从天然来源分离的胶原肽制剂,特别是非重组产生的胶原肽制剂相同的生物学效力。
本发明制备的含有重组胶原肽的非羟基化胶原肽制剂,即胶原肽制剂B,特别优选地在至少一种用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白合成的体外试验中,特别是在实施例3~7(特别是实施例3~5)所示的至少一个,优选至少两个、优选所有用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白的合成的体外试验中,显示出比分离自天然来源的胶原肽制剂,特别是非重组产生的胶原肽制剂更好的生物有效性。
在本发明的一个优选实施方式中,在进行步骤d)之前,在步骤x1)中将步骤c)中获得的胶原肽羟基化,然后在步骤e)中获得裂解前离体羟基化的胶原肽制剂。
因此,本发明还包括一种用于生产含有重组胶原肽的胶原肽制剂的方法,特别是裂解前离体羟基化的胶原肽制剂,所述方法包括以下步骤:
a)提供包含至少一个表达盒的表达系统,其中所述表达盒包含至少一个可编码分子量在8~100kDa范围内的胶原肽的核苷酸序列,并且其中所述表达系统不能使所表达的胶原肽的脯氨酸残基、赖氨酸残基或脯氨酸和赖氨酸残基羟基化;
b)在允许胶原肽表达的条件下孵育所述表达系统;
c)得到胶原肽;
x1)将步骤c)中获得的胶原肽进行离体羟基化;
d)在可以产生胶原肽制剂的条件下水解所述胶原肽,特别是离体羟基化胶原肽,所述胶原肽制剂,特别是离体羟基化胶原肽包含平均分子量为1~7kDa且分子量为0.1~13.5kDa的胶原肽;
e)获得胶原肽制剂,特别是裂解前离体羟基化的胶原肽制剂,以下也称为胶原肽制剂C。
在一个优选的实施方式中,本发明制备的含有重组胶原肽的裂解前离体羟基化胶原肽制剂,即胶原肽制剂C,在至少一种用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白合成的体外试验中,特别是在实施例3~7(特别是实施例3~5中)所示的至少一个、优选至少两个、优选所有用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白合成的体外试验中,显示具有生物活性。
本发明制备的含有裂解前离体羟基化胶原肽的重组胶原肽制剂,即胶原肽制剂C,优选在至少一种用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白的合成的体外试验中,特别是在实施例3~7(特别是在实施例3~5中)所示的至少一个、优选至少两个、优选所有用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白的合成的体外试验中,表现出与从天然来源分离的胶原肽制剂,特别是具有与非重组产生的胶原肽制剂相同的生物学效力。
本发明制备的含有重组胶原肽的裂解前离体羟基化胶原肽制剂,即胶原肽制剂C,特别优选地在至少一种用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白合成的体外试验中,特别是在实施例3~7(特别是实施例3~5中)所示的至少一个、优选至少两个、优选所有用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白合成的体外试验中,显示出比分离自天然来源的胶原肽制剂,特别是非重组产生的胶原肽制剂更好的生物有效性。
在本发明的另一个优选实施方式中,在进行步骤d)之后,在步骤x2)中将步骤d)中制备的胶原肽制剂羟基化,并且在步骤e)中获得裂解后离体羟基化的胶原肽制剂。
因此,本发明还包括一种用于生产含有重组胶原肽的胶原肽制剂的方法,特别是裂解后离体羟基化的胶原肽制剂,其包括以下步骤:
a)提供包含至少一个表达盒的表达系统,其中所述表达盒包含至少一个可编码分子量在8~100kDa范围内的胶原肽的核苷酸序列,并且其中所述表达系统不能使所表达的胶原肽的脯氨酸残基、赖氨酸残基或脯氨酸和赖氨酸残基羟基化;
b)在允许胶原肽表达的条件下孵育所述表达系统;
c)得到胶原肽;
d)在可以产生胶原肽制剂的条件下水解所述胶原肽,所述胶原肽制剂包含平均分子量为1~7kDa且分子量为0.1~13.5kDa的胶原肽;
x2)将步骤d)中获得的胶原肽进行离体羟基化;
e)获得胶原肽制剂,特别是裂解后离体羟基化的胶原肽制剂,以下也称为胶原肽制剂D。
在一个优选的实施方式中,含有本发明制备的重组胶原肽的裂解后离体羟基化胶原肽制剂,即胶原肽制剂D,在至少一种用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白合成的体外试验中,特别是在实施例3~7(特别是实施例3~5中)所示的至少一个、优选至少两个、优选所有用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白合成的体外试验中,显示具有生物活性。
本发明制备的含有重组胶原肽的裂解后离体羟基化胶原肽制剂,即胶原肽制剂D,优选在至少一种用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白的合成的体外试验中,特别是在实施例3~7(特别是实施例3~5中)所示的至少一个、优选至少两个、优选所有用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白的合成的体外试验中,表现出与从天然来源分离的胶原肽制剂,特别是与非重组产生的胶原肽制剂相同的生物学效力。
本发明制备的含有重组胶原肽的裂解后离体羟基化胶原肽制剂,即胶原肽制剂D,特别优选地在至少一种用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白合成的体外试验中,特别是在实施例3~7(特别是实施例3~5中)所示的至少一个、优选至少两个、优选所有用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白合成的体外试验中,显示出比分离自天然来源的胶原肽制剂,特别是非重组产生的胶原肽制剂更好的生物学效力。
根据本发明的一个优选实施方式,所述至少一个表达盒的至少一个核苷酸序列是密码子优化的,即,核苷酸序列中未使用或未优选使用的那些密码子被所提供的表达系统取代,特别是被所提供的基于细胞的表达系统,特别是所提供的宿主细胞的翻译系统优选使用的那些密码子取代,而并不因此改变所编码的肽或蛋白质的氨基酸序列。
在本发明的一个优选实施方式中,所述由核苷酸序列编码的胶原肽是来自脊椎动物的胶原肽,特别是哺乳动物,例如人或非人哺乳动物,例如马、驴、袋鼠、羊、啮齿动物、猪或牛,例如鸟类,例如鸡、鱼,例如两栖动物,爬行动物或无脊椎动物,例如水母。
由核苷酸序列编码的胶原肽优选具有I、II、III、IV、V、VI、VII、VIII、IX、X、XI、XII、XIII、XIV、XV、XVI、XVII、XVII、XVIII、XIX、XX、XXI、XXII、XXIII、XXIV、XXV、XXVI、XXVII型胶原中的氨基酸序列,优选I型、II型或III型,优选II型,优选III型。
所述由核苷酸序列编码的胶原肽优选I型、II型或III型,优选I型或II型,特别优选I型。
由所述核苷酸序列编码的胶原肽优选包括存在于来自脊椎动物,特别是鱼、两栖动物、爬行动物、鸟类和哺乳动物的胶原中的氨基酸序列,特别是人、牛、猪、马或鸟类的I型、II型或III型胶原,优选I型,优选II型,优选III型胶原。
由所述核苷酸序列编码的胶原肽特别优选包括存在于人胶原中的氨基酸序列,特别是存在于人I型胶原中,优选存在于人I型胶原的α1链中。
由所述核苷酸序列编码的胶原肽特别优选地包括存在于非人胶原中的氨基酸序列,特别是存在于非人I型胶原中,优选地存在于非人I型胶原的α1链中,特别是存在于牛、猪、马或鸟类胶原中的氨基酸序列。
由核苷酸序列编码的胶原肽优选为天然存在的胶原肽。在本发明的另一个优选实施方式中,由核苷酸序列编码的胶原肽不是天然存在的胶原肽。由核苷酸序列编码的胶原肽优选为遗传修饰的胶原肽。在本发明特别优选的实施方式中,由核苷酸序列编码的胶原肽是遗传修饰的胶原肽,其中胶原肽中天然存在的氨基酸序列的至少一个氨基酸,优选至少一个非必需氨基酸,特别是天然存在的胶原肽中氨基酸序列的Ala,Asn,Asp,Glu,Ser,已经被至少一种必需氨基酸替换,特别是Ile、Leu、Lys、Met、Phe、Thr、Trp、Val、His、Cys、Tyr,特别优选Trp。
根据本发明,由核苷酸序列编码的胶原肽是遗传修饰的胶原肽,其中在天然存在的胶原肽的氨基酸序列中添加了至少一个氨基酸,优选至少一个必需氨基酸,特别是Ile、Leu、Lys、Met、Phe、Thr、Trp、Val、His、Cys、Tyr,特别优选Trp。在这种情况下,本发明可以提供,所述至少一个氨基酸,优选所述至少一个必需氨基酸,特别是Ile、Leu、Lys、Met、Phe、Thr、Trp、Val、his、Cys、Tyr,特别优选Trp,已经在N-末端、C-末端和/或在天然存在的胶原肽的氨基酸序列内添加。
根据本发明的一个优选实施方式,所述至少一个核苷酸序列编码的胶原肽的分子量优选为8~95kDa,优选8~90kDa,优选8~85kDa,优选8~80kDa,优选9~95kDa,优选9~90kDa,优选9~85kDa,优选9~80kDa,优选10~95kDa,优选10~90kDa,优选10~85kDa,优选10~80kDa。
在本发明特别优选的实施方式中,水解是酶促或酸催化的水解,优选酶促水解,优选酸催化的水解。步骤c)中获得的胶原肽的水解特别优选通过加入至少一种细菌或微生物蛋白酶,特别是至少一种细菌和/或微生物丝氨酸、半胱氨酸、天冬氨酸和/或金属蛋白酶,优选至少一种细菌和/或微生物内切蛋白酶,优选至少一种细菌和/或微生物外切蛋白酶来进行。
在本发明的另一个优选实施方式中,所述胶原肽在步骤d)中,在可以产生含有胶原肽的胶原肽制剂的条件下进行水解,其中所述所述胶原肽的平均分子量为1~3kDa和分子量为0.1~10kDa、优选0.18~10kDa、优选0.2~10kDa。
在本发明的一个优选实施方式中,所述胶原肽在步骤d)中,在可以产生含有平均分子量为1~5kDa且分子量为0.1~12kDa、优选0.18~12kDa、优选0.2~12kDa的胶原肽的胶原肽制剂的条件下水解。
本发明还涉及使用本发明的上述方法之一制备的胶原肽制剂,特别是含有平均分子量为1~7kDa且分子量为0.1~13.5kDa、优选0.18~13.5kDa、优选0.2~13.5kDa的胶原肽的胶原肽制剂。
在本发明的一个优选实施方式中,用本发明的上述方法之一生产的胶原肽制剂,特别是包括平均分子量为1~7kDa且分子量为0.1~13.5kDa的胶原肽的胶原肽制剂,是非羟基化的、部分羟基化的或完全羟基化的胶原肽制剂,优选非羟基化的胶原肽制剂,优选部分羟基化的胶原肽制剂,优选完全羟基化的胶原肽制剂。
根据本发明用上述方法之一生产的胶原肽制剂,特别是含有平均分子量为1~7kDa和分子量为0.1~13.5kDa的胶原肽的胶原肽制剂,优选是胶原肽制剂,其中至少1%,优选至少2%,优选至少3%,优选至少4%,优选至少5%,优选至少10%,优选至少15%,优选至少20%,优选至少25%,优选至少30%,优选至少35%,优选至少40%,优选至少45%,优选至少50%的胶原肽的脯氨酰残基,优选赖氨酰残基,特别优选脯氨酰和赖氨酰残基是羟基化的,优选在体内羟基化,优选在体外羟基化,特别是在体外羟基化前裂解或体外羟基化后裂解。
根据本发明的上述方法之一制备得到的胶原肽制剂,特别是包括平均分子量为1~7kDa和分子量为0.1~13.5kDa的胶原肽的胶原肽制剂,特别优选胶原肽制剂,其中至多95%,优选至多90%,优选至多85%,优选至多80%,优选至多75%,优选至多70%,优选至多65%,优选至多60%,优选至多55%,优选至多50%,优选至多45%,优选至多40%,优选至多35%,优选至多25%,优选至多20%,优选至多15%,优选至多10%,优选至多5%的脯氨酰残基,优选赖氨酰残基,特别优选胶原肽的脯氨酰和赖氨酰残基被羟基化,优选在体内羟基化,优选离体羟基化,特别是在体外裂解前羟基化或体外裂解后羟基化。
在本发明的另一个优选实施方式中,根据本发明的上述方法之一生产得到的胶原肽制剂,特别是包括平均分子量为1~7kDa和分子量为0.1~13.5kDa的胶原肽的胶原肽制剂,其中0.5~80%,优选1~75%,优选5~70%,优选5~65%,优选10~60%,优选15~55%,优选20~50%,优选25~50%,优选30~50%,优选35~50%,优选40~50%的胶原肽的脯氨酰残基,优选赖氨酰残基,特别优选脯氨酰和赖氨酰残基是羟基化的,优选在体内羟基化,优选在体外羟基化,特别是在体外裂解前羟基化或在体外裂解后羟基化。
在本发明的一个优选实施方式中,根据本发明的方法之一生产得到的胶原肽制剂,特别是包括平均分子量为1~7kDa和分子量为0.1~13.5kDa的胶原肽的胶原肽制剂,是胶原肽被糖基化的胶原肽制剂。胶原肽优选在体内糖基化,优选在体外糖基化。至少1%,优选至少2%,优选至少3%,优选至少4%,优选至少5%,优选至少6%,优选至少7%,优选至少8%,优选至少9%,优选至少10%,优选至少15%,优选至少20%的羟基残基优选被糖基化,优选在体内糖基化,优选在体外糖基化。
在本发明的另一个优选实施方式中,根据本发明的方法之一生产得到的胶原肽制剂是其胶原肽未糖基化的胶原肽制剂。
在本发明的一个优选实施方式中,胶原肽制剂,特别是包括平均分子量为1~7kDa和分子量为0.1~13.5kDa的胶原肽的胶原肽制剂,是体内羟基化的胶原肽制剂,即,胶原肽制剂A。
在本发明的一个优选实施方式中,胶原肽制剂,特别是包括平均分子量为1~7kDa和分子量为0.1~13.5kDa的胶原肽的胶原肽制剂,是非羟基化的胶原肽制剂,即,胶原肽制剂B。
在本发明的另一个优选实施方式中,胶原肽制剂,特别是包括平均分子量为1~7kDa和分子量为0.1~13.5kDa的胶原肽的胶原肽制剂,是离体羟基化胶原肽制剂,即,胶原肽制剂C或D。
所述胶原肽制剂,特别是包括平均分子量为1~7kDa和分子量为0.1~13.5kDa的胶原肽的胶原肽制剂,优选在裂解前,即在水解之前,对胶原肽制剂离体羟基化,即,胶原肽制剂C。
本发明的另一个实施方式,所述胶原肽制剂,特别是包括平均分子量为1~7kDa和分子量为0.1~13.5kDa的胶原肽的胶原肽制剂,是裂解后的,即水解后,离体羟基化胶原肽制剂,即,胶原肽制剂D。
本发明还特别涉及胶原肽制剂,特别是羟基化或非羟基化的胶原制剂,其通过对在分子量为8~100kDa的宿主细胞中重组产生的胶原肽进行水解得到,所述胶原肽制剂包括平均分子量为1~7kDa和分子量为0.1~13.5kDa的胶原肽。
胶原肽制剂中特征肽的存在有助于其有效性的测定,尤其通过质谱的方式,优选通过ESI(电子喷雾电离)或MALDI质谱,特征肽在质谱中以峰的形式出现。在通过MALDI质谱测定的分子量分布中,与周围相比,特征肽表现出至少两倍的强度,更优选至少四倍的强度。
本发明的胶原肽制剂,特别是胶原肽制剂A、胶原肽制剂B、胶原肽制剂C和胶原肽制剂D,也可以包括大小为1,500~3,500Da的特征肽。
在本发明的另一个优选实施方式中,本发明的胶原肽制剂,特别是胶原肽制剂A、胶原肽制剂B、胶原肽制剂C和胶原肽制剂D,包括最大5.5%、优选最大5%、优选最大4.5%、优选最大4%、优选最大3.5%的胶原肽(尺寸<500Da)。
根据该实施方式,与现有技术中已知的制剂相比,尺寸小于500Da的特别低百分比的肽有利地改善了胶原肽制剂的味道,特别是减少了胶原肽制剂的苦味。
优选35~60%,优选35~55%,优选35~50%,优选36~48%,优选36~46%,优选37~45%,优选38-44%的本发明胶原肽制剂的胶原肽,特别是胶原肽制剂A、胶原肽制剂B、胶原肽制剂C和胶原肽制剂D,其大小在1500Da~3500Da的范围内。
根据本发明的胶原肽制剂,特别是胶原肽制剂A、胶原肽制剂B、胶原肽制剂C和胶原肽制剂D,优选包括最多2.8%、优选最多2.75%、优选最多2.7%、优选最多2.65%、优选最多2.6%、优选最多2.55%、优选最多2.5%、优选最多2.45%、优选最多2.4%、优选最多2.35%、优选最多2.3%的大小在7500Da~13500Da范围内的胶原肽。
本发明的一个特别优选的实施方式,至少93%、优选至少93.5%、优选至少94%、优选至少94.5%、优选至少95%的本发明的包含胶原肽制剂的胶原肽,特别是包含胶原肽制剂A、胶原肽制剂B、胶原肽制剂C和胶原肽制剂D的胶原肽,其大小在500Da~7500Da的范围内。
优选至少94.5%、优选至少95%、优选至少95.5%、优选至少95.6%、优选至少95.7%、优选至少95.6%、优选至少95.7%、优选至少95.8%、优选至少95.9%、优选至少96%、优选至少96.1%、优选至少96.2%、优选至少96.3%、优选至少96.4%、优选至少96.5%的本发明的包含胶原肽制剂的胶原肽,特别是包含胶原肽制剂A、胶原肽制剂B、胶原肽制剂C和胶原肽制剂D的胶原肽,其大小在500Da~13500Da的范围内。
在一个优选的实施方式中,所述胶原肽制剂局部给药,特别是局部(topically)给药,或全身给药,特别是肠道给药,优选口服给药。
根据本发明的一个优选实施方式,所述胶原肽制剂以食物补充剂的形式给药。本发明的食品补充剂特别有利地为溶液、悬浮液或凝胶的形式,例如在安瓿中,为颗粒或粉末的形式。由于其良好的溶解性,胶原肽制剂也可以添加到各种饮料中而不引起浑浊。
根据本发明的一个优选实施方式,除了所述胶原肽制剂之外,本发明提供的食品补充剂不含其他蛋白质或蛋白质水解产物。
根据本发明的一个实施方式,除了所述胶原肽制剂之外,本发明的食品增补剂不含其他生理活性成分,特别是不含蛋白质或蛋白质水解产物。
本发明还涉及包含本发明所述的胶原肽制剂和至少一种添加剂的产品。
本发明的主题也是一种食品补充剂,其包含本发明所述的胶原制剂和至少一种另外的组分,特别是至少一种食品可接受的添加剂。
在一个实施方式中,所述胶原肽制剂可以添加到食品或高档食品中,例如巧克力棒、蛋白质棒、谷物棒、牛奶、奶制品,例如酸奶、乳清或夸克和牛奶替代品,例如豆奶、米乳、杏仁乳和椰奶(所谓的功能性食品)。
因此,本发明的主题也是包含本发明所述的胶原制剂的食品或高档食品。
根据本发明,可以进一步提供以药物组合物的形式给药的胶原肽制剂。本发明的药物组合物特别有利地以例如片剂、锭剂、咀嚼片、胶囊、咬胶囊、包衣片剂、锭剂、汁、凝胶或软膏的形式给药。
本发明还涉及包含本发明所述的胶原肽制剂和至少一种药学上可接受的添加剂的药物组合物。
在另一个实施方式中,可以提供以化妆品组合物的形式给药的胶原肽制剂。本发明的化妆品组合物特别有利地以例如洗剂、软膏剂、霜剂、凝胶剂、粉剂、注射剂或喷雾剂的形式给药。
本发明还涉及包含本发明所述的胶原肽制剂和至少一种皮肤相容性添加剂的化妆品组合物。
如果本发明所述的一个优选实施方式的胶原肽制剂不用作产品的唯一生理活性组分,特别是食品增补剂、食品或高档食品、药物组合物或化妆品组合物,即,其可以与一种或多种对总体健康,特别是耐力表现具有积极作用的其他组分进行组合。这样的组分优选地选自维生素C、B、D、E和K系列的维生素、ω-3脂肪酸、ω-6脂肪酸、共轭亚麻酸、咖啡因及其衍生物、瓜拉那提取物、绿茶提取物、表没食子儿茶素没食子酸酯、肌酸、L-肉碱、α-硫辛酸、N-乙酰半胱氨酸、NADH、D-核糖、天冬氨酸镁、抗氧化剂如花色素苷、类胡萝卜素、类黄酮、白藜芦醇、谷胱甘肽和超氧化物歧化酶(SOD)、大麻素例如大麻二酚(CBD)、适应原(例如红景天、人参、山莨菪、紫草、灵芝)、矿物(例如铁、镁、钙、锌、硒和磷),以及其他蛋白质、水解产物和肽如大豆、小麦和乳清蛋白。
在本发明的一个优选实施方式中,所述胶原肽制剂的给药量为1~40g/天,优选1~30g/天,优选1~20g/天,优选1~15g/天,优选2.5~30g/天,优选2.5~20g/天,优选2.5~15g/天,优选2.5~10g/天,优选4~15g/天,优选4~12g/天,更优选5~25g/天,优选5~15g/天,更优选10~25g/天,优选12~22g/天,特别是12.5~20g/天,特别优选6~15g/天,特别是2.5~7.5g/天,优选2.5~5g/天。
本发明还涉及本发明所述的胶原肽制剂用于维持和改善骨健康的治疗方法,用于预防和/或治疗骨质疏松症,用于预防和/或治疗肌肉减少症,用于预防和/或治疗肌肉质量的退化性损失,用于改善肌肉强度,用于刺激脂肪消耗,以及用于减轻体重。
在一个优选的实施方式中,本发明还涉及本发明所述的胶原肽制剂在预防和/或治疗骨病,特别是骨质疏松症的方法中的应用。
在一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在预防和/或治疗少肌症的方法中的应用。
在一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在预防和/或治疗肌肉质量退化性损失的方法中的应用。
在一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在预防和/或治疗软骨疾病,特别是关节病或关节炎的方法中的应用。
在一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在改善肌肉强度的方法中的应用。
在一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在预防和/或治疗以线粒体活性降低为特征的病理状况的方法中的应用,特别是用于预防和/或治疗以耐力降低为特征的病理状况。
在一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在刺激脂肪消耗的方法中的应用。
在一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在减轻体重的方法中的应用。
在一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在预防和/或治疗退行性关节疾病,特别是骨关节炎、类风湿性关节炎、风湿性疾病、脊椎炎和/或纤维肌痛的方法中的应用。
在一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在预防和/或治疗腱或韧带疾病的方法中的应用。
在一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在预防和/或治疗皮肤病的方法中的应用,特别是寻常型银屑病、痤疮、特应性皮炎、慢性瘙痒和/或酒渣鼻。
在一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在治疗创伤,特别是慢性创伤、急性创伤和/或烧伤的方法中的应用。
在一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在预防和/或治疗退行性神经疾病的方法中的应用。
在一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在预防和/或治疗痴呆的方法中的应用。
在一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在预防和/或治疗阿尔茨海默病的方法中的应用。
在一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在预防和/或治疗以智力下降为特征的病理状况的方法中的应用。
在一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在预防和/或治疗与血脑屏障功能障碍,特别是脑膜的结构和/或功能障碍相关的疾病的方法中的应用。
在一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在预防和/或治疗肠病,特别是慢性炎性肠病的方法中的应用。
在一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在预防和/或治疗心血管系统疾病,特别是血管的结构和/或功能,特别是血管壁,特别是预防和/或治疗高血压和/或循环障碍的方法中的应用。
在一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在预防和/或治疗牙齿固定装置疾病的方法中的应用。
本发明还涉及本发明所述的胶原肽制剂在维持和改善骨健康的非治疗方法,用于预防骨质疏松症,用于预防和/或治疗少肌症,用于预防肌肉质量的退行性损失,用于改善肌肉强度,用于刺激脂肪消耗,用于减轻体重和/或用于预防退行性关节疾病中的应用。
在一个优选的实施方式中,本发明还涉及本发明所述的胶原肽制剂在皮肤的视觉和结构改善的非治疗性方法中的应用,特别是用于减少皱纹、改善皮肤弹性、增加肤色、增加皮肤的含水量、减少脂肪团和/或减少妊娠纹,特别是妊娠纹。
在另一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在促进指甲生长和/或降低指甲脆性的非治疗性方法中的应用。
在一个优选的实施方式中,本发明还涉及本发明所述的胶原肽制剂在头发的光学和结构改善的非治疗性方法中的应用,特别是用于改善头发质量、减少分叉和/或减少/延迟脱发。
在另一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在增加线粒体数量和/或线粒体活性的非治疗方法中的应用。
在另一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在改善耐力表现的非治疗性方法中的应用。
在另一个优选的实施方式中,本发明涉及本发明所述的胶原肽制剂在改善智力的非治疗性方法中的应用。
在本发明的优选实施方式中,本发明所述的胶原肽制剂单独使用(即不使用其他物质)用于根据本发明提供的一种应用中。
在本发明的另一个实施方式中,本发明所述的胶原肽制剂被用作在根据本发明提供的应用中表现出生物活性的唯一试剂。
在进一步优选的实施方式中,在根据本发明提供的应用中,本发明所述的胶原肽制剂可以与至少一种另外的试剂,特别是另外的生物活性剂一起使用。
本发明还涉及预防和/或治疗上述适应症,特别是上述治疗适应症的方法,根据该方法,向人或动物体施用足够量的本发明所述的胶原肽制剂用于治疗目的,任选地与添加剂进行配合。
本发明还涉及用于改善肌肉强度、用于增加肌肉质量、用于刺激脂肪消耗、用于减轻体重、用于维持和/或改善骨骼健康、用于维持和/或改善皮肤健康、用于维持和/或改善肠道健康、用于维持和/或改善血管结构、用于维持和/或改善心血管系统健康、用于维持和/或改善牙龈,用于维持和/或改善人或动物体的指甲和毛发的健康、用于维持和/或增加线粒体的数量和/或线粒体的活性、用于维持和/或改善耐力表现或用于维持和/或改善精神表现的非治疗性方法,其中给予人或动物体至少一种本发明所述的胶原肽制剂。
本发明还涉及应用于制备膜、箔和涂层的方法中的本发明所述的胶原肽制剂。涂层可以是例如油漆和清漆,特别是具有特殊光学效果的油漆和清漆,或用于产生自清洁表面的涂层。
在一个优选的实施方式中,与本发明有关的术语“胶原”以本领域惯用的方式理解,特别是例如在例如WO 01/34646中所定义的。在一个优选的实施方式中,术语“胶原”涉及I型至XXVII型胶原。在另一个优选的实施方式中,术语“胶原”应理解为包括序列甘氨酸-脯氨酸、甘氨酸-4-羟脯氨酸或甘氨酸-X-4-羟脯氨酸,优选重复基序(Gly-X-Y)
就本发明而言,术语“明胶”优选以本领域惯用的方式理解,特别是例如在例如WO01/34646中所定义的。
在本发明中,术语“胶原肽”优选理解为具有如上定义的胶原中存在的氨基酸序列的肽。“胶原肽”优选还理解为是指遗传修饰的胶原肽,其通过修饰天然存在的胶原肽的氨基酸序列而获得,其中从本发明所述的方法的步骤e)中获得的“胶原肽”获得的胶原肽制剂优选在至少一种用于刺激成骨细胞、成纤维细胞和软骨细胞中,特别是在实施例3~7(特别是实施例3~5中)所示的至少一个、优选至少两个、优选所有用于刺激成骨细胞、成纤维细胞和软骨细胞中细胞外基质蛋白合成的体外试验中,具有生物活性,优选与从天然来源分离的胶原肽制剂,特别是与非重组产生的胶原肽制剂具有相同的生物活性,特别优选比从天然来源分离的胶原肽制剂,特别是非重组产生的胶原肽制剂具有更好的生物效力。
在本发明中,术语“重组DNA”表示人工产生或人工操纵的DNA分子,其已经通过基因工程方法在体外产生。在一个优选的实施方式中,重组DNA由来自不同来源生物体的组分组成。
就本发明而言,“重组的胶原肽或重组产生的胶原肽”应理解为指由重组DNA编码的胶原肽。
就本发明而言,术语“表达盒”应被理解为是DNA片段,其负责将该片段中编码的信息转录成RNA,特别是转录成mRNA,并包括至少一个启动子和一个编码蛋白质的核苷酸序列,通常具有至少一个启动子、至少一个编码蛋白质的核苷酸序列和任选的终止子。
在本发明中,“核苷酸序列”应理解为指核酸中的核苷酸的序列,特别是核酸链的核苷酸序列,特别是DNA或RNA链的核苷酸序列。因此,“核苷酸序列”应被理解为既是信息单位,又是物理上表现该信息的DNA或RNA链。
就本发明而言,术语“表达系统”应理解为指其中可发生靶向和受控制的蛋白质生物合成的系统。就本发明而言,术语“表达系统”包括无细胞表达系统以及基于细胞的表达系统,其所述无细胞表达系统中蛋白质生物合成必需的组分不存在于细胞内,即,蛋白质合成发生在细胞外,其中所述基于细胞的表达系统中蛋白质生物合成发生在活细胞内。就本发明而言,无细胞表达系统优选来自大肠杆菌、昆虫细胞、小麦胚芽、烟草细胞或哺乳动物细胞,特别是CHO细胞或兔网织红细胞的裂解物或提取物,其包含蛋白质生物合成所必需的组分,特别是翻译和转录系统。
就本发明而言,“宿主细胞”应理解为指能够表达外源DNA中编码的肽或蛋白质的活细胞,特别是重组DNA中编码的肽或蛋白质的活细胞。
就本发明而言,术语“裂解前”和“裂解后”表示水解之前或之后的时间点,特别是在酶促或酸催化的水解之前或之后。
就本发明而言,术语“孵育”应理解为既指基于细胞的表达系统的培养,特别是宿主细胞的培养,也指某些条件对无细胞表达系统的作用。
就本发明而言,术语根据步骤c)“获得胶原肽”和根据步骤e)“获得胶原肽制剂”应理解为是指本领域技术人员通过已知的分离方法从含有多种组分的组合物中分离胶原肽或胶原肽制剂的方法,例如离心方法,特别是差速离心和/或密度梯度离心、色谱法,特别是凝胶过滤、离子交换、亲和和/或高效液相色谱、电泳法、过滤法和/或萃取法,其中可以优选通过顺序应用多种分离方法从含有多种组分的组合物中富集和纯化相关组分。
就本发明而言,“能使胶原肽表达的条件”应理解为指能激活或增强胶原肽表达的条件,例如特别是温度、压力、时间、光以及诱导剂和/或阻遏剂存在与否。在一个优选的实施方式中,胶原肽的表达发生在高细胞密度发酵的背景下,特别是在高压下,优选在高压空气下。能够表达胶原肽的具体条件是本领域技术人员已知的,并且取决于所使用的表达系统和所使用的表达盒,特别是其中包含的启动子。根据表达盒的结构,胶原肽的表达可以是组成型或诱导型表达。
就本发明而言,术语“在可以产生胶原肽制剂的条件下水解胶原肽”应理解为指那些条件,特别是水解的类型,用于水解的至少一种酶可能的类型和量、pH值、水解时间和水解温度,其可以从重组产生的分子量为8~100kDa的胶原肽获得平均分子量为1~7kDa和分子量为0.1~13.5kDa的胶原肽。例如,在实施例1中,规定了从重组产生的分子量为8~100kDa的胶原肽获得平均分子量为1~7kDa且分子量为0.1~13.5kDa的胶原肽的合适条件。
本发明所引用的胶原肽制剂中胶原肽分子量分布的百分比,与相关胶原肽制剂中所含的所有胶原肽按重量百分比(%)表示。
就本发明而言,术语“包括”和“包含”应理解为除了这些术语明确涵盖的元素之外,还可以添加未明确提及的其他元素。就本发明而言,这些术语还被理解为意味着仅包括明确提及的元件,并且不存在其他元件。在该特定实施方式中,术语“包括”和“包含”的含义与术语“由...组成”同义。此外,术语“包括”和“包含”还包括这样的组合物,其除了明确命名的元素之外,还包含未提及的其他元素,但是在功能和质量上是从属的。在该实施例中,术语“包括”和“包含”与术语“基本上由...组成”同义。
就本发明而言,术语“和/或”被理解为表示由术语“和/或”连接的组的所有成员被公开为彼此的替代,并且还以任何组合的方式彼此累积。对于表述“A、B和/或C”,这意味着以下披露内容应理解为:a)A或B或C,或b)(A和B),或c)(A和C),或d)(B和C),或e)(A和B和C)。
其他优选的实施方式由从属权利要求得出。
附图说明
下面参照附图,表格和相关的示例性实施例描述本发明,而不限制本发明的总体构思。
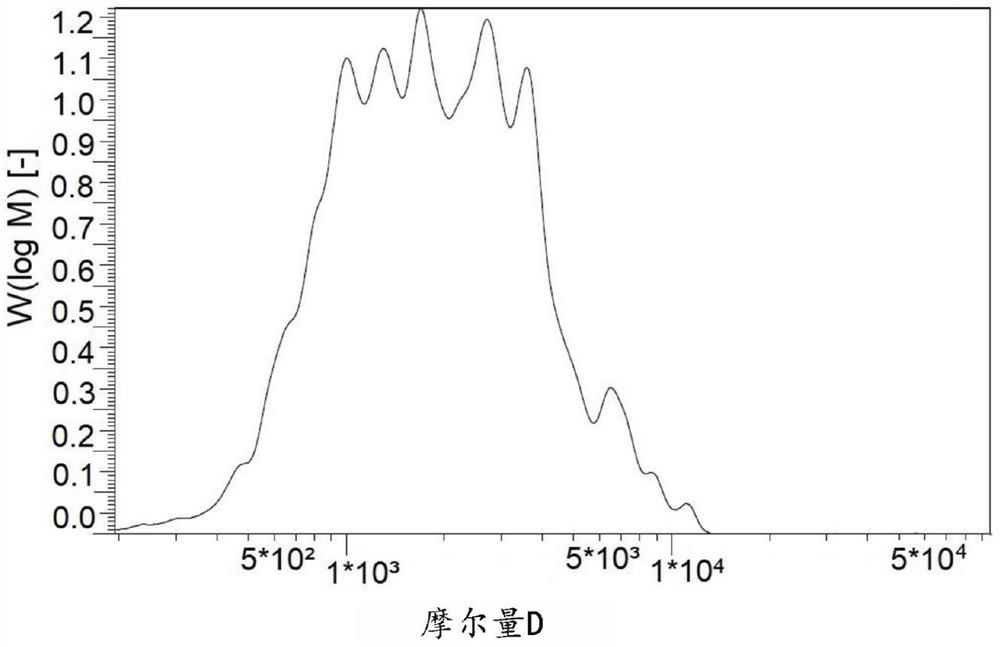
图1示出了在规定的分子量范围内的对比产品1和2的单个胶原肽以及根据实施例1.3、1.4和1.5的胶原肽制剂的百分比。
图2A示出了对比产品1的1%强度溶液的色谱图。分子量以对数刻度绘制在横坐标上。
图2B示出了对比产品2的1%强度溶液的色谱图。分子量以对数刻度绘制在横坐标上。
图3A示出了实施例1.3所述的胶原肽制剂的1%强度溶液的色谱图。分子量以对数刻度绘制在横坐标上。
图3B示出了实施例1.4所述的胶原肽制剂的1%强度溶液的色谱图。分子量以对数刻度绘制在横坐标上。
图4示出了实施例1.5所述的胶原肽制剂的1%强度溶液的色谱图。分子量以对数刻度绘制在横坐标上。
图5示出了在不存在胶原肽(对照1)、存在0.5mg/ml的100kDa胶原肽(对照2)、存在本发明所述的平均分子量为1.8kDa的非羟基化胶原肽制剂(样品1)、存在本发明所述的平均分子量为2.4kDa的非羟基化胶原肽制剂(样品2)或存在本发明所述的平均分子量为3.4kDa的非羟基化胶原肽制剂(样品3)的情况下对原代人成纤维细胞的胶原合成的刺激的比较。误差线显示标准偏差。
图6示出了在不存在胶原肽(对照1)、存在0.5mg/ml的100kDa胶原肽(对照2)、存在本发明所述的平均分子量为1.8kDa的非羟基化胶原肽制剂(样品1)、存在本发明所述的平均分子量为2.4kDa的非羟基化胶原肽制剂(样品2)或存在本发明所述的平均分子量为3.4kDa的非羟基化胶原肽制剂(样品3)的情况下对原代人成纤维细胞的弹性蛋白合成的刺激的比较。误差线显示标准偏差。
图7示出了在不存在胶原肽(对照1)、存在0.5mg/ml的100kDa胶原肽(对照2)、存在本发明所述的平均分子量为1.8kDa的非羟基化胶原肽制剂(样品1)、存在本发明所述的平均分子量为2.4kDa的非羟基化胶原肽制剂(样品2)或存在本发明所述的平均分子量为3.4kDa的非羟基化胶原肽制剂(样品3)的情况下对原代人成纤维细胞的蛋白聚糖合成的刺激的比较。误差线显示标准偏差。
图8示出了在不存在胶原肽(对照1)、存在本发明所述的平均分子量为7kDa的羟基化胶原肽制剂(样品4)、存在本发明所述的平均分子量为5.6kDa的羟基化胶原肽制剂(样品2)或存在本发明所述的平均分子量为1.3kDa的羟基化胶原肽制剂(样品3)的情况下对原代人成纤维细胞的胶原合成的刺激的比较。误差线显示标准偏差。
图9示出了在不存在胶原肽(对照1)、存在本发明所述的平均分子量为7kDa的羟基化胶原肽制剂(样品4)、存在本发明所述的平均分子量为5.6kDa的羟基化胶原肽制剂(样品2)或存在本发明所述的平均分子量为1.3kDa的羟基化胶原肽制剂(样品3)的情况下对原代人成纤维细胞的弹性蛋白合成的刺激的比较。误差线显示标准偏差。
图10示出了在不存在胶原肽(对照1)、存在本发明所述的平均分子量为7kDa的羟基化胶原肽制剂(样品4)、存在本发明所述的平均分子量为5.6kDa的羟基化胶原肽制剂(样品2)或存在本发明所述的平均分子量为1.3kDa的羟基化胶原肽制剂(样品3)的情况下对原代人成纤维细胞的蛋白聚糖合成的刺激的比较。误差线显示标准偏差。
实施例:
1.1用中性蛋白酶水解在毕赤酵母中重组产生的大小为45kDa的牛来源的非羟基化胶原肽
将0.789%胶原溶液置于50ml瓶中,在低温恒温器中加热至50℃。然后向温控胶原溶液中加入200ppm CaCl
水解180分钟后,胶原肽的平均分子量被确定为5.04kDa。
1.2用碱性蛋白酶水解在毕赤酵母中重组产生的大小为45kDa的牛来源的非羟基化胶原肽
将0.792%胶原溶液置于50ml瓶中,在低温恒温器中加热至63℃。然后向温控胶原溶液中加入200ppm CaCl
水解180分钟之后,胶原肽的平均分子量被确定为3.01kDa。
1.3用碱性蛋白酶水解毕赤酵母中重组产生的大小为25kDa的人来源的非羟基化胶原肽
将2.85%胶原溶液置于50ml瓶中,在低温恒温器中加热至63℃。然后向温和(tempered)胶原溶液中加入200ppm CaCl
水解45分钟后,胶原肽的平均分子量为1.8kDa。
1.4用碱性蛋白酶水解毕赤酵母中重组产生的大小为100kDa的人来源的非羟基化胶原肽
首先,将50ml瓶中的2.85%胶原溶液在低温恒温器中加热至63℃。然后向温控胶原溶液中加入200ppm CaCl
水解45分钟后,溶液中含有平均分子量为2.4kDa的胶原肽。将所得的本发明所述的胶原肽制剂用作实施例6中的样品2。
1.5用碱性蛋白酶水解毕赤酵母中重组产生的大小为100kDa的人来源的非羟基化胶原肽
将1.5%胶原溶液置于50ml瓶中,在低温恒温器中加热至63℃。然后向温控胶原溶液中加入200ppm CaCl
水解60分钟后,所得胶原肽的平均分子量为1.8kDa。将所得的本发明所述的胶原肽制剂用作实施例6中的样品1。
1.6用碱性蛋白酶水解毕赤酵母中重组产生的大小为25kDa的人来源的非羟基化胶原肽
将2.85%胶原溶液置于50ml瓶中,在低温恒温器中加热至63℃。然后向温和胶原溶液中加入200ppm CaCl
水解60分钟后,胶原肽的平均分子量为3.4kDa。将所得的本发明胶原肽制剂用作实施例6中的样品3。
1.7用碱性蛋白酶水解毕赤酵母中重组产生的大小为45kDa的牛来源的羟基化胶原肽
将5.53%的胶原溶液置于250ml的玻璃瓶中,在低温恒温器中加热至55℃。然后向温控胶原溶液中加入200ppm CaCl
水解150分钟后,胶原肽的平均分子量被确定为7kDa。将所得的本发明所述的胶原肽制剂用作实施例7中的样品4。
1.8用碱性蛋白酶水解毕赤酵母中重组产生的大小为45kDa的牛来源的羟基化胶原肽
将5.00%胶原溶液置于100ml的玻璃瓶中,在低温恒温器中加热至55℃。然后向温控胶原溶液中加入200ppm CaCl
在水解240分钟后,胶原肽的平均分子量为5.6kDa。将所得的本发明所述的胶原肽制剂用作实施例7中的样品5。
1.9用碱性蛋白酶水解毕赤酵母中重组产生的大小为45kDa的牛来源的羟基化胶原肽
从实施例1.7获得的胶原肽水解产物开始,通过具有5000Da尺寸排阻膜的浓缩器(例如Vivaspin 20)除去水解产物的较高分子量组分。
对于如此获得的胶原肽,确定平均分子量为1.3kDa。将本发明所述的胶原肽制剂用作实施例7中的样品6。
1.10胶原肽水解产物的凝胶色谱分析
实施例1.3~1.5中获得的胶原肽水解产物和两种市售的平均分子量分别为2.3kDa和1.7kDa的对比产品的分子量分布通过凝胶色谱法(德国Knauer)进行测定。统计分析是使用WinGPC软件(德国美因茨PSS GmbH公司)进行的。凝胶色谱法的参数如下:
固定相:TSK 2000SWXL(TOSOH Bioscience GmbH)
流动相:0.4mol/l磷酸二氢钠,pH 5.3。
流速:0.5ml/min
校准标准:定义的1型胶原片段(FILK)
检测:214nm紫外线检测(Knauer)
样本浓度:1%
对于不同的胶原肽水解产物,表1和图1中所示的单个胶原肽的百分比是在规定的分子量范围内获得的。
表1:在规定的分子量范围内各胶原肽百分比的评估。使用规定的1型胶原肽标准品,通过凝胶色谱法进行分析。
图2~4示出了对比产品和实施例1.3~1.5的胶原肽制剂的每一种的1%溶液的色谱图。
由于较窄的分子量分布、较高分子量肽的缺乏和本发明所述的水解的实施,分子量<500Da的肽的百分比可以显著降低,但是仍然可以获得平均分子量小于2kDa的产物。同时,在1500~3500Da的优选区间内的肽的数量显著增加。尽管本领域技术人员将分子量>1500Da的肽归类为味道中性,但正是分子量<500Da的低分子量肽显著增加了胶原肽产品的苦味。
避免形成此类肽对于消费者归类为“中性”的感觉和感官上优异的胶原肽的生产是另一个优势。这同样适用于平均分子量在3~7kDa范围内的产品。
从上述实施例可以推断,本发明所述的方法以及因此使用均匀的重组胶原片段作为水解的起始材料使得能够在窄分子量分布内形成优选的单个肽,所述窄分子量分布取决于所选择的水解条件,具有通常在4~6之间的特征峰(图3A、图3B、图4)。
这些单个肽的形成可以通过起始片段的选择以及水解条件来具体控制,这在使用动物起始材料时几乎是不可能的,因为动物材料的不均匀性。
对于离体胶原片段的翻译后修饰(脯氨酸残基的羟基化),使用了在辅因子α-酮戊二酸、铁(II)离子和O
为了分析本发明所述的胶原肽制剂在维持骨健康和预防及治疗骨疾病方面的生物有效性,其对在基质的结构和矿化中起作用的基质蛋白和酶的合成的刺激作用通过体外成骨细胞进行检查。这通过借助于实时PCR和半定量评估(基于不含胶原水解物的对照)测定相应mRNA的表达来完成。
为此,首先从膝关节分离人成骨细胞,方法是在37℃剧烈搅拌下,在Hanks溶液中培养骨材料1h,补充7mg/ml的I型和III-S型透明质酸酶以及5mg/ml的链霉蛋白酶。然后在补充16mg/ml CLS IV型胶原酶的Hanks’s溶液中于37℃下继续消化3~5h。获得的原代成骨细胞在Ham’s F12培养基中酶消化后培养,培养基中添加10%胎牛血清、20U/ml青霉素-链霉素、50μg/ml蓖麻毒素、0.05mg/ml抗坏血酸和0.15mg/ml谷氨酰胺。可选的,原代成骨细胞(商品编号C-12760;2019),也可从德国海德堡PromoCell GmbH获得,用于研究生物有效性。然后在加入10%胎牛血清、20U/ml青霉素-链霉素、50μg/ml蓖麻毒素和0.15mg/ml谷氨酰胺的Ham’s F12培养基中培养细胞。
为了研究生物学有效性,将分离的人成骨细胞的单层细胞培养物在补充有0.5mg/ml相应胶原肽制剂的培养基中孵育24小时。在每种情况下,都设置了在不添加胶原肽制剂的培养基中培养的对照组。然后测定各自的mRNA表达。
实施例4.1-mRNA合成的刺激:
在体外在人皮肤成纤维细胞(皮肤细胞)上研究了合成胶原(I型)以及蛋白聚糖双糖聚糖和多功能蛋白聚糖(versican)的合成刺激。为此,将细胞与0.5mg/ml的低分子量胶原肽制剂或本发明所述的胶原肽制剂共同孵育24小时,然后通过实时PCR和半定量(基于未经制备的对照)测定胶原RNA、双链聚糖RNA和多功能蛋白聚糖RNA的表达。
实施例4.2-结缔组织蛋白的合成刺激:
为了确定通过本发明所述的胶原肽制剂对结缔组织的蛋白质合成的刺激,将酶消化后的原代人皮肤成纤维细胞初始培养在包含10%FCS、20U/ml青霉素-链霉素、50μg/ml蓖麻毒素、0.05mg/ml抗坏血酸和0.15mg/ml谷氨酰胺的HAM’s F12培养基中。在达到80%的汇合后,用不含胶原肽的培养基(对照)或用0.5mg/ml待测胶原肽制剂代替各自的培养基,原代人成纤维细胞在各自的培养基中孵育至少14天,优选14~21天,特别是14天。然后可以通过合适的测定法测定和评价结缔组织的不同蛋白质的表达(参见,例如,实施例6和7)。
对于细胞培养物,以已知的方式从软骨组织中分离猪或人软骨细胞,并以约350,000个细胞/cm
胶原生物合成的测定:
用软骨细胞(基本上为II型)合成的胶原的定量是通过用
首先向培养基中加入
可选的,可以根据Sircol胶原测定试剂盒(商品编号054S5000,2019,tebu-bio,德国奥芬巴赫,或英国,Biocolor Ltd)的说明进行定量检测(参见实施例6和7)。
蛋白聚糖生物合成的测定:
通过阿尔新蓝染色和糖胺聚糖(GAG)光度测定对软骨细胞合成的蛋白聚糖进行量化,其中所述糖胺聚糖是蛋白聚糖的组成部分。
为了测定细胞培养物中的GAG含量,首先丢弃培养基,并用PBS缓冲液(pH 7)冲洗贴壁细胞层。然后将细胞固定在PBS中的10%甲醛溶液中(4℃,2小时)。去除甲醛后,将阿尔新蓝染色试剂(5%阿尔新蓝,3%乙酸溶液)涂于细胞苔(cell lawn)上,并在4℃下培养过夜。丢弃未结合的阿尔新蓝,并用PBS仔细冲洗细胞3~4次。通过加入酸性胍溶液(8mol/l),GAG复合物从细胞层释放。然后可在620nm波长下用光度分析法定量糖胺聚糖的含量。
可选的,可根据Blyscan糖胺聚糖测定试剂盒(商品编号054B3000,2019,tebu-bio,德国奥芬巴赫,或英国,Biocolor Ltd.)的说明进行定量检测(参见实施例6和7)。
为了测定对胶原、弹性蛋白和蛋白聚糖合成的刺激,将实施例4.2所述的原代人皮肤成纤维细胞在不含胶原肽(对照1)和在含0.5mg/ml 100kDa胶原肽(对照2)、含平均分子量为1.8kDa的胶原肽制剂(样品1)、含平均分子量为2.4kDa的胶原肽制剂(样品2)和含平均分子量为3.4kDa的胶原肽制剂(样品3)的培养基中孵育至少14天,优选14~21天,特别是14天。
实施例6.1-胶原合成刺激的测定
使用Sircol胶原测定试剂盒(商品编号054S5000,2019,tebu-bio,德国奥芬巴赫,或英国,Biocolor Ltd)的说明进行定量检测。实验结果见表2和图5。
表2:根据Sircol胶原含量测定法(tebu-bio,德国奥芬巴赫或英国,BiocolorLtd.)测定450nm波长下的光密度(OD)用于确定胶原的合成
实施例6.2-弹性蛋白合成的刺激的测定
根据制造商的说明,使用Fastin弹性蛋白测定法(商品编号054F2000,2019,tebu-bio,德国奥芬巴赫,或英国,Biocolor Ltd)通过人类原代皮肤成纤维细胞进行弹性蛋白合成的测定。实验结果示于表3和图6。
表3:根据Fastin弹性蛋白测定法(tebu-bio,德国奥芬巴赫或英国,BiocolorLtd)测定450nm波长下的光密度(OD),以确定弹性蛋白的合成。
实施例6.3-糖胺聚糖合成刺激的测定
根据制造商的说明,使用Blyscan糖胺聚糖分析法(商品编号054B3000,2019,tebu-bio,德国奥芬巴赫,或英国,Biocolor Ltd)通过人类原代皮肤成纤维细胞进行糖胺聚糖合成的测定。实验结果示于表糖胺聚糖4和图7。
表4:根据Blyscan糖胺聚糖测定法(tebu-bio,德国奥芬巴赫,或英国,BiocolorLtd.)测定450nm波长下的光密度(OD),以确定糖胺聚糖的合成。
为了测定对胶原、弹性蛋白和蛋白聚糖合成的刺激,将实施例4.2所述的原代人皮肤成纤维细胞在不含胶原肽的(对照1)和在含0.5mg/ml的平均分子量为7.0kDa的胶原肽制剂(样品4)、含平均分子量为5.6kDa的胶原肽制剂(样品5)和平均分子量为1.3kDa的胶原肽制剂(样品6)的培养基中孵育至少14天,优选14~21天,特别是14天。
实施例7.1-胶原合成刺激的测定
通过原代人真皮成纤维细胞合成胶原的测定是使用Sircol胶原测定试剂盒(商品编号第条。054S5000,2019,tebu-bio,德国奥芬巴赫,或英国,Biocolor Ltd)的说明进行定量检测。实验结果见表5和图8。将未处理对照(对照1)的确定平均值标准化为1作为标准值。
表5:根据Sircol胶原蛋白含量测定法(tebu-bio,德国奥芬巴赫或英国,BiocolorLtd)确定用于确定胶原蛋白合成的光密度(OD)。
实施例7.2-测定弹性蛋白合成的刺激
原代人真皮成纤维细胞合成弹性蛋白的测定采用Fastin弹性蛋白分析法(商品编号054F2000,2019,tebu-bio,德国奥芬巴赫或英国,Biocolor Ltd)的说明进行定量检测。实验结果见表6和图9。将未处理对照(对照1)的确定平均值标准化为1作为标准值。
表6:根据Fastin弹性蛋白测定法(tebu-bio,德国奥芬巴赫,或英国,BiocolorLtd)测定用于确定弹性蛋白合成的光密度(OD)。
实施例7.3-糖胺聚糖合成刺激的测定
通过原代人皮肤成纤维细胞合成糖胺聚糖的测定是根据Blyscan糖胺聚糖分析法(商品编号054B3000,2019,tebu-bio,奥芬巴赫或英国,Biocolor Ltd)的说明进行的。实验结果见表7和图10。将未处理对照(对照1)的确定平均值标准化为1作为标准值。
表7:根据Blyscan糖胺聚糖测定法(tebu-bio,德国奥芬巴赫或Biocolor Ltd.)测定用于确定糖胺聚糖合成的光密度(OD)。
- 胶原肽重组产品的制备及其应用
- 一种重组人胶原蛋白肽及其制备方法和应用
