用干扰素λ治疗丁型肝炎病毒感染
文献发布时间:2023-06-19 12:16:29
技术领域
本发明提供用于治疗丁型肝炎病毒(HDV)感染引起的病毒性肝炎的方法,并且因此涉及化学、药物化学、医学、分子生物学以及药理学领域。
相关申请的交叉引用
本申请要求临时申请No.62/831,548(2019年4月9日提交),No.62/823,530(2019年3月25日提交)和No.62/721,763(2018年8月23日提交)的优先权,其中的每一个均通过引用并入本文。
通过EFS-WEB作为文本文件提交的序列表的引用
序列表的正式副本是通过EFS-Web以ASCII格式的序列表以电子方式提交的,其文件名为097854-1152075-002410PC_SL.TXT,该文件创建于2019年8月8日,大小为1.97MB,并且与本说明书同时提交。该ASCII格式的文档中包含的序列表是本说明书的一部分,并且通过引用整体并入本文。
背景技术
丁型肝炎病毒(HDV)引起最严重形式的慢性病毒性肝炎。HDV表现为与乙型肝炎病毒(HBV)共同感染。慢性HDV和HBV共同感染使先前存在的HBV相关肝损伤恶化并导致肝硬化、肝功能代偿不全和肝细胞癌。参见,Negro,Cold Spring Harb Perspect Med,2014,4:a021550;
已经描述了用于治疗HDV的干扰素α疗法。在2011年发布的国际丁型肝炎干预试验1(HIDIT-1)研究中,发现接受聚乙二醇干扰素α-2a疗法的受试者中有28%在治疗结束后24周清除了HDV RNA。参见Wedemeyer et al.,N Engl J Med,2011,364:322-331。但是,在HIDIT-1研究中对受试者进行的为期五年的长期随访发现,超过50%的受试者表现出晚期HDV RNA复发。参见Heidrich et al.,Hepatology,2014,60:87-97。
与干扰素α(该干扰素α通过由许多不同细胞类型广泛表达的干扰素α受体发出信号来介导其作用)相反,干扰素λ通过不同类型的受体(干扰素λ受体)发出信号,干扰素λ受体具有受限的细胞表达模式。干扰素λ还表现出与干扰素α不同的抗病毒活性,部分原因在于干扰素受体的表达中的差异。在聚乙二醇化干扰素α和聚乙二醇化干扰素λ治疗HBV的比较研究(Chan et al.,J.Hepatology,2016,64:1011-1019)中发现,尽管在治疗中点(24周)聚乙二醇化干扰素λ与聚乙二醇化干扰素α相比在病毒血症中产生更明显的下降,但是在治疗期结束时,聚乙二醇化干扰素α和聚乙二醇化干扰素λ治疗之间没有差异,并且在治疗后,聚乙二醇化干扰素λ治疗组中病毒学反弹更大。接受聚乙二醇化干扰素α治疗四周的HBV/HDV共同感染的小鼠显示HDV-RNA水平2.2log减少,而接受聚乙二醇化干扰素λ治疗四周的小鼠显示HDV-RNA水平1.5log减少(Giersch et al.,2013)。
迄今为止,尚未描述长期聚乙二醇化干扰素λ疗法治疗HDV的功效。仍然存在对治疗HDV感染的药剂的持续需求。
发明内容
在一个方面,提供了治疗人类受试者中的丁型肝炎病毒(HDV)感染的方法。在一些实施方案中,该方法包括向受试者皮下施用治疗有效量的聚乙二醇化干扰素λ-1a至少48周。
在一些实施方案中,所述聚乙二醇化干扰素λ-1a以180微克每周一次(QW)的剂量施用。在一些实施方案中,所述聚乙二醇化干扰素λ-1a以120微克QW的剂量施用。在一些实施方案中,(i)在第一治疗期每周施用160-180微克聚乙二醇化干扰素λ-1a,然后在第二治疗期每周施用150-70微克;或(ii)在第一治疗期每周施用180微克,然后在第二治疗期每周施用170-120微克之间,其中(i)和(ii)中的每一者的剂量可分成每周超过一个的剂量。
在一些实施方案中,该方法包括在第一治疗期以180微克QW的剂量施用所述聚乙二醇化干扰素λ-1a,然后在第二治疗期以120微克QW的剂量施用。在一些实施方案中,该方法包括在第一治疗期以120微克QW的剂量施用所述聚乙二醇化干扰素λ-1a,然后在第二治疗期以80微克QW的剂量施用。在一些实施方案中,所述第一治疗期长于所述第二治疗期。在一些实施方案中,所述第二治疗期长于所述第一治疗期。在一些实施方案中,所述第一治疗期和所述第二治疗期的时间长度相同。在一些实施方案中,第一治疗期具有至少8周的持续时间。在一些实施方案中,第一治疗期具有8-12周的持续时间。在一些实施方案中,该方法还包括在第三治疗期内以80微克QW的剂量施用聚乙二醇化干扰素λ-1a。在某些实施方案中,该方法包括在第一治疗期以180微克QW的剂量施用聚乙二醇化干扰素λ-1a,然后在第二个治疗期间以120微克QW的剂量施用,然后施用60微克-110微克QW的剂量进行第三次治疗。
在一些实施方案中,该方法包括在第一治疗期以第一剂量180微克QW、在第二治疗期以第二剂量120微克QW、以及在第三治疗期以第三剂量110-80微克QW施用所述聚乙二醇化干扰素λ-1a。在一些实施方案中,第一治疗期具有至少8周的持续时间。在一些实施方案中,第一治疗期具有8-12周或1-8周或2-12周的持续时间。
在一些实施方案中,治疗导致受试者中HDV病毒载量下降至少2.0log HDV RNAIU/mL血清。在一些实施方案中,治疗导致HDV病毒载量在检测水平以下。在一些实施方案中,在开始治疗之前,所述受试者的血清丙氨酸氨基转移酶(ALT)水平在正常上限(ULN)以上,并且治疗过程导致所述受试者的血清ALT水平改善至处于ULN以内的水平。
在一些实施方案中,在治疗之前,所述受试者的基线病毒载量为高达每mL血清或血浆约10
在一些实施方案中,具有低病毒载量的受试者在48周和治疗后24周时具有较高百分比的BLQ应答。
在一实施方案中,在λ180μg治疗组中,在基线病毒载量高(>4log)与低(≤4log)的受试者之间应答率不同。在一实施方案中,在第48周,具有高基线病毒载量和低基线病毒载量的受试者中分别有38-43%和33-40%达到HDV RNA水平BLQ。在另一实施方案中,在第72周,这两组之间的差异变得更加明显,低基线病毒载量的50-60%的受试者达到BLQ,而高基线病毒载量的25-29%的受试者达到了该终点。
在一个实施方案中,在第48周,分别具有高和低基线病毒载量的受试者的25-29%和33-40%达到检测不到的HDV RNA水平。在一个实施方案中,在第72周,两组之间的差异与48周的测量值一致,低基线病毒载量的受试者中33-40%达到BLQ,而高基线病毒载量的受试者达到25-29%这个端点。
在一些实施方案中,该方法还包括向受试者施用核苷或核苷酸类似物。在一些实施方案中,核苷或核苷酸类似物是拉米夫定(lamuvidine)、阿德福韦(adefovir)、替比夫定(telbivudine)、恩替卡韦(entecavir)或替诺福韦(tenofovir)。
在一些实施方案中,受试者患有伴有或不伴有肝硬化的代偿性肝病。在一些实施方案中,受试者患有伴有肝硬化的代偿性肝病。
下文公开了其他方面和实施方案。
附图说明
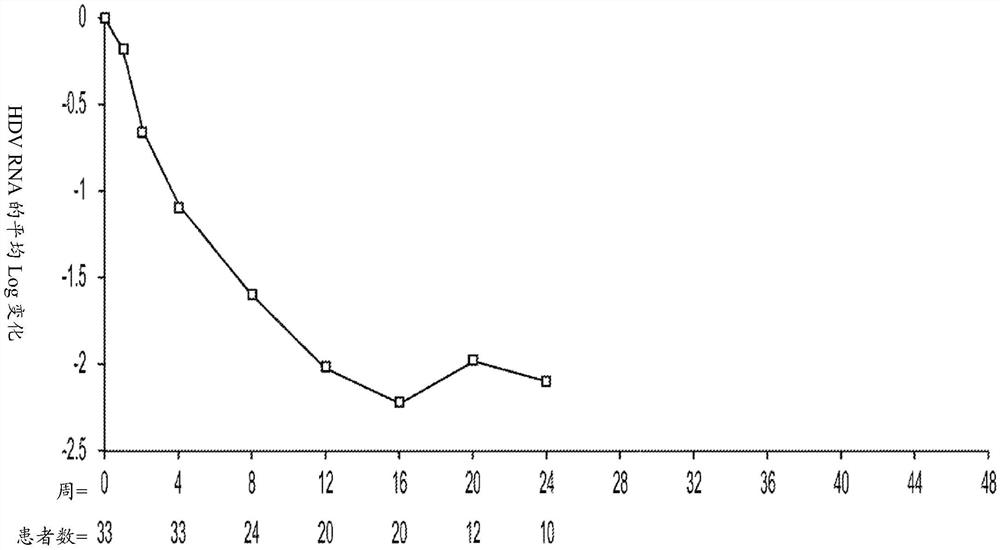
图1.干扰素λ在第24周表现出HDV RNA的快速下降。在整个第24周显示了log HDVRNA的平均变化。
图2.干扰素λ在第48周表现出HDV RNA的快速下降。在整个第48周显示了log HDVRNA的平均变化。插图表显示HDV RNA下降了≥2log
图3.与120mcg的干扰素λ相比,180mcg的干扰素λ产生更高的应答率。图显示了用180mcg或120mcg干扰素λ治疗的受试者在整个48周的平均HDV RNA下降。插图表显示了在120mcg和180mcg剂量下HDV RNA的平均log下降,HDV RNA下降≥2log
图4.证明病毒学应答的持久性。
图5.证明干扰素λ使ALT正常化。
图6.结合表5证明对干扰素λ的应答是持久的。
图7.证明干扰素λ降低了HBsAg。
图8.在治疗的第48周时应答者的HDV RNA的时间进程。
图9.进一步证明了病毒学应答的持久性。
图10.证明ALT正常化和≥2log
图11.λ与PEG INFα的比较证明了用PEG INFα实现的0%的持续病毒学应答(SVR)和用λ实现的36%的持久病毒学应答(DVR)。
具体实施方式
I.定义
因为本发明的范围将仅由所附权利要求书限定,所以本文所使用的术语仅是出于描述具体实施方案的目的,而不旨在是限制性的。除非另外定义,否则本文所用的所有技术和科学术语具有与本发明所属领域普通技术人员通常所理解的意义相同的意义。在本说明书和以下权利要求书中,将参考应定义为具有下列含义的大量术语,除非明显是相反的意图。在一些情况下,为了清楚和/或为了便于参考而在本文中定义了具有通常理解的含义的术语,并且在本文中包括这些定义不应被解释为表示与本领域中通常理解的术语的定义之间的实质性差异。
虽然类似或等同于本文描述的那些方法和材料的任何方法和材料也可以用于本发明的实践或测试,但现在描述优选的方法、装置和材料。本文引证的所有技术以及专利出版物通过引用以其全部内容并入本文。本文没有任何内容应解释为承认本发明无权由于先前发明而早于这些公开内容。
所有数字表达,例如pH、温度、时间、浓度和分子量(包括范围)都是近似值,其根据情况以0.1或1.0的增量变化(+)或(-)。应当理解的是,尽管不总是明确陈述,在所有数字表达前面加上术语“约”。
单数形式“一个/一种(a/an)”和“该(the)”包括多个指示物,除非上下文中另外明确指明。因此,例如,提及的“化合物”包括多种化合物。
术语“施用”是指将本公开内容的化合物、组合物、或药剂引入宿主(如人类)中。在本公开内容的上下文中,该药剂的一种优选施用途径是皮下施用。其他施用途径是静脉施用和口服施用。
除非另有说明或从上下文明显可见,术语“基线”是指在疗程之前进行的测量(例如,病毒载量、受试者状况、ALT水平的测量)。
术语“包含”旨在表示化合物、组合物和方法包括所列举的要素,但不排除其他。当用于定义化合物、组合物和方法时,“基本上由……组成”应意指排除将显著影响要求保护的发明的基本和新颖特征的其他元素。由这些过渡术语中的每一个所定义的实施方案在本发明的范围内。
术语“疗程和治疗过程(course of treatment和course of therapy)”在本文中可互换使用,并且是指在受试者被诊断后(例如被HDV感染并且需要医学干预)进行的医疗干预。医学干预包括但不限于,典型地,对于HDV感染的受试者施用药物持续一段时间(持续至少一次并且通常为若干个月或很多月或甚至数年)。
关于人类血清或血浆样品的术语“HDV RNA病毒载量”或“病毒载量”是指在给定量的人类血清或血浆样品中HDV RNA的量。通常通过定量实时逆转录聚合酶链式反应(qRT-PCR)测定法检测HDV RNA。在此类测定中,在测定过程中产生的信号量与样品中HDV RNA的量成比例。将来自测试样品的信号与量化的丁型肝炎RNA标准品的稀释系列的信号进行比较,并且计算基因组拷贝的拷贝数。参见例如,Kodani et al.,2013,J.Virol.Methods,193(2),531;Karatayli et al.,2014,J.Clin.Virol,60(1),11。可将HDV RNA病毒载量以RNA拷贝/mL血清(或血浆)或使用国际单位(IU)/mL血清(血浆)进行报告。参见Chudy等人,2013,Collaborative Study to establish a World Health OrganizationInternational standard for hepatitis D virus RNA for nucleic acidamplification technique(NAT)-based assays[合作研究以建立基于核酸扩增技术(NAT)的测定丁型肝炎病毒RNA的世界卫生组织国际标准]。WHO生物标准化专家委员会WHO/BS/2013.2227。可商购的测定可从ARUP Laboratories(Salt Lake City,UT)获得。已经报道ARUP HDV RNA测定的检测限为31IU/mL。耶拿分析仪器股份公司(Analytik Jena AG)(德国)提供
一般使用log10单位表示HDV水平。HDV RNA水平能以“RNA拷贝/mL”或“国际单位(IU)/mL”为单位表示。参见Chudy等人,2013,Collaborative Study to establish aWorld Health Organization International standard for hepatitis D virus RNAfor nucleic acid amplification technique(NAT)-based assays(合作研究以建立基于核酸扩增技术(NAT)的测定丁型肝炎病毒RNA的世界卫生组织国际标准)。WHO生物标准化专家委员会WHO/BS/2013.2227。这两个单位在本说明书中使用。如本文所用,出于书面描述或基础的目的,应将“HDV RNA拷贝/mL”(当不另外指明且不包括与临床试验结果有关的讨论,例如如示例中所呈现的)的列举读作涉及“HDV RNA拷贝/mL或HDV IU/mL。”在列举每mL的HDV RNA拷贝的特定数量的情况下,出于书面描述和支持的目的,可以应用1.2的乘数将HDVRNA拷贝/mL的量转换为IU/mL的量。例如,“120HDV RNA拷贝/mL”应该被读作“120拷贝/mL或100IU/mL”。
遵循病毒学的正常惯例,HDV RNA水平的变化可以表示为“log减少”。例如,病毒载量的1log
关于人类(宿主)的术语“HDV感染”是指宿主患有HDV感染的事实。典型地,HDV感染的人类宿主将具有如下的HDV RNA的病毒载量:至少约2log
术语“定量下限”是指被分析物的物质的最低浓度(例如,病毒滴度),其可通过特定测定在所述置信限度内可靠地定量。
术语“患者”、“宿主”或“受试者”可互换使用并是指被HDV感染的人类,包括先前被HDV感染的受试者,在该受试者中病毒已清除。
术语“药物组合物”意指涵盖适合施用至受试者的组合物。一般而言,“药物组合物”是无菌的,并且优选地没有能够在受试者内引起不希望的应答的污染物(例如,药物组合物中的一种或多种化合物是药物级的)。药物组合物可以被设计为经由很多不同给予途径施用至对其有需要的受试者或患者,这些施用途径包括口服、静脉内、口腔、直肠、肠胃外、腹膜内、皮肤内、气管内、肌肉内、皮下、吸入等。
HDV病毒载量的“持续下降”是指病毒载量的下降(例如,降低至少1.5log
如本文使用的术语“治疗有效量”是指被施用的药剂(例如化合物、抑制剂、或药物)的实施方案的量,该量将在某种程度上治疗疾病、障碍、或病症,例如减轻所治疗的疾病(即,感染)的一种或多种症状,和/或该量将在一定程度上预防被治疗的受试者患有或有发展风险的疾病(即,感染)的一种或多种症状。
术语“治疗(treatment、treating和treat)”被定义为用药剂作用于疾病、障碍或病症,以减少或改善疾病、障碍或病症的药理学和/或生理学作用和/或其症状。如本文所使用的“治疗”覆盖了人类受试者中疾病的任何治疗,并且包括:(a)降低在被确定为易患疾病但尚未诊断为被该疾病感染的受试者中发病的风险,(b)阻止该病症的发展和/或(c)减轻该疾病,即,引起该疾病的消退和/或减轻一种或多种疾病症状。“治疗”也意指涵盖递送抑制剂以提供药理学作用,即使在没有疾病或病症的情况下也如此。例如,“治疗”涵盖递送药剂,其提供在受试者中增强的或令人满意的作用(例如,减少病毒载量、减少疾病症状等)。
关于HDV RNA水平使用的术语“检测不到的”或“在检测水平以下”或“BLD”意指通过使用的测定方法学没有检测到HDV RNA拷贝。在一些实施方案中,该测定是定量RT-PCR。
如本文所用,术语“持久病毒学应答”或“DVR”是指在治疗结束后一或多个星期内,或在结束治疗的2至12周之间,在结束治疗的12至24周之间或在结束治疗后的12至48周之间,受试者的在定量限以下(BLQ)的HDV RNA的治疗后应答。
II.治疗方法
在一方面,本公开内容提供了通过对被HDV感染的受试者施用干扰素λ疗法来治疗HDV感染的方法。在一些实施方案中,施用聚乙二醇化形式的干扰素λ(例如,聚乙二醇化干扰素λ-1a)。在一些实施方案中,还用抗病毒核苷或核苷酸类似物(例如抗HBV核苷酸或核苷类似物)治疗接受干扰素λ疗法(例如,聚乙二醇化干扰素λ疗法)的受试者。在一些实施方案中,接受干扰素λ疗法(例如,聚乙二醇化干扰素λ疗法)的受试者也用洛那法尼(lonafarnib)疗法或洛那法尼和利托那韦(利托那韦)疗法进行治疗,例如,在干扰素λ疗法的持续时间期间或在进行干扰素λ疗法的一部分时间期间进行。在一些实施方案中,不给接受干扰素λ疗法(例如,聚乙二醇化干扰素λ疗法)的受试者施用抗病毒核苷或核苷酸类似物疗法。在一些实施方案中,不对接受干扰素λ疗法(例如,聚乙二醇化干扰素λ疗法)的受试者进行洛那法尼疗法或洛那法尼和利托那韦疗法。
干扰素是抑制病毒复制和细胞增殖并调节免疫应答的多肽。人类干扰素基于它们发出信号的受体类型分为三种主要类型(I型、II型和III型)。所有I型IFN都与称为IFN-α受体(IFNAR)的特定细胞表面受体复合物结合,该特定细胞表面受体复合物由IFNAR1和IFNAR2链组成。存在于人类的I型干扰素是IFN-α、IFN-β、IFN-ε和IFN-ω。将II型IFN与由IFNGR1和IFNGR2链组成的IFN-γ受体(IFNGR)结合。人类中的II型干扰素是IFN-γ。III型干扰素组由三种称为IFN-λ1、IFN-λ2和IFN-λ3(也分别称为IL29、IL28A和IL28B)的IFN-λ分子组成。这些IFN通过由IL10R2(也称为CRF2-4)和IFNLR1(也称为CRF2-12)组成的受体复合物发出信号。
如本文所使用的,术语“干扰素-λ”或“IFN-λ”包括天然存在的IFN-λ;合成的IFN-λ;衍生的IFN-λ(例如,聚乙二醇化IFN-λ、糖基化的IFN-λ等);以及天然存在或合成的IFN-λ的类似物。在一些实施方案中,IFN-λ是被衍生化(例如相对于天然存在的肽进行化学修饰)以改变某些特性(如血清半衰期)的IFN-λ的衍生物。这样,术语“IFN-λ”包括用聚乙二醇衍生的IFN-λ(“聚乙二醇化IFN-λ”)等。聚乙二醇化IFN-λ(例如聚乙二醇化IFN-λ-1a)及其制备方法在例如美国专利No.6,927,040、No.7,038,032、No.7,135,170、No.7,157,559和No.8,980,245;以及PCT公开号WO 2005/097165、WO 2007/012033、WO 2007/013944和WO2007/041713中进行了讨论;其通过引用整体并入本文。在一些实施方案中,IFN-λ是PCT/US2017/018466中公开的IFN-λ,其通过引用整体并入本文。在一些实施方案中,聚乙二醇化IFN-λ-1a具有US 7,157,559中描述的结构,其通过引用整体并入本文。
在一些实施方案中,用于如本文所述的治疗方法的干扰素是聚乙二醇化IFN-λ1(例如聚乙二醇化IFN-λ-1a)、聚乙二醇化IFN-λ-2或聚乙二醇化IFN-λ-3。在一些实施方案中,干扰素是聚乙二醇化IFN-λ1(例如聚乙二醇化的IFN-λ-1a)。
在一些实施方案中,聚乙二醇化IFN-λ1具有如下所示的氨基酸序列(线显示链内二硫键)[SEQ ID NO:1]:
在一些实施方案中,待用如本文描述的干扰素λ疗法治疗的受试者是患有HDV感染、急性HDV感染或者慢性HDV感染的受试者。在一些实施方案中,待治疗的受试者在通过阳性HDV抗体(Ab)测试记录期间具有至少6个月的慢性HDV感染,和/或通过qRT-PCR可检测的HDV RNA。在一些实施方案中,用本文描述的治疗方法治疗的受试者是患有急性HDV感染的受试者,该急性HDV感染是新诊断的或以其他方式被认为在受试者中存在超过六个月。HDV的诊断和发病机理描述于例如Wedemeyer et al.,Nat.Rev.Gastroenterol.Hepatol,2010,7:31-40中。已知HDV以各种亚型存在;本文描述的方法适用于治疗所有HDV受试者,而不管HDV亚型。在一些实施方案中,该受试者是成人(18岁或以上),或者在其他实施方案中,该受试者是儿科的。
在一些实施方案中,待治疗的受试者具有基线病毒载量为每mL血清或血浆至少10
在一些实施方案中,使用来自受试者的血清样品测量HDV病毒载量。在一些实施方案中,使用来自受试者的血浆样品测量HDV病毒载量。在一些实施方案中,通过定量RT-PCR测量病毒载量。用于定量血清或血浆中的HDV RNA的qRT-PCR测定法是本技术领域已知的,例如,如上文所述。
在一些实施方案中,待治疗的受试者表现出肝功能障碍的一种或多种症状。在一些实施方案中,受试者表现出一个或多个肝功能参数,该参数在健康对照(例如,未被HDV或HBV感染的受试者)的正常参数之外。在一些实施方案中,肝功能参数选自由以下项组成的群组:血清白蛋白、胆红素、丙氨酸氨基转移酶(ALT)、天冬氨酸转氨酶(AST)和凝血酶原活性。在一些实施方案中,该受试者具有比正常上限(ULN)高至少两倍(例如,比ULN高至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少10倍或更高)的血清ALT水平。在现有技术中描述了肝功能参数。参见例如,Limdi et al.,Postgrad Med J,2003,79:307-312。测量这些肝功能参数的方法是本技术领域已知的并且也是可商购的。
在一些实施方案中,受试者具有代偿性肝病(例如,根据Child-Turcotte-Pugh分类系统分类),伴有或不伴有肝硬化。本领域普通技术人员将认识到Child-Turcotte-Pugh分类系统用于对肝病的严重程度进行分类,并通过评估血清白蛋白水平、胆红素水平、凝血酶原时间水平的国际标准化比率、腹水形成和脑病来确定。在一些实施方案中,受试者的Child-Turcotte-Pugh评分为5-6(A类)。受试者的Child-Turcotte-Pugh评分为1-6。在一些实施方案中,所述受试者的Child-Turcotte-Pugh评分为或1-2、或1-3、或2-4、或3-4、或2-5、3-5或2-6。在一些实施方案中,受试者患有代偿性肝病,伴有肝硬化。在一些实施方案中,受试者患有代偿性肝病,不伴有肝硬化。
在一些实施方案中,将受试者诊断为患有通过例如以下一项或多项确定的慢性肝炎:肝活检、肝功能检查、超声、肝静脉压梯度(HVPG)测量、ALT水平、其他血液检查或白蛋白水平。在一些实施方案中,活检在治疗前的6个月内进行。在一些实施方案中,根据本文提供的方法,活检在开始治疗之前的18个月内进行。在一些实施方案中,活检在治疗前的1天至24个月内进行。在一些实施方案中,受试者在筛选前6个月内具有基于肝脏活组织检查的慢性肝炎的证据。在一些实施方案中,受试者在治疗前和/或治疗开始前24周内、在治疗前24个月内、在治疗前24个月至1个月内、或在治疗前12个月至1天内具有高于正常上限(ULN)的血清丙氨酸氨基转移酶(ALT)水平。在多种实施方案中,受试者满足实施例1中的一个或多个独立选择的资格标准。
在一些实施方案中,干扰素λ疗法包括以每周180微克(mcg)、每周120mcg、每周110mcg、每周100mcg、每周90mcg、每周80mcg、每周120-70mcg、每周200-120mcg、每周170-130mcg的剂量向受试者施用干扰素λ(例如,聚乙二醇化干扰素λ-1a)。在一些实施方案中,干扰素λ以180mcg QW的剂量施用。在一些实施方案中,干扰素λ以每周两次90mcg的剂量施用。在一些实施方案中,干扰素λ以每3-4天90mcg的剂量施用。在一些实施方案中,干扰素λ以每周两次80mcg的剂量施用。在一些实施方案中,干扰素λ以每3-4天80mcg的剂量施用。在一些实施方案中,干扰素λ以每周两次100-70mcg的剂量施用。在一些实施方案中,干扰素λ以每3-4天100-70mcg的剂量施用。在一些实施方式中,干扰素λ以120mcg QW的剂量施用。在一些实施方案中,干扰素λ以80mcg QW的剂量施用。
在一些实施方案中,正在治疗HDV感染的受试者在疗程中接受干扰素λ疗法的给药方案的调整。在一些实施方案中,受试者接受干扰素λ的剂量减少,因为一个或多个后期剂量比一个或多个早期剂量低。在一些实施方案中,如果受试者表现出不可接受的副作用,则减少剂量。在一些实施方案中,在用干扰素λ疗法的疗程中,受试者可以接受多次剂量减少。在一些实施方案中,在以第一剂量(例如,以180mcg QW的第一剂量)治疗8周之前,或在以第一剂量治疗的1周、或2周、或3周、或4周、或5周、或6周、或7周之前,不降低向受试者施用的剂量。在一些实施方案中,在以第一剂量(例如,以180mcg QW的第一剂量)治疗9-12周之前,不降低向受试者施用的剂量。
在一些实施方案中,干扰素λ疗法包括在第一治疗期以每周180微克的剂量向受试者施用干扰素λ,随后在第二治疗期以每周120μg的剂量向受试者施用干扰素λ。在一些实施方案中,第一治疗期的时间长度与第二治疗期的时间长度相同。在一些实施方案中,第一治疗期和第二治疗期是不同的时间长度。在一些实施方案中,第一治疗期(即,每周180mcg剂量的干扰素λ)比第二治疗期(即,每周120mcg剂量的干扰素λ)更长。在一些实施方案中,第二治疗期(即,每周120mcg剂量的干扰素λ)比第一治疗期(即,每周180mcg剂量的干扰素λ)更长。在一些实施方案中,干扰素λ疗法还包括在第三治疗期以每周110-80微克的剂量向受试者施用干扰素λ。在一些实施方案中,第三治疗期的时间长度与第一和/或第二治疗期的时间长度相同。在一些实施方案中,第三治疗期与第一和/或第二治疗期是不同的时间长度。在一些实施方案中,第三治疗期(即每周110-80mcg剂量的干扰素λ)长于第一和/或第二治疗期。在一些实施方案中,第三治疗期(即,每周80mcg剂量的干扰素λ)比第一和/或第二治疗期短。
在一些实施方案中,干扰素λ疗法包括在第一治疗期以120微克/周的剂量施用干扰素λ,然后在第二治疗期以110-80微克/周的剂量施用干扰素λ。在一些实施方案中,第一治疗期的时间长度与第二治疗期的时间长度相同。在一些实施方案中,第一治疗期和第二治疗期是不同的时间长度。在一些实施方案中,第一治疗期(即,120mcg/周的剂量的干扰素λ)比第二治疗期(即,80mcg/周的剂量的干扰素λ)更长。在一些实施方案中,第二治疗期(即,80mcg/周的剂量的干扰素λ)长于第一治疗期(即,120mcg/周的剂量的干扰素λ)。
在一些实施方案中,干扰素λ疗法包括在第一治疗期以180微克QW的第一剂量、在第二治疗期以170-120微克QW的第二剂量以及在第三治疗期以110-80微克QW的第三剂量施用干扰素λ。在一些实施方案中,第一治疗期的持续时间为至少8周、或1-8周、或1-12周。在一些实施方案中,第一治疗期具有8-12周的持续时间。
在一些实施方案中,干扰素λ疗法包括在第一治疗期以160-180微克/周的第一剂量、在第二治疗期以170-120微克/周的第二剂量以及在第三治疗期以110-60微克/周的第三剂量施用干扰素λ。在一些实施方案中,第一治疗期的持续时间为至少8周、或1-8周、或1-12周。在一些实施方案中,第一治疗期具有8-12周的持续时间。剂量可以以每周多剂量施用,其中微克数等于每周剂量。
在一些实施方案中,治疗期(例如,第一治疗期、第二治疗期和/或第三治疗期)的持续时间为至少1周,例如,至少2、3、4周或更长时间。在一些实施方案中,治疗期(例如,第一治疗期、第二治疗期和/或第三治疗期)持续时间至少2周,例如至少4、6、8、10、12、16、20、24、28、32、36、40、44、48周或更长时间。在一些实施方案中,治疗期持续时间至少为8周。在一些实施方案中,治疗期持续时间长达约4周,或持续时间长达约6、8、10、12、16、20、24、28、32、36、40、44或48周。在一些实施方案中,治疗期持续时间长达约8周。在一些实施方案中,治疗期持续时间长达约12周。
对于接受剂量减少的受试者,在一些实施方案中,在以第二较低剂量开始随后的治疗期之前,暂停或停止以第一剂量进行的治疗期。例如,在一些实施方案中,在(例如,以120mcg/周的剂量)开始第二治疗期之前,将(例如,以180mcg/周的剂量进行的)第一治疗期暂停或停止至少1周、2周、3周、4周或更长的持续时间。
在一些实施方案中,在剂量减少之前,向受试者施用180微克QW的第一剂持续至少8周。在一些实施方案中,在剂量减少之前,向受试者施用180微克QW的第一剂持续至少8-12周。
在一些实施方案中,如果受试者的绝对嗜中性白血球计数(ANC)为介于≥500/mm
在一些实施方案中,如果受试者的ANC≤500/mm
在一些实施方案中,如果受试者的血小板水平<50,000,则受试者将开始第二治疗期,或者如果受试者的血小板水平<25,000,则受试者将终止治疗。
在一些实施方案中,如果受试者的总胆红素(TBILI)>2.5×正常范围上限(ULN)的上限,并且直接胆红素(DB)>3×ULN,则对受试者的给药将停止,直到受试者的TBILI≤1.5×ULN,然后在第二治疗期恢复给药。
在一些实施方案中,如果受试者的TBILI>3×ULN且DB>3×ULN,则对受试者的给药将被中断,直到TBILI≤1.5×ULN,然后在第二治疗期恢复给药。
在一些实施方案中,如果受试者的ALT(或AST)≥20×ULN和TBILI和/或国际标准化比率(INR)<2级,则对受试者的给药将被中断,直到ALT/AST<10×ULN,然后将在第二治疗期恢复给药。在一些实施方案中,如果第二次受试者的丙氨酸氨基转移酶(ALT)(或天冬氨酸氨基转移酶(AST))的绝对嗜中性细胞计数(ANC)≥20×ULN和TBILI和/或INR<2级,则对受试者的给药将被中断,然后将在第二治疗期恢复给药。
在一些实施方案中,如果受试者的ALT(或AST)≥15-20×ULN和TBILI和/或INR<2级,则对受试者的给药将中断,直到ALT/AST<10×ULN,然后将在第二治疗期恢复给药,或者,如果第二次受试者的ALT(或AST)的ANC≥15-20×ULN和TBILI和/或INR<2级,则对受试者的给药将中断,直到ALT/AST<10×ULN,然后将在第二治疗期恢复给药。
在一些实施方案中,中断或停止后的剂量恢复在停止或中断后一周、两周、三周或四周恢复。
在一些实施方案中,如果受试者的ALT(或AST)≥15×ULN和TBILI和/或INR<2级,则对受试者的给药将中断,直到ALT/AST<10×ULN,然后将在第二治疗期恢复给药。在一些实施方案中,如果受试者第二次具有ALT(或AST)的ANC≥15×ULN和TBILI和/或INR<2级,则对受试者的给药将中断,然后将在第二治疗期恢复给药。
在一些实施方案中,如果受试者具有ALT(或AST)≥5×ULN和TBILI和/或INR≥2级,则对受试者的治疗将终止。
在一些实施方案中,如果受试者具有ALT(或AST)≥10×ULN和TBILI和/或INR≥3级,则对受试者的治疗将终止。
在一些实施方案中,如果受试者经历≥3级的不良事件,则对受试者的给药将停止,直到该事件解决或≤1级,并且在第二治疗期将恢复给药。
在一些实施方案中,如果受试者经历≥3级的第二不良事件,则对受试者的给药将被中断,然后在第三治疗期恢复给药。
在一些实施方案中,如果受试者的肌酐清除率水平<50mL/min,则终止对该受试者的治疗。
在一些实施方案中,基于肝胆异常满足治疗中断、减少和/或终止标准的受试者可以进行临床检查,其包括以下一项或多项:自身免疫标记物(抗核抗体[ANA],抗平滑肌抗体[例如,抗SMA],抗LC1,抗SLA肝肾微粒体1型和III型抗体[例如,抗LKM1,3]);C3、C4和CH50;急性病毒性肝炎;急性甲型和戊型肝炎血清(IgM);PCR检测HCV,戊型肝炎(大便和血液);巨细胞病毒(CMV),爱泼斯坦巴尔病毒(EBV)或单纯疱疹病毒1和2(HSV),例如,通过PCR进行;用多普勒超声(Doppler US)检查肝脏的胆汁淤积症;审查既存的肝病(不包括HBV);审查同时使用的药物、草药或已知具有肝毒性的物质,测试对酒精和乙酰氨基酚以及药物的滥用(如果指示);对于胆红素水平高于基线1.5倍的受试者,应进行肝超声检查,包括多普勒检查;如果临床可行,则应进行肝活检;当禁忌经皮穿刺活检时,可以讨论经颈静脉活检;每周应进行肝脏和化学实验室检查(至少包括ALT、AST、胆红素、INR、碱性磷酸酶和γ-GT),直到胆红素恢复到基线值为止;应当每周监测HBV DNA和HDV RNA,直到Bili<1.5×ULN。应收集5ml血清和5ml血浆,以用于以后的生物标记物分析。
在某些实施方案中,对于在任何治疗期期间基线GGT、ALT/AST或碱性磷酸酶升高4倍或胆红素>1.5mg/dL,直接胆红素>0.6(如果存在吉尔伯特综合症)的受试者,可以开出处方:熊去氧胆酸,以用于“肝脏保护”。
在某些实施方案中,还向受试者施用替诺福韦DF或恩替卡韦以治疗乙型肝炎。
在一些实施方案中,患有0-III期疾病的受试者,其中所述受试者在基线具有≤11.4kPa,并且需要剂量中断,然后,依次降低然后中断:在Alb>3.5g/dL和INR<1.5、总胆红素<3mg/dL的受试者中,然后在ALT>20×ULN(>1000IU/mL)时进行剂量中断1,并且当ALT<10×ULN(<500IU/mL)时以下一个较低的λ剂量重新开始,并且在ALT 20×ULN(>1000IU/mL)时进行下一次剂量中断2,然后在ALT<10×ULN(<500IU/mL)时以下一个较低的λ剂量重新开始,或者在80mg剂量时胆红素为3.0mg/dL或更高时停止。
如本文所使用的,使用以下缩写:AE,不良事件;ALT,丙氨酸转氨酶;ANC,中性粒细胞绝对计数;AST,天冬氨酸转氨酶;CTCAE,不良事件通用术语标准;DB,直接胆红素;DILI,药物性肝损伤;PT,凝血酶原时间;SAE,严重不良事件;TBILI,总胆红素;ULN,正常范围的上限。
受试者可以接受干扰素λ疗法持续预定时间、无限期或直至达到终点。在连续每日基础上,治疗可持续至少两个月至三个月。在一些实施方案中,该疗法持续至少30天、至少60天、至少90天、至少120天、至少150天或至少180天。在一些实施方案中,治疗持续至少6个月、至少7个月、至少8个月、至少9个月、至少10个月、至少11个月、至少一年、至少15个月、至少18个月或至少2年。在一些实施方案中,疗法持续至少6周、12周、18周、24周、30周、36周、42周、48周、60周、72周、84周或96周。在其他实施方案中,继续治疗持续受试者的余生或直至施用不再有效地将病毒维持在足够低的水平以提供有意义的治疗益处。
根据本发明的方法,一些HDV受试者通常通过将病毒清除至检测不到的水平来响应本文描述的疗法。在一些实施方案中,对于其中HDV RNA水平在检测水平以下的受试者,治疗暂停,除非并且直到HDV水平恢复至可检测水平。其他受试者将经历病毒载量的减少和症状的改善,但不会将病毒清除至检测不到的水平,但会继续进行疗法持续定义的一段时间(例如,持续约1年、约2年、约3年或者更长)或只要它提供治疗益处。
在一些实施方案中,当在48周的治疗后测量时,用干扰素λ疗法的治疗导致受试者中至少1.5log
在一些实施方案中,用干扰素λ疗法治疗导致HDV病毒载量的持续下降(例如,降低至少1.5log
在一些实施方案中,将如本文披露的疗法继续一段时间直至HDV RNA水平低于3log
在一些实施方案中,根据本文所述方法治疗的受试者在疗程中表现出HDV病毒载量降低至检测不到的水平,并且受试者在治疗结束后维持HDV病毒载量降低至检测不到的水平持续至少12周。在一些实施方案中,根据本文所述方法治疗的受试者在疗程中表现出HDV病毒载量降低至检测不到的水平,并且受试者在治疗结束后维持HDV病毒载量降低至检测不到的水平持续至少24周。
在一些实施方案中,受试者的HDV滴度在疗程中在降至基线以下之前从基线上升。在一些实施方案中,受试者的HDV水平升高至超过基线的150%,或超过基线的200%。在一些实施方案中,滴度的升高介于基线的25-50%之间,或从基线的25-100%,或从基线的50-200%。在一些实施方案中,滴度的升高发生在疗法开始后2周内。在一些实施方案中,受试者的升高的HDV滴度在开始疗法的2周内或3周内降至基线以下。
在一些实施方案中,根据本文所述方法治疗的受试者表现出在一个或多个肝功能参数中的改善。在一些实施方案中,改善的肝功能是一种或多种血清标志物(例如,一种、两种、三种、四种、五种、六种或更多种标志物)的改善,例如,血清白蛋白、胆红素、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、凝血酶原、α-2巨球蛋白、载脂蛋白A1、触珠蛋白、γ-谷氨酰转肽酶(GGT)。在一些实施方案中,根据本文所述方法治疗的受试者表现出在肝纤维化中的改善(例如,通过组织学分析的活组织检查、瞬时超声弹性成像(例如,FibroScan)或磁共振弹性成像评估)。在一些实施方案中,治疗导致与治疗开始之前相比,患者中的一个或多个肝功能参数中的至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少70%、至少75%、至少80%、至少100%、或介于5-50%之间、或介于10-80%之间、或介于50-100%之间的改善(例如,一种或多种血清标记物的改善或肝纤维化的改善)。在一些实施方案中,治疗导致一个或多个肝功能参数(例如,一种或多种血清标记物的改善或肝纤维化的改善)改善至没有被HDV或HBV感染的健康对照受试者的水平。在一些实施方案中,受试者表现出血清ALT水平改善至正常上限内的水平。
在一些实施方案中,根据本文所述方法治疗的受试者与治疗开始时的基线水平相比,和/或与未接受有效降低受试者HDV病毒载量的治疗的类似感染受试者相比表现出HBV病毒载量的降低。在一些实施方案中,治疗导致HBV病毒载量的至少1log
在一些实施方案中,根据本文所述方法治疗的受试者表现出在实施例1中描述的一个或多个参数的改善。在一些实施方案中,根据本发明的方法治疗的患者表现出HDV和/或HBV病毒载量的降低。在治疗之前,测量受试者的HDV和/或HBV病毒载量以确定基线病毒载量。在治疗一段时间后(例如,治疗12周后),与基线相比,受试者的病毒载量降低。在一些实施方案中,在治疗一段时间后(例如,在治疗12周后),与基线相比受试者的病毒载量显著降低,例如降至非常低的水平或检测不到的水平。在一些实施方案中,治疗导致HBV病毒载量的至少2log
在一实施方案中,在用180μg干扰素λ疗法的受试者群体中,在高(>4log
在一实施方案中,所述受试者具有介于约11%至约14%之间的导致ALT水平正常化的治疗概率。在另一实施方案中,所述受试者具有约12.1%至约42.4%的导致HDV RNA下降2log
在一个实施方案中,被施用180mcg/周剂量的受试者的百分比具有以下一种或多种:剂量减少(约30-36%),中断(约7-9%)和治疗终止(约21-24%)。在另一实施方案中,以120mcg/周的剂量施用的受试者的百分比具有以下一种或多种:剂量减少(约26-30%)、中断(约5-9%)和治疗终止(约24-26%)。在另一实施方案中,其中具有高(>4log
在另一实施方案中,在最后一次剂量之后,有以下一者或多者:接受每周120微克的起始剂量的受试者中的16-21%达到HDV RNA水平BLQ;:接受每周120微克的起始剂量的受试者中的21-29%达到下降>2log
在一些实施方案中,被实施根据本公开的干扰素λ疗法的受试者还可以用一种或多种其他抗病毒剂(如核苷和核苷酸类似物)、用于治疗HBV感染的化合物和其他药剂来治疗。
在一些实施方案中,被实施干扰素λ疗法的受试者用抗病毒剂治疗,该抗病毒剂用于治疗HBV。目前批准的抗-HBV药物(干扰素除外)可抑制逆转录酶,并且是核苷或核苷酸类似物。这些药物虽然对HBV有效,但对HDV无效,因为它们不能清除HDV复制需要的HBsAg。当前批准的抗HBV核苷/核苷酸类似物包括拉米夫定(
在一些实施方案中,用洛那法尼治疗被实施干扰素λ疗法的受试者。US 2017/0042862中公开了用于治疗HDV的洛那法尼疗法,其通过引用并入本文。在一些实施方案中,被实施干扰素λ疗法的受试者还接受每天50-200mg(例如每天50mg,每天75mg,每天100mg,每天150mg,或每天200毫克)的每日总剂量的洛那法尼疗法。洛那法尼疗法可以每天一次(QD)或每天两次(BID)给药。在一些实施方案中,被实施干扰素λ疗法的受试者还接受剂量为25mg BID,50mg BID,75mg BID,100mg BID,50mg QD,75mg QD或100mg QD的洛那法尼疗法。在一些实施方案中,在干扰素λ疗法开始时或在干扰素λ疗法过程中开始洛那法尼疗法。
在一些实施方案中,用洛那法尼和CYP3A抑制剂联合疗法(例如利托那韦或考比司他)治疗被实施干扰素λ疗法的受试者。在一些实施方案中,CYP3A抑制剂是利托那韦。洛那法尼和利托那韦的联合疗法在WO 2015/168648和WO 2017/079009中公开,其通过引用并入本文。在一些实施方案中,被实施干扰素λ疗法的受试者还接受每天50-200mg洛那法尼(例如每天50mg,每天75mg,每天100mg,每天150mg或每天200mg洛那法尼)和每天100-200mg利托那韦(例如每天100mg,每天150mg或每天200mg利托那韦)的每日总剂量的洛那法尼-利托那韦联合疗法。洛那法尼-利托那韦联合治疗可以每天一次(QD)或每天两次(BID)施用。在一些实施方案中,被实施干扰素λ疗法的受试者还被施用25mg BID,50mg BID,75mg BID,100mg BID,50mg QD,75mg QD或100mg QD剂量的洛那法尼和50mg BID或100mg BID剂量的利托那韦。在一些实施方案中,洛那法尼-利托那韦联合疗法在干扰素λ疗法开始时或在干扰素λ疗法过程中开始。
可以对正在接受干扰素λ疗法的HDV感染的受试者有益地施用的其他治疗性化合物包括噻唑化物(thiazolide);蛋白酶抑制剂;聚合酶抑制剂;解旋酶抑制剂;C类CpG toll样受体7和/或9拮抗剂;两亲性螺旋破坏剂或NS4B抑制剂;他汀类或其他HMG CoA还原酶抑制剂;免疫调节剂;抗炎药;第二异戊烯化抑制剂;亲环蛋白抑制剂;和α-葡萄糖苷酶抑制剂。
在多种实施方案中,干扰素λ与标准核苷HBV药物以及在US2017/0042862中描述的有希望的新抗HDV疗法(例如,洛那法尼疗法)一起施用,任选地与诸如利托那韦之类的加强剂联合施用,以获得最佳治疗效果。当与其他抗HBV或HDV药物联合施用时,根据本发明,医生可以以一般日剂量范围80-180mcg内的任何日剂量开始服用λ干扰素,起始剂量例如为180、120或80mcg/天。巴基斯坦籍的一些受试者因本文所述的干扰素λ疗法而表现出不良副作用(高胆红素水平),这可能是由于影响胆红素转运的基因遗传变异所致,医生可能希望先采取其他治疗方案,无论如何要密切监测此类受试者出现此类副作用,以确保停药或减少剂量以消除此类副作用。
干扰素λ可以配制成用于通过任何治疗合适的途径施用。在一些实施方案中,配制干扰素λ以用于通过静脉或皮下施用来施用。可以使用适用于药物递送的其他途径,包括全身和局部施用途径。
在一些实施方案中,干扰素λ通过皮下施用(例如皮下注射)施用。注射部位包括但不限于在大腿、腹部、上臂区域或上臀部区域中的注射。
在实施方案中,干扰素λ(例如,聚乙二醇化的干扰素λ)作为药物制剂提供,该药物制剂包含干扰素λ和一种或多种赋形剂,例如防腐剂、表面活性剂(例如,聚山梨酯或泊洛沙姆)或着色剂(例如,药学上可接受的染料、无机颜料和天然着色剂)。多种药学上可接受的赋形剂是本技术领域已知的。药学上可接受的赋形剂已在各种出版物中充分描述,各种出版物包括,例如,A.Gennaro(2000)“Remington:The Science and Practice ofPharmacy,”20th edition,Lippincott,Williams,&Wilkins;Pharmaceutical DosageForms and Drug Delivery Systems(1999)H.C.Ansel et al.,eds.,7th ed.,Lippincott,Williams,&Wilkins;和Handbook of Pharmaceutical Excipients(2000)A.H.Kibbe et al.,eds.,3rd ed.Amer.Pharmaceutical Assoc.,其各自通过引用并入本文。
在一些实施方案中,干扰素λ可以通过以下方式配制成用于注射的制剂:将干扰素λ溶解、悬浮或乳化于水性或非水性溶剂(如植物油或其他类似的油、合成的脂族酸甘油酯、高级脂族酸或丙二醇的酯)中;并且如果需要的话,与常规添加剂(如增溶剂、等渗剂、悬浮剂、乳化剂、稳定剂和防腐剂)一起。用于注射或静脉施用的单位剂型可以作为在无菌水、生理盐水或另外的药学上可接受的载体中的溶液包含在组合物中。本文提供了单位剂型的干扰素λ的适当量的活性药物成分。
在一些实施方案中,如以下专利公开中的一个所述配制和/或施用和/或修饰干扰素λ(例如干扰素λ1,例如干扰素λ1a)或其类似物,其通过引用并入本文:美国专利No.6,927,040、No.7,038,032、No.7,135,170、No.7,157,559、和No.8,980,245、US 2009/0326204、US 2010/0222266、US 2011/0172170或US 2012/0036590。
III.实施例
提供以下实施例以说明但不限制要求保护的本发明。
本实施例描述了用于评估聚乙二醇化干扰素λ单一疗法在患有慢性HDV感染的受试者中的安全性、耐受性和药效动力学的2期临床研究方案。
表1.方案概要
来自在整个48周的治疗期内接受总研究药物剂量的至少80%的并且其HDV病毒载量数据在研究访问的第1天(基线)和治疗结束(第48周)可用的受试者群组中的至少一名受试者显示如方案中描述的一个或多个终点的改善。在一些实施方案中,受试者与基线相比在治疗结束时表现出HDV病毒载量的降低。在一些实施方案中,受试者与基线相比在治疗结束时表现出HBV病毒载量的降低。在一些实施方案中,干扰素λ疗法显著降低HDV病毒,例如在治疗结束后12周测量时将至检测不到的水平。在一些实施方案中,受试者与基线相比在治疗结束时表现出HBsAg水平的降低。在一些实施方案中,受试者表现HBsAg抗原的改善的清除。在一些实施方案中,受试者表现出丙氨酸氨基转移酶(ALT)水平的降低。在一些实施方案中,在治疗开始之前具有高于正常上限(ULN)的血清ALT的受试者表现出:血清ALT水平改善至处于ULN之内的水平。
实施例2.治疗HDV的聚乙二醇化干扰素λ单一疗法
该实施例描述了根据实施例1中所述的方案进行的2期聚乙二醇化干扰素λ-1a(LIMT)临床研究的在24周时的中期数据。
背景:全球共有15-20百万人感染了丁型肝炎(HDV)和乙型肝炎(HBV)病毒。已经在患有慢性HDV的受试者中测试了干扰素(IFN)或聚乙二醇化(PEG)IFN-α。多达25%的受试者可能变为HDV PCR阴性,但治疗终止后大多数复发且耐受性不理想。PEG IFNλ-1a(“λ”)是III型IFN。基于λ更受限制的受体分布,可以推测λ可以诱导HDV响应,但副作用比IFN-α小。LIMT HDV是λ在患有慢性HDV感染(包括肝硬化)的受试者中的首项研究。
在患有慢性HDV的受试者中,在48周内每周皮下注射施用λ120或180μg的随机开放标签研究。纳入的主要标准是:qPCR阳性的HDV RNA,ALT<10×ULN升高,肝病补偿和血小板≥90,000细胞/μL。每次访视时评估HDV RNA(Robogene 2.0,LLOQ 14IU/mL)、ALT、胆红素和其他参数。替诺福韦或恩替卡韦从基线(BL)开始使用,并一直持续到研究结束。主要终点是HDV病毒载量相对于基线的变化。
总共招募了33名受试者。慢性HDV受试者每周皮下注射λ(120μg或180μg),持续48周。16名受试者随机分配至λ180μg/周,而17名受试者随机分配至120μg/周。受试者在基线时的中位特征值示于下表2中。由于在巴基斯坦卡拉奇站点进行肝相关SAE的频率增加(在7/15[46.7%]个受试者中观察到),在卡拉奇站点随机分配180mcg/周的6名受试者全部降低为120mcg/周(在第一剂量之前)。由于给药方案的这些变化,对于本文所述的疗效和安全性评估,受试者按其初始λ剂量而非随机治疗组进行分类:14/33受试者为λ180mcg(“180剂量”),以及19/33名受试者为λ120mcg(“120剂量”)。
表2.基线特征
在中期分析时,所有受试者至少达到治疗的第4周,并且一些受试者达到治疗的第8、12或24周。图1显示了:用干扰素λ治疗的受试者表现出HDV RNA的快速下降。如下表3所示,对于治疗已达到第24周的受试者,50%实现了≥2.0的HDV RNA下降。40%的受试者为HDV PCR阴性。轻度至中度头痛、发热、疲劳和肌痛是最常报道的AE。每个方案的剂量减少(12%)、中断(12%)和治疗终止(15%)主要是由于肝AE(ALT发作和/或高胆红素血症)引起的。ALT发作和肝功能异常通常与HDV病毒载量下降相关。没有观察到临床代偿失调的情况。
表3.抗HDV活性
该中期分析表明,每周的λ(120μg或180μg)具有抗HDV的抗病毒活性,一些受试者在治疗的第8周时就已成为PCR阴性。λ在治疗24周时表现出与历史PEG-α相当的抗HDV活性。另外,大多数受试者对λ疗法的耐受性良好。
实施例3.用于治疗HDV的聚乙二醇化干扰素λ单一疗法
该实施例描述了实施例1和实施例2中所述的2期聚乙二醇化干扰素λ-1a(LIMT)临床研究在48周时的治疗结束数据。上面的实施例2和表2描述了针对所述受试者的方法和基线特征。
33名受试者中的23名达到了第48周(治疗结束),并且10名受试者终止治疗。如图2所示,用干扰素λ治疗的受试者表现出HDV RNA的快速下降。在33名受试者中,有20名(60.6%)在第48周时是应答者,其定义为HDV RNA的下降≥2log
表4.治疗结束(第48周)抗HDV活性
*BLQ=低于定量限(14IU/mL);BLD=低于检测限(8IU/mL)
如图3所示,发现以180mcgλ剂量治疗的受试者显示出比以120mcgλ剂量治疗的受试者更高的应答率,而不管每方案剂量减少如何。与以120mcg干扰素λ治疗的受试者的-1.18log
背景:丁型肝炎病毒(HDV)感染导致人类病毒性肝炎的最具侵略性形式。没有已批准的疗法。HDV感染在全球范围内为15-20百万。PEG IFN-λ-1a(λ)先前已证明在>3000HBV和HCV受试者中具有良好的耐受性,与PEG IFN-α(α)相比,血细胞减少,流感样症状和精神病症状减轻。LIMT这项研究旨在评估HDV受试者中干扰素λ单一疗法(“λ”)的安全性和有效性。
这是在患有慢性HDV的受试者中对λ120或180μg,每周SC注射进行48周,随后是治疗后24周的随机、开放标签的研究。
纳入标准包括通过qPCR得到的HDV RNA阳性(
在该研究中,将33名受试者随机分为λ180μg(N=14)或120μg(N=19)。BL平均值:HDV RNA 4.1log
*低基线病毒载量=HDV RNA≤4log
**所有接受该起始剂量试验的受试者
***所有完成试验且未终止给药的受试者
在第48周,λ180mcg组中36%-45%的受试者的HDV RNA水平低于LLOQ(BLQ)。这些受试者中具有HDV RNA水平BLQ的比例与在基线时具有高病毒载量与低病毒载量的那些受试者的比例(分别为38%[3/8]和33%[2/6])(表5)是相当的。
在给药后第24周,BLQ率与λ180mcg组在EOT时相同(36-45%),并且总体上与在基线时具有高病毒载量与低病毒载量的那些的EOT时的结果(分别为25%[2/8]和50%[3/6]))(表5)是相当的。
在λ180mcg/周治疗之后,29-36%(总受试者4/14,完成受试者4/11)的受试者在第48周和在给药后第24周报告了检测不到的HDV RNA(表8),从而进一步证明了对λ的病毒学应答的持久性。
λ180μg的持久病毒学应答(治疗后24周时,DVR=BLQ))的ITT率(14个中的5个,占36%)较优于α180μg的不可检测性的历史发生率(0%)(Wedemeyer,2019)。在低BL病毒载量(VL)受试者(≤4log10)中50%DVR已使用λ180mcg QW证实。
常见的治疗中的AE包括轻至中度的流感样症状和转氨酶水平升高。先前用α治疗的受试者对λ的副作用明显较少。在巴基斯坦群组中观察到黄疸病例和胆红素升高的发生率增加。没有受试者表现出代偿失调的症状,并且所有受试者都对剂量减少或剂量停止反应良好。ALT和胆红素动力学的
与α180mcg的历史数据相比,λ180μg具有更好的抗病毒活性和更好的耐受性。用λ180mcg治疗后24周观察到持久BLQ病毒学应答。
图4显示了在治疗后24周(第72周)使用λ180和120mcg QW的持久病毒学应答(DVR)。持久病毒学应答(DVR)被定义为HDV RNA BLQ治疗后24周的应答。认为,HDV RNA下降2log
令人惊讶的是,此处显示的是用λ进行的治疗具有介于约36%至45%之间的提高的持久应答率,这比用α可获得的约25%的应答率要好。图9和表6进一步证明了用λ治疗的在治疗48周后达到BLQ的36-45%的受试者在治疗后24周维持HDV RNA BLQ。
λ180mcg/周组中的受试者,在第48周时显示50-64%的HDV RNA相对于基线下降了>2log
与在180mcg/周组中观察到的应答率相比,用λ120mcg/周治疗的受试者在EOT和最后一次给药后第24周的应答率较低。但是,在治疗后的随访中,在EOT时的应答率也保持不变。在第72周,120mcg/周组的16-21%(3/19)的受试者表现出HDV RNA BLQ,而11-14%(2/19)的受试者表现出HDV RNA相对于基线下降>2log
在第48周,分别用λ180mcg/周和120mcg/周剂量治疗的受试者中有14-18%和11-14%表现出ALT正常化。在最后一次给药后第24周,这些数字分别提高到36-45%和26-36%。
每个方案的大多数剂量减少(26-36%的受试者)、中断(3-15%的受试者)和治疗终止(21-26%的受试者),该大多数与肝胆实验室异常(ALT、AST、GGT和/或胆红素升高)相关。在终止研究药物治疗的8名(24.2%)受试者中,有5名(62.5%)来自巴基斯坦卡拉奇站点,这可能归因于潜在的药物基因组学和/或环境因素。没有观察到临床代偿失调的情况。施用180mcg/周剂量的受试者的百分比具有以下一种或多种:剂量减少(约12-35%)、中断(约7-15%)和治疗终止(约15-21%)。
被施用120mcg/周剂量的受试者的百分比具有以下一种或多种:剂量减少(约12-35%),中断(约7-15%)和治疗终止(约15-21%)。
图10和表6表明,受试者在治疗后24周确实达到了ALT正常化的复合终点以及≥2log
起始剂量。由于在巴基斯坦卡拉奇站点的肝相关的SAE的发生次数增加(在7/15[46.7%]的受试者中观察到),在卡拉奇站点随机分配180mcg/周的6名受试者全部降低为120mcg/周(如果可以的话,在第一次给药之前)。由于给药方案的这些变化,对于本主要报告中所述的功效和安全性评估,受试者按其初始λ剂量而非随机治疗组进行分类:14/33的受试者为λ180mcg,而19/33的受试者为λ120mcg。
*起始剂量
**试验中的所有受试者
***所有完成试验且未终止给药的受试者
在λ180μg治疗组中,具有高(>4log
在第48周时,分别具有高基线病毒载量和低基线病毒载量的25-29%和33-40%的受试者达到检测不到的HDV RNA水平。在第72周时,这两组之间的差异与48周的测量值一致,其中低基线病毒载量的33-40%的受试者达到BLQ,而高基线病毒载量的25-29%的受试者达到了这一终点(表6)。
在治疗后维持这种应答可能表明受试者的免疫应答实现了对病毒复制的控制。出乎意料的是,与先前HDV研究中报道的聚乙二醇化干扰素α-2a的患者百分比(Myr203研究中为0%)相比,对于λ180mcg QW,在治疗后24周时观察到检测不到HDV RNA的患者百分比为较高的29%。
图5表明了使用λ时的ALT正常化。丙氨酸氨基转移酶(ALT)正常化是肝脏健康改善的标志。分别在用λ180mcg QW和λ120mcg QW治疗的14%和11%的受试者在治疗结束时观察到ALT正常化。治疗后24周(第72周),ALT正常化继续增加。
图4和6以及表7和8表明,与λ120mcg QW剂量相比,λ180mcg QW导致更大的HDV RNA下降,尽管在治疗期间剂量减少(180mcg减少至120mcg或120mcg减少至80mcg)。
表7
*起始剂量。由于在巴基斯坦卡拉奇站点的肝相关的SAE的发生次数增加(在7/15的受试者中观察到),在卡拉奇站点随机分配180mcg/周的6名受试者全部降低为120mcg/周(如果可以的话,在第一次给药之前)。由于给药方案的这些变化,对于本主要报告中所述的功效和安全性评估,受试者按其初始λ剂量而非随机治疗组进行分类:14/33的受试者为λ180mcg的,而19/33的受试者为λ120mcg。
**试验中的所有受试者
***所有完成试验且未终止给药的受试者
图7表明了λ治疗导致一些受试者的HBsAg下降>1log10。治疗后,一些受试者的HBsAg水平持续下降。较低的HBsAg水平可能反映了HBeAg丢失和HBV感染性。
图8表明了在治疗的第48周时应答者的HDV RNA。应答者定义为第48周HDV RNA的下降≥2Log
表8示出了研究期间受试者的处置。例如,19名受试者以120mcg剂量开始,14名受试者以180mcg剂量开始。然而,在研究中,直到第72周,14名受试者保持在120mcg剂量,而11名受试者保持在180mcg剂量。在此,一些数据是根据登记和开始的受试者数量(修改的治疗意向)(表8中的“N”表示)计算得出的,而一些数据是参照表8中(按照方案)“保持在研究中”的数量计算出的。
*起始剂量(见上文)
表9显示,在本研究中,使用λ治疗,流感样症状和精神病症状主要为1级。与历史上的聚乙二醇化干扰素α用途相比。血细胞减少症和血小板减少症(没有血小板减少症)的发生率要低得多。在研究中使用λ治疗时,流感样症状和精神病症状较轻且较少,并且没有血小板减少事件。剂量减少或终止治疗后,胆红素升高,ALT水平恢复正常。
表10显示,与先前的使用α的研究相比,使用λ时具有较轻度的流感样症状和精神病症状。没有血小板减少症的事件,没有使用造血生长因子,在减少剂量或停止治疗后,胆红素升高和ALT水平正常化。在一项针对176名HBV感染受试者(LIRA-B)的第二阶段研究中的λ对比α的头对头研究中,相关的临床事件的总体发生次数(体质症状、神经系统事件、流感样症状、肌肉骨骼症状和精神病症状)在α组(72.3%)高于λ180-μg组(50.0%)。
临床实验室测试异常与λ和α的已知安全性特征一致,与α组相比,在λ180-μg组中的ALT、AST和胆红素(1-4级和3/4级)的频率增加;并且与λ180-μg组相比,α组中的血细胞减少症,尤其是白细胞减少症,中性粒细胞减少症和血小板减少症(1至4级)的频率增加。当与其他干扰素(例如α)相比时,在λ中观察到流感样症状和精神病症状较轻且较少。没有报道血小板减少的事件,也没有使用造血生长因子。对于胆红素、ALT和/或AST水平升高的事件,在剂量减少或治疗终止后所有事情均恢复正常。
当与λ120mcg/周组相比时,λ180mcg/周组的受试者报告的不良事件对于体质(疲劳、乏力)和神经(头晕、头痛)AE更为严重,而对于实验室异常(胆红素、ALT、AST、GGT或INR升高;DILI;血白蛋白降低;LFT异常)则较不严重。参见表11和12。
缩写:AE=不良事件;ALT=丙氨酸氨基转移酶;AST=天冬氨酸转氨酶;DILI=药物性肝损伤;GGT=γ-谷氨酰转移酶;INR=国际标准化比率;LFT=肝功能检查。
缩写:AE=不良事件;ALT=丙氨酸氨基转移酶;AST=天冬氨酸转氨酶;DILI=药物性肝损伤;GGT=γ-谷氨酰转移酶;INR=国际标准化比率;LFT=肝功能检查。
在该研究中,在巴基斯坦群组中高胆红素血症发生率更高。例如,以下参数与其他群组不同:巴基斯坦群组中的4/15(27%)有高胆红素血症对比非巴基斯坦群组中的2/18(11%)有高胆红素血症;在巴基斯坦受试者中有3/15(20%)出现黄疸对比在非巴基斯坦受试者中有0/18(0%)出现黄疸;非巴基斯坦群组的发病率/严重程度与HBV中的先前的λ和α数据一致。也就是说,胆红素升高的受试者没有出现代偿失调的迹象或症状,并且胆红素水平对剂量减少/中断有应答,并且受试者在整个胆红素升高期间均表现出正常的肝功能(PT)。
总之,在达到第48周的24个受试者中:120μg组(N=14)的平均HDV RNA下降=1.5log
不管治疗期间的剂量中断或减少或剂量终止,λ180mcg/周的剂量提供的功效都大于λ120mcg/周的剂量。180mcg/周剂量的受试者中约有35%-45%降低至120mg剂量。180mcg/周剂量的受试者中约有7-9%,剂量减少至一半。
在经过48周的λ180mcg/周治疗后,36-45%的受试者达到了HDV RNA水平BLQ(29-36%检测不到),并且50%的受试者显示HDV RNA相对于基线下降了>2log
在使用λ180mcg/周治疗的情况下,在给药后24周(例如,在最终或最后一次剂量后),这种病毒学应答得以维持,其中36-45%的受试者表现出HDV RNA水平BLQ(29%检测不到)。
相比之下,最近的一项研究使用相同的RoboGene测定法(Kit 2.0)针对MyrcludexB与PEG-IFNα联合治疗患有慢性HBV/HDV合并感染的受试者的功效来测量HDV RNA,该研究报道13%(2/15)的受试者在第48周时检测不到HDV RNA,在给药后第24周(72周)时HDV RNA为0%。(Wedemeyer et al,2019),ILC 2019;GS-13
对于λ180mcg/周组中的受试者,在给药后24周,报道36-45%为ALT-正常化,这是在对患有HBV和HCV受试者施用λ而进行的先前的研究中观察到的趋势,可能与λ对宿主效应细胞的免疫调节作用有关,导致在治疗期间短暂的ALT增加,然后在治疗后正常化。此外,在180mcg/周的剂量下,有29-36%的受试者符合ALT正常化以及或者HDV RNA BLQ或相对于基线下降>2log
在第48周时,33名受试者中的7名在48周期间比先前的HDV RNA水平的测量值反弹了超过1log
在健康受试者和HCV患者中,在单剂量和多剂量SC施用λ后,表征了λPK(表12)。达到最大浓度的中值时间(Tmax)为8.00至25.1小时(范围为1至120小时)。单剂量施用λ180μg后,最大观察浓度的几何平均(Cmax)(变异系数[%CV])值在1.06(102)到2.41(177)ng/mL之间。多剂量施用后,几何平均Cmax(%CV)为1.54(86.0)ng/mL,这表明有中等积累。在健康受试者和HCV患者单剂量SC施用λ180μg后,从时间零外推至无限时间的浓度-时间曲线下的面积(AUCinf)(%CV)范围为116.9(73.1)至221(59)ng×h/mL。通常,暴露值(浓度-时间曲线[AUC]和Cmax下的面积)在80至240μg剂量范围内近似与剂量成比例。终末消除半衰期(T1/2)的平均值(标准偏差[SD])为50.43(20.47)到74.0(42.7)小时。
群体PK建模已证明体重影响清除率,与标准异体测量法一致;然而,尽管体重对清除率有显著影响,但与总体受试者间差异相比,影响很小,因此不能保证基于体重的给药。初步结果表明,肾功能不全会增加暴露;与正常肾功能的受试者相比,在轻度肾功能不全的受试者中,Cmax和AUC分别高出约13%和20%,在中度肾功能不全、严重肾功能不全和终末期肾病(ESRD)组中,Cmax和AUC分别是正常肾功能的受试者的约2倍。初步临床结果表明,在单次180μg剂量施用后,λ是CYP1A2、CYP2C9和CYP3A4的轻度抑制剂,也是CYP2C19和CYP2D6的中度抑制剂。
在本说明书中引用的所有出版物和专利都通过引用并入本文,就好像每个单独的出版物或专利被确切地并单独地指示为通过引用结合,并且通过引用并入本文从而结合引用的出版物披露和描述这些方法和/或材料。
应该理解,虽然本发明已通过某些方面、实施方案、和可选特征进行了具体公开,但是本领域技术人员可以采取对此类方面、实施方案和可选特征的修改、改进和变化,并且此类修改、改进和变化被认为是在本公开内容的范围内。
本文已经宽泛地和概括地对本发明进行了说明。落在总披露内容之内的更窄的种类和亚属的分类中的每个也形成了本发明中的一部分。此外,当本发明的特征或方面以马库什组(Markush group)描述时,本领域技术人员应意识到本发明还由此描述马库什组的任何单个个体或亚组个体。
- 用干扰素λ治疗丁型肝炎病毒感染
- 对乙型肝炎病毒感染或其与丁型肝炎病毒感染及相关肝脏疾病结合的治疗
