组合物
文献发布时间:2023-06-19 12:16:29
技术领域
本发明涉及过氧化物酶体增殖物激活受体(PPAR)调节剂的新制剂及其在治疗中的用途。本发明还涉及酰基高丝氨酸内酯(PPAR调节剂)用于通过非肠道或局部给药途径增强药物递送的用途。
背景技术
本发明在一个方面涉及治疗或预防神经退行性疾病、视网膜疾病和脑部疾病以及肺动脉高压、癌症和抗纤维化疾病。神经退行性疾病影响中枢和周围神经系统的各个部分,包括帕金森氏病、阿尔茨海默氏病和亨廷顿氏病。视网膜疾病可包括视网膜退行性疾病,例如青光眼、年龄相关性黄斑变性(AMD)、糖尿病性视网膜病和视神经炎。脑部疾病可包括颅脑外伤、中风、脑瘫,例如由新生儿缺氧和癌症(包括脑瘤)引起的脑瘫。
过氧化物酶体增殖物激活受体(PPAR)是属于核激素受体超家族的配体激活转录因子。这些受体在1990年的啮齿动物肝细胞中被鉴定,名称来自它们诱导过氧化物酶体增殖的能力。PPAR在线粒体生物发生的调节中通过检测和控制脂质体内平衡,直接与PPARγ共活化剂1-α(PGC-1α)和1-β(PGC-1β)相互作用。这些受体还调节用于解偶联蛋白(UCPs)的基因编码的表达。UCPs是涉及热生成、ROS产生和氧化功能的控制的内部线粒体膜中的转运蛋白。通过结合靶基因的启动子区域中的特定序列,PPAR能够调节基因转录。激活的PPAR也可以直接抑制转录因子。当存在对能量的蜂窝需求时,这些功能允许PPAR促进ATP产生中的脂类消耗。许多PPAR调节剂具有较差的水溶性和/或生物活性,这可能会限制治疗效用。
罗格列酮(Rosiglitazone)是PPAR-γ的外源激动剂,属于噻唑烷二酮家族,它充当胰岛素敏化剂。罗格列酮最初用于对抗2型糖尿病中的胰岛素抵抗,最近显示可用作帕金森病(PD)的动物模型中的治疗(Normando等,2016年)。已报道罗格列酮疗法可促进抗炎反应,具有微神经胶质激活的衰减,促炎性细胞因子的释放,氧化应激,星形胶质瘤和单胺氧化酶-对多巴胺代谢的关键酶的可逆抑制。用于治疗帕金森病(PD)的噻唑烷二酮疗法的临床研究的结果一直是复杂的,并且这些试剂的给药被报道为不会减慢疾病进展。
最近,已经报道姜黄素、白藜芦醇和酰基高丝氨酸内酯(AHLs)可结合PPAR,并且已经发现这种相互作用有助于它们的生物活性和/或治疗作用,包括:促进抗炎反应,具有微神经胶质激活的衰减,促炎性细胞因子和氧化应激的释放。AHL被证明与PPAR-γ(Jahoor等,2008年;Cooley等,2010年)上的同一位点竞争。与其它PPAR调节剂一样,这些化合物具有差的水溶性和/或生物利用度。
因此,需要为PPAR调节剂提供改进的制剂以提高生物利用度和/或生物活性。
发明内容
本发明的第一个方面提供了一种药物组合物,它包括过氧化物酶体增殖物激活受体(PPAR)调节剂和聚合物纳米载体组分,其中,所述聚合物纳米载体组分能够在水性介质中溶解所述PPAR调节剂。已知PPAR调节剂在水中的溶解度低,需要使用诸如二甲基亚砜(DMSO)之类的溶剂。然而,本发明人发现,聚合物纳米载体可用于在生理pH(约pH 4至约pH8)下增溶PPAR调节剂。因此,可以制备本发明所述的组合物而无需使用潜在有害的溶剂,例如二甲基亚砜(DMSO)。令人惊讶地,已经观察到本发明所述的组合物在中枢神经系统损伤的体内模型中具有神经保护作用。另外,观察到全身施用这种组合物对视网膜和中枢神经系统(CNS)具有神经保护作用。与单独施用PPAR调节剂相比,本发明所述的组合物显示出更高的神经保护功效。
PPAR调节剂可以是内源性或外源性分子,并且包括调节PPAR活性以使净受体活性改变的化合物,即该化合物可以充当PPAR激动剂或抑制剂。例如,PPAR的活性可以通过与受体结合或作用于PPAR激活的途径的下游成分上的PPAR激动剂来调节,以诱导相似的活性。PPAR激动剂可以是超激动剂、部分激动剂或完全激动剂。PPAR调节剂对PPAR的结合亲和力可以为100μM或更小,优选10μM或更小,5μM或更小,或更优选2μM或更小或1μM或更小。在本发明的具体实施方式中,PPAR调节剂对PPAR的结合亲和力可以为100nM或更小,或者10nM或更小。
这里所采用的聚合物纳米载体组分是指包含聚合物的组分。例如,聚合物纳米载体组分可包含聚乙二醇(PEG)基团和/或基于聚合物的组分,例如泊洛沙姆。优选地,聚合物纳米载体组分是表面活性剂或其合成衍生物。
聚合物纳米载体组分可以是非离子表面活性剂和/或可以是形成胶束的表面活性剂。有利地,形成相对柔软/柔性的胶束的非离子性胶束形式的表面活性剂,其可以增强它们跨非肠胃外给药途径的运输,例如跨粘膜或生物膜的运输。非离子表面活性剂可包括:聚山梨酯(吐温)、Triton X-100、聚乙氧基化蓖麻油和Solutol HS。在本发明的具体实施方式中,形成胶束的表面活性剂可以选自以下一种或多种:D-α-生育酚聚乙二醇1000琥珀酸酯(维生素E TPGS)、聚乙二醇化磷脂衍生物(例如DSPE-PEG、DSPS-PEG等)、泊洛沙姆(例如Lutrol F68、Lutrol F127等),聚乳酸-乙醇酸共聚物(PLGA)或壳聚糖衍生物。任选地,可以通过添加“点击化学”反应性基团来进一步官能化PEG衍生物,例如将马来酰亚胺-PEG用于与硫醇基团共价结合,或将叠氮化物-PEG/炔-PEG用于与炔烃/叠氮化物官能化的靶向部分共价结合。所述功能化的靶向部分可以包括蛋白质或肽,包括磷脂酰丝氨酸结合蛋白,例如膜联蛋白,特别是膜联蛋白V或其功能性片段或功能性衍生物,其优选包含膜联蛋白重复序列。可替代地,可以使用镍官能化的脂质(例如18:1DGS-NTA(Ni)),将His标记的蛋白质或肽与颗粒表面非共价结合。
在本发明的优选具体实施方式中,聚合物纳米载体组分包含维生素E TPGS,任选地与Lutrol F127、Solutol HS、壳聚糖或DSPE-PEG组合。维生素E TPGS是一种非离子型表面活性剂,当浓度大于0.02%w/w时会形成稳定的胶束,从而提供较低的临界胶束浓度。α-生育酚成分还具有内源性和抗氧化特性,以及对P-糖蛋白的拮抗作用,可以增强含有该试剂的制剂的屏障穿透能力。本发明的聚合物纳米载体组合物可以包含维生素E TPGS,其浓度为约0.02mg/mL至约100mg/mL,优选为约10mg/mL至约65mg/mL,更优选为约20至约55mg/mL。
Lutrol F127是一种双官能团嵌段共聚物表面活性剂,由侧接亲水性聚氧乙烯基的中心疏水性聚氧丙烯基组成,可在空间上稳定纳米载体以防止聚集。本发明的聚合物纳米载体组合物可以包含Lutrol F127,其浓度为约0.2%w/v至约30%w/v,优选为约5%w/v至约20%w/v,更优选为约10%w/v至约20%w/v。Lutrol F127可以单独使用或与维生素ETPGS组合使用。
Solutol HS(2-羟基乙基12-羟基十八烷酸酯)是非离子型增溶剂和乳化剂,具有低毒性。本发明的聚合物纳米载体组合物可以包含Solutol HS,其浓度约为100mg/mL至约200mg/mL。Solutol HS优选与维生素E TPGS组合使用。
聚合物纳米载体组分可以是最高达100%的形成胶束的表面活性剂,例如,聚合物纳米载体组分可以是最高达100%的维生素E TPGS或最高达100%的Lutrol F127。可替代地,形成胶束的表面活性剂可包含表面活性剂的组合,例如维生素E TPGS与PEG化磷脂衍生物(例如DSPE-PEG)、非离子表面活性剂(例如Solutol HS)或泊洛沙姆(例如Lutrol F127)组合。
所述组合物优选为胶囊化制剂的形式,最优选为胶束。不受理论的束缚,发明人认为,PPAR调节剂的包封可以通过提供PPAR调节剂的持续释放并保护PPAR调节剂免于水解降解而改善该组分的生物利用度。已经观察到本发明所述的组合物比以未包封形式施用的PPAR调节剂表现出更大的神经保护作用。
本发明的胶束纳米载体的直径可为约100nm或更小,优选约70nm或更小,或约50nm或更小。在本发明的优选具体实施方式中,胶束纳米载体的直径为约30nm或更小。胶束纳米载体可具有约10nm的最小直径。优选地,胶束纳米载体的直径为约20nm。没有上浆(例如挤出工艺)的脂质体的大小是异质的,直径通常为100nm至1000nm。相反,本发明的胶束纳米载体的直径基本均一。例如,在本发明所述的组合物中,至少70%或至少80%或至少90%的胶束纳米载体可具有约10nm至约30nm的直径。
PPAR调节剂的增溶优选是指PPAR调节剂的包封,其可以通过包封效率来量化。当在生理pH下进行时,包封效率优选为至少5%或至少10%或至少15%。在本发明的实施例中,包封效率可以是至少20%或至少25%。在本发明的实施例中,包封效率可以是50%或更高,或70%或更高,或80%或更高,并且可以高达100%。
包封的制剂可以包含PPAR调节剂,其浓度为约0.1mg/mL至约100mg/mL,优选为约0.5mg/mL至约50mg/mL,更优选为约1mg/mL至约10mg/mL。
在本发明的优选具体实施方式中,所述组合物为三元体系形式,包含水连续相、PPAR调节剂和聚合物纳米载体组分,主要以分散在其中的分散相存在。
PPAR调节剂可以是PPAR-α调节剂、PPAR-γ调节剂、PPAR-δ调节剂、双PPAR调节剂或泛PPAR调节剂。在本发明的优选具体实施方式中,PPAR调节剂是PPAR-γ激动剂或具有PPAR-γ激动剂活性的化合物。不受理论的束缚,本发明人认为PPAR-γ激动剂(或具有这种活性的化合物)作用于神经元和视网膜神经节细胞(RGC)以减轻氧化应激、减少小胶质细胞活化和促炎性细胞因子释放并促进线粒体生物发生。这些途径已经涉及某些CNS病症的发病机理,包括青光眼和帕金森氏病,提示了本文所述的治疗此类病症的作用机制。
PPAR激动剂可以是噻唑烷二酮。在本发明的具体实施方式中,PPAR激动剂可以选自:吡格列酮、罗格列酮、洛贝格列酮、西格列酮、达格列酮、英格列酮、奈托格列酮、利沃格列酮、植物大麻素Δ9-THCA和曲格列酮中的一种或多种。
可替代地,如上所述,PPAR调节剂可以是调节PPAR活性以增加净受体活性的化合物,即具有与激动剂相同的净作用的化合物。此类化合物包括姜黄素和白藜芦醇,已知具有PPAR-γ活性。
可替代地,PPAR调节剂可以是酰基高丝氨酸内酯(AHSL)化合物。此类化合物已显示具有PPAR调节能力(Jahoor等)。AHSL可例如具有长度为4至20个碳的酰基。还有提及3-氧代和3-羟基衍生物,以及AHSL的四酸和四氢代酸衍生物。示例性的AHSL化合物包括3-羟基十二烷酰基高丝氨酸内酯和3-氧十二烷酰基高丝氨酸内酯。AHSL化合物还具有另一个优势,即它们可与紧密连接相互作用以增加生物屏障的通透性(Karlsson等)。这可以增强组合物在体内向预期组织的递送。
例如,本发明的合适的聚合物纳米载体组合物可以是以下的胶束制剂:
约10mg/ml维生素E TPGS;
约20mg/ml Lutrol F127;
约5mg/ml姜黄素;或者
约25mg/ml维生素E TPGS;
约150mg/ml Solutol HS;
约5mg/ml姜黄素或约15mg/ml白藜芦醇;或者
约50mg/ml维生素E TPGS;
约150mg/ml Solutol HS;
约5mg/ml姜黄素,或约15mg/ml白藜芦醇。
本发明所述的组合物可以包含两种或更多种PPAR调节剂的组合。优选地,如上所述包封至少一个PPAR调节剂。备选地,两个PPAR调节剂可以被包封。当两个或多个PPAR调节剂被包封时,包封的类型可以相同或不同。例如,两个PPAR调节剂可以被包封在单个聚合物纳米载体中,或者每个PPAR调节剂可以被包封在单独的聚合物纳米载体中,在给药之前将其结合。在本发明的具体实施方式中,组合物可以包含白藜芦醇和姜黄素的组合。
该组合物可以是无菌的,并且可以包含一种或多种药学上可接受的载体或赋形剂。合适的载体和赋形剂是本领域技术人员所熟知的,并且可以根据预期的递送途径进行优化。例如,本发明所述的组合物可包括:缓冲剂、粘合剂、防腐剂、增稠剂或抗氧化剂,例如海藻糖。
优选地,该组合物适合于局部递送,包括经眼和经鼻递送、口服或经皮肤递送。由于减少了对PPAR调节剂的全身暴露,该组合物的局部递送可能是有利的,PPAR调节剂已报道与有害的副作用相关,包括增加的心肌梗塞和死亡的风险。
局部用制剂优选为在溶液或悬浮液形式的水性介质中,例如溶液、洗剂、凝胶、乳膏、软膏、凝胶或泡沫。口服制剂可以是以下形式:溶液剂,混悬剂,片剂,胶囊剂,散剂或颗粒剂。肠胃外给药可包括:静脉内、皮下或腹膜内给药。肠胃外制剂尤其可以是在水性介质中的溶液或悬浮液的形式,或者可以作为冻干粉末提供。
在本发明的具体实施方式中,该组合物适合于鼻内递送。这样的制剂可以是适合吸入的溶液、悬浮液或干粉形式。
通常,特别是当组合物以液体形式(通过任何上述途径)给药时,本发明所述的组合物可以冻干粉的形式提供。已经确定本发明所述的组合物对于冻干是稳定的,并且可以使用例如生理盐水或其他(优选水性的)媒介物进行重构。当要进行冻干时,优选在组合物中包括冷冻保护剂材料,例如海藻糖。
本发明所述的组合物可以用于治疗。特别地,本发明所述的组合物可以用于治疗或预防CNS疾病,例如神经退行性疾病、视网膜疾病或脑部疾病。
在另一方面,本发明提供了一种用于治疗CNS疾病,例如神经退行性疾病、视网膜疾病或脑部疾病的方法,该方法包括向患者施用本发明所述的组合物。该患者优选是哺乳动物,包括人,并且可以是幼年或老年患者。
神经退行性疾病可以是帕金森氏病、阿尔茨海默氏病或亨廷顿氏病。视网膜疾病可能包括视网膜退行性疾病,例如青光眼、年龄相关性黄斑变性(AMD)、糖尿病性视网膜病和视神经炎。脑部疾病可能包括颅脑外伤、中风、脑瘫,例如由新生儿缺氧和癌症(包括脑瘤)引起的脑瘫。在本发明的具体实施方式中,该组合物可以用于治疗症状前的帕金森氏病。
如上所述,该组合物可以局部给药,例如眼内或鼻内给药。在本发明的具体实施方式中,组合物可以与一种或多种其他治疗剂组合施用,例如胰岛素、二甲双胍、二肽基肽酶-4(DPP-4)抑制剂(例如阿格列汀)、胰高血糖素样肽-1(GLP-1)受体激动剂、抗氧化剂(例如白藜芦醇、辅酶Q10、艾地苯醌、槲皮素等)、维生素D类化合物或其衍生物、血管内皮生长因子(VEGF)拮抗剂(例如兰尼单抗、贝伐单抗或其功能性片段)、N-甲基-D-天冬氨酸(NMDA)受体拮抗剂、谷氨酸拮抗剂或美金刚。附加的治疗剂可以与本发明所述的组合物同时施用或可以顺序施用。当附加的治疗剂与本发明所述的组合物同时给药时,它可以以与PPAR相同的相或以三元组合物的连续相包含在本发明所述的组合物中。在一个具体的实施方案中,附加的治疗剂具有疏水性,使得它和PPAR都存在于分散相中(即,共包封)。在本发明的具体实施方式中,组合物包含姜黄素和抗氧化剂,例如白藜芦醇。
在另一方面,本发明提供了一种制备如上所述的PPAR调节剂胶束组合物的方法,该方法包括:(i)将一种或多种聚合物纳米载体组分溶解在第一溶剂混合物中;(ii)将PPAR调节剂溶解在第二溶剂混合物中;(iii)将溶解的聚合物纳米载体组分和溶解的PPAR调节剂混合,并干燥该混合物以形成薄膜;(iv)用缓冲液使膜再水化以形成胶束溶液;(v)过滤悬浮液以除去未包封的PPAR调节剂。优选地,第一溶剂混合物是短链伯醇,例如乙醇。与其他溶剂(如氯仿/甲醇)相比,乙醇的毒性较小,这意味着组合物中可能存在的残留溶剂不太可能出现问题。在本发明的具体实施方式中,第一和第二溶剂混合物可以相同。在该方法的优选实施方案中,PPAR调节剂是姜黄素,白藜芦醇或AHSL,已显示它们难溶于其他溶剂混合物。优选地,将悬浮液通过孔径为约0.22μm的膜过滤器过滤,该膜过滤器可以附带去除任何潜在的生物污染物。
在另一方面,本发明提供了一种药物组合物,它包含活性药物成分(API)和AHSL化合物。该AHSL化合物可以是例如具有长度为4至20个碳的酰基,还可以包括3-氧代和3-羟基衍生物,也可以包括AHSL的四酸和tetronic酸衍生物。示例性的AHSL化合物包括3-羟基十二烷酰基高丝氨酸内酯和3-氧十二烷酰基高丝氨酸内酯。
如上所述,AHSL化合物是紧密连接相互作用的,以增加生物屏障的通透性。已知这些化合物在宿主感染建立期间被某些细菌用作组织入侵过程的一部分。然而,先前尚未被认识到这些化合物作为将API递送到靶组织中的手段的潜力,并且本发明人已经确定这种方法可用于大范围的API,包括上述的PPAR调节剂(姜黄素、白藜芦醇等)和高分子量物质,例如肽或抗体。
在一个优选的具体实施方案中,该方面的组合物还包括在脂质体或胶束中包封AHSL和/或API的聚合物纳米载体组分。聚合物纳米载体组分优选为脂质体形式,其可以包含一种或多种磷脂,并且还可以包含固醇,例如胆固醇和/或维生素E衍生物,例如TPGS。合适的磷脂包括例如基于磷脂酰胆碱、磷脂酰丝氨酸和磷脂酰乙醇胺的那些磷脂。更详细地,用于本发明所述的组合物的磷脂可包括天然磷脂衍生物或合成磷脂衍生物。天然磷脂衍生物可包括:卵磷脂酰胆碱、氢化卵磷脂酰胆碱、豆磷脂酰胆碱、氢化大豆磷脂酰胆碱或鞘磷脂中的一种或多种,例如1-肉豆蔻酰基-2-棕榈酰基-sn-甘油-3-磷酸胆碱、1-肉豆蔻酰基-2-硬脂酰-sn-甘油-3-磷酸胆碱、1-棕榈酰基-2-肉豆蔻酰基-sn-甘油-3-磷酸胆碱、1-棕榈酰基-2-油酰基-sn-甘油-3-磷酸胆碱、1-棕榈酰基-2-油酰基-sn-甘油-3-磷酸乙醇胺、1-棕榈酰基-2-硬脂酰基-sn-甘油-3-磷酸胆碱、1-硬脂酰基-2-肉豆蔻酰基-sn-甘油-3-磷酸胆碱、1-硬脂酰基-2-油酰基-sn-甘油-3-磷酸胆碱和1-硬脂酰基-2-棕榈酰基-sn-甘油-3-磷酸胆碱。合成的磷脂衍生物可包括:1,2-二癸酰基-sn-甘油-3-磷酸胆碱(DDPC)、1,2-二十二烷基-sn-甘油-3-磷酸胆碱(DEPC)、1,2-二十二烷基-sn-甘油-3-磷酸乙醇胺(DEPE)、1,2-二亚油酰基-sn-甘油-3-磷酸胆碱(DLOPC)、1,2-二聚十二烷基-sn-甘油-3-磷酸胆碱(DLPC)、1,2-二聚十二烷基-sn-甘油-3-磷酸乙醇胺(DLPE)、1,2-二氨基十二烷基-sn-甘油-3-磷酸丝氨酸(DLPS)、1,2-二肉豆蔻酰基-sn-甘油-3-磷酸胆碱(DMPC)、1,2-二豆蔻酰基-sn-甘油-3-磷酸乙醇胺(DMPE)、1,2-二肉豆蔻酰基-sn-甘油-3-磷酸丝氨酸(DMPS)、1,2-二油酰基-sn-甘油-3-磷酸胆碱(DOPC)、1,2二油酰基-sn-甘油-3-磷酸乙醇胺(DOPE)、1,2-二油基-sn-甘油-3-磷酸丝氨酸(DOPS)、1,2-二棕榈酰基-sn-甘油--3-磷酸胆碱(DPPC)、1,2-二棕榈酰基-sn-甘油-3-磷酸乙醇胺(DPPC)、1,2-二棕榈酰基-sn-甘油-3-磷酸丝氨酸(DPPS)、1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(DSPC)、1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺(DSPE)和1,2-二硬脂酰基-sn-甘油-3-磷酸丝氨酸(DSPS)中的一种或多种。在本发明的具体实施方式中,表面活性剂或脂质可以共轭于聚乙二醇(PEG),例如PLGA-PEG。可选择地,聚合物纳米载体组分可以如关于本发明的第一方面所定义的。
一些AHSL能够在水性介质中形成胶束状结构,因此能够在不添加其他成分的情况下充当API的递送系统。然而,可通过包含聚合物纳米载体组分,例如聚乙烯吡咯烷酮来改善组合物的稳定性,例如上面所述。
对包括在该方面的组成中的API没有特别限制,并且本领域技术人员将能够容易地确定可以潜在地使用哪些API。然而,作为示例,可以考虑上面关于第一方面提到的各种API类型。
在相关方面,本发明提供了AHSL用于增强API的递送的用途。特别地,增强了跨生物学屏障(例如血脑屏障、血视网膜屏障等)的递送。
附图说明
现在将仅通过实施例并参考附图的方式来详细描述本发明。
图1显示了姜黄素在DMSO中的吸收光谱和摩尔消光系数以及稳定和降解的姜黄素在DMSO中的摩尔消光系数。
[A]溶解于DMSO中的已知浓度为0.005mg/mL姜黄素的标准曲线,其揭示了在435nm波长处的峰值吸收率(OD)。[B]姜黄素浓度相对于435nm的对数吸光度的梯度表示摩尔消光系数(ε)。[C]在5mg/mL氢氧化钠(NaOH)中降解的姜黄素比溶解的稳定的胶束姜黄素制剂要暗得多(右)。[D]将降解的姜黄素在NaOH中稀释并在DMSO中稀释的摩尔消光系数与在DMSO中稀释的5mg/mL姜黄素在乙醇中的溶液进行比较。降解72小时后,摩尔消光系数从22,462L·mol
图2显示了采用真空辅助旋转蒸发的薄膜水化技术,该技术涉及将溶解的物质添加到圆底烧瓶[A.i]中,并在真空和高温下蒸发乙醇(EtOH)[A.ii],薄膜干燥留下产物[A.iii]。将其重悬于水性缓冲液中以产生姜黄素胶束[A.iv]。旋转蒸发[B.i]和剩余薄膜[B.ii]的摄影图像。
图3显示了姜黄素在胶束制剂中的增溶作用。
2mg/mL姜黄素在蒸馏水(A.i)中的溶解度非常差,形成沉淀,然后使用0.22μm的孔膜在过滤(B.i)上除去,以留下水(A.ii)。2mg/mL姜黄素负载胶束(A.iii)的溶液已通过0.22μm孔膜滤器(B.ii),显示出良好的姜黄素保留能力。
图4显示了姜黄素稳定性评估,可测量不同环境中的包封效率。
[A]25℃和4℃样品之间的比较。从3周开始,与基线相比,4℃样品的EE下降。[B]25℃和冻干(25℃)样品的比较。在所有时间点,冻干样品的EE均显著下降。数据用SEM表示为平均值。使用双向方差分析(ANOVA)与Bonferroni事后分析进行数据分析,***p<0.001。
图5显示了姜黄素制剂随时间变化的Z直径和PDI。
[A]随时间变化的胶束大小(z直径)保持均匀,未见显著变化。[B]胶束的扩散(PDI)随时间增加,但这种变化并不明显。数据用SEM表示为平均值。使用双向方差分析(ANOVA)和Bonferroni事后分析对数据进行分析。
图6显示了两周时间内白藜芦醇制剂(配置B)的变色。
图[A]至[E]对应于时间点0、7、8、9和14天。初始制剂[A]澄清,没有任何沉积物形成;将该制剂在室温下在干燥,黑暗的环境中保持两周。在一周内[B],观察到变色,且制剂继续变黑。到两周[E]时,制剂最暗,但没有沉淀物形成。
图7显示了储存在不同环境中超过9天的白藜芦醇制剂(配置C)。
图[A]至[E]对应于时间点0、2、3、8和9天,其中[i]制剂保持在室温(25℃),[ii]制剂保持在4℃。在此期间,将制剂保持在干燥和黑暗的环境中。在25℃和4℃的情况下,在9天的时间内未观察到脱色或沉淀。
图8显示了在不同环境中测量包封效率的白藜芦醇稳定性评估。[A]25℃和4℃样品之间的比较[B]25℃和冻干(25℃)样品之间的比较。与每个时间点的基线相比,所有样品均显示出显著差异。[B]还表明两个样本在6周和9周的时间点之间存在显著差异。数据用SEM表示为平均值。数据采用双向方差分析(ANOVA)和Bonferroni事后分析进行分析,*p<0.05,**p<0.01。
图9显示了白藜芦醇制剂随时间的Z直径和PDI。
[A]随时间变化的胶束大小(z直径)保持均匀,未见明显变化。[B]胶束的扩散(PDI)保持均匀,未见显著变化。数据用SEM表示为平均值。数据采用双向方差分析(ANOVA)和Bonferroni事后分析进行分析。
图10显示了在百草枯引起氧化应激损伤之前,仅用50μM姜黄素胶束制剂或等效浓度的溶媒对初级RGC(鼠类)进行体外预处理。使用阿拉玛蓝(Alamarblue)测定法评估细胞活性。[A]剂量反应曲线;随着百草枯浓度的增加,细胞活性降低。姜黄素预处理的细胞的细胞活性显著增加。[B]姜黄素处理过的RGC中的IC50是媒介物处理过的RGC的两倍。
图11显示了整个视网膜的治疗组的RGC总体密度。
pONT--部分视神经横切;Curc--姜黄素;Resv--白藜芦醇。对照组的RGC密度显著高于治疗组。与仅pONT组相比,仅姜黄素和联合治疗组的RGC密度显著改善。数据用SEM表示为平均值。使用单向方差分析(ANOVA)和图基(Tukey)事后检验进行数据分析,*p<0.05,**p<0.01。
图12A显示了在眼部高血压模型(Morrison模型)中局部施用姜黄素胶束(CN)滴眼液(每天两次,共三周)相对于仅使用OHT的对照组显示出明显的神经保护作用。在该模型中,未配制的姜黄素(FC)对照对RGC群体没有明显的保护作用。该模型通常用作青光眼中视网膜神经节细胞变性的模型,但是越来越多地认识到神经变性的机制与其他中枢神经系统疾病(包括阿尔茨海默氏病、PD等)具有很强的相似性。RGC密度是根据Brn3a评估通过组织学确定的,如在文献Davis等,2016年中所述的。图12B显示姜黄素治疗对眼压没有影响,表明神经保护作用与眼压无关。
图13是纳米载体制剂中姜黄素含量的光谱测定。[A]姜黄素(1,7-双-(4-羟基-3-甲氧基苯基)-1,6-庚二烯-3,5-二酮)的酮基和烯醇式。[B]0.2μm过滤后的(左)PBS、(中)PBS中的姜黄素悬浮液4.5mg/mL,以去除不溶物质;在0.2μm过滤后的TPGS/Pluronic F127纳米颗粒中、(右)悬浮物去除不溶物质。[C]在DMSO中溶解时,22μM姜黄素具有435nm的吸收峰。[D]测定姜黄素在DMSO溶剂(58,547L·mol
图14是姜黄素负载纳米颗粒的表征和随时间的稳定性评估。[A]姜黄素负载的纳米颗粒(CN)用1%乙酸铀酰阴性染色的透射电子显微照片。比例尺=50nm。动态光散射显示出均匀的粒子群,其在[B]25℃下储存或在[25]冻干下在[C]下储存以及在25℃下储存以及在9周后重新悬浮时均没有显著变化。[D]在10mM HEPES、50mg/mL海藻糖缓冲液中的1mL冻干CN的照片,显示出良好的滤饼结构。稳定性研究说明了将CN储存在[E]25℃(溶液)与冻干和再水化后,包封效率随时间的变化。分别记录平均粒径[F]和分散指数[G]。平均值±95%CI。
图15是载有姜黄素的纳米载体制剂的X射线衍射和FT-IR表征。[A]天真(naive)姜黄素(蓝色)、空纳米载体(黑色)和姜黄素纳米载体(红色)的X射线衍射图。[B](1)海藻糖、(2)载有姜黄素的纳米颗粒、(3)游离姜黄素和(4)空纳米颗粒的傅立叶变换红外吸收光谱仪(FTIR)分析。
图16是姜黄素的体外释放。在37℃下从PBS中的[A]95%乙醇溶液或[B]载有姜黄素的纳米载体中体外释放4.5mg/mL姜黄素(平均值±SE,n=3)。由于姜黄素在水性缓冲液中的溶解性较差,姜黄素从乙醇溶液中的释放受到0.5h时间点形成可见沉淀的限制。在使用纳米载体姜黄素的实验中未观察到这种聚集。
图17是姜黄素纳米颗粒治疗对永生化视网膜细胞中的低氧模拟氯化钴具有神经保护作用。使用阿拉玛蓝(Alamarblue)细胞活性测定法,将R28细胞与不同浓度的CNs共同孵育可显著保护细胞免受[A,B]谷氨酸或[C,D]氯化钴诱导的损伤(单向方差分析(ANOVA)与图基(Tukey)事后检验,***p<0.001)。发现含有TPGS的空纳米颗粒对谷氨酸诱导的毒性具有神经保护作用[B],而对氯化钴[D]则没有毒性。
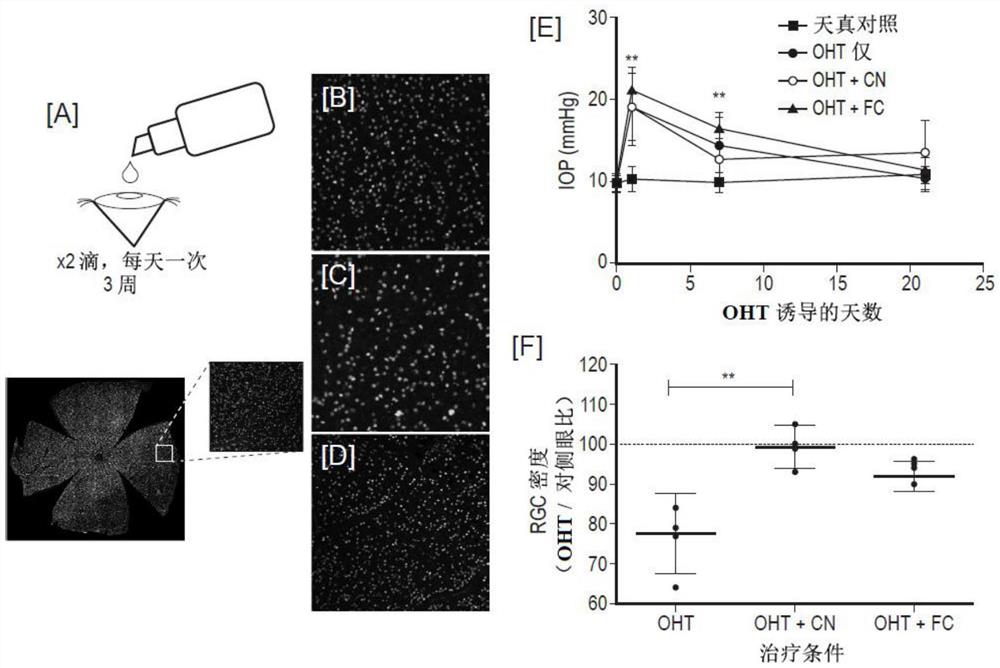
图18是局部姜黄素纳米颗粒在体内保护RGC体免受OHT诱导的细胞损失。[A]体内实验设计示意图。从高眼压诱导前两天开始,将OHT大鼠随机分为两组,即不接受任何治疗或每天一次姜黄素纳米颗粒(CN)或游离姜黄素(FC)眼药水。手术后三周,处死动物并平铺视网膜,然后用Brn3a标记。如前所述对RGC群体进行计数。[B]天真对照(naive control),[C]未治疗的OHT和[D]OHT+CN动物显示了视网膜上类似Brn3a标记区域的代表性视网膜图像。[E]直到手术后21天,所有OHT动物的IOP均较基线水平显著提高(学生T检验对比对侧眼睛,**p<0.01)。在任何时候,OHT治疗组之间的IOP均无显著差异,表明观察到的任何神经保护活性均与IOP无关。[F]与以前的研究一致,仅OHT眼中的IOP升高与RGC密度显著降低(约23%)有关;CN,但未进行FC治疗,可显著降低RGC损失(Kunskal-Wallis检验和Dunns post检验,**p<0.01)。
图19是局部姜黄素纳米颗粒可保护RGC体免受视神经损伤。每天局部CN治疗21天后,从[A]幼稚视网膜[B]pONT视网膜和[C]pONT模型视网膜的类似区域取具有代表性的Brn3a标记的视网膜上段。[D]整个视网膜RGC密度的测量结果表明,尽管pONT导致RGC密度显著降低,但通过每天施用CN可以减少这一降低(单向方差分析(ANOVA)与图基(Tukey)事后检验,**p<0.01和***p<0.0001)。[E]使用先前描述的方法将每个视网膜进一步分为上,下象限(Davis等人,2016年,表明局部CN可以防止上,下视网膜中的一些RGC密度损失(采用双向方差分析(ANOVA)和图基(Tukey)事后检验,***p<0.001)。
图20显示了使用酰基高丝氨酸衍生物3-HO-C
图21显示[A]过滤后负载3-OH-C
图22证明了酰基高丝氨酸内酯(3-OH-C
图23显示,将含有3-OH-C
图24显示,使用体外HETCAM测试[A]和体内Drazie测试[B]在0.3mM(F1)和0.6mM(F2)的浓度下,含有AHL的制剂(3-OH-C
图25显示了包封在由25mg/mL TPGS和150mg/mL solutol形成的胶束中的4.5mg/mL姜黄素制剂的稳定性评估结果,测量了包封效率(A)、粒径(B)和多分散指数(PDI)(C)。
图26显示了冷冻干燥和随后再水化后图25的制剂的包封效率(A)、粒径(B)和多分散指数(PDI)(C)的稳定性评估的结果。
图27显示了与单独的赋形剂相比,经鼻内施用姜黄素胶束(B,C)降低了3xTg-AD小鼠模型的视网膜中的DARC计数。
图28显示了与单独的赋形剂相比,经鼻内施用姜黄素胶束(B,C)可防止3xTg-AD小鼠模型中的视网膜神经节细胞(RGC)丢失。
图29显示了与单独的赋形剂相比,经鼻内施用姜黄素胶束(B,C)减少了3xTg-AD小鼠海马中的淀粉样蛋白β沉积。
图30显示了包封在由25mg/mL TPGS和150mg/mL solutol形成的胶束中的15mg/mL白藜芦醇制剂的稳定性评估结果,测量了包封效率(A)、粒径(B)和多分散指数(PDI)(C)。
图31显示了冷冻干燥和随后的再水化之后图30的制剂的包封效率(A)、粒度(B)和多分散指数(PDI)(C)的稳定性评估的结果。
图32:白藜芦醇纳米颗粒治疗对永生化视网膜细胞中的谷氨酸兴奋性毒性具有神经保护作用。使用阿拉玛蓝(Alamarblue)细胞生存力测定法,R28细胞与RNs共同孵育可显著保护细胞免受谷氨酸诱导的损伤(A)(单向方差分析(ANOVA)和图基(Tukey)事后检验,***p<0.001)。谷氨酸毒性(B)。发现含有TPGS的空纳米颗粒对谷氨酸诱导的毒性具有神经保护作用(A,C)。RN的保护作用(A,D)。
图33:白藜芦醇纳米颗粒对永生化视网膜细胞中氯化钴诱导的缺氧没有神经保护作用(A)。对照(B),空纳米颗粒(C)和RN(D)。
图34显示了与单独的媒介物相比,经鼻内施用白藜芦醇胶束降低了3xTg-AD小鼠模型的视网膜中的DARC计数。
图35显示了与单独的赋形剂相比,经鼻内施用白藜芦醇胶束(B,C)减少了3xTg-AD小鼠海马中的淀粉样蛋白β沉积。
具体实施方式
实施例1
已经制备了包含TPGS和Lutrol F127以及最多5mg/mL姜黄素或白藜芦醇的胶束并进行了稳定性测试。还使用PEG-胆固醇和Lutrol F127制备了胶束。如图1所示,用光谱法测定制剂中姜黄素的浓度。这使我们不仅能够确定每种制剂中姜黄素的浓度,而且能够确定相对于完整药物而言,水解姜黄素(治疗上无用)的活性药物的量(在治疗上无用)实际上在435nm处没有吸收。(用氢氧化钠处理后姜黄素被强制降解(图1D,红线))。
制造方法
姜黄素胶束通过薄膜水化法形成(见图2)。首先通过超声处理将姜黄素、P127和TPGS溶于无水乙醇(Fisher Scientific公司,英国)中以形成储备溶液。将它们以所需的摩尔比(表1)加入到圆底烧瓶中并涡旋混合。使用真空辅助旋转蒸发仪(旋转蒸发仪R-210/真空控制器V-850,瑞士布奇)在50mbar真空和所需温度(表1)下蒸发乙醇溶剂,直到剩下干燥的溶解物质薄膜。将干膜在高温下在旋转蒸发仪(1巴)上重悬于各种水性缓冲溶液中。通过0.22μm过滤器(33mm Millex过滤器,默克密理博公司,美国)过滤,将所得的胶束与未包封的(不溶性)姜黄素分离。然后通过测定姜黄素的包封效率,粒度和随时间的稳定性来表征所得的胶束制剂。包括补液缓冲液;蒸馏水、磷酸盐缓冲液(PBS)和含有缓冲液的Tris(20mM)海藻糖(50mg/mL)。对于局部滴注,优选中性pH,因此在PBS缓冲液中研究了药物稳定性。
表1:单个制剂的方案和组成细节
本研究中产生的制剂的描述。dH2O(蒸馏水);PBS(磷酸盐缓冲液);乙醇(乙醇);姜黄素(姜黄素);TPGS(D-α-生育酚聚乙二醇1000琥珀酸酯);P127(Pluronic F-127)。
如图3所示,通过过滤除去未包封的姜黄素。
表2:表征和稳定性结果(姜黄素胶束)
表3:冷冻干燥:三步程序
冷冻干燥方案包括三个阶段。1°(初次),2°(再次);h(小时)。
表4:冷冻干燥和再水化的长期稳定性(在PBS中的初级结果)
低温保护剂随后以10mg/mL替换为100mg/mL海藻糖(含10mM HEPES,pH 7.4),显示出更好的稳定性,如以下制剂所示。
姜黄素胶束的稳定性在室温下以及在海藻糖冷冻保护剂(10mg/mL至100mg/mL海藻糖)存在下冷冻干燥后均良好。在pH 4.5和pH 7.4下制备胶束。参见图4和图5。
白藜芦醇胶束制剂(后来与姜黄素胶束在体内共同施用)使用相同的胶束制剂表现出良好的稳定性(见表5)。
表5:在研究中产生的初始制剂的配置:#——制剂配置代码;PBS——磷酸盐缓冲盐水;海藻糖——Hepes-Thalhalose(50mg/mL);TPGS——D-α-生育酚聚乙二醇100琥珀酸酯;P127——Pluronic F-127;Res——白藜芦醇。
表6:不同起始浓度药物产生的包封的白藜芦醇的量
优选的缓冲液组合物含有海藻糖(10mg/mL至100mg/mL),因为与PBS相比,该抗氧化剂可防止产品随时间推移而降解,从而导致产品逐渐变色(请参见图6和图7)。
样品显示长达10周的良好稳定性(请参见图8和图9)。
发现姜黄素胶束制剂在体外具有显著的神经保护作用(参见图10)。
在视神经病变(部分视神经横断)大鼠模型中,发现局部姜黄素胶束滴眼液(一天两次,连续三周)和姜黄素/白藜芦醇胶束联合疗法(每天两滴)对神经性视神经病变(部分视神经横断)模型具有显著的神经保护作用(图11)。该神经退行性模型主要用于评估针对视网膜疾病的治疗功效,但由于视网膜和大脑之间的生成过程相似,因此可用于告知其他CNS疾病的治疗潜力。这些结果表明,使用我们的胶束制剂,PPAR-g活性调节剂姜黄素和抗氧化剂白藜芦醇具有协同作用。
姜黄素治疗对IOP没有影响,表明神经保护作用与IOP无关(见图12)。
实施例2
方法与材料
姜黄素负载纳米载体的制备
姜黄素、D-α-生育酚聚乙二醇1000琥珀酸酯(TPGS)和Pluronic F127是从Sigma-Aldrich(英国肯特)获得的最高纯度。姜黄素负载的纳米载体(CN)是使用先前描述的薄膜水化技术的改编制备的(Davis等,2014年)。将姜黄素、TPGS和Pluronic F127分别溶解在乙醇中,浓度分别为5mg/mL、10mg/mL和20mg/mL;用10分钟的温和加热和超声波浴达到清晰。将溶液以所需摩尔比(分别为22.55mM TPGS、12.22mM姜黄素和7.94mM Pluronic F127)等分到圆底烧瓶中,充分混合。使用带有V850真空控制器(瑞士布奇)的旋转蒸发仪R210,通过旋转蒸发(50mBar,65℃,2h)除去溶剂,同时避光。此后,将薄膜在所需的缓冲液(蒸馏水,磷酸盐缓冲盐水(pH 7.4)或HEPES海藻糖缓冲液(10mM HEPES,50mg/mL海藻糖,pH 7.4)中再水化(50℃,0.5h))。然后通过0.22μm过滤(33mm Millex过滤器,Merck Millipore公司,美国)从制剂中除去未包封的姜黄素,如图13B所示。根据与上述相同的方案制备游离姜黄素(FC),添加TPGS或Pluronic F127。
姜黄素负载纳米载体的冻干
CN制剂在HEPES海藻糖缓冲液中的冻干是通过先在760托下在-60℃下冷冻2小时,然后在25℃下在7mL螺旋颈蹲式玻璃小瓶(CamLab,英国剑桥)中平衡1mL纳米载体的等分试样来实现的。样品的初次干燥在-38℃和200mTorr下完成24h,然后在25℃和200mTorr进行二次干燥2h。停止二次干燥后,立即将样品盖好,然后保存在25℃,同时避光直到需要。为了进行稳定性评估,通过在温和混合下添加1mL 0.22μm过滤过的蒸馏水,将样品再水化30分钟。
使用热重分析(TGA)测定制剂的水分含量。将冷冻干燥的样品置于铝盘中,并通过Discovery TGA(TA仪器公司,美国)进行分析。用25mL/min的氮气流量吹扫样品,并以10℃/min的速率从30加热到200℃。通过TA Instruments Trios软件在120℃下针对水含量计算质量损失百分比。对于每个样品,测量三种冷冻干燥制剂三次。
姜黄素加载效率
用光谱法测定CN的负载效率,并用HPLC证实结果。姜黄素负载量的光谱测定是通过在435nm的DMSO 1:500中稀释以归一化为空纳米载体而实现的。然后使用姜黄素的摩尔消光系数(图13)确定姜黄素在每种制剂中的浓度,该摩尔消光系数是通过构建测量已知姜黄素浓度的吸光度的标准曲线确定的。使用公式1计算每种制剂的包封效率:
其中,[C]
动态光散射
使用Malvern Zetasizer确定粒度。对于每种实验条件或制造后的时间点,至少从三种制剂中记录了粒径和多分散指数的测量值。在记录之前,将纳米载体在适当的缓冲液中以十分之一的比例稀释。
透射电子显微镜
使用碳网格处理纳米载体悬浮液,以从悬浮液中吸收颗粒,然后用1%乙酸铀酰染色1分钟并干燥。使用在100kV下操作的Joel-1010过渡电子显微镜观察样品,并使用GatanOrius数码相机获取图像。
X射线衍射和FT-IR
从X射线衍射仪(Rigaku MiniFlex 600)制备单独的药物,空的纳米颗粒或CN的X射线衍射图,将2-θ角设定为5°至65°,角度增量为0.05°/秒。在40kV和15mA的电压下进行测量。使用PerkinElmer Spectrum 100FT-IR光谱仪以4cm
姜黄素释放测定
体外姜黄素的释放是通过改编先前描述的方案来评估的(Wang等,2012年)。简言之,将游离姜黄素(溶于95%乙醇)或含有4.5mg/mL姜黄素的CN装入分子量截断值为3.5-5kDa的1mL Spectra-Por Float-A-Lyzer透析盒(Sigma-Aldrich)中。以200mL含10%Tween-80的PBS对样品进行透析,在保持37℃水槽且以50rpm搅拌以释放姜黄素。在指定的时间点,从混合物中取出样品,并用新鲜的缓冲液代替。如上所述测定姜黄素的浓度。来自三个实验重复的结果适合单相关联(方程式2)。
Y=Y
其中,Y
细胞培养
R28细胞系(Kerafast公司,美国马萨诸塞州波士顿)在补充了5%胎牛血清(Invitrogen公司,英国)、100U/ml青霉素、100μg/ml链霉素和0.292mg/mL的谷氨酰胺(Gibco公司,英国)、7.5%无菌dH
细胞活性评估
将R28细胞以4,000个细胞/孔的密度在96孔板中接种24小时,然后用不同浓度的姜黄素(0至20μM)或同等浓度的TPGS/Pluronic F127仅纳米载体(载体对照)结合不同浓度的氯化钴或谷氨酸进行损伤处理又持续了24小时。根据制造商的说明,使用阿拉玛蓝(Alamarblue)(英国Invitrogen公司)分析法评估每种情况下的细胞活性。简言之,将阿拉玛蓝溶液添加到每个孔板上,并孵育4小时,然后使用Safire平板读数器记录530nm激发和590nm发射的荧光91。
动物
所有动物实验均按照英国内政部批准的程序进行,并符合《ARVO眼科和视觉研究中动物的使用声明》。为了进行体内实验评估:将总共48只体重150至200g的成年雄性DarkAgouti(DA)大鼠(Harhar实验室公司,英国)放在21℃的空调环境中,进行12小时的明暗循环(140-260lux),可随意提供食物和水。
13只动物作为天真对照(naive control),在免疫组织化学之前未作进一步干预。
高眼压(OHT)模型
如前所述(Morrison等,1997年),在18只DA大鼠(仅5只OHT,5只OHT+CN,8只OHT+FC)的左眼中手术诱发了高眼压。在全麻醉下使用腹膜内给药的2mL/kg的37.5%氯胺酮(辉瑞动物健康公司,美国宾夕法尼亚州埃克斯顿)和25%Dormitol(辉瑞动物健康公司,美国宾夕法尼亚州埃克斯顿)和37.5%无菌水的混合物进行全身麻醉。简言之,使用注射泵(50μL/min;UMP2;World Precision Instruments,美国佛罗里达州萨拉索塔)将50μL高渗盐溶液(1.8M)注射到两条巩膜静脉中。将一个从圆周上切开1毫米间隙的丙烯环放在赤道周围,以防止注入的盐水从其他含水静脉中流出。使用TonoLab眼压计(Tiolat Oy,芬兰赫尔辛基)在吸入麻醉下(氧气中0.4%异氟烷)定期测量每只大鼠两只眼睛的IOP。在模型诱导前两天开始,每天在5只DA大鼠中进行局部CN的给药(每天两次,每天上午10点,每只5分钟,每天两次,每滴35μL,每天两次),直到模型终止(IOP升高后21天)为止,其中有5只大鼠作为OHT仅控件。另外8只大鼠接受使用与CN姜黄素相同的方案制备的游离姜黄素(FC),但不添加TPGS或Pluronic F127。使用与CN所述相同的给药方案,将FC施用给OHT动物。在单侧眼压升高三周后处死动物,并在Brn3a免疫组织化学之前将视网膜平置。
部分视神经横断(PONT)模型
使用先前描述的技术(Levokovitch-Verbin等人,2003年)在17只DA大鼠的左眼进行部分视神经横切。全身麻醉下,在结膜上切开切口,露出ON鞘。接下来在硬脑膜上形成一个纵向缝以暴露ON,并使用带钢质切割防护装置的眼科手术刀在眼后2mm的背ON切开一个0.2mm的切口。避免了对主要眼科血管的损害,并在完成眼底镜检查后证实了这一点。诱导pONT模型后,每天用9只DA大鼠进行每日局部CN给药,使用与先前所述相同的治疗方案,其余8只DA大鼠作为pONT对照。
Brn-3a免疫组化和共聚焦显微镜
如前所述(Davis等,2016年),完成了视网膜全壁样RGC的Brn-3a标记。简言之,在实验时将眼睛摘除,并在4℃的4%多聚甲醛中固定过夜,然后解剖视网膜整个支架。使用抗小鼠单克隆抗体(1:500,Merck Millipore公司,德国达姆施塔特)对整个支架进行RGC特异性核定位转录因子Brn3a染色,并在共聚焦显微镜下检查(LSM 710,Carl ZeissMicroImaging GmbH,德国耶拿)。整个固定的每个视网膜在×10放大倍率下成像为平铺的z堆叠,用于在每个视网膜中生成RGC层的单个平面最大投影,以进行后续分析。使用视网膜脉管系统的体内cSLO成像作为参考,手动定位每个整个固定图像,以使上视网膜朝向图像顶部。视网膜成像采集设置对于所有成像的视网膜保持恒定,从而可以如前所述比较每个实验组中Brn3a的表达。94如前所述完成了视网膜全标本中Brn3a标记的RGC的自动定量分析(Davis等,2016年)。
统计分析
所有数据均通过学生t检验、方差分析(ANOVA)或使用GraphPad Prism5(GraphPad软件公司,La Jolla,美国加州)进行适当的事后测试进行了分析。数据以均值±SE表示,p<0.05被认为是显著的。使用ACD/ChemSketch 2015绘制分子结构,所有图像均由作者(BMD)拍摄。
结果与讨论
光谱法可用于评估姜黄素的包封效率和氧化态
在二甲基亚砜(DMSO)中稀释时,姜黄素在435nm处有一个吸收峰(图13C),摩尔消光系数(图13D和E)为58547L·mol
纳米载体中姜黄素浓度的光谱测定也可用于指示姜黄素降解的程度。姜黄素进行酮-烯醇互变异构化(图13A),在酸性或中性条件下以更稳定的酮形式存在,在碱性条件下以水溶性更强的烯醇形式存在。与经历酮-烯醇互变异构的其他分子相同,姜黄素的烯醇形式更易于水解降解。与配制的姜黄素相比,通过溶解在碱性缓冲液中加速姜黄素降解过程,导致在435nm处姜黄素摩尔消光系数大大降低(图13C-D,在室温下在1M氢氧化钠溶液中孵育72h后为2133L·mol
TPGS/Pluronic F127纳米载体可增强姜黄素的溶解度和稳定性
最初,通过将姜黄素负载的纳米载体掺入TPGS纳米载体中来制备。选择TPGS是因为该赋形剂的临界胶束浓度低(0.02%w/w),α-生育酚组分的内源性和抗氧化性能以及P-糖蛋白拮抗作用,从而增强了含有该试剂的制剂的屏障穿透能力。TPGS存在于现有的眼科制剂中,姜黄素和TPGS均可轻松溶解在乙醇中,乙醇在市售眼药水制剂中的浓度为0.8%(例如,用于干眼的Optrex ActiMist2合1眼用喷雾剂),从而降低了风险与制造过程中残留的溶剂有关。此外,由于使用TPGS增强口服药物的生物利用度已得到充分证明。结合最近对使用Pluronic F127食品研究应用的兴趣,可能表明本发明所述的新型姜黄素制剂也可能适合口服。
通过动态光散射测定,发现具有TPGS胶束的姜黄素制剂可产生直径为16nm的纳米载体(数据未示出)。不幸的是,这些制剂在25℃时迅速聚集,导致在重新悬浮数小时内形成沉淀物,这可能表明奥斯特瓦尔德(Ostwald)熟化过程。姜黄素负载的TPGS纳米载体的稳定化是通过添加聚合物稳定剂Pluronic F127(聚氧乙烯和聚氧丙烯的三嵌段共聚物)来实现的,该聚合物以前已用于空间稳定纳米载体以防止聚集。
根据所述方法制备了载有姜黄素的纳米载体(CN),并确定了包封效率和平均粒径(图14)。将其重悬于PBS(pH 7.4)或HEPES海藻糖缓冲液(pH 7.4)中时,发现纳米载体分别包封了96.0%±2.0%(4.32mg/mL)和94.2%±4.1%(4.31mg/mL)的姜黄素。透射电子显微镜显示,纳米载体的直径通常为20nm,尺寸均匀(图14A)。通过动态光散射(图14B-C)证实了这些结果,该动态光散射确定了z平均直径在16至20nm之间的均匀颗粒分散体,暗示了胶束制剂。
在25℃下储存并避光的条件下,评估CN制剂的包封效率和粒径。发现该CN制剂在25℃下可保持9周的优异稳定性,并且在这段时间内没有降低EE%(图14E),粒径(图14F)或分散度(图14G)显著变化。使用在相同缓冲液中制备的冻干CN重复此稳定性研究,然后在25℃储存并避光保存。在120℃下计算出的残留水含量为1.085±0.050%,表明已正确制备了冻干制剂。在记录分散性能(图14E-G)之前将制剂重新悬浮,发现该分散特性保持恒定并与液体制剂报道的那些数据相似(表7)。发现在每个评估的时间点,EE%与基线相比平均下降20%,这表明这可能是冻干或补液过程的结果。
先前有几组尝试制备负载姜黄素的纳米颗粒制剂,包括:PLGA纳米载体、固体脂质纳米载体、脂质体和外泌体。现有的姜黄素纳米颗粒制剂具有有限的稳定性(在任何引用的研究中均未评估超过72小时),仅达到了中等姜黄素上样量(<0.77mg/mL),并且由于复杂、多因素,多数方案难以转化为临床,需要有机溶剂的分步生产方案。本文所述的TPGS/Pluronic F127姜黄素制剂与现有文献相比具有优势。
表7:姜黄素负载的纳米载体的特性和随时间的稳定性(n=3)。
一旦结合到纳米载体中,就获得了XRD和FT-IR光谱以确定姜黄素的性质(图15)。游离姜黄素的X射线衍射图在5°至30°之间显示出特征峰,表明其为高度结晶的结构。在将姜黄素包含在纳米载体制剂中时,该特性消失了,这表明姜黄素已成功地掺入了无定形纳米载体结构中,并且与颗粒表面无关。FT-IR光谱显示游离姜黄素在3509cm
与游离药物相比,在37℃下将姜黄素配制成纳米载体的方法大大降低了药物释放的速度(t
载有姜黄素的纳米载体可保护视网膜细胞免受谷氨酸和缺氧引起的损伤
谷氨酸兴奋性毒性代表导致青光眼RGC丧失的潜在机制。使用阿拉玛蓝(AlamarBlue)细胞活性测定法,发现永生化的R28细胞与CN和空的纳米颗粒共同孵育对谷氨酸诱导的毒性具有明显的保护作用(单向方差分析(ANOVA)和图基(Tukey)事后检验,p<0.001)(图17A和B,IC
缺氧相关因子如缺氧诱导因子1α(HIF-1α)的上调已被暗示与青光眼病理学中的缺氧有关。氯化钴(CoCl
姜黄素纳米载体局部给药疗法可在高眼压和视神经损伤的啮齿动物模型中保护RGC
已经建立了相对于仅用媒介物治疗的CN的体外神经保护活性,我们接下来使用已建立的体内RGC损失的啮齿动物模型评估了该制剂对RGC健康的神经保护作用。我们预计局部应用姜黄素负载的纳米颗粒将通过局部和全身吸收途径的组合到达视网膜。为支持这一假设,Sigurdsson等人报告说,他们的地塞米松制剂与姜黄素具有相似的分子量(分别为392和368Da),通过局部渗透进入视网膜的比例为60%,通过全身吸收途径进入视网膜的比例为40%。我们预期,充分记录的生育酚和姜黄素的P-gp抑制活性,以及先前报道的针对PEG化胶束制剂的增强的角膜渗透活性,将通过局部吸收途径增强姜黄素向视网膜的递送。
基于我们先前描述OHT和pONT模型自然历史的工作,选择了模型诱导后的最佳时间点(诱导后最短时间内最大RGC损失),其中模型诱导后评估了多个时间点。我们最近报道,含有胶束的TPGS本身在体内并不具有神经保护作用,这与我们的体外观察相结合,表明观察到的任何神经保护功效都是姜黄素治疗的结果。根据图18A所示的给药方案,大鼠接受局部CN。简言之,在OHT模型引入前两天,啮齿类动物开始接受两滴(每组35μL)CN,它们从模型引入之日起连续三周每天间隔五分钟给药。发现CN的局部给药对大鼠具有良好的耐受性,在合格的眼科医生监测的幼稚眼中未发现眼刺激或炎症迹象。通过将高渗盐水注射到两条巩膜静脉中,将啮齿动物的IOP升高,IOP曲线(图18B)表明,与天真对照的眼睛相比,在模型诱导后,IOP至少持续7天仍显著升高。仅在CN和OHT组之间未观察到IOP分布的显著差异,表明姜黄素的任何神经保护作用均归因于IOP独立过程。使用Brn3a评估从整个视网膜支架组织学评估RGC健康(图18C)。之所以选择这种方法,是因为Brn3a是一种核限制性和RGC特异性转录因子,仅标记了97%的RGC群体(不包括光敏性RGC)。我们最近还开发了一种算法,可以在视网膜病变的啮齿动物模型中准确、自动地量化整个RGC群体,从而能够可靠地评估RGC的健康状况。使用这种方法,与对侧眼睛相比,发现OHT诱导导致整体RGC密度显著降低了约23%,这与以前使用该模型的研究相当。CN给药显著改善了OHT眼与未对侧未治疗眼之间的RGC密度比(Kruskal-Wallis试验和Dunns事后检验,**p<0.01),而未包囊于PBS中的未包囊姜黄素(不含FC的姜黄素)的给药具有此效果(图18D-F)。
为了进一步研究局部应用CN的神经保护潜力,在pONT模型中对全视网膜Brn3a标记的RGC群体进行了评估(图19A)。在该模型中,发现每天两次CN的局部给药可显著保护RGC(单向方差分析(ANOVA),***p<0.001)。在将整个视网膜坐骨细分为上象限和下象限时(图19B),观察到用CN处理可以在上象限和下象限中保留RGC群体,但是这种作用在视网膜上象限中更为明显(双向方差分析(ANOVA)),***p<0.001),可能暗示姜黄素治疗通过抗凋亡和抗氧化机制发挥保护作用。来自Brn3a标记的视网膜整个壁的上象限的代表区域(图19C-E)说明,与单纯的对照组(图19C)相比,视网膜受试者pONT(图19D)中的RGC群体有所减少。发现用CN处理三周可保护RGC体免于pONT诱导的损伤(图19E)。由于在视网膜的上象限和下象限都观察到RGC体的保存,这表明姜黄素可能通过涉及原发性和继发性神经退行性过程的多种途径引发神经保护活性。
TPGS介导的通过抑制谷氨酸兴奋性毒性而介导的神经保护的可能性令人着迷,并且可能有助于我们制剂在体内的神经保护作用。为支持该假设和我们目前的体外研究结果,Nucci等人先前曾报道眼内施用总量为10μL的0.5%(w/v)TPGS(相当于0.5mg TPGS的总剂量)对缺血具有神经保护作用/大鼠再灌注损伤。以前,我们报道了以相同浓度局部施用TPGS在体内没有神经保护作用。与侵入性应用相比,这种差异可能是到达视网膜的浓度较低,通常估计为局部应用剂量的约3%。尽管我们先前使用该模型的工作表明仅施用TPGS似乎没有其自身的神经保护作用,但姜黄素和TPGS之间的协同作用极有可能,如果不是仅通过TPGS的神经保护作用,则可能是通过TPGS介导的P-gp活性调节,增强姜黄素跨眼屏障的转运。
在本研究中观察到的加载姜黄素的纳米载体的神经保护作用可能是模型诱导前两天开始的治疗结果,这表明该疗法对于有IPO高峰风险的患者(如超声乳化手术后或预防性确定的患者)、患有青光眼的高风险(例如患有高眼压或其他青光眼的危险因素)的患者最有效。此外,随着新技术的发展,例如具有在疾病过程早期诊断青光眼的潜力的DARC(检测凋亡性视网膜细胞)(Cordeiro等,2017年),可在疾病发展的早期阶段减缓或预防RGC丢失,该疗法在青光眼的治疗中将发挥更大的作用。
总之,这项研究描述了在TPGS/Pluronic F127中姜黄素的新型纳米载体制剂,该制剂将这种难溶性药物的溶解度提高了近40万。该制剂掺入了4.3mg/mL姜黄素,其包封率始终>90%,并且在液体或冻干形式下在室温下保存至少两个月具有出色的稳定性(通过HPLC和光谱技术测定)。发现该制剂在体外对视网膜培养物中的谷氨酸和氯化钴诱导的损伤具有神经保护作用,并且在两个良好建立的眼损伤啮齿动物模型中显著保留了RGC密度。总之,我们证明了载有姜黄素的纳米颗粒具有克服眼屏障的令人兴奋的潜力,并可能促进基于姜黄素的疗法向临床治疗诸如青光眼等眼病的翻译。
实施例3:酰基高丝氨酸内酯(AHSL)是药物递送的增强剂
转到图20至图23,这些结果证明了在根据以上定义的本发明的另一方面的组合物中,AHSL作为药物递送增强剂的安全性和有效性。结果表明,两种含结构无关的模型剂FITC-葡聚糖和FITC-Annexin V以及抗体(贝伐单抗)在含有AHSL的胶束中的跨上皮递送有增强。正如本领域技术人员所理解的,胶束(或其他三元配制系统)可以通过多种方法来制备。但是,可以涉及薄膜水化,也可以涉及将制剂成分在水性介质中进行简单混合并进行可选的加热。
示例性组合物的制备
更详细地,并且仅通过实施例的方式说明所述的组合物可以如下方法来制备(注意,在图21中报道了制剂1至3):
a.将100mg TPGS(或DSPE-PEG和胆固醇)和5mg/mL的3-OH-C12 HSL溶于5:1的氯仿:甲醇;
b.将所需量的TPSG(或DSPE-PEG和胆固醇)和3-OH-C12 HSL(通常分别为0.5%和0.1%w/v)等分,并通过旋转蒸发(65℃,50mBar持续1h)蒸发溶剂;
c.将滤饼在65℃下重悬于PBS缓冲液中30分钟,然后过滤(0.22μm)以除去未包囊的物质。
a.将TPGS粉末通过加热至65℃2h至最终浓度为0.5%(v/v)的方式直接溶于PBS缓冲液中,以生产TPGS胶束;
b.作为替代方案,通过在A中超声处理溶液来制备TPGS胶束;
c.将3-OH-C12 HSL在DMSO中溶解至10mg/mL的浓度,然后将0.1%(v/v)与TPGS胶束溶液混合1h;
d.通过0.22μm的过滤除去未包封的材料。
a.55mg/mL的5K壳聚糖是通过将110mg的5K壳聚糖溶于2mL的缓冲液(10mM HEPES,140mM氯化钠,pH 7.4)中并加热到37℃持续1h来制备的;
b.如上所述制备TPGS溶液(制剂1或制剂2);
c.将25mg的5K壳聚糖与2.75mg的上述溶液中的TPGS合并,并添加到0.1mg的3-OH-C12 HSL中,并在37℃孵育1h,同时进行短暂的超声处理以完全溶解;
d.过滤除去未包封的材料(0.22μm孔)。
1.通过溶解在5:1的氯仿:甲醇中,制备具有3.25mM QSSM的PC
PC
PS
胆固醇(50mg/mL):151μl
3-OH-C
2.在氩气下蒸发,然后在真空下蒸发1h,以产生干燥的脂质饼;
3.同时用1ml AnxV-776(13-03,0.475mg/mL)对10mM HEPES,140mM NaCl pH 6.5透析3h;
4.在1ml AnxV-776溶液中将脂质滤饼重新水化1小时,在37℃下温和混合(150rpm)孵育;
5.在液氮中冻融混合物5次;
6.依次使用400nm,200nm和最后100nm的孔过滤器挤出。
注意,在这些示例性组合物中,3-OH-C12 HSL可以被任意AHSL取代。
Transwell分析规程(部分基于Davis等人(2014年))
将HCE-S细胞(不固定的人角膜上皮细胞)单层培养在90%的DMEM中,其中添加了10%的热灭活的FBS和青霉素-链霉素(100U/mL)。将细胞在含5%CO
使用改编的先前描述的方法(Reichl,2008年)制备用于转胞吞测定的HCE-S屏障模型。将HCE-S细胞(5×10
图21和22。在将300μM 300 3-OH-C12 HSL加入胶束(假设载药量为100%)或仅以等效浓度的胶束(不含酚红的培养基中溶解2h)之前,记录了基线TER。在这段时间之后,记录TER,然后将培养基替换为新鲜的。向顶端室中加入模型药物分子(FITC-葡聚糖或阿瓦斯汀),并通过监测FITC荧光(FITC-葡聚糖)相对于已知浓度的标准曲线或使用市售的阿瓦斯汀夹心ELISA试剂盒,如前所述(Davis等,2014年)。将每个时间点的TER测量值相对于经媒介物处理的对照进行标准化,并清楚地证明了AHSL可逆性破坏生物屏障的能力,重要的是,该概念在药物输送应用中的用途。
图23。FITC ANXV(在这种情况下为模型蛋白药物)与载有AHSL的胶束共同施用3小时,以证明可以共同施用含AHSL的制剂以及进行预处理以增强具有治疗作用的药物的递送跨越生物屏障的潜力。结合图21和图22所述的规程。
尽管此处使用的HCE-S transwell模型是角膜上皮的模型,但酰基高丝氨酸内酯介导的可逆屏障破坏方法是通过与IQGAP1相互作用[Karlsson等]。因此,在其他生物屏障(即血脑\血液视网膜\肠和皮肤屏障)中也会观察到类似的效果。
迄今为止,酰基高丝氨酸内酯破坏生物屏障的能力仅集中于这些试剂(由细菌产生,而3-OH-C12 HSL是3-oxo-C12 HSL的合成类似物)使细菌能够侵入宿主组织的能力。这项工作首次展示了使用这些试剂促进治疗剂(包括大分子,如多糖和大蛋白)的递送(图25和图26),但是本领域技术人员应该理解的是,该概念也适用于小分子API跨越生物屏障。
实施例4:HET-CAM测试
材料和方法
为了研究体外的眼耐受性,按照INVITTOX no15方案(Warren等,1990年)中的描述开发了
该测试基于对10天胚胎蛋的绒毛膜尿囊膜(CAM)的刺激作用(出血、血管收缩和凝血)的观察,该刺激是通过在每种鸡蛋的前5分钟内分别加入0.3ml每种研究制剂而引起的应用。
在孵化的日子里,这些鸡蛋(来自西班牙塔拉戈纳的G.A.L.L.S.A农场)在控制温度(37.8℃)和湿度(50-60%)的恒温箱中放置之前,将其在12±1℃的温度下放置至少24h。
进行了一系列对照:SDS 1%(慢刺激的阳性对照),0.1N NaOH(快刺激的阳性对照),NaCl 0.9%(阴性对照)。
分析数据为在受伤发生时的时间的媒介±SD(n=3/组)。潜在的刺激性得分可分为四类(表8)。
表8:HET-CAM的计算和分类
结果
分析的制剂显示在体外无刺激性(表9)。有趣的是,在所有情况下,唯一出现的现象是轻微的血管收缩过程(图24)。在所有制剂中均不存在出血或凝血。
表9:制剂评估的结果
体内
材料与方法
使用Draize刺激试验评估体内眼耐受性。使用来自San Bernardo农场(Navarra)的中重2.5公斤的新西兰白化雄性兔进行。根据UB动物实验伦理委员会和现行法规(Decret214/97,Gencat)进行了此测试。
将样品放在左眼结膜囊中,并进行轻柔按摩以确保适当的循环(Nobrga等,2012年)。使用右眼作为阴性对照(n=3/组),在给药时和给药后1小时都观察到刺激性。
通过直接观察眼前段来进行评估,并注意结膜可能的损伤(发炎、化学反应、发红或渗血)、虹膜和角膜可能的损伤(不透明和受影响的表面)。根据观察到的损伤评估眼刺激指数(OII)(表10和11)。
表10:Draize测试计算和分类
表11:Draize测试评估得分。
结果
所有制剂均无刺激性(OII=0)。在施用时或一小时后,这些动物在体内没有任何刺激的迹象(图24)。这与产品显示无刺激性的体外评估结果相关。
实施例5
使用先前描述的薄膜水化技术,制备由25mg/mL TPGS和150mg/mL solutol形成的胶束中的4.5mg/mL姜黄素制剂。
该制剂在90天内表现出高的包封效率和稳定性(图25A-C)。当冷冻干燥并随后再水化时,包封效率仍然很高(65%),而粒度和多分散性也显示出在90天之内的稳定性(图26A-C)。
然后在阿尔茨海默氏病的3xTg-AD小鼠模型中测试该制剂,并每周5天经鼻内给药3个月。当与单独的赋形剂相比时,姜黄素纳米颗粒减少了视网膜中的DARC计数(关于DARC计数的更多细节,参见例如WO 2011/055121),表明细胞死亡减少了(图27A-C)。姜黄素纳米颗粒还保护视网膜神经节细胞(RGC)免受丢失(图28A-C)和减少海马中的淀粉样蛋白β沉积(图29A-C)。
实施例6
使用前述薄膜水化技术制备由25mg/mL TPGS和150mg/mL solutol形成的胶束中包封的15mg/mL白藜芦醇的制剂。
该制剂表现出高的包封效率(>70%)和在90天内的稳定性(图27A-C)。当冷冻干燥并随后再水化时,包封效率仍然很高,而粒径和多分散性也显示出在90天之内的稳定性(图28A-C)。
如上所述培养R28细胞,然后用白藜芦醇(20μm)处理,该白藜芦醇含有胶束或等价浓度的TPGS/仅溶剂酚(即空的)胶束,以及不同浓度的氯化钴或谷氨酸损伤。
观察到含有白藜芦醇的胶束对谷氨酸兴奋性毒性具有神经保护作用(图29A-D),但对氯化钴诱导的缺氧没有神经保护作用(图30A-D)。
然后在阿尔茨海默氏病的3xTg-AD小鼠模型中测试该制剂,并每周5天经鼻内给药3个月。与单独使用赋形剂相比,白藜芦醇纳米颗粒减少了视网膜中的DARC计数,表明细胞死亡减少(图31),海马淀粉样蛋白β沉积减少(图32A-C)。
参考文献
Becker U,Ehrhardt C,Daum N,Baldes C,Schaefer UF,Ruprecht KW,Kim KJ,Lehr CM(2007)Expression of ABC-transporters in human corneal tissue and thetransformed cell line,HCE-T.J Ocul Pharmacol Ther.23(2):172-81。
Biehlmaier O,Alam M,Schmidt WJ(2007)A rat model of Parkinsonism showsdepletion of dopamine in the retina.Neurochemistry international 50:189-195Doi10.1016/j.neuint.2006.08.001。
Bizrah M,Dakin SC,Guo L,Rahman F,Parnell M,Normando E,Nizari S,DavisB,Younis A,Cordeiro MF(2014)A semi-automated technique for labeling andcounting of apoptosing retinal cells.BMC bioinformatics 15:169Doi 10.1186/1471-2105-15-169。
Cooley MA,Whittall C,Rolph MS(2010)Pseudomonas signal molecule 3-oxo-C12-homoserine lactone interferes with binding of rosigliatzone to human PPARγ.Microbes and Infection 12 231-237。
Cordeiro MF,Guo L,Luong V,Harding G,Wang W,Jones HE,Moss SE,SillitoAM,Fitzke FW(2004)Real-time imaging of single nerve cell apoptosis in retinalneurodegeneration.Proc Natl Acad Sci U S A 101:13352-13356 Doi 10.1073/pnas.0405479101。
Cordeiro,M.F.et al.Real-time imaging of single neuronal cellapoptosis in patients with glaucoma.Brain 274,61–5(2017)。
Davis,B.M.,Richens,J.L.&O’Shea,P.Label-free critical micelleconcentration determination of bacterial quorum sensingmolecules.Biophys.J.101,245–54(2011)。Davis BM,Normando EM,Guo L,Turner LA,Nizari S,O'Shea P,Moss SE,Somavarapu S,Cordeiro MF(2014)Topical delivery ofAvastin to the posteriorsegment of the eye in vivo using annexin A5-associated liposomes.Small 10(8):1575-84。
Davis BM,Guo L,Brenton J,Langley L,Normando EM,Cordeiro MF(2016)Automatic quantitative analysis of experimental primary and secondary retinalneurodegeneration:implications for optic neuropathies.Cell Death Discovery 2,Article number 16031(2016)doi:10.1038/cddiscoery.2016.31。
Galvao J,Davis B,Tilley M,Normando E,Duchen MR,Cordeiro MF(2014)Unexpected low-dose toxicity of the universal solvent DMSO.FASEB Journal:official publication of the Federation of American Societies for ExperimentalBiology 28:1317-1330 Doi 10.1096/fj.13-235440。
Guddadarangavvanahally K.Jayaprakasha,Lingamullu Jagan Mohan Rao,and&Sakariah*,K.K.Improved HPLC Method for the Determination of Curcumin,Demethoxycurcumin,and Bisdemethoxycurcumin.(2002).doi:10.1021/JF025506A。GuoL,Salt TE,Luong V,Wood N,Cheung W,Maas A,Ferrari G,Russo-Marie F,Sillito AM,Cheetham ME et al(2007)Targeting amyloid-beta in glaucoma treatment.Proc NatlAcad Sci U S A 104:13444-13449 Doi 10.1073/pnas 0703707104。
Guo L,Normando EM,Nizari S,Lara D,Cordeiro MF(2010)Trackinglongitudinal retinal changes in experimental ocular hypertension using thecSLO and spectral domain-OCT.Investigative ophthalmology&visual science 51:6504-6513 Doi 10.1167/iovs.10-5551。
Jahoor A,Patel R,Bryan A,Do C,Frier J,Watters C,Wahli W,Li G,WilliamsSC,Rumbaugh KP(2008)Peroxisome Proliferator-Activated Receptors Mediate HostCell Proinflammatory Response to Pseudomonda aeruginosa Autoinducer.Journalof Bacteriology 13:4408-4415。
Karlsson T,Turkina M,Yakymenkko,Magnusson KE,Vikstrom E(2012)ThePseudomonas aeruginosa N-Acylhomoserine Lactone Quorum Sensing MoleculesTarget IQGAP1 and Modulate Epithelial Cell Migration PLoS Pathogens 8,e1002953。Levkovitch-Verbin,H.et al.A model to study differences betweenprimary and secondary degeneration of retinal ganglion cells in rats bypartial optic nerve transection.IOVS 44,3388–93.(2003)。
Mayer LD,Hope MJ,Cullis PR(1986)Vesicles of variable sizes producedby a rapid extrusion procedure.Biochim Biophys Acta 858:161-168。
Morrison,J.C.et al.A rat model of chronic pressure-induced opticnerve damage.Exp.Eye Res.64,85–96(1997)。
Nóbrega AM,Alves EN,Presgrave RF,Coste RN,Delgado IF.Determination ofeye Irritation Potential of Low-irritant Products:Comparison of invitro.Results with the in vivo Draize Rabbit Test.Brazilian Archives ofBiology and Technology.2012(55):381-388。
Normando EM,Davis BM,De Groef L,Nizari S,Turner LA,Ravindran N,Pahlitzsch M,Brenton J,Malaguamera,Guo L,Somavarapu S,Cordeiro MF(2016)ActaNeuropathologica Communications 4:86。
Nucci,C.et al.Retinal damage caused by high intraocular pressure--induced transient ischemia is prevented by coenzyme Q10 inrat.Int.Rev.Neurobiol.82,397–406(2007)。
Reichl S(2008)Cell culture models of the human cornea—a comparativeevaluation of their usefulness to determine ocular drug absorption in-vitro.J.Pharm.Pharmacol.60,299。
Sigurdsson,H.H.,Konráesdóttir,F.,Loftsson,T.&Stefánsson,E.Topical andsystemic absorption in delivery of dexamethasone to the anterior andposterior segments of the eye.Acta Ophthalmol.Scand.85,598–602(2007)。
M.Warren,K.Atkinson,S.Steer,INVITTOX:The ERGATT/FRAME data bank of invitro techniques in toxicology,Toxicol.Vitro 4(1990)707–710,http://dx.doi.org/10.1016/0887-2333(90)90148-M。
Wang,W.et al.Enhanced bioavailability and efficiency of curcumin forthe treatment of asthma by its formulation in solid lipid nanoparticles.Int.J.Nanomedicine 7,3667–77(2012)。
- 包含由石油疏松蜡和费-托蜡组成的蜡混合物的沥青组合物、蜡混合物在沥青组合物中的用途、沥青组合物在沥青混料组合物中的用途、包含沥青组合物的沥青混料组合物和其制造沥青混料路面的方法
- 集成导电聚合物粘合剂组合物、该粘合剂组合物的制备方法、包含该粘合剂组合物的储能装置、包含由该粘合剂组合物形成的感测部的传感器,及包含该粘合剂组合物作为活性成分的防腐涂料组合物
