一种抗猪肺炎支原体单克隆抗体的重链和轻链可变区及其应用
文献发布时间:2023-06-19 18:37:28
技术领域
本发明涉及猪支原体性肺炎检测技术领域,尤其是涉及一种抗猪肺炎支原体单克隆抗体的重链和轻链可变区及其应用。
背景技术
猪支原体性肺炎(Mycoplasma hyopneumoniae,MHP)是由猪肺炎支原体(M.hyopneumoniae)引发的一种慢性肺炎,又称猪地方流行性肺炎。该病属于二类传染病、寄生虫病,猪肺炎支原体作为该病的病原,最早是从患病猪的肺部组织中分离出的。该病通常与猪瘟、猪流感、猪繁殖与呼吸综合征及猪圆环病毒等在内的其他病原体相互作用,引起呼吸系统疾病综合征(Porcine respiratory disease complex, PRDC),导致猪免疫功能受损,增加感染相关疾病的风险性和严重性。
P46蛋白是MHP中的一个细胞膜蛋白,该蛋白在MHP致病性及病原传播方面起着重要作用。P46蛋白作为免疫优势蛋白,基因序列高度保守,利用P46蛋白应用于ELISA,检测猪血清MHP抗体时具有良好的特异性和敏感性。
发明内容
本发明的目的是提供一种抗猪肺炎支原体单克隆抗体的重链和轻链可变区及其应用,单克隆抗体具有较高亲和力和检测灵敏度,为建立竞争或阻断ELISA抗体检测方法,形成ELISA抗体检测试剂盒产品的研发推广奠定基础。
为实现上述目的,本发明提供了一种抗猪肺炎支原体单克隆抗体的重链和轻链可变区,单克隆抗体的Heavy链的基因序列如SEQ ID NO.5所示,其氨基酸序列如SEQ ID NO.6所示;单克隆抗体的Kappa链的基因序列如SEQ ID NO.7所示,其氨基酸序列如SEQ ID NO.8所示。
优选地,P46蛋白单克隆抗体重链可变区的互补决定区序列分别为CDR-H1、CDR-H2、CDR-H3,其氨基酸序列分别如SEQ ID NO.9、SEQ ID NO.10、SEQ ID NO.11所示。
优选地,P46蛋白单克隆抗体轻链可变区的互补决定区序列分别为CDR-L1、CDR-L2、CDR-L3,其氨基酸序列分别如SEQ ID NO.12、SEQ ID NO.13、SEQ ID NO.14所示。
一种抗猪肺炎支原体单克隆抗体的重链和轻链可变区在制备以P46蛋白为靶点的检测试剂或试剂盒中的应用。
一种抗猪肺炎支原体单克隆抗体的重链和轻链可变区在制备以P46蛋白为靶点的基因工程抗体或疫苗中的应用。
因此,本发明采用上述一种抗猪肺炎支原体单克隆抗体的重链和轻链可变区,单克隆抗体具有较高亲和力和检测灵敏度,为建立竞争或阻断ELISA抗体检测方法,形成ELISA抗体检测试剂盒产品的研发推广奠定基础。
下面通过附图和实施例,对本发明的技术方案做进一步的详细描述。
附图说明
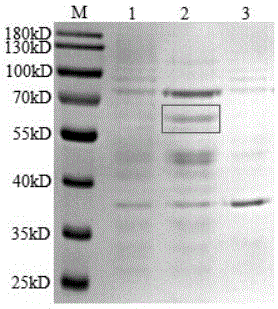
图1是pET-32a-P46菌液诱导表达SDS-PAGE鉴定凝胶图;
图2是pET-32a-P46纯化后SDS-PAGE鉴定凝胶图;
图3是免疫小鼠血清效价检测折线图;
图4是单克隆抗体纯化后SDS-PAGE鉴定凝胶图;
图5是单克隆抗体重链可变区基因序列比对结果示意图;
图6是单克隆抗体重链可变区氨基酸序列比对结果示意图;
图7是单克隆抗体轻链可变区基因序列比对结果示意图;
图8是单克隆抗体轻链可变区氨基酸序列比对结果示意图。
具体实施方式
以下通过附图和实施例对本发明的技术方案作进一步说明。
本发明使用的所有术语(包括技术术语或者科学术语)与本发明所属领域的普通技术人员理解的含义相同,除非另外特别定义。还应当理解,在诸如通用词典中定义的术语应当被理解为具有与它们在相关技术的上下文中的含义相一致的含义,而不应用理想化或极度形式化的意义来解释,除非本文有明确地这样定义。
对于相关领域普通技术人员已知的技术、方法和设备可能不作为详细讨论,但在适当情况下,所述技术、方法和设备应当被视为说明书的一部分。
本发明说明书中引用的现有技术文献所公开的内容整体均通过引用并入本发明中,并且因此是本发明公开内容的一部分。
实施例一
猪肺炎支原体重组P46蛋白的表达及纯化
一、基因合成
根据NCBI上公布的MHP P46基因序列(GenBank Accession No.AY496283.1),将该基因序列做密码子优化后交由武汉金开瑞生物工程有限公司进行基因合成,合成至pET-32a载体上,以BL21感受态为宿主菌进行保种。
二、表达及纯化
取保种的pET-32a-P46/BL21种子液按照1:1000的比例接种至10mL含Amp+的LB液体培养基中,置于恒温摇床中,37℃,220rpm过夜培养。次日,取出活化后的菌液,按照1:100的比例接种至500mL含Amp+的LB液体培养基中,置于恒温摇床中,37℃,220rpm培养约4h,当菌液OD
用Ni预装柱(GE)对破碎后上清液进行纯化。先用10倍柱体积的双蒸水冲洗柱子,再用10倍柱体积的缓冲A液平衡柱子,然后将破碎后上清液用0.45μm滤膜过滤后开始上样。上样结束后,再用缓冲A液平衡柱子,直至UV峰值基线平稳。先用10% B液(50mM Tris+300mMNaCl+500mM 咪唑,pH8.2)洗杂,直至UV峰值基线平稳,再用50% B液洗脱目的蛋白,当UV值升高时开始收集洗脱液,直到UV峰值基线下降至100mAu以下停止收集。收集到的目的蛋白洗脱液用1×PBS透析,透析后测浓度并于-20℃保存备用。
重组pET-32a-P46菌液诱导表达后,SDS-PAGE检测表达产物,可见重组pET-32a-P46菌液诱导后上清在60kDa左右的位置有一条明显的条带。与预期大小一致,且该重组蛋白为可溶性表达,具体见图1。
其中,在图1中,跑道1为pET-32a-P46菌液未诱导样品,跑道2为pET-32a-P46菌液诱导后上清样品,跑道3为pET-32a-P46菌液诱导后沉淀样品。
重组P46蛋白经镍柱亲和纯化后,SDS-PAGE鉴定如图2,在60kDa左右的位置可见一条明显的目的条带,纯度约90%,可用于制备单克隆抗体。
其中,在图2中,跑道1为pET-32a-P46菌液未诱导样品,跑道2为pET-32a-P46菌液诱导后上清样品,跑道3为纯化后重组P46蛋白样品。
实施例二
单克隆抗体的制备
一、小鼠免疫
取4只6-8周龄的雌性Balb/c小鼠,每只免疫50μg的重组P46蛋白。首次免疫时,将P46蛋白与弗氏完全佐剂做等体积乳化,皮下多点注射免疫小鼠。共免疫三次,每两周免疫一次,二次免疫和三次免疫均用弗氏不完全佐剂进行抗原乳化,免疫剂量和方式不变。三次免疫后一周对小鼠进行尾静脉采血,取血清并通过间接ELISA方法测其效价。免疫后小鼠血清效价结果见图3,结果显示,血清效价最高可达1:1.024×10
二、SP2/0骨髓瘤细胞的培养
将冻存在液氮中的SP2/0骨髓瘤细胞取出一支,立即将其转移到37℃恒温水浴锅中,不时轻柔晃动冻存管,当细胞融化至半冰晶状态时取出。在无菌环境内操作,把冻存管中的SP2/0细胞转入50mL无菌离心管中,取预热的1640完全培养基10mL缓慢滴加入离心管中,1000r/min离心5min,弃去上清。将细胞团轻柔打散,取5mL培养基重悬细胞并将其转移至T75细胞培养瓶中。另外补加5mL培养基,“十字”方向晃动细胞瓶,放入CO
三、细胞融合
(1)取冲击后的实验鼠进行眼眶采血,收集在EP管中,37℃静置2h后,4000rpm离心10min,收集血清为后续筛选单克隆抗体作为阳性对照使用。小鼠脱颈处死并将其放在75%酒精中浸泡消毒。
(2)脾细胞的制备:在生物安全柜内使用已灭菌的剪刀和镊子剪开小鼠外皮,更换一套新的已灭菌的剪刀镊子剪开小鼠腹腔,再用一套已灭菌的剪刀和镊子小心取出脾脏,剪掉多余的脂肪。准备一支无菌15mL离心管,加入10mL DMEM培养基,将脾脏放入该离心管中,脾脏润湿后小心弃去多余培养基。再吸取10mL的DMEM培养基置于无菌平皿中,用毛玻璃片研磨脾脏,制成单细胞悬液并通过200目尼龙网过滤到无菌离心管中,在50mL无菌离心管中加入30mL的DMEM,用吸管冲洗尼龙网,将装有脾细胞悬液的离心管离心,1500rpm,5min,弃去上清,用手轻轻打散细胞团,再加入30mL DMEM培养基重悬后再离心一次,然后弃去上清,用手轻轻打散细胞团,再加入10mL DMEM培养基重悬。
(3)细胞融合:1000rpm,5min离心收集生长良好的SP2/0细胞于50 mL离心管中,轻轻打散SP20细胞团,加入30mL DMEM培养基重悬,再离心一次后,加入10mL DMEM培养基重悬,再将脾细胞悬液与SP2/0细胞悬液混合,1000rpm离心5min,弃去上清,轻轻打散细胞团。置于37℃水浴环境中,吸取1mL PEG融合剂滴加到离心管中,1min内加完1mL,此时细胞状态为红色均质流沙状,转动管壁感觉像毛玻璃状。
(4)终止融合:吸取9mL预热的DMEM培养基来终止融合,共分为三个阶段。第一阶段为前1min内滴加1mL,第二阶段为1min内滴加1mL,第三阶段为3min内滴加完剩余的7mL培养基。然后在37℃水浴中静置稳定5min后,800rpm离心5min。
(5)铺板:弃去上清,轻轻打散细胞团,加入HAT培养基(例如要铺5块96孔板,200μL/孔,除去已提前铺好100μL/孔的饲养层细胞,则需要加入50mL的HAT培养基),混匀细胞后,将融合细胞悬液均匀铺于已加入饲养层细胞的96孔细胞板中,100μL/孔,放入CO
四、阳性杂交瘤细胞的筛选
细胞融合后7天,观察到细胞团比较大时,用间接ELISA法对细胞上清进行检测。以1μg/mL的重组P46蛋白和ALV重组P27蛋白(带有His标签)分别作为检测用的抗原,阳性对照是融合小鼠的血清,阴性对照为PBS免疫小鼠血清。选取显色反应最强、同时与ALV重组P27蛋白不反应的杂交瘤细胞孔确定为阳性孔。将筛选到的阳性杂交瘤细胞进行有限稀释法亚克隆。将亚克隆后鉴定得到的能稳定分泌单克隆抗体的杂交瘤细胞株扩大培养,转移至T75细胞瓶中,培养至细胞数量约80%时,可收集为制备腹水做准备。
五、腹水制备
细胞瓶中加入10 mL的无菌1×PBS,吹下细胞层,重悬后将其转移到15mL离心管中,1000r/min离心10min。弃掉上清,沉淀另取1mL无菌1×PBS重悬混匀,用1mL注射器吸取。每只小鼠注射约500μL的细胞悬液,注意小鼠生长状态,一周后待小鼠腹部涨大时方可收集腹水。收集小鼠腹水于离心管中,8000r/min离心20min,吸取中间腹水层。
六、单克隆抗体的纯化
对收集到的腹水先进行辛酸-硫酸铵法粗纯化,再使用Protein G预装柱对粗纯化的单抗进行二次纯化。SDS-PAGE鉴定纯化后的单克隆抗体纯度,结果见图4,纯度约95%,测该单抗浓度为2.56mg/mL。
实施例三
猪肺炎支原体P46蛋白单克隆抗体的灵敏度、特异性及亚类鉴定
一、单克隆抗体灵敏度、特异性鉴定
采用间接ELISA方法检测P46蛋白单克隆抗体灵敏度及特异性。P46蛋白按照1μg/mL进行包被,将1mg/mL的单抗做梯度稀释,验证单抗的灵敏度,结果见表1。单抗灵敏度可达到1:50000倍稀释。分别取MHP P46蛋白、PRRSV N蛋白、CSFV E2蛋白和PCV VP1蛋白按照1μg/mL进行包被,1mg/mL的单抗P46做1:5000稀释,验证单抗的特异性,结果见表2。
表1 单克隆抗体灵敏度验证
表2 单克隆抗体特异性验证
二、单克隆抗体亚类鉴定
使用IgG亚类检测试剂盒(美国Sigma公司)检测猪肺炎支原体P46蛋白单克隆抗体的亚类,结果见表3。P46蛋白单克隆抗体为IgG1/Kappa型。
表3 单克隆抗体的亚类鉴定
实施例四
单克隆抗体重链和轻链可变区基因克隆
一、杂交瘤细胞培养及总RNA提取
用RPMI 1640完全培养基在37℃、5%二氧化碳条件下培养杂交瘤细胞,使细胞数量达到1×10
二、cDNA第一链的合成
使用翻转录试剂盒(购自TAKARA),以提取到的总RNA为扩增模板来合成cDNA第一链。
三、基因扩增
设计Lambda链,Kappa链,Heavy链的下游引物及上游通用引物。
引物:F:AAGCAGTGGTATCAACGCAGA(SEQ ID NO.1)
Rκ:AACATTGATGTCTTTGGGGTAGAA(SEQ ID NO.2)
Rλ:AATCGTACACACCAGTGTGTGGG(SEQ ID NO.3)
RH:AGGGATCCAGAGTTCCAGGT(SEQ ID NO.4)
以cDNA第一链为模板进行PCR扩增,反应体系为50μL。模板 3μL,上游引物(10μM)2.5μL,下游引物(10μM)2.5μL,2×Taq酶25μL,无菌水17μL。
降落PCR反应条件为:98℃ 30s;98℃ 15s,64℃-58℃ 30s,每次下降0.5℃,直到58℃,循环10次;72℃ 30s;98℃ 15s,56℃ 30s,72℃30s,循环15次;72℃ 7min结束程序。
四、PCR扩增产物的克隆和筛选
PCR产物经1%琼脂糖凝胶电泳,用PCR产物回收试剂盒(购自天根)回收Kappa链,Lambda链和Heavy链扩增片段,用pLB零背景快速克隆试剂盒(购自天根)将回收纯化的目的片段插入pLB载体中,转化至DH5α感受态细胞(氨苄抗性)中,筛选重组阳性克隆并进行测序。
Heavy链的基因序列如SEQ ID NO.5所示,其氨基酸序列如SEQ ID NO.6所示;Kappa链的基因序列如SEQ ID NO.7所示,其氨基酸序列如SEQ ID NO.8所示。
五、可变区氨基酸序列及同源性分析
将重链和轻链基因序列分别在NCBI数据库中进行比对分析,分析结果显示单克隆抗体重链可变区基因序列与小鼠免疫球蛋白重链可变区(Sequence ID:BC010327.1)同源性最高,同源性为513/593,同源性百分比为87%,结果见图5。单克隆抗体重链可变区氨基酸序列与小鼠免疫球蛋白重链可变区氨基酸序列(Sequence ID:707F-H)同源性最高,同源性为142/166,同源性百分比为86%,结果见图6。单克隆抗体轻链可变区基因序列与小鼠免疫球蛋白Kappa链可变区(Sequence ID:BC091754.1)同源性最高,同源性为488/511,同源性百分比为95%,结果见图7。单克隆抗体轻链可变区氨基酸序列与小鼠免疫球蛋白Kappa链可变区氨基酸序列(Sequence ID:AAG12167.1)同源性最高,同源性为145/165,同源性百分比为88%,结果见图8。编码单克隆抗体的重链和轻链可变区的基因序列和氨基酸序列同源性分析结果表明,未发现与本发明相同的序列。此结果与使用IgG亚类检测试剂盒(美国Sigma公司)鉴定单克隆抗体与IgG1/Kappa相一致。
六、CDR区分析
将重链可变区和轻链可变区序列,在https://www.novopro.cn/tools/cdr.html进行分析,得出其CDR区。
抗体重链CDR区:
CDR-H1:DYGH(SEQ ID NO.9)
CDR-H2:YINSGSTTIYYADTVKG(SEQ ID NO.10)
CDR-H3:ELWLRRIDY(SEQ ID NO.11)
抗体轻链CDR区:
CDR-L1:QDVTTA(SEQ ID NO.12)
CDR-L2:LIHWASTR(SEQ ID NO.13)
CDR-L3:QQYSSYPLT(SEQ ID NO.14)
实施例五
制备猪肺炎支原体阻断ELISA抗体检测试剂盒,检测38份猪血清样本,与外购的猪肺炎支原体阻断ELISA抗体检测试剂盒(英吉纳)对比,共有2份样本检测结果不符合,详细结果见表4。总符合率可达95%。
表4 样本符合率对比
注:外购的猪肺炎支原体阻断ELISA抗体检测试剂盒(英吉纳)判定标准:CUT OFF(-)=0.45×阴性对照OD值,CUT OFF(+)=0.4×阴性对照OD值;样品OD值≤CUT OFF(+),样品呈阳性;样品OD值≥CUT OFF(-),样品呈阴性;介于二者之间则为可疑样品。
本发明试剂盒判定标准:阻断率(IN)的计算:IN=(阴性对照OD
选取敏感性质控血清样品进行最低检出量研究。研究结果表明,本发明的猪肺炎支原体阻断ELISA抗体检测试剂盒可以检测到8倍稀释的灵敏度样品;外购的猪肺炎支原体阻断ELISA抗体检测试剂盒(英吉纳)也可检测到8倍稀释的灵敏度样品。详细结果见表5。由此结果说明,试制的猪肺炎支原体阻断ELISA抗体检测试剂盒具有良好的敏感性。
表5 敏感性质控品检测结果
用本发明试制的猪肺炎支原体阻断ELISA抗体检测试剂盒和外购的猪肺炎支原体阻断ELISA抗体检测试剂盒(英吉纳)分别检测5份阴性样品,结果均为阴性,见表6。由此可以表明,试制的猪肺炎支原体阻断ELISA抗体检测试剂盒具有良好的特异性。
表6 特异性质控品检测结果
因此,本发明采用上述一种抗猪肺炎支原体单克隆抗体的重链和轻链可变区,单克隆抗体具有较高亲和力和检测灵敏度,为建立竞争或阻断ELISA抗体检测方法,形成ELISA抗体检测试剂盒产品的研发推广奠定基础。
最后应说明的是:以上实施例仅用以说明本发明的技术方案而非对其进行限制,尽管参照较佳实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对本发明的技术方案进行修改或者等同替换,而这些修改或者等同替换亦不能使修改后的技术方案脱离本发明技术方案的精神和范围。
