高烯丙胺类化合物及其制备方法
文献发布时间:2023-06-19 18:37:28
技术领域
本发明属于有机合成技术领域,具体涉及一类高烯丙胺化合物,还涉及上述化合物的制备方法。
背景技术
高烯丙胺类化合物是一种特殊的结构单元,是多种天然产物和药物活性分子的重要组成片段,例如狭叶羽扇豆中提取到的生物碱Angustifoline,具有抗癌作用的蛋白酶体抑制剂Eponemycin中含有高烯丙胺结构片段。同时高烯丙胺类化合物也是一类重要的中间体,烯丙基部分可进行多种转化,如双键进行环氧化,双羟化,卤代等,可得到多种衍生物。因此对此类化合物的合成研究一直以来是化学家和药物学家的研究热点。
通过烯丙基金属络合物对亚胺的碳氮双键的加成是获得高烯丙胺最有效的方法之一,烯丙基金属试剂由于对水及氧气敏感在空气中不易存放,需要使用烯丙基卤代烃与化学计量的金属还原试剂新制备,此外需要将胺氧化为亚胺,此传统方法虽然使用范围广,但需要将底物提前制备,方法既繁琐又不经济,并且造成了环境污染和资源浪费,因此急需发展更为绿色环保的方法。
针对上述问题,本发明提出将可见光促进的烯丙化反应应用到高烯丙胺化合物的合成中,可见光作为一种安全、廉价、丰富和可再生的化学潜能来源,促进的化学反应满足了有机化学家对原子经济性和绿色环保的要求。
发明内容
本发明的目的是提供一种高烯丙胺类化合物,其是天然产物及药物分子的片段同时也是重要的合成中间体。
本发明第二个目的是提供上述高烯丙胺类化合物的制备方法,克服了现有制备方法原料需预官能团化,需要过渡金属参与等不经济、不环保的问题。
本发明所采用的第一个技术方案是,一种高烯丙胺类化合物,其结构如下通式3所示:
式3中,R
本发明所采用的第二个技术方案是,上述高烯丙胺类化合物的制备方法,具体步骤如下:
步骤1、将三级胺化合物、烯丙基三氟硼酸钾溶于氯仿溶剂中,在蓝光照射,孟加拉玫瑰红催化下经过一步反应得到反应混合物,反应式如下:
上式中,R
步骤2、向反应混合物加入蒸馏水,并用氯仿萃取三次,得到有机相,用饱和氯化钠洗涤有机相,并采用无水硫酸钠干燥半小时后,用旋转蒸发仪除去溶剂,过硅胶柱层析纯化,即得到高烯丙胺类化合物。
本发明的特点还在于,
步骤1中反应温度为室温,反应时间为12~48h。
三级胺化合物、烯丙基三氟硼酸钾的摩尔比为1:1。
孟加拉玫瑰红用量为三级胺化合物用量的1~5mol%。
步骤1中溶剂氯仿的加入量为每1mmol三级胺化合物加入5~10mL氯仿。
蓝光为为市售10W蓝光灯,其波段为465~475nm。
与现有技术相比,本发明具有以下优点和有益效果:
(1)本发明的高烯丙胺类化合物,是天然产物及药物分子的片段同时也是重要的合成中间体。
(2)本发明以空气中稳定的烯丙基三氟硼酸钾试剂为烯丙化试剂,选用廉价易得的孟加拉玫瑰红为催化剂,利用市售的可见光LED光源照射一步法合成了一系列具有应用前景的高烯丙基化合物,合成方法具有步骤简短、操作简单、条件温和、底物范围广、无添加剂和无金属参与等优点。
附图说明
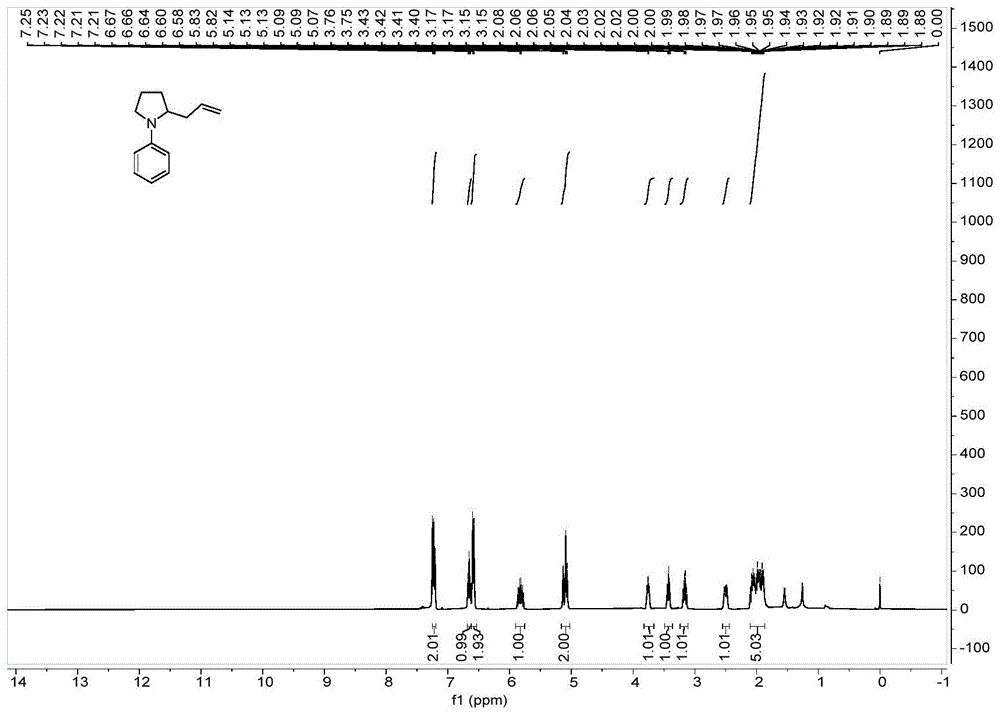
图1是本发明实施例1制备的2-烯丙基-1-苯基吡咯烷核磁氢谱图;
图2是本发明实施例1制备的2-烯丙基-1-苯基吡咯烷核磁碳谱图。
图3是本发明实施例2制备的2-烯丙基-1-(4-溴苯基)吡咯烷核磁氢谱图;
图4是本发明实施例2制备的2-烯丙基-1-(4-溴苯基)吡咯烷核磁碳谱图;
图5是本发明实施例3制备的2-烯丙基-1-(3-甲氧基苯基)吡咯烷核磁氢谱图;
图6是本发明实施例3制备的2-烯丙基-1-(3-甲氧基苯基)吡咯烷核磁碳谱图;
图7是本发明实施例4制备的2-烯丙基-1-(3,5-二甲基苯基)吡咯烷核磁氢谱图;
图8是本发明实施例4制备的2-烯丙基-1-(3,5-二甲基苯基)吡咯烷核磁碳谱图;
图9是本发明实施例5制备的2-烯丙基-1-苯基哌啶核磁氢谱图;
图10是本发明实施例5制备的2-烯丙基-1-苯基哌啶核磁碳谱图;
图11是本发明实施例6制备的2-烯丙基-1-苯基六亚甲基亚胺核磁氢谱图;
图12是本发明实施例6制备的2-烯丙基-1-苯基六亚甲基亚胺核磁碳谱图;
图13是本发明实施例7制备的N-(丁-3-烯-1-基)-N-甲基苯胺核磁氢谱图;
图14是本发明实施例7制备的N-(丁-3-烯-1-基)-N-甲基苯胺核磁碳谱图;
图15是本发明实施例8制备的N-(丁-3-烯-1-基)-N-异丁基苯胺核磁氢谱图;
图16是本发明实施例8制备的N-(丁-3-烯-1-基)-N-异丁基苯胺核磁碳谱图。
具体实施方式
下面结合具体实施方式对本发明进行详细说明。
本发明的一种高烯丙胺类化合物,其结构如下通式3所示:
式3中,R
上述高烯丙胺类化合物的合成具体步骤如下:
步骤1、将三级胺化合物、烯丙基三氟硼酸钾按照1:1的摩尔比溶于氯仿溶剂中,在市售10W蓝光灯照射,孟加拉玫瑰红催化下经过一步反应得到反应混合物,反应式如下:
上式中,R
反应条件为:反应温度为室温,反应时间为12~48h。孟加拉玫瑰红用量为三级胺化合物用量的1~5mol%。溶剂氯仿的加入量为每1mmol三级胺化合物加入5~10mL氯仿。蓝光波段为465~475nm;
步骤2、向反应混合物加入蒸馏水,并用氯仿萃取三次,得到有机相,用饱和氯化钠洗涤有机相,并采用无水硫酸钠干燥半小时后,用旋转蒸发仪除去溶剂,过硅胶柱层析纯化,即得到高烯丙胺类化合物。
下面结合实施例,对本发明作进一步地详细说明:
实施例1
在装有搅拌磁子的10mL反应瓶中加入0.2mmol 1-苯基吡咯烷,0.2mmol 烯丙基三氟硼酸钾,10.2mg孟加拉玫瑰红,然后在反应体系里面加入溶剂氯仿2.0mL,在10W蓝光照射下搅拌反应12h,待反应结束后,加入蒸馏水 10mL,将反应混合物分别用10mL的氯仿萃取三次,有机相用10mL饱和氯化钠洗涤,无水硫酸钠干燥半小时,用旋转蒸发仪除去溶剂,剩余的反应物通过硅胶柱层析纯化,得到2-烯丙基-1-苯基吡咯烷3a,产率为73%。
上述实施例中产物2-烯丙基-1-苯基吡咯烷3a为黄色油状液体;洗脱剂采乙酸乙酯:石油醚(1:50,Rf=0.50)。
如图1及图2中所示,产物核磁数据如下:1H NMR(400MHz,CDCl3) δ7.25–7.19(m,2H),6.66(t,J=7.3Hz,1H),6.59(d,J=8.2Hz,2H),5.83(ddt, J=17.2,10.2,7.0Hz,1H),5.16–5.05(m,2H),3.80–3.70(m,1H),3.43(td,J =9.0,8.2,2.4Hz,1H),3.20–3.11(m,H),2.54–2.46(m,1H),2.11–1.85(m, 5H);13C NMR(101MHz,CDCl3)δ147.2,135.8,129.4,117.0,115.5,112.0, 58.1,48.5,37.5,29.9,23.4。
实施例2
在装有搅拌磁子的10mL反应瓶中加入0.2mmol 1-(4-溴苯基)吡咯烷, 0.2mmol烯丙基三氟硼酸钾,6.1mg孟加拉玫瑰红。然后在反应体系里面加入溶剂氯仿1.0mL,在10W蓝光照射下搅拌反应12h,待反应结束后,加入蒸馏水10mL,将反应混合物分别用10mL的氯仿萃取三次,有机相用10mL 饱和氯化钠洗涤,无水硫酸钠干燥半小时,用旋转蒸发仪除去溶剂,剩余的反应物通过硅胶柱层析纯化,得到2-烯丙基-1-(4-溴苯基)吡咯烷3b,产率为69%。
上述实施例中产物2-烯丙基-1-(4-溴苯基)吡咯烷3b为黄色油状液体;洗脱剂:乙酸乙酯:石油醚(1:50,Rf=0.50)。
如图3及图4中所示,产物核磁数据如下:1H NMR(400MHz,CDCl3) δ7.30–7.25(m,2H),6.46–6.40(m,2H),5.85–5.74(m,1H),5.13–5.06(m, 2H),3.73–3.68(m,1H),3.40–3.35(m,1H),3.15–3.09(m,1H),2.47–2.41 (m,1H),2.09–1.88(m,5H);13C NMR(101MHz,CDCl3)δ146.1,135.4, 131.9,117.3,113.6,107.3,58.2,48.5,37.2,29.9,23.4。
实施例3
在装有搅拌磁子的10mL反应瓶中加入0.2mmol 1-(3-甲氧基苯基)吡咯烷,0.2mmol烯丙基三氟硼酸钾,10.2mg孟加拉玫瑰红。然后在反应体系里面加入溶剂氯仿2.0mL,在10W蓝光照射下搅拌反应24h,待反应结束后,加入蒸馏水10mL,将反应混合物分别用10mL的氯仿萃取三次,有机相用 10mL饱和氯化钠洗涤,无水硫酸钠干燥半小时,用旋转蒸发仪除去溶剂,剩余的反应物通过硅胶柱层析纯化,得到2-烯丙基-1-(3-甲氧基苯基)吡咯烷3c,产率为62%。
产物2-烯丙基-1-(3-甲氧基苯基)吡咯烷3c为黄色油状液体;洗脱剂:乙酸乙酯:石油醚(1:50,Rf=0.50)。
如图5及图6中所示,产物核磁数据如下:1H NMR(400MHz,CDCl3) δ7.13(t,J=8.2Hz,1H),6.23(td,J=8.2,2.2Hz,2H),6.14(t,J=2.2Hz,1H), 5.87–5.76(m,1H),5.16–5.01(m,2H),3.80(s,3H),3.78–3.70(m,1H),3.41 (td,J=8.0,2.4Hz,1H),3.19–3.13(m,1H),2.56–2.45(m,1H),2.12–1.84(m, 5H);13C NMR(101MHz,CDCl3)δ160.9,148.5,135.8,130.0,117.1,105.3, 100.5,98.4,58.3,55.2,48.5,37.5,29.9,23.3。
实施例4
在装有搅拌磁子的10mL反应瓶中加入0.2mmol 1-吡咯烷,0.2mmol烯丙基三氟硼酸钾,10.2mg孟加拉玫瑰红。然后在反应体系里面加入溶剂氯仿 1.2mL,在10W蓝光照射下搅拌反应48h,待反应结束后,加入蒸馏水10mL,将反应混合物分别用10mL的氯仿萃取三次,有机相用10mL饱和氯化钠洗涤,无水硫酸钠干燥半小时,用旋转蒸发仪除去溶剂,剩余的反应物通过硅胶柱层析纯化,得到2-烯丙基-1-(3,5-二甲基苯基)吡咯烷3d,产率为62%。
产物2-烯丙基-1-(3,5-二甲基苯基)吡咯烷3d为黄色油状液体;洗脱剂:乙酸乙酯:石油醚(1:50,Rf=0.50)。
如图7及图8中所示,产物核磁数据如下:1H NMR(400MHz,CDCl3) δ6.34(s,1H),6.22(s,2H),5.89–5.76(m,1H),5.17–5.01(m,2H),3.76–3.70 (m,1H),3.48–3.35(m,1H),3.17–3.10(m,1H),2.54–2.43(m,1H),2.27(s, 6H),2.12–1.80(m,5H);13C NMR(101MHz,CDCl3)δ147.4,138.0,135.9, 117.6,116.9,109.9,58.0,48.5,37.7,29.8,23.3,21.9。
实施例5
在装有搅拌磁子的10mL反应瓶中加入0.2mmol 1-苯基哌啶,0.2mmol 烯丙基三氟硼酸钾,2.0mg孟加拉玫瑰红。然后在反应体系里面加入溶剂氯仿2.0mL,在10W蓝光照射下搅拌反应24h,待反应结束后,加入蒸馏水 10mL,将反应混合物分别用10mL的氯仿萃取三次,有机相用10mL饱和氯化钠洗涤,无水硫酸钠干燥半小时,用旋转蒸发仪除去溶剂,剩余的反应物通过硅胶柱层析纯化,得到2-烯丙基-1-苯基哌啶3e,产率为34%。
产物2-烯丙基-1-苯基哌啶3e为黄色油状液体;洗脱剂:乙酸乙酯:石油醚(1:50,Rf=0.50)。
如图9及图10中所示,产物核磁数据如下:1H NMR(400MHz,CDCl3) δ7.26–7.20(m,2H),6.92(d,J=8.0Hz,2H),6.79(t,J=8.0Hz,1H),5.81– 5.61(m,1H),5.07–4.93(m,2H),3.88–3.78(m,1H),3.32(dt,J=12.0,4.0Hz, 1H),3.0–2.9(m,1H),2.41–2.12(m,2H),1.77–1.57(m,6H);13C NMR(101 MHz,CDCl3)δ151.1,136.5,129.2,118.8,116.9,116.6,55.9,44.4,31.8,27.4, 25.8,19.3。
实施例6
在装有搅拌磁子的10mL反应瓶中加入0.2mmol 1-苯基六亚甲基亚胺, 0.2mmol烯丙基三氟硼酸钾,10.2mg孟加拉玫瑰红。然后在反应体系里面加入溶剂氯仿2.0mL,在10W蓝光照射下搅拌反应24h,待反应结束后,加入蒸馏水10mL,将反应混合物分别用10mL的氯仿萃取三次,有机相用10mL 饱和氯化钠洗涤,无水硫酸钠干燥半小时,用旋转蒸发仪除去溶剂,剩余的反应物通过硅胶柱层析纯化,得到2-烯丙基-1-苯基六亚甲基亚胺3f,产率为71%。
产物2-烯丙基-1-苯基六亚甲基亚胺3f为黄色油状液体;洗脱剂:乙酸乙酯:石油醚(1:50,Rf=0.50)。
如图11及图12中所示,产物核磁数据如下:1H NMR(400MHz,CDCl3) δ7.27–7.16(m,2H),6.68(d,J=8.0Hz,2H),6.61(t,J=8.0Hz,1H),5.90– 5.77(m,1H),5.13–5.01(m,2H),3.70–3.62(m,1H),3.48(dt,J=16.0,4.0Hz, 1H),3.12–3.15(m,1H),2.44–2.34(m,1H),2.26–2.09(m,2H),1.83–1.18 (m,7H);13C NMR(101MHz,CDCl3)δ148.4,135.6,129.5,116.9,114.7, 110.5,56.9,43.3,38.1,34.7,30.1,27.4,25.5。
实施例7
在装有搅拌磁子的10mL反应瓶中加入0.2mmolN,N-二甲基苯胺, 0.2mmol烯丙基三氟硼酸钾,8.1mg孟加拉玫瑰红。然后在反应体系里面加入溶剂氯仿2.0mL,在10W蓝光照射下搅拌反应48h,待反应结束后,加入蒸馏水10mL,将反应混合物分别用10mL的氯仿萃取三次,,有机相用10mL 饱和氯化钠洗涤,无水硫酸钠干燥半小时,用旋转蒸发仪除去溶剂,剩余的反应物通过硅胶柱层析纯化,得到N-(丁-3-烯-1-基)-N-甲基苯胺,产率为 47%。
产物N-(丁-3-烯-1-基)-N-甲基苯胺3g黄色油状液体;洗脱剂:乙酸乙酯:石油醚(1:50,Rf=0.50)。
如图13及14中所示,产物核磁数据如下:1H NMR(400MHz,CDCl3) δ7.27–7.19(m,2H),6.76–6.63(m,3H),5.88–5.78(m,1H),5.17–4.96(m, 2H),3.44–3.31(m,2H),2.93(s,3H),2.39–2.25(m,2H);13C NMR(101MHz, CDCl3)δ149.2,136.1,129.3,116.5,116.2,112.3,52..5,38.4,31.2。
实施例8
在装有搅拌磁子的10mL反应瓶中加入0.2mmolN-异丁基-N-甲基苯胺, 0.2mmol烯丙基三氟硼酸钾,10.2mg孟加拉玫瑰红。然后在反应体系里面加入溶剂氯仿2.0mL,在10W蓝光照射下搅拌反应48h,待反应结束后,加入蒸馏水10mL,将反应混合物分别用10mL的氯仿萃取三次,,有机相用10mL 饱和氯化钠洗涤,无水硫酸钠干燥半小时,用旋转蒸发仪除去溶剂,剩余的反应物通过硅胶柱层析纯化,得到N-(丁-3-烯-1-基)-N-异丁基苯胺3h,产率为89%。
产物N-(丁-3-烯-1-基)-N-异丁基苯胺3h为黄色油状液体;洗脱剂:乙酸乙酯:石油醚(1:50,Rf=0.50)。
如图15及图16中所示,产物核磁数据如下:1H NMR(400MHz,CDCl3) δ7.24–7.18(m,2H),6.74–6.60(m,3H),5.87–5.77(m,1H),5.15–4.99(m, 2H),3.43–3.29(m,2H),3.06(d,J=8.0Hz,2H),2.38–2.26(m,2H),2.10– 1.99(m,1H),0.92(d,J=6.8Hz,6H);13C NMR(101MHz,,CDCl3)δ148.2, 136.1,129.3,116.4,115.5,112.2,59.3,51.6,31.0,27.2,20.5。
