一种生乳中乳蛋白定量检测试剂盒及其应用
文献发布时间:2023-06-19 18:46:07
技术领域
本发明属于生乳检测领域,特别涉及一种生乳中乳蛋白定量检测试剂盒及其应用。
背景技术
乳铁蛋白(lactoferrin,LF)是乳汁中一种重要的非血红素铁结合糖蛋白,其分子量为80kDa,主要由乳腺上皮细胞表达和分泌。LF是一种与铁的转运和存储有关、能够调节免疫功能等重要作用的蛋白。它在初乳中含量最高,成熟乳中含量明显降低。LF能够与铁离子结合,具有参与铁代谢、运输铁的功能。它能防止铁离子刺激肠胃并促使铁的吸收利用,从而维持人体内铁离子的正常水平。同时LF具有广谱抗菌、抗氧化、抗癌、调节免疫系统等强大生物功能,LF之所以被重视乃是因为它可以夺走细菌生长所需的铁质而抑制细菌的生长,或破坏细菌细胞膜而具杀死细菌的效果,此外LF可提升免疫力,抑制病毒所引起的感染,如肠病毒中的轮状细菌、肠细菌71型等等。
α-乳白蛋白(α-Lactoalbumin,α-La)广泛存在于哺乳动物(牛、山羊、骆驼、马、荷兰猪、兔等)和人的乳汁中,是由乳腺腺泡上皮合成的特殊蛋白质,它是牛乳清中第二大丰富的蛋白质。牛乳中的α-La和人乳中的α-La相比,74%的氨基酸是相同的,6%的氨基酸极为相似。α-La具有调节产乳、细胞溶解活性、诱导细胞生长抑制和细胞凋亡等多种功能。α-La中含有较高的色氨酸含量,有助于缓解压力,改善工作表现,并改善睡眠,改善抽象的视觉记忆。由于从牛奶分离出来的α-La在很多方面与人乳都非常相似,使得α-La在婴儿配方食品、保健品和药品等领域得到广泛应用。
β-乳球蛋白(β-Lactoblobulin,β-Lg)含有162个氨基酸残基,分子量约为18ku,在鲜乳中主要是以非共价键连接的两个单体形成的二聚体形式存在,每个单体中的4个半胱氨酸残基在链内形成2个二硫键,β-Lg约占乳蛋白的7~12%。在若干细胞及动物实验研究中发现,认为β-乳球蛋白的水解物质或分子修饰物,具有降胆固醇与抗氧化等生理活性。天然的β-乳球蛋白易与脂溶性营养素如VA、VD、VK结合,所以β-Lg是在液态乳中强化维生素最理想的物质。
目前有关乳制品中乳铁蛋白、α-乳白蛋白和β-乳球蛋白活性物质的含量具体有多少还不清楚,相关的检测方法也各有局限,也没有国家统一的标准作为依据,未形成系统的检测方法,缺乏相应的检测手段,无法满足乳制品中乳铁蛋白等活性成分的检测需求。
CN109507423A公开的一种基于适配体探针同时检测α-乳白蛋白、β-乳球蛋白和乳铁蛋白含量的方法。核酸适配体探针法和生物芯片法主要是基于分子间的作用力,如静电相互作用、氢键、疏水相互作用等作用力,并未直接测定目标蛋白含量。前者采用核苷酸识别特殊序列,受温度影响较大,重复性差;后者采用抗原抗体结合识别并定量检测,尽管检测时间短,但由于抗体存在一定不稳定性,假阳性率高,且成本较高。
发明内容
本发明所要解决的技术问题是提供一种生乳中乳蛋白定量检测试剂盒及其应用,本发明直接基于目标蛋白特征肽段,建立了超高效液相色谱串联质谱法可达到同时测定生牛乳中α-乳白蛋白、β-乳球蛋白和乳铁蛋白的含量,具有抗干扰能力强,灵敏度高,重复性好等优点。
本发明的一种生乳的前处理试剂,所述试剂包括:提取剂、还原剂、烷基化试剂、酶试剂、终止剂;其中所述提取剂为碳酸氢铵;还原剂为二硫苏糖醇;烷基化试剂为碘代乙酰胺;酶试剂为牛胰蛋白酶;终止剂为甲酸。
优选地,所述提取剂为80~120mmol/L碳酸氢铵溶液;还原剂为450~550mmol/L二硫苏糖醇溶液;烷基化试剂为450~550mmol/L碘代乙酰胺溶液;酶试剂为80~120μg/mL牛胰蛋白酶溶液。
本发明的一种生乳中乳蛋白定量检测试剂盒,所述试剂盒含所述试剂。
所述试剂包括提取剂、还原剂、烷基化试剂、酶试剂、终止剂;其中所述提取剂为碳酸氢铵;还原剂为二硫苏糖醇;烷基化试剂为碘代乙酰胺;酶试剂为牛胰蛋白酶;终止剂为甲酸。
进一步地,本发明的一种生乳中乳铁蛋白、α-乳白蛋白和β-乳球蛋白定量检测试剂盒,所述试剂盒含所述试剂。
本发明的一种生乳中乳蛋白定量检测方法,包括:
(1)称取适量生乳样品,水稀释,涡旋摇匀,得到稀释样品;
(2)取稀释样品并加入提取剂,混匀,加入还原剂,混匀,于60℃恒温水浴50~60min;冷却至室温,加入烷基化试剂,暗处静置30~40min,加入酶试剂,混匀后置于35~39℃恒温水浴酶解过夜,最后加入终止剂终止反应,静置,用水定容,离心,取上清液,得到样品溶液,然后进行高效液相色谱-串联质谱检测;
(3)根据乳蛋白基质混合标准工作溶液进行高效液相色谱-串联质谱检测,并以质量浓度为横坐标,以峰面积为纵坐标绘制标准工作曲线;
(4)将样品溶液中乳蛋白的色谱峰面积代入到标准工作曲线中,计算得到乳蛋白的含量。上述制备方法的优选方式如下:
所述步骤(2)中稀释样品的浓度为4~5%(g/mL);所述提取剂与稀释样品的体积比为0.7~0.8;还原剂与稀释样品的体积比为0.07~0.08;烷基化试剂与稀释样品的体积比为0.12~0.18;酶试剂与稀释样品的体积比为0.2~0.3;终止剂与稀释样品的体积比为0.04~0.06。
所述步骤(2)中所述提取剂为碳酸氢铵;还原剂为二硫苏糖醇;烷基化试剂为碘代乙酰胺;酶试剂为牛胰蛋白酶;终止剂为甲酸。
优选地,所述提取剂为80~120mmol/L碳酸氢铵溶液;还原剂为450~550mmol/L二硫苏糖醇溶液;烷基化试剂为450~550mmol/L碘代乙酰胺溶液;酶试剂为80~120μg/mL牛胰蛋白酶溶液。
所述碳酸氢铵溶液中的溶剂为水;二硫苏糖醇溶液为采用碳酸氢铵溶液溶解配置;碘代乙酰胺溶液为采用碳酸氢铵溶液溶解配置;牛胰蛋白酶溶液为乙酸溶液溶解配置。
举例如提取剂为100mmol/L碳酸氢铵溶液,由称取0.395g碳酸氢铵,用水溶解后定容至50mL配制而成;如还原剂为500mmol/L二硫苏糖醇溶液,由称取0.771g二硫苏糖醇,用100mmol/L碳酸氢铵溶液溶解后定容至10mL配制而成。如烷基化试剂为500mmol/L碘代乙酰胺溶液,由称取0.925g碘代乙酰胺,用100mmol/L碳酸氢铵溶液溶解后定容至10mL配制而成。
如酶试剂为100μg/mL牛胰蛋白酶溶液,由称取1mg碱性牛胰蛋白酶,用1%乙酸水(V/V)溶液溶解后定至10mL配制组成。
所述步骤(2)中取稀释样品于低蛋白吸附离心管中;所述取上清液于低蛋白吸附进样瓶中。
所述步骤(2)、(3)中
高效液相色谱-串联质谱参数均为:
液相色谱条件:色谱柱:C8柱;进样体积:10μL;柱温:40℃;流速:0.3mL/min;流动相为流动相A:0.1%甲酸水溶液,流动相B:0.1%甲酸乙腈溶液;洗脱梯度程序:0~0.5min,5%B;0.5~4.5min,70%B;4.5~5.5min,70%B;5.5~6.0min,5%B;6.0~8.0min,5%B;
质谱条件:离子源:电喷雾离子源;电离模式:正离子扫描;监测模式:多重反应监测MRM;干燥气温度200℃;干燥气流量14L/min;雾化气压力20psi;鞘气温度300℃;鞘气流量11L/min;毛细管电压4.00kV;喷嘴电压300V。
所述步骤(3)中高效液相色谱-串联质谱检测的目标物是乳铁蛋白、α-乳白蛋白、β-乳球蛋白中经牛胰蛋白酶酶解后的特征性肽段,其氨基酸序列分别为:乳铁蛋白:SFQLFGSPPGQR、α-乳白蛋白:VGINYWLAHK和β-乳球蛋白:TPEVDDEALEK。
所述步骤(3)中基质混合标准工作溶液具体为:将马乳基质中添加乳铁蛋白、α-乳白蛋白和β-乳球蛋白标准溶液,按步骤(2)进行样品前处理过程,进行提取,还原,烷基化,酶切处理,最终得到0.5、1.0、5.0、10.0、25.0、50.0、100.0μg/mL的基质混合标准工作溶液。所述基质空白样品具体为本底中不含有氨基酸序列为SFQLFGSPPGQR,VGINYWLAHK,TPEVDDEALEK三种特征性肽段的马乳样品。
所述步骤(3)中乳蛋白为乳铁蛋白、α-乳白蛋白、β-乳球蛋白中的一种或几种;
所述标准工作曲线为:
乳铁蛋白的标准工作曲线:y=53747.51702x-21822.47985,R
α-乳白蛋白的标准工作曲线:y=48652.34122x-9525.06444,R
β-乳球蛋白的标准工作曲线:y=100676.5731x-4898.46264,R
本发明的一种所述生乳中乳蛋白定量检测试剂盒的应用,所述试剂盒同时检测生乳中乳铁蛋白、α-乳白蛋白、β-乳球蛋白中的一种或几种的含量。
优选地,本发明的一种所述生乳中乳蛋白定量检测试剂盒的应用,所述试剂盒同时检测生乳中乳铁蛋白、α-乳白蛋白、β-乳球蛋白中三种的含量。
本发明方法采用高效液相色谱-串联质谱法同时检测乳铁蛋白、α-乳白蛋白和β-乳球蛋白的含量,通过乳铁蛋白、α-乳白蛋白和β-乳球蛋白经过酶解后特征性肽段特有的离子对进行定性确证,具有非常高的特异性,极大程度地降低了假阳性的发生概率。
本发明采用蛋白质酶解特征性肽段的前处理技术,通过结合液质联用法实现了同时测定生乳中乳铁蛋白、α-乳白蛋白和β-乳球蛋白的含量,仪器灵敏度达到0.5μg/mL,方法灵敏度达到0.01g/kg,样品加标回收率在85.08~103.40%,变异系数小于8.6%。本方法优化了前处理,可同时对三种化合物进行处理,缩短了近80%的前处理时间;采用外标法定量避免了特征性肽段同位素标记物的使用,大大降低了试剂成本。方法操作简单、快速、准确度和灵敏度高,且能够做到批量测定,具有良好的实际应用前景。
附图说明
图1为乳铁蛋白基质加标标准工作曲线;
图2为α-乳白蛋白基质加标标准工作曲线;
图3为β-乳球蛋白基质加标标准工作曲线;
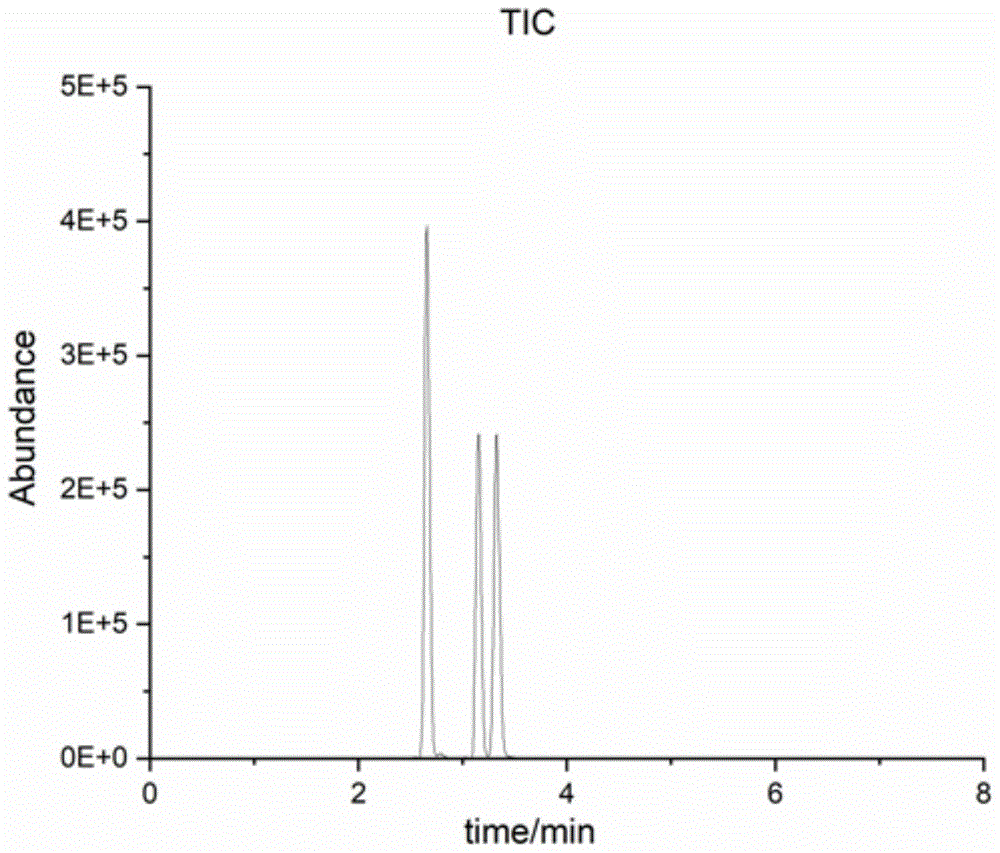
图4为乳铁蛋白、α-乳白蛋白、β-乳球蛋白特征性肽段总离子流图谱;
图5为马乳基质空白乳铁蛋白、α-乳白蛋白、β-乳球蛋白特征性肽段总离子流图谱;
图6为乳铁蛋白特征性肽段SFQLFGSPPGQR的提取离子流图;其中(a)为660.8>554.3(b)为660.8>698.4;
图7为α-乳白蛋白特征性肽段VGINYWLAHK的提取离子流图;其中(a)为600.8>355.2(b)为600.8>654.4;
图8为β-乳球蛋白特征性肽段TPEVDDEALEK的提取离子流图;其中(a)为623.3>918.4(b)为623.3>460.3。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
一、仪器、试剂与材料
高效液相色谱-串联质谱仪Agilent 6495(美国Agilent公司);恒温水浴锅HWS24(上海一恒);Milli-Q超纯水仪(美国Millipore公司)。
50ml塑料离心管;低蛋白吸附离心管;低蛋白吸附进样瓶。
水为超纯水;碳酸氢铵;二硫苏糖醇;碘代乙酰胺;牛胰蛋白酶;甲酸。
标准品:乳铁蛋白标准物质(wako,96.7%)、α-乳白蛋白标准物质(supelco,98.4%)、β-乳球蛋白标准物质(supelco,96.03%)。
实施例1
(1)前处理方法
提取:称取生乳样品2g(精确到0.01g),置于50mL离心管中,用水定容至50mL,涡旋摇匀。取200μL于低蛋白吸附离心管中,加入150μL 100mmol/L碳酸氢铵溶液,混匀备用。酶解:在提取液中加入15μL 500mmol/L二硫苏糖醇(DTT)溶液,混匀,于60℃恒温水浴1h;冷却至室温,加入30μL 500mmol/L碘代乙酰胺(IAA)溶液,暗处静置0.5h,加入50μL100μg/mL的牛胰蛋白酶溶液,混匀后置于37℃恒温水浴酶解过夜,最后加入10μL甲酸终止反应,静置15min,用水定容至1mL,10000rpm离心5min,取上清于低蛋白吸附进样瓶中,供高效液相色谱-质谱/质谱仪测定。
(2)标准溶液配制
(a)标准储备液(1mg/L):准确称取标准品10mg至10mL容量瓶中,分别用水定容至刻度,混匀,0-4℃冷藏避光保存,有效期6个月。
(b)混合标准工作液(200μg/mL):准确移取乳铁蛋白、α-乳白蛋白、β-乳球蛋白标准储备液各2.00mL至10mL容量瓶中,用空白基质(羊奶)定容至刻度,混匀,0-4℃冷藏避光保存,有效期1周。
(c)基质标准工作曲线:将混合标准工作液用空白基质(羊奶)稀释成质量浓度为0.1μg/mL、0.2μg/mL、0.5μg/mL、1.0μg/mL、5.0μg/mL、10.0μg/mL、50.0μg/mL和100.0μg/mL的系列基质标准溶液,按照前处理方法(1)进行提取和酶解,最终制备成基质标准工作曲线待液质联用怡测定,基质标准溶液应现配现用。
(3)高效液相色谱-串联质谱检测
液相色谱条件:
(a)色谱柱:Waters Acquity UPLC BEH C8柱,(2.1mm×100mm,
(b)进样体积:10μL。
(c)流速:0.3mL/min
(d)A路流动相:0.1%甲酸水溶液;B路流动相:0.1%甲酸乙腈溶液,流速及梯度洗脱见表1。
表1流动相梯度洗脱条件
质谱检测条件:
(a)离子源:电喷雾离子源(ESI);
(b)毛细管电压:4.0kV;喷嘴电压:300V;干燥气温度:200℃;鞘气温度:300℃;
(c)扫描方式:正离子扫描;
(d)检测方法:多重反应监测(MRM);
(e)干燥气流量:14L/min;鞘气流量:11L/min;雾化气压力:20psi。
(f)定量离子对、定量离子对、碰撞能量加速电压参考参数见表2。
表2目标蛋白特征肽段及MRM参数
(4)标准工作曲线的制定及定量分析
将乳铁蛋白、α-乳白蛋白、β-乳球蛋白基质混合标准工作溶液在上述液相色谱和质谱条件下进行检测,检测图谱如图8所示,将得到的目标分析物的峰面积与相应的浓度进行回归分析,得出乳铁蛋白、α-乳白蛋白和β-乳球蛋白的标准工作曲线及其回归方程,分别如图1-图3所示。
以质量浓度(x)为横坐标,以峰面积(y)为纵坐标作标准曲线,得各目标化合物的线性回归方程和相关系数(r)。结果表明,目标化合物在0.5~100μg/mL浓度范围内呈良好的线性关系,乳铁蛋白、α-乳白蛋白和β-乳球蛋白的相关系数r分别为0.99922、0.99973和0.99902。
其中所述乳铁蛋白的标准工作曲线:y=53747.51702x-21822.47985,R
所述α-乳白蛋白的标准工作曲线:y=48652.34122x-9525.06444,R
所述β-乳球蛋白的标准工作曲线:y=100676.5731x-4898.46264,R
本实施例中乳铁蛋白、α-乳白蛋白、β-乳球蛋白的检出限为0.01g/kg,定量限为0.03g/kg,具有较高的灵敏度。
本实施例中生鲜乳样品添加浓度为0.005g/kg~0.06g/kg时,乳铁蛋白的回收率在85.08~92.82%,α-乳白蛋白的回收率在85.58~103.40%,β-乳球蛋白的回收率在95.92~98.90%,可实现较高的回收率,满足化合物定量检测要求,具体详见表3。
表3乳铁蛋白、α-乳白蛋白和β-乳球蛋白含量的加标回收准确度
本实施例中对随机选取一生鲜乳样品进行重复性试验,乳铁蛋白的变异系数为3.0%,α-乳白蛋白的变异系数为2.1%,β-乳球蛋白的变异系数为3.5%,具有较好的重复性和稳定性,具体详见表4。
表4:乳铁蛋白、α-乳白蛋白和β-乳球蛋白含量的精密度
