丹参、黄芪成分组合物及制剂协同PD-1抑制剂抗肝癌的应用
文献发布时间:2023-06-19 19:23:34
技术领域
本发明属于生物医药技术领域,具体涉及丹参、黄芪成分组合物及其制剂在协同PD-1 抑制剂抗肝癌增效中的应用。
背景技术
目前,临床上针对肝癌的治疗方式主要有手术、放疗、化疗等,但仅对早期肝癌患者有效。大多数肝癌患者确诊时已是晚期,缺乏有效的治疗手段。近年来,以PD-1抑制剂为代表的免疫检查点阻断疗法,给晚期肝癌患者治疗带来了新的希望。然而,由异常肿瘤血管和肿瘤浸润性T 淋巴细胞(TILs)功能异常等肿瘤微环境因素引起的TILs数量和活性的不足,导致了PD-1 抑制剂在临床上存在客观响应率低等问题,严重限制了其抗肝癌疗效的发挥和进一步的应用。
丹参酮ⅡA(Tanshinone IIA,TSA)和黄芪甲苷(Astragaloside IV,As)是中药丹参和黄芪中主要有效成分,文献和我们的研究表明,二者具有良好的调控血管正常化和免疫调节作用。其中,丹参酮IIA可抑制促血管生成因子VEGF的分泌,显著增加微血管密度和完整性,促进肿瘤血管正常化从而促进TILs浸润以抑制肝癌细胞;黄芪甲苷可抑制肿瘤细胞生长,增强细胞毒性T淋巴细胞、巨噬细胞和树突状细胞免疫功能,改善免疫抑制微环境。
经检索,现有技术已有对丹参酮ⅡA或黄芪甲苷抗肿瘤或辅助抗肿瘤的相关报道。
有关丹参酮ⅡA的中国专利有:三七总皂苷联合丹参酮ⅡA在制备预防结直肠癌药物中的应用(CN201910576085),一种同源重组外泌体多药递送的仿生纳米粒及其制备方法和应用 (CN202210180491),一种靶向肽修饰的中药多组分“外泌体样”融合纳米粒及其制备方法和应用(CN202111204735),一种治疗肝癌的药物组合物及其应用(CN201810845662),丹参酮类化合物在制备抗肿瘤药物中的应用(CN201710148655),由肿瘤微环境控制粒径大小及药物释放的多组分脂质复合系统、其制备方法与应用(CN201610882317),一种丹参提取物及其在制备抗肿瘤药物中的应用(CN201610786749),一种丹参酮ⅡA-聚乳酸羟基乙酸微球用于制备抗肿瘤药物的用途(CN201310022772),一种载丹参酮IIA的纳米给药系统的制备方法及用途(CN201310076397)。
有关黄芪甲苷的中国专利有:一种活血化瘀中药组合物及其应用(CN201911095186.2),一种含有大黄总蒽醌的药物组合物及其制药用途CN201410170923,黄芪甲苷与奥沙利铂的组合在制备抗肿瘤药物中的用途(CN201910632861.4),一种能抑制与肿瘤相关的细胞因子的中药组合物及应用(CN201710146178),免疫刺激组合物及其用途(CN202011456366.1),一种抗肿瘤注射制剂的检测方法(CN201711436366.3),治疗因癌症放化疗所致白细胞减少中药新药及制备方法(CN201210023511.6),用于肝癌的新复方辅助治疗药物 (CN201410434469.6),一种治疗癌症的药物组合物及制备方法和用途(CN201310698698.4),治疗癌症的药物组合物、药物制剂及应用和制法(CN201110158035)。
现有文献也有分别对丹参酮ⅡA与黄芪甲苷抗肝癌或辅助抗肝癌作用的报道。但现有技术尚无将丹参酮ⅡA与黄芪甲苷两者按照特定的比例配伍并用于提升PD-1抑制剂抗肝癌效果的报道,且目前尚无将二者共载于同一纳米制剂的报道,也无使用金属有机骨架(MOF)载药系统共递送二者至肿瘤组织的报道。
发明内容
本发明的第一目的是提供一种丹参、黄芪成分组合物在协同PD-1抑制剂抗肝癌增效中的应用。
所述丹参、黄芪成分组合物为丹参活性成分丹参酮ⅡA、黄芪活性成分黄芪甲苷配伍的组合物。
作为一种优选的实施方式,所述丹参酮ⅡA与黄芪甲苷的质量比为4:1~1:1,优选4:1或 1:1。
作为一种优选的实施方式,所述组合物还包括丹参酮ⅡA、黄芪甲苷配伍组合物药学上可接受的载体。即可将所述组合物制成制剂后递送药物。
作为一种优选的实施方式,所述载体为铁基MOF(Fe·MOF)或微乳。
本发明将难溶性药物丹参酮ⅡA和黄芪甲苷二者以特定比例配伍并制备成纳米制剂,提高二者的溶解性和生物利用度,可以将二者共同递送至肿瘤组织中,和PD-1抑制剂联用可以显著提高PD-1抑制剂的抗肿瘤疗效。
本发明的另一目的在于提供一种协同PD-1抑制剂抗肿瘤增效的纳米制剂,其包括丹参酮ⅡA、黄芪甲苷配伍的组合物及其药学上可接受的载体。
作为一种优选的实施方式,所述载体为铁基MOF。共载难溶性药物丹参酮ⅡA和黄芪甲苷的纳米制剂,由丹参酮ⅡA和黄芪甲苷作为原料药,以金属铁和有机配体构建的MOF系统作为药物载体,并使用表面修饰改善靶向肝癌组织能力。
所述纳米制剂的制备方式包括:由金属节点经有机配体连接构成铁基MOF,将铁基MOF 活化后置于以活性成分配伍组合物为溶质的溶液中进行载药,获取载药纳米制剂,对载药纳米制剂利用表面修饰材料修饰,获得成品纳米制剂;
其中,上述制备方式的原料包括如下质量份的组分:
活性成分配伍组合物40-239份,金属节点12-112份,有机配体48-118份,表面修饰材料15-120份;所述以活性成分配伍组合物为溶质的溶液中,溶质和溶剂的质量比浓度为0.004~0.79%(w/w)。作为一种优选的实施方式,所述金属节点采用Fe
所述有机配体采用均苯三甲酸、对苯二甲酸和2-氨基对苯二甲酸中的一种,优选均苯三甲酸。
所述表面修饰材料采用红细胞膜、肝癌细胞膜、透明质酸中的一种,优选肝癌细胞膜。
作为一种实施方案,铁基MOF通过水热合成法制备。
作为一种实施方式,微乳通过水滴定法制备。以油相内核荷载难溶性药物丹参酮ⅡA、黄芪甲苷,并通过EPR效应被动靶向肝癌组织。
所述纳米制剂包括如下质量份的组分:
活性成分配伍组合物2-10份,油相200-400份,表面活性剂450-525份,助表面活性剂 150-175份,水7000~10000份。
作为一种优选的实施方式,所述油相为长链油或长链油与短链油组成的混合物;
所述长链油为肉豆蔻酸异丙酯、油酸乙酯中的一种;
所述长链油与短链油组成的混合物为油酸乙酯和甘油三乙酸酯、油酸乙酯和甘油三丙酸酯、油酸乙酯和甘油三丁酸酯中的一种,优选油酸乙酯和甘油三丙酸酯组成的混合物;
所述表面活性剂为聚氧乙烯氢化蓖麻油、聚乙二醇羟基硬脂酸酯中的一种,优选聚氧乙烯氢化蓖麻油;
所述助表面活性剂选用聚乙二醇300、聚乙二醇400中的一种,优选聚乙二醇300。
作为一种优选的实施方式,所述油相为甘油三丙酸酯和油酸乙酯按质量比1~3:1形成的混合油相;优选质量比1:1。
本课题组经过长期大量的实验研究发现,丹参酮ⅡA可抑制促血管生成因子VEGF的分泌和血管生成素ANGPT2表达,改善内皮细胞功能,显著降低肿瘤血管的渗漏,增加微血管密度和完整性,具有明显的促肿瘤血管正常化的作用。黄芪甲苷具有促进T淋巴细胞活性,改善免疫抑制微环境的作用。在体外实验中二者以特定比例联合使用显示出极强的促血管正常化与提高肿瘤浸润性T细胞浸润和活性的作用。联合PD-1抑制剂后,抗肿瘤疗效的改善显著优于单一药物,显示出极强的协同抗肿瘤作用。经处方优选,丹参酮ⅡA和黄芪甲苷通过特定比例配伍的组合物具有开发成提高PD-1抑制剂抗肿瘤疗效药物的应用前景。
由于丹参酮ⅡA和黄芪甲苷水溶性差,存在代谢速度快、生物利用度低及体内组织分布靶向性差的问题,因此如何提高二者的溶解度及生物利用度并共递送至肿瘤组织内极具挑战。
铁基MOF是由金属Fe作为节点与有机配体自组装形成的金属-有机框架(Metal-Organic Frameworks,MOF),具有高孔隙率和大比表面积的特点,为药物荷载提供了巨大的空间。由金属节点和有机配体组成的MOF系统能够在肿瘤酸性和还原性的微环境下通过配位键的断裂实现药物的释放,具有较高的安全性。此外,利用磁性Fe
微乳是一种由油相、水相、表面活性剂、助表面活性剂混合自发组成的光学各向同性和热力学稳定的胶体溶液。微乳可以提高难溶性药物的溶解度,提高药物的生物利用度,可凭借纳米尺度,使其通过EPR效应(肿瘤组织增强通透性和滞留效应)被动地聚集于病变部位,增强药物的靶向递送能力。
本发明所述中药活性成分配伍组合物、制剂及应用的有益效果表现在如下几方面:
1、本发明将丹参中主要成分丹参酮ⅡA和黄芪中主要成分黄芪甲苷以特定的比例配伍,并与PD-1抑制剂联用,发挥协同的抗肿瘤药效。
2、本发明采用的纳米给药系统能够显著提高难溶性药物的溶解度。
3、本发明使用金属节点和有机配体构建的纳米给药系统,实现了难溶性药物丹参酮ⅡA 和黄芪甲苷的共载并解决了二者载药量低的问题。
4、本发明采用磁性铁基MOF作为药物载体,并在其表面修饰以肿瘤细胞膜等表面修饰物,具有磁靶向、同源靶向的双重优势,能够实现对肿瘤的精准高效递送,克服了丹参酮ⅡA 和黄芪甲苷体内组织分布靶向性差的缺陷。
5、本发明采用MOF系统作为药物载体,利用其环境响应性的特性,实现药物在肿瘤组织的高效释放,提高药物的生物利用度。
6、本发明采用水滴定法制备微乳给药系统,制备工艺技术成熟,有利于工业化生产,临床转化前景广阔。
附图说明
图1为丹参酮ⅡA和黄芪甲苷的化学结构式。
图2为实施例1中不同浓度丹参酮ⅡA对HUVEC人脐静脉内皮细胞垂直迁移的影响(n=3,
图3为实施例2中不同浓度丹参酮ⅡA对内皮细胞渗漏的影响(n=3,
图4为实施例3中不同浓度丹参酮ⅡA对T细胞跨内皮细胞迁移的影响(n=3,
图5为实施例4中不同浓度黄芪甲苷对CTLL-2小鼠T细胞IL-2分泌的影响(n=3,
图6为实施例5中不同配伍比例和浓度的丹参酮ⅡA与黄芪甲苷单药及二者组合物对 CTLL-2小鼠T细胞活性的影响(n=6,
图7为实施例6中不同配伍比例和浓度的丹参酮ⅡA与黄芪甲苷组合物对Jurkat细胞活性的影响(n=6,
图8为实施例7中不同配伍比例和浓度的丹参酮ⅡA与黄芪甲苷组合物对HUVEC人脐静脉内皮细胞迁移的影响(n=3,Scale bar:50μm)。
图9为实施例7中不同配伍比例和浓度的丹参酮ⅡA与黄芪甲苷组合物对HUVEC人脐静脉内皮细胞迁移的影响(n=3,
图10为实施例8中得到的铁基MOF粒径分布与zeta电位图。
图11为实施例8中得到的铁基MOF扫描电镜图。
图12为实施例10中得到的微乳粒径分布与zeta电位图。
图13为实施例12中共载丹参酮ⅡA与黄芪甲苷Fe·MOF对CTLL-2小鼠T细胞活性的影响(n=6,
图14为实施例13中共载丹参酮ⅡA与黄芪甲苷Fe·MOF对bEnd.3小鼠内皮细胞活性的影响(n=6,
图15为实施例14中使用本发明组合物及纳米制剂与PD-1抑制剂联合治疗H
图16为实施例14中使用本发明组合物及纳米制剂与PD-1抑制剂联合治疗H
图17为实施例14中使用本发明组合物及纳米制剂与PD-1抑制剂联合治疗H
图18为实施例14中使用本发明组合物及纳米制剂与PD-1抑制剂联合治疗H
图19为实施例14中使用本发明组合物及纳米制剂与PD-1抑制剂联合治疗H
图20为实施例14中使用本发明组合物及纳米制剂与PD-1抑制剂联合治疗H
具体实施方式
实施例涉及药品、试剂、细胞、仪器来源如下:
实验细胞:CTLL-2小鼠T细胞、Jurkat细胞(人T淋巴母细胞瘤细胞)、H
实验动物:SPF级,雄性C57BL/6小鼠,60只,4周龄,购自江苏集萃药康生物技术股份有限公司。实验动物许可证号:SCXK(苏)2018-0008。实验动物饲养于江苏省中医药研究院实验动物中心屏障环境内[实验单位使用许可证号:SYXK(苏)2016-0018,实验严格遵守实验动物伦理学相关条例]。光照时间12h,恒温(20~26℃),恒湿(40%~70%RH),自由饮水,采食全价标准饲料。适应性饲养7天后开始实验。
药品与试剂:丹参酮ⅡA、黄芪甲苷(HPLC≥98%,源叶生物);吐温80、四甲基偶氮唑蓝(MTT)、胶原酶Ⅰ、胶原酶Ⅳ、DNA酶Ⅰ、透明质酸酶(Biofroxx);Zombie Aqua FixableViability kit、APC-cy7 anti-mouse CD45、APC anti-mouse CD3、PE-cy7 anti-mouseCD4、PE anti-mouse CD8(Biolegend);注射用鼠源PD-1抗体(Bioxcell);甘油三丙酸酯、FeCl
仪器:Mutiskan Go型酶标仪、ST16R型离心机、311型CO
实施例1:不同浓度丹参酮ⅡA对HUVEC人脐静脉内皮细胞垂直迁移的影响
HUVEC细胞饥饿12-24h后,消化离心用含不同浓度的丹参酮ⅡA无血清培养基重悬。 Transwell小室上室以每孔1×10
结果:丹参酮ⅡA浓度为1~2μg/mL,对HUVEC人脐静脉内皮细胞垂直迁移具有明显的抑制作用(如图2),表明丹参酮ⅡA具有一定的抑制血管生成作用。
实施例2:不同浓度丹参酮ⅡA对内皮细胞渗漏的影响
Transwell上室先接种5×10
结果:丹参酮ⅡA浓度为2μg/mL时,相比于模型组,下室液体的FITC荧光强度最低(如图3),表明丹参酮ⅡA对肿瘤微环境引起的内皮细胞的渗漏具有明显的改善作用。
结合实施例1可知,丹参酮ⅡA可以抑制内皮细胞迁移,改善内皮细胞功能,具有一定的促肿瘤血管正常化作用。
实施例3:不同浓度丹参酮ⅡA对T细胞跨内皮细胞迁移的影响
bEnd.3细胞消化离心重悬后以1×10
结果:丹参酮ⅡA浓度为1~4μg/mL时,下室的T细胞数量与模型组相比显著升高(如图4),表明丹参酮ⅡA对T细胞跨内皮细胞迁移具有促进作用。
结合实施例1、2可知,丹参酮ⅡA是具有调节肿瘤血管正常化,促进T细胞浸润作用的中药活性成分。
实施例4:不同浓度的黄芪甲苷对CTLL-2小鼠T细胞IL-2分泌的影响
采用Transwell共培养24孔板,上室种H
结果:黄芪甲苷浓度为2.5μg/mL时,CTLL-2细胞IL-2分泌量增加(如图5)。IL-2能够活化T细胞,诱导细胞毒作用,表明黄芪甲苷可以在肿瘤微环境中增加促进T淋巴细胞活化和杀伤肿瘤。
结合实施例1、2、3可知,丹参酮ⅡA能够改善肿瘤血管正常化,促进T淋巴细胞浸润,黄芪甲苷能够促进T细胞活性并介导杀伤肿瘤。因此我们推测丹参酮ⅡA和黄芪甲苷有望协同提高PD-1抑制剂抗肝癌效果。
实施例5:不同配伍比例和浓度的丹参酮ⅡA与黄芪甲苷对CTLL-2小鼠T细胞活性的影响
取对数生长期的CTLL-2细胞,以1×10
孵育结束后,每孔加入10μL CCK8试剂,继续孵育1.5h后,酶标仪测定450nm处吸光度。并计算相对细胞活性(相对细胞活性=(给药孔吸光度-培养基吸光度)/(空白组吸光度-培养基吸光度))。
结果:丹参酮ⅡA与黄芪甲苷单药没有显著促进小鼠T细胞的活性,质量比为4:1、2:1、 1:1、1:3的丹参酮ⅡA与黄芪甲苷组合物浓度为0.25、0.5μg/mL时(以黄芪甲苷浓度计),能显著提高小鼠T细胞的活性(如图6,P<0.05),质量比为1:1的丹参酮ⅡA与黄芪甲苷组合物浓度为1μg/mL(以黄芪甲苷浓度计)时,能显著提高小鼠T细胞的活性(如图7,P<0.001)。
结果表明相比于单药,质量比为4:1、2:1、1:1、1:3丹参酮ⅡA与黄芪甲苷组合物能够更有效地提高小鼠T细胞的活性。
实施例6:不同配伍比例和浓度的丹参酮ⅡA与黄芪甲苷对Jurkat细胞活性的影响
取对数生长期的Jurkat细胞,以1×10
孵育结束后,每孔加入10μL CCK8试剂,继续孵育1.5h后,酶标仪测定450nm处吸光度。并计算相对细胞活性(相对细胞活性=(给药孔吸光度-培养基吸光度)/(空白组吸光度-培养基吸光度))。
结果:质量比为3:1、1:1、1:3、1:5的丹参酮ⅡA与黄芪甲苷组合物浓度为0.25、0.5、2、 4μg/mL时,能显著提高小鼠T细胞的活性(如图7,P<0.05),质量比为4:1、1:1的丹参酮ⅡA与黄芪甲苷组合物浓度为0.25、2μg/mL时(以黄芪甲苷浓度计),能显著提高小鼠T细胞的活性(如图7,P<0.01),质量比为4:1、3:1、1:1的丹参酮ⅡA与黄芪甲苷组合物浓度为0.5、1、2、4μg/mL时,能显著提高小鼠T细胞的活性(如图7,P<0.001)。
结果表明相比于单药,质量比为4:1、3:1、1:1、1:3、1:5丹参酮ⅡA与黄芪甲苷组合物均对Jurkat细胞活性具有明显的促进作用,其中质量比为4:1、3:1、1:1丹参酮ⅡA与黄芪甲苷组合物具有更明显地促进T细胞的活性作用。
结合实施例5可知,当丹参酮ⅡA和黄芪甲苷二者以一定质量比(4:1、1:1)组合时,可以促进T细胞活性,可用于协同PD-1抑制剂提升抗肿瘤效果。
实施例7:不同配伍比例和浓度的丹参酮ⅡA与黄芪甲苷对HUVEC人脐静脉内皮细胞迁移的影响
六孔板中种HUVEC细胞,加入丝裂霉素C处理2h后,垂直于板底横线竖直划出一条直线,PBS清洗2遍,分别添加不同浓度的丹参酮ⅡA、黄芪甲苷、丹参酮ⅡA与黄芪甲苷组合物(质量比为1:1、2:1、3:1和4:1,以黄芪甲苷计浓度为0.5、1、2μg/mL)的含药培养基。显微镜下拍摄给药0h,24h细胞水平迁移的照片,使用Image J进行分析统计,并计算划痕愈合率(划痕愈合率=(0h划痕面积-24h划痕面积)/0h划痕面积×100%),考察药物对细胞水平迁移的影响,如图8所示。
结果:丹参酮ⅡA单药、丹参酮ⅡA与黄芪甲苷的组合物(质量比为4:1)均对HUVEC细胞具有明显的抑制迁移作用(如图9,P<0.001),且丹参酮ⅡA与黄芪甲苷的组合物相比于丹参酮ⅡA单药抑制迁移作用效果更好。
结合实施例5、6可知,当丹参酮ⅡA和黄芪甲苷二者以一定质量比(4:1、1:1)组合时,可以促进T细胞(CTLL-2鼠T细胞和Jurkat细胞)活性。当丹参酮ⅡA和黄芪甲苷比例为4:1 时,对HUVEC细胞具有明显的抑制迁移作用,表现为一定的抑制血管生成作用。因此,丹参酮ⅡA和黄芪甲苷组合物改善肿瘤微环境,协同PD-1抑制剂提升抗肿瘤效果的最佳比例为4:1。
实施例8:共载丹参酮ⅡA与黄芪甲苷的Fe·MOF纳米制剂制备及性能测试
取FeCl
取丹参酮ⅡA 48份,黄芪甲苷12份,Fe
共载丹参酮ⅡA与黄芪甲苷的Fe·MOF纳米制剂的粒径分布与zeta电位图及扫描电镜图分别如图10、11所示。
实施例9:共载丹参酮ⅡA与黄芪甲苷的Fe·MOF纳米系统的制备
本实施例实验了不同处方对共载丹参酮ⅡA与黄芪甲苷Fe·MOF纳米系统的影响。
处方1:12份Fe
处方2:12份Fe
处方3:12份Fe
处方4:12份Fe
处方5:12份Fe
处方6:12份Fe
处方7:将5份Fe
处方8:将12份Fe
处方9:15份Fe
处方10:12份Fe
处方11:12份Fe
结果显示,在活性成分配伍组合物40-239份,金属节点12-112份,有机配体48-128份,表面修饰材料15-120份;所述以活性成分配伍组合物为溶质的溶液中,溶质和溶剂的质量比浓度为0.044~0.79%(w/w)的条件下均可制得共载丹参酮ⅡA与黄芪甲苷的Fe·MOF纳米系统。
实施例10:共载丹参酮ⅡA与黄芪甲苷的微乳纳米制剂制备及性能测试
取300份甘油三丙酸-油酸乙酯(1:1)加入至450份表面活性剂RH 40中,再取150份助表面活性剂PEG-300至上述混合体系中,然后取黄芪甲苷1份、丹参酮ⅡA4份加入上述制备的混合体系中,磁力搅拌8h,直到无不溶物悬浮于体系,备用;最后将10000份去离子水恒速、缓慢的定量加入到上述制备的混合体系中,并不断匀速搅拌,直至出现透亮澄明的体系,即为丹参酮ⅡA与黄芪甲苷共载微乳,DLS测定粒径和电位。
结果:丹参酮ⅡA与黄芪甲苷共载微乳粒径分布与电位结果如图12所示。
实施例11:共载丹参酮ⅡA与黄芪甲苷微乳的制备
本实施例实验了不同处方对共载丹参酮ⅡA与黄芪甲苷微乳系统的影响。
处方1:取300份甘油三丙酸-油酸乙酯(1:1)加入至450份表面活性剂RH 40(聚氧乙烯氢化蓖麻油-40)中,再取150份助表面活性剂PEG-300至上述混合体系中,然后取黄芪甲苷2份、丹参酮ⅡA8份加入上述制备的混合体系中,磁力搅拌8h,直到无不溶物悬浮于体系,备用;最后将10000份去离子水恒速、缓慢的定量加入到上述制备的混合体系中,并不断匀速搅拌,直至出现透亮澄明的体系,即为丹参酮ⅡA与黄芪甲苷共载微乳。
处方2:取400份甘油三丙酸-油酸乙酯(1:1)加入至500份表面活性剂RH 40中,再取 175份助表面活性剂PEG-300至上述混合体系中,然后取黄芪甲苷1份、丹参酮ⅡA3份加入上述制备的混合体系中,磁力搅拌8h,直到无不溶物悬浮于体系,备用;最后将10000份去离子水恒速、缓慢的定量加入到上述制备的混合体系中,并不断匀速搅拌,直至出现透亮澄明的体系,即为丹参酮ⅡA与黄芪甲苷共载微乳。
处方3:取350份甘油三丙酸-油酸乙酯(3:1)加入至525份表面活性剂RH 40中,再取 150份助表面活性剂PEG-400至上述混合体系中,然后取黄芪甲苷1份、丹参酮ⅡA1份加入上述制备的混合体系中,磁力搅拌8h,直到无不溶物悬浮于体系,备用;最后将7000份去离子水恒速、缓慢的定量加入到上述制备的混合体系中,并不断匀速搅拌,直至出现透亮澄明的体系,即为丹参酮ⅡA与黄芪甲苷共载微乳。
处方4:取320份甘油三丙酸-油酸乙酯(2:1)加入至510份表面活性剂HS 15(聚乙二醇羟基硬脂酸酯)中,再取170份助表面活性剂PEG-300至上述混合体系中,然后取黄芪甲苷2份、丹参酮ⅡA5份加入上述制备的混合体系中,磁力搅拌8h,直到无不溶物悬浮于体系,备用;最后将10000份去离子水恒速、缓慢的定量加入到上述制备的混合体系中,并不断匀速搅拌,直至出现透亮澄明的体系,即为丹参酮ⅡA与黄芪甲苷共载微乳。
处方5:取350份油酸乙酯加入至490份表面活性剂HS 15(聚乙二醇羟基硬脂酸酯)中,再取160份助表面活性剂PEG-400至上述混合体系中,然后取黄芪甲苷2份、丹参酮ⅡA2份加入上述制备的混合体系中,磁力搅拌8h,直到无不溶物悬浮于体系,备用;最后将10000份去离子水恒速、缓慢的定量加入到上述制备的混合体系中,并不断匀速搅拌,直至出现透亮澄明的体系,即为丹参酮ⅡA与黄芪甲苷共载微乳。
处方6:取350份肉豆蔻酸异丙酯加入至490份表面活性剂HS 15中,再取160份助表面活性剂PEG-400至上述混合体系中,然后取黄芪甲苷2份、丹参酮ⅡA4份加入上述制备的混合体系中,磁力搅拌8h,直到无不溶物悬浮于体系,备用;最后将10000份去离子水恒速、缓慢的定量加入到上述制备的混合体系中,并不断匀速搅拌,直至出现透亮澄明的体系,即为丹参酮ⅡA与黄芪甲苷共载微乳。
结果显示:中药活性组分2~10份,油相200份-400份,表面活性剂400-525份,助表面活性剂150-400份,水7000~10000份均可制得丹参酮ⅡA-黄芪甲苷共载微乳给药系统。
实施例12:共载丹参酮ⅡA与黄芪甲苷的Hm-TSA-As-Fe·MOF对CTLL-2小鼠T细胞活性的影响
考察实施例8制备的Hm-TSA-As-Fe·MOF对CTLL-2小鼠T细胞活性的影响,取对数生长期的CTLL-2细胞,以1×10
孵育结束后,每孔加入10μL CCK8试剂,继续孵育1.5h后,酶标仪测定450nm处吸光度。并计算相对细胞活性(相对细胞活性=(给药孔吸光度-培养基吸光度)/(空白组吸光度-培养基吸光度))。
结果:0~125μg/mL Hm-TSA-As-Fe·MOF对CTLL-2小鼠T细胞的活性没有明显的细胞毒性作用,而且0~62.5μg/mL Hm-TSA-As-Fe·MOF对小鼠T细胞的活性有促进作用(如图13)。
结果表明Hm-TSA-As-Fe·MOF具有良好的安全性,且对CTLL-2小鼠T细胞的活性有促进作用。
实施例13:共载丹参酮ⅡA与黄芪甲苷的Hm-TSA-As-Fe·MOF对bEnd.3小鼠内皮细胞活性的影响
考察实施例8制备的Hm-TSA-As-Fe·MOF对bEnd.3小鼠内皮细胞活性的影响,取生存状况良好的bEnd.3细胞,使用含10%胎牛血清的DMEM完全培养基调整细胞浓度,并以1×10
孵育结束后,每孔加入10μL MTT,孵育4h后弃去上清液,每孔加入150μL DMSO,避光振荡10min后于490nm处测吸光度。并计算相对细胞活性(相对细胞活性=(给药孔吸光度-培养基吸光度)/(空白组吸光度-培养基吸光度))。
结果:Hm-TSA-As-Fe·MOF的浓度为3.9~62.5μg/mL可显著抑制bEnd.3细胞的增殖(如图14),表明Hm-TSA-As-Fe·MOF有一定的抑制血管生成作用。
结合实施例12可知,Hm-TSA-As-Fe·MOF具有较好的安全性,不仅能够促进T细胞活性,还有一定的促血管正常化的作用,表明Hm-TSA-As-Fe·MOF是理想的共载丹参酮ⅡA与黄芪甲苷制剂。
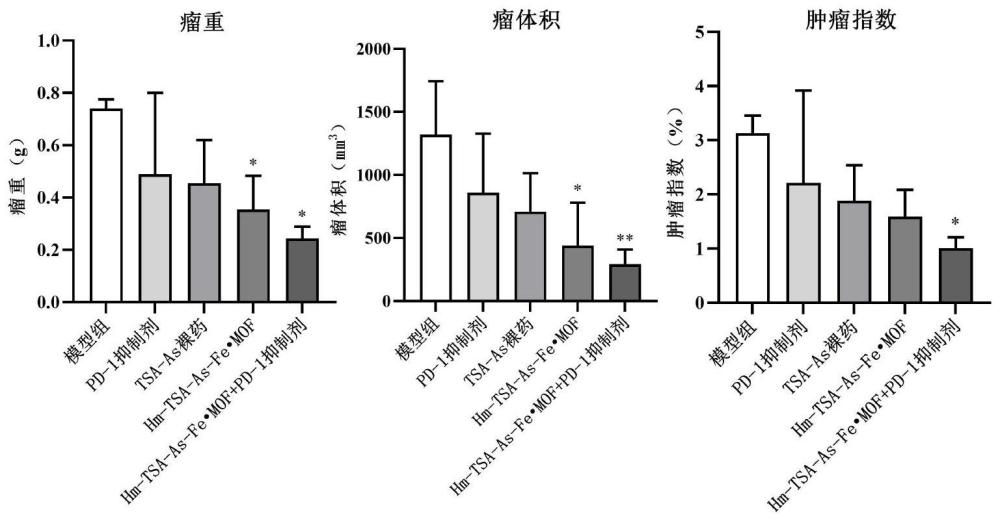
实施例14:丹参酮ⅡA-黄芪甲苷纳米递药系统联合PD-1抑制剂抗原位肝癌药效学实验
考察实施例8制备的Hm-TSA-As-Fe·MOF联合PD-1抑制剂抗原位肝癌效果,将H
结果:
Hm-TSA-As-Fe·MOF与PD-1抑制剂联合应用组的瘤重、瘤体积、肿瘤指数均显著低于模型组(P<0.05),且Hm-TSA-As-Fe·MOF与PD-1抑制剂联合应用组瘤重、瘤体积、肿瘤指数均小于PD-1抑制剂组(如图15)。
流式分析结果显示,与模型组相比,Hm-TSA-As-Fe·MOF与PD-1抑制剂联合应用组小鼠肿瘤组织CD45
免疫荧光结果显示,与模型组相比,Hm-TSA-As-Fe·MOF与PD-1抑制剂联合应用组小鼠瘤内CD4
免疫组化结果显示,与模型组相比,Hm-TSA-As-Fe·MOF与PD-1抑制剂联合应用组小鼠瘤内颗粒酶B阳性区域最多;苏木精-伊红染色法结果显示组织无其他病变(如图20)。
结果表明丹参酮ⅡA-黄芪甲苷纳米递药系统(Hm-TSA-As-Fe·MOF)能够抑制肝癌原位肿瘤生长,与PD-1抑制剂协同作用,有效提高了PD-1抑制剂的抗肿瘤疗效。此外, Hm-TSA-As-Fe·MOF与PD-1抑制剂协同作用,有效提高了肿瘤组织内淋巴细胞的水平,增加了肿瘤浸润T淋巴细胞的数量和浸润,并提高了肿瘤浸润T淋巴细胞的活性,改善了肿瘤免疫抑制的微环境,抑制肿瘤生长。
- 中药成分组合物及其制剂在协同PD-1抑制剂抗肿瘤中的应用
- MLL-menin抑制剂组合物在制备抗肝癌药物中的应用
