一种糖基转移酶融合酶变体及其在AA-2G制备中的应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及一种糖基转移酶融合酶变体及其在AA-2G制备中的应用,属于酶工程技术领域。
背景技术
目前L-抗坏血酸-2-葡萄苷(AA-2G)生产几乎都是采用酶催化,所用的酶主要是环糊精葡萄糖基转移酶(CGTase)和蔗糖磷酸化酶,前者所用糖基供体主要有液化淀粉、麦芽糊精、环糊精等,后者所用供体为蔗糖,糖基受体均为维生素C。与蔗糖磷酸化酶不同的是,采用环糊精葡萄糖基转移酶催化生产AA-2G通常以β-环糊精、液化淀粉或麦芽糊精为糖基供体,以维生素C为受体,在一定的温度和pH条件下进行反应,此时反应过程中会有大量的AA-2Gn以及AA-2G,需要在催化结束后通过加入糖化酶进一步糖化处理,将AA-2Gn上多余的糖基切除得到AA-2G,完成催化反应。
然而现有技术中的CGTase催化效率较低,AA-2G酶催化制备周期普遍较长(需要24~72h),此外,反应还存在严重的平衡问题,AA-2G收率最高仅能达到40-60%左右。
发明内容
本发明提供了一种环糊精葡萄糖基转移酶融合酶,含有SEQ ID NO.1所示的氨基酸序列。
本发明还提供了环糊精葡萄糖基转移酶融合酶突变体,是在SEQ ID NO.1所示的融合酶的基础上,将第46位亮氨酸、第152位酪氨酸、第190位甘氨酸、第269位天冬酰胺、第325位异亮氨酸中第一个或多个位点进行了突变。
在一种实施方式中,所述突变体是将第46位亮氨酸突变为苯丙氨酸,获得突变体L46F。
在一种实施方式中,所述突变体是将第152位酪氨酸突变为甘氨酸,获得突变体Y152G。
在一种实施方式中,所述突变体是将第190位甘氨酸突变为色氨酸,获得突变体G190W。
在一种实施方式中,所述突变体是将第269位天冬酰胺突变为丙氨酸,获得突变体N269A。
在一种实施方式中,所述突变体是将第325位异亮氨酸突变为赖氨酸,获得突变体I325K。
在一种实施方式中,所述突变体是将第46位亮氨酸突变为苯丙氨酸,并将第152位酪氨酸突变为甘氨酸,并将第269位天冬酰胺突变为丙氨酸,并将第325位异亮氨酸突变为赖氨酸,获得突变体L46F/Y152G/N269A/I325K。
在一种实施方式中,所述突变体是将第46位亮氨酸突变为苯丙氨酸,并将第190位甘氨酸突变为色氨酸,并将第325位异亮氨酸突变为赖氨酸,获得突变体L46F/G190W/I325K。
在一种实施方式中,所述突变体是将第46位亮氨酸突变为苯丙氨酸,并将第152位酪氨酸突变为甘氨酸,并将第325位异亮氨酸突变为赖氨酸,获得突变体L46F/Y152G/I325K。
本发明还提供了编码所述融合酶或所述融合酶突变体的基因。
在一种实施方式中,编码所述融合酶的基因含有SEQ ID NO.2所示的核苷酸序列。
本发明还提供了携带所述基因的重组质粒。
在一种实施方式中,所述质粒包括但不限于pET系列质粒。
本发明还提供了表达所述融合酶或融合酶突变体的重组微生物细胞。
在一种实施方式中,所述微生物包括但不限于大肠杆菌。
在一种实施方式中,所述微生物细胞是以大肠杆菌为宿主,以pET-28a(+)为表达载体,表达所述突变体。
本发明还提供含有所述微生物细胞的细胞催化剂。
在一种实施方式中,所述细胞催化剂是将所述重组微生物细胞在培养基中培养一段时间,收集具有环糊精葡萄糖基转移酶活性的细胞培养液。
在一种实施方式中,所述细胞催化剂按如下方法制备:将所述重组微生物在培养基中培养至菌液OD达到0.6~0.8,加入IPTG诱导酶的表达,诱导一段时间后收集菌体,得到细胞催化剂。
在一种实施方式中,所述培养基为LB培养基或TB培养基。
在一种实施方式中,所述诱导剂的添加量为0.05~0.15mmol/L。
在一种实施方式中,所述诱导是在20~25℃诱导20~28h。
本发明还提供所述突变体或所述细胞催化剂在催化生产L-抗坏血酸-2-葡萄苷中的应用。
在一种实施方式中,所述应用是将所述突变体或所述细胞催化剂在含β-环糊精和L-抗坏血酸的反应体系中催化合成L-抗坏血酸-2-葡萄苷。
在一种实施方式中,所述应用是以β-环糊精为糖基供体,以抗坏血酸为受体,以所述环糊精葡萄糖基转移酶融合酶或所述环糊精葡萄糖基转移酶融合酶突变体或所述细胞催化剂催化反应3~10h,再加入糖化酶反应至少4h。
在一种实施方式中,所述应用是以β-环糊精为糖基供体,以抗坏血酸为受体,先采用细胞催化剂在25~30℃反应3~10小时,再升温至50℃并使用糖化酶反应至少4小时。
在一种实施方式中,所述β-环糊精和抗坏血酸的质量比为1:0.8~1.2。
有益效果:
1、本发明通过将CGTase-Tx的前1-331段氨基酸和CGTase-Bs的后327-681段氨基酸融合,得到CGTase-TB变体,催化效率较CGTase-Tx进一步提高,AA-2G收率更高,且无副产物产生。
2、本发明对融合突变体CGTase-TB进行了进一步突变,使突变体的催化活性较之其亲本进一步提升,AA-2G收率进一步提升至70%以上,比活力达9.21~19.53U/mg;且突变体的热稳定性相对亲本明显提高,在70℃处理4小时,酶的活性仍有90%残留。
附图说明
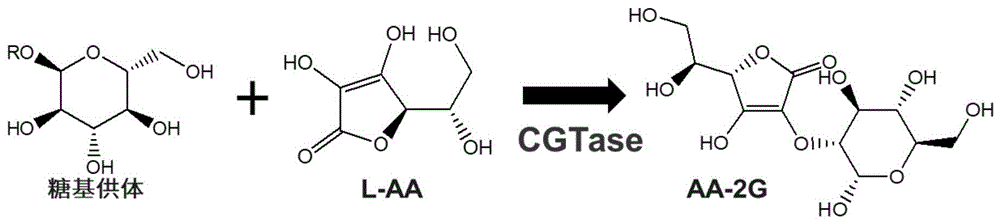
图1为CGTase催化生产AA-2G示意图。
具体实施方式
下面结合具体实施例,进一步阐明本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
实施例涉及的实验材料、试剂和器材,如表1~表2。
表1试剂
表2仪器及设备
/>
实施例1:CGTase融合酶的构建
通过对CGTase-Pm(Genbank登录号:WP_036618292.1)、CGTase-Nc(UniProtKB登录号:P43379.1)、CGTase-Bs(SEQ ID NO.5所示,原始序列的UniProtKB登录号:P31797.1)和CGTase-Tx(SEQ ID NO.3所示,原始序列的Genbank登录号:WP_013787419.1)进行序列分析,发现在CGTase-Pm的V323位点到M331位点区间内的序列高度保守。将CGTase-Pm氨基酸序列中M331前后的序列分别定义为域1和域2,即CGTase-Pm的域1为M1~M331,域2为D332~N688;。将CGTase-Nc氨基酸序列中M332前后的序列分别定义为域1和域2,即CGTase-Nc的域1为M1~M332,域2为E333~P689;将CGTase-Bs氨基酸序列中M326前后的序列分别定义为域1和域2,CGTase-Bs的域1为M1~M326,域2为D327~N681;将CGTase-Tx氨基酸序列中M331前后的序列分别定义为域1和域2,即CGTase-Tx的域1为M1~M331,域2为D332~Q684。将CGTase-Pm、CGTase-Nc、CGTase-Bs和CGTase-Tx的域1和域2进行交错重组融合(如表3所示),理论上存在12种融合变体,分别为CGTase-PN(Pm1-Nc2)、CGTase-PB、(Pm1-Bs2)、CGTase-PT(Pm1-Tx2)、CGTase-TP(Tx1-Pm2)、CGTase-TN、(Tx1-Nc2)、CGTase-TB(Tx1-Bs2)、CGTase-BT(Bs1-Tx2)、CGTase-BP、(Bs1-Pm2)、CGTase-BN(Bs1-Nc2)、CGTase-NP(Nc1-Pm2)、CGTase-NT(Nc1-Tx2)、CGTase-NB(Nc1-Bs2),并验证这些融合变体对AA2G催化收率的影响。
表3融合变体列表
CGTase-Tx、CGTase-Bs、CGTase-Pm和CGTase-Nc的基因经密码子优化后(核苷酸序列分别如SEQ ID NO.4、SEQ ID NO.6、SEQ ID NO.8和SEQ ID NO.10所示),优化后调整4条CGTase中编码V323位点-M331位点段的基因为相同序列,由通用生物公司合成,经NcoⅠ和EcoRⅠ酶切后连接至pET-28a(+)载体中构建基因表达载体。通过化学转化将重组质粒转化至大肠杆菌TOP10感受态细胞中用于表达载体的储存与克隆。设计引物用于获取CGTase-Pm、CGTase-Nc、CGTase-Bs和CGTase-Tx的域1和域2DNA片段,具体引物如下:
域1-F:GCGGATAACAATTCCCCTCTAGAAATAATT;
域1-R:ATCATGATTATCGATGAAGGTCACCATATCG;
域2-F:GACCTTCATCGATAATCATGATATGGATCGTT;
域2-R:TCTAGAGGGGAATTGTTATCCGCTCACAATT;
以各CGTase表达载体DNA为模板,通过PCR分别扩增CGTase-Pm、CGTase-Nc、CGTase-Bs和CGTase-Tx的域1和域2片段。PCR体系:50μL体系,其中PrimeStar Max酶25μL,上下游引物各2μL,模板DNA 1μL,加水补足至50μL。PCR反应条件:98℃变性5min后开始循环,后98℃变性30s,58℃退火15s,72℃延伸1min,共30个循环,再于72℃条件下延伸10min。扩增得到的各CGTase的域1片段大小约为1000bp,而域2片段由于含有质粒骨架,大小约为6300bp。PCR反应结束后,使用DNA片段回收试剂盒(爱思进)回收上述PCR片段,具体方法参照制造商提供的说明书。回收结束后,测定DNA产物浓度,并将各基因的域1和域2片段浓度调整至50ng/μL,在此浓度下,通过Seamless Cloning试剂盒(碧云天)进行域1和域2片段的重组融合反应。
Seamless Cloning反应体系:Seamless Cloning酶5μL,域1PCR片段1μL,域2PCR片段2μL,补水至10μL,反应条件为50℃,持续反应25min。融合反应结束后,将连接产物pET-28a(+)-CGTase-PT、pET-28a(+)-CGTase-PN、pET-28a(+)-CGTase-PB、pET-28a(+)-CGTase-TP、pET-28a(+)-CGTase-TN、pET-28a(+)-CGTase-TB、pET-28a(+)-CGTase-BT、pET-28a(+)-CGTase-BP、pET-28a(+)-CGTase-BN、pET-28a(+)-CGTase-NP、pET-28a(+)-CGTase-NT、pET-28a(+)-CGTase-NB转化大肠杆菌BL21(DE3)感受态细胞,将孵育后的细胞涂布后经37℃培养过夜,后续将长出的融合酶转化子送往杭州擎科生物技术有限公司进行基因测序,并保存构建成功融合酶变体,共计获得12株融合酶变体。
实施例2:融合酶变体活性验证
24深孔板中加入1mL含有50mg/L卡那霉素的LB液体培养基,接入10μL菌种,并于37℃、250rpm过夜培养。然后取40μL菌液转接入1.5mL同样含50mg/L卡那霉素的TB液体培养基中,37℃下生长至OD
AA-2G液相检测方法(HPLC法):催化反应结束后,将反应液进行离心处理(10000rpm),后取上清20μL,加入纯水稀释至2000μL,用0.22μm滤膜过滤后进样,并根据吸收峰面积代入外标计算公式,计算AA-2G收率。AA-2G收率计算方法如下:
其中A为AA-2G催化反应液样品测得的AA-2G峰面积,N为稀释倍数,K为AA-2G单位浓度的峰面积,W为底物抗坏血酸全部转化成AA-2G理论得到的AA-2G浓度。
融合酶变体的活性验证结果如下,CGTase-TB变体的AA-2G收率可达34.7%。
表4融合酶变体活性验证结果
实施例3:CGTase-TB饱和突变文库的构建
分析CGTase-TB的催化口袋组成,选定L46、Y152、G190、N269以及I325位点进行饱和突变文库的建立,根据CGTase-TB的质粒信息,设计相应饱和突变引物,具体如下。
TB-L46-F:ATACCAGTNNKAAAAAATATTTTGGCGGTG;
TB-L46-R:TATTTTTTMNNACTGGTATGGGTCGGATCA;
TB-Y152-F:ATCCGACCNNKGCCGAAAATGGCCGTCTGT;
TB-Y152-R:TTTTCGGCMNNGGTCGGATCGGTTTCACTT;
TB-G190-F:ATGAAGATNNKATCTATCGCAATCTGTTTG;
TB-G190-R:CGATAGATMNNATCTTCATAACTGCTAAAA;
TB-N269-F:TGGATGCCNNKAATACCTATTTTGCAAATG;
TB-N269-R:TAGGTATTMNNGGCATCCACTTCATTGGTG;
TB-I325-F:TGACCTTCNNKGATAATCATGATATGGATC;
TB-I325-R:TGATTATCMNNGAAGGTCACCATATCGTTA;
以pET-28a(+)-CGTase-TB质粒DNA为模板,使用PrimeStar Max酶进行PCR扩增。PCR反应在50μL的体系中进行,反应体系为PrimeStar Max酶25μL,上下游引物各2μL,模板DNA 1μL,加纯水补足至50μL。反应条件为98℃变性5min后开始循环,然后98℃变性30s,58℃退火15s,72℃延伸1min 10s,共30个循环后,再于72℃延伸10min。扩增结束后得到约7300bp的片段产物,产物经DpnⅠ酶消解后转化大肠杆菌BL21(DE3)感受态细胞,并涂布后在37℃下培养过夜,后将长出的克隆挑至96孔板,得到饱和突变文库。
实施例4:饱和突变文库的筛选
挑取饱和突变文库中的克隆到96孔板中,每孔加入200μL含有50mg/L卡那霉素的LB液体培养基,并在37℃、250rpm下过夜培养,得到一级种子液。吸取40μL一级种子液转接入同样含50mg/L卡那霉素TB液体培养基中,37℃下培养至OD
其中,W0-初始反应液中L-抗坏血酸的含量;
W-最终反应液中L-抗坏血酸的含量。
初筛获得活力提升的突变体再参照实施例2的方法进行复筛,复筛得到的有益突变体送往杭州擎科生物技术有限公司进行基因测序,有益突变体的测序结果与对应活性如表5所示。
表5高活性CGTase-TB突变体活性测定结果
实施例5:交错延伸PCR构建组合突变文库及筛选
将实施例4饱和突变得到的有益突变进行随机组合突变。根据CGTase-TB的质粒信息,设计建立L46、Y152、G190、N269以及I325交错延伸PCR体系的引物。
TB-StEP-F:GAATTGTGAGCGGATAACAATTCCCCTC
TB-StEP-R:GCAAGCTTGTCGACGGAGCTCGAATTCT
使用质粒抽提试剂盒(爱思进)提取携带CGTase-TB突变体L46F、Y152G、G190W、N269A或I325K的质粒,相同DNA浓度下混合上述质粒DNA,以混合的质粒DNA为模板,使用TaqDNA 聚合酶(Takara)进行交错延伸PCR。PCR反应在50μL的体系中进行:Taq DNA聚合酶1μL,上下游引物后各2μL,模板DNA 1μL,10×Ex Taq Buffer 5μL,dNTP Mix(2.5mM)4μL,加纯水补足至50μL。反应条件为98℃变性30s,55℃复性延伸30s,如此循环80次。扩增结束后得到约2000bp的片段产物,使用DNA片段回收试剂盒(爱思进)回收上述PCR片段。再以上述PCR片段为模板,使用PrimeStar Max酶进行PCR扩增。PCR反应在50μL的体系中进行,反应体系为PrimeStar Max酶25μL,上下游引物各2μL,模板DNA1μL,加纯水补足至50μL。反应条件为98℃变性5min后开始循环,然后98℃变性30s,58℃退火15s,72℃延伸30s,共30个循环后,再于72℃延伸10min。扩增结束后得到约2000bp的片段产物,使用DNA片段回收试剂盒(爱思进)回收上述PCR片段。回收的PCR产物与pET-28a(+)-CGTase-TB质粒经NcoⅠ和EcoRⅠ酶切,T4连接酶酶连后,连接产物转化至大肠杆菌BL21(DE3)感受态细胞,并涂布后在37℃下培养过夜,后将长出的克隆挑至96孔板,得到饱和突变文库。有益突变体的测序结果与对应活性如表6所示,分别命名为CGTase-TB1(L46F/Y152G/N269A/I325K)、CGTase-TB2(L46F/G190W/I325K)、CGTase-TB3(L46F/Y152G/I325K)。
表6高活性CGTase-TB组合突变体活性测定结果
实施例6:酶制剂的制备
按1%接种量(50μL)从保菌管中将表达突变体CGTase-TB-L46F、CGTase-TB-Y152G、CGTase-TB-G190W、CGTase-TB-N269A、CGTase-TB-I325K、CGTase-TB1、CGTase-TB2或CGTase-TB3的菌株接种至5mL LB培养基中,含卡那霉素终浓度50mg/L,37℃、200rpm过夜培养15h。然后将一级种按4%的接种量接入同样含卡那霉素终浓度50mg/L的50mL TB培养基中,37℃、220rpm下培养至菌液OD为0.6~0.8,加入终浓度为0.1mmol/L的IPTG,在25℃、220rpm下诱导表达,诱导24h后,离心去除发酵液,收集菌体,得到细胞催化剂。
对细胞催化剂进行破壁,纯化蛋白,测定突变体的比酶活,结果显示,CGTase-TB-L46F的比酶活为11.60U/mg,CGTase-TB-Y152G的比酶活为9.49U/mg,CGTase-TB-G190W的比酶活为10.22U/mg,CGTase-TB-N269A的比酶活为11.97U/mg,CGTase-TB-I325K的比酶活为14.00U/mg,CGTase-TB1的比酶活为19.25U/mg,CGTase-TB2的比酶活为19.53U/mg,CGTase-TB3的比酶活为18.6U/mg。
实施例7:CGTase-TB1催化合成AA-2G应用
配制100mL酶催化反应体系,含有(按终浓度计)200g/Lβ-环糊精(糖基供体)、200g/L L-抗坏血酸(糖基受体),50g/L参照实施例6的方法制备的CGTase-TB1湿菌体细胞;使用氢氧化钠调节溶液pH为5.0,反应温度为30℃。定时取样监测反应进程,反应时间5小时,AA2G含量不再升高。向反应体系中再加入500000U/L反应液的糖化酶(金源生物),并调节溶液pH为5.0,50℃持续4小时,反应结束后液相检测,结果显示20g的L-抗坏血酸经过酶催化转化制得27.61g AA-2G,AA-2G收率达到71.9%。
AA-2G液相检测方法(HPLC法):催化反应结束后,将反应液进行离心处理(10000rpm),后取上清20μL,加入纯水稀释至2000μL,用0.22μm滤膜过滤后进样,并根据吸收峰面积代入外标计算公式,计算AA-2G收率。AA-2G收率计算方法如下:
其中A为AA-2G催化反应液样品测得的AA-2G峰面积,N为稀释倍数,K为AA-2G单位浓度的峰面积,W为底物抗坏血酸全部转化成AA-2G理论得到的AA-2G浓度。
实施例8:CGTase-TB2催化合成AA-2G应用
配制100mL酶催化反应体系,含有(按终浓度计)200g/Lβ-环糊精(糖基供体)、200g/LL-抗坏血酸(糖基受体),50g/L参照实施例6的方法制备的CGTase-TB2湿菌体细胞;使用氢氧化钠调节溶液pH为5.0,反应温度为30℃。定时取样监测反应进程,反应时间3小时,AA2G含量不再升高。向反应体系中再加入500000U/L反应液的糖化酶(金源生物),并调节溶液pH为5.0,50℃持续4小时,反应结束后液相检测,结果显示20g的L-抗坏血酸经过酶催化转化制得27.9g AA-2G,AA-2G收率达到72.8%。
实施例9:CGTase-TB3催化合成AA-2G应用
配制100mL酶催化反应体系,含有(按终浓度计)200g/Lβ-环糊精(糖基供体)、200g/LL-抗坏血酸(糖基受体),50g/L参照实施例6的方法制备的CGTase-TB3湿菌体细胞;使用氢氧化钠调节溶液pH为5.0,反应温度为30℃。定时取样监测反应进程,反应时间10小时,AA2G含量不再升高。向反应体系中再加入500000U/L反应液的糖化酶(金源生物),并调节溶液pH为5.0,50℃持续4小时,反应结束后液相检测,结果显示20g的L-抗坏血酸经过酶催化转化制得25.8g AA-2G,AA-2G收率达到67.3%。
实施例10:各突变体热稳定性分析
将各突变体的发酵液离心去除上清,保留菌体,用50mM KH
表7不同突变体的热稳定性
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 一种腈水合酶突变体、含该突变体的基因工程菌及其应用
- 一种环糊精葡萄糖基转移酶突变体
- 一种糖基转移酶突变体
- 一种提高AA-2G产量的环糊精葡萄糖基转移酶突变体
- 一种提高AA-2G产量的环糊精葡萄糖基转移酶突变体
