一种光学发色团化合物及含其的复合材料、薄膜和光电集成器件
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及光学材料技术领域,具体涉及一种光学发色团化合物及含其的复合材料、薄膜和光电集成器件。
背景技术
有机聚合物光波导材料具有制作工艺简单、响应时间超快、介电常数小等优点,通过旋涂甩膜、光刻或压印等工艺可制作出复杂的光电集成器件,可大规模生产。然 而,其中的生色团化合物往往受限于较低的电光系数,如何对生色团化合物进行简单 高效的修饰,提高电光系数并保持在工作波长的光学透明性对于电光材料的发展具有 重大意义。
发明内容
为解决上述技术问题,本发明的第一个目的在于提供一种光学发色团化合物。
本发明的第二个目的在于提供一种含有上述光学发色团化合物的复合材料。
本发明的第三个目的在于提供一种由上述复合材料制成的薄膜,以及具有该薄膜的光电集成器件。
为了实现以上目的,本发明采用以下技术方案:
本发明第一方面提供一种光学发色团化合物,该光学发色团化合物的结构通式如式1所示:
R
式1中,R
式2、式3中的R
R
R
/>
式5中的R
本发明提供的光学发色团化合物中,π-电子给体基团通过双烯共轭桥与π-电子受体基团共轭相连。通过结构修饰,改变空间位阻、键长交替和给受体推拉强度。
根据本发明的光学发色团化合物,π-电子给体基团为烷基苯胺噻吩类化合物;其结构如式2或式3所示,优选地,R
根据本发明的光学发色团化合物,π-电子受体基团为三氰基呋喃(TCF)及其衍 生物,其结构如式5所示,优选地,R
根据本发明的光学发色团化合物,优选地,所述光学发色团化合物的结构式为下式之一:
本发明提供的以上光学发色团化合物是一种非线性光学材料,能够用于制备光学复合材料、光学薄膜以及电光器件等。
本发明还提供了一种以上光学发色团化合物的合成路线:
路线一:
/>
路线二:
其中,R
苯胺化合物通过NBS溴代、Stille偶联、丙烯化和缩合四步与对应的原料反应, 得到本发明以上光学发色团化合物。
本发明第二方面提供一种复合材料,其包含上述光学发色团化合物。
根据本发明的复合材料,优选地,以所述复合材料的总重量计,所述光学发色团化合物的含量为10%-90%。
根据本发明的复合材料,优选地,所述复合材料还包括聚合物。本发明的光学发色团化合物与聚合物混合制成复合材料,该复合材料具有非线性系数大、易加工等优 点,能够制成具有良好光学质量的薄膜。
根据本发明的复合材料,优选地,所述聚合物包括聚甲基丙烯酸甲酯、甲基丙烯酸甲酯-苯乙烯共聚物和聚碳酸酯中的一种或两种以上的组合。
根据本发明的复合材料,优选地,在1000nm-1600nm的波长范围内,所述复 合材料的电光系数r
根据本发明的复合材料,优选地,在0-40V/μm电场作用下,所述复合材料的折 射率的改变值为0.0005至0.005。
上述电光系数r
本发明第三方面提供一种薄膜,其是由以上复合材料制成的。
本发明还提供了一种光电集成器件,其具有上述薄膜。优选地,所述光电集成器件为电光器件。本发明提供的光学发色团实现了比较大的电光效应。
电光或电吸收调制器是一类通过电压来调制激光强度的器件。有机电光材料对于调制电信号具有重要意义。现有的电光材料面临电光系数低、溶解性差、热稳定性低 和成膜质量差等问题。本发明通过对生色团化合物的给体进行结构修饰,使得材料的 溶解性、加工性、稳定性得到显著改善,电光系数显著增加,同时在1300nm的工作 波长透明性好。而且本发明合成方法在一步丙烯化后,直接与受体缩合得到所需生色 团化合物,与相关文献相比,该合成方法相对简单高效、合成效率高,极大简化合成 时间和成本。对于实现调制器的大面积制备、组装和应用,以及下一代信息技术应用 具有广泛潜力。
附图说明
图1为实施例1的化合物N-2的
图2为实施例1的化合物N-3的
图3为实施例1的化合物N-3的
图4为实施例1的化合物N-4的
图5为实施例1的化合物ZJL-7的
图6为实施例1的化合物ZJL-7的
图7为实施例2的化合物A-2的
图8为实施例2的化合物A-2的
图9为实施例2的化合物A-3的
图10为实施例2的化合物A-3的
图11为实施例2的化合物A-4的
图12为实施例2的化合物A-4的
图13为实施例2的化合物ZJL-8的
图14为实施例2的化合物ZJL-8的
图15为实施例3的化合物AT-2的
图16为实施例3的化合物AT-2的
图17为实施例3的化合物AT-3的
图18为实施例3的化合物AT-3的
图19为实施例3的化合物AT-4的
图20为实施例3的化合物AT-4的
图21为实施例3的化合物ZJL-9的
图22为实施例3的化合物ZJL-9的
图23为实施例4的化合物TQ-8的
图24为实施例4的化合物TQ-8的
图25为实施例4的化合物TQ-9的
图26为实施例4的化合物TQ-9的
图27为实施例4的化合物TQ-10的
图28为实施例4的化合物TQ-10的
图29为实施例4的化合物TQ-11的
图30为实施例4的化合物TQ-12的
图31为实施例4的化合物TQ-12的
图32为实施例4的化合物ZJL-10的
图33为实施例4的化合物ZJL-10的
图34为实施例1的化合物ZJL-7在溶液中的摩尔消光系数光谱图。
图35为实施例2的化合物ZJL-8在溶液中的摩尔消光系数光谱图。
图36为实施例3的化合物ZJL-9在溶液中的摩尔消光系数光谱图。
图37为实施例4的化合物ZJL-10在溶液中的摩尔消光系数光谱图。
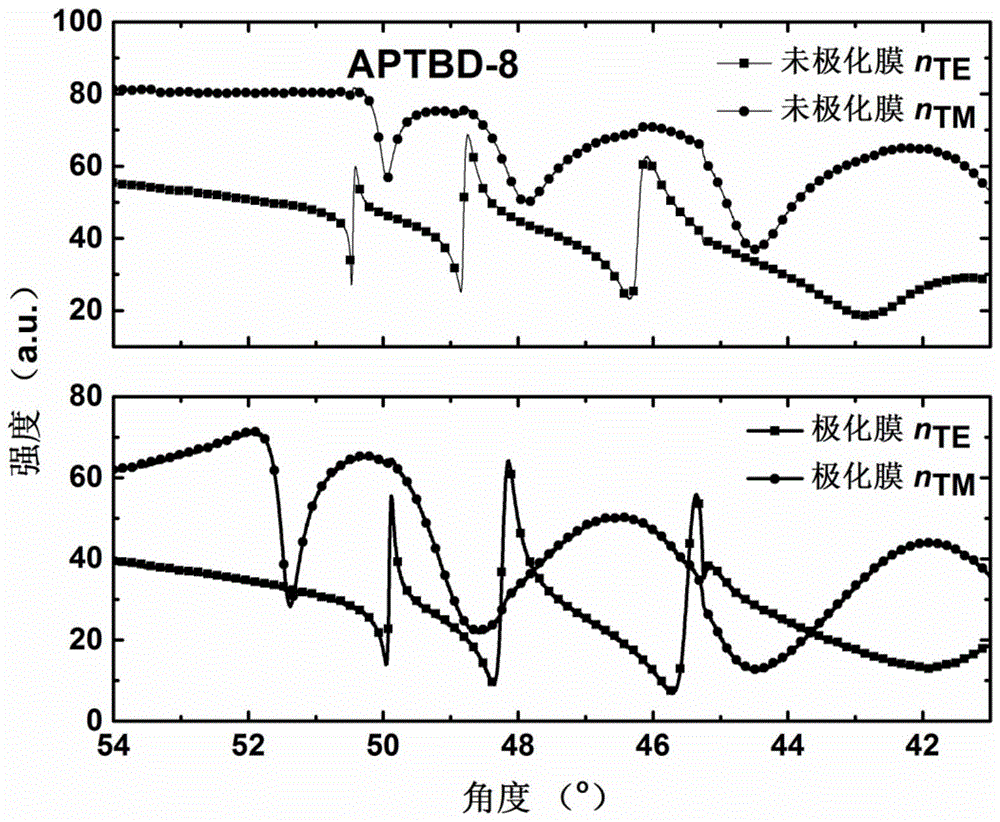
图38为实施例2的化合物ZJL-8与聚合物混合制成薄膜在采用波长1304nm时, 未极化薄膜,极化薄膜TE、TM波的反射强度测试结果图。
具体实施方式
为了更清楚地说明本发明,下面结合优选实施例对本发明做进一步的说明。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限 制本发明的保护范围。
本发明所有数值指定(例如温度、时间、浓度及重量等,包括其中每一者的范围)通常可是适当以0.1或1.0的增量改变(+)或(-)的近似值。所有数值指定均可理解为前 面有术语“约”。
实施例1
本实施例制备了一种光学发色团化合物(化合物ZJL-7),其结构如下所示:
该光学发色团化合物是通过以下步骤制备的:
步骤i、合成化合物N-2
将5.0g化合物N-1溶于20mL DMF中,并冷至0℃;向其中滴加4.55g NBS 的DMF溶液(溶在5mL DMF中);滴加完毕后,将溶液的温度升温至室温,并搅 拌过夜得反应液;将反应液倾入水中,正己烷萃取;所得溶液用无水Na
该化合物N-1的
1
步骤ii、合成化合物N-3
将4.0g步骤i得到的化合物N-2,0.25g Pd
该化合物N-3的
1
步骤iii、合成化合物N-4
将0.5g步骤ii得到的化合物N-3溶于5mL无水四氢呋喃中,并冷至-20℃;向 其中滴加1.2mL的1.6M正丁基锂溶液,得到的反应液在-20℃反应2h;将0.2g 3- (二甲氨基)丙烯醛滴加到上述-20℃的反应液中;滴加完毕后,将溶液的温度升温至 室温,并搅拌过夜得到反应液;将反应液倾入水中,二氯甲烷萃取;所得溶液用无水 Na
该化合物N-4的
1
该化合物N-4的
13
步骤iv、合成化合物ZJL-7
将0.25g步骤iii得到的化合物N-4,0.23g CF
该化合物ZJL-7的
1
该化合物ZJL-7的
13
实施例2
本实施例提供了一种光学发色团化合物(化合物ZJL-8),其结构如下所示:
该光学发色团化合物是通过以下步骤制备的:
步骤i、合成化合物A-2
将6.0g化合物A-1溶于20mL DMF中,并冷至0℃;向其中滴加2.7g NBS的 DMF溶液(溶在5mL DMF中);滴加完毕后,将溶液的温度升温至室温,并搅拌 过夜得反应液;将反应液倾入水中,正己烷萃取;所得溶液用无水Na
该化合物A-2的
1
该化合物A-2的
13
步骤ii、合成化合物A-3
将1.0g步骤i得到的化合物A-2,80mg Pd
该化合物A-3的
1
该化合物A-3的
13
步骤iii、合成化合物A-4
将0.6g步骤ii得到的化合物A-3溶于5mL无水四氢呋喃中,并冷至-20℃;向 其中滴加1.2mL的1.6M正丁基锂溶液,得到的反应液在-20℃反应2h;将0.2g 3- (二甲氨基)丙烯醛滴加到上述-20℃的反应液中;滴加完毕后,将溶液的温度升温至 室温,并搅拌过夜得到反应液;将反应液倾入水中,二氯甲烷萃取;所得溶液用无水 Na
该化合物A-4的
1
该化合物A-4的
13
步骤iv、合成化合物ZJL-8
将0.4g步骤iii得到的化合物A-4,0.24g CF
该化合物ZJL-8的
1
该化合物ZJL-8的
13
实施例3
本实施例制备了一种光学发色团化合物(化合物ZJL-9),其结构如下所示:
该光学发色团化合物是通过以下步骤制备的:
步骤i、合成化合物AT-2
将1.75g化合物AT-1溶于10mL DMF中,并冷至0℃;向其中滴加1.73g NBS 的DMF溶液(溶在5mL DMF中);滴加完毕后,将溶液的温度升温至室温,并搅 拌过夜得反应液;将反应液倾入水中,正己烷萃取;所得溶液用无水Na
该化合物AT-2的
1
该化合物AT-2的
13
步骤ii、合成化合物AT-3
将1.5g步骤i得到的化合物AT-2,0.1g Pd
该化合物AT-3的
1
该化合物AT-3的
13
步骤iii、合成化合物AT-4
将0.5g步骤ii得到的化合物AT-3和0.25g 3-(二甲氨基)丙烯醛溶于5mL氯仿 中,并冷至0℃;向其中滴加0.25mL三氯氧磷,滴加完毕后,将溶液的温度升温至 70℃反应3h;将反应液倾入水中,二氯甲烷萃取;所得溶液用无水Na
该化合物AT-4的
1
该化合物AT-4的
步骤iv、合成化合物ZJL-9
将0.2g步骤iii得到的化合物AT-4,0.19g CF
该化合物ZJL-9的
1
该化合物ZJL-9的
13
实施例4
本实施例制备了一种光学发色团化合物(化合物ZJL-10),其结构如下所示:
该光学发色团化合物是通过以下步骤制备的:
步骤i、合成化合物TQ-8
将5.0g化合物TQ-7溶于20mL DMF中,并冷至0℃;向其中滴加4.1g NBS 的DMF溶液(溶在5mL DMF中);滴加完毕后,将溶液的温度升温至室温,并搅 拌过夜得反应液;将反应液倾入水中,正己烷萃取;所得溶液用无水Na
该化合物TQ-8的
1
该化合物TQ-8的
13
步骤ii、合成化合物TQ-9
将2.5g步骤i得到的化合物TQ-8,0.15g Pd
该化合物TQ-9的
1
该化合物TQ-9的
13
步骤iii、合成化合物TQ-10
将0.7g步骤ii得到的化合物TQ-9和0.3g 3-(二甲氨基)丙烯醛溶于5mL氯仿 中,并冷至0℃;向其中滴加0.3mL三氯氧磷,滴加完毕后,将溶液的温度升温至 70℃反应3h;将反应液倾入水中,二氯甲烷萃取;所得溶液用无水Na
该化合物TQ-10的
1
该化合物TQ-10的
13
步骤iv、合成化合物TQ-11
将0.6g步骤iii得到的化合物TQ-10溶于含有1M KOH的3mL甲醇中,室温 搅拌过夜得到反应液;将反应液倾入水中,二氯甲烷萃取;所得溶液用无水Na
该化合物TQ-11的
1
步骤v、合成化合物TQ-12
将0.4g步骤iv得到的化合物TQ-11和0.17g咪唑溶于5mL DMF中,向其中滴 加0.53g叔丁基二苯基氯硅烷,得到的反应液室温搅拌过夜得到反应液;将反应液 倾入水中,二氯甲烷萃取;所得溶液用无水Na
该化合物TQ-12的
1
该化合物TQ-12的
13
步骤vi、合成化合物ZJL-10
将0.3g步骤v得到的化合物TQ-12,0.17g CF
该化合物ZJL-10的
1
该化合物ZJL-10的
13
测试例1
对实施例1-4的化合物进行吸收光谱测试,采用UV-vis-NIR吸收光谱进行测试,溶剂分别为甲苯(toluene)、三氯乙烯(trichloroethylene)、氯仿(chloroform)、二 氯甲烷(dichloromethane)、环己酮(cyclohexanone)、丙酮(acetone)、乙腈(acetonitrile);室温条件下使用1cm的石英比色皿进行测试。其中该材料的消光系数(ε)利用公式: A=εcb来计算,A为最大吸收峰的吸光度;c为材料的物质的量浓度;b为使用比 色皿的厚度。图34-图37为消光系数(Extinction Coefficient)结果图。由图34-图37 可以看出,该材料显示出了强烈的近红外吸收和溶致变色结果(Strong vis-NIR Absorption andSolvatochromism)。
测试例2
对实施例2的化合物ZJL-8进行棱镜耦合波导折射率测试,其中,入射波长为1304nm。
测试方法参考文献Wang,W.;Wu,J.;Chen,K.;Huang,Q.;Luo,J.;Chiang,K.S.,Graphene electrodes for electric poling of electro-optic polymer films.OpticsLetters,2020, 45,2383-2386.Kuzyk,M.G.and C.W.Dirk,Characterization Techniquesand Tabulations for Organic Nonlinear Optical Materials.1998:Marcel Dekker.
生色团化合物与聚合物聚碳酸酯按照一定比例(生色团化合物占比20-30wt%)混合,加入二溴甲烷充分溶解混合均匀,旋涂在ITO玻璃上。真空干燥后进行加工与 测试。利用台阶仪测试薄膜厚度。镀金作为正极,ITO作为负极,施加电场(100V/μm)。 提高温度,当升至玻璃化温度范围125-135℃后,漏电流显著增加,表明极化成功, 降温冷却。所使用的棱镜耦合为商用的棱镜耦合测试仪,型号为Model 2010/M,生产 厂商是美国Metricon公司。
测试结果如图38和表1、表2所示。图38为ZJL-8的极化薄膜含生色团占比 25%,相当于在高分子中的数密度N为2.16×10
实施例1-4的化合物展示出了相似的电光效应,如下表2所示。
表1化合物ZJL-8极化膜在1304nm处,棱镜耦合波导折射率测试结果
表2不同生色团化合物的最大吸收波长λ
本发明提供的生色团化合物在1304nm处,显示出很大的线性电光系数(r
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上 还可以做出其它不同形式的变化或变动,这里无法对所有的实施方式予以穷举,凡是 属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围 之列。
- 一种含喹唑啉杂环化合物及其在有机光电器件中的应用
- 一种光学发色团化合物及含其的复合材料、薄膜和光电集成器件
- 一种光学发色团化合物及含其的复合材料、薄膜和光电集成器件
