一种介入的医疗器械
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及介入的医疗器械,特别涉及导管、被覆导管的材料技术领域,具体涉及一种药物球囊涂覆液、药物球囊涂层材料、药物球囊及其制备方法。
背景技术
雷帕霉素(Rapamycin)是是一种疗效好、低毒、无肾毒性的新型免疫抑制剂以及抗真菌药物,是一种mTOR蛋白特异性抑制剂,与细胞内受体FKBP-12结合形成复合物后直接作用于mTOR中的FRB(FKBP-12-rapamycin binding)结构域从而抑制蛋白活性。经常作为维持移植器官免疫能力的药物(特别是肾移植),以减缓器官移植手术后的免疫排斥反应。雷帕霉素作为强效免疫抑制剂通过不同的细胞因子受体阻断信号传导,阻断T淋巴细胞及其他细胞由G1期至S期的进程,从而发挥免疫抑制效应。雷帕霉素为白色固体结晶,熔点为183-185℃,具有亲脂性,溶解于甲醇、乙醇、丙酮、氯仿等有机溶剂,极微溶于水,几乎不溶于乙醚。
目前市售的雷帕霉素剂型以口服片、注射液为主,但是传统的片剂和液体制剂无法解决雷帕霉素因水溶性差从而导致生物利用度低的问题,也无法实现雷帕霉素在治疗部位的定点、长效释放。为解决以上问题,可采用目前已经上市的新型剂型——微球作为制剂载体,微球的粒径一般在1-250μm,是药物分散或被吸附在高分子聚合物基质中而形成的微粒分散系统,是常用的具有靶向作用的药物载体,针对减少雷帕霉素服药次数、使雷帕霉素在治疗部位长效释药的目的,在医疗领域广泛应用聚乳酸-羟基乙酸共聚物(PLGA)作为微球的载体。PLGA是一种可降解的功能高分子有机化合物,具有良好的生物相容性、无毒、良好的成囊和成膜的性能,被广泛应用于制药、医用工程材料和现代化工业领域,同时PLGA微球作为蛋白质、酶类等各类药物的缓释载体,更是近些年来研究的热点,各种PLGA药物微球制备应用多见报道。
同时,临床医学技术的创新将单纯的制剂输送与医疗器械的介入相结合,近年来出现了较多的关于接触转移的管腔内可扩张导管的临床定点介入治疗的研究与应用,将雷帕霉素制备成微球型的药物微贮库可有效解决药物的靶向给药及吸收屏障等问题,然而其制剂的难点在于常用的PLGA载体释药时间长、其细胞亲和性与接触转移的要求有待提高,且如何实现药物的涂覆。
发明内容
本发明的目的在于提供一种含有透明质酸钠的雷帕霉素PLGA缓释微球,该微球为核壳结构,外层为透明质酸钠层,通过透明质酸钠的材料特性使得雷帕霉素可在不同介质中呈现快速释放以及缓慢释药的作用,内层为PLGA微球,PLGA作为雷帕霉素载体的同时实现雷帕霉素的持续缓慢释放。
本发明的另一目的是提供了这种雷帕霉素微球的涂覆方法,使用静电喷雾技术实现了含有透明质酸钠的雷帕霉素微球体系的稳定涂覆,并提供了雷帕霉素微球涂层的优化涂覆工艺。
为实现上述目的,本发明采用的技术方案如下:
本发明提供一种药物球囊涂覆液,所述涂覆液包括混合溶剂体系,所述混合溶剂体系包括:水、乙醇和N,N-二甲基甲酰胺(DMF);所述涂覆液还包括:雷帕霉素原料药、药物缓释载体、亲水性高分子材料、助纺剂和释药调节剂;其中,所述释药调节剂包括透明质酸钠(SH)。
可选的是,所述涂覆液按质量计包括雷帕霉素原料药∶药物缓释载体∶亲水性高分子材料∶助纺剂∶释药调节剂=1∶16∶40-50∶8∶6-8。
可选的是,所述药物缓释载体包括聚乳酸-羟基乙酸共聚物(PLGA);
优选的是,所述药物缓释载体包括PLGA 75/25(0.22dl/l)、PLGA 50/50(0.1dl/l)、PLGA 50/50(0.2dl/l)、PLGA 50/50(0.23dl/l)中的其中一种或几种。
可选的是,所述的亲水性高分子材料包括聚乙烯醇;
优选的是,所述的亲水性高分子材料包括聚乙烯醇403(PVA403)。
可选的是,所述的助纺剂为聚氧化乙烯(PEO);
优选的是,所述聚氧化乙烯(PEO)的数均分子量为Mn=10,000、Mn=50,000或Mn=100,000。
可选的是,所述透明质酸钠(SH)数均分子量为Mn=10,000、或Mn=100,000-400,000。
可选的是,所述的混合溶剂体系中水、乙醇和N,N-二甲基甲酰胺的体积比例为2∶1∶1。
本发明还提供一种药物球囊涂层材料,所述材料包括含有透明质酸钠的雷帕霉素缓释微球,所述微球为核壳结构,所述核壳结构包括包覆雷帕霉素的外层,所述外层包括透明质酸钠层,所述核壳结构的内核包括雷帕霉素和PLGA。
可选的是,所述材料按质量计包括雷帕霉素原料药∶PLGA∶透明质酸钠=1∶16∶6-8。
本发明还提供一种药物球囊涂层材料的制备方法,所述方法包括如下步骤:
(1)将亲水性高分子材料在搅拌的状态下加入到纯水中,充分溶解制备成溶液①;将药物缓释载体先溶于有机溶剂中,涡旋后超声搅拌使其充分溶解,再加入雷帕霉素原料药涡旋并超声制备成溶液②;将溶液②倒入溶液①中超声搅拌,使其充分乳化,于室温下继续搅拌以挥发有机溶剂;之后将无水乙醇和N,N-二甲基甲酰胺(DMF)加入其中,充分搅拌;再将助纺剂在搅拌的状态下加入到溶液中,充分搅拌,待搅拌充分后将释药调节剂加入其中,充分搅拌后超声搅拌,使溶液均匀分散,得到微球静电喷雾工作液;其中,所述释药调节剂包括透明质酸钠(SH);
(2)将微球静电喷雾工作液置于注射器中,由恒流泵缓慢输出,溶液喷速为0.2-0.8mL/h,电压范围为10-25KV,经喷头喷出至接收装置,接收距离为10-20cm,收集即得粉末状药物球囊涂层材料。
可选的是,步骤(1)中的有机溶剂包括二氯甲烷。
可选的是,所述微球静电喷雾工作液按质量计包括雷帕霉素原料药∶药物缓释载体∶亲水性高分子材料∶助纺剂∶释药调节剂=1∶16∶40-50∶8∶6-8。
可选的是,所述药物缓释载体包括聚乳酸-羟基乙酸共聚物(PLGA);
优选的是,所述药物缓释载体包括PLGA 75/25(0.22dl/l)、PLGA 50/50(0.1dl/l)、PLGA 50/50(0.2dl/l)、PLGA 50/50(0.23dl/l)中的其中一种或几种。
可选的是,所述的亲水性高分子材料包括聚乙烯醇;
优选的是,所述的亲水性高分子材料包括聚乙烯醇403(PVA403)。
可选的是,所述的助纺剂为聚氧化乙烯(PEO);
优选的是,所述聚氧化乙烯(PEO)的数均分子量为Mn=10,000、Mn=50,000或Mn=100,000。
可选的是,所述透明质酸钠(SH)数均分子量为Mn=10,000、或Mn=100,000-400,000。
有益效果
本发明具有以下的有益效果:
1、本发明解决了雷帕霉素水溶性差的问题,通过使用亲水性载体及微粒给药体系制备出了可调节释药速率的雷帕霉素微球制剂,体外溶出实验研究表明,该雷帕霉素微球在水中1天后释放能达到80%,而在pH7.4的磷酸盐缓冲液中可在7天内缓慢持续释放。该法制得的雷帕霉素微球制剂在不同介质中释药速率可调可控。
2、本发明提供了一种具有前景的雷帕霉素微球涂层涂覆方法,使用静电喷雾法制得的该雷帕霉素微球为干燥粉末状,可涂覆于平面或者导管表面,微球制剂复溶于水中后平均粒径为436.28nm,PDI为0.238,扫描电镜显示其粒子分布均匀。
附图说明
通过参考附图会更加清楚的理解本发明的特征和优点,附图是示意性的而不应理解为对本发明进行任何限制,在附图中:
图1为实施例5雷帕霉素微球的透射电镜结果图片;
图2为实施例5雷帕霉素微球的扫描电镜结果图片;
图3为实施例6雷帕霉素微球的透射电镜结果图片;
图4为实施例6雷帕霉素微球的扫描电镜结果图片;
图5为实施例8雷帕霉素微球的透射电镜结果图片;
图6为实施例8雷帕霉素微球的扫描电镜结果图片;
图7为实施例8雷帕霉素微球的粒径分布图;
图8为实施例9雷帕霉素微球的扫描电镜结果图片;
图9为实施例10雷帕霉素微球的扫描电镜结果图片;
图10为实施例8雷帕霉素微球的体外释药结果曲线图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明采用透明质酸钠作为药物球囊涂覆液的释药调节剂,通过静电喷雾技术实现微球成型与涂覆一体化,制备一种含有透明质酸钠的雷帕霉素PLGA缓释微球。
透明质酸(Hyaluronic Acid,HA)又名玻璃酸、玻尿酸,是一种以葡萄糖醛酸和N-乙酰氨基葡萄糖胺为双糖单位交替连接而成的黏多糖,它广泛存在于胎盘、羊水、晶状体、关节软骨、皮肤真皮层等组织中,市售透明质酸会以其钠盐形式呈现,叫做透明质酸钠。透明质酸钠广泛应用于制药行业和化妆品行业,具有生物相容性高、安全性好的特点,在体内起到保水、维持细胞外空间、调节渗透压、润滑、促进细胞修复的特性,透明质酸钠作为药物的载体可通过增加药物的粘度延长药物在治疗部位表面的滞留时间,提高药物的生物利用度,减轻药物对治疗部位的刺激性。透明质酸钠具有一定的吸水储水能力,较好的成膜性,其渗透性较强可有效帮助药物进入体内特定部位,发挥药物的功效。同时,选择不同分子量的透明质酸钠可调节静电或超声喷涂工作液的粘度,从而优化工艺参数。
本发明使用了静电喷雾技术制备由透明质酸钠包载的雷帕霉素微球纳米粒,相较于其他制备微球的方法如:乳化法、溶剂挥发法、喷雾干燥法等,静电喷雾法有着显著优势,如制备条件可控性好,制备过程中避免了加热过程减少药物的损失,制备出的微球粒径均一可控且表面形态可控。相较于传统的微球制备过程明显的优势在于:避免高温操作、制备过程简单、省略第二乳液。本发明使用静电喷雾技术是用于将孵化后的含透明质酸钠的微球母液进行固化成型,透明质酸钠本身具有一定粘度且形成的核壳结构易在高温或低温下被破坏,因此使用传统的干燥方法难以固化得到理想的微球结构。本发明使用静电喷雾技术成功制备出微球、纳米粒、纳米凝胶等制剂。
以下为实施例所用主要仪器和原料:
原料:雷帕霉素原料药(上海麦克林生化科技有限公司);PLGA(深圳市博立生物材料有限公司);PVA403(巴斯夫新材料有限公司);PEO(巴斯夫新材料有限公司);透明质酸钠(广州美懿生物科技有限公司);乙醇(国药集团化学试剂有限公司);N,N-二甲基甲酰胺(国药集团化学试剂有限公司)。
仪器:电子天平(德国赛多利斯SartoriusBSA124S-CW);数控超声波清洗器(昆山市超声仪器有限公司);恒温振荡器(江苏金坛市中大仪器厂);90Plus PALS粒径分析仪(美国Brookhaven Instruments);LSP01-1A型微量注射泵(河北保定兰格有限公司);HB-Z303-1AC型直流高压电源(天津豪凯科技发展有限公司);液相色谱仪(包括LC-20AD液相泵,SIL-20AC进样器,CTO-20AC柱温箱,SPD-M20A紫外检测器,symmetry C18柱)(日本岛津)。
实施例1雷帕霉素微球
(1)用电子天平精密称200mg PVA403,量取5mL纯水,将200mg PVA403在搅拌的状态下加入到纯水中,充分溶解制备成溶液①,再用电子天平精密称5mg雷帕霉素原料药和80mg PLGA50/50(0.23dl/l),将80mg PLGA50/50(0.23dl/l)先溶于1mL的二氯甲烷中,涡旋后超声5min使其充分溶解,再加入5mg雷帕霉素原料药涡旋并超声制备成溶液②。将溶液②倒入溶液①中超声5min,使其充分乳化,于室温下继续搅拌1h挥发有机试剂。之后将2.5mL无水乙醇和2.5mL N,N-二甲基甲酰胺(DMF)加入其中,充分搅拌。再将40mg PEO(Mn=100,000)在搅拌的状态下加入到溶液中,充分搅拌后再将75mg透明质酸钠(麦克林)加入其中,充分搅拌后超声5min,使溶液均匀分散,得到微球静电喷雾处方。
(2)将微球工作液约10mL置于注射器中,由恒流泵缓慢输出,溶液喷速为0.4mL/h,电压范围为15KV,喷头规格22G,经喷头喷出至平面接收板,收集即得粉末状雷帕霉素微球制剂,接收距离为15cm。
实施例2雷帕霉素微球
(1)用电子天平精密称250mg PVA403,量取5mL纯水,将250mg PVA403在搅拌的状态下加入到纯水中,充分溶解制备成溶液①,再用电子天平精密称5mg雷帕霉素原料药和80mg PLGA50/50(0.23dl/l),将80mg PLGA50/50(0.23dl/l)先溶于1mL的二氯甲烷中,涡旋后超声5min使其充分溶解,再加入5mg雷帕霉素原料药涡旋并超声制备成溶液②。将溶液②倒入溶液①中超声5min,使其充分乳化,于室温下继续搅拌1h挥发有机试剂。之后将2.5mL无水乙醇和2.5mL N,N-二甲基甲酰胺(DMF)加入其中,充分搅拌。再将40mg PEO(Mn=100,000)在搅拌的状态下加入到溶液中,充分搅拌后再将75mg透明质酸钠(麦克林)加入其中,充分搅拌后超声5min,使溶液均匀分散,得到微球静电喷雾处方。
(2)将微球工作液约10mL置于注射器中,由恒流泵缓慢输出,溶液喷速为0.4mL/h,电压范围为15KV,喷头规格22G,经喷头喷出至平面接收板,收集即得粉末状雷帕霉素微球制剂,接收距离为15cm。
实施例3雷帕霉素微球
(1)用电子天平精密称250mg PVA403,量取5mL纯水,将250mg PVA403在搅拌的状态下加入到纯水中,充分溶解制备成溶液①,再用电子天平精密称5mg雷帕霉素原料药和80mg PLGA50/50(0.23dl/l),将80mg PLGA50/50(0.23dl/l)先溶于1mL的二氯甲烷中,涡旋后超声5min使其充分溶解,再加入5mg雷帕霉素原料药涡旋并超声制备成溶液②。将溶液②倒入溶液①中超声5min,使其充分乳化,于室温下继续搅拌1h挥发有机试剂。之后将2.5mL无水乙醇和2.5mL N,N-二甲基甲酰胺(DMF)加入其中,充分搅拌。再将40mg PEO(Mn=50,000)在搅拌的状态下加入到溶液中,充分搅拌后再将50mg透明质酸钠(麦克林)加入其中,充分搅拌后超声5min,使溶液均匀分散,得到微球静电喷雾处方。
(2)将微球工作液约10mL置于注射器中,由恒流泵缓慢输出,溶液喷速为0.4mL/h,电压范围为15KV,喷头规格22G,经喷头喷出至平面接收板,收集即得粉末状雷帕霉素微球制剂,接收距离为15cm。
实施例4雷帕霉素微球
(1)用电子天平精密称250mg PVA403,量取5mL纯水,将250mg PVA403在搅拌的状态下加入到纯水中,充分溶解制备成溶液①,再用电子天平精密称5mg雷帕霉素原料药和80mg PLGA50/50(0.23dl/l),将80mg PLGA50/50(0.23dl/l)先溶于1mL的二氯甲烷中,涡旋后超声5min使其充分溶解,再加入5mg雷帕霉素原料药涡旋并超声制备成溶液②。将溶液②倒入溶液①中超声5min,使其充分乳化,于室温下继续搅拌1h挥发有机试剂。之后将2.5mL无水乙醇和2.5mL N,N-二甲基甲酰胺(DMF)加入其中,充分搅拌。再将40mg PEO(Mn=50,000)在搅拌的状态下加入到溶液中,充分搅拌后再将30mg透明质酸钠(Mn=100,000)加入其中,充分搅拌后超声5min,使溶液均匀分散,得到微球静电喷雾处方。
(2)将微球工作液约10mL置于注射器中,由恒流泵缓慢输出,溶液喷速为0.4mL/h,电压范围为15KV,喷头规格22G,经喷头喷出至平面接收板,收集即得粉末状雷帕霉素微球制剂,接收距离为15cm。
实施例5雷帕霉素微球
(1)用电子天平精密称250mg PVA403,量取5mL纯水,将250mgPVA403在搅拌的状态下加入到纯水中,充分溶解制备成溶液①,再用电子天平精密称5mg雷帕霉素原料药和80mgPLGA50/50(0.2dl/l),将80mg PLGA50/50(0.2dl/l)先溶于1mL的二氯甲烷中,涡旋后超声5min使其充分溶解,再加入5mg雷帕霉素原料药涡旋并超声制备成溶液②。将溶液②倒入溶液①中超声5min,使其充分乳化,于室温下继续搅拌1h挥发有机试剂。之后将2.5mL无水乙醇和2.5mL N,N-二甲基甲酰胺(DMF)加入其中,充分搅拌。再将40mg PEO(Mn=50,000)在搅拌的状态下加入到溶液中,充分搅拌后再将40mg透明质酸钠(麦克林)加入其中,充分搅拌后超声5min,使溶液均匀分散,得到微球静电喷雾处方。
(2)将微球工作液约10mL置于注射器中,由恒流泵缓慢输出,溶液喷速为0.4mL/h,电压范围为15KV,喷头规格22G,经喷头喷出至平面接收板,收集即得粉末状雷帕霉素微球制剂,接收距离为15cm。
实施例6雷帕霉素微球
(1)用电子天平精密称250mg PVA403,量取5mL纯水,将250mg PVA403在搅拌的状态下加入到纯水中,充分溶解制备成溶液①,再用电子天平精密称5mg雷帕霉素原料药和80mg PLGA50/50(0.23dl/l),将80mg PLGA50/50(0.23dl/l)先溶于1mL的二氯甲烷中,涡旋后超声5min使其充分溶解,再加入5mg雷帕霉素原料药涡旋并超声制备成溶液②。将溶液②倒入溶液①中超声5min,使其充分乳化,于室温下继续搅拌1h挥发有机试剂。之后将2.5mL无水乙醇和2.5mL N,N-二甲基甲酰胺(DMF)加入其中,充分搅拌。再将40mg PEO(Mn=100,000)在搅拌的状态下加入到溶液中,充分搅拌后再将40mg透明质酸钠(Mn=20万至40万)加入其中,充分搅拌后超声5min,使溶液均匀分散,得到微球静电喷雾处方。
(2)将微球工作液约10mL置于注射器中,由恒流泵缓慢输出,溶液喷速为0.4mL/h,电压范围为15KV,喷头规格22G,经喷头喷出至平面接收板,收集即得粉末状雷帕霉素微球制剂,接收距离为15cm。
实施例7雷帕霉素微球
(1)用电子天平精密称250mg PVA403,量取5mL纯水,将250mg PVA403在搅拌的状态下加入到纯水中,充分溶解制备成溶液①,再用电子天平精密称5mg雷帕霉素原料药和80mg PLGA50/50(0.1dl/l),将80mg PLGA50/50(0.1dl/l)先溶于1mL的二氯甲烷中,涡旋后超声5min使其充分溶解,再加入5mg雷帕霉素原料药涡旋并超声制备成溶液②。将溶液②倒入溶液①中超声5min,使其充分乳化,于室温下继续搅拌1h挥发有机试剂。之后将2.5mL无水乙醇和2.5mL N,N-二甲基甲酰胺(DMF)加入其中,充分搅拌。再将40mg PEO(Mn=10,000)在搅拌的状态下加入到溶液中,充分搅拌后再将40mg透明质酸钠(Mn=10,000)加入其中,充分搅拌后超声5min,使溶液均匀分散,得到微球静电喷雾处方。
(2)将微球工作液约10mL置于注射器中,由恒流泵缓慢输出,溶液喷速为0.4mL/h,电压范围为15KV,喷头规格22G,经喷头喷出至平面接收板,收集即得粉末状雷帕霉素微球制剂,接收距离为15cm。
实施例8雷帕霉素微球
(1)用电子天平精密称250mg PVA403,量取5mL纯水,将250mg PVA403在搅拌的状态下加入到纯水中,充分溶解制备成溶液①,再用电子天平精密称5mg雷帕霉素原料药和80mg PLGA50/50(0.1dl/l),将80mg PLGA50/50(0.1dl/l)先溶于1mL的二氯甲烷中,涡旋后超声5min使其充分溶解,再加入5mg雷帕霉素原料药涡旋并超声制备成溶液②。将溶液②倒入溶液①中超声5min,使其充分乳化,于室温下继续搅拌1h挥发有机试剂。之后将2.5mL无水乙醇和2.5mL N,N-二甲基甲酰胺(DMF)加入其中,充分搅拌。再将40mg PEO(Mn=10,000)在搅拌的状态下加入到溶液中,充分搅拌后再将30mg透明质酸钠(Mn=10,000)加入其中,充分搅拌后超声5min,使溶液均匀分散,得到微球静电喷雾处方。
(2)将微球工作液约10mL置于注射器中,由恒流泵缓慢输出,溶液喷速为0.4mL/h,电压范围为15KV,喷头规格22G,经喷头喷出至球囊导管装置,收集即得粉末状雷帕霉素微球制剂,接收距离为15cm。
实施例9雷帕霉素微球
(1)用电子天平精密称45mg PVA403,量取5mL纯水,将45mg PVA403在搅拌的状态下加入到纯水中,充分溶解制备成溶液①,再用电子天平精密称25mg雷帕霉素原料药和50mg PLGA50/50(0.1dl/l),将50mg PLGA50/50(0.1dl/l)先溶于1mL的二氯甲烷中,涡旋后超声5min使其充分溶解,再加入5mg雷帕霉素原料药涡旋并超声制备成溶液②。将溶液②倒入溶液①中超声5min,使其充分乳化,于室温下继续搅拌1h挥发有机试剂。之后将2.5mL无水乙醇和2.5mL N,N-二甲基甲酰胺(DMF)加入其中,充分搅拌。再将30mg PEO(Mn=10,000)在搅拌的状态下加入到溶液中,充分搅拌后再将40mg透明质酸钠(Mn=10,000)加入其中,充分搅拌后超声5min,使溶液均匀分散,得到微球静电喷雾处方。
(2)将微球工作液约10mL置于注射器中,由恒流泵缓慢输出,溶液喷速为0.4mL/h,电压范围为15KV,喷头规格22G,经喷头喷出至球囊导管装置,收集即得粉末状雷帕霉素微球制剂,接收距离为15cm。
实施例10雷帕霉素微球
(1)用电子天平精密称25mg PVA403,量取5mL纯水,将25mg PVA403在搅拌的状态下加入到纯水中,充分溶解制备成溶液①,再用电子天平精密称25mg雷帕霉素原料药和25mg PLGA50/50(0.1dl/l),将25mg PLGA50/50(0.1dl/l)先溶于1mL的二氯甲烷中,涡旋后超声5min使其充分溶解,再加入5mg雷帕霉素原料药涡旋并超声制备成溶液②。将溶液②倒入溶液①中超声5min,使其充分乳化,于室温下继续搅拌1h挥发有机试剂。之后将2.5mL无水乙醇和2.5mL N,N-二甲基甲酰胺(DMF)加入其中,充分搅拌。再将30mg PEO(Mn=10,000)在搅拌的状态下加入到溶液中,充分搅拌后再将30mg透明质酸钠(Mn=10,000)加入其中,充分搅拌后超声5min,使溶液均匀分散,得到微球静电喷雾处方。
(2)将微球工作液约10mL置于注射器中,由恒流泵缓慢输出,溶液喷速为0.4mL/h,电压范围为15KV,喷头规格22G,经喷头喷出至球囊导管装置,收集即得粉末状雷帕霉素微球制剂,接收距离为15cm。
结果及讨论
对实施例5所制备的雷帕霉素微球形态学及粒径分布进行研究:
(1)使用透射电子显微镜(TEM)进行形态观察。从铝箔纸上刮取适量雷帕霉素微球充分分散于纯水中,以微量移液枪吸取后滴于碳膜铜网,同时以磷钼酸负染30s,随后样品放在红外灯下烘干,由分散到烘干过程控制在30min左右。将样品推入样品杆,使用TEM观察样品的形态特征,结果见图1。由图看出,该微球分布较均一,呈椭圆形颗粒状,透明质酸钠未能形成壳层包裹微球,且灰色阴影处可见分散不均匀的透明质酸钠,说明透明质酸钠本身的粘性导致了微球之间的粘连,黑色微球部分粒径为200-300nm。
(2)使用扫描电子显微镜(SEM)进行形态观察。从铝箔纸上刮取适量雷帕霉素微球置于样品架上,使用导电胶将其固定于样品盘上,在真空条件下使用SEM观测其表面形态,结果见图2。由该图看出,该微球分布不均匀,微球粒径大小不均一,且微球之间有明显的粘连现象,其粒径为400-800nm。
(3)粒径分布。取适量雷帕霉素微球,加入适量蒸馏水,振荡涡旋后使其完全溶解,随后使用90Plus PALS粒度分析仪(美国布鲁克海文仪器公司)测定微球的粒径分布,结果表明,该雷帕霉素微球的粒径为763.67nm,PDI指数为0.341。
对实施例6所制备的雷帕霉素微球形态学及粒径分布进行研究:
(1)使用透射电子显微镜(TEM)进行形态观察。从铝箔纸上刮取适量雷帕霉素微球充分分散于纯水中,以微量移液枪吸取后滴于碳膜铜网,同时以磷钼酸负染30s,随后样品放在红外灯下烘干,由分散到烘干过程控制在30min左右。将样品推入样品杆,使用TEM观察样品的形态特征,结果见图3。由该图看出,该微球分布不均一,但微球呈较规整的圆形颗粒状,透明质酸钠能形成壳层包裹微球,但微球间存在粘连现象,并且在微球周围可见分散不均匀的透明质酸钠,微球粒径为800-1000nm。
(2)使用扫描电子显微镜(SEM)进行形态观察。从铝箔纸上刮取适量雷帕霉素微球置于样品架上,使用导电胶将其固定于样品盘上,在真空条件下使用SEM观测其表面形态,结果见图4。由该图看出,该微球颗粒分布不均匀,微球粒径大小极不均一,且微球之间有明显的粘连现象,其粒径为800-2500nm。
(3)粒径分布。取适量雷帕霉素微球,加入适量蒸馏水,振荡涡旋后使其完全溶解,随后使用90Plus PALS粒度分析仪(美国布鲁克海文仪器公司)测定微球的粒径分布,结果表明,该雷帕霉素微球的粒径为1143.64nm,PDI指数为0.286。
对实施例8所制备的雷帕霉素微球形态学及粒径分布进行研究:
(1)使用透射电子显微镜(TEM)进行形态观察。从铝箔纸上刮取适量雷帕霉素微球充分分散于纯水中,以微量移液枪吸取后滴于碳膜铜网,同时以磷钼酸负染30s,随后样品放在红外灯下烘干,由分散到烘干过程控制在30min左右。将样品推入样品杆,使用TEM观察样品的形态特征,结果见图5。由该图看出,该微球分布均匀,呈球形颗粒状,微球表面有透明质酸钠层包裹,且粒径为300-400nm。
(2)使用扫描电子显微镜(SEM)进行形态观察。从铝箔纸上刮取适量雷帕霉素微球置于样品架上,使用导电胶将其固定于样品盘上,在真空条件下使用SEM观测其表面形态,结果见图6。由该图看出,该微球分布均匀,呈规整的球形颗粒状,微球之间略有粘连,且粒径为300-400nm。
(3)粒径分布。取适量雷帕霉素微球,加入适量蒸馏水,振荡涡旋后使其完全溶解,随后使用90Plus PALS粒度分析仪(美国布鲁克海文仪器公司)测定微球的粒径分布,如图7所示。结果表明,该雷帕霉素微球的粒径为436.28nm,PDI为0.238。
实施例9所制备的雷帕霉素微球形态学及粒径分布研究:
(1)使用扫描电子显微镜(SEM)进行形态观察。从铝箔纸上刮取适量雷帕霉素微球置于样品架上,使用导电胶将其固定于样品盘上,在真空条件下使用SEM观测其表面形态,结果见图8。由图看出,该微球分布均匀,但有的呈球形颗粒状,有的微球呈长条状,且微球之间略有粘连,粒径为300-800nm。
(2)粒径分布。取适量雷帕霉素微球,加入适量蒸馏水,振荡涡旋后使其完全溶解,随后使用90Plus PALS粒度分析仪(美国布鲁克海文仪器公司)测定微球的粒径分布,结果表明,该雷帕霉素微球的粒径为791.64nm,PDI为0.361。
实施例10所制备的雷帕霉素微球形态学及粒径分布研究:
(1)使用扫描电子显微镜(SEM)进行形态观察。从铝箔纸上刮取适量雷帕霉素微球置于样品架上,使用导电胶将其固定于样品盘上,在真空条件下使用SEM观测其表面形态,结果见图9。由图看出,该微球分布均匀,呈规整的球形颗粒状,微球之间略有粘连,且粒径为400-900nm。
(2)粒径分布。取适量雷帕霉素微球,加入适量蒸馏水,振荡涡旋后使其完全溶解,随后使用90Plus PALS粒度分析仪(美国布鲁克海文仪器公司)测定微球的粒径分布,结果表明,该雷帕霉素微球的粒径为847.20nm,PDI为0.281。
对实施例8的载药量与包封率进行测定:
喷涂全部静电喷雾微球工作液后,将球囊前端含药部分放入2mL水中溶解,溶解过程中使用超声加速溶解过程,待样品完全溶解后,加入1mL乙腈按1∶1的比例破乳,涡旋30s后过0.45μm的尼龙有机膜即得样品1。另取1mL使用离心机8000rpm离心10min后加入1mL乙腈按1∶1的比例破乳,过0.45μm的尼龙有机膜即得样品2。取样品1和样品2中20μL样品经HPLC测定分析,样品1测得的药量即为实际的含药量,样品2测得的药量即为实际包载的药量,实际包载的药量经换算即为载药量,(实际包载的药量/实际的含药量)×100%即为包封率。最终测得载药量为10.1mg/g,包封率为84.2%。
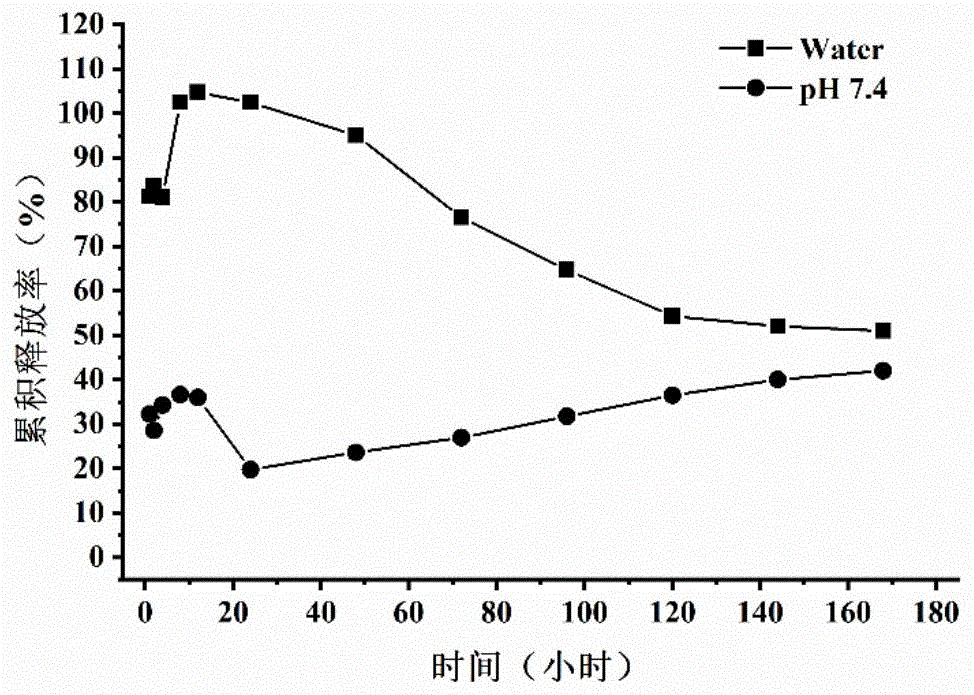
对实施例8的雷帕霉素微球进行体外释药实验:
以100mL蒸馏水溶液作为溶出介质,温度37±0.5℃,转速100rpm。取实施例8所制备的雷帕霉素微球置于溶出介质水和pH7.4磷酸盐缓冲液中,分别于1h、2h、4h、8h(小时)、1d、2d、3d、4d、5d、6d、7d(天),取出1mL溶出液,同时及时补充等量等温的溶出介质,经8000rpm离心,取500μL加500μL色谱乙腈稀释后取其中20μL样品经HPLC测定分析,计算药物的累积释放率,结果见图10。由该图可看出,雷帕霉素微球在水中24小时累积释药率即达105%,之后开始缓慢下降,直至累积释药率达到45%,而雷帕霉素微球在pH7.4磷酸盐缓冲液中24小时累积释药率达到38%后立刻下降,随后缓慢上升,直至达到50%。
实验例
实验用新西兰兔植入实施例的药物球囊,共计植入20只动物,
实验组:植入18只新西兰兔,植入部位为双侧髂动脉,每组动物置入药物球囊,术后即刻(0天)、术后4天和7天各解剖6只。向实验组兔均植入上述实施例8-10所述的药物球囊。
对照组:植入2只新西兰兔,植入部位为双侧髂动脉,每组动物置入空白对照球囊导管2个,术后即刻解剖1只,术后7天解剖1只。
新西兰兔术前静脉给予肝素,监测血压、心率等指标。使用导引导管和0.014导丝,经颈动脉输送药物球囊到达髂动脉目标位置后,以适当压力扩开药物球囊,保压60秒后撤出球囊压力。记录球囊距血管分叉位置,手术结束从实验动物体内撤除一切器械、设备。术后术后即刻(0天)、术后4天和7天原位解剖新西兰图,暴露目标血管,在手术操作部位上下游2-3mm处截取目的血管组织。
血管样品称重后,剪碎,按照组织∶50%甲醇=1∶4(w∶v)的比例进行匀浆,部分匀浆液在-20℃以下冻留样贮存,用移液器精确移取20μL匀浆液于1.5mL的EP管中,加入180μL空白基质后混匀,备用。取100μL标准曲线样品和质控样品按照样品∶沉淀剂=1∶3(v∶v)的比例加入沉淀剂,混匀,4℃下以12000rpm离心10min,液质联用色谱法测定组织中西罗莫司含量(单位ng/mg)。
色谱条件:色谱柱:ZORBAX Extend-C18柱,2.1*50mm 3.5μm,流速:0.9mL/min,进样体积:20μL,柱温:40℃,流动相A:0.1%甲酸超纯水溶液(10mmol甲酸铵),流动相B:0.1%甲酸甲醇溶液(10mmol甲酸铵),梯度洗脱测定数据见下表。
由此可见,实施例8-10所述的药物球囊可以发挥把西罗莫司摄入血管壁,并能够在7天内持续发挥作用。上述技术效果对其他实施例同样适用,在此不再赘述。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明,本领域技术人员可以在不脱离本发明的精神和范围的情况下作出各种修改和变型,这样的修改和变型均落入由所附权利要求所限定的范围之内。
- 介入医疗器械推送器及介入医疗器械输送系统
- 介入医疗器械推送器及介入医疗器械输送系统
