一种PD-1/PTX联合PD-1耐药模型建立的方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于医药技术领域,具体涉及一种PD-1/PTX联合PD-1耐药模型建立的方法。
背景技术
随着研究者对恶性肿瘤免疫治疗方面的突破性研究,发现肿瘤免疫治疗可作为一种有效的治疗方法,其中代表性的是阻断程序性死亡受体1(PD-1)/程序性死亡受体⁃配体1(PD-L1)免疫抑制点通路的免疫治疗方法。目前PD-1抑制剂联合其他疗法使用用于晚期癌症的治疗,如紫杉醇(PTX),可以大幅度的提高治疗效果。但是并不是所有的患者都对PD-1抑制剂治疗有反应,或者很多患者在治疗后发生了耐药的情况。因此,探究PD-1/PTX联合PD-1耐药是本领域亟需解决的问题。
发明内容
本发明的目的在于提供一种在动物水平建立PD-1/PTX联合PD-1耐药模型以及建立原代细胞的方法并建立了耐药原代细胞系,通过建立体外体内耐药模型将有助于研究病人PD-1/PTX联合PD-1耐药机制。
本发明为实现上述目的所采取的技术方案为:
本发明公开了一种PD-1/PTX联合PD-1耐药模型建立的方法,包括以下步骤:
a)培养实体瘤细胞;
b)将实体瘤细胞注入小鼠皮下,待肿瘤长大到100-150mm
本发明通过建立体外体内PD-1单药或PD-1联合PTX耐药模型以及PD-1耐药细胞系、PD-1联合PTX耐药细胞系,将有助于研究病人PD-1/PTX联合PD-1耐药机制,改善PD-1或者PD-1联合PTX耐药情况从而提高患者疗效。
根据上述方法,在某些实施方式中,实体瘤细胞包括实体瘤包括良性实体瘤和恶性实体瘤;其中良性实体瘤主要包括错构瘤、平滑肌瘤、血管瘤、淋巴管瘤、腺瘤或腺瘤性息肉;恶性实体瘤包括霍奇金淋巴瘤、非霍奇金淋巴瘤、肺癌、乳腺癌、卵巢癌、胃癌、结肠癌、直肠癌、肝癌、胰腺癌,还有头颈部恶性肿瘤、泌尿系统恶性肿瘤、子宫内膜癌、子宫颈癌、骨肉瘤、软骨肉瘤、尤文氏肉瘤、甲状腺癌、肝母细胞瘤、肾母细胞瘤。
根据上述方法,在某些实施方式中,PTX药物还包括白蛋白结合紫杉醇、紫杉醇、多西他赛、卡巴他赛,或具有紫衫烷骨架结构的衍生物。
根据上述方法,在某些实施方式中,PD-1抗体包括特瑞普利单抗。
根据上述方法,在某些实施方式中,PD-1的剂量范围为体内10-100mg;具体可选10mg、20mg、30mg、40mg、50mg、60mg、70mg、80mg、90mg、100mg。
根据上述方法,在某些实施方式中,紫杉醇药物的剂量范围为体内10-100mg;具体可选10mg、20mg、30mg、40mg、50mg、60mg、70mg、80mg、90mg、100mg。
本发明联合的给药途径选自经口给药、胃肠外给药、经皮给药;其中胃肠外给药包括但不限于静脉注射、皮下注射、肌肉注射。
根据上述方法,在某些实施方式中,含PD-1抗体的药物包括PD-1抗体的药用的赋形剂、稀释剂、载体的一种或多种。
根据上述方法,在某些实施方式中,含PTX药物的药物包括PTX药物的药用的赋形剂、稀释剂、载体的一种或多种。
本发明进一步涉及PD-1抗体与紫杉醇在制备预防或治疗各种实体肿瘤的药物中的用途,其中PD-1抑制剂的给药频次可以是一日一次、一日二次、一日三次、一周一次、二周一次、三周一次或一月一次;紫杉醇的给药频次可以是一日一次、一日二次、一日三次、一周一次、二周一次、三周一次或一月一次。
本发明所述的PD-1抗体、紫杉醇,可以单独给药,或者与一种两种治疗剂联合使用。
本发明所述的“联合”是一种给药方式,是指一定时间期限内给予至少一种剂量的PD-1抗体和至少一种剂量紫杉醇。所述的时间期限可以是一个给药周期内,优选4周内,3周内,2周内,1周内,24小时以内,或12小时以内。这种期限包括这样的治疗,其中通过相同给药途径或不同给药途径给予PD-1抗体及紫杉醇。
本发明还提供了一株PD-1抗体耐药原代细胞系,其由一种PD-1耐药模型的细胞构建。
本发明还提供了一种株PTX联合PD-1抗体耐药原代细胞系,其由一种PTX联合PD-1耐药模型的细胞构建。
本发明通过建立体外体内PD-1单药或PD-1联合PTX耐药模型以及PD-1耐药细胞系、PD-1联合PTX耐药细胞系,将有助于研究病人PD-1/PTX联合PD-1耐药机制,改善PD-1或者PD-1联合PTX耐药情况从而提高患者疗效;因此,本发明是一种在动物水平建立PD-1/PTX联合PD-1耐药模型以及建立原代细胞的方法并建立了耐药原代细胞系,通过建立体外体内耐药模型将有助于研究病人PD-1/PTX联合PD-1耐药机制。
附图说明
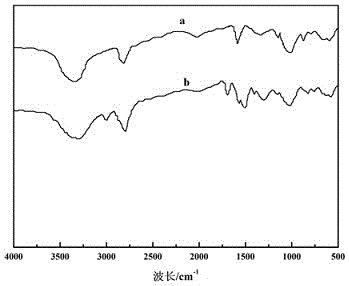
图1为β-环糊精改性前后的红外光谱图;
图2为实施例1中小鼠给予PD-1、PTX+PD-1治疗后小鼠体内肿瘤体积的变化;
图3为实施例1中小鼠给予PD-1、PTX+PD-1治疗后小鼠体内肿瘤体重的变化;
图4为实施例4给予小鼠给予PD-1治疗后的耐药细胞系;
图5为实施例4给予小鼠给予PTX+PD-1治疗后的耐药细胞系。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
当用“给予”和“治疗”提及动物、人、实验对象、细胞、组织、器官或生物液时,是指将外源性药物、治疗剂、诊断剂或组合物与动物、人、受治疗者、细胞、组织、器官或生物液接触。“给予”和“治疗”可指例如治疗方法、药动学方法、诊断方法、研究方法和实验方法。治疗细胞包括让试剂与细胞接触以及让试剂与流液接触,其中所述流液与细胞接触。“给予”和“治疗”还意味着例如通过试剂、诊断剂、结合组合物或通过其他细胞对细胞进行体外和离体治疗。
为了加快耐药模型的建立,本发明还提供了一种增溶剂,包括β-环糊精衍生物;其由2-(甲基-2-吡啶基氨基)乙酸改性β-环糊精。将紫衫醇类药物与β-环糊精衍生物混合,与PD-1共同给予治疗,可能能够进一步提高紫杉醇类药物的溶解度,进而增加紫衫醇类药物的溶解性,易于人体或动物体吸收,进而更易构建耐药模型。
需要说明的是:β-环糊精衍生物与紫杉醇的重量比为1:0.01-0.05;具体优选1:0.01、1:0.02、1:0.03、1:0.04、1: 0.05。
进一步需要说明的是,本发明将β-环糊精衍生物与紫杉醇制成冻干剂进行使用,其制备方法,包括:将紫杉醇配制成浓度为10-50mg/L的紫杉醇乙醇溶液,然后加入浓度为5-10wt%β-环糊精衍生物水溶液,其中β-环糊精衍生物与紫杉醇的重量比为1:0.01-0.05,在30-35℃下恒温搅拌2-4h,再置于-50℃至-60℃下预冻,然后真空冷冻干燥18-24h,得到紫杉醇冻干制剂。
本发明还公开了β-环糊精衍生物的制备方法,包括:将2-(甲基-2-吡啶基氨基)乙酸盐酸盐、次亚磷酸钠溶于去离子水中,搅拌混合均匀,然后加入β-环糊精,加热溶解,然后置于100-110℃下干燥1-3h,重新溶解,析出沉淀,清洗,干燥,得到β-环糊精衍生物。
上述β-环糊精衍生物的制备方法中,2-(甲基-2-吡啶基氨基)乙酸盐酸盐、次亚磷酸钠、去离子水与β-环糊精的重量比为8-15:0.5-1:10-20:5-10。
进一步需要说明的是,本发明所用β-环糊精衍生物的制备方法,包括:将2-(甲基-2-吡啶基氨基)乙酸盐酸盐、次亚磷酸钠溶于去离子水中,搅拌混合均匀,然后加入β-环糊精,其中2-(甲基-2-吡啶基氨基)乙酸盐酸盐、次亚磷酸钠、去离子水与β-环糊精的重量比为8-15:0.5-1:10-20:5-10,加热到70~80℃溶解,然后置于100-110℃下干燥1-3h,用去离子水重新溶解,再加入无水乙醇析出沉淀,并用无水乙醇清洗2-3次,最后在50-60℃条件下干燥恒重,得到β-环糊精衍生物。
更进一步需要说明的是,本发明实施例中所用β-环糊精衍生物的制备方法,包括:将2-(甲基-2-吡啶基氨基)乙酸盐酸盐、次亚磷酸钠溶于去离子水中,搅拌混合均匀,然后加入β-环糊精,其中2-(甲基-2-吡啶基氨基)乙酸盐酸盐、次亚磷酸钠、去离子水与β-环糊精的重量比为10:1:15:8,加热到75℃溶解,然后置于110℃下干燥2h,用去离子水重新溶解,再加入无水乙醇析出沉淀,并用无水乙醇清洗3次,最后在55℃条件下干燥恒重,得到β-环糊精衍生物。
以下结合具体实施方式和附图对本发明的技术方案作进一步详细描述:
实施例1:动物水平建立PD-1联合PTX或PD-1单药耐药模型
1. 受试药物
药物名称:PD-1抗体、紫杉醇(PTX);
2. 实验动物
BALB/c小鼠,6-8周龄,雌性,SPF级;
饲养环境:控制温度为20-26℃;控制相对湿度为40%-70%;光照:自动光照,每12h明暗交替。
3. 实验步骤
1)将4T1细胞重悬于PBS中(2×10
表1 实验分组及给药方案
注:QDx4:每三天给一次,给药4次;IV:尾静脉注射;i.p.:腹腔注射。
2)经过一个治疗周期后停药一周后,将小鼠处死取瘤块,获得肿瘤细胞,将肿瘤细胞皮下荷瘤于6只BALB/c小鼠右肋部皮下,记录分组,待小鼠平均肿瘤体积达到100-150mm
表2 实验分组及给药方案
注:QDx4:每三天给一次,给药4次;IV:尾静脉注射;i.p.:腹腔注射。
3)再经过一个治疗周期后停药一周后,将小鼠处死取瘤块,获取肿瘤细胞,皮下荷瘤于6只BALB/c小鼠右肋部皮下,记录分组,待小鼠平均肿瘤体积达到100-150mm
表3 实验分组及给药方案
注:QDx4:每三天给一次,给药4次;IV:尾静脉注射;i.p.:腹腔注射。
4)经过三轮给药后,进行验证,将小鼠处死取瘤块,获得肿瘤细胞,将肿瘤细胞皮下荷瘤17只BALB/c小鼠右肋部皮下,记录分组,待小鼠平均肿瘤体积达到100-150mm
V=0.52×a×b
其中a、b分别表示肿瘤的长、宽。
表4 实验分组及给药方案
注:QDx4:每三天给一次,给药4次;IV:尾静脉注射;i.p.:腹腔注射。
获得肿瘤细胞的方法如下:将小鼠处死取瘤块时,准备小皿,加入PBS,将取下来的肿瘤组织放在装有PBS小皿中洗一遍,将肿瘤中脂肪,纤维和坏死区域去除,移至另一个小皿,然后用手术刀和剪子剪成小块2-4mm;准备酶混合液(使用Tumor Dissociation Kit试剂盒),向5ml离心管中加入2.35mlRPMI 1640,100u Enzyme D,50u Enzyme R,12.5uEnzymeA;将切好的小块放入装有酶混合液的5ml离心管中,放置在摇床上,最高转速(200r),37℃摇床震荡1h,将裂解好的肿瘤悬液过40μ滤网,将滤网放在50ml离心管上。使用RPMI 1640洗滤网后,转移至15ml离心管,300xg,离心5min,使用RPMI11640(2%P/S、10%FBS)重悬,37℃,5%CO
实施例2:动物水平建立PD-1联合PTX或PD-1单药耐药模型
1. 受试药物
药物名称:PD-1抗体、PTX冻干制剂组;
本实施例中PTX冻干制剂的制备方法,包括:将紫杉醇配制成浓度为25mg/L的紫杉醇乙醇溶液,然后加入浓度为5wt%β-环糊精衍生物水溶液,其中β-环糊精衍生物与紫杉醇的重量比为1:0.03,在32℃下恒温搅拌3h,再置于-55℃下预冻,然后真空冷冻干燥24h,得到紫杉醇冻干制剂。
且需要说明的是,本实施例的表中添加的PTX冻干制剂的含量均为PTX冻干制剂中PTX的含量。
2. 实验动物
BALB/c小鼠,6-8周龄,雌性,SPF级;
饲养环境:控制温度为20-26℃;控制相对湿度为40%-70%;光照:自动光照,每12h明暗交替。
3. 实验步骤
1)将4T1细胞重悬于PBS中(2×10
表5 实验分组及给药方案
注:QDx4:每三天给一次,给药4次;IV:尾静脉注射;i.p.:腹腔注射。
2)经过一个治疗周期后停药一周后,将小鼠处死取瘤块,按照实施例1中获得肿瘤细胞的方法获得肿瘤细胞,将肿瘤细胞皮下荷瘤6只BALB/c小鼠右肋部皮下,记录分组,待小鼠平均肿瘤体积达到100-150mm
表6 实验分组及给药方案
注:QDx4:每三天给一次,给药4次;IV:尾静脉注射;i.p.:腹腔注射。
3)再经过一个治疗周期后停药一周后,将小鼠处死取瘤块,按照实施例1中获得肿瘤细胞的方法获得肿瘤细胞,,将肿瘤细胞皮下荷瘤于6只BALB/c小鼠右肋部皮下,记录分组,待小鼠平均肿瘤体积达到100-150mm
表7 实验分组及给药方案
注:QDx4:每三天给一次,给药4次; IV:尾静脉注射;i.p.:腹腔注射。
4)经过三轮给药后,进行验证,将小鼠处死取瘤块,按照实施例1中获得肿瘤细胞的方法获得肿瘤细胞,将肿瘤细胞皮下荷瘤于17只BALB/c小鼠右肋部皮下,记录分组,待小鼠平均肿瘤体积达到100-150mm
V=0.52×a×b
其中a、b分别表示肿瘤的长、宽。
表8 实验分组及给药方案
注:QDx4:每三天给一次,给药4次; IV:尾静脉注射;i.p.:腹腔注射。
实施例3:动物水平建立PD-1联合PTX或PD-1单药耐药模型
1. 受试药物
药物名称:PD-1抗体、紫杉醇(PTX);
2. 实验动物
BALB/c小鼠,6-8周龄,雌性,SPF级;
饲养环境:控制温度为20-26℃;控制相对湿度为40%-70%;光照:自动光照,每12h明暗交替。
3. 实验步骤
与实施例1不同的是,在RPMI1640培养基中添加1-3wt%的赤藓糖醇,将其得到的4T1细胞悬浮液注射到小鼠体内,能够促进小鼠体内肿瘤的生长,进而能够更快得到耐药模型。
1)将4T1细胞重悬于PBS中(2×10
其他步骤均与实施例1相同。
实施例4:构建PD-1或PTX联合PD-1耐药原代细胞
1. 实验步骤
实施例1中的小鼠经过三轮给药后,将小鼠处死取瘤块时,准备小皿,加入PBS,将取下来的肿瘤组织放在装有PBS小皿中洗一遍,将肿瘤中脂肪,纤维和坏死区域去除,移至另一个小皿,然后用手术刀和剪子剪成小块2-4mm;准备酶混合液(使用TumorDissociation Kit试剂盒),向5ml离心管中加入2.35mlRPMI 1640,100u Enzyme D,50uEnzyme R,12.5uEnzyme A;将切好的小块放入装有酶混合液的5ml离心管中,放置在摇床上,最高转速(200r),37℃摇床震荡1h,将裂解好的肿瘤悬液过40μ滤网,将滤网放在50ml离心管上。使用RPMI 1640洗滤网后,转移至15ml离心管,300xg,离心5min,使用RPMI11640(2%P/S、10%FBS)重悬,37℃,5%CO
性能测试与表征:
1. β-环糊精衍生物红外光谱测试
采用傅立叶红外光谱仪(640-IR)对改性前后的β-环糊精进行红外光谱测试,测试范围为500-4000cm
图1为β-环糊精改性前后的红外光谱图;曲线a、b分别为β-环糊精、β-环糊精衍生物;由图1可以看出,β-环糊精在3750cm
2. β-环糊精衍生物的增溶性能
将制得的β-环糊精衍生物、β-环糊精配制成浓度为25wt%的水溶液,然后分别加入浓度为35mg/L的紫杉醇乙醇溶液,其中β-环糊精衍生物(β-环糊精)与紫杉醇的重量比为1:0.03;分别记为试验组A、试验组B、在30℃、45r/min条件下振荡48h,冷冻干燥,加入去离子水,在4000r/min条件下离心50s,过滤,进样25μL流动相:甲醇:乙腈:水(v/v/v=25:40:35);流速为2.5mL/min,进而测定紫杉醇在β-环糊精衍生物溶液中的溶解度,将不加β-环糊精衍生物、β-环糊精的实验作为对照组。
表9 紫杉醇的溶解性
由表9可以看出,紫杉醇在β-环糊精衍生物溶液中的溶解度高于200μmol/L,高于紫衫醇在β-环糊精溶液中的溶解度;远高于紫杉醇在水中的溶解度;这表明由2-(甲基-2-吡啶基氨基)乙酸改性β-环糊精制得β-环糊精衍生物,将紫衫醇类药物与β-环糊精衍生物混合,能够增加紫衫醇类药物的溶解性,易于人体或动物体吸收,进而更易构建耐药模型。
3. 紫杉醇冻干制剂安全性测试
取BALB/c小鼠10只,6-8周龄,雌性,SPF级,每组5只;
将PTX冻干制剂溶于生理盐水中配制成紫衫醇浓度为30mg/kg的溶液,记为试验组C;PTX溶于无水乙醇溶液中配制成浓度为35mg/kg的溶液,记为试验组D;分别注射2.5mL于小鼠肌肉中,隔天再次注射,连续3天,观察小鼠是否出现过敏反应,并根据小鼠的过敏反应程度分为0-4级。分级程度如表10所示。
表10 小鼠的过敏反应症状与程度等级
测试结果如表11所示:
表11 小鼠的过敏反应等级
由表3可以看出,注射紫杉醇冻干制剂与紫杉醇溶液,小鼠均没有产生明显过敏反应;因此,本发明采用2-(甲基-2-吡啶基氨基)乙酸改性β-环糊精制得β-环糊精衍生物,并与紫杉醇复合制得紫杉醇冻干制剂,其对小鼠不会产生明显过敏反应,具有较好的安全性。
4. 紫杉醇冻干制剂的代谢性能测试
取BALB/c小鼠10只,6-8周龄,雌性,SPF级,每组5只;
将PTX冻干制剂溶于生理盐水中配制成紫衫醇浓度为15mg/kg的溶液,记为试验组E;PTX溶于无水乙醇溶液中配制成浓度为15mg/kg的溶液,记为试验组F;分别注射0.5mL于小鼠体内,注射4h后从眼丛静脉采血,放入加有肝素的样品管中,离心分离出血浆,检测出血浆中PTX的浓度。
表12 注射后小鼠血浆中的PTX浓度
由表12可以看出,试验组E的PTX浓度高于9μg/mL,高于试验组F,这表明注射PTX冻干制剂后,小鼠体内在5h内仍保持较高的PTX浓度,可以延长药物在体内的循环时间,使小鼠能够较好的吸收,避免代谢出去,进而更易构建耐药模型。
5. 耐药模型与耐药细胞系的建立分析
(1)本发明中NC代表空白对照组;NC-PTX+PD-1指的是最后一轮直接种瘤小鼠,给予PTX+PD-1治疗;PTX+PD-1指的是耐药组小鼠给予PTX+PD-1治疗;PD-1指的是PD-1耐药组小鼠,给予PD-1治疗。
图2、图3分别为实施例1中小鼠给予PD-1、PTX+PD-1治疗后小鼠体内肿瘤体积的变化、体重的变化;由图2可以看出,同样给药剂量对比耐药小鼠与直接种瘤小鼠对药物耐受情况,可以看到耐药组小鼠肿瘤生长速度快于直接种瘤小鼠;由图2、图3可以看出,随着给药天数的增加,耐药小鼠给予PD-1或PTX+PD-1治疗后,肿瘤体积仍明显增大,重量也有一定的增加,说明了耐药模型构建成功。
图4、图5分别为实施例4给予小鼠给予PD-1、PTX+PD-1治疗后的耐药细胞系;由图4、图5可以看出,细胞出现体积增大的趋势,细胞之间变得更加粘连,且增殖速度变慢,故,得到了PD-1耐药细胞系、PTX+PD-1耐药细胞系。
(2)计算实施例1-3中刚开始4T1细胞注入小鼠体内肿瘤体积长至150mm
表13 小鼠肿瘤长至150mm
由表13可以看出,实施例3中刚开始4T1细胞注入小鼠体内肿瘤体积长至150mm
本发明的操作步骤中的常规操作为本领域技术人员所熟知,在此不进行赘述。
以上所述的实施例对本发明的技术方案进行了详细说明,应理解的是以上所述仅为本发明的具体实施例,并不用于限制本发明,凡在本发明的原则范围内所做的任何修改、补充或类似方式替代等,均应包含在本发明的保护范围之内。
- 程序性死亡-1(PD-1)的人单克隆抗体及单独使用或与其它免疫治疗剂联合使用抗PD-1抗体来治疗癌症的方法
- 程序性死亡-1(PD-1)的人单克隆抗体及单独使用或与其它免疫治疗剂联合使用抗PD-1抗体来治疗癌症的方法
