一种谷氨酸棒杆菌内源GlcNAc6P磷酸酶及提高GlcNAc产量的方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及一种谷氨酸棒杆菌内源GlcNAc6P磷酸酶及提高GlcNAc产量的方法,属于生物技术领域。
背景技术
N-乙酰氨基葡萄糖(GlcNAc)是氨基葡萄糖的一种衍生物,也是合成双岐因子和透明质酸的重要前体物质,又称2-(乙酰氨基)-2-脱氧-葡萄糖及N-乙酰葡萄糖胺,是生物体内多种多糖的基本组成单位,在生物体内具有重要的生理功能,现已在食品、医药、化妆品等领域有着广泛应用。谷氨酸棒杆菌是一种革兰氏阳性菌,它作为一种食品级的微生物已经应用于诸多氨基酸的工业化发酵生产中。相比于大肠杆菌来说,谷氨酸棒杆菌具有高安全性,低致病性,高抗逆性,而且受噬菌体污染的概率较低等优点,因而使用谷氨酸棒杆菌工程菌发酵生产GlcNAc更为安全。但目前使用谷氨酸棒杆菌生产GlcNAc的代谢通路还有若干途径未被解析,因此,进一步解析代谢途径对发酵生产GlcNAc来说十分重要。
发明内容
为解决上述问题,本发明通过解析谷氨酸棒杆菌中GlcNAc胞内转运蛋白以及GlcNAc6P磷酸酶,期望进一步提高GlcNAc的产量及转化率。首先根据结构相似性筛选出候选内源胞内转运蛋白和内源磷酸酶,之后分别尝试敲除内源胞内转运蛋白的编码基因或过表达磷酸酶的编码基因,发现过表达其中一种磷酸酶的编码基因,产量得到明显提升。
本发明的第一个目的是提供一种谷氨酸棒杆菌内源GlcNAc6P磷酸酶,其氨基酸序列如SEQ ID NO.6所示。该蛋白编码GlcNAc6P磷酸酶,能将GlcNAc6P去磷酸化为GlcNAc。具体地,序列如下:
MIKAIFWDMDGTMVDSEPQWGIATYELSEAMGRRLTPELRELTVGSS
LPRTMRLCAEHAGITLSDTDYERYRAGMFARVHELFDESLVPNPGVTELLT
ELKALEIPMLVTTNTERDLATRSVAAVGNEFFIGSIAGDEVPTAKPAPDMYL
EAARRVGFDPSECLVFEDSYNGMLGAVTAGCRVIGLHPEEVQAPEGVVPLR
SLHGKNSFEGVTAEMVTSWYHQIEPAGVAK。
目前,有人在使用大肠杆菌和枯草芽孢杆菌生产GlcNAc,而大肠杆菌K12(E.coliK-12)以及枯草芽孢杆菌168(Bacillus Subtilis 168)中GlcNAc胞内转运蛋白已经有相关报道,研究人员通过敲除GlcNAc胞内转运蛋白的编码基因,所得到的重组菌株生产GlcNAc的能力有显著提升。而在谷氨酸棒杆菌中上述蛋白还未被鉴定。在发酵生产GlcNAc产品时,是否存在GlcNAc向胞内转运的途径,以及胞内GlcNAc-6P去磷酸化为GlcNAc的途径,还未被揭示。
本发明中,在初步确认无专一性的内源转运蛋白后,首次通过机器学习的方法筛选出具有类似功能的转运蛋白,同时鉴定出两种具有类似功能的GlcNAc6P磷酸酶。之后通过敲除转运蛋白、过表达磷酸酶的方法以期进一步提高产量。最终发现过表达其中一种磷酸酶能够使产量进一步提升,同时进一步完善了谷氨酸棒杆菌发酵生产GlcNAc的代谢途径,具有重要的经济价值和社会意义。
本发明的第二个目的是提供编码上述谷氨酸棒杆菌内源GlcNAc6P磷酸酶的基因。
进一步地,其核苷酸序列如SEQ ID NO.3所示。
本发明的第三个目的是提供携带上述基因的重组质粒。
本发明的第四个目的是提供一种重组谷氨酸棒杆菌,所述重组谷氨酸棒杆菌过表达了如SEQ ID NO.6所示的氨基酸序列。
进一步地,以谷氨酸棒杆菌S9114为出发菌株。
进一步地,以pJYW-4为表达载体。
本发明的第五个目的是提供一种提高N-乙酰氨基葡萄糖GlcNAc产量的方法,包括应用上述重组谷氨酸棒杆菌进行发酵的步骤。
进一步地,将所述重组谷氨酸棒杆菌在种子培养基中活化培养得到种子液,再将种子液接种至发酵培养基中进行发酵培养。
进一步地,发酵温度为25~35℃。
本发明的有益效果:
本发明通过机器学习的方式分析转录组数据,筛选出了一种谷氨酸棒杆菌内源GlcNAc胞内转运蛋白,同时筛选出了两种谷氨酸棒杆菌内源GlcNAc6P磷酸酶,并公布了其编码基因。从而提供了一种提高谷氨酸棒杆菌N-乙酰氨基葡萄糖产量的方法,其浓度在摇瓶中为37.5g/L,50L发酵罐中产量为117.1g/L,葡萄糖转化率为30.7%,均为行业领先水平。本发明筛选出的GlcNAc胞内转运蛋白以及GlcNAc6P磷酸酶编码基因为进一步代谢工程改造谷氨酸棒杆菌生产氨基葡萄糖奠定了基础。
附图说明
图1为实验验证谷氨酸棒杆菌S9114中是否存在专一性的GlcNAc胞内转运蛋白;
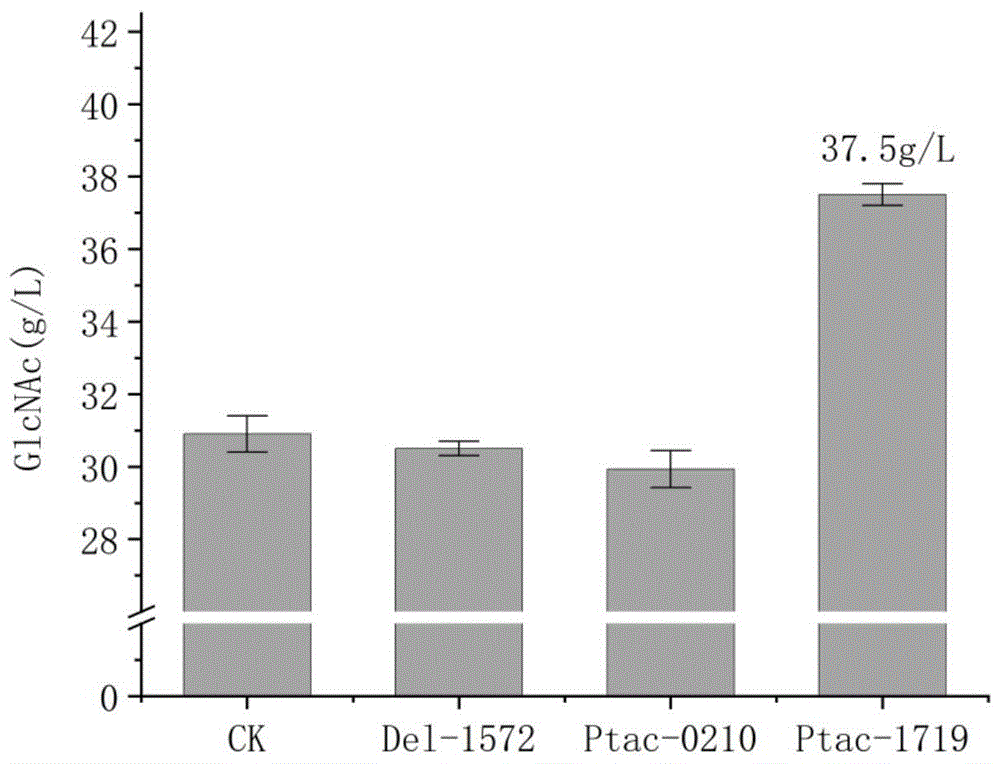
图2为对照组、敲除胞内转运蛋白、过表达两种磷酸酶发酵生产GlcNAc的产量;
图3为不同菌代谢途径的鉴定情况;灰色方框代表相关蛋白已经解析,白色方框代表未被解析。
具体实施方式
下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
下述实施例中所涉及的检测方法及相关实验方案:
(一)培养基
种子活化液体培养基(LBB培养基)(g/L):酵母粉5.0,蛋白胨10.0,NaCl 10.0,脑心浸液18.5,250mL挡板三角瓶装液量为25mL。
种子活化固体培养基(LBB固体培养基)(g/L):酵母粉5.0,蛋白胨10.0,NaCl10.0,脑心浸液18.5,营养琼脂粉20.0。
感受态培养基(g/L):脑心浸液18.5,酵母粉5.0,蛋白胨10.0,NaCl 10.0,甘氨酸30.0,异烟肼4.0,添加1mL吐温80(Tween 80),500mL挡板三角瓶装液量为50mL。
电击转化后恢复液体培养基LBHIS(g/L):蛋白胨5.0,酵母膏5.0,NaCl5.0,山梨醇91.0,脑心浸液18.5。
转化子涂布固体培养基(g/L):蛋白胨5.0,酵母膏5.0,NaCl 5.0,山梨醇91.0,脑心浸液18.5,营养琼脂20.0。
种子培养基(g/L):葡萄糖25.0,玉米浆20.0,KH
摇瓶发酵培养基(g/L):葡萄糖100.0,玉米浆15.0,KH
补料分批发酵初始培养基(g/L):葡萄糖50.0,玉米浆10.0,KH
谷氨酸棒杆菌培养基所采用的抗生素及相应浓度:卡那霉素25μg/mL,氯霉素10μg/mL。
灭菌条件:葡萄糖配成500g/L的母液,采用115℃灭菌20min,不含葡萄糖的培养基采用121℃灭菌15min。
(二)产物的测定方法
乙酰氨基葡萄糖的测定方法:高效液相色谱(HPLC)检测法:Agilent 1260,RID检测器,HPX-87H柱(Bio-Rad Hercules,CA),流动相:5mM H
发酵液中葡萄糖浓度采用SBA-40C型葡萄糖-谷氨酸分析仪(山东科学院生物研究所)进行测定。
(三)质粒化学转化大肠杆菌感受态细胞
超底温冰箱保存的大肠杆菌感受态细胞置于冰上融化;加入6μL消化后的PCR产物轻轻混合,冰浴30min。将装有感受态细胞的离心管置于42℃的水浴中热激90s,将离心管转移至冰浴中使细胞冷却2min;加入800μL LB培养基于37℃培养1h;离心去除少量上请,再悬浮菌休,将培养液涂布在含有相应抗生素的LB平板上,37℃倒置培养10-12h,观察菌落,挑取单菌落使用菌落PCR验证阳性克隆,挑取阳性单菌落于含有相应抗性的LB液体培养基中培养过夜后提取质粒并进行测序验证。
(四)谷氨酸棒杆菌电转感受态的制备
(1)谷氨酸棒杆菌S9114接种于LBB培养基(需要在新鲜培养的斜面上进行挑选,否则会影响菌体的生长),置于巡回式摇床(220rpm)上,30℃培养16h,OD600达到0.4。
(2)以10%的接种量将(1)中的菌液转接入感受态培养基中OD600达到0.3,置于巡回式摇床(220rpm)上,30℃培养至OD600达到0.8(培养约3-5h,处于对数生长期即可,一般如果菌浓的持续较低约0.6左右也可以继续后续操作)。需要保证菌体浓度尽量要浓,一般浓缩倍数为100倍(50mL感受态培养基浓缩至0.5mL制备5管感受态细胞)。
(3)菌液冰水浴15min,4000rpm,4℃离心10min,弃去上清。
(4)用30mL预冷的10%甘油充分悬浮菌体,4000rpm,4℃离心10min,弃去上清,重复洗涤重悬四次。
(5)用500μL预冷10%甘油重悬细胞(浓缩100倍),1.5mL无菌离心管分装,每管分装90-100μL。
(6)分装的感受态细胞-80℃保存待用(为保证感受态的转化效率最好现用现做,不能放置超过1周,否则由于感受态细胞裂解细胞内容物释放,在后续电击转化过程中造成电转杯的击穿,同时影响转化效率)。
(五)谷氨酸棒杆菌的电击转化
(1)-80℃保存的谷氨酸棒状杆菌感受态,冰浴中融化。
(2)加入1-5.0μL质粒混匀(DNA总量约为1.0μg),冰浴5-10min。
(3)加入提前预冷的0.1cm电击杯中,1.8KV电压5ms电击2次。
(4)迅速加入预热的恢复用培养基(LBHIS)1.0mL混匀并转移到新的1.5mL无菌离心管中,46℃水浴6min。
(5)将菌体置于巡回式摇床(220rpm)上,30℃后培养2h。
(6)6000rpm,常温离心1min,弃掉少量上清,剩余菌液重悬并涂布到加入对应抗性的转化子涂布固体平板中,于30℃恒温培养箱,培养2-3天。
实施例1以GlcNAc为唯一碳源,验证谷氨酸棒杆菌工程菌能否转运至胞内利用
设置三组平行实验,其中一组为对照。具体培养基配方为(g/L):玉米浆20.0,KH
挑取活化后的谷氨酸棒杆菌S9114单菌落接种于种子活化液体培养基500ml摇瓶中于30℃,220rpm摇床培养。至菌体OD600达到1.0左右时,准确接种5%菌液于实验培养基中,30℃,220rpm,培养48小时,每隔12h取样,稀释到合适浓度后用分光光度计在600nm下检测菌液吸光度。结果表明(见图1)以GlcNAc为碳源的两组实验组,菌体OD值较接种时几乎无增长。以葡萄糖为碳源的对照组,菌体OD值增高8倍左右,表明谷氨酸棒杆菌S9114不能利用GlcNAc作为碳源。因此,可以初步推断出谷氨酸棒杆菌S9114中无专一性的GlcNAc胞内转运蛋白。
实施例2使用监督学习模型辅助鉴定谷棒内源的GlcNAc胞内转运蛋白和磷酸酶
使用转录组数据用于模型训练,最终筛选出一个与GlcNAc胞内转运蛋白相似度约为30%的谷氨酸棒杆菌内源GlcNAc胞内转运蛋白:Cg1GL001572(核苷酸序列如SEQ IDNO.1所示,蛋白质序列如SEQ ID NO.4所示),以及两种与磷酸酶相似度约为40%的内源磷酸酶:Cg1GL000210(核苷酸序列如SEQ ID NO.2所示,蛋白质序列如SEQ ID NO.5所示)和Cg1GL001719(核苷酸序列如SEQ ID NO.3所示,蛋白质序列如SEQ ID NO.6所示)。筛选出的几种蛋白进一步完善了谷氨酸棒杆菌发酵生产GlcNAc的代谢途径。
根据筛选出的三种蛋白对菌株进行改造,摇瓶发酵操作均相同(具体操作见下文),结果见图2,其中:
尝试敲除谷氨酸棒杆菌内源GlcNAc胞内转运蛋白的编码基因Cg1GL001572,菌体OD值无显著变化,但GlcNAc产量略有下降。考虑筛选出的相似度约30%的内源GlcNAc胞内转运蛋白除具有转运GlcNAc的作用外,在代谢过程中还具有其他作用,单纯地敲除会影响其他代谢过程。
尝试使用质粒分别过表达谷氨酸棒杆菌内源GlcNAc6P磷酸酶的编码基因Cg1GL000210和Cg1GL001719。过表达Cg1GL000210基因产量略有下降,但过表达Cg1GL001719基因,实现了GlcNAc产量的进一步提高。同上,考虑鉴定出的谷氨酸棒杆菌内源磷酸酶在代谢过程中还具有其他作用。
实施例3在谷氨酸棒杆菌工程菌中过表达GlcNAc6P磷酸酶基因Cg1GL001719
使用由王小元博士(江南大学)提供的质粒pJYW-4作为表达载体来表达Cg1719(简写Cg1GL001719,下同)。(pJYW-4载体的构建参考2014年公开论文——Hu J,Li Y,Zhang H,et al.Construction of a novel expression system for use in Corynebacteriumglutamicum[J].Plasmid,2014,75.)
以本课题组之前改造过的谷氨酸棒杆菌工程菌S9114为基础,使用pJYW-4-gna1-glms-ramAM质粒为模板(参见文献——Chen Deng,Xueqin Lv,Yanfeng Liu,etal.Metabolic engineering of Corynebacterium glutamicum S9114based on whole-genome sequencing for efficient N-acetylglucosamine synthesis[J].Syntheticand Systems Biotechnology,2019,4(3):120-129.以及文献Chen Deng.Synergisticimprovement of N-acetylglucosamine production by engineering transcriptionfactors and balancing redox cofactors[J].Metabolic Engineering,2021:17.),以pJYW-4-CgF和pJYW-4-CgR为引物PCR获得开环模板质粒。
使用引物Cg1719F和Cg1719R将谷氨酸棒杆菌S9114中内源GlcNAc6P磷酸酶基因扩增下来,基因两段带有20bp左右的同源臂。
PCR条件为:95℃预变性3min;98℃变性1min;58℃退火1min;72℃延伸时间视片段长度而定,反应30个循环;最后72℃延伸l0 min。PCR产物用DNA纯化试剂盒回收,获得带有同源臂的Cg1719基因以及开环的质粒模板。
采用连接试剂盒(购于上海公司赛默飞公司,货号:15224041)连接插入片段和质粒。将载体和插入片段按1:1到1:10的摩尔比混合,加入等量的连接混合溶液,16℃下采用T4连接酶连接1h或过夜。然后转化大肠杆菌DH5α感受态细胞。挑选菌落PCR正确的转化子进行测序验证,得到重组质粒pJYW-4-gna1-glms-ramAM-Cg1719。之后将获得的质粒通过电击转化法转化到实验室之前改造的工程菌谷氨酸棒杆菌S9114中。于-80℃超低温冰箱中保存备用。
工程菌株的摇瓶发酵过程:将储藏在-80℃超低温冰箱的重组谷氨酸棒杆菌工程菌株S9114甘油管中的菌液划线于Kan抗性的LBB固体平板上,于30℃培养48h后挑选单菌落接种于种子培养基中,按起始OD600为1.6的接种量将种子培养液接种至发酵培养基中,30℃下于恒温调温往复式摇床采用220rpm的转速培养培养72h。待72h发酵结束后检测发酵上清液GlcNAc的含量。
50-L罐补料分批发酵过程:补料分批发酵所采用的种子培养基的成分同摇瓶发酵所采用的种子培养基,种子培养在装有100mL种子培养基的1000mL摇瓶中于30℃,220rpm的培养条件下培养16-18h。以保证发酵培养基初始OD600为1.6的体积量将种子发酵液接种到50-L发酵罐(上海百仑生物科技有限公司)中,初始发酵培养基体积为14.5L。通过加入浓度为29%的氨水将pH值保持在7.0,并将温度控制在30℃。风量和初始转速分别为0.8Nm
最终过表达GlcNAc6P磷酸酶基因Cg1GL001719,实现了GlcNAc在重组谷氨酸棒杆菌胞外产量的提高。其在500ml摇瓶中产量提高至37.5g/L,在50L发酵罐中产量提高至117.5g/L,转化率提高至30.7%,均为业内领先水平。
引物表
显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
- 一种利用谷氨酸棒杆菌和钝齿棒杆菌提高精氨酸产量的方法
- 改造谷氨酸棒杆菌和钝齿棒杆菌精氨酸合成途径中关键酶NAGK来提高精氨酸产量的方法
