基于ERA技术的对虾传染性肌肉坏死病毒的检测方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及生物技术领域,具体涉及基于ERA技术的对虾传染性肌肉坏死病毒的检测方法。
背景技术
传染性肌肉坏死病毒(IMNV)是影响南美白对虾的传染性最强的病害之一,被世界动物卫生组织(World Organization for Animal Health,OIE)列为甲壳动物主要疾病。传染性肌肉坏死病毒(IMNV)于2002年在巴西的一家凡纳滨对虾养殖场被首次发现。此后,于2006年在印度尼西亚报道,2017年印度也报告了该病毒。IMNV是全病毒科的成员,是由120个衣壳蛋白组成的正二十面体结构,无囊膜包被,直径约为40纳米。IMNV基因组是一个长度为7560bp的非分节的双链RNA,包含两个开放阅读框(ORF),其中ORF1编码结构蛋白,即主要衣壳蛋白(MCP)和两种小蛋白(SP1和SP2)和假定的RNA结合蛋白。ORF2区域编码病毒特异性RNA依赖性RNA聚合酶(RdRp)。根据RdRp基因同源性,该病毒被归类为节肢动物病毒Totivirus家族的贾第鞭毛虫病毒进化枝。患病对虾的主要症状是肌肉白浊、坏死,腹部末端及尾部明显,体表有不规则黑斑的症状。组织学检查显示骨骼肌严重凝固性坏死,可能伴有水肿、血细胞浸润和纤维化症状。在特定的环境因素下,IMNV相关死亡率可高达70%,该病毒对全球虾产业构成严重威胁,据估计已经造成数10亿美元的经济损失。
近年来,我国的对虾进口贸易日益增长,因此对虾疫病的实验室与实地检测量和需求增加。针对IMNV感染的诊断,基于临床体征和组织学检查,无法与其他病原体感染的体征区分开来,例如南美白对虾诺达病毒(PvNV)和细菌性病毒。基于核酸的方法包括原位杂交、反转录巢式PCR和反转录RT-PCR,是目前检测IMNV感染的高度特异和灵敏的方法,但需要精密的热循环仪器和较长的时间,不适合养殖者的虾场实地检测。等温扩增技术逐渐应用于病原检测中,如环介导等温扩增技术(LAMP)等,然而LAMP靶向序列为小片段内的6个或8个区域,引物设计受到许多限制,面临易被污染的高风险。酶促恒温扩增技术(ERA)是一种改良的重组酶聚合酶扩增技术(RPA),将来源于细菌,病毒和噬菌体的特定重组酶、外切酶、聚合酶等多酶体系进行优化组合,从而获得核心的重组等温扩增体系。在37-42℃恒温条件下,可以使之将单分子DNA/RNA的特异性区段在5-10分钟内扩增10
发明内容
本发明提出一种基于ERA技术的对虾传染性肌肉坏死病毒检测方法及应用,利用实时定量酶促重组扩增技术(RT-ERA)建立了IMNV检测体系,不仅可快速实地实时检测,而且具有较高的特异性和灵敏性。
本发明采用了如下技术方案:
一种基于ERA技术的对虾传染性肌肉坏死病毒的检测方法,包括以下步骤:
(1)选取对虾传染性肌肉坏死病毒基因中MCP序列作为检测靶基因,设计RT-ERA引物和探针;上游引物的核苷酸序列如SEQ ID NO:1所示,下游引物的核苷酸序列如SEQ IDNO:2所示;
(2)以待测样品的基因组DNA为模板,采用步骤(1)设计的RT-ERA引物和探针,进行恒温RT-ERA扩增,得到RT-ERA扩增产物,检测其荧光信号强度,根据扩增曲线的荧光信号值,判断扩增结果。
优选的,所述探针为:
CGACGCTGCTAACCATACAAAACCTTTTGC/i6FAMdT//idSp//iBHQ1dT/TGAAGGAGGAAGACT/iSpC3/;其中,所述i6FAMdT为修饰6FAM荧光报告基团的胸腺嘧啶核苷酸,idSp为四氢呋喃THF残基,iBHQ1dT为修饰了BHQ1荧光淬灭集团的胸腺嘧啶核苷酸,iSpC3为阻抑聚合酶延伸或扩增的修饰基团。
优选的,恒温RT-ERA扩增的温度为37℃-42℃。
更优选的,恒温RT-ERA扩增的温度为41℃。
优选的,步骤(2)中,若在RT-ERA扩增的15min内扩增曲线的荧光信号值超过阈值且出现拐点,则表明检测结果为阳性;若RT-ERA扩增产物不满足上述条件,则表明检测结果显示为阴性。
优选的,以扩增起始2min内的荧光信号强度的平均值加上3倍的标准差作为检测阈值。
优选的,步骤(2)中,RT-ERA扩增步骤包括:取溶解剂20μL,上下游引物各2μL,探针0.6μL、模板2μL、ddH
与现有技术相比,本发明的有益成果在于:
由于目前没有有效的治疗方法来预防或减少虾类养殖业中IMNV的传播,因此需要开发简便和快速的IMNV检测技术。本发明选取MCP序列作为检测靶基因,设计并筛选RT-ERA引物组和RT-ERA荧光型探针,构建了基于酶促恒温扩增技术(ERA)技术的对虾传染性肌肉坏死病病原的检测方法。RT-ERA非常适合现场条件、护理点和其他资源匮乏的环境。RT-ERA与PCR扩增一样具有特异性,与AHPND、WSSV、EHP、IHHNV等病原的核酸产生没有交叉反应,同时检出限大大降低,检出限为10
附图说明
图1为本发明实施例对虾传染性肌肉坏死病RT-ERA检测体系筛选引物结果图;其中,A-C为在10
图2为本发明实施例筛选出的4组引物进行RT-ERA的扩增曲线图,实验在三个独立运行的重复中进行测试;
图3为本发明实施例使用不同引物组的扩增阈值时间柱状图;
图4为本发明实施例不同温度下的对虾传染性肌肉坏死病RT-ERA扩增曲线图;
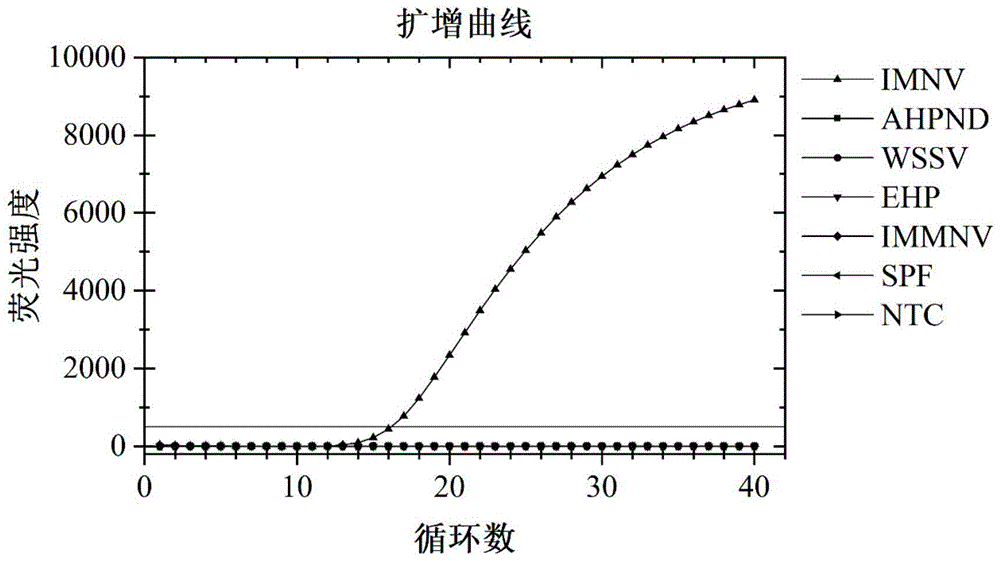
图5为本发明实施例对虾传染性肌肉坏死病RT-ERA扩增系统的特异性检测图;
图6为本发明实施例对虾传染性肌肉坏死病巢式PCR扩增电泳图(模板为标准质粒),其中,A、B分别为巢式第一步反应程序和巢式第二步反应程序的扩增情况,泳道1-9样品浓度:10
图7为本发明实施例对虾传染性肌肉坏死病RT-PCR扩增曲线图(模板为10倍梯度稀释的标准质粒);
图8为本发明实施例对虾传染性肌肉坏死病RT-PCR测定的阈值时间分析图(模板为10倍梯度稀释的标准质粒);
图9为本发明实施例对虾传染性肌肉坏死病RT-ERA扩增曲线图(模板为10倍梯度稀释的标准质粒);
图10为本发明实施例对虾传染性肌肉坏死病RT-ERA测定的阈值时间分析图(模板为10倍梯度稀释的标准质粒)。
具体实施方式
为了更好理解本发明技术内容,下面结合具体实施例和附图对本发明做进一步的说明。
下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中的定量实验,均设置三次重复实验,结果取平均值。
下述实施例中的ERA荧光型核酸扩增试剂盒是苏州先达基因科技有限公司的产品,产品货号为KS103。
实施例1-对虾传染性肌肉坏死病的RT-ERA检测引物和探针的设计及合成
在NCBI网页Genbank数据库下载对虾传染性肌肉坏死病致病质粒的全基因序列(AY570982),进行序列比对分析,选取种内保守、种间特异的MCP序列作为检测靶基因,设计对虾传染性肌肉坏死的RT-ERA检测引物和探针,见表1。
表1RT-ERA引物及探针
将上述前引物和后引物排列组合进行ERA扩增,并进行琼脂糖凝胶电泳,筛选出较优引物;随后,将筛选出的四对引物再与设计的探针进行RT-ERA扩增,根据是否有明显的指数期与平台期、达到阈值的时间快慢和荧光值大小筛选出最优引物对与探针。
结果如图1,其中如图1(A-C)所示,在10
如图1(D)所示,在10
如图2所示的筛选出的4组引物进行RT-ERA的扩增曲线结果和图3所示的使用不同引物组的扩增阈值时间柱状图中可以看出,将以上筛选的4对引物与探针配合进行RT-ERA扩增,F1/R1引物组有明显的指数期与平台期,达到阈值时间最短,荧光值最高,筛选其为最优引物对,实验在三个独立运行的重复中进行测试。
筛选出最优引物对与探针如下:
F1:TACCAACAGGATCATATATTAAGCAGAGAG(序列SEQ ID NO:1)
R1:TGCCGGTTTTGAAAGCCTTTGTTTCCTCTG(序列SEQ ID NO:2)
根据上述探针设计要求,设计的RT-ERA探针如下:
CGACGCTGCTAACCATACAAAACCTTTTGC/i6FAMdT/(序列SEQ ID NO:3)
/idSp//iBHQ1dT/TGAAGGAGGAAGACT(序列SEQ ID NO:4)/iSpC3/
上述探针中,序列SEQ ID NO:3自5’端起最后一位胸腺嘧啶核苷酸为修饰6FAM荧光报告基团胸腺嘧啶核苷酸(6FAMdT),序列SEQ ID NO:3自5’端起第一位胸腺嘧啶核苷酸为修饰了BHQ1荧光淬灭集团的胸腺嘧啶核苷酸(BHQ1dT);dSpacer(THF四氢呋喃)作为外切酶exo的切断位点;SpC3:序列SEQ ID NO:4的3’端用C3封闭以阻断延伸,阻止3’端外切酶和聚合酶发挥作用。
上述引物和探针均由生工生物工程(上海)股份有限公司合成。
实施例2对虾传染性肌肉坏死病的RT-ERA检测方法
以待测样品的基因组DNA为模板,采用上述设计的RT-ERA引物组和RT-ERA探针进行RT-ERA扩增,得到RT-ERA扩增产物,并检测荧光信号强度,具体步骤如下:
每个RT-ERA反应管的体系如下:溶解剂20μL,上下游引物各2μL(10μM),ERA探针0.6μL(10μM)、模板2μL、ddH
使用荧光扩增检测仪自带的软件,对扩增结果进行分析,以扩增起始2min内的荧光信号强度的平均值加上3倍的标准差作为检测阈值;
判断扩增结果:若RT-ERA扩增产物满足如下条件:若在RT-ERA扩增的15min内扩增曲线的荧光信号值超过阈值且出现拐点,则表明扩增结果为阳性,即,待测样品感染IMNV;若RT-ERA扩增产物不满足上述条件:则表明扩增结果为阴性,即待测样品未感染IMNV。
实施例3-对虾传染性肌肉坏死病的RT-ERA反应温度的优化
为确定RT-ERA扩增反应的最适温度,本发明还进行了RT-ERA反应温度的优化实验:
将10
结果如图4所示,结果表明:RT-ERA反应体系在38-42℃的不同温度条件下均正常扩增,在相同浓度的模板下标准质粒在41℃时的达到阈值时间最短,荧光值最高,因此,以41℃为RT-ERA反应体系的最佳温度。
实施例3-对虾传染性肌肉坏死病的RT-ERA引物和探针的特异性实验
分别以如下四种对虾病毒:急性肝胰腺坏死病(AHPND)、白斑综合征病毒(WSSV)、肝肠胞虫(EHP)和传染性皮下炎和造血坏死病毒(IHHNV)的病毒核酸DNA或RNA以及SPF对虾核酸为模板,采用实施例1中的对虾传染性肌肉坏死病IMNV的最优引物探针与RT-ERA检测方法,检测本发明的RT-ERA引物组和RT-ERA探针的特异性。
结果如图5所示,结果表明:本发明设计的RT-ERA引物和探针均可特异性的扩增出靶基因,而与其它四种病毒(急性肝胰腺坏死病(AHPND)、白斑综合征病毒(WSSV)、肝肠胞虫(EHP)和传染性皮下炎和造血坏死病毒(IHHNV))核酸以及SPF对虾核酸均无交叉反应,说明本发明的对虾传染性肌肉坏死病的RT-ERA引物与探针具有良好的特异性。
实施例4-对虾传染性肌肉坏死病的RT-ERA检测的灵敏性实验
将本发明的对虾传染性肌肉坏死病的RT-ERA检测方法和巢式PCR、RT-PCR检测的灵敏度比较:
使用10
表2巢式PCR与RT-PCR引物表
表3巢式PCR第一步反应组分
表4巢式PCR第一步反应程序
表5巢式PCR第二步反应组分
/>
表6巢式PCR第二步反应程序
表7 RT-PCR反应组分
表8 RT-PCR反应程序
当模板为10
由图6-10结果分析得到,IMNV RT-ERA的灵敏度为10
本发明将筛选出的F5/R4的引物组与探针用于对虾传染性肌肉坏死病的RT-ERA检测,进行灵敏性实验时,实验结果显示RT-ERA的灵敏度为10
综上实验结果表明,本发明提供了一种RT-ERA方法来扩增IMNV的MCP致病基因,从而可高效准确判断待测样品是否感染IMNV。该方法可在41℃下,20分钟内高效准确检测IMNV,同时,IMNV的RT-ERA检测体系不会与AHPND、WSSV、EHP和IHHNV病原以及SPF对虾核酸发生交叉反应。RT-ERA的检测限为10
以上所述仅为本发明的较佳实施例而已,并不用限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 检测传染性肌肉坏死病毒的遗传标志物及使用该遗传标志物检测传染性肌肉坏死病毒的方法
- 检测传染性肌肉坏死病毒的遗传标志物及使用该遗传标志物检测传染性肌肉坏死病毒的方法
