一种抑制CyHV-2病毒增殖的反义RNA组、重组载体和纳米粒递送系统及应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于水产动物育种技术领域,具体涉及一种抑制CyHV-2病毒增殖的反义RNA组、重组载体和纳米粒递送系统及应用。
背景技术
鲫(Crassiusauratus)属鲤形目,鲤科,鲫属。因其食性杂,适应能力、繁殖能力、抗逆性和抗病力强等,同时肉质细嫩,肉味甜美,营养丰富,具有较高的经济价值,是我国传统的优质淡水养殖品种。鲫鱼作为我国淡水养殖的名优品种,在江苏、湖北等地养殖产量极高。目前国内高密度池塘养殖的良种鲫包括:湘云鲫、异育银鲫、彭泽鲫等品种。
江苏省是我国鲫鱼的主要养殖地区,其鲫鱼精养面积达80万亩以上,2019年产量达62.40万吨,产值约90多亿元,位居全国首位。网络流传“全国鲫鱼看江苏、江苏鲫鱼看盐城”,一语道出江苏鲫鱼养殖在全国首屈一指的地位。然而,自2009年起,江苏地区的鲫鱼养殖中开始流行一种以“鳃出血”为主要症状的急性传染性疾病,这种疾病主要由鲤疱瘆病毒-2(Cyprinid herpesvirus2,CyHV-2)引起,具有发病急、传播快、死亡率高的特点。发病鱼体几乎无药可治。2021年鲫鱼养殖面积减少60%以上。江苏省鲫鱼产业面临养殖面积和养殖产量双下滑,造成严重的经济损失。据统计,2020年江苏鲫鱼鳃出血病平均发病率高达50%以上,部分区域甚至高达90%~100%,造成的经济损失高达数亿元,严重制约了江苏省鲫鱼种业与养殖产业的可持续发展,急迫需要开展抗病苗种培育工作。
反义RNA是一种本身缺乏编码能力,但能与特异靶RNA(主要是mRNA)互补的RNA分子。已证明,RNA干扰技术可以在细胞水平有效抑制乙肝病毒、疱疹病毒、AIDS病毒等复制。然而目前还没有人将RNA干扰技术应用于鲫鱼CyHV-2病毒防治中。
发明内容
有鉴于此,本发明的目的在于提供一种抑制CyHV-2病毒增殖的反义RNA组,能有效抑制CyHV-2病毒大量繁殖。
本发明还提供了一种携载反义RNA组的纳米粒递送系统,能够快速批量生产抗CyHV-2病毒的鲫鱼苗种,明显降低鲫鱼感染CyHV-2病毒死亡率,增强鱼体自身的保护力。
本发明提供了一种抑制CyHV-2病毒增殖的反义RNA组,包括核苷酸序列如SEQ IDNO:1~SEQ ID NO:4所示的反义RNA。
本发明提供了一种抗CyHV-2病毒的重组载体组,每个重组载体中插入一条不同的所述反义RNA组中反义RNA。
优选的,所述重组载体的骨架载体为pcDNA3.1质粒;
所述反义RNA在所述骨架载体的多克隆位点为XhoⅠ与XbaⅠ。
本发明提供了一种抗CyHV-2病毒的纳米粒递送系统,包括固体脂质纳米粒和包裹在所述固体脂质纳米粒内部的所述反义RNA组或反义RNA组的扩增产物。
优选的,所述反义RNA组或所述反义RNA组的扩增产物和固体脂质纳米粒的体积比为(1~2):100;
所述反义RNA组的扩增产物的浓度为380~470ng/μL;
所述固体脂质纳米粒中原料卵磷脂和胆固醇的总质量百分含量为30%。
优选的,所述反义RNA组中每种反义RNA或所述反义RNA组中每种反义RNA的扩增产物按照等摩尔比混合。
优选的,所述固体脂质纳米粒的制备方法,将卵磷脂和胆固醇溶解于氯仿/无水乙醇中,去除有机溶剂后进行超声,分离脂质体,得到固体脂质纳米粒;
所述卵磷脂和胆固醇的质量比为(1.8~2.2):(0.9~1.1);
氯仿/无水乙醇中氯仿和无水乙醇等体积混合;
所述超声的条件为功率175W~225W,总时间15~20min,温度控制在40℃~50℃。
本发明提供了所述反义RNA组、所述重组载体组或所述抗CyHV-2病毒的纳米粒递送系统在抗CyHV-2病毒的水产动物的培育或育种中的应用。
本发明提供了一种抗CyHV-2病毒鱼苗的孵化方法,包括以下步骤:
将所述抗CyHV-2病毒的纳米粒递送系统转染鱼卵,得到转染后的鱼卵与精子混合进行人工授精,将得到的受精率进行孵化,得到鱼苗。
优选的,每1万鱼卵子添加2mL抗CyHV-2病毒的纳米粒递送系统悬浮液;所述抗CyHV-2病毒的纳米粒递送系统悬浮液中抗CyHV-2病毒载体的浓度是38~47ng/μL;所述抗CyHV-2病毒的纳米粒递送系统悬浮液的溶剂为含6~10g/L氯化钠和10~20g/L葡萄糖的pH值6.5~7磷酸缓冲液。
本发明公开了一种抑制CyHV-2病毒增殖的反义RNA组,包括核苷酸序列如SEQ IDNO:1~SEQ ID NO:4所示的反义RNA。本发明通过针对CyHV-2病毒基因组全序列设计得到多条反义RNA,通过不同的反义RNA组合转染鱼卵,结果表明,本发明提供的反应RNA组能显著降低CyHV-2病毒攻毒后鱼的死亡率,同时提高孵化率和仔鱼成活率。这说明反义RNA组不仅能有效抑制CyHV-2病毒在鱼体内的增殖,而且还能提高鱼卵或受精卵的病毒抗逆性。
附图说明
图1为反义RNA设计位点与序列信息图;
图2为合成质粒的PCR扩增产物电泳效果图;
图3为转染阳性率检测结果效果图;
图4为CyHV-2病毒RT-PCR绝对定量标准曲线。
具体实施方式
本发明提供了一种抑制CyHV-2病毒增殖的反义RNA组,包括核苷酸序列如SEQ IDNO:1~SEQ ID NO:4所示的反义RNA。
在本发明中,为了开发一套RNA干扰效果较强的反义RNA,以CyHV-2病毒的不同种类膜蛋白(膜蛋白Allo46、膜蛋白97、膜蛋白62、膜蛋白54)或DNA聚合酶催化亚单位为靶基因,设计多条反义RNA,优选以膜蛋白Allo46、膜蛋白62和DNA聚合酶催化亚单位为靶基因,设计的4条反义RNA组合在抗CyHV-2病毒增殖方便最佳。
本发明提供了一种抗CyHV-2病毒的重组载体组,每个重组载体中插入一条不同的所述反义RNA组中反义RNA。
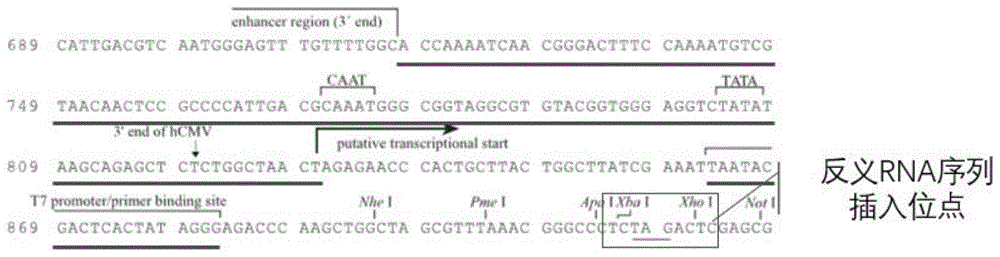
在本发明中,所述重组载体组为4个插入所述反义RNA组中不同种类的反义RNA的重组载体。所述重组载体的骨架载体优选为pcDNA3.1质粒;所述反义RNA在所述骨架载体的多克隆位点为XhoⅠ与XbaⅠ。本发明对所述重组载体组的制备方法没有特殊限制,采用本领域所熟知的重组载体的制备方法即可。在本发明实施例中,所述重组载体组委托亦欣生物科技(上海)有限公司合成。
本发明提供了一种抗CyHV-2病毒的纳米粒递送系统,包括固体脂质纳米粒和包裹在所述固体脂质纳米粒内部的所述反义RNA组或反义RNA组的扩增产物。
在本发明中,所述反义RNA组或所述反义RNA组的扩增产物和固体脂质纳米粒的体积比为(1~2):100。所述反义RNA组的扩增产物的浓度为380~470ng/μL;所述固体脂质纳米粒中原料卵磷脂和胆固醇的总质量百分含量为30%。所述反义RNA组中每种反义RNA或所述反义RNA组中每种反义RNA的扩增产物优选按照等摩尔比混合。
在本发明中,所述固体脂质纳米粒的制备方法,优选将卵磷脂和胆固醇溶解于氯仿/无水乙醇中,去除有机溶剂后进行超声,分离脂质体,得到固体脂质纳米粒。所述卵磷脂和胆固醇的质量比优选为(1.8~2.2):(0.9~1.1),更优选为2:1。所述氯仿/无水乙醇中氯仿和无水乙醇等体积混合。每1L氯仿/无水乙醇溶剂添加50~100g的卵磷脂和胆固醇混合物。所述去除溶剂的方法,优选包括旋蒸法。所述超声的条件优选为功率175W~225W,总时间15~20min,温度控制在40℃~50℃,更优选为功率200W,总时间18min,温度控制在45℃。分离脂质体的方法优选为将所得脂质体溶液通过0.8μm微孔滤膜2次,进行整粒。固体脂质纳米粒优选溶解于pH6.5~7弱酸性磷酸缓冲液中溶剂为含6~10g/L氯化钠和10~20g/L葡萄糖的pH值6.5~7磷酸缓冲液。由于DNA碱基序列呈弱酸性,转染弱酸性试剂有助于减少卵子应激损伤。氯化钠和葡萄糖有利于提高溶液的渗透压,避免在后续转染时对鱼卵造成损伤。
在本发明中,所述抗CyHV-2病毒的纳米粒递送系统的制备方法,优选包括以下步骤:
将固体脂质纳米粒悬浮液和含所述反义RNA组的溶液或含所述反义RNA组的扩增产物的溶液混合,冷冻即可。
在本发明中,所述含所述反义RNA组的扩增产物的溶液优选以重组载体组为模板进行PCR扩增获得。所述PCR扩增的引物包括核苷酸序列如SEQ ID NO:5所示的正向引物和核苷酸序列如SEQ ID NO:6所示的反向引物。所述PCR扩增的条件优选为95℃预变性3min,30个循环(95℃变性30s,50℃退火30s,72℃延伸2min);72℃延长5min。所述PCR扩增的体系为20μl,优选包括Ex-Taq酶10μL、模板1μL、正向引物/反向引物1μL、无RNA水8μL。
本发明提供了所述反义RNA组、所述重组载体组或所述抗CyHV-2病毒的纳米粒递送系统在抗CyHV-2病毒的水产动物的培育或育种中的应用。
在本发明中,所述水产动物优选为鱼类。所述鱼类优选为鲫鱼。
本发明提供了一种抗CyHV-2病毒鱼苗的孵化方法,包括以下步骤:
将所述抗CyHV-2病毒的纳米粒递送系统转染鱼卵,得到转染后的鱼卵与精子混合进行人工授精,将得到的受精率进行孵化,得到鱼苗。
在本发明中,所述鱼的种类优选为鲫鱼。每1万鱼卵优选添加2mL抗CyHV-2病毒的纳米粒递送系统悬浮液;所述抗CyHV-2病毒的纳米粒递送系统悬浮液中抗CyHV-2病毒载体的浓度是38~47ng/μL。转染时,优选轻轻摇晃6~8min体系。
在本发明中,所述人工授精的方法,优选每1万鱼卵添加0.2~0.5mL的精液,继续摇晃30秒后,加水再摇晃30秒完成。所述受精卵孵化前,优选脱粘处理。所述脱粘处理的方法为每1万鱼受精卵使用200mL滑石粉处理,然后过筛网,清水洗掉滑石粉,得到脱粘的受精卵。所述孵化的方法优选为水温23℃~24℃,水流速度为3~7升/分钟。孵化桶呈圆锥形,底部进水,上端有出水口,保证受精卵充分翻滚,充氧充足。每10L孵化桶放置30万~50万受精卵。孵化时间优选为100~130h,更优选为120h。
在本发明中,通过检测制备的育苗的阳性感染率,结果表明纳米粒递送系统介导下,通过卵子将特定的反义RNA插入鱼苗基因组中。攻毒试验表明,本发明孵化制备的鱼苗具较高的孵化率、仔鱼存活率和较低的感染死亡率,为提高鱼类特别是鲫鱼的养殖效益提供了新手段。
下面结合实施例对本发明提供的一种抑制CyHV-2病毒增殖的反义RNA组、重组载体和纳米粒递送系统及应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
一、CyHV-2病毒反义RNA选择与序列设计。本发明设计反义RNA表达序列的CyHV-2基因组全序列来自NCBI,编号MK260012,全称:鲤鱼疱疹病毒2型YZ-01菌株,全长288076bp线形DNA,编码154个蛋白。
根据序列信息,选取5个有明确的功能注释蛋白序列,包括CyHV2_086/QAU54821.1, CyHV2_084/QAU54819.1 ,CyHV2_066/QAU54809.1 和 CyHV2_050/QAU54786.1 ,CyHV2_043/QAU54779.1。
相关反义RNA序列设计如下:
CyHV2_086/QAU54821.1是CyHV-2病毒的膜蛋白Allo46,mRNA序列中包括1个内含子和2个外显子,反义RNA序列I:TTCACGGGGCATCCCTGTCAAACAAATCAAAAAAACATTAATGATGATGATGATAATAGATGAGACATGTAGACCTATGATGATAATGATGGTGGTG AG(SEQ ID NO:1)。
CyHV2_084/QAU54819.1是CyHV-2病毒的膜蛋白97,mRNA序列中包括1个内含子和2个外显子,反义RNA序列II:TTTGAAAGCGTTCAGACAAATCTACCACTGTCACTTTGACTACAGGTTC GTCTCTTTTCAATCTTTTCATAAAAAATTCTCAACCAACCAACCTACAG GTTTCTGGCATCGTCTATCGTTATAGACACGCTG(SEQ ID NO:7)。
CyHV2_066/QAU54809.1是CyHV-2病毒的DNA聚合酶催化亚单位,mRNA序列中包括4个内含子和5个外显子,反义RNA序列III:
GATGGATGCATAACGGCCACCCTACAAAAGAAAAACCAAAAGAG TGTAGATTTCAGAGAAAGAAAGAGAGGGGTACCTGGCCAAAAGTTCA GAATCGGCCAGATTGTACATGAGATA(SEQ ID NO:2);
反义RNA序列IV:CCAACACCGATTTGATGTGCTCGGGTCTCAACTGAAAAACAACACAAC ACGGATCAGATCAGTGGTGGTCGGATGAGCTTCTTGATTAAAGGTCTG AAGGCCCGAATACTAGAAAGAA(SEQ ID NO:3)
CyHV2_050/QAU54786.1是CyHV-2病毒的膜蛋白62,mRNA序列中包括1个内含子和2个外显子,反义RNA序列V:TTGAATGTAACCGTCGTCGTATCCCTGTGTGAGAGACAAACCAAAAGC GCTATCGTCGCCGTAGTCGCCTCCAGAGCCTCCAGCAGCAGCGACCGT GGAGCGGAACCGT(SEQ ID NO:4);
CyHV2_043/QAU54779.1是CyHV-2病毒的膜蛋白54,mRNA序列中包括1个内含子和2个外显子,反义RNA序列VI:TCAGGCCTCAACAGGTGAGTTTCCGTCCTTTCTTTAAGCTCTTTCTTCT TTAAGCTCTCTCTCGTCTCGGTGGTGATGCGTTTGGTTTGGTTTGTTTT GAAGGTGCCCGA(SEQ ID NO:8)。
二、不同反义RNA组合
实验1:反义RNA序列I,II和III;
实验2:反义RNA序列IV,V和VI;
实验3:反义RNA序列II和VI;
实验4:反义RNA序列I,III,IV和V。
三、CyHV-2病毒反义RNA序列合成与载体组装。
将上述设计的反义RNA序列送至亦欣生物科技(上海)有限公司进行碱基合成。利用pcDNA3.1质粒构建表达载体,将各反义RNA序列分别克隆至XhoⅠ与XbaⅠ的位点之间。表达载体包含了T7启动子与CMV启动子增强子。
三、表达载体PCR扩增。
设计1对特异引物分别对构建好的表达载体进行PCR扩增(正向引物PolyAF1:GGAGGTCGCTGAGTAGTGCGCG,SEQ ID NO:5;反向引物polyAR1:CTGCGCGTAACCACCACACCCG,SEQID NO:6)。反应体系为20μL,具体按照表1方法配制。
表1PCR扩增反应体系
扩增程序为:95℃预变性3min,30个循环(95℃变性30s,50℃退火30s,72℃延伸2min);72℃延长5min。将扩增好的PCR产物按照实验分组混合进行凝胶电泳检测PCR扩增效果(图2)。最后将混合后的PCR产物放置于4℃冷藏备用。
加载反义RNA的pcDNA3.1质粒,特异引物扩增后进行琼脂糖凝胶电泳,由电泳结果可知扩增产物在1000bp~2000bp之间存在明显的条带,与预期片段条带大小一致。表明扩增效果是有效的。
每1mL固体脂质纳米粒中添加不同实验组PCR产物混合液20μL,放置于-20℃冷冻备用。
四、固体脂质纳米粒的制作。将卵磷脂与胆固醇按照2:1的质量比共溶于氯仿和无水乙醇(1:1)组成溶剂中,每1L溶剂添加50~100g的卵磷脂与胆固醇混合物。通过搅拌去除有机溶剂后进行超声(功率200W,超声时间20min,温度45℃),分离出脂质体,再将其重悬于pH6.5弱酸性磷酸缓冲液中。最后,向重悬有脂质体的磷酸缓冲液添加NaCl和葡萄糖,使NaCl终浓度为10g/L,葡萄糖终浓度为15g/L,得到固体脂质纳米粒悬浮液。
五、PCR扩增产物的递送。
每1mL固体脂质纳米粒悬浮液中添加各实验组PCR扩增产物混合液15μL,放置于-20℃冷冻备用,得到包裹PCR扩增产物的固体脂质纳米粒。使用前提前半个小时拿出平衡室温。
选取性成熟的鲫鱼,轻轻挤压腹部收集卵子。每1万鲫鱼卵子添加2mL包裹PCR扩增产物的固体脂质纳米粒悬浮液。同时,设置未经任何处理的鲫鱼卵子作为对照组。轻轻摇晃6分钟完成PCR扩增产物的卵子转染操作。选取性腺发育良好的鲫鱼,轻轻挤压腹部,每1万鲫鱼卵子添加0.2mL的精液,继续摇晃30秒后,加水再摇晃30秒,完成整个授精过程。每1万鲫鱼受精卵使用200mL滑石粉进行脱粘处理,再倒入200目筛网内,22℃~24℃清水冲洗干净滑石粉后,将受精卵倒入孵化桶进行孵化。每10L孵化桶放置30万~50万受精卵,水温控制在23℃,水流速度为6升/分钟。120h后观察受精卵的孵化率,仔鱼成活率。收集初孵仔鱼,按照1万尾/立方米水体的密度放置于5个2立方米水体的水泥池中培育。待鱼体长至3~4cm时,放入5个1亩的土池进行养殖,密度3500尾/亩,养殖180天。每个实验组随机选取30尾鱼,按照每75g鱼体重腹腔注射1mLCyHV-2病毒组织液,进行人工感染试验。持续7天,观察鲫鱼发病状况。按照以下公式I计算攻毒后鲫鱼死亡率。
死亡率(%)=死亡鲫鱼尾数/试验初始鲫鱼尾数×100 公式I
表2各组鲫鱼死亡率结果
注:不同小写字母表示有显著差异(P<0.05)。
结果表明,转染不同的反义RNA组合对于鲫鱼孵化率、仔鱼成活率和感染CyHV-2病毒的死亡率均存在显著影响(P<0.05)。本发明设计的反义RNA位点的功能与作用很多尚未得到明确解析,有些可能存在致死或致畸。因此,出现转染不同反义RNA组合后孵化率与仔鱼成活率存在明显差异。其中实验组4的受精卵孵化率与对照组相比无显著差异。不同反义RNA组合可能对CyHV-2病毒的抑制效果存在差异。实验组4的反义RNA组合能够明显提高CyHV-2病毒感染后鲫鱼的成活率。
实施例2
在江苏无锡,选取1个流水循环系统内的6个1m
保护率(%)=(对照组死亡率–实验组死亡率)/对照组死亡率×100公式II表3循环桶养殖下实验组与对照组鲫鱼感染CyHV-2病毒的死亡率和保护率
注:“*”代表有显著差异(P<0.05)。
实验组鲫鱼在CyHV-2病毒人工感染试验中具有很好的保护率,经试验结果显示,对照组死亡率达93.33%;实验组死亡率为46.67%,两组间存在显著差异,实验组有效保护率达到50%。
实施例3
在江苏宜兴,选取6个1亩的养殖池塘,其中3个池塘分别放养抗CyHV-2病毒鲫鱼(按照实施例1中实验组4孵化得到的抗CyHV-2病毒鲫鱼)2000尾作为实验组,鱼体规格在20g左右;另外3个池塘未进行抗CyHV-2病毒处理的鲫鱼作为对照组,每个池塘同样放养2000尾,规格在20g左右。实验组和对照组分别投喂宁波天邦饲料科技有限公司全熟化水产配合饲料(蛋白34%,脂肪8%)。早上7:00和下午17:00各投喂1次,投喂量为鱼体重的5%。养殖周期为100d。每个养殖桶分别选取鲫鱼各10尾,分成3个平行,其中包括对照组30尾鱼和实验组30为鱼。养殖实验结束后,每个池塘随机抓取10尾鱼,按照每75g鱼体重腹腔注射1mLCyHV-2病毒组织液,进行人工感染试验。持续7天,观察鲫鱼发病状况。
表4池塘养殖100d后实验组与对照组鲫鱼感染CyHV-2病毒的死亡率
注:“*”代表有显著差异(P<0.05)。
实验组鲫鱼在CyHV-2病毒人工感染试验中具有很好的保护率,经试验结果显示,对照组死亡率达83.33%;实验组死亡率为36.67%,两组间存在显著差异,实验组有效保护率达到56%。
实施例4
在江苏宜兴,选取6个1亩的养殖池塘,其中3个池塘分别放养抗CyHV-2病毒鲫鱼(按照实施例1实验组4孵化得到的抗CyHV-2病毒鲫鱼)2000尾作为实验组,鱼体规格在20g左右;另外3个池塘未进行抗CyHV-2病毒处理的鲫鱼作为对照组,每个池塘同样放养2000尾,规格在20g左右。实验组和对照组分别投喂宁波天邦饲料科技有限公司全熟化水产配合饲料(蛋白34%,脂肪8%)。早上7:00和下午17:00各投喂1次,投喂量为鱼体重的3%。养殖周期为180d。每个养殖桶分别选取鲫鱼各10尾,分成3个平行,其中包括对照组30尾鱼和实验组30为鱼。养殖实验结束后,每个池塘随机抓取10尾鱼,按照每75g鱼体重腹腔注射1mLCyHV-2病毒组织液,进行人工感染试验。持续7天,观察鲫鱼发病状况。
表5池塘养殖180d后实验组与对照组鲫鱼感染CyHV-2病毒的死亡率
注:“*”代表有显著差异(P<0.05)。
实验组鲫鱼在CyHV-2病毒人工感染试验中具有很好的保护率,经试验结果显示,对照组死亡率达80.00%;实验组死亡率为53.00%,两组间存在显著差异,实验组有效保护率达到33.33%。
为了明确实验组鱼的病毒量开展了肾脏组织的病毒决定定量检测实验
以CyHV-2病毒衣壳间三联体蛋白基因(Intercapsomerictriplexprotein gene,GeneBank号:EU349286)为目标基因设计RT-PCR引物(F:5’GCATGTGCGTCGACCTAGTA3’,SEQID NO:9;R:5’GTTCTTGACGCTCTGTCCGA3’,SEQ ID NO:10),引物由上海捷瑞生物工程有限公司合成。
以pUC57为载体构建含有CyHV-2衣壳间三链蛋白基因部分序列的质粒,用Nanodrop在260nm测定DNA浓度,调整质粒浓度,将质粒浓度从1×10
分别选取实验组与对照组CyHV-2病毒组织液感染7d后死亡与存活的鱼体,剖取肾脏样品。提取DNA后,将DNA浓度调整至10ng/μL,按照上述PCR扩增程序进行,计算各肾脏样本的病毒绝对定量。
表6CyHV-2病毒感染后鲫鱼病毒绝对定量检测结果
注:不同小写字母代表有显著差异(P<0.05)。
疱疹病毒感染后鱼体肾脏的病毒绝对定量检测结果显示,疱疹病毒抑制的实验鱼死鱼肾脏中的病毒量(30343.83copies/ngDNA)显著高于正常鱼体病毒感染后的死鱼病毒量(22934.52copies/ngDNA),表明疱疹病毒抑制的试验鱼可能具有更强的病毒承受能力。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 受磷蛋白基因反义RNA重组AAV载体、病毒、构建方法及应用
- 一种基于微小RNA调控可在肿瘤细胞内特异性增殖的重组腺病毒载体、其构建方法及其用途
