NK细胞的大规模组合CAR转导和CRISPR基因编辑
文献发布时间:2023-06-19 19:28:50
本申请要求2019年11月27日提交的美国临时专利申请序列号62/941,134的优先权,该专利申请通过引用整体并入本文。
序列表
本申请包含以ASCII格式电子提交并在此通过引用整体并入本文的序列表。于2020年11月12日创建的所述ASCII副本命名为UTSC_P1199WO_SL.txt,大小为5,505字节。
技术领域
本公开内容一般至少涉及免疫学、细胞生物学、分子生物学和医学领域。
背景
细胞免疫治疗对癌症的治疗前景广阔。然而,大多数免疫治疗方法单独应用时对大多数恶性肿瘤(包括实体瘤)的价值有限。这种有限成功的原因包括(1)肿瘤细胞表面上肿瘤抗原的减少的表达,其降低了免疫系统对其的检测;(2)抑制性受体的配体(例如PD1、NKG2A、TIGIT)的表达;(3)细胞检查点的上调,例如诱导免疫细胞失活的CISH;和(4)在微环境中诱导细胞(例如调节性T细胞或髓系来源的抑制细胞),其释放抑制免疫应答并促进肿瘤细胞增殖和存活的物质,例如转化生长因子-β(TGFβ)和腺苷。因此,对于至少在一些实施方案中解决这些挑战的改进的细胞免疫治疗方法存在未得到满足的需求。
概述
本公开内容的实施方案包括用于天然杀伤(NK)细胞的组合的CAR转导和CRISPR基因编辑的大规模方法(包括GMP级)的新颖的方法和组合物。本公开内容提供了表达一种或多种异源抗原受体并且还已被基因编辑以破坏NK细胞中的一种或多种内源性基因的工程化NK细胞。在特定实施方案中,异源抗原受体是已经人工产生(例如产生为包含来自不同来源的组分的融合蛋白)的工程化抗原受体。在一些实施方案中,对CAR转导的NK细胞进行工程化以破坏NK细胞中一种或多种内源性基因的表达,并且在其他实施方案中,将在NK细胞中具有一种或多种内源性基因表达的破坏的NK细胞转导或转染(例如,修饰)以表达一种或多种异源抗原受体。特定实施方案提供了原代CAR转导NK细胞的大规模CRISPR/Cas9介导的工程化策略。
在某些实施方案中,该工艺使用允许该工艺为大规模的特定参数,包括用于工程化至多1x10
所产生的细胞可用于任何目的,包括用于治疗例如癌症、感染性疾病和/或免疫相关疾病的医学病况。所产生的细胞可以被储存,例如用于在使用时可以或可以不进一步修饰的现用目的,例如以将细胞定制给有需要的个体。在某些情况下,无需进一步修饰,因为NK细胞表达的CAR靶向需要靶向抗原的个体的抗原(例如抗原是个体的癌症的癌症(包括肿瘤)抗原)。在其他情况下,NK细胞在被修饰以表达异源抗原受体之前储存,并且在储存后和使用前,将其修饰以表达靶向需要靶向抗原的个体的抗原的CAR。产生的细胞可以被冷冻保存。
本公开内容的实施方案包括生产工程化NK细胞的体外方法,包括以下步骤:
(a)用抗原呈递细胞和有效量的一种或多种合适的细胞因子(例如白细胞介素(IL)-2、IL-15、IL-21和/或IL-18)将NK细胞(其可以来源于脐带血、外周血、骨髓、造血干细胞、诱导的多能干细胞、细胞系或其混合物)扩增第一时间段以产生扩增的NK细胞;
如下的(b1)和(c1)或(b2)和(c2)中的一个:
(b1)用编码异源抗原受体的载体转导或转染(a)的扩增的NK细胞以产生修饰的NK细胞;
(c1)在第二时间段之后,基因编辑NK细胞,例如向修饰的NK细胞递送有效量的Cas9和一个或多个引导RNA以破坏NK细胞中一种或多种基因的表达,从而产生基因编辑的修饰的NK细胞;或
(b2)基因编辑扩增的NK细胞,例如向(a)的扩增的NK细胞递送有效量的Cas9和一种或多种引导RNA以破坏NK细胞中一种或多种基因的表达,从而产生基因编辑的NK细胞;
(c2)在第二时间段后,用编码异源抗原受体的载体转导或转染基因编辑的NK细胞,以产生基因编辑的修饰的NK细胞;和
(d)在存在抗原呈递细胞和有效量的IL-2的情况下,任选地将(c1)或(c2)的基因编辑的修饰的NK细胞扩增第三时间段。在特定情况下,基因编辑的修饰的NK细胞由(b1)和(c1)的步骤或(b2)和(c2)的步骤产生。在至少一些情况下,作为实例,第一时间段为约1-7天,包括1-4天或5-7天。第二时间段可以是约1-4天,包括1、2、3或天。第三时间段可以是至少约7天,包括约1-2周。
在该方法的特定情况下,(c1)和(b2)的步骤各自进一步定义为两个或更多个递送步骤。在这种情况下,第一递送步骤可以包括递送靶向一种或多种基因的引导RNA,并且第二递送步骤可以包括递送靶向与第一递送步骤中的一种或多种基因不同的一种或多种基因的引导RNA。在特定实例中,第一和第二递送步骤之间的持续时间为至少约1、2、3或4天或更长时间,和/或第一和第二递送步骤之间的持续时间为约1-4、1-3、1-2、2-4、2-3、3-4或1、2、3、4或更多天。
在特定实施方案中,通过电穿孔递送递送至NK细胞的一种或多种组合物。在细胞被电穿孔的情况下,电穿孔可使用约200,000个细胞至1x10
在特定实施方案中,方法还可以包括耗竭CD3阳性、CD14阳性和/或CD19阳性细胞的NK细胞的步骤,例如在(a)之前。本公开内容的任一方法还可以包括在步骤(b1)或(b2)之前耗竭CD3阳性、CD14阳性和/或CD19阳性细胞的NK细胞的步骤。在某些情况下,在(a)和/或(d)中,NK细胞与抗原呈递细胞的比率为1:1、1:1.5、1:2或1:3。至少在特定情况下,电穿孔步骤中引导RNA的浓度为3、4或5μM。举例而言,电穿孔步骤中Cas9核酸酶的浓度可为约4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9或5μM。在特定情况下,IL-2的浓度为约100单位/ml至约300单位/ml。在一些情况下,IL-2的浓度可以是100、125、150、175、200、225、250、275或300单位/ml。
在特定实施方案中,异源抗原受体是嵌合抗原受体或T细胞受体,尽管单个NK细胞可以表达它们两者中的一种或多种。异源抗原受体可以靶向肿瘤相关抗原。在特定情况下,异源抗原受体靶向选自以下的抗原:CD19、CD319(CS1)、ROR1、CD20、CD70、B7H3、HLA-G、CD38、癌胚抗原、甲胎蛋白、CA-125、MUC-1、上皮肿瘤抗原、黑色素瘤相关抗原、突变的p53、突变的ras、HER2/Neu、ERBB2、叶酸结合蛋白、HIV-1包膜糖蛋白gp120、HIV-1包膜糖蛋白gp41、GD2、CD5、CD123、CD23、CD30、CD56、c-Met、间皮素、GD3、HERV-K、IL-11Rα、κ链、λ链、CSPG4、ERBB2、WT-1、TRAIL/DR4、VEGFR2、CD33、CD47、CLL-1、U5snRNP200、CD200、BAFF-R、BCMA、CD99及其组合。
在特定实施方案中,在NK细胞中具有表达的破坏的基因是任何基因,但在特定情况下它是抑制基因,例如选自以下的抑制基因:NKG2A、SIGLEC-7、LAG3、TIM3、CISH、FOXO1、TGFBR2、TIGIT、CD96、ADORA2、NR3C1、PD1、PDL-1、PDL-2、CD47、SIRPA、SHIP1、ADAM17、RPS6、4EBP1、CD25、CD40、IL21R、ICAM1、CD95、CD80、CD86、IL10R、TDAG8、CD5、CD7、SLAMF7、CD38、LAG3、TCR、β2-微球蛋白、HLA、CD73、CD39及其组合。在特定情况下,该基因是抑制基因。
在本文的任一方法中,在(d)的步骤之后可以或可以不分析细胞,包括通过基因编辑效率(例如敲除(KO)效率)、功能性测定、细胞毒性测定和/或体内活性分析细胞。在特定实施方案中,分析细胞的表达状态、细胞因子产生、脱颗粒、细胞毒性、抗肿瘤活性或其组合。分析方法可以包括PCR、流式细胞术、质谱流式细胞术、RNA测序、Incucyte杀伤、BLI成像、铬释放测定、膜联蛋白V凋亡测定或其组合。在(d)的步骤后,可储存细胞,例如冷冻保存。在(d)之后,可将有效量的细胞递送至有需要的个体,例如患有癌症、感染性疾病和/或免疫相关疾病的个体。
本公开内容的实施方案包括通过本文所包含的任何方法产生的NK细胞群。设想了包含本公开内容的细胞群的组合物,包括当群体在药学上可接受的载体中时。
本公开内容的实施方案包括治疗个体的医学病况的方法,包括向个体施用治疗有效量的由本公开内容的任何方法产生的NK细胞的步骤。
本公开内容的其他目的、特征和优点将从以下详细描述中变得明显。然而,应当理解,详细描述和具体实例虽然指示了本公开内容的特定实施方案,但仅通过举例说明的方式给出,因为在本发明的精神和范围内的各种变化和修改将根据该详细描述对本领域技术人员变得明显。
附图简述
以下附图构成本说明书的一部分,并被包括以进一步证明本发明的某些方面。可以通过参考这些附图中的一个或多个结合本文所呈现的具体实施方案的详细描述来更好地理解本发明。
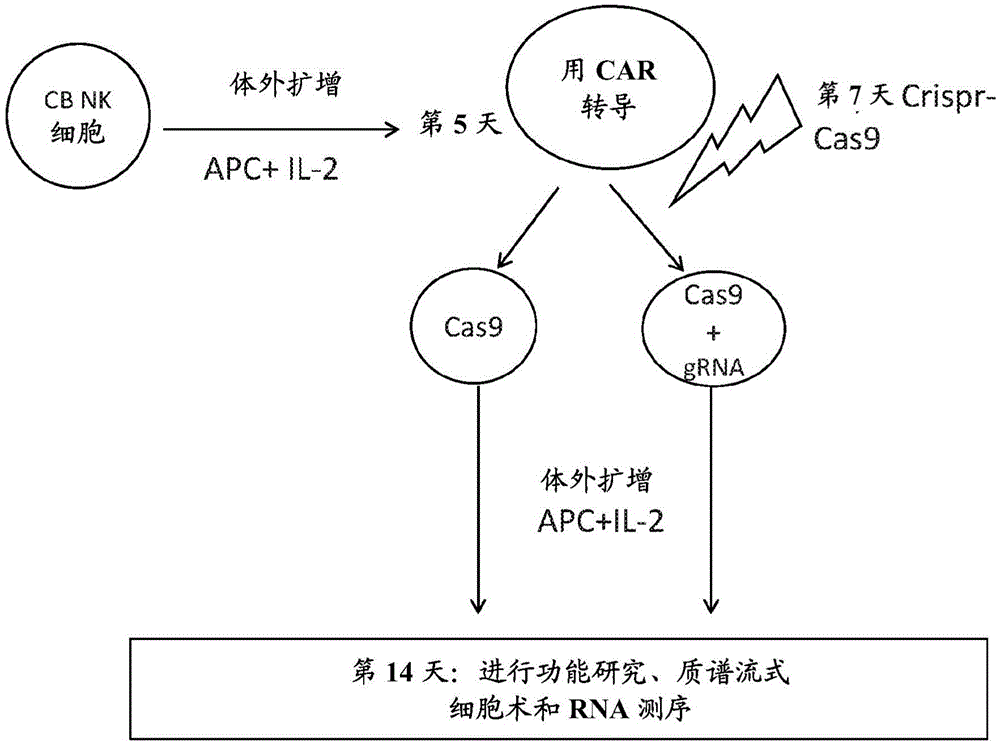
图1.将原代脐带血来源的NK细胞的CAR转导和CRISPR Cas9基因编辑相结合的方案的示意图。首先用饲养细胞(APC)和IL-2扩增CB NK细胞,培养第5天,通过逆转录病毒载体用CAR构建体转导NK细胞,在第7天,然后使用核糖核蛋白复合物(RNP)进行CRISPR-Cas9基因编辑。然后在体外进一步扩增NK细胞,并在第14天进行功能研究,质谱流式细胞术和RNA测序(根据需要)。
图2.示出了例如在GMP中的原代NK细胞的CAR转导和CRISPR Cas9基因编辑的方案的实例的示意图。
图3A-3C.在原代CAR-NK细胞中CD47的小规模和大规模高效CRISPR RNP介导的KO的比较。图3A.在500万和3000万规模水平下通过tracrRNA荧光标记证明的电穿孔效率。图3B.在500万和3000万个电穿孔的细胞剂量水平下,通过PCR凝胶电泳显示的敲除效率。图3C.在小规模和大规模水平下再次通过流式细胞术显示的敲除效率。
图4A-4F.在原代CAR-NK细胞中TGFBR2的小规模和大规模CRISPR RNP介导的KO的比较。图4A.在500万和3000万规模水平下通过tracrRNA荧光标记证明的电穿孔效率。图4B.在500万相对3000万个细胞中通过PCR凝胶电泳显示的敲除效率。图4C.在500万相对3000万个细胞中,与Cas9对照相比,在RNP介导的KO后,显示活细胞数的有核活细胞总数。图4D.在500万和3000万剂量水平下,评估在使用或不使用TGF-β的处理的情况下的pSMAD2/3信号传导的Phosphoflow测定。图4E.在500万和3000万个细胞KO规模下,在THP-1肿瘤靶标上门控的凋亡膜联蛋白V测定。Lonza 4-D;100ul X试剂盒L-V4XP-3024;1mL LV Unit-V4LP-3002;程序EO-115;Cas9/gRNA的摩尔比-4.6uM gRNA,4uM Cas9。图4F.总结了500万和3000万个细胞KO规模水平下对于cas9对照或TGFBR2 KO CAR NK细胞使用质谱流式细胞术进行表型分析的热图。
图5A-5L.用于每个靶基因的crRNA序列的实例,和通过流式细胞术或PCR描述的KO效率的代表性实例。图5A.NKG2A(外显子4),SEQ ID NO:1;图5B.TIM3(外显子2),SEQ IDNO:2;图5C.SHP1(外显子4;SEQ ID NO:3;图5D.TIGIT(外显子3),SEQ ID NO:4;图5E.CD96(外显子2),SEQ ID NO:5;图5F.TGFBR2(外显子5),gRNA1的SEQ ID NO:6,gRNA2的SEQ IDNO:7;图5G.CISH(外显子4),crRNA1的SEQ ID NO:8,crRNA2的SEQ ID NO:9;图5H.PD1(外显子2),SEQ ID NO:10;图5I.A2AR(外显子3),crRNA1的SEQ ID NO:11,crRNA2的SEQ ID NO:12;图5J.LAG3(外显子3),SEQ ID NO:13;图5K.Siglec 7(外显子1),SEQ ID NO:14;图5L.CD38(外显子2),SEQ ID NO:15。
图6.用于每个靶向的基因的crRNA的序列的实例。
图7A-7C.CRISPR/Cas9介导NK细胞中有效的多个基因破坏。FIGS.7A-7B.PCR凝胶电泳显示与左图上的野生型(WT)相比,2个NK细胞供体中不同基因(2个不同组,图7A中的组1,图7B中的组2)的KO效率。图7C.通过流式细胞术显示与Cas9对照相比各种基因的KO效率的直方图。
图8A-8G.NK细胞中抑制性分子的多重基因编辑改善了其体外功能。图8A.代表性FACS图显示当针对Raji淋巴瘤测试时,与Cas9对照相比,在NKG2A、TGFBR2和CISH的三重KO后CAR19-NK细胞的增加的细胞因子(IFNg、TNFa)产生和脱颗粒(CD107a)。图8B.柱状图总结了来自3个不同NK细胞供体的功能测定的细胞因子产生和脱颗粒数据。图8C.铬释放测定显示与Cas9对照相比,三重KO CAR19-NK细胞对Raji肿瘤细胞的增加的特异性裂解。图8D.Incucyte杀伤测定显示与Cas9对照相比,三重KO CAR19-NK细胞对Raji肿瘤细胞的增强的杀伤作用。图8E.膜联蛋白V凋亡测定的代表性FACS图显示与Cas9对照相比,与三重KOCAR19-NK细胞共培养后Raji肿瘤的增加的凋亡。图8F.柱状图总结了3个NK细胞供体的膜联蛋白V凋亡测定的数据。图8G.柱状图显示当针对Raji淋巴瘤进行测试时,与Cas9对照相比,NKG2A、TGFBR2和CISH的三重KO后CAR19-NK细胞的增加的穿孔素和颗粒酶B产生
图9A-9B.NK细胞中抑制性分子的多重基因编辑改善其在Raji淋巴瘤小鼠模型中的体内抗肿瘤活性。图9A.BLI成像显示与接受Raji+Cas9对照CAR19-NK细胞或单独的Raji的小鼠组相比,接受Raji+三重KO CAR19-NK细胞的小鼠组中的改善的肿瘤控制。图9B.Kaplan Meir曲线显示与接受Raji+Cas9对照CAR19-NK细胞或单独的Raji的小鼠组相比,接受Raji+三重KO CAR19-NK细胞的小鼠的增强的存活。
图10A-10C.CAR-NK细胞中的ADAM17 KO防止CD16和CD62L的脱落。图10A.PCR DNA凝胶电泳显示ADAM17在CAR-NK细胞中的有效KO。图10B.代表性FACS图显示了在具有或不具有与肿瘤的共培养的情况下以及在具有或不具有使用利妥昔单抗(一种靶向表达CD20的癌症的单克隆抗体)的治疗的情况下在ADAM17 KO后,CAR-NK细胞上CD16的增加的表达。图10C.代表性FACS图显示,在具有或不具有与肿瘤的共培养的情况下,与WT NK细胞相比,在ADAM17 KO后CAR-NK细胞上增加的CD62L表达。
图11A-11B.证明使用PCR测试Lonza 4D-NucleofactorTM中电穿孔的各种程序(CM137、DN100、CA137、DS137和EH100)的NR3C1基因敲除效率。这使用5E6 T细胞和Plasmalyte(补充有HEPES和甘露醇,PL)以小规模进行;图11A显示使用各种生产商程序在T细胞中敲除NR3C1基因。图11B显示了用各种电穿孔程序测试的NR3C1基因敲除细胞的倍数扩增。
图12A-12B.关注使用PCR对于在Lonza 4D-NucleofactorTM中用于电穿孔的CM137程序测试的NR3C1敲除效率。这使用Lonza缓冲液(P3)或PL(补充有HEPES和甘露醇)利用50E6和使用PL(补充有HEPES和甘露醇)利用100E6以大规模进行(图12A)。图12B显示了在Lonza 4D-NucleofactorTM中使用CA137程序进行电穿孔的NR3C1敲除效率。这使用PL(补充HEPES和甘露醇)利用50E6或100E6以大规模进行。
举例说明性实施方案的描述
I.定义
如在本说明书中使用的,“一个”或“一种”可以是指一个或多个/一种或多种。如权利要求中使用的,当与单词“包括”一起使用时,单词“一个”或“一种”可以是指一个或多个/一种或多种。如本文所用,“另一个”可以是指至少第二个或更多个。此外,术语“具有”、“包括”、“包含”和“含有”是可互换的,本领域技术人员认识到这些术语是开放式术语。在具体实施方案中,本公开内容的各方面可例如“基本上由”或“由”本公开内容的一个或多个序列组成。本发明的一些实施方案可以由本公开内容的一个或多个元件、方法步骤和/或方法组成或基本上由一个或多个元件、方法步骤和/或方法组成。预期本文所述的任何方法或组合物可相对于本文所述的任何其他方法或组合物来实施。本申请的范围不限于本说明书中描述的工艺、机器、制造、物质组成、手段、方法和步骤的特定实施方案。如本文所用,术语“或”和“和/或”用于描述组合或相互排斥的多个组分。例如,“x、y和/或z”可以指单独的“x”、单独的“y”、单独的“z”、“x、y和z”、“(x和y)或z”、“x或(y和z)”或“x或y或z”。具体地设想,x、y或z可以被具体地从实施方案中排除。
权利要求中术语“或”的使用用于表示“和/或”,除非明确指示仅指替代品或替代品是相互排斥的,尽管本公开内容支持指仅替代品和“和/或”的定义。如本文所用,“另一个”可以是指至少第二个或更多个。术语“约”、“实质”和“约”通常是指所述值的正负5%。
在整个本说明书中,提及“一个实施方案”、“实施方案”、“特定实施方案”、“相关实施方案”、“某个实施方案”、“额外的实施方案”或“另一个实施方案”或其组合意味着结合实施方案描述的特定特征、结构或特征包括在本公开内容的至少一个实施方案中。因此,前述短语在整个本说明书的各个地方的出现不一定都指相同的实施方案。此外,在一个或多个实施方案中,可以以任何合适的方式组合特定特征、结构或特征。
“免疫性疾病”、“免疫相关疾病”或“免疫介导的疾病”是指其中免疫应答在疾病的发生或进展中起关键作用的疾病。免疫介导的疾病包括自身免疫性疾病、同种异体移植物排斥、移植物抗宿主病以及炎性和过敏性疾病。
如本文所用,术语“工程化”是指人工产生的实体,包括细胞、核酸、多肽、载体等。在至少一些情况下,工程化实体是合成的,并且包括不天然存在或不以其在本公开内容中使用的方式配置的元件。关于细胞,可以对细胞进行工程化,因为它们具有一种或多种内源性基因的降低的表达和/或因为它们表达一种或多种异源基因(例如合成的抗原受体和/或细胞因子),在这种情况下,工程化全部人工进行。关于抗原受体,抗原受体可被认为是工程化的,因为其包含被基因重组以以在自然界中未发现的方式(例如以在自然界中未发现如此配置的组分的融合蛋白的形式)配置的多个组分。
如本文所用,术语“大规模”是指近似地多至10
疾病或病况的“治疗”或医治是指执行方案,该方案可能包括向患者施用一种或多种药物,以努力减轻疾病的体征或症状。治疗的理想效果包括降低疾病进展率、改善或缓解疾病状态、和缓解或改善预后。缓解可发生在疾病或病况的体征或症状出现之前,也可发生在其出现之后。因此,“治疗”或“医治”可包括“预防”或“防止”疾病或不想要的病况。此外,“治疗”或“医治”不需要完全缓解体征或症状,不需要治愈,并且具体包括对患者仅有轻微影响的方案。
在本申请中使用的术语“治疗益处”或“治疗有效”是指关于该病况的医疗治疗促进或增强受试者的福祉的任何方面。这包括但不限于降低疾病的体征或症状的频率或严重程度。例如,癌症的治疗可涉及例如肿瘤尺寸的减小、肿瘤侵袭性的降低、癌症的生长率的降低或转移的预防。癌症的治疗也可以指延长癌症受试者的生存期。
“受试者”和“患者”或“个体”是指人或非人,例如灵长类动物、哺乳动物和脊椎动物。在特定实施方案中,受试者是人。
如本文所用,“哺乳动物”是本发明的方法的合适受试者。哺乳动物可以是包括人类在内的高等脊椎动物类哺乳动物的任何成员;其特征是活产、体毛和雌性动物中分泌乳汁用于喂养幼仔的乳腺。此外,哺乳动物的特征是,尽管气候条件发生变化,但它们仍能够保持恒定的体温。哺乳动物的例子是人、猫、狗、牛、小鼠、大鼠、马、山羊、绵羊和黑猩猩。哺乳动物可以被称为“患者”或“受试者”或“个体”。
术语“药学或药理学上可接受”是指当根据需要施用至动物(例如人)时不产生不利、过敏或其他不良反应的分子实体和组合物。根据本公开内容,本领域技术人员将已知包含抗体或其他活性成分的药物组合物的制备。此外,对于动物(例如人)施用,应理解制剂应符合FDA生物标准办公室要求的无菌、热原性、一般安全性和纯度标准。
如本文所用,“药学上可接受的载体”包括任何和所有的水性溶剂(例如,水、醇/水溶液、盐水溶液、胃肠外媒介物,例如氯化钠、林格氏葡萄糖等)、非水溶剂(例如丙二醇、聚乙二醇、植物油和可注射有机酯,例如乙醇酸盐)、分散介质、涂层、表面活性剂、抗氧化剂、防腐剂(例如抗细菌剂或抗真菌剂、抗氧化剂、螯合剂和惰性气体)、等渗剂、吸收延迟剂、盐、药物、药物稳定剂、凝胶、粘合剂、赋形剂、崩解剂、润滑剂、甜味剂、调味剂、染料、流体和营养补充剂,像这样的材料及其组合,如本领域普通技术人员已知的。根据众所周知的参数调节药物组合物中各种组分的pH和精确浓度。
如本文所用,基因的“破坏”是指与不存在破坏的基因产物的表达水平相比,由对象基因编码的一种或多种基因产物在细胞中的表达的消除或减少。示例性基因产物包括由基因编码的mRNA和蛋白质产物。在某些情况下,破坏是短暂或可逆的,在其他情况下是永久性的。在某些情况下,尽管可能产生截短或非功能性产物,但破坏是功能性或全长蛋白或mRNA的破坏。在本文的一些实施方案中,与表达相对地,破坏基因活性或功能。基因破坏通常是通过人工方法诱导的,即通过添加或引入化合物、分子、复合物或组合物,和/或通过破坏基因的核酸或与基因相关的核酸,例如在DNA水平上。基因破坏的示例性方法包括基因沉默、敲低、敲除和/或基因破坏技术,例如基因编辑。实例包括反义技术,例如RNAi、siRNA、shRNA和/或核酶,其通常导致表达的短暂降低,以及导致靶向的基因失活或破坏的基因编辑技术,例如通过诱导断裂和/或同源重组。实例包括插入、突变和缺失。这种破坏通常导致基因编码的正常或“野生型”产物的表达的抑制和/或完全缺失。此类基因破坏的实例是插入、移码和错义突变、缺失、敲入和基因或部分基因的敲除,包括整个基因的缺失。这种破坏可发生在编码区,例如在一个或多个外显子中,导致无法产生全长产物、功能性产物或任何产物,例如通过插入终止密码子。这种破坏也可通过启动子或增强子或影响转录激活的其他区域的破坏而发生,从而阻止基因的转录。基因破坏包括基因靶向,包括通过同源重组使靶向的基因失活。
如本文所用,术语“异源”是指来源于不同的细胞类型或不同的物种(与受者相比)。在特定情况下,其是指合成的和/或不是来自NK细胞的基因或蛋白质。该术语也指合成衍生的基因或基因构建体。该术语也指合成衍生的基因或基因构建体。例如,即使细胞因子是由NK细胞天然产生的,也可以认为细胞因子相对于NK细胞异源,因为细胞因子是合成衍生的,例如通过基因重组,包括在含有编码细胞因子的核酸序列的载体中提供给NK细胞。
本公开内容涉及用于NK细胞的大规模扩增、CAR转导、细胞因子表达和基因编辑的新方法。该方法允许待扩增至较大数量并经转导以重定向其对一种或多种肿瘤抗原的特异性(此外还任选地表达一种或多种异源抗原受体和/或一种或多种异源细胞因子基因)的NK细胞(例如,外周血来源的、脐带血来源的、干细胞来源的(例如,造血或诱导多能干细胞)或细胞系来源的NK细胞)的扩增。通过删除增加NK细胞活性的基因(例如参与细胞耗竭和肿瘤诱导的功能障碍的一种或多种基因,作为一些实例)进一步改善NK细胞的功能。
在特定实施方案中,本公开内容首次报告人NK细胞中单个或多个基因的组合CAR转导和缺失有助于细胞的改善的功能和对肿瘤微环境的抗性。特别是,大规模和GMP级方案被用于此方法以用于临床转化。本公开内容对使用增强患者自身NK细胞或过继转移的NK细胞或其混合物的功能的新型免疫治疗方法的患者护理具有直接影响。
II.工艺
本公开内容的实施方案涉及产生工程化NK细胞(特别是在大规模上)以及包含由其产生的产品、由其产生的产品组成或基本上由其产生的产品组成的组合物的工艺。在特定实施方案中,该工艺利用一个特定参数或特定参数的组合来产生某些类型的工程化NK细胞,其中所述参数可以包括一定浓度的试剂、某些类型的NK细胞、一个或多个步骤的一定持续时间、某些类型的修饰、某些类型的细胞修饰机制或它们的组合。本领域技术人员将认识到,尽管本文描述了最佳变量,但仍然存在将产生适当量的有效工程化NK细胞的工艺的变型,并且这些也包含在本文中。
在特定实施方案中,该工艺涉及多个步骤,其中通过修饰细胞以表达一种或多种异源蛋白,但也通过基因编辑对其基因组进行修饰以减少或消除细胞的一种或多种内源性基因的表达来产生细胞。在一些情况下,细胞可经受针对一种或多种标志物的选择或经受对于一种或多种标志物的选择。这些步骤可以具有或可以不具有特定顺序。在特定实施方案中,一个或多个步骤同时发生,和/或一个或多个步骤相继发生。在特定情况下,该工艺通常涉及一系列步骤,并且在特定实施方案中,该系列包括NK细胞的扩增、NK细胞在两个或更多个方面的工程化以及所产生的工程化细胞的扩增,随后是任选的分析步骤和/或任选的施用步骤(对个体)。在特定实施方案中,工程化包括(1)修饰细胞以表达异源蛋白,例如抗原受体,和(2)修饰细胞以具有NK细胞中一种或多种内源性基因的减少的表达(敲低)或消除的表达(敲除)。可以特异性地选择基因用于敲低或敲除,因为这样做时,与未如此修饰的NK细胞相比,所得的修饰的细胞具有一种或多种增强的活性。此类活性的实例包括例如抗肿瘤活性、效力、增殖、运输、抗体依赖性细胞毒性、对皮质类固醇的耐药性和/或持久性。在某些情况下(1)发生在(2)之前,而在其他情况下(2)发生在(1)之前。尽管可以通过任何方式进行细胞的修饰以具有降低的表达或消除的表达,但在具体实施方案中,该修饰是通过CRISPR进行的。
该工艺的初始步骤可能包括NK细胞的扩增,其允许增加用于最终修饰的NK细胞的数量。NK细胞可例如从新鲜来源或储存或商购获得。NK细胞可以来自供体或需要最终修饰的NK细胞的个体。尽管NK细胞可以是任何种类的,但在特定实施方案中,NK细胞来源于脐带血、外周血、骨髓、造血或诱导的多能干细胞、NK细胞系或其混合物。在特定情况下NK细胞来自脐带血。在特定实施方案中,用于扩增步骤的NK细胞的起始培养物包括至少5-100x10
在特定实施方案中,在开始培养中的扩增步骤之前,NK细胞经受可能存在于NK细胞群的特定不想要的细胞(例如T细胞、B细胞和/或单核细胞)的耗竭。耗竭步骤可能利用不想要的细胞上某些标志物的存在,作为从NK细胞群中剔除它们的手段。例如,在特定情况下,NK细胞的起始来源经受CD3、CD14和/或CD19阳性细胞的耗竭。作为实现这一点的方法的一个实例,可以使用免疫磁珠(分别具有附着到其上的CD3、CD14和/或CD19的抗体)使细胞耗竭,从而产生富集的NK细胞群。在其他情况下,来自混合群体的所需NK细胞可通过NK细胞上一种或多种标志物(例如CD56、CD16、NKp46和/或NKG2D)的存在来选择。
扩增步骤可以或可以不从待计数以提供用于用饲养细胞(例如可以或可以不被辐照的抗原呈递细胞)培养NK细胞的数量的准确评估的富集的NK细胞群开始。扩增步骤中NK细胞与APC的比例可以是一定数量,例如1:1、1:1.5、1:2或1:3。在某些方面,对APC进行工程化以表达膜结合IL-21(mbIL-21)。在特定方面,APC被替代地或额外地工程化以表达IL-21、IL-15和/或IL-2。在某些方面,APC是通用抗原呈递细胞(uAPC)。在某些方面,uAPC经工程化以表达(1)CD48和/或CS1(CD319)、(2)膜结合白细胞介素-21(mbIL-21)和/或(3)41BB配体(41BBL)。在某些方面,uAPC表达CD48。在某些方面,uAPC表达CS1。在特定方面,uAPC表达CD48和/或CS1。在某些方面,uAPC基本上不表达内源性HLA I类、II类和/或CD1d分子。在某些方面,uAPC表达ICAM-1(CD54)和/或LFA-3(CD58)。在特定方面,uAPC进一步定义为白血病细胞衍生的aAPC,例如K562细胞。
在特定实施方案中,其中发生扩增步骤的培养基包括一种或多种促进扩增的试剂,例如一种或多种细胞因子。在特定实施方案中,培养基包括IL-2、IL-15、IL-18和/或IL-21,并且可不包括其他外源性添加的细胞因子。在一些实施方案中,培养基中IL-2的浓度为10-1000IU,包括10-1000、10-750、10-500、10-250、10-200、10-100、50-1000、50-750、50-500、50-250、50-200、50-100、100-1000、100-750、100-500、100-250、100-200、250-1000、250-750、250-500、500-1000、500-750或750-1000IU。在特定实施方案中,培养基中IL-2的浓度在100-300单位/mL的范围内,包括100、125、150、175、200、225、250、275或300单位/mL。扩增步骤可在一定温度下进行,例如约35℃-38℃,包括35℃、36℃、37℃或38℃。在不同的温度下可能发生或可能不发生不同的扩增步骤。扩增步骤可以或可以不在一定水平的氧气下发生,例如从3%-7%CO
在扩增步骤开始后的一定天数之后,细胞可以进一步经历耗竭步骤,尽管在替代实施方案中它们不经历耗竭步骤。在特定情况下,在扩增步骤开始后第5天或第6天,细胞经历耗竭步骤,以耗竭CD3、CD14和/或CD19阳性细胞。
在NK细胞扩增开始后约第3、4、5、6、7或8天,可对扩增的NK细胞进行一种或多种修饰。第一修饰可以是NK细胞的转导或转染以表达异源抗原受体,尽管在某些情况下,第一修饰是破坏NK细胞的一种或多种内源性基因的表达。当第一修饰是转导或转染NK细胞以表达异源抗原受体时,随后的修饰是破坏NK细胞的一种或多种内源性基因的表达。当第一修饰是破坏NK细胞的一种或多种内源性基因的表达时,随后的修饰是转导或转染NK细胞以表达异源抗原受体。
在特定实施方案中,将扩增的NK细胞转导或转染以容纳异源抗原受体基因,随后细胞被编辑用于破坏一种或多种内源性基因的表达。在特定实施方案中,用包含编码一种或多种嵌合抗原受体、一种或多种T细胞受体或其组合的表达构建体的特定载体转导或转染细胞。载体可以是任何种类的,包括至少纳米颗粒、质粒、慢病毒载体、逆转录病毒载体、腺病毒载体、腺病毒相关载体等。NK细胞可以用载体转染或转导,所述载体允许NK细胞表达多种异源蛋白,例如异源抗原受体、自杀基因和一种或多种细胞因子,例如一种或多种选自IL-7、IL-2、IL-15、IL-12、IL-18、IL-21及其组合的异源细胞因子。虽然多个异源蛋白的基因可能存在于同一载体上,但在某些情况下,它们存在于多个载体上。一旦细胞被转导或转染,NK细胞就被修饰,并且可以或可以不针对异源蛋白的表达进行测试,并且这可能发生在转染/转导后1、2、3或更多天。当测试来自修饰的NK细胞群的等分试样时,在进一步修饰之前,例如在NK细胞的基因编辑之前,可以或可以不进行所述测试。
在一些实施方案中,在NK细胞的扩增开始后约第6、7、8、9、10、11或12天内,可对修饰的NK细胞进行基因编辑的方法。基因编辑步骤可以或可以不发生在转染/转导步骤后的1、2、3或更多天内。修饰的NK细胞的基因编辑可以通过任何合适的方法发生,但在特定实施方案中,通过CRISPR方法进行修饰的NK细胞的基因编辑。因此,在特定实施方案中,将修饰的细胞暴露于适当量的Cas9和引导RNA。在NK细胞的多于一个基因被破坏表达的情况下,可以存在一组引导RNA,其包括针对待编辑的每个所需基因的一个或多个序列特异性引导RNA。在特定实施方案中,并且作为其中要编辑NK细胞中的两个内源性基因的实例,将修饰的NK细胞经受两个不同的电穿孔步骤,时间间隔为1、2、3或更多天。在一些情况下,第一电穿孔步骤包括靶向一个、两个或更多个基因,第二电穿孔步骤包括靶向一个、两个或更多个基因,其是与第一电穿孔步骤中的基因不同的基因。在某些情况下,存在两个电穿孔步骤以外的连续电穿孔步骤,包括3、4、5或更多个额外的电穿孔步骤。在使用多个电穿孔步骤的任何情况下,下一次电穿孔只能在一定持续时间之后发生,例如仅在自先前电穿孔步骤的1、2、3、4或更多天之后发生。
在某些实施方案中,NK细胞首先经历基因编辑步骤,随后经历转导或转染步骤以容纳异源抗原受体基因。
在NK细胞的基因编辑和转化/转导之后,NK细胞可以或可以不经历第二扩增步骤以增加修饰的基因编辑的NK细胞的数量。在特定实施方案中,工艺中的第二扩增步骤可以基本上与工艺中的第一扩增步骤相同,尽管在替代实施方案中,第二扩增步骤不同于第一扩增步骤,例如具有不同的培养基、不同的外源性添加的化合物、不同的培养/扩增的持续时间、不同的扩增瓶例如GREX或WAVE(仅举几例)或其组合,等等。在特定情况下,第二扩增步骤包括用饲养细胞(包括可以或可以不被辐照的抗原呈递细胞)培养经修饰的基因编辑的NK细胞。在该第二扩增步骤中,NK细胞与APC的比率可以是一定数量,例如1:1、1:1.5、1:2或1:3。在特定实施方案中,其中发生扩增步骤的培养基包括一种或多种促进扩增的试剂,例如一种或多种细胞因子。在特定实施方案中,培养基包括IL-2,并且可以不包括其他外源性添加的细胞因子。在特定实施方案中,培养基中IL-2的浓度在100-300单位/mL的范围内,包括100、125、150、175、200、225、250、275或300单位/mL。扩增步骤可在一定温度下进行,例如约35℃-38℃,包括35℃、36℃、37℃或38℃。扩增步骤可以在一定水平的氧气下进行,例如从3%-7%CO
在第二扩增步骤的特定持续时间之后,可以使用、分析、储存细胞等。例如,可以分析细胞的(1)异源抗原受体结合其靶抗原的能力;(2)编辑的基因的表达或其缺乏以确认表达的敲低或敲除;或(3)两者。在特定实施方案中,分析细胞的功能性、细胞毒性、体内活性、表达状态、细胞因子产生、脱颗粒等。分析方法可以包括PCR、流式细胞术、质谱流式细胞术、RNA测序、Incucyte杀伤、BLI成像、铬释放测定、膜联蛋白V凋亡测定或其组合。
在特定实施方案中,储存产生的NK细胞,包括例如冷冻保存。例如,NK细胞可以被冷冻保存以供从其获得起始NK细胞的个体使用,或者NK细胞可以被冷冻保存以供与从其获得起始NK细胞的个体不同的个体使用。
III.NK细胞
本公开内容涉及修饰NK细胞的工艺,而不是其他类型的免疫细胞。NK细胞是一种对多种肿瘤细胞、病毒感染的细胞以及骨髓和胸腺中的一些正常细胞具有自发性细胞毒性的淋巴细胞亚群。NK细胞在骨髓、淋巴结、脾脏、扁桃体和胸腺中分化成熟。NK细胞可通过特异性表面标志物(例如人中的CD16和/或CD56)检测。NK细胞不表达T细胞抗原受体、泛T标志物CD3或表面免疫球蛋白B细胞受体。
在某些实施方案中,NK细胞通过本领域公知的方法衍生自人外周血单核细胞(PBMC)、未刺激的白细胞去除术产物(PBSC)、人胚胎干细胞(hESC)、诱导多能干细胞(iPSC)、骨髓或脐带血或NK细胞系。特别地,脐带CB可用于衍生NK细胞。在某些方面,通过先前描述的NK细胞的离体扩增的方法分离和扩增NK细胞(Spanholtz等人,2011;Shah等人,2013)。在该方法中,通过ficoll密度梯度离心分离CB单核细胞,并将其与IL-2和人工抗原呈递细胞(aAPC)在生物反应器中培养。7天后,细胞培养物可耗竭表达CD3的任何细胞,并再培养另外7天。细胞可再次进行CD3耗竭并经表征以确定CD56
如本文其他地方所述,NK细胞在其制备期间扩增一次或两次。如上所述,在特定情况下,NK细胞的扩增包括:在抗原呈递细胞(APC)和IL-2存在的情况下,刺激来自脐带血的单核细胞(MNC);以及在该工艺中的某个时间点,用APC再刺激细胞以产生扩增的NK细胞。在至少一些情况下,该方法在生物反应器中进行。工艺的多个步骤可能发生在同一容器中,包括相同的生物反应器。该刺激步骤可将MNC导向NK细胞。再刺激步骤可以包括或可以不包括IL-2的存在。在特定方面,该方法不包括在刺激步骤期间移除或添加任何培养基组分。在特定方面,该方法在特定的时间范围内进行,例如在少于15天内,例如在14天内进行。
如本文其他地方详述的,在某些实施方案中,通过用于扩增的离体方法扩增NK细胞,所述方法包括:(a)从脐带血获得单核细胞(MNC)的起始群体;(b)在抗原呈递细胞(APC)和IL-2的存在下刺激MNC;和(c)用APC再刺激细胞以产生扩增的NK细胞,其中该方法在生物反应器中进行,并且符合药品生产质量管理规范(GMP)。步骤(b)的刺激可将MNC导向NK细胞。在一些情况下,步骤(c)可以包括或可以不包括IL-2的存在。在特定方面,该方法不包括在步骤(b)期间移除或添加任何培养基组分。在特定方面,该方法在少于15天内,例如在14天内进行。
如所述的,该方法还包括例如耗竭对一种或多种特定标志物(例如CD3、CD14和/或CD19)呈阳性的细胞。在某些方面,在转导或转染之前和/或在基因编辑之后执行耗竭步骤。在某些方面,将细胞从生物反应器中移出以用于CD3、CD14和/或CD19耗竭,并置于生物反应器中进行后续步骤。
在某些方面,从脐带血中获得MNC的起始群体包括在右旋糖酐、人血清白蛋白(HSA)、DNAse和/或氯化镁的存在下解冻脐带血。在特别的方面,从脐带血获得MNC的起始群体包括在右旋糖酐和/或DNase的存在下解冻脐带血。在特定方面,脐带血在5-20%例如10%的右旋糖酐的存在下洗涤。在某些方面,脐带血在氯化镁的存在下(例如浓度为100-300mM,特别是200mM)悬浮。在一些方面,获得包括进行ficoll密度梯度离心以获得单核细胞(MNC)。在某些方面,NK细胞源自的脐带血是冷冻的脐带血。在特定方面,已经对冷冻的脐带血测试了一种或多种传染病,例如甲型肝炎、乙型肝炎、丙型肝炎、克氏锥虫、HIV、人嗜T淋巴细胞病毒、梅毒、寨卡病毒等。在一些方面,脐带血是合并的脐带血,例如来自3、4、5、6、7或8个个体脐带血单元。
在某些方面,该方法不包括人白细胞抗原(HLA)匹配。在某些方面,NK细胞的起始群体不是从单倍同一性的供体获得的。
在一些方面,由工艺产生的扩增的NK细胞包括临床相关剂量。在一些方面,NK细胞相对于受者个体是自体的。在某些方面,NK细胞相对于受者个体是同种异体的。
IV.异源抗原受体
本公开内容的NK细胞可经遗传工程化以表达一种或多种异源抗原受体,例如一种或多种工程化TCR、一种或多种CAR、一种或多种嵌合细胞因子受体、一种或多种趋化因子受体、其组合等。异源抗原受体是人工合成产生的。在特定实施方案中,NK细胞被修饰以表达一种或多种CAR和/或一种或多种TCR,其各自对不同癌症抗原具有抗原特异性。可以向NK细胞添加多个CAR和/或TCR,例如针对不同抗原的CAR和/或TCR。在一些方面,通过在特定基因座敲入CAR或TCR,例如通过使用CRISPR,对免疫细胞进行工程化以表达CAR和/或TCR。
尽管在特定情况下使用CRISPR特别编辑NK细胞,但本领域已知替代的合适的修饰方法。参见例如上文的Sambrook和Ausubel。例如,可以使用Heemskerk等人,2008和Johnson等人,2009中描述的转导技术转导细胞以表达对癌症抗原具有抗原特异性的CAR或TCR。在一些实施方案中,细胞包含通过遗传工程化引入的编码一种或多种抗原受体的一种或多种核酸,以及此类核酸的遗传工程化产物。在一些实施方案中,核酸是异源的,即,通常不存在于细胞或样品(从该细胞获得)中,例如从另一种生物或细胞获得的核酸,其例如通常不在进行工程化的细胞和/或衍生出此类细胞的生物体中发现。在一些实施方案中,核酸不是天然存在的,例如自然界中不存在的核酸(例如,嵌合的)。
在一些实施方案中,CAR含有与抗原特异性结合的细胞外抗原识别结构域。在一些实施方案中,抗原是在细胞表面表达的蛋白质。在一些实施方案中,CAR是TCR样CAR,并且抗原是经加工的肽抗原,例如细胞内蛋白的肽抗原,其像TCR一样,在主要组织相容性复合物(MHC)分子的背景下在细胞表面被识别。
示例性抗原受体(包括CAR和重组TCR)以及将所述受体工程化和引入细胞的方法包括例如描述于以下中的那些:国际专利申请公开号WO200014257、WO2013126726、WO2012/129514、WO2014031687、WO2013/166321、WO2013/071154、WO2013/123061美国专利申请公开号US2002131960、US2013287748、US20130149337、美国专利号6,451,995、7,446,190、8,252,592、8,339,645、8,398,282、7,446,179、6,410,319、7,070,995、7,265,209、7,354,762,7,446,191,8,324,353和8,479,118,和欧洲专利申请号EP2537416和/或Sadelain等人,2013;Davila等人,2013;Turtle等人,2012;Wu等人,2012描述的那些。在一些方面,遗传工程化的抗原受体包括如美国专利号7,446,190中描述的CAR,以及国际专利申请公开号WO/2014055668A1中描述的那些。
A.嵌合抗原受体
在一些实施方案中,CAR包含:a)一个或多个细胞内信号转导结构域,b)跨膜结构域,和c)包含一个或多个抗原结合区的细胞外结构域。
在一些实施方案中,工程化的抗原受体包括CAR,包括活化或刺激性CAR、共刺激性CAR(参见WO2014/055668)和/或抑制性CAR(iCAR,参见Fedorov等人,2013)。CAR通常包含与一种或多种细胞内信号转导组分连接(在一些方面通过接头和/或一个或多个跨膜结构域)的细胞外抗原(或配体)结合结构域。这样的分子通常模拟或近似通过天然抗原受体引起的信号、通过与共刺激受体组合的这样的受体引起的信号和/或仅通过共刺激受体引起的信号。
本公开内容的某些实施方案涉及使用核酸,包括编码抗原特异性CAR多肽(包括已被人源化以降低免疫原性的CAR(hCAR),其包含细胞内信号转导结构域、跨膜结构域以及包含一个或多个信号转导基序的细胞外结构域)的核酸。在某些实施方案中,CAR可以识别包含在一种或多种抗原之间的共享空间的表位。在某些实施方案中,结合区可包含单克隆抗体的互补决定区、单克隆抗体的可变区和/或其抗原结合片段。在另一个实施方案中,该特异性来源于与受体结合的肽(例如,细胞因子)。
预期人CAR核酸可以是用于增强人患者的细胞免疫疗法的人基因。在一个具体的实施方案中,本发明包括全长CAR cDNA或编码区。抗原结合区或结构域可以包含来源于特定人单克隆抗体的单链可变片段(scFv)的V
排列可以是多聚体,例如双抗体或多聚体。多聚体最可能通过将轻链和重链的可变部分交叉配对成双抗体而形成。构建体的铰链部分可以具有多种替代选择,从完全缺失到维持第一半胱氨酸,到脯氨酸而不是丝氨酸置换、到被截短至第一半胱氨酸。Fc部分可以被删除。任何稳定和/或二聚化的蛋白质都可以达到这个目的。可以仅使用Fc结构域的一个,例如人免疫球蛋白的CH2或CH3结构域。还可以使用经过修饰以改善二聚化的人免疫球蛋白的铰链区、CH2区和CH3区。也可以只使用免疫球蛋白的铰链部分。也可以使用CD8α的一部分。
在一些实施方案中,CAR核酸包含编码其他共刺激受体(例如,跨膜结构域和修饰的CD28细胞内信号转导结构域)的序列。其他共刺激受体包括但不限于CD28、CD27、OX-40(CD134)、DAP10、DAP12、4-1BB(CD137)或其组合中的一种或多种。除了由CD3ζ引发的主要信号外,由插入人CAR中的人共刺激受体提供的其他信号对于NK细胞的完全活化也很重要,并且可以帮助改善体内持久性和过继免疫疗法的治疗成功。
在一些实施方案中,以对特定抗原(或标志物或配体)具有特异性的方式构建CAR,所述特定抗原是例如在特定细胞类型中表达以通过过继疗法靶向的抗原,例如癌症标志物,和/或旨在诱导抑制反应的抗原,例如在正常或未患病细胞类型上表达的抗原。因此,CAR通常在其细胞外部分中包含一个或多个抗原结合分子,例如一个或多个抗原结合片段、结构域或部分,或一个或多个抗体可变结构域,和/或抗体分子。在一些实施方案中,CAR包含抗体分子的一个或多个抗原结合部分,例如来源于单克隆抗体(mAb)的可变重链(VH)和可变轻链(VL)的单链抗体片段(scFv)。
在嵌合抗原受体的某些实施方案中,受体的抗原特异性部分(其可以被称为包含抗原结合区的细胞外结构域)包含肿瘤相关抗原或病原体特异性抗原结合结构域。抗原包括被模式识别受体(例如Dectin-1)识别的碳水化合物抗原。肿瘤相关抗原可以是任何种类的,只要它在肿瘤细胞的细胞表面上表达。抗原的示例性实施方案包括CD19、CD70、HLA-G、CD38、CD123、CLL1、EBNA、CD123、HER2、CA-125、TRAIL/DR4、CD20、癌胚抗原、甲胎蛋白、CD56、AKT、Her3、上皮肿瘤抗原、CD319(CS1)、ROR1、叶酸结合蛋白、HIV-1包膜糖蛋白gp120、HIV-1包膜糖蛋白gp41、CD5、CD23、CD30、HERV-K、IL-11Rα、κ链、λ链、CSPG4、CD33、CD47、CLL-1、U5snRNP200、CD200、BAFF-R、BCMA、CD99、p53、突变的p53、Ras、突变的ras、c-Myc、胞浆丝氨酸/苏氨酸激酶(例如,A-Raf、B-Raf和C-Raf,细胞周期蛋白依赖性激酶)、MAGE-A1、MAGE-A2、MAGE-A3、MAGE-A4、MAGE-A6、MAGE-A10、MAGE-A12、MART-1、黑色素瘤相关抗原、BAGE、DAM-6、-10、GAGE-1、-2、-8、GAGE-3、-4、-5、-6、-7B、NA88-A、MC1R、mda-7、gp75、Gp100、PSA、PSM、酪氨酸酶、酪氨酸酶相关蛋白、TRP-1、TRP-2、ART-4、CAMEL、CEA、Cyp-B、hTERT、hTRT、iCE、MUC1、MUC2、磷酸肌醇3-激酶(PI3K)、TRK受体、PRAME、P15、RU1、RU2、SART-1、SART-3、维尔姆斯瘤抗原(WT1)、AFP、-连环蛋白/m、半胱天冬酶-8/m、CDK-4/m、ELF2M、GnT-V、G250、HAGE、HSP70-2M、HST-2、KIAA0205、MUM-1、MUM-2、MUM-3、肌球蛋白/m、RAGE、SART-2、TRP-2/INT2、707-AP、膜联蛋白II、CDC27/m、TPI/mbcr-abl、BCR-ABL、干扰素调节因子4(IRF4)、ETV6/AML、LDLR/FUT、Pml/RAR、肿瘤相关钙信号转导子1(TACSTD1)、TACSTD2、受体酪氨酸激酶(例如表皮生长因子受体(EGFR)(特别是EGFRvIII)、血小板衍生生长因子受体(PDGFR)、血管内皮生长因子受体(VEGFR))、VEGFR2、细胞质酪氨酸激酶(例如src家族、syk-ZAP70家族)、整合素连接激酶(ILK)、信号转导子和转录激活子STAT3、STATS和STATE、缺氧诱导因子(例如HIF-1和HIF-2)、核因子-κB(NF-B),Notch受体(例如Notch1-4)、NY ESO 1、c-Met、哺乳动物雷帕霉素靶点(mTOR)、WNT、细胞外信号调节激酶(ERK)及其调节亚基、PMSA、PR-3、MDM2、间皮素、肾细胞癌-5T4、SM22-α、碳酸酐酶I(CAI)和IX(CAIX)(也称为G250)、STEAD、TEL/AML1、GD2、蛋白酶3、hTERT、肉瘤易位断裂点、EphA2、ML-IAP、EpCAM、ERG(TMPRSS2 ETS融合基因)、NA17、PAX3、ALK、雄激素受体,细胞周期蛋白B1、聚唾液酸、MYCN、RhoC、GD3、岩藻糖基GM1、mesothelian、PSCA、sLe、PLAC1、GM3、BORIS、Tn、GLoboH、NY-BR-1、RGsS、SAGE、SART3、STn、PAX5、OY-TES1、精子蛋白17、LCK、HMWMAA、AKAP-4、SSX2、XAGE 1、B7H3、legumain、TIE2、Page4、MAD-CT-1、FAP、MAD-CT-CT-2、fos相关抗原1、CBX2、CLDN6、SPANX、TPTE、ACTL8、ANKRD30A、CDKN2A、MAD2L1、CTAG1B、SUNC1和LRRN1或其组合。
在某些实施方案中,当存在少量的肿瘤相关抗原时,CAR可以与一种或多种细胞因子共表达以改善持久性。例如,CAR可以与一种或多种细胞因子例如IL-7、IL-2、IL-15、IL-12、IL-18、IL-21或其组合共表达。
编码嵌合受体的开放阅读框的序列可获自基因组DNA源、cDNA源或可被合成(例如,经由PCR)或其组合。取决于基因组DNA的大小和内含子的数目,可能期望使用cDNA或其组合,因为发现内含子使mRNA稳定。此外,使用内源或外源非编码区来稳定mRNA可能是进一步有利的。
预期可以将嵌合构建体作为裸露的DNA或在合适的载体中引入免疫细胞。使用裸露的DNA通过电穿孔稳定转染细胞的方法是本领域已知的。参见,例如,美国专利号6,410,319。裸露的DNA通常是指以用于表达的合适取向包含在质粒表达载体中的编码嵌合受体的DNA。
或者,可以使用病毒载体(例如,逆转录病毒载体,腺病毒载体,腺相关病毒载体或慢病毒载体)将嵌合构建体引入免疫细胞。根据本公开内容的方法使用的合适的载体在免疫细胞中是非复制性的。已知许多基于病毒的载体,其中维持在细胞中的病毒的拷贝数足够低以维持细胞的存活力,例如基于HIV、SV40、EBV、HSV或BPV的载体。
在一些方面,抗原特异性结合或识别组分连接至一个或多个跨膜和细胞内信号转导结构域。在一些实施方案中,CAR包括与CAR的细胞外结构域融合的跨膜结构域。在一个实施方案中,使用与CAR中的结构域之一天然缔合的跨膜结构域。在一些情况下,跨膜结构域通过氨基酸置换来选择或修饰,以避免此类结构域与相同或不同的表面膜蛋白的跨膜结构域结合,以使与受体复合物的其他成员的相互作用最小化。
在一些实施方案中,跨膜结构域来源于天然来源或来源于合成来源。如果来源是天然的,则该结构域在某些方面来源于任何膜结合蛋白或跨膜蛋白。跨膜区包括来源于以下(即至少包括其一个或多个跨膜区)的那些:T细胞受体的α、β或ζ链、CD28、CD3ζ、CD3ε、CD3γ、CD3δ、CD45、CD4、CD5、CD8、CD9、CD 16、CD22、CD33、CD37、CD64、CD80、CD86、CD 134、CD137、CD154、ICOS/CD278、GITR/CD357、NKG2D和DAP分子。可替代地,在一些实施方案中,跨膜结构域是合成的。在一些方面,合成的跨膜结构域主要包含疏水性残基,例如亮氨酸和缬氨酸。在一些方面,在合成的跨膜结构域的每个末端将发现苯丙氨酸、色氨酸和缬氨酸的三联体。
在某些实施方案中,本文公开的用于遗传修饰免疫细胞(例如,NK细胞)的平台技术包括(i)使用电穿孔装置(例如,nucleofector)的非病毒基因转移,(ii)通过内结构域(例如,CD28/CD3-ζ,CD137/CD3-ζ或其他组合)发送信号的CAR,(iii)具有可变长度的将抗原识别结构域连接到细胞表面的胞外结构域的CAR,和在某些情况下(iv)来源于K562以能够鲁棒地和数字地扩增CAR
B.T细胞受体(TCR)
在一些实施方案中,遗传工程化的抗原受体包括重组TCR和/或从天然存在的T细胞克隆的TCR。“T细胞受体”或“TCR”是指包含可变的a和β链(分别称为TCRα和TCRβ)或可变的γ和δ链(也分别称为TCRγ和TCRδ),并且能够特异性结合与MHC受体结合的抗原肽的分子。在一些实施方案中,TCR为αβ形式。
通常,以αβ和γδ形式存在的TCR通常在结构上相似,但是表达它们的T细胞可能具有不同的解剖学位置或功能。TCR可以在细胞表面上或以可溶形式存在。通常,TCR在T细胞(或T淋巴细胞)的表面上发现,通常负责识别与主要组织相容性复合物(MHC)分子结合的抗原。在一些实施方案中,TCR还可以包含恒定结构域、跨膜结构域和/或短胞质尾(参见,例如,Janeway等人,1997)。例如,在一些方面,TCR的每条链可具有一个N末端免疫球蛋白可变结构域、一个免疫球蛋白恒定结构域、跨膜区和在C末端的短胞质尾。在一些实施方案中,TCR与参与介导信号转导的CD3复合物的不变蛋白相关。除非另有说明,否则术语“TCR”应理解为涵盖其功能性TCR片段。该术语还涵盖完整的或全长的TCR,包括αβ形式或γδ形式的TCR。
因此,出于本文的目的,提及的TCR包括任何TCR或功能片段,例如与结合在MHC分子中的特定抗原肽(即MHC-肽复合物)结合的TCR的抗原结合部分。TCR的“抗原结合部分”或“抗原结合片段”(其可以互换使用)是指包含TCR的结构性结构域的一部分但与全长TCR结合的抗原(例如,MHC-肽复合物)结合的分子。在某些情况下,抗原结合部分包含TCR的可变结构域,例如TCR的可变α链和可变β链,其足以形成与特定MHC-肽复合物结合的结合位点,例如通常每条链包含三个互补决定区。
在一些实施方案中,TCR链的可变结构域缔合以形成类似于免疫球蛋白的环或互补决定区(CDR),其赋予抗原识别并确定肽特异性(通过形成TCR分子的结合位点并确定肽特异性)。通常,像免疫球蛋白一样,CDR被框架区(FR)分开(参见,例如,Jores等人,1990;Chothia等人,1988;Lefranc等人,2003)。在一些实施方案中,CDR3是负责识别经加工的抗原的主要CDR,尽管也已显示CDR1α链与抗原肽的N末端部分相互作用,而CDR1β链与肽的C末端部分相互作用。CDR2被认为识别MHC分子。在一些实施方案中,β链的可变区可以包含另外的高变(HV4)区。
在一些实施方案中,TCR链包含恒定结构域。例如,像免疫球蛋白一样,TCR链(例如,a链、β链)的细胞外部分可以包含两个免疫球蛋白结构域,分别是N末端处的可变结构域(例如,V
在一些实施方案中,TCR链可包含跨膜结构域。在一些实施方案中,跨膜结构域带正电。在一些情况下,TCR链包含细胞质尾部。在一些情况下,该结构允许TCR与其他分子(例如,CD3)缔合。例如,具有跨膜区的含有恒定结构域的TCR可以将蛋白质锚定在细胞膜中,并与CD3信号转导装置或复合物的不变亚基缔合。
通常,CD3是一种多蛋白复合物,其在哺乳动物中可以具有三条不同的链(γ、δ和ε)以及ζ链。例如,在哺乳动物中,该复合物可含有CD3γ链、CD3δ链、两条CD3ε链和CD3ζ链的同二聚体。CD3γ、CD3δ和CD3ε链是包含单个免疫球蛋白结构域的免疫球蛋白超家族的高度相关的细胞表面蛋白。CD3γ、CD3δ和CD3ε链的跨膜区带负电荷,这是允许这些链与带正电荷的T细胞受体链缔合的特征。CD3γ、CD3δ和CD3ε链的细胞内尾部各自包含单个保守的基序,称为基于酪氨酸的免疫受体活化基序或ITAM,而每个CD3ζ链具有三个。通常,ITAM涉及TCR复合体的信号转导能力。这些辅助分子具有带负电的跨膜区,并在将信号从TCR传播到细胞中发挥作用。CD3-和ζ-链与TCR一起形成所谓的T细胞受体复合物。
在一些实施方案中,TCR可以是两条链α和β(或任选地γ和δ)的异二聚体,或者它可以是单链TCR构建体。在一些实施方案中,TCR是包含两条分开的链(α和β链或γ和δ链)的异二聚体,其例如通过一个或多个二硫键连接。在一些实施方案中,鉴定针对靶抗原(例如,癌症抗原)的TCR并将其引入细胞。在一些实施方案中,编码TCR的核酸可以从多种来源获得,例如通过可公开获得的TCR DNA序列的聚合酶链反应(PCR)扩增。在一些实施方案中,TCR获自生物学来源,诸如获自细胞,诸如获自T细胞(例如细胞毒性T细胞)、T细胞杂交瘤或其他可公开获得的来源。在一些实施方案中,T细胞可以获自体内分离的细胞。在一些实施方案中,可以从患者中分离出高亲和力的T细胞克隆,并分离出TCR。在一些实施方案中,T细胞可以是培养的T细胞杂交瘤或克隆。在一些实施方案中,已经在用人免疫系统基因(例如人白细胞抗原系统或HLA)工程化的转基因小鼠中产生了针对靶抗原的TCR克隆。参见,例如,肿瘤抗原(参见,例如,Parkhurst等人,2009和Cohen等人,2005)。在一些实施方案中,噬菌体展示用于分离针对靶抗原的TCR(参见,例如,Varela-Rohena等人,2008和Li,2005)。在一些实施方案中,TCR或其抗原结合部分可以根据TCR序列的知识合成产生。
C.抗原呈递细胞
抗原呈递细胞(包括巨噬细胞、B淋巴细胞和树突状细胞)的特征在于它们表达特定的MHC分子。APC将抗原内化并将该抗原的一部分与MHC分子一起重新表达在其外细胞膜上。MHC是具有多个基因座的大型遗传复合体。MHC基因座编码两大类MHC膜分子,称为I类和II类MHC。T辅助淋巴细胞通常识别与II类MHC分子相关的抗原,而T细胞毒性淋巴细胞识别与I类MHC分子相关的抗原。在人中,MHC被称为HLA复合物,在小鼠中被称为H-2复合物。
在一些情况下,aAPC可用于制备实施方案的治疗组合物和细胞治疗产品。对于有关抗原呈递系统的制备和使用的一般指导,参见,例如,美国专利号6,225,042、6,355,479、6,362,001和6,790,662;美国专利申请公开号2009/0017000和2009/0004142;和国际公开号WO2007/103009。
aAPC系统可以包含至少一个外源性辅助分子。可以采用任何合适数量和组合的辅助分子。辅助分子可以选自诸如共刺激分子和粘附分子的辅助分子。示例性共刺激分子包括CD86、CD64(FcγRI)、41BB配体和IL-21。粘附分子可以包括碳水化合物结合糖蛋白(例如选择素),跨膜结合糖蛋白(例如整合素),钙依赖性蛋白(例如钙黏着蛋白)和单程跨膜免疫球蛋白(Ig)超家族蛋白,例如细胞间粘附分子(ICAM),其促进例如细胞间或细胞与基质间的接触。示例性的粘附分子包括LFA-3和ICAM,例如ICAM-1。可用于选择、克隆、制备和表达示例性辅助分子(包括共刺激分子和粘附分子)的技术、方法和试剂在例如美国专利号6,225,042、6,355,479和6,362,001中得到了例示。
D.抗原
由经遗传工程化的抗原受体靶向的抗原包括在待通过过继细胞疗法靶向的疾病、病况或细胞类型的背景下表达的抗原。在疾病和病况中包括增生性、赘生性和恶性疾病和病症,包括癌症和肿瘤,包括血液癌症,免疫系统癌症,例如淋巴瘤、白血病和/或骨髓瘤,例如,B、T和髓样白血病,淋巴瘤和多发性骨髓瘤。在一些实施方案中,与正常或非靶向细胞或组织相比,抗原在疾病或病况的细胞(例如,肿瘤或病原性细胞)上选择性表达或过表达。在其他实施方案中,抗原在正常细胞上表达和/或在经工程化的细胞上表达。
在本方法中可以靶向任何合适的抗原。在某些情况下,抗原可能与某些癌细胞相关,但与非癌细胞无关。示例性抗原包括但不限于来自感染原的抗原分子、自体/自身抗原、肿瘤/癌症相关抗原和肿瘤新抗原(Linnemann等人,2015)。特别地,抗原包括CD19、EBNA、CD123、HER2、CA-125、TRAIL/DR4、CD20、CD70、HLA-G、CD38、CD123、CLL1、癌胚抗原、甲胎蛋白、CD56、AKT、Her3、上皮肿瘤抗原、CD319(CS1)、ROR1、叶酸结合蛋白、HIV-1包膜糖蛋白gp120、HIV-1包膜糖蛋白gp41、CD5、CD23、CD30、HERV-K、IL-11Rα、κ链、λ链、CSPG4、CD33、CD47、CLL-1、U5snRNP200、CD200、BAFF-R、BCMA、CD99、p53、突变的p53、Ras、突变的ras、c-Myc、胞浆丝氨酸/苏氨酸激酶(例如,A-Raf、B-Raf和C-Raf,细胞周期蛋白依赖性激酶)、MAGE-A1、MAGE-A2、MAGE-A3、MAGE-A4、MAGE-A6、MAGE-A10、MAGE-A12、MART-1、黑色素瘤相关抗原、BAGE、DAM-6、-10、GAGE-1、-2、-8、GAGE-3、-4、-5、-6、-7B、NA88-A、MC1R、mda-7、gp75、Gp100、PSA、PSM、酪氨酸酶、酪氨酸酶相关蛋白、TRP-1、TRP-2、ART-4、CAMEL、CEA、Cyp-B、hTERT、hTRT、iCE、MUC1、MUC2、磷酸肌醇3-激酶(PI3K)、TRK受体、PRAME、P15、RU1、RU2、SART-1、SART-3、维尔姆斯瘤抗原(WT1)、AFP、-连环蛋白/m、半胱天冬酶-8/m、CDK-4/m、ELF2M、GnT-V、G250、HAGE、HSP70-2M、HST-2、KIAA0205、MUM-1、MUM-2、MUM-3、肌球蛋白/m、RAGE、SART-2、TRP-2/INT2、707-AP、膜联蛋白II、CDC27/m、TPI/mbcr-abl、BCR-ABL、干扰素调节因子4(IRF4)、ETV6/AML、LDLR/FUT、Pml/RAR、肿瘤相关钙信号转导子1(TACSTD1)、TACSTD2、受体酪氨酸激酶(例如表皮生长因子受体(EGFR)(特别是EGFRvIII)、血小板衍生生长因子受体(PDGFR)、血管内皮生长因子受体(VEGFR)、VEGFR2、胞浆酪氨酸激酶(例如src家族、syk-ZAP70家族)、整合素连接激酶(ILK)、信号转导子和转录激活子STAT3、STATS和STATE、缺氧诱导因子(例如HIF-1和HIF-2)、核因子-κB(NF-B),Notch受体(例如Notch1-4)、NY ESO 1、c-Met、哺乳动物雷帕霉素靶点(mTOR)、WNT、细胞外信号调节激酶(ERK)及其调节亚基、PMSA、PR-3、MDM2、间皮素、肾细胞癌-5T4、SM22-α、碳酸酐酶I(CAI)和IX(CAIX)(也称为G250)、STEAD、TEL/AML1、GD2、蛋白酶3、hTERT、肉瘤易位断裂点、EphA2、ML-IAP、EpCAM、ERG(TMPRSS2ETS融合基因)、NA17、PAX3、ALK、雄激素受体,细胞周期蛋白B1、聚唾液酸、MYCN、RhoC、GD3、岩藻糖基GM1、mesothelian、PSCA、sLe、PLAC1、GM3、BORIS、Tn、GLoboH、NY-BR-1、RGsS、SAGE、SART3、STn、PAX5、OY-TES1、精子蛋白17、LCK、HMWMAA、AKAP-4、SSX2、XAGE 1、B7H3、legumain、TIE2、Page4、MAD-CT-1、FAP、MAD-CT-2、fos相关抗原1、CBX2、CLDN6、SPANX、TPTE、ACTL8、ANKRD30A、CDKN2A、MAD2L1、CTAG1B、SUNC1和LRRN1。抗原序列的实例在本领域已知,例如,在
肿瘤相关抗原可以来源于例如前列腺癌、乳腺癌、结肠直肠癌、肺癌、胰腺癌、肾癌、间皮瘤、卵巢癌、肝癌、脑癌、骨癌、胃癌、脾脏癌、睾丸癌、宫颈癌、肛门癌、胆囊癌、甲状腺或黑素瘤癌症。示例性的肿瘤相关抗原或肿瘤细胞来源的抗原包括MAGE 1、3和MAGE 4(或其他MAGE抗原,例如国际专利公开号WO99/40188中所公开的那些);PRAME;BAGE;RAGE,Lage(也称为NY ESO 1);SAGE;和HAGE或GAGE。肿瘤抗原的这些非限制性实例在多种肿瘤类型(例如,黑素瘤、肺癌、肉瘤和膀胱癌)中表达。参见,例如,美国专利号6,544,518。与前列腺癌肿瘤相关的抗原包括例如前列腺特异性膜抗原(PSMA),前列腺特异性抗原(PSA)、前列腺酸性磷酸盐、NKX3.1和前列腺的六跨膜上皮抗原(STEAP)。
其他肿瘤相关的抗原包括Plu-1、HASH-1、HasH-2、Cripto和Criptin。另外,肿瘤抗原可以是自身肽激素,例如全长促性腺激素释放激素(GnRH),其是一种短的10个氨基酸长的肽,可用于治疗许多癌症。
抗原可以包括抗原表位区或抗原表位肽,所述抗原表位区或抗原表位肽来源于肿瘤细胞中突变的基因或来源于在肿瘤细胞中以与正常细胞相比不同的水平转录的基因,例如端粒酶,存活蛋白,间皮素,突变的ras,bcr/abl重排,Her2/neu,突变或野生型p53,细胞色素P450 1B1和异常表达的内含子序列,例如N-乙酰氨基葡萄糖氨基转移酶-V;免疫球蛋白基因的克隆重排,其在骨髓瘤和B细胞淋巴瘤中产生独特的独特型;包括来源于致癌病毒过程的表位区域或表位肽的肿瘤抗原,例如人乳头瘤病毒蛋白E6和E7;Epstein bar病毒蛋白LMP2;具有肿瘤选择性表达的非突变癌胚蛋白,例如癌胚抗原和甲胎蛋白。
在其他实施方案中,代替癌抗原(肿瘤抗原),抗原获自或来源于病原微生物或机会性病原微生物(在本文中也称为传染病微生物)例如病毒、真菌、寄生虫和细菌。在某些实施方案中,来源于此类微生物的抗原包括全长蛋白质。
其抗原预期用于本文描述的方法的示例性病原性生物包括人免疫缺陷病毒(HIV),单纯疱疹病毒(HSV),呼吸道合胞病毒(RSV),巨细胞病毒(CMV),Epstein-Barr病毒(EBV),甲型、乙型和丙型流感,水疱性口炎病毒(VSV),水疱性口腔炎病毒(VSV),多瘤病毒(例如,BK病毒和JC病毒),腺病毒,葡萄球菌属(Staphylococcus)物种,包括抗甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus,MRSA),和链球菌属(Streptococcus)物种,包括肺炎链球菌(Streptococcus pneumoniae)。如本领域技术人员将理解的,来源于这些和其他病原微生物的用作如本文所述的抗原的蛋白质可以在出版物和公共数据库(例如,
来源于人免疫缺陷病毒(HIV)的抗原包括以下任一种:HIV病毒体结构蛋白(例如,gp120、gp41、p17、p24),蛋白酶,逆转录酶或由tat、rev、nef、vif、vpr和vpu编码的HIV蛋白。
来源于单纯疱疹病毒(例如,HSV 1和HSV2)的抗原包括但不限于从HSV晚期基因表达的蛋白质。晚期基因组主要编码形成病毒体颗粒的蛋白质。这样的蛋白质包括来自形成病毒衣壳的(UL)的五种蛋白质:UL6、UL18、UL35、UL38和主要衣壳蛋白UL19、UL45和UL27,它们各自可以用作本文所述的抗原。预期在本文中用作抗原的其他示例性HSV蛋白包括ICP27(H1,H2)、糖蛋白B(gB)和糖蛋白D(gD)蛋白。HSV基因组包含至少74个基因,每个基因编码可能被用作抗原的蛋白质。
来源于巨细胞病毒(CMV)的抗原包括CMV结构蛋白,在病毒复制的即刻早期和早期阶段期间表达的病毒抗原,糖蛋白I和III,衣壳蛋白,外壳蛋白,低基质蛋白pp65(ppUL83),p52(ppUL44),IE1和1E2(UL123和UL122),来自UL128-UL150的基因簇的蛋白质产物(Rykman等人,2006),包膜糖蛋白B(gB),gH,gN和pp150。如本领域技术人员将理解的,可用作本文描述的抗原的CMV蛋白可在例如
预期用于某些实施方案中的来源于Epstein-Ban病毒(EBV)的抗原包括EBV裂解蛋白gp350和gp110,在潜伏期感染期间产生的EBV蛋白,包括Epstein-Ban核抗原(EBNA)-1,EBNA-2,EBNA-3A,EBNA-3B,EBNA-3C,EBNA-前导蛋白(EBNA-LP)和潜伏膜蛋白(LMP)-1,LMP-2A和LMP-2B(参见,例如,Lockey等人,2008)。
预期用于本文的来源于呼吸道合胞病毒(RSV)的抗原包括由RSV基因组编码的11种蛋白质中的任何一种或其抗原片段:NS 1,NS2,N(核衣壳蛋白),M(基质蛋白)SH,G和F(病毒外壳蛋白),M2(第二基质蛋白),M2-1(延伸因子),M2-2(转录调节),RNA聚合酶和磷蛋白P。
预期使用的来源于水疱性口炎病毒(VSV)的抗原包括VSV基因组编码的五种主要蛋白质中的任何一种及其抗原片段:大蛋白质(L),糖蛋白(G),核蛋白(N),磷蛋白(P)和基质蛋白(M)(参见,例如,Rieder等人,1999)。
预期在某些实施方案中使用的来源于流感病毒的抗原包括血凝素(HA),神经氨酸酶(NA),核蛋白(NP),基质蛋白M1和M2,NS1,NS2(NEP),PA,PB1,PB1-F2和PB2。
示例性病毒抗原还包括但不限于腺病毒多肽,甲病毒多肽,杯状病毒多肽(例如杯状病毒衣壳抗原),冠状病毒多肽,瘟热病毒多肽,埃博拉病毒多肽,肠病毒多肽,黄病毒多肽,肝炎病毒(AE)多肽(乙型肝炎核心或表面抗原,丙型肝炎病毒E1或E2糖蛋白、核心或非结构蛋白),疱疹病毒多肽(包括单纯疱疹病毒或水痘带状疱疹病毒糖蛋白),感染性腹膜炎病毒多肽,白血病病毒多肽,马尔堡病毒多肽,正粘病毒多肽,乳头瘤病毒多肽,副流感病毒多肽(例如血凝素和神经氨酸酶多肽),副粘病毒多肽,细小病毒多肽,瘟病毒多肽,微小核糖核酸病毒多肽(例如脊髓灰质炎病毒衣壳多肽),痘病毒多肽(例如牛痘病毒多肽),狂犬病病毒多肽(例如狂犬病病毒糖蛋白G),呼肠孤病毒多肽,逆转录病毒多肽和轮状病毒多肽。
在某些实施方案中,抗原可以是细菌抗原。在某些实施方案中,感兴趣的细菌抗原可以是分泌的多肽。在其他某些实施方案中,细菌抗原包括具有暴露于细菌的外细胞表面上的多肽的一个或多个部分的抗原。
预期使用的来源于葡萄球菌属物种(包括抗甲氧西林金黄色葡萄球菌(MRSA))的抗原包括毒力调节剂,例如,Agr系统、Sar和Sae、Arl系统、Sar同系物(Rot、MgrA、SarS、SarR、SarT、SarU、SarV、SarX、SarZ和TcaR)、Srr系统和TRAP。可以用作抗原的其他葡萄球菌蛋白包括Clp蛋白、HtrA、MsrR、乌头酸酶、CcpA、SvrA、Msa、CfvA和CfvB(参见,例如,Staphylococcus:Molecular Genetics,2008Caister Academic Press,Ed.JodiLindsay)。已经对金黄色葡萄球菌的两个种(N315和Mu50)的基因组进行了测序,并可公开获得,例如在PATRIC(PATRIC:The VBI PathoSystems Resource Integration Center,Snyder等人,2007)。如本领域技术人员将理解的,还可以在其他公共数据库(例如
预期用于本文所述的某些实施方案中的来源于肺炎链球菌的抗原包括肺炎球菌溶血素,PspA,胆碱结合蛋白A(CbpA),NanA,NanB,SpnHL,PavA,LytA,Pht和菌毛蛋白(RrgA;RrgB;RrgC)。肺炎链球菌的抗原性蛋白在本领域中也是已知的,并且在一些实施方案中可用作抗原(参见,例如,Zysk等人,2000)。已经对肺炎链球菌的强毒株的完整基因组序列进行了测序,并且如本领域技术人员将理解的,用于本文的肺炎链球菌蛋白也可以在其他公共数据库例如
可用作抗原的细菌抗原的实例包括但不限于放线菌(Actinomyces)多肽,芽孢杆菌(Bacillus)多肽,拟杆菌(Bacteroides)多肽,博德特氏菌(Bordetella)多肽,巴尔通氏体(Bartonella)多肽,疏螺旋体(Borrelia)多肽(例如伯氏疏螺旋体(B.burgdorferi)OspA),布鲁氏菌(Brucella)多肽,弯曲杆菌(Campylobacter)多肽,二氧化碳噬纤维菌(Capnocytophaga)多肽,衣原体(Chlamydia)多肽,棒状杆菌(Corynebacterium)多肽,柯克斯氏体(Coxiella)多肽,嗜皮菌(Dermatophilus)多肽,肠球菌(Enterococcus)多肽,埃利希氏体(Ehrlichia)多肽,埃希氏杆菌(Escherichia)多肽,弗朗西斯氏菌(Francisella)多肽,梭杆菌(Fusobacterium)多肽,血巴通氏体(Haemobartonella)多肽,嗜血杆菌(Haemophilus)多肽(例如b型流感嗜血杆菌外膜蛋白),螺杆菌(Helicobacter)多肽,克雷伯菌(Klebsiella)多肽,L型细菌多肽,钩端螺旋体(Leptospira)多肽,李斯特菌(Listeria)多肽,分枝杆菌(Mycobacteria)多肽,支原体(Mycoplasma)多肽,奈瑟菌(Neisseria)多肽,新立克次体(Neorickettsia)多肽,诺卡氏菌(Nocardia)多肽,巴斯德氏菌(Pasteurella)多肽,消化球菌(Peptococcus)多肽,消化链球菌(Peptostreptococcus)多肽,肺炎球菌(Pneumococcus)多肽(即肺炎链球菌(S.pneumoniae)多肽),变形杆菌(Proteus)多肽,假单胞菌(Pseudomonas)多肽,立克次体(Rickettsia)多肽,罗沙利马体(Rochalimaea)多肽,沙门氏菌(Salmonella)多肽,志贺氏菌(Shigella)多肽,葡萄球菌多肽,A组链球菌多肽(例如化脓链球菌(S.pyogenes)M蛋白),B组链球菌(无乳链球菌(S.agalactiae))多肽,密螺旋体(Treponema)多肽和耶尔森氏菌(Yersinia)多肽(例如,鼠疫耶尔森氏菌(Y pestis)F1和V抗原)。
真菌抗原的实例包括但不限于:犁头霉属(Absidia)多肽,支顶孢属(Acremonium)多肽,链格孢属(Alternaria)多肽,曲霉属(Aspergillus)多肽,蛙粪霉属(Basidiobolus)多肽,双极霉属(Bipolaris)多肽,芽生菌属(Blastomyces)多肽,念珠菌属(Candida)多肽,球孢子菌属(Coccidioides)多肽,耳霉属(Conidiobolus)多肽,隐球菌属(Cryptococcus)多肽,弯孢属(Curvalaria)多肽,表皮癣菌属(Epidermophyton)多肽,外瓶霉属(Exophiala)多肽,地丝菌属(Geotrichum)多肽,组织胞浆菌属(Histoplasma)多肽,马杜拉分枝菌属(Madurella)多肽,马拉色菌属(Malassezia)多肽,小孢霉属(Microsporum)多肽,小丛梗孢属(Moniliella)多肽,被孢霉属(Mortierella)多肽,毛霉属(Mucor)多肽,拟青霉属(Paecilomyces)多肽,青霉菌属(Penicillium)多肽,单胞瓶霉属(Phialemonium)多肽,瓶霉属(Phialophora)多肽,原壁菌属(Prototheca)多肽,Pseudallescheria多肽,假小托菌属(Pseudomicrodochium)多肽,腐霉属(Pythium)多肽,鼻孢子虫属(Rhinosporidium)多肽,根霉菌属(Rhizopus)多肽,线状担子菌属(Scolecobasidium)多肽,孢子丝菌属(Sporothrix)多肽,匍柄霉属(Stemphylium)多肽,发癣菌属(Trichophyton)多肽,毛孢子菌属(Trichosporon)多肽和木丝霉属(Xylohypha)多肽。
原生动物寄生虫抗原的实例包括但不限于巴贝西虫(Babesia)多肽,肠袋虫(Balantidium)多肽,贝诺孢子虫(Besnoitia)多肽,隐孢子虫(Cryptosporidium)多肽,艾美球虫(Eimeria)多肽,脑胞内原虫(Encephalitozoon)多肽,内变形虫(Entamoeba)多肽,贾第鞭毛虫(Giardia)多肽,哈蒙德虫(Hammondia)多肽,肝簇虫(Hepatozoon)多肽,等孢子球虫(Isospora)多肽,利什曼虫(Leishmania)多肽,微孢子虫(Microsporidia)多肽,新孢子虫(Neospora)多肽,小孢子虫(Nosema)多肽,五毛滴虫(Pentatrichomonas)多肽,疟原虫(Plasmodium)多肽。蠕虫寄生虫抗原的实例包括但不限于棘唇线虫(Acanthocheilonema)多肽,猫圆线虫(Aelurostrongylus)多肽,钩虫(Ancylostoma)多肽,管圆线虫(Angiostrongylus)多肽,蛔虫(Ascaris)多肽,布鲁格丝虫(Brugia)多肽,仰口线虫(Bunostomum)多肽,毛细线虫(Capillaria)多肽,夏伯特虫(Chabertia)多肽,古柏线虫(Cooperia)多肽,环体线虫(Crenosoma)多肽,网尾线虫(Dictyocaulus)多肽,膨结线虫(Dioctophyme)多肽,双瓣线虫(Dipetalonema)多肽,裂头绦虫(Diphyllobothrium)多肽,Diplydium多肽,恶丝虫(Dirofilaria)多肽,龙线虫(Dracunculus)多肽,蛲虫(Enterobius)多肽,类丝虫(Filaroides)多肽,血矛线虫(Haemonchus)多肽,兔唇蛔虫(Lagochilascaris)多肽,Loa多肽,曼森线虫(Mansonella)多肽,缪勒线虫(Muellerius)多肽,侏体吸虫(Nanophyetus)多肽,板口线虫(Necator)多肽,细颈线虫(Nematodirus)多肽,结节线虫(Oesophagostomum)多肽,盘尾丝虫(Onchocerca)多肽,后睾吸虫(Opisthorchis)多肽,奥斯特线虫(Ostertagia)多肽,副丝虫(Parafilaria)多肽,并殖吸虫(Paragonimus)多肽,副蛔虫(Parascaris)多肽,泡翼线虫(Physaloptera)多肽,原圆线虫(Protostrongylus)多肽,腹腔丝虫(Setaria)多肽,尾旋线虫(Spirocerca)多肽,迭宫绦虫(Spirometra)多肽,冠丝虫(Stephanofilaria)多肽,粪类圆线虫(Strongyloides)多肽,圆线虫(Strongylus)多肽,吸吮线虫(Thelazia)多肽,弓蛔线虫(Toxascaris)多肽,弓蛔虫(Toxocara)多肽,旋毛虫(Trichinella)多肽,毛圆线虫(Trichostrongylus)多肽,鞭虫(Trichuris)多肽,钩虫(Uncinaria)多肽和吴策线虫(Wuchereria)多肽。(例如恶性疟原虫(P.falciparum)环子孢子(PfCSP))、子孢子表面蛋白2(PfSSP2)、肝状态抗原1的羧基末端(PfLSA1 c-term)和输出蛋白1(PfExp-1),肺囊虫(Pneumocystis)多肽,肉孢子虫(Sarcocystis)多肽,血吸虫(Schistosoma)多肽,泰勒虫(Theileria)多肽,弓形虫(Toxoplasma)多肽和锥虫(Trypanosoma)多肽。
体外寄生虫抗原的实例包括但不限于来自以下的多肽(包括抗原以及过敏原):跳蚤;蜱,包括硬蜱和软蜱;蝇类,例如蠓,蚊子,沙蝇,黑蝇,马蝇,角蝇,鹿蝇,采采蝇,厩螫蝇,引起蝇蛆病的蝇类和叮咬蚊;蚂蚁;蜘蛛,虱子;螨;和蝽象(true bug),例如床虱和猎蝽。
E.自杀基因
在一些情况下,对本公开内容的任何细胞进行修饰以产生除异源细胞因子、工程化受体等之外的一种或多种试剂。在特定实施方案中,对细胞例如NK细胞进行工程化以携带一种或多种自杀基因,并且如本文所用的术语“自杀基因”定义为在施用前药后实现基因产物向杀死其宿主细胞的化合物的过渡的基因。在一些情况下,当接受NK细胞治疗和/或已经接受NK细胞治疗的个体显示出一种或多种不良事件的一种或多种症状(例如细胞因子释放综合征、神经毒性、过敏反应/变态反应和/或中靶/脱靶肿瘤毒性(例如)或被认为处于具有所述一种或多种症状的风险,包括紧急地)时,NK细胞疗法可以经受任何类型的一种或多种自杀基因的使用。自杀基因的使用可能是治疗计划方案的一部分,或可能仅在认为需要使用其时使用。在某些情况下,由于不再需要治疗,因此通过使用靶向自杀基因或其基因产物的试剂终止细胞治疗。
自杀基因的实例包括工程化的不可分泌的(包括膜结合的)肿瘤坏死因子(TNF)-α突变多肽(见PCT/US19/62009,其通过引用整体并入本文),并且它们可以通过递送结合TNF-α突变体的抗体来靶向。可以使用的自杀基因/前药组合的实例是单纯疱疹病毒胸苷激酶(HSV-tk)和更昔洛韦、阿昔洛韦或FIAU;氧化还原酶和放线菌酮;胞嘧啶脱氨酶和5-氟胞嘧啶;胸苷激酶胸苷酸激酶(thymidine kinase thymidilate kinase)(Tdk::Tmk)和AZT;和脱氧胞苷激酶和胞嘧啶阿拉伯糖苷。可以使用大肠杆菌嘌呤核苷磷酸化酶,一种所谓的自杀基因,其将前药6-甲基嘌呤脱氧核糖核苷转化为毒性的嘌呤6-甲基嘌呤。另外的自杀基因包括例如CD20、CD52、诱导型半胱天冬酶9、嘌呤核苷磷酸化酶(PNP)、细胞色素p450酶(CYP)、羧肽酶(CP)、羧酸酯酶(CE)、硝基还原酶(NTR)、鸟嘌呤核糖基转移酶(XGRTP)、糖苷酶、蛋氨酸-α、γ-裂解酶(MET)和胸苷磷酸化酶(TP)。
F.递送方法
在特定实施方案中,任何组合物可通过任何合适的方法递送至受体NK细胞。组合物可例如通过电穿孔或载体递送至NK细胞。在特定实施方案中,例如,将用于引入至少一种或多种异源抗原受体的一种或多种组合物递送至载体中的NK细胞。在一些实施方案中,将一种或多种用于基因编辑的组合物递送至载体中的NK细胞。本领域技术人员将被充分装备以通过标准重组技术(参见,例如,Sambrook等人,2001和Ausubel等人,1996,均通过引用并入本文)来构建用于本公开内容的抗原受体的表达的载体。载体包括但不限于质粒、粘粒、病毒(噬菌体、动物病毒和植物病毒)和人工染色体(例如YAC),例如逆转录病毒载体(例如来源于莫洛尼氏鼠白血病病毒载体(MoMLV)、MSCV、SFFV、MPSV、SNV等),慢病毒载体(例如,来源于HIV-1、HIV-2、SIV、BIV、FIV等),腺病毒(Ad)载体,包括其具有复制能力、复制缺陷和无病毒基因的形式,腺病毒相关病毒(AAV)载体,猿猴病毒40(SV-40)载体,牛乳头瘤病毒载体,Epstein-Barr病毒载体,疱疹病毒载体,牛痘病毒载体,Harvey鼠肉瘤病毒载体,鼠乳腺肿瘤病毒载体,劳斯氏肉瘤病毒载体,细小病毒载体,脊髓灰质炎病毒载体,水疱性口炎病毒载体,马拉巴病毒载体和B组腺病毒enadenotucirev载体。
在特定实施方案中,载体是多顺反子载体,例如PCT/US19/62014中所述,其通过引用整体并入本文。在这种情况下,单个载体可以编码CAR或TCR(并且表达构建体可以以模块化格式配置以允许互换CAR或TCR的部分)、自杀基因和一种或多种细胞因子。
1.病毒载体
在本公开内容的某些方面可以提供编码抗原受体的病毒载体。在产生重组病毒载体中,通常将非必需基因替换为异源(或非天然)蛋白的基因或编码序列。病毒载体是一种类型的表达构建体,它利用病毒序列将核酸和可能地蛋白质引入细胞。某些病毒通过受体介导的内吞作用感染细胞或进入细胞并整合进宿主细胞基因组并稳定有效地表达病毒基因的能力使其成为将外来核酸转移到细胞(例如,哺乳动物细胞)中的诱人候选物。下文描述了可用于递送本发明某些方面的核酸的病毒载体的非限制性实例。
慢病毒是复杂的逆转录病毒,其除了常见的逆转录病毒基因gag、pol和env之外,还包含具有调节或结构功能的其他基因。慢病毒载体是本领域众所周知的(参见,例如,美国专利6,013,516和5,994,136)。
重组慢病毒载体能够感染非分裂细胞,并且可以用于体内和离体基因转移和核酸序列的表达。例如,在美国专利5,994,136(通过引用并入本文)中描述了能够感染非分裂细胞的重组慢病毒,其中合适的宿主细胞被两种或更多种携带包装功能(即gag、pol和env以及rev和tat)的载体转染。
a.调控元件
包括在用于本公开内容的载体中的表达盒特别地包含(沿5'至3'方向)可操作地连接至蛋白质编码序列的真核转录启动子、包括间插序列的剪接信号和转录终止/聚腺苷酸化序列。控制真核细胞中蛋白质编码基因的转录的启动子和增强子由多种遗传元件组成。细胞机构能够收集和整合每个元件传达的调控信息,从而允许不同的基因进化出独特的、通常是复杂的转录调控模式。在本公开内容的上下文中使用的启动子包括组成型、诱导型和组织特异性启动子。
b.启动子/增强子
本文提供的表达构建体包含驱动抗原受体表达的启动子。启动子通常包含用于定位RNA合成的起始位点的序列。最熟知的实例是TATA盒,但在一些缺少TATA盒的启动子中,诸如,例如,哺乳动物末端脱氧核苷酸转移酶基因的启动子和SV40晚期基因的启动子,覆盖起始位点的离散元件本身帮助固定起始位置。另外的启动子元件调节转录起始的频率。通常,这些位于起始位点上游30110bp的区域,尽管已显示许多启动子在起始位点下游也含有功能元件。为了使编码序列“处于启动子的控制之下”,将转录阅读框的转录起始位点的5′末端定位在所选择的启动子的“下游”(即3′)。“上游”的启动子刺激DNA的转录并促进编码的RNA的表达。
启动子元件之间的间隔通常是柔性的,使得当元件相对于彼此反转或移动时,启动子功能得以保留。在tk启动子中,启动子元件之间的间隔可以在活性开始下降之前增加到50bp。取决于启动子,似乎个体元件可以合作地或独立地起作用以激活转录。启动子可以或可以不与“增强子”结合使用,“增强子”是指与核酸序列的转录激活有关的顺式作用调节序列。
启动子可以是与核酸序列天然缔合的启动子,如可以通过分离位于编码片段和/或外显子上游的5′非编码序列而获得。这样的启动子可以称为“内源的”。类似地,增强子可以是与核酸序列天然缔合的增强子,位于该序列的下游或上游。可替代地,通过将编码核酸片段置于重组或异源启动子的控制下将获得某些优势,所述重组或异源启动子是指在其天然环境中通常不与核酸序列缔合的启动子。重组或异源增强子也指在其天然环境中通常不与核酸序列缔合的增强子。此类启动子或增强子可以包括其他基因的启动子或增强子,以及从任何其他病毒、原核或真核细胞中分离的启动子或增强子,以及不是“天然存在”的启动子或增强子,即包含不同转录调控区的不同元件,和/或改变表达的突变。例如,最常用于重组DNA构建的启动子包括β-内酰胺酶(青霉素酶)、乳糖和色氨酸(trp-)启动子系统。除了合成地产生启动子和增强子的核酸序列以外,还可以结合本文公开的组合物使用重组克隆和/或核酸扩增技术(包括PCR
自然地,重要的是使用有效地指导DNA片段在选择用于表达的细胞器、细胞类型、组织、器官或生物体中的表达的启动子和/或增强子。分子生物学领域的技术人员通常知道用于蛋白质表达的启动子、增强子和细胞类型组合的使用(参见,例如Sambrook等人,1989,通过引用并入本文)。所使用的启动子可以是组成型的、组织特异性的、可诱导的和/或在适当的条件下可用于指导引入的DNA片段的高水平表达,例如在重组蛋白和/或肽的大规模生产中是有利的。启动子可以是异源的或内源的。
另外,任何启动子/增强子组合(例如,根据真核启动子数据库EPDB,通过网址epd.isb-sib.ch/访问)也可以用于驱动表达。T3、T7或SP6细胞质表达系统的使用是另一个可能的实施方案。如果提供适当的细菌聚合酶(无论是作为递送复合物的一部分还是作为额外的基因表达构建体),则真核细胞可以支持某些细菌启动子的胞质转录。
启动子的非限制性实例包括早期或晚期病毒启动子,例如SV40早期或晚期启动子,巨细胞病毒(CMV)立即早期启动子,劳斯氏肉瘤病毒(RSV)早期启动子;真核细胞启动子,例如β肌动蛋白启动子,GADPH启动子,金属硫蛋白启动子;以及串联反应元件启动子,例如环AMP反应元件启动子(cre)、血清反应元件启动子(sre)、佛波酯启动子(TPA)和反应元件启动子(tre)(最小TATA盒附近)。也可以使用人生长激素启动子序列(例如,Genbank登录号X05244,核苷酸283-341中描述的人生长激素最小启动子)或小鼠乳腺肿瘤启动子(可得自ATCC登录号ATCC 45007)。在某些实施方案中,启动子是CMV IE、dectin-1、dectin-2、人CD11c、F4/80、SM22、RSV、SV40、Ad MLP、β-肌动蛋白、I类MHC或II类MHC启动子,但是可用于驱动治疗性基因的表达的其他任何启动子适用于本公开内容的实践。
在某些方面,本公开内容的方法还涉及增强子序列,即,增加启动子的活性并具有顺式作用也起作用)潜力的核酸序列(无论其取向,即使在相对长的距离(多至距离靶启动子数千碱基)。然而,增强子功能不一定限于这样长的距离,因为它们也可以在非常接近给定启动子的情况下起作用。
c.起始信号和连锁表达
特异性起始信号也可以用于本公开内容中提供的表达构建体中以有效翻译编码序列。这些信号包括ATG起始密码子或相邻序列。可能需要提供外源翻译控制信号,包括ATG起始密码子。本领域普通技术人员将能够容易地确定这一点并提供必要的信号。众所周知,起始密码子必须与所需编码序列的阅读框“在读框内”,以确保整个插入片段的翻译。外源翻译控制信号和起始密码子可以是天然的或合成的。通过包含适当的转录增强子元件可以提高表达效率。
在某些实施方案中,内部核糖体进入位点(IRES)元件的使用被用于产生多基因或多顺反子信息。IRES元件能够绕过5′甲基化的帽依赖性翻译的核糖体扫描模型,并在内部位点开始翻译。已经描述了来自微小核糖核酸病毒家族的两个成员(脊髓灰质炎和脑心肌炎)的IRES元件,以及来自哺乳动物信息的IRES。IRES元件可以链接到异源开放阅读框。可以将多个开放阅读框一起转录,各自通过IRES隔开,从而产生多顺反子信息。借助于IRES元件,核糖体可接近每个开放阅读框以进行有效翻译。可以使用单个启动子/增强子来转录单个信息来有效表达多个基因。
另外,某些2A序列元件可用于在本公开内容提供的构建体中产生基因的连锁表达或共表达。例如,通过连接开放阅读框以形成单个顺反子,切割序列可用于共表达基因。示例性的切割序列是F2A(口蹄疫病毒2A)或“2A样”序列(例如,Thosea asigna病毒2A;T2A)。
d.复制的起点
为了使载体在宿主细胞中增殖,它可以包含一个或多个复制起始位点(通常称为“ori”),例如,对应于如上文所述的EBV的oriP或在编程中具有相似或增强的功能的遗传工程化的oriP(其是复制起始处的特定核酸序列)的核酸序列。可替代地,可以使用如上文所述的其他染色体外复制病毒的复制起点或自主复制序列(ARS)。
e.选择和可筛选的标志物
在一些实施方案中,可以通过在表达载体中包含标志物来在体外或体内鉴定含有本公开内容的构建体的细胞。这样的标志物将赋予细胞可识别的改变,从而允许容易地鉴定含有表达载体的细胞。通常,选择标志物是赋予允许进行选择的属性的标志物。阳性选择标志物是其中标志物的存在允许其选择的标志物,而阴性选择标志物是其中其存在阻止其选择的标志物。阳性选择标志物的一个实例是抗药性标志物。
通常药物选择标志物的包括有助于克隆和鉴定转化体,例如,赋予对新霉素、嘌呤霉素、潮霉素、DHFR、GPT、博来霉素(zeocin)和组氨醇的抗性的基因是有用的选择标志物。除了赋予允许基于条件的实施来区分转化体的表型的标志物之外,还考虑了其他类型的标志物,包括可筛选的标志物,例如GFP,其基础是比色分析。可替代地,可以使用可筛选的酶作为阴性选择标志物,例如单纯疱疹病毒胸苷激酶(tk)或氯霉素乙酰转移酶(CAT)。本领域技术人员还将知道如何使用免疫学标志物,可能结合FACS分析使用。所使用的标志物据信是不重要的,只要其能够与编码基因产物的核酸同时表达。选择性和可筛选的标志物的其他实例是本领域技术人员众所周知的。
2.核酸递送的其他方法
除了编码抗原受体的核酸的病毒递送外,以下是将重组基因递送至给定宿主细胞的其他方法,并因此在本公开内容中考虑。
如本文所述或如本领域普通技术人员所知,将核酸(例如,DNA或RNA)引入本公开内容的免疫细胞可使用任何合适的用于核酸递送以用于转化细胞的方法。此类方法包括但不限于直接递送DNA,例如通过离体转染,通过注射(包括显微注射);通过电穿孔;通过磷酸钙沉淀;通过使用DEAE-葡聚糖然后使用聚乙二醇;通过直接声波加载;通过脂质体介导的转染和受体介导的转染;通过微粒轰击;通过用碳化硅纤维搅拌;由农杆菌介导的转化;通过干燥/抑制介导的DNA摄取,以及这些方法的任何组合。通过应用诸如此类的技术,可以稳定地或瞬时地转化细胞器、细胞、组织或生物体。
V.基因编辑和CRISPR
本公开内容的NK细胞生产工艺可以包括NK细胞的基因编辑以去除NK细胞中的1、2、3、4、5、6、7、8、9、10或更多种内源性基因。在某些情况下,基因编辑发生在表达一种或多种异源抗原受体的NK细胞中,而在其他情况下,基因编辑发生在不表达异源抗原受体但最终将表达一种或多种异源抗原受体的NK细胞中,至少在一些情况下。在特定实施方案中,基因编辑的NK细胞是扩增的NK细胞。
在特定情况下,NK细胞的一种或多种内源性基因被修饰,例如表达被破坏,其中表达被部分或全部减少。在特定情况下,使用本公开内容的工艺敲低或敲除一种或多种基因。在特定情况下,多个基因在与本公开内容的工艺相同的步骤中被敲低或敲除。在NK细胞中编辑的基因可以是任何种类的,但在特定实施方案中,基因是其基因产物抑制NK细胞的活性和/或增殖的基因。在特定情况下,NK细胞中被编辑的基因允许NK细胞在肿瘤微环境中更有效地工作。在特定情况下,基因是以下的一种或多种:NKG2A、SIGLEC-7、LAG3、TIM3、CISH、FOXO1、TGFBR2、TIGIT、CD96、ADORA2、NR3C1、PD1、PDL-1、PDL-2、CD47、SIRPA、SHIP1、ADAM17、RPS6、4EBP1、CD25、CD40、IL21R、ICAM1、CD95、CD80、CD86、IL10R、TDAG8、CD5、CD7、SLAMF7、CD38、LAG3、TCR、β2-微球蛋白、HLA、CD73和CD39。在特定实施方案中,在NK细胞中敲除或敲低TGFBR2基因。
在一些实施方案中,使用一种或多种DNA结合核酸进行基因编辑,例如通过RNA指导的内切核酸酶(RGEN)进行改变。例如,可以使用规律间隔成簇短回文重复序列(CRISPR)和CRISPR相关的(Cas)蛋白进行改变。通常,“CRISPR系统”总体地指CRISPR相关(“Cas”)基因的表达或指导CRISPR相关(“Cas”)基因的活性有关的转录物和其他元件,包括编码Cas基因的序列、tracr(反式激活CRISPR)序列(例如,tracrRNA或活性部分tracrRNA)、tracr配对序列(在内源CRISPR系统的背景下包含“直接重复序列”和tracrRNA处理的部分直接重复序列)、指导序列(在内源CRISPR系统的背景下也称为“间隔子”)和/或来自CRISPR基因座的其他序列和转录物。
CRISPR/Cas核酸酶或CRISPR/Cas核酸酶系统可包括非编码RNA分子(指导)RNA(其序列特异性结合DNA)和具有核酸酶功能(例如,两个核酸酶结构域)的Cas蛋白(例如,Cas9)。CRISPR系统的一个或多个元件可以来源于I型、II型或III型CRISPR系统,例如来源于包含内源性CRISPR系统的特定生物,例如化脓链球菌。
在一些方面,将Cas核酸酶和gRNA(包括对靶序列特异的crRNA和固定的tracrRNA的融合体)引入细胞中。通常,使用互补碱基配对,在gRNA的5'末端的靶位点将Cas核酸酶靶向至靶位点,例如基因。靶位点可以基于其紧邻前间区序列邻近基序(PAM)序列的5'的位置(例如,通常为NGG或NAG)进行选择。在这方面,通过修饰指导RNA的前20、19、18、17、16、15、14、14、12、11或10个核苷酸以对应于靶DNA序列来将gRNA靶向至所需序列。通常,CRISPR系统的特征在于促进靶序列位点处的CRISPR复合物形成的元件。通常,“靶序列”通常是指指导序列被设计成与其具有互补性的序列,其中靶序列和指导序列之间的杂交促进CRISPR复合物的形成。如果存在足够的互补性以引起杂交并促进CRISPR复合物的形成,则不一定需要完全互补。
CRISPR系统可以在靶位点诱导双链断裂(DSB),随后引起如本文所讨论的破坏或改变。在其他实施方案中,被认为是“切口酶”的Cas9变体用于在靶位点处对单链切口。可以使用成对的切口酶,例如以改善特异性,其各自由不同gRNA靶向序列对指导,使得在同时引入切口时,引入5'突出端。在其他实施方案中,将无催化活性的Cas9融合至异源效应子结构域,例如转录阻遏物或激活子,以影响基因表达。
靶序列可以包含任何多核苷酸,例如DNA或RNA多核苷酸。靶序列可以位于细胞的核或细胞质中,例如在细胞的细胞器内。通常,可用于重组为包含靶序列的靶基因座的序列或模板称为“编辑模板”或“编辑多核苷酸”或“编辑序列”。在一些方面,外源模板多核苷酸可以被称为编辑模板。在一些方面,重组是同源重组。
通常,在内源性CRISPR系统的情况下,CRISPR复合物(包含与靶序列杂交并与一种或多种Cas蛋白复合的指导序列)的形成导致在靶序列中或其附近(例如,在距靶序列的1、2、3、4、5、6、7、8、9、10、20、50个或更多个碱基对内)的一条或两条链的切割。tracr序列(其可以包含野生型tracr序列的全部或一部分或由其全部或一部分组成(例如,野生型tracr序列的约或大于约20、26、32、45、48、54、63、67、85个或更多个核苷酸)也可以形成CRISPR复合物的一部分,例如通过沿着tracr序列的至少一部分与可操作地连接至指导序列的tracr配对序列的全部或一部分杂交。tracr序列与tracr配对序列具有足够的互补性,以杂交并参与CRISPR复合物的形成,例如当最佳匹配时沿tracr配对序列的长度至少50%、60%、70%、80%、90%、95%或99%的序列互补性。
可以将驱动CRISPR系统的一种或多种元件的表达的一种或多种载体引入细胞,使得CRISPR系统的元件的表达指导在一个或多个靶位点形成CRISPR复合物。组分也可以作为蛋白质和/或RNA递送到细胞。例如,Cas酶、连接至tracr-配对序列的指导序列和tracr序列可各自可操作地连接至单独载体上的单独调控元件。可替代地,可以将从相同或不同调控元件表达的两个或更多个元件组合在单个载体中,而一个或多个附加载体提供不包含在第一载体中的CRISPR系统的任何组分。载体可以包含一个或多个插入位点,例如限制性内切核酸酶识别序列(也称为“克隆位点”)。在一些实施方案中,一个或多个插入位点位于一个或多个载体的一个或多个序列元件的上游和/或下游。当使用多个不同的指导序列时,单个表达构建体可以用于将CRISPR活性靶向至细胞内的多个不同的相应靶序列。
载体可以包含与编码CRISPR酶(例如Cas蛋白)的酶编码序列可操作地连接的调节元件。Cas蛋白的非限制性实例包括Cas1、Cas1B、Cas2、Cas3、Cas4、Cas5、Cas6、Cas7、Cas8、Cas9(也称为Csn1和Csx12)、Cas10、Csy1、Csy2、Csy3、Cse1、Cse2、Csc1、Csc2、Csa5、Csn2、Csm2、Csm3、Csm4、Csm5、Csm6、Cmr1、Cmr3、Cmr4、Cmr5、Cmr6、Csb1、Csb2、Csb3、Csx17、Csx14、Csx10、Csx16、CsaX、Csx3、Csx1、Csx15、Csfl、Csf2、Csf3、Csf4、其同源物或其修饰形式。这些酶是已知的;例如,化脓链球菌Cas9蛋白的氨基酸序列可以在SwissProt数据库中以登录号Q99ZW2找到。
CRISPR酶可以是Cas9(例如来自化脓链球菌或肺炎链球菌)。CRISPR酶可以指导一条或两条链的在靶序列位置处的切割,例如在靶序列内和/或在靶序列的互补序列内。载体可以编码相对于相应的野生型酶被突变的CRISPR酶,使得突变的CRISPR酶缺乏切割含有靶序列的靶多核苷酸的一条或两条链的能力。例如,来自化脓链球菌的Cas9的RuvC I催化结构域中的天冬氨酸至丙氨酸置换(D10A)将Cas9从切割两条链的核酸酶转化成切口酶(切割单链)。在一些实施方案中,Cas9切口酶可以与一个或多个指导序列(例如两个指导序列(其分别靶向DNA靶标的有义链和反义链))组合使用。这种组合允许两条链都被切口并用于诱导NHEJ或HDR。
在一些实施方案中,对编码CRISPR酶的酶编码序列进行密码子优化以在特定细胞(例如真核细胞)中表达。真核细胞可以是特定生物(例如哺乳动物,包括但不限于人,小鼠,大鼠,兔,狗或非人灵长类)的真核细胞或来源于该特定生物的真核细胞。一般而言,密码子优化是指通过用在宿主细胞的基因中更频繁或最频繁使用的密码子替换天然序列的至少一个密码子同时保持天然氨基酸序列来修饰核酸序列以在感兴趣的宿主细胞中增强表达的过程。各种物种对特定氨基酸的某些密码子表现出特定的偏倚。密码子偏倚(生物之间密码子使用的差异)通常与信使RNA(mRNA)的翻译效率相关,其进而被认为取决于(除其他以外)翻译的密码子的性质和特定转移RNA(tRNA)分子的可用性。所选tRNA在细胞中的优势通常反映了肽合成中最常使用的密码子。因此,可以基于密码子优化针对在给定生物中的最佳基因表达定制基因。
一般而言,指导序列是与靶多核苷酸序列具有足够互补性以与靶序列杂交并指导CRISPR复合物与靶序列的序列特异性结合的任何多核苷酸序列。在一些实施方案中,当使用合适的比对算法进行最佳比对时,指导序列与其相应的靶序列之间的互补程度为约或大于约50%、60%、75%、80%、85%、90%、95%、97%、99%或更高。
可以使用任何合适的用于比对序列的算法来确定最佳比对,算法的非限制性示例包括Smith-Waterman算法,Needleman-Wunsch算法,基于Burrows-Wheeler变换的算法(例如Burrows Wheeler Aligner),Clustal W,Clustal X,BLAT,Novoalign(NovocraftTechnologies,ELAND(Illumina,San Diego,Calif.),SOAP(可在soap.genomics.org.cn上获得)和Maq(可在maq.sourceforge.net上获得)。
CRISPR酶可以是包含一个或多个异源蛋白质结构域的融合蛋白的一部分。CRISPR酶融合蛋白可包含任何其他蛋白序列,以及任选地任何两个结构域之间的接头序列。可以与CRISPR酶融合的蛋白质结构域的实例包括但不限于表位标签,报告基因序列和具有以下一种或多种活性的蛋白结构域:甲基化酶活性,脱甲基酶活性,转录激活活性,转录抑制活性,转录释放因子活性,组蛋白修饰活性,RNA切割活性和核酸结合活性。表位标签的非限制性实例包括组氨酸(His)标签,V5标签,FLAG标签,流感血凝素(HA)标签,Myc标签,VSV-G标签和硫氧还蛋白(Trx)标签。报告基因的实例包括但不限于谷胱甘肽-5-转移酶(GST),辣根过氧化物酶(HRP),氯霉素乙酰转移酶(CAT),β半乳糖苷酶,β-葡萄糖醛酸苷酶,荧光素酶,绿色荧光蛋白(GFP),HcRed,DsRed,青色荧光蛋白(CFP),黄色荧光蛋白(YFP)和自发荧光蛋白包括蓝色荧光蛋白(BFP)。CRISPR酶可以与编码结合DNA分子或结合其他细胞分子的蛋白质或蛋白质片段的基因序列融合,包括但不限于麦芽糖结合蛋白(MBP),S-标签,Lex A DNA结合结构域(DBD)融合体,GAL4A DNA结合结构域融合体和单纯疱疹病毒(HSV)BP16蛋白融合体。可以形成包含CRISPR酶的融合蛋白的一部分的其他结构域在US 20110059502中描述,其通过引用并入本文。
VI.治疗方法
在一些实施方案中,由本公开内容的方法产生的NK细胞用于治疗有需要的个体的方法。作为实例,本公开内容的实施方案包括治疗个体的癌症、任何类型的感染和/或任何免疫病症的方法。个体可以使用本公开内容的治疗方法作为初始治疗或在(和/或与)另一种治疗之后使用本公开内容的治疗方法。在癌症实施方案中,免疫治疗方法可基于癌症的类型和/或分期针对患有癌症的个体的需要进行定制,并且在至少一些情况下,免疫治疗可在针对个体的治疗过程中进行修改。
在特定情况下,治疗方法的实例如下:1)用产生的NK细胞(离体扩增的或表达CAR或TCR)进行过继细胞治疗,以治疗患有任何类型恶性血液病的癌症患者,(2)用产生的NK细胞(离体扩增的或表达CAR或TCR)进行过继细胞治疗,以治疗患有任何类型实体瘤的癌症患者,(3)用产生的NK细胞(体外扩增的或表达CAR或TCR)进行过继性细胞治疗,以治疗患有感染性疾病和/或免疫性疾病的患者。
在一些实施方案中,本公开内容提供了用于免疫治疗的方法,所述方法包括施用由本公开内容的方法产生的有效量的NK细胞。在一个实施方案中,医学疾病或病症通过由本文所述的方法产生并且至少在特定情况下引起免疫应答的一种或多种NK细胞群转移来治疗。在本公开内容的某些实施方案中,癌症或感染通过递送由本公开内容方法产生并引起免疫应答的一种或多种NK细胞群来治疗。本文提供了用于治疗或延缓个体中的癌症进展的方法,包括向个体施用有效量的抗原特异性细胞疗法。本发明的方法可以用于治疗免疫病症、实体癌、血液癌症和/或病毒感染。
本发明的治疗方法可用于的肿瘤包括任何恶性肿瘤细胞类型,例如在实体瘤或血液肿瘤中发现的那些。示例性实体瘤可包括但不限于选自胰腺、结肠、盲肠、胃、脑、头、颈、卵巢、肾、喉、肉瘤、肺、膀胱、黑素瘤、前列腺和乳房的器官的肿瘤。示例性血液肿瘤包括骨髓、T或B细胞恶性肿瘤、白血病、淋巴瘤、母细胞瘤、骨髓瘤等的肿瘤。可以使用本文提供的方法治疗的癌症的其他实例包括但不限于肺癌(包括小细胞肺癌、非小细胞肺癌、肺腺癌和肺鳞状癌)、腹膜癌、胃部(gastric)癌或胃(stomach)癌(包括胃肠癌和胃肠道间质癌)、胰腺癌、子宫颈癌、卵巢癌、肝癌、膀胱癌、乳腺癌、结肠癌、结肠直肠癌、子宫内膜或子宫癌、唾液腺癌、肾脏(kidney)或肾(renal)癌、前列腺癌、外阴癌、甲状腺癌、各种类型的头颈癌、和黑素瘤。
癌症可以具体地是以下组织学类型,尽管不限于这些:赘生物,恶性;癌;癌,未分化;巨细胞和梭形细胞癌;小细胞癌;乳头状癌;鳞状细胞癌;淋巴上皮癌;基底细胞癌;毛基质癌;移行细胞癌;乳头状移行细胞癌;腺癌;胃泌素瘤,恶性;胆管癌;肝细胞癌;合并的肝细胞癌和胆管癌;小梁腺癌;腺样囊性癌;腺瘤息肉中的腺癌;腺癌,家族性结肠息肉病;实体癌;类癌瘤,恶性;支气管肺泡腺癌;乳头状腺癌;嫌色细胞癌;嗜酸癌;嗜氧腺癌;嗜碱性细胞癌;透明细胞腺癌;颗粒细胞癌;滤泡腺癌;乳头状和滤泡状腺癌;非包膜硬化性癌;肾上腺皮质癌;子宫内膜样癌;皮肤附属器癌;大汗腺腺癌;皮脂腺癌;盯聍腺腺癌;粘液表皮样癌;囊腺癌;乳头状囊腺癌;乳头状浆液性囊腺癌;粘液性囊腺癌;粘液腺癌;印戒细胞癌;浸润性导管癌;髓样癌;小叶癌;炎性癌;佩吉特氏病,乳腺;腺泡细胞癌;腺鳞癌;腺癌伴鳞状上皮化生;胸腺瘤,恶性;卵巢间质瘤,恶性;卵泡膜细胞瘤,恶性;颗粒细胞瘤,恶性;男性细胞瘤,恶性;sertoli细胞癌;leydig细胞肿瘤,恶性;脂质细胞瘤,恶性;副神经节瘤,恶性;乳腺外副神经节瘤,恶性;嗜铬细胞瘤;血管球肉瘤;恶性黑素瘤;无黑素性黑素瘤;浅表扩散性黑素瘤;恶性雀斑黑素瘤;肢端雀斑黑素瘤;结节性黑素瘤;巨大色素痣中的恶性黑素瘤;上皮样细胞黑素瘤;蓝色痣,恶性;肉瘤;纤维肉瘤;纤维组织细胞瘤,恶性;粘液肉瘤;脂肪肉瘤;平滑肌肉瘤;横纹肌肉瘤;胚胎横纹肌肉瘤;肺泡横纹肌肉瘤;基质肉瘤;混合性肿瘤,恶性;苗勒管混合瘤;肾母细胞瘤;肝母细胞瘤癌;癌肉瘤;间质瘤,恶性;布伦纳瘤,恶性;叶状肿瘤,恶性;滑膜肉瘤;间皮瘤,恶性;无性细胞瘤;胚胎癌;畸胎瘤,恶性;卵巢甲状腺肿样瘤,恶性;绒毛膜癌;中肾瘤,恶性;血管肉瘤;血管内皮瘤,恶性;卡波西氏肉瘤;血管外皮细胞瘤,恶性;淋巴管肉瘤;骨肉瘤;皮质旁骨肉瘤;软骨肉瘤;软骨母细胞瘤,恶性;间质软骨肉瘤;骨巨细胞瘤;尤因氏肉瘤;牙源性肿瘤,恶性;成釉细胞牙肉瘤;成釉细胞瘤,恶性;成釉细胞牙肉瘤;松果体瘤,恶性;脊索瘤;神经胶质瘤,恶性;室管膜瘤;星形细胞瘤;原生质星形细胞瘤;纤维性星形细胞瘤;星形母细胞瘤;胶质母细胞瘤;少突胶质细胞瘤;成少突胶质细胞瘤;原始神经外胚层;小脑肉瘤;神经节神经母细胞瘤;成神经细胞瘤;视网膜母细胞瘤;嗅觉神经源性肿瘤;脑膜瘤,恶性;神经纤维肉瘤;神经鞘瘤,恶性;颗粒细胞瘤,恶性;恶性淋巴瘤;霍奇金氏病;霍奇金氏;副肉芽肿;恶性淋巴瘤,小淋巴细胞;恶性淋巴瘤,大细胞,弥漫性;恶性淋巴瘤,滤泡;蕈样真菌病;其他指定的非霍奇金淋巴瘤;B细胞淋巴瘤;低等级/滤泡性非霍奇金淋巴瘤(NHL);小淋巴细胞(SL)NHL;中等级/滤泡性NHL;中等级弥散性NHL;高等级免疫原性NHL;高等级淋巴母细胞NHL;高等级小非裂解细胞NHL;巨大疾病(bulky disease)NHL;套细胞淋巴瘤;AIDS相关淋巴瘤;Waldenstrom巨球蛋白血症;恶性组织细胞增生症;多发性骨髓瘤;肥大细胞肉瘤;免疫增生性小肠疾病;白血病;淋巴性白血病;浆细胞白血病;红白血病;淋巴肉瘤细胞白血病;髓细胞性白血病;嗜碱性粒细胞白血病;嗜酸性粒细胞白血病;单核细胞白血病;肥大细胞白血病;成巨核细胞白血病;髓样肉瘤;毛细胞白血病;慢性淋巴细胞性白血病(CLL);急性淋巴细胞性白血病(ALL);急性髓细胞性白血病(AML);和慢性髓细胞性白血病。
特定的实施方案涉及治疗血液恶性肿瘤(例如淋巴瘤或白血病)的方法。白血病是血液或骨髓的癌症,其特征在于血细胞(通常是白血细胞(白细胞))的异常增殖(通过繁殖产生)。它是被称为血液肿瘤的广泛疾病组的一部分。白血病是涵盖一系列疾病的广义术语。白血病在临床和病理上分为急性和慢性形式。
在本公开内容的某些实施方案中,将免疫细胞递送至需要其的个体,例如患有癌症或感染的个体。然后,这些细胞增强个体的免疫系统,以攻击相应的癌症或致病细胞。在一些情况下,向个体提供一个或多个剂量的免疫细胞。在为个体提供两个或更多个剂量的免疫细胞的情况下,施用之间的持续时间应足以允许在个体中繁殖的时间,并且在特定的实施方案中,剂量之间的持续时间为1、2、3、4、5、6、7或更多天,或1、2、3或4或更多周,或1、2、3、4、5、6、7、8、9、10、11、12或更多个月。
本公开内容的某些实施方案提供了用于治疗或预防免疫介导的病症的方法。在一个实施方案中,受试者患有自身免疫性疾病。自身免疫性疾病的非限制性实例包括:斑秃、强直性脊柱炎、抗磷脂综合症、自身免疫性艾迪生氏病、肾上腺自身免疫性疾病、自身免疫性溶血性贫血、自身免疫性肝炎、自身免疫性卵巢炎和睾丸炎、自身免疫性血小板减少症、白塞氏病、大疱性类天疱疮、心肌病、乳糜泻性皮炎(celiac spate-dermatitis)、慢性疲劳免疫功能障碍综合症(CFIDS)、慢性炎症性脱髓鞘性多神经病、Churg-Strauss综合征、瘢痕性类天疱疮、CREST综合征、冷凝集素病、克罗恩病、盘状狼疮、特发性混合冷凝球蛋白血症、纤维肌痛-纤维肌炎;肾小球肾炎、格雷夫斯病、Guillain-Barre、桥本氏甲状腺炎、特发性肺纤维化、特发性血小板减少性紫癜(ITP)、IgA神经病、幼年型关节炎、扁平苔藓、红斑狼疮、Meniere病、混合性结缔组织病、多发性硬化、1型或免疫介导的糖尿病、重症肌无力、肾病综合征(例如轻微变化疾病、局灶性肾小球硬化或膜性肾病)、寻常型天疱疮、恶性贫血、结节性多动脉炎、多软骨炎、多腺体综合征、风湿性多肌痛、多肌炎和皮肌炎、原发性无丙种球蛋白血症、原发性胆汁性肝硬化、牛皮癣、牛皮癣关节炎、雷诺现象、雷特综合征、类风湿性关节炎、结节病、硬皮病、干燥综合征、僵硬综合征、系统性红斑狼疮、红斑狼疮、溃疡性结肠炎、葡萄膜炎、脉管炎(例如结节性多动脉炎、大动脉炎、颞动脉炎/巨细胞性动脉炎或疱疹样皮炎性血管炎)、白癜风和韦格纳肉芽肿病。因此,可以使用本文公开的方法治疗的自身免疫疾病的一些实例包括但不限于多发性硬化症、类风湿性关节炎、系统性红斑狼疮、I型糖尿病、克罗恩病;溃疡性结肠炎、重症肌无力、肾小球肾炎、强直性脊柱炎、血管炎或牛皮癣。受试者还可以患有过敏性病症,例如哮喘。
在另一个实施方案中,受试者是移植的器官或干细胞的接受者,并且免疫细胞用于预防和/或治疗排斥。在特定的实施方案中,受试者患有移植物抗宿主病或处于发展移植物抗宿主病的风险。GVHD是使用或包含来自相关或不相关供体的干细胞的任何移植物的可能并发症。有两种GVHD,急性的和慢性的。急性GVHD出现在移植后的前三个月内。急性GVHD的体征包括手和脚上出现红色的皮疹,该皮疹可能扩散并变得更严重,具有皮肤剥落或起泡。急性GVHD也可影响胃和肠,在这种情况下会出现痉挛、恶心和腹泻。皮肤和眼睛的发黄(黄疸)指示急性GVHD已经影响了肝脏。慢性GVHD根据其严重程度进行分级:阶段/等级1是轻度的;阶段/等级4是严重的。慢性GVHD在移植后三个月或之后发展。慢性GVHD的症状与急性GVHD的症状相似,但此外,慢性GVHD可能还会影响眼睛的粘液腺、口腔的唾液腺以及润滑胃粘膜和肠道的腺体。可以利用本文公开的任何免疫细胞群体。移植的器官的实例包括实体器官移植物,例如肾脏、肝脏、皮肤、胰腺、肺和/或心脏,或细胞移植物,例如胰岛、肝细胞、成肌细胞、骨髓或造血或其他干细胞。移植物可以是复合移植物,例如面部组织。免疫细胞可以在移植之前、移植同时或移植后施用。在一些实施方案中,免疫细胞在移植前施用,例如在移植前至少1小时、至少12小时、至少1天、至少2天、至少3天、至少4天、至少5天、至少6天、至少1周、至少2周、至少3周、至少4周或至少1个月施用。在一个具体的非限制性实例中,治疗有效量的免疫细胞的施用在移植前3-5天进行。
在一些实施方案中,可以在免疫细胞治疗之前向受试者施用非清髓性淋巴细胞清除性化学疗法。非清髓性淋巴细胞清除性化学疗法可以是任何合适的此类疗法,其可以通过任何合适的途径施用。非清髓性淋巴细胞清除性化学疗法可包括,例如,施用环磷酰胺和氟达拉滨(fludarabine),特别是如果癌症是可转移的黑素瘤时。施用环磷酰胺和氟达拉滨的示例性途径是静脉内。此外,可以施用任何合适剂量的环磷酰胺和氟达拉滨。在特定方面,施用约60mg/kg的环磷酰胺持续两天,此后施用约25mg/m
在某些实施方案中,将促进NK细胞生长和活化的一种或多种生长因子与NK细胞同时或在NK细胞后施用给受试者。生长因子可以是促进NK细胞生长和活化的任何合适的生长因子。合适的免疫细胞生长因子的实例包括白介素(IL)-2、IL-7、IL-12、IL-15、IL-18和IL-21,它们可以单独使用或以多种组合使用,例如IL-2和IL-7,IL-2和IL-15,IL-7和IL-15,IL-2、IL-7和IL-15,IL-12和IL-7,IL-12和IL-15或IL-12和IL2。
治疗有效量的产生的NK细胞可以通过多种途径施用,包括肠胃外施用,例如静脉内、腹腔内、肌内、胸骨内、瘤内、鞘内、脑室内、通过储液器、关节内注射或输注。
用于过继细胞疗法的产生的NK细胞的治疗有效量是在被治疗的受试者中达到期望效果的量。例如,这可以是抑制自身免疫或同种免疫疾病的进展或引起自身免疫或同种免疫疾病的消退所必需的或能够缓解由自身免疫疾病引起的症状(例如疼痛和炎症)的NK细胞的量。它可能是缓解与炎症相关的症状(例如疼痛、水肿和体温升高)所必需的量。它也可以是减少或防止移植器官排斥所必需的量。
可以以与疾病一致的治疗方案来施用产生的NK细胞群,例如在一到几天内的单次或几次剂量以改善疾病状态,或在延长的时间内的定期剂量以抑制疾病进展并预防疾病复发。制剂中要使用的精确剂量还取决于施用途径以及疾病或病症的严重性,并且应根据从业者的判断和每个患者的情况来决定。NK细胞的治疗有效量将取决于所治疗的受试者、患病的严重程度和类型以及施用方式。在一些实施方案中,可用于治疗人受试者的剂量为至少3.8×10
可以将NK细胞与一种或多种其他治疗剂组合施用以用于治疗免疫介导的病症。组合疗法可包括但不限于可以施用一种或多种抗微生物剂(例如抗生素,抗病毒剂和抗真菌剂),抗肿瘤剂(例如氟尿嘧啶,甲氨蝶呤(methotrexate),紫杉醇,氟达拉滨(fludarabine),依托泊苷(etoposide),阿霉素或长春新碱),免疫消耗剂(例如氟达拉滨,依托泊苷,阿霉素或长春新碱),免疫抑制剂(例如硫唑嘌呤(azathioprine)或糖皮质激素,例如地塞米松(dexamethasone)或泼尼松(prednisone),抗炎剂(例如糖皮质激素,例如氢化可的松(hydrocortisone)、地塞米松或泼尼松,或非类固醇抗炎剂例如乙酰水杨酸、布洛芬(ibuprofen)或萘普生钠(naproxen sodium),细胞因子(例如白介素-10或转化生长因子-β),激素(例如雌激素)或疫苗。另外,可以施用免疫抑制剂或致耐受剂,包括但不限于钙调磷酸酶抑制剂(例如环孢菌素(cyclosporin)和他克莫司(tacrolimus));mTOR抑制剂(例如雷帕霉素);麦考酚酸莫酯(mycophenolate mofetil),抗体(例如识别CD3、CD4、CD40、CD154、CD45、IVIG或B细胞);化疗剂(例如甲氨蝶呤,苏消安(Treosulfan),白消安(Busulfan);辐照;或趋化因子,白介素或其抑制剂(例如BAFF,IL-2,抗IL-2R,IL-4,JAK激酶抑制剂)。取决于所需的效果,可以在施用免疫细胞之前、期间或之后施用此类另外的药剂。细胞和试剂的这种施用可以通过相同的途径或通过不同的途径,并且可以在相同的部位或在不同的部位。
A.药物组合物
本文还提供了包含由本文所包含的方法产生的NK细胞和药学上可接受的载体的药物组合物和制剂。
本文所述的药物组合物和制剂可通过将具有所需纯度的活性成分(例如抗体或多肽)与一种或多种任选的药学上可接受的载体(Remington's Pharmaceutical Sciences第22版,2012)混合来以冻干制剂或水性溶液形式制备。药学上可接受的载体在所采用的剂量和浓度下通常对受体无毒,并且包括但不限于:缓冲剂,例如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(例如十八烷基二甲基苄基氯化铵;氯化六甲双铵;苯扎氯铵;苄索氯铵;苯酚、丁醇或苄醇;对羟基苯甲酸烷基酯,例如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;邻苯二酚;间苯二酚;环己醇;3-戊醇和间甲酚);低分子量(少于约10个残基)多肽;蛋白质,例如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,例如聚乙烯吡咯烷酮;氨基酸,例如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖,二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,例如EDTA;糖,例如蔗糖、甘露醇、海藻糖或山梨糖醇;成盐抗衡离子,例如钠;金属配合物(例如Zn-蛋白配合物);和/或非离子表面活性剂,例如聚乙二醇(PEG)。本文的示例性药学上可接受的载体还包括间质药物分散剂,例如可溶性中性活性透明质酸酶糖蛋白(sHASEGP),例如人可溶性PH-20透明质酸酶糖蛋白,例如rHuPH20(
B.组合疗法
在某些实施方案中,本实施方案的组合物和方法涉及与至少一种另外的疗法组合的NK细胞群。对于癌症实施方案,另外的疗法可以是放射疗法、手术(例如,肿块切除术和乳房切除术),化学疗法、基因疗法、DNA疗法、病毒疗法、RNA疗法、免疫疗法、骨髓移植、纳米疗法、单克隆抗体疗法或前述的组合。另外的疗法可以是辅助疗法或新辅助疗法的形式。对于致病性情况,另外的治疗可以包括一种或多种抗生素、抗病毒药物等。
在一些癌症实施方案中,另外的疗法是小分子酶抑制剂或抗转移剂的施用。在一些实施方案中,另外的疗法是副作用限制剂(例如,旨在减少治疗的副作用的发生和/或严重性的药剂,例如抗恶心剂等)的施用。在一些实施方案中,另外的疗法是放射疗法。在一些实施方案中,另外的疗法是手术。在一些实施方案中,另外的疗法是放射疗法和手术的组合。在一些实施方案中,另外的疗法是伽马辐照。在一些实施方案中,另外的疗法是靶向PBK/AKT/mTOR途径疗法、HSP90抑制剂、微管蛋白抑制剂、细胞凋亡抑制剂和/或化学预防剂。另外的疗法可以是本领域已知的一种或多种化学治疗剂。
可以相对于另外的癌症疗法(例如免疫检查点疗法)在之前、期间、之后或以各种组合施用本公开内容的NK细胞疗法。施用间隔可以从同时至数分钟至数天至数周。在其中免疫细胞疗法与另外的治疗剂分开地提供给患者的实施方案中,通常将确保在每次递送的时间之间没有显著的时间段到期,使得两种化合物将仍然能够发挥对患者有利的联合作用。在这样的情况下,预期可以在彼此约12至24或72小时内,更具体地在彼此约6-12小时内为患者提供抗体疗法和抗癌疗法。在某些情况下,可能期望将治疗时间显著延长,其中在各自施用之间经过几天(2、3、4、5、6或7)至几周(1、2、3、4、5、6、7或8)。
可以采用各种组合。对于下面的实例,免疫细胞疗法为“A”,和抗癌疗法为“B”:
A/B/A B/A/B B/B/A A/A/B A/B/B B/A/A A/B/B/B B/A/B/B
B/B/B/A B/B/A/B A/A/B/B A/B/A/B A/B/B/A B/B/A/A
B/A/B/A B/A/A/B A/A/A/B B/A/A/A A/B/A/A A/A/B/A
考虑到试剂的毒性(如果有的话),本实施方案的任何化合物或疗法向患者的施用将遵循用于施用此类化合物的一般方案。因此,在一些实施方案中,存在监测归因于组合疗法的毒性的步骤。
1.化学疗法
根据本发明的实施方案,可以使用多种化学治疗剂。术语“化学疗法”是指使用药物来治疗癌症。“化学治疗剂”用于表示在癌症的治疗中施用的化合物或组合物。这些药剂或药物根据它们在细胞内的活动方式(例如,它们是否影响细胞周期以及在什么阶段影响细胞周期)进行分类。可替代地,药剂可以基于其直接交联DNA、插入DNA或通过影响核酸合成来诱导染色体和有丝分裂畸变的能力来进行表征。
化疗剂的实例包括烷基化剂,例如噻替派(thiotepa)和环磷酰胺;烷基磺酸盐,诸如白消安、英丙舒凡(improsulfan)和哌泊舒凡(piposulfan);氮丙啶,例如苯并多巴(benzodopa)、卡波醌(carboquone)、米特多巴(meturedopa)和尤利多巴(uredopa);乙烯亚胺和甲基氨基吖啶(methylamelamines),包括六甲蜜胺(altretamine)、三亚乙基三聚氰胺(triethylenemelamine)、三亚乙基磷酰胺(trietylenephosphoramide)、三亚乙基硫代磷酰胺(triethiylenethiophosphoramide)和三甲基三聚氰胺(trimethylolomelamine);多聚乙酰(acetogenins)(特别是布拉他辛(bullatacin)和布拉他辛酮(bullatacinone));喜树碱(包括合成类似物拓朴替康(topotecan));苔藓抑素;callystatin;CC-1065(包括其阿多来新(adozelesin)、卡折来新(carzelesin)和比折来新(bizelesin)合成类似物);念珠藻素(cryptophycin)(特别是念珠藻素1和念珠藻素8);海兔毒素(dolastatin);多卡霉素(duocarmycin)(包括合成类似物KW-2189和CB1-TM1);eleutherobin;水鬼蕉碱(pancratistatin);sarcodictyin;海绵抑素(spongistatin);氮芥,例如苯丁酸氮芥、萘氮芥(chlornaphazine)、氯磷酰胺(cholophosphamide)、雌氮芥(estramustine)、异环磷酰胺(ifosfamide)、甲氮芥(mechlorethamine)、盐酸甲氧氮芥(mechlorethamineoxidehydrochloride)、美法仑(melphalan)、新恩比兴(novembichin)、苯芥胆甾醇(phenesterine)、泼尼氮芥(prednimustine)、曲磷胺(trofosfamide)、和尿嘧啶氮芥;亚硝基尿素,诸如卡莫司汀(carmustine)、氯脲霉素(chlorozotocin)、福莫司汀(fotemustine)、洛莫司汀(lomustine)、尼莫司汀(nimustine)和雷莫司汀(ranimnustine);抗生素,诸如烯二炔抗生素(例如,卡奇霉素(calicheamicin),特别是卡奇霉素γII和卡奇霉素ωII);达米辛(dynemicin),包括达米辛A;双膦酸盐,诸如氯膦酸盐;埃斯培拉霉素(esperamicin);以及新制癌菌素生色团和相关的色蛋白烯二炔类抗生素生色团、aclacinomysin、放线菌素(actinomycin)、安曲霉素(authrarnycin)、重氮丝氨酸、博来霉素(bleomycins)、放线菌素(cactinomycin)、卡拉比辛(carabicin)、洋红霉素(carminomycin)、嗜癌菌素(carzinophilin)、色霉素(chromomycinis)、放线菌素(dactinomycin)、道诺霉素(daunorubicin)、地托比星(detorubicin)、6-重氮-5-氧-L-正亮氨酸、多柔比星(doxorubicin)(包括吗啉基-多柔比星、氰基吗啉基-多柔比星、2-吡咯啉基-多柔比星、和deoxydoxorubicin)、表柔比星(epirubicin)、伊达比星(esorubicin)、去甲氧正定霉素(idarubicin)、麻西罗霉素(marcellomycin)、丝裂霉素例如丝裂霉素C、霉酚酸、诺加霉素(nogalarnycin)、橄榄霉素(olivomycins)、培洛霉素(peplomycin)、紫菜霉素(potfiromycin)、嘌呤霉素、三铁阿霉素(quelamycin)、罗多比星(rodorubicin)、链黑菌素(streptonigrin)、链唑霉素(streptozocin)、杀结核菌素(tubercidin)、乌苯美司(ubenimex)、净司他丁(zinostatin)和佐柔比星(zorubicin);抗代谢物例如甲氨蝶呤和5-氟尿嘧啶(5-FU);叶酸类似物例如二甲叶酸、蝶罗呤(pteropterin),和三甲曲沙(trimetrexate);嘌呤类似物例如氟达拉滨(fludarabine)、6-巯嘌呤、硫咪嘌呤和硫鸟嘌呤;嘧啶类似物例如环胞苷、阿扎胞苷、6-氮尿苷、卡莫氟(carmofur)、阿糖胞苷、二脱氧尿苷、去氧氟尿苷、依诺他滨(enocitabine)和氟尿苷;雄激素,例如卡普睾酮(calusterone)、丙酸甲雄烷酮(dromostanolone propionate)、表硫雄醇(epitiostanol)、美雄烷(mepitiostane)和睾内脂(testolactone);抗肾上腺,例如米托坦(mitotane)和曲洛司坦(trilostane);叶酸补充剂例如亚叶酸;醋葡醛内酯(aceglatone);醛磷酰胺糖苷(aldophosphamide glycoside);氨基乙酰丙酸;恩尿嘧啶(eniluracil);安吖啶(amsacrine);bestrabucil;比山群(bisantrene);依达曲沙(edatraxate);得弗伐胺(defofamine);地美可辛(demecolcine);地吖醌(diaziquone);elfornithine;依利醋铵;埃博霉素(epothilone);依托格鲁(etoglucid);硝酸镓;羟基脲;磨茹多糖(lentinan);氯尼达明(lonidainine);美登醇(maytansinoids),例如美登素(maytansine)和安丝菌素(ansamitocins);米托胍腙(mitoguazone);米托蒽醌(mitoxantrone);mopidanmol;nitraerine;喷司他丁(pentostatin);蛋氨氮芥(phenamet);吡柔比星(pirarubicin);洛索蒽醌(losoxantrone);鬼臼酸(podophyllinic acid);2-乙基肼类;甲基苄肼;PSK多糖复合物;丙亚胺(razoxane);根霉素(rhizoxin);西佐喃(sizofiran);螺旋锗(spirogermanium);细格孢氮杂酸(tenuazonic acid);三亚胺醌;2,2',2”-三氯三乙胺;单端孢霉烯族毒素类(特别是T-2毒素、黏液霉素A、杆孢菌素A和anguidine);乌拉坦(urethan);长春地辛(vindesine);氮烯唑胺(dacarbazine);甘露莫司汀(mannomustine);二溴甘露醇;二溴卫矛醇;哌血生(pipobroman);gacytosine;阿糖胞苷(″Ara-C″);环磷酰胺;紫杉烷,例如紫杉醇和多西他赛吉西他滨;6-硫鸟嘌呤;巯嘌呤;铂配位复合物例如顺铂、奥沙利铂和卡铂;长春碱;铂;依托泊苷(VP-16);异环磷酰胺;米托蒽醌;长春新碱;长春瑞滨;能灭瘤(novantrone);鬼臼噻吩甙(teniposide);依达曲沙(edatrexate);柔红霉素;氨基蝶呤;希罗达(xeloda);伊班膦酸盐;伊利替康(irinotecan)(例如CPT-11);拓扑异构酶抑制剂RFS 2000;二氟甲基鸟氨酸(DMFO);类视黄醇,例如视黄酸;卡培他滨(capecitabine);卡铂、甲基苄肼(procarbazine)、plicomycin、吉西他滨、那韦尔滨(navelbine)、法呢基蛋白转移酶抑制剂、跨铂(transplatinum)和上述任何一种的药学上可接受的盐、酸或衍生物。
2.放射疗法
引起DNA损伤并已被广泛使用的其他因素包括通常已知的γ射线、X射线和/或放射性同位素向肿瘤细胞的定向递送。也可以考虑其他形式的DNA损伤因素,例如微波、质子束辐照和UV辐照。最有可能的是所有这些因素影响对DNA、DNA的前体、DNA的复制和修复以及染色体的装配和维持的广泛损害。X射线的剂量范围从长时间(3-4周)的50至200伦琴的每日剂量到2000至6000伦琴的单剂量。放射性同位素的剂量范围广泛变化,并且取决于同位素的半衰期、所发射的辐照的强度和类型以及肿瘤细胞的吸收。
3.免疫疗法
本领域技术人员将理解,其他免疫疗法可以与实施方案的方法组合或结合使用。在癌症治疗的背景下,免疫疗法通常依靠使用免疫效应细胞和分子来靶向和破坏癌细胞。利妥昔单抗
抗体-药物缀合物(ADC)包含与杀细胞药物共价连接并且可用于组合疗法的单克隆抗体(MAb)。这种方法将MAb针对其抗原靶标的高特异性与高效的细胞毒性药物结合在一起,从而产生了“经武装的”MAb,其可将有效载荷(药物)递送至具有丰富抗原水平的肿瘤细胞。药物的靶向递送还将其在正常组织中的暴露降至最低,从而降低了毒性并改善了治疗指数。示例性ADC药物包括
在免疫疗法的一方面,肿瘤细胞必须带有一些易于靶向的标志物物,即其在大多数其他细胞上不存在。存在许多肿瘤标志物,并且在本发明的实施方案的背景下,这些肿瘤标志物中的任何一种都可能适于靶向。常见的肿瘤标志物包括CD20、癌胚抗原、酪氨酸酶(p97)、gp68、TAG-72、HMFG、唾液酸化的路易斯抗原、MucA、MucB、PLAP、层粘连蛋白受体、erbB和p155。免疫疗法的可选择的方面是将抗癌作用与免疫刺激作用相结合。还存在免疫刺激分子,包括:细胞因子,例如IL-2、IL-4、IL-12、GM-CSF、γ-IFN、趋化因子、例如MIP-1、MCP-1、IL-8和生长因子,例如FLT3配体。
免疫疗法的实例包括免疫佐剂,例如牛分枝杆菌、恶性疟原虫、二硝基氯苯和芳香族化合物;细胞因子疗法,例如干扰素α、β和γ、IL-1、GM-CSF和TNF;基因疗法,例如TNF、IL-1、IL-2和p53;和单克隆抗体,例如抗CD20、抗神经节苷脂GM2和抗p185。预期可以将一种或多种抗癌疗法与本文所述的抗体疗法一起使用。
在一些实施方案中,免疫疗法可以是免疫检查点抑制剂。免疫检查点调高信号(例如共刺激分子)或调低信号。可被免疫检查点阻滞靶向的抑制性免疫检查点包括腺苷A2A受体(A2AR)、B7-H3(也称为CD276)、B和T淋巴细胞弱化剂(BTLA)、细胞毒性T淋巴细胞相关蛋白4(CTLA-4,也称为CD152)、吲哚胺2,3-双加氧酶(IDO)、杀伤细胞免疫球蛋白(KIR)、淋巴细胞激活基因3(LAG3)、程序性死亡1(PD-1)、T细胞免疫球蛋白结构域和粘蛋白结构域3(TIM-3)和T细胞激活的V-结构域Ig抑制剂(VISTA)。特别地,免疫检查点抑制剂靶向PD-1轴和/或CTLA-4。
免疫检查点抑制剂可以是药物,例如小分子、配体或受体的重组形式,或者特别是抗体,例如人抗体。可以使用免疫检查点蛋白的已知抑制剂或其类似物,特别是可以使用抗体的嵌合、人源化或人形式。如技术人员将知道的,替代和/或等效名称可以用于本公开内容中提及的某些抗体。在本公开内容的上下文中,这样的替代和/或等效名称是可互换的。例如,已知lambrolizumab也已知为替代和等效名称MK-3475和派姆单抗(pembrolizumab)。
在一些实施方案中,PD-1结合拮抗剂是抑制PD-1与其配体结合伴侣结合的分子。在一个具体方面,PD-1配体结合伴侣是PDL1和/或PDL2。在另一个实施方案中,PDL1结合拮抗剂是抑制PDL1与其结合伴侣结合的分子。在特定方面,PDL1结合伴侣是PD-1和/或B7-1。在另一个实施方案中,PDL2结合拮抗剂是抑制PDL2与其结合伴侣结合的分子。在一个具体方面,PDL2结合伴侣是PD-1。拮抗剂可以是抗体,其抗原结合片段,免疫粘附素,融合蛋白或寡肽。
在一些实施方案中,PD-1结合拮抗剂是抗PD-1抗体(例如,人抗体、人源化抗体或嵌合抗体)。在一些实施方案中,抗PD-1抗体选自纳武单抗、派姆单抗和CT-011。在一些实施方案中,PD-1结合拮抗剂是免疫粘附素(例如,包含与恒定区(例如,免疫球蛋白序列的Fc区)融合的PDL1或PDL2的细胞外或PD-1结合部分的免疫粘附素)。在一些实施方案中,PD-1结合拮抗剂是AMP-224。纳武单抗(也称为MDX-1106-04,MDX-1106,ONO-4538,BMS-936558和
可以在本文提供的方法中靶向的另一个免疫检查点是细胞毒性T淋巴细胞相关蛋白4(CTLA-4),也称为CD152。人CTLA-4的完整cDNA序列的Genbank登录号为L15006。CTLA-4发现于T细胞的表面,并当与抗原呈递细胞表面上的CD80或CD86结合时,充当“关闭”开关。CTLA4是免疫球蛋白超家族的成员,其在辅助T细胞的表面表达并向T细胞传递抑制信号。CTLA4与T细胞共刺激蛋白CD28相似,并且两种分子均与抗原呈递细胞上的CD80和CD86(分别也称为B7-1和B7-2)结合。CTLA4将抑制信号传递给T细胞,而CD28传递刺激信号。细胞内CTLA4也存在于调节性T细胞中,并且可能对它们的功能很重要。通过T细胞受体和CD28的T细胞活化导致CTLA-4(B7分子的抑制受体)的表达增加。
在一些实施方案中,免疫检查点抑制剂是抗CTLA-4抗体(例如,人抗体、人源化抗体或嵌合抗体)、其抗原结合片段、免疫粘附素、融合蛋白或寡肽。
适用于本发明方法的抗人-CTLA-4抗体(或来源于其的VH和/或VL结构域)可以使用本领域众所周知的方法产生。或者,可以使用本领域公认的抗CTLA-4抗体。示例性的抗CTLA-4抗体是伊匹单抗(也称为10D1,MDX-010,MDX-101和
4.手术
大约60%的癌症患者将接受某种类型的手术,包括预防性、诊断或分期性、治愈性和姑息手术。治愈性手术包括切除(其中全部或部分癌组织被物理移除、切除和/或破坏),并且可以与其他疗法(例如本实施方案的治疗、化学疗法、放射疗法、激素疗法、基因疗法、免疫疗法和/或替代疗法)结合使用。肿瘤切除术是指肿瘤的至少一部分的切除。除肿瘤切除术外,手术治疗还包括激光手术、冷冻手术、电外科手术和显微控制手术(莫氏手术)。
在切除部分或全部癌细胞、组织或肿瘤后,可在体内形成空腔。可以通过使用其他抗癌疗法对该区域进行灌注、直接注射或局部应用来完成治疗。例如,可以每1、2、3、4、5、6或7天,或者每1、2、3、4和5周或每1、2、3、4、5、6、7、8、9、10、11或12个月重复这种治疗。这些治疗也可以具有不同的剂量。
5.其他药剂
预期可以将其他药剂与本实施方案的某些方面组合使用以改善治疗的疗效。这些另外的药剂包括影响细胞表面受体的上调和GAP连接的药剂、细胞生长抑制剂和分化剂、细胞粘附抑制剂、增加过度增殖细胞对凋亡诱导剂的敏感性的药剂或其他生物药剂。通过增加GAP连接数增加细胞间信号转导将增加对邻近的过度增殖细胞群的抗过度增殖作用。在其他实施方案中,细胞生长抑制剂或分化剂可以与本实施方案的某些方面结合使用以改善治疗的抗过度增殖功效。预期细胞粘附的抑制剂可改善本发明实施方案的功效。细胞粘附抑制剂的实例是粘着斑激酶(FAK)抑制剂和洛伐他汀。进一步考虑了可以将增加过度增殖细胞对凋亡的敏感性的其他试剂(例如抗体c225)与发明本实施方案的某些方面组合使用以改善治疗功效。
VII.制品或试剂盒
提供了一种制品或试剂盒,其包含NK细胞和/或用于产生NK细胞的一种或多种试剂。NK细胞可以来自任何来源,并且在特定实施方案中,NK细胞已经通过本文所包含的方法产生。在特定实施方案中,NK细胞已经被基因编辑并且可以提供在试剂盒中,使得它们可以被进一步修饰以表达一种或多种异源抗原受体。在特定实施方案中,NK细胞已经被修饰以表达一种或多种异源抗原受体,并且可以提供在试剂盒中,使得它们可以被进一步修饰以被基因编辑。在特定实施方案中,在试剂盒中提供一种或多种用于产生NK细胞的试剂,例如靶向特定NK细胞基因的试剂、包含异源抗原受体的试剂(或一种或多种产生异源抗原受体的试剂)或其组合。在一般实施方案中,试剂可包括核酸(包括DNA或RNA)、蛋白质、培养基、缓冲液、盐、辅因子等。在特定情况下,试剂盒包括一种或多种CRISPR相关试剂,包括用于靶向特定的所需NK细胞基因。
制品或试剂盒可进一步包括包装插页,该包装插页包含用于使用免疫细胞以治疗或延迟个体中癌症的进展或增强患有癌症的个体的免疫功能的说明。本文所述的任何抗原特异性免疫细胞可包括在制品或试剂盒中。合适的容器包括例如瓶子、小瓶、袋子和注射器。容器可以由多种材料(例如玻璃、塑料(例如聚氯乙烯或聚烯烃)或金属合金(例如不锈钢或哈氏合金))形成。在一些实施方案中,容器容纳制剂,并且在容器上或与容器相关的标签可以指示使用说明。制品或试剂盒还可以包括从商业和用户角度出发期望的其他材料,包括其他缓冲液、稀释剂、过滤器、针头、注射器和带有使用说明的包装插页。在一些实施方案中,制品还包括一种或多种其他药剂(例如化学治疗剂和抗肿瘤剂)。用于一种或多种药剂的合适容器包括例如瓶子、小瓶、袋子和注射器。
VIII.实施例
包括以下实施例以证明本发明的优选实施方案。本领域技术人员应当理解,以下实施例中公开的技术代表发明人发现的在本发明的实践中发挥良好作用的技术,以及因此可以认为构成其实践的优选方式。然而,鉴于本公开内容,本领域技术人员应当理解,可以在不脱离本发明的精神和范围的情况下在所公开的特定实施方案中进行许多改变,并且仍可获得类似或相似的结果。
实施例1
NK细胞的大规模组合CAR转导和CRISPR基因编辑
本实施例涉及使用大规模工艺生产用于免疫治疗的NK细胞,该大规模工艺还组合了使用至少一种CAR分子的NK细胞的转导和NK细胞中至少一种内源性基因的CRISPR基因编辑。作为一个实例,例如图1所示,存在组合原代脐带血来源的NK细胞的CAR转导和CRISPRCas9基因编辑的方案。在此实例中,CB NK细胞用饲养细胞(APC)和IL-2扩增。培养第5天,通过逆转录病毒载体用CAR构建体转导NK细胞。第7天,随后使用核糖核蛋白复合物(RNP)进行CRISPR-Cas9基因编辑(左侧圆圈中的仅Cas9作为对照,和右侧圆圈中的用gRNA和Cas9(RNP复合物)电穿孔的那些)。然后用APC和IL-2在体外进一步扩增NK细胞,并在第14天对细胞进行分析,例如使用功能研究、质谱流式细胞术和RNA测序中的一项或多项进行分析。图2提供了示意图,其示出了用于在GMP中原代NK细胞的CAR转导和CRISPR Cas9基因编辑的方案的一个实例。用饲养细胞和IL-2扩增NK细胞。5天后,用选择的CAR转导扩增的NK细胞。两天后,CAR NK细胞经受CRISPR/Cas9 RNP以敲除一种或多种感兴趣的基因,例如抑制性基因。在特定实施方案中,存在一种或多种抑制性基因、抑制基因、检查点分子等的大规模KO。在基因编辑步骤后,用饲养细胞和IL-2扩增修饰的细胞。最后,可以使用功能测定、细胞毒性测定、体内活性、它们的组合等来分析细胞,例如分析KO效率。
在原代CAR-NK细胞中比较了CD47的CRISPR RNP介导的KO的小规模和大规模效率(图3)。在500万和3000万规模水平上使用tracrRNA荧光标记证明了电穿孔的效率(图3A)。在图3B中,在500万和3000万个电穿孔的细胞剂量水平下使用PCR凝胶电泳证明了敲除效率。如图3C所示,在小规模和大规模水平下,使用流式细胞术证明的敲除效率是相似的。
图4涉及在CAR-NK细胞中小规模和大规模使用的TGFBR2KO。特别地,图4提供了原代CAR-NK细胞中一种不同基因TGFBR2的小规模和大规模CRISPR RNP介导的KO的另一个比较。提供了在500万和3000万规模水平下通过tracrRNA荧光标记证明的电穿孔效率(图4A)和在500万相对3000万个细胞中通过PCR凝胶电泳显示的敲除效率(图4B)。在图4C中,在500万相对3000万个细胞中,在RNP介导的KO后,有核活细胞总数显示在活细胞数中与Cas9对照相比无差异。这表明细胞活力不受影响。Phosphoflow测定评估在使用或不使用TGF-β的处理的情况下的pSMAD2/3信号传导(图4D),数据证实在500万和3000万剂量水平下,TGFBR2KO后下游TGF-β信号传导的有效消除。进行了在THP-1肿瘤靶标上门控的凋亡膜联蛋白V测定(图5E),证明与THP-1共培养4小时后,在500万和3000万个细胞KO规模下,与TGFBR2 KOCAR-NK细胞相比,用TGFB处理的Cas9对照CAR-NK细胞杀伤肿瘤靶点的效率较低。最后,图4F示出了总结在500万和3000万细胞KO规模水平下对于cas9对照或TGFBR2 KO CAR NK细胞使用质谱流式细胞术进行表型分析的热图。这表明TGFBR2 KO CAR NK细胞被保护以避免由TGF-β暴露诱导的免疫抑制表型变化,包括活化和细胞毒性标志物(例如NKP30、NKG2D、DNAM、穿孔素和/或颗粒酶)的下调。
可被敲除的基因的实例及其各自的引导或crRNA的实例见图5A-5L,包括通过流式细胞术或PCR证明的KO效率的相应实例。用于靶向的序列的其他实例见图6。
实施例2
NK细胞的大规模组合CAR转导和CRISPR基因编辑用于转化至临床的具体实例
使用病毒载体产生基因修饰的天然杀伤(NK)细胞和使用Crispr Cas9进行基因编辑的程序如下:
第0天,从单个脐带血(CB)单位或从外周血分离单核细胞,使用CliniMACS免疫磁珠(Miltenyi Biotec)耗竭CD3、CD14和CD19阳性细胞。收集未标记的、富集的NK细胞,用CliniMACS缓冲液洗涤,计数,并以1:2的比例与经辐照(100Gy)的APC合并。将细胞混合物(1×10
在特定情况下,细胞准备好用于在第15-17天输注。
以下提供了工程化NK细胞的大规模生产的特定工艺的一个特定实例:
1.CRISPR CAS9:大规模方案(起始NK细胞数5-100×10
crRNA预复合和电穿孔(Lonza 4D)
步骤1:制备crRNA+tracrRNA双链体
crRNA和tracrRNA的起始浓度为200uM。将其等摩尔浓度混合后的终浓度为100uM。
a.用移液器混合,并离心。
b.在热循环仪中于95℃下孵育5分钟。
c.允许在工作台上冷却至室温
步骤2:合并crRNA:tracrRNA双链体和Cas9核酸酶
a.用移液器混合,并离心。
b.将混合物在室温下孵育15分钟。
步骤3:合并来自步骤3的crRNA#1和crRNA#2
步骤4:执行电穿孔
a.用含IL-2的培养基(优选无抗生素)制备培养板
b.临用前制备5E+106个细胞(用PBS洗涤两次以去除FBS),并重悬于100uL P3原代细胞Nucleofector溶液中。
c.将细胞悬液和RNP混合(Cas9终浓度为4.6uM,gRNA浓度为4uM),转移至nucluocuvette中,并点击盖子就位。
d.电穿孔程序为EO-115;然后将细胞加入培养板中,并允许在37℃培养箱中复苏。
e.多至5E+106-X单位(Cat:AAF-1002X)(来自最后一个产品的20uL是足够的,关于终浓度的实例见上文)
f.为了电穿孔多至30x10
g.例如:如果细胞计数为30x10
以下提供了工程化NK细胞的小规模生产的特定工艺。
CRISPR CAS9:小规模方案(起始细胞群0.25-3x10
2.sgRNA-Cas9预复合和电穿孔(Neon-Thermo Fisher)
a.设计1或2个跨越紧密区域的sgRNA,并用于每个基因。对每个基因进行1.5μgcas9(PNA Bio)和500ng sgRNA(所有sgRNA的总和)反应,并在冰上孵育20分钟。
b.20分钟后,加入重悬于T缓冲液*(包括于Neon电穿孔试剂盒,Invitrogen,包括RNP复合物和细胞在内的总体积应为14ul)中250,000个NK细胞,并使用Neon转染系统用10uL电穿孔头进行电穿孔。
c.NK细胞的电穿孔条件为1600V、10ms和3个脉冲。然后将细胞加入含有APC(1个NK:2个APC)、SCGM培养基(优选无抗生素)、200IU/ml IL2的培养板中,并允许在37℃培养箱中复苏。
3.crRNA预复合和电穿孔(Neon-Thermo Fisher)
步骤1:制备crRNA+tracrRNA双链体
crRNA和tracrRNA的起始浓度为200uM。将其等摩尔浓度混合后的终浓度为44uM。
d.用移液器混合,并离心。
e.在热循环仪中于95℃下孵育5分钟。
f.允许在工作台上冷却至室温。
步骤2:制备cas9核酸酶
步骤3:合并crRNA:tracrRNA双链体和Cas9核酸酶
g.用移液器混合,并离心。
h.将混合物在室温下孵育15分钟。
步骤4:合并来自步骤3的crRNA#1和crRNA#2
步骤5:执行电穿孔
临用前每孔制备250,000个细胞并重悬于7.5uL T缓冲液中。
电穿孔条件为1600V、10ms和3个脉冲。然后将细胞加入培养板中,并允许在37℃培养箱中复苏。
实施例3
NK细胞和CAR-NK细胞中的多重基因编辑
本实施例涉及NK细胞的产生,所述NK细胞表达一种或多种工程化抗原受体例如CAR并且还已被基因编辑以减少或消除一种或多种内源性基因的表达。在图2中是在NK细胞中将CAR转导与多重基因编辑相结合的方法的一个实例。NK细胞从合适的来源(例如脐带血)获得,并以合适的方式扩增,例如用饲养细胞和一种或多种合适的细胞因子(例如IL-2)扩增。在特定情况下,首先对扩增的细胞进行修饰以表达CAR,在特定实例中。NK细胞的转导步骤可以在特定量的扩增时间内进行,例如在扩增步骤开始后的第5天或约第5天。NK细胞可使用用于NK细胞的标准转导方法转导,以产生CAR-NK细胞。在适当的时间量内,例如在扩增步骤开始后的第7天(或约第7天),CAR-NK细胞经受基因编辑修饰,并且在特定情况下,这作为基因敲除使用CRISPR/Cas9 RNP进行。在特定情况下,基因编辑步骤是大规模敲除CAR-NK细胞中的一种或多种内源性基因。敲除的基因的某些实例包括TGF-β、TIGIT和/或ADAM17。在一些实施方案中,将产生的CAR-NK KO细胞在合适的条件下扩增,例如使用适当的饲养细胞和一种或多种细胞因子,例如IL-2。在适当的持续时间后,首先在使用前评估CAR-NK KO细胞的一种或多种活性,但在其他情况下未评估其一种或多种活性。在某些情况下,仅作为实例,评估CAR-NK KO细胞的KO效率、功能测定、细胞毒性测定和/或体内活性。
在CAR-NK KO细胞的产生后,可评估产生的细胞。作为一个实例,可以评估它们关于NK细胞中所需内源性基因的破坏的基因编辑效率。图7示出了CAR-NK细胞针对所述基因的基因破坏以及使用PCR评估的一个实例。在图7A和7B中,PCR结果显示CRISPR/Cas9介导NK细胞中的有效多基因破坏。用于证明KO的效率的另一种方法是通过流式细胞术,例如图7C所示。
在CAR-NK KO细胞的产生后,可评估其体外或体内活性。图8A-8H显示NK细胞中抑制性分子的多重基因编辑改善其体外功能和抗肿瘤活性。具体地,图8涉及表达CD19 CAR并且被敲除了三种基因(NKG2A、TGFBR2和CISH)的NK细胞。图8A,除了脱颗粒状态(the statusof degranulation)(通过CD107a测定)外,还在功能上评估细胞的特定细胞因子产生(这里,IFNg和TNFa)。图8A中的FACS图显示了与对照相比增加的IFNg和TNFa产生和脱颗粒(另见图8C)。在图8C中,通过铬释放测定评估细胞毒性,这里显示与Cas9对照相比,三重KOCAR19-NK细胞对Raji肿瘤细胞的增加的特异性裂解。另一种细胞毒性测定,Incucyte杀伤测定,证实三重KO CAR19-NK细胞对Raji肿瘤细胞的增强的杀伤(图8D)。如膜联蛋白V凋亡测定的FACS图所示,三重KO CAR19-NK细胞也表现出Raji肿瘤细胞的增加的凋亡(图8E、8F)。最后,图8G通过显示三重KO CAR19-NK细胞的增加的穿孔素和颗粒酶B产生来证明NK细胞毒性。
可评估细胞的体内活性。在图9A-9B中,使用BLI成像评估细胞的抗肿瘤活性。与对照相比,三重KO CAR19-NK细胞的肿瘤控制有所改善,表明NK细胞中抑制性分子的多重基因编辑提高了其体内抗肿瘤功效并且还增强了存活(图10B)。
在一个实例中,可敲除CAR NK细胞的防止CD16和CD62L脱落的内源性基因(防止CD16脱落可保存抗体细胞毒性,防止CD62L脱落可改善归巢至骨髓和淋巴结)。在特定情况下,敲除CAR NK细胞的ADAM17,并且图10A-10C证明CAR-NK细胞中的ADAM17 KO防止CD16和CD62L的脱落。
实施例4
大规模NR3C1敲除方案
本方面涉及基因NR3C1的大规模敲除方案的一个实例。在这种特殊情况下,例如,通过CRISPR技术进行基因编辑。
材料的实例
1.gRNA#1(61uM,Synthego)
2.gRNA#2(61uM,Synthego)
3.SpyFY Cas9(61uM,Aldevron)
4.补充有HEPES(15mM)和甘露醇(50mM)的Plasmalyte
5.Lonza 4D Nucleofactor(程序:主要P3、CA137、CM137)
6.培养瓶
程序:以下是用于100E6个细胞的方案
步骤1:将gRNA和cas9以3:1的摩尔比合并。对所有gRNA单独进行此操作。
用移液器混合,离心。
将混合物在室温下孵育20分钟。
步骤2:以1:1的比例合并gRNA#1+Cas9和gRNA#2+Cas9
步骤3:执行细胞的电穿孔。
电穿孔前,用适当的培养基制备培养瓶。
临用前制备100E6个细胞,并重悬于1mL Plasmalyte中。
使用Lonza 4D Nucleofactor系统,使用程序代码CA137或CM137进行电穿孔
电穿孔并添加至预先制备的培养瓶。
混合并在37℃下培养。
3天后,例如通过PCR和/或western印迹检查敲除效率。
图11A示出了用于Lonza 4D-Nucleofactor
在图12A中,测试了用于Lonza 4D-Nucleofactor
鉴于本公开内容,可以在不进行过度实验的情况下进行和执行本文公开和要求保护的所有方法。尽管已经根据优选实施方案描述了本发明的组合物和方法,但是对于本领域技术人员而言明显的是,可以在不背离本发明的概念、精神和范围的情况下对所述方法以及本文所描述的方法的步骤或步骤顺序进行变化。更具体地,将明显的是,化学和生理相关的某些试剂可以代替本文所述的试剂,而将获得相同或相似的结果。对于本领域技术人员明显的所有这些类似的替代和修改都被认为在所附权利要求所限定的本发明的精神、范围和概念之内。
参考文献
以下参考文献在提供示例性的程序或补充本文所示的那些的其他细节的程度上被特别地通过引用并入本文。
Ausubel等人,Current Protocols in Molecular Biology,Greene PublishingAssociates and John Wiley&Sons,NY,1994.
Bennekov等人,Mt.Sinai J.Med.71(2):86-93,2004.
Chothia等人,EMBO J.7:3745,1988.
Cohen等人J Immunol.175:5799-5808,2005.
Davila等人PLoS ONE 8(4):e61338,2013.
欧洲专利申请号EP2537416
Fedorov等人,Sci.Transl.Medicine,5(215),2013.
Frolet等人,BMC Microbiol.10:190(2010).
Hanibuchi等人,Int.J.Cancer,78(4):480-485,1998.
Heemskerk等人Hum Gene Ther.19:496-510,2008.
国际专利公开号WO 00/37504
国际专利公开号WO 01/14424
国际专利公开号WO 14/055668
国际专利公开号WO 00/14257
国际专利公开号WO 01/014424
国际专利公开号WO 07/103009
国际专利公开号WO 12/129514
国际专利公开号WO 13/071154
国际专利公开号WO 13/123061
国际专利公开号WO 13/166321
国际专利公开号WO 13/126726
国际专利公开号WO 14/031687
国际专利公开号WO 99/40188
Janeway等人,Immunobiology:The Immune System in Health and Disease,3
Johnson等人Blood 114:535-46,2009.
Jores等人,PNAS U.S.A.87:9138,1990.
Lefranc等人,Dev.Comp.Immunol.27:55,2003.
Linnemann,C.等人Nat Med 21,81–85,2015.
Lockey等人,Front.Biosci.13:5916-27,2008.
Loewendorf等人,J.Intern.Med.267(5):483-501,2010.
Marschall等人,Future Microbiol.4:731-42,2009.
Parkhurst等人Clin Cancer Res.15:169-180,2009.
Rieder等人,J.Interferon Cytokine Res.(9):499-509,2009.
Rykman,等人,J.Virol.80(2):710-22,2006.
Sadelain等人,Cancer Discov.3(4):388-398,2013.
Sambrook等人,Molecular Cloning:A Laboratory Manual,3
Shah等人,PLoS One,8:e776781,2013.
Singh等人,Cancer Research,68:2961-2971,2008.
Singh等人,Cancer Research,71:3516-3527,2011.
Turtle等人,Curr.Opin.Immunol.,24(5):633-39,2012.
美国专利号4,870,287
美国专利号5,760,395
美国专利号5,801,005
美国专利号5,994,136
美国专利号6,013,516
美国专利号6,225,042
美国专利号6,355,479
美国专利号6,410,319
美国专利号6,416,998
美国专利号6,544,518
美国专利号7,109,304
美国专利号7,446,190
美国专利号7,989,425
美国专利号8,017,114
美国专利号8,071,369
美国专利号8,354,509
美国专利公开号2002131960
美国专利公开号2005/0260186
美国专利公开号2006/0104968
美国专利公开号2009/0004142
美国专利公开号2009/0017000
美国专利公开号20130149337
美国专利公开号2013287748
Varela-Rohena等人Nat Med.14:1390-1395,2008.
Wu等人,Adv.Cancer Res.,90:127-56,2003.
Wu等人,Cancer,18(2):160-75,2012.
Yu等人,Science,318:1917-1920,2007.
Zysk等人,Infect.Immun.68(6):3740-43,2000.
序列表
<110> BOARD OF REGENTS, THE UNIVERSITY OF TEXAS SYSTEM
<120> NK细胞的大规模组合CAR转导和CRISPR基因编辑
<130> UTSC.P1199WO-1001143828
<140> UNKNOWN
<141> 2020-11-25
<150> 62/941,134
<151> 2019-11-27
<160> 22
<170> PatentIn版本3.5
<210> 1
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 描述人工序列:合成寡核苷酸
<400> 1
aacaactatc gttaccacag20
<210> 2
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 描述人工序列:合成寡核苷酸
<400> 2
agacgggcac gaggttccct20
<210> 3
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 描述人工序列:合成寡核苷酸
<400> 3
tcacgcacaa gaaacgtcca20
<210> 4
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 描述人工序列:合成寡核苷酸
<400> 4
accctgatgg gacgtacact20
<210> 5
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 描述人工序列:合成寡核苷酸
<400> 5
aggcacagta gaagccgtat20
<210> 6
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 描述人工序列:合成寡核苷酸
<400> 6
gacggctgag gagcggaaga20
<210> 7
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 描述人工序列:合成寡核苷酸
<400> 7
tgtggaggtg agcaatcccc20
<210> 8
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 描述人工序列:合成寡核苷酸
<400> 8
aggccacata gtgctgcaca20
<210> 9
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 描述人工序列:合成寡核苷酸
<400> 9
tgtacagcag tggctggtgg20
<210> 10
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 描述人工序列:合成寡核苷酸
<400> 10
ccccttcggt caccacgagc20
<210> 11
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 描述人工序列:合成寡核苷酸
<400> 11
ctcctcggtg tacatcacgg20
<210> 12
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 描述人工序列:合成寡核苷酸
<400> 12
agtagttggt gacgttctgc20
<210> 13
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 描述人工序列:合成寡核苷酸
<400> 13
cgctacacgg tgctgagcgt20
<210> 14
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 描述人工序列:合成寡核苷酸
<400> 14
gagttccgtg accgtgcaag20
<210> 15
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 描述人工序列:合成寡核苷酸
<400> 15
tgagttccca acttcattag20
<210> 16
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 描述人工序列:合成寡核苷酸
<400> 16
tgagaagcga cagccagtga20
<210> 17
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 描述人工序列:合成寡核苷酸
<400> 17
ggccagactg gcaccaacgg20
<210> 18
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 描述人工序列:合成寡核苷酸
<400> 18
ctactgaagt atacgtaaag20
<210> 19
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 描述人工序列:合成寡核苷酸
<400> 19
catctatcgg aacacttcat20
<210> 20
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 描述人工序列:合成寡核苷酸
<400> 20
cgaaaggaac cacgctggtc20
<210> 21
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 描述人工序列:合成寡核苷酸
<400> 21
atttactgtc acggttccca20
<210> 22
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 描述人工序列:合成寡核苷酸
<400> 22
ccccatagat gattatgcat20
