用于缓解或治疗神经退行性疾病的症状的贴剂
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及用于缓解或治疗神经退行性疾病的症状的贴剂,其含有东莨菪碱的盐和/或其水合物作为有效成分。
背景技术
东莨菪碱(scopolamine)作为抗胆碱药而广为人知,其是具有抑制口腔内/呼吸道内分泌、预防有害的副交感神经反射等效果的药物。迄今为止,开发了含有东莨菪碱作为有效成分的药物,例如,在日本国内已制造销售含有东莨菪碱的盐即东莨菪碱氢溴酸盐水合物作为有效成分的注射剂“Hysco(注册商标)皮下注射剂、杏林制药”,在海外已制造销售含有东莨菪碱游离碱作为有效成分的贴剂“Transderm Scop(注册商标)、Novartis”。
在非专利文献1中暗示了东莨菪碱软膏具有减少唾液分泌量的倾向。另外,在非专利文献2~7中记载了东莨菪碱的经皮给药制剂使唾液分泌量减少。
现有技术文献
非专利文献
非专利文献1:Maeda M等人,Jpn J Clin Pharmacol Ther 2018;49(2):53-58;
非专利文献2:Gordon C等人,J Clin Pharmacol.,1985;25:407-412;
非专利文献3:Talmi YP等人,Otolaryngol Head Neck Surg.,1990,第103卷,No.4,615-618;
非专利文献4:Jongerius PH等人,Pediatrics.2004,第114卷,No.3,620-627;
非专利文献5:Brodtkorb E等人,J Mental Deficiency Res.,1988,32,233-237;
非专利文献6:Mato A等人,Br J Clin Pharmacol.,2010,69:6,684-688;
非专利文献7:Gordon C等人,Aviation Space Environmental Medicine.March1986,236-240。
发明内容
发明所要解决的课题
本发明以提供用于缓解或治疗神经退行性疾病的症状的新型贴剂为课题。
用于解决课题的手段
为了解决上述课题,本发明人反复进行了研究,结果发现:通过在规定的用法和用量下经皮应用含有东莨菪碱的盐和/或其水合物、聚乙烯吡咯烷酮和碱的贴剂,可减少唾液分泌量,并发现其可用于缓解或治疗神经退行性疾病的症状,从而完成了本发明。根据本发明,提供以下的发明。
<1>贴剂,其是用于缓解或治疗神经退行性疾病的症状的贴剂,含有东莨菪碱的盐和/或其水合物,每次的贴附时间为48小时以内。
<2><1>所述的贴剂,其中,每次的贴附时间为24小时以内。
<3><1>所述的贴剂,连续地反复进行2次以上的每次48小时以内的贴附。
<4><1>~<3>中任一项所述的贴剂,其中,成人每天的东莨菪碱的盐和/或其水合物的给药量为0.75mg~50mg。
<5><1>~<4>中任一项所述的贴剂,其中,将贴剂贴附在耳廓后部、肩、上臂部、胸部、腹部、腰背部、臀部或大腿部。
<6><1>~<5>中任一项所述的贴剂,其中,上述东莨菪碱的盐和/或其水合物为东莨菪碱氢溴酸盐和/或东莨菪碱氢溴酸盐水合物。
<7><1>~<6>中任一项所述的贴剂,该贴剂还含有聚乙烯吡咯烷酮和碱。
<8><7>所述的贴剂,其中,上述碱为选自胺化合物的至少1种。
<9><8>所述的贴剂,其中,上述胺化合物为甲基丙烯酸甲酯/甲基丙烯酸丁酯/甲基丙烯酸二甲基氨基乙酯共聚物。
<10><1>~<8>中任一项所述的贴剂,该贴剂是包含支撑体、含药物的粘合剂层和剥离衬垫的贴剂,上述含药物的粘合剂层包含含有东莨菪碱的盐和/或其水合物、聚乙烯吡咯烷酮和碱的药物组合物。
<11><10>所述的贴剂,其中,相对于上述药物组合物整体的质量,东莨菪碱的盐和/或其水合物的含量为0.5~10质量%。
<12><10>或<11>所述的贴剂,其中,相对于上述药物组合物整体的质量,聚乙烯吡咯烷酮的含量为0.3~12质量%。
<13><10>~<12>中任一项所述的贴剂,其中,相对于上述药物组合物整体的质量,上述碱的含量为0.3~10质量%。
<14><10>~<13>中任一项所述的贴剂,其中,上述含药物的粘合剂层的基质成分为选自丙烯酸系粘合剂、橡胶系粘合剂和硅酮系粘合剂的至少1种。
<15><10>~<14>中任一项所述的贴剂,其中,上述含药物的粘合剂层的基质成分为丙烯酸系粘合剂。
<16><15>所述的贴剂,其中,上述丙烯酸系粘合剂为选自含羟基型和无极性型的至少1种。
发明效果
根据本发明的含有东莨菪碱的盐和/或其水合物作为有效成分的贴剂可有效抑制唾液分泌量,可用于缓解或治疗肌萎缩性侧索硬化症(ALS)等神经退行性疾病的症状。
附图说明
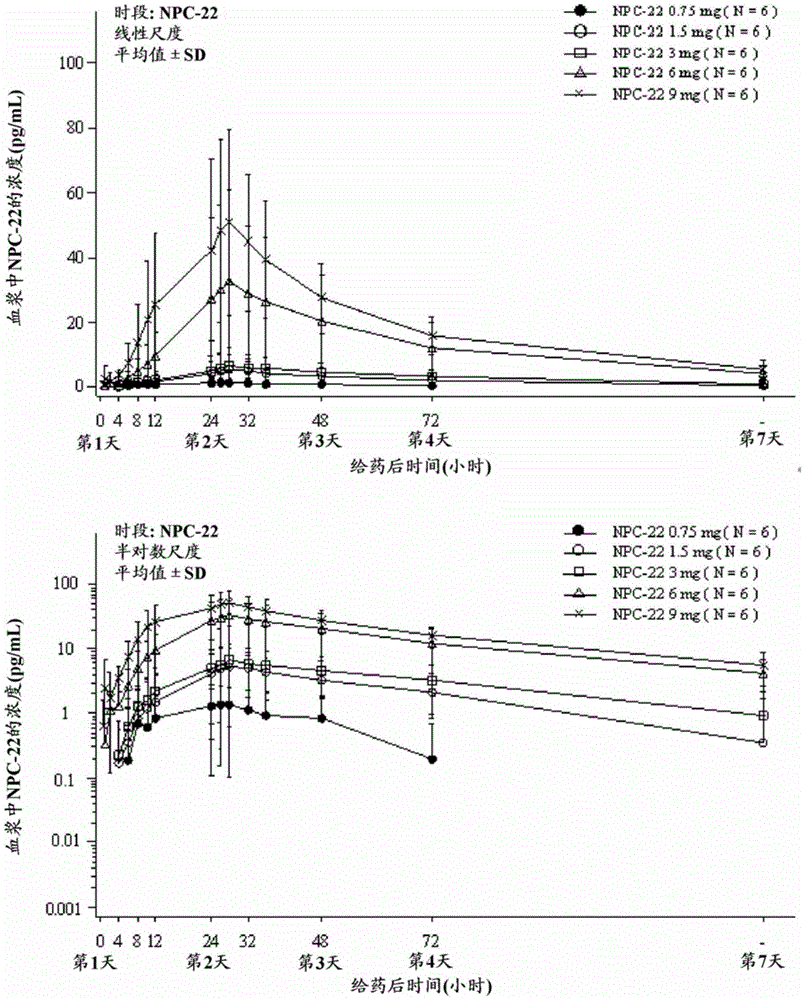
[图1]图1显示对健康成人男性单次给予NPC-22(贴附24小时)时的血浆中东莨菪碱浓度变化(上段:标准尺度、下段:对数尺度)。
[图2]图2显示对健康成人男性单次皮下给予0.25mg东莨菪碱氢溴酸盐水合物注射剂时的血浆中东莨菪碱浓度变化(上段:标准尺度、下段:对数尺度)。
[图3]图3显示单次给予0.75mg、1.5mg、3mg、6mg或9mg NPC-22(贴附24小时)时的药物动力学参数的用量比例性的研究(C
[图4]图4显示单次给予0.75mg、1.5mg、3mg、6mg或9mg NPC-22(贴附24小时)时的药物动力学参数的用量比例性的研究(AUC
[图5]图5显示单次给予0.75mg、1.5mg、3mg、6mg或9mg NPC-22(贴附24小时)时的药物动力学参数的用量比例性的研究(AUC
[图6]图6显示用NPC-22单次给予0.75mg、1.5mg、3mg、6mg或9mg东莨菪碱(贴附24小时)时东莨菪碱的累积尿中排泄率(平均值±标准偏差)。
[图7]图7显示单次皮下给予0.25mg东莨菪碱氢溴酸盐水合物注射剂时东莨菪碱的累积尿中排泄率(平均值±标准偏差)。
[图8]图8显示血浆中东莨菪碱浓度与唾液分泌量的变化量和变化率的关系。
[图9]图9显示血浆中东莨菪碱浓度与心率(12导联心电图)的变化量/变化率的关系。
[图10]图10显示对健康成人男性单次给予NPC-22(贴附24小时)时各给药部位的血浆中东莨菪碱浓度变化(平均值±标准偏差)。
具体实施方式
本发明的贴剂是用于缓解或治疗神经退行性疾病的症状的贴剂,其含有东莨菪碱的盐和/或其水合物,每次的贴附时间为48小时以内。
作为神经退行性疾病,可列举:肌萎缩性侧索硬化症(ALS)、与焦虑相关的疾病(社会焦虑障碍、焦虑神经症、强迫性障碍、外伤后应激障碍(PTSD))、多聚谷氨酰胺疾病、视网膜色素变性病、神经官能症、痉挛、恐慌障碍、睡眠障碍、抑郁症、反应性抑郁症、癫痫、帕金森病、帕金森综合征、唐氏症、精神分裂症、自主神经失调症、亨廷顿氏病、阿尔茨海默病、路易体痴呆、额颞叶痴呆、情感障碍(包括抑郁症性或双相性障碍)、偏头痛、紧张型头痛、丛集性头痛、解离性障碍、视神经脊髓炎、视神经炎、急性散发性(播散性)脑脊髓炎、过敏性脑脊髓炎、Marchiafava–Bignami病、Binswanger病、进行性多灶性白质脑病、感染后脑炎、脑桥中央髓鞘溶解症、肾上腺白质萎缩症、多系统萎缩症、Krabbe病、异染性脑白质营养不良、亚历山大病、Canavan病、Cockayne综合征、佩梅(Pelizaeus-Merzbacher)病、Hurler综合征、Lowe综合征、脊髓损伤、横断性脊髓炎、脊髓小脑变性症、慢性炎症性脱髄鞘性多发神经炎、Guillain-Barré综合征、苯丙酮尿症、Refsum病、腓骨肌萎缩(Charcot-Marie-Tooth)症、Gaucher病、NieMann-Pick病、多发性硬化症、脆性X染色体综合征、自闭症、失眠、神经性咳嗽、心源性痉挛发作、心源性昏厥发作、书写痉挛、痉挛性斜颈、神经病变等。
萎缩性侧索硬化症的治疗效果可通过ALS功能评价量表(ALSFRS-R)等予以评价。
作为神经退行性疾病的症状,可列举:唾液分泌量的增加。所谓神经退行性疾病的症状的缓解或治疗可列举:使唾液的分泌量减少。
本发明的贴剂的每次的贴附时间为48小时以内、优选为36小时以内、更优选为30小时以内、进一步优选为24小时以内。本发明的贴剂的每次的贴附时间特别优选为24小时。
对于本发明的贴剂,可连续地反复进行2次以上的每次48小时以内(优选为36小时以内、更优选为30小时以内、进一步优选为24小时以内)的贴附。在连续地反复进行2次以上的贴附的情况下,对贴附次数的下限没有特别限定,可以是2次以上、3次以上、4次以上、5次以上、6次以上或7次以上。对贴附次数的上限也没有特别限定,可以是100次以内、50次以内、40次以内、30次以内、20次以内、10次以内。
在本发明的贴剂中,成人每天的东莨菪碱的盐和/或其水合物的给药量优选为0.75mg~50mg、更优选为0.75mg~30mg、进一步优选为0.75mg~20mg、特别优选为0.75mg~9mg。作为每天的东莨菪碱的盐和/或其水合物的给药量的具体例子,为0.75mg、1.5mg、3mg、6mg、9mg或18mg。
对本发明的贴剂的贴附部位没有特别限定,可列举:耳廓后部、肩、上臂部、胸部、腹部、腰背部、臀部或大腿部等,优选为耳廓后部、上臂部、胸部或腹部,特别优选为耳廓后部。
本发明的贴剂中使用的有效成分是东莨菪碱((-)-(S)-3-羟基-2-苯基丙酸(1R,2R,4S,7S,9S)-9-甲基-3-氧杂-9-氮杂三环[3.3.1.0
本发明的贴剂只要含有治疗有效量的东莨菪碱的盐和/或其水合物即可,对其状态没有特别限定,从生物体中的吸收性的观点来看,优选溶解状态、无定形状态。为了对患者给予治疗上有效的量的有效成分,重要的是含有某一定量的有效成分。
本发明的贴剂优选为:包含支撑体、含药物的粘合剂层和剥离衬垫的贴剂,其中,含药物的粘合剂层包含含有东莨菪碱的盐和/或其水合物、聚乙烯吡咯烷酮和碱的药物组合物。
上述的药物组合物中的东莨菪碱的盐和/或其水合物的含量相对于组合物整体为0.5~10质量%、优选为1~8质量%、更优选为3~6质量%。如果小于0.5质量%,则治疗效果有可能不充分,另一方面,当为超过10质量%的量时,在经济上不利。
上述的药物组合物中,为了提高东莨菪碱的化学稳定性而含有聚乙烯吡咯烷酮。通常使用的聚乙烯吡咯烷酮存在重均分子量为数千~数百万的聚乙烯吡咯烷酮。这些聚乙烯吡咯烷酮可使用一种以上。
上述的药物组合物中的聚乙烯吡咯烷酮的含量相对于组合物整体为0.3~12质量%、优选为0.5~10质量%、更优选为1~8质量%的范围。当小于0.3质量%时,有可能无法获得充分的化学稳定性提高效果,另一方面,当为超过12质量%的量时,有可能对组合物的物性产生不良影响,因此不优选。另外,当聚乙烯吡咯烷酮与东莨菪碱的盐和/或其水合物的重量比为2以上时,有可能对组合物的均一性产生不良影响,因此聚乙烯吡咯烷酮与东莨菪碱的盐和/或其水合物的重量比优选小于2。
上述的药物组合物中,为了使东莨菪碱的盐和/或其水合物成为游离碱和为了提高东莨菪碱的化学稳定性而优选含有胺化合物。胺化合物可以是伯胺、仲胺、叔胺中的任一种,作为伯胺,可列举:甲胺、乙胺、十二烷基胺等,作为仲胺,可列举:二甲胺、二乙胺、N-甲基乙醇胺等,作为叔胺,可列举:N,N-二乙基甲胺、三丁胺、N,N-二甲基对甲苯胺、N,N-二乙基对甲苯胺、甲基丙烯酸甲酯/甲基丙烯酸丁酯/甲基丙烯酸二甲基氨基乙酯共聚物等,但并不限于这些。这些胺化合物可使用一种以上。
上述的药物组合物中的胺化合物的含量相对于组合物整体为0.3~10质量%、优选为0.5~8.5质量%、更优选为0.9~7.5质量%的范围。当小于0.3质量%时,有可能无法获得充分的在生物体中的吸收性,另一方面,当为超过10质量%的量时,有可能对化学稳定性产生不良影响。
作为本发明的贴剂,可列举:基质型、储库型。本发明的贴剂可以是基质型或储库型中的任一种,为了使制剂容易设计、可降低制造时的成本,优选基质型。
基质型贴剂由支撑体、含药物的粘合剂层、剥离衬垫构成。
含药物的粘合剂层是含有包含有效成分的药物组合物和基质成分的层。对该含药物的粘合剂层中使用的基质成分没有特别限定,优选橡胶系粘合成分、丙烯酸系粘合成分、硅酮系粘合成分等通常用于贴剂的粘合成分,特别优选丙烯酸系粘合成分,更优选无极性型丙烯酸系粘合成分和含羟基型丙烯酸系粘合成分。
所谓丙烯酸系粘合成分是指含有至少一种(甲基)丙烯酸酯的聚合物或共聚物。
无极性型丙烯酸系粘合成分在单体结构单元中的侧链上不具有官能团,例如可列举:(甲基)丙烯酸烷基酯聚合物或共聚物、(甲基)丙烯酸烷基酯/乙酸乙烯酯共聚物等,具体而言,可列举:丙烯酸-2-乙基己酯/甲基丙烯酸-2-乙基己酯/甲基丙烯酸十二烷基酯共聚物、丙烯酸-2-乙基己酯/乙酸乙烯酯共聚物、甲基丙烯酸甲酯/甲基丙烯酸丁酯/甲基丙烯酸二甲基氨基乙酯共聚物等,但并不限定于这些。
含羟基型丙烯酸系粘合成分是以在单体结构单元中的侧链上含有游离羟基的(甲基)丙烯酸酯中的至少一种作为构成单体的聚合物或共聚物,例如可列举:包含(甲基)丙烯酸羟基烷基酯的共聚物等,具体而言,可列举:丙烯酸-2-乙基己酯/丙烯酸羟乙酯/乙酸乙烯酯共聚物、丙烯酸-2-乙基己酯/乙烯基吡咯烷酮/丙烯酸羟乙酯/乙酸乙烯酯共聚物、丙烯酸-2-乙基己酯/丙烯酸羟乙酯/乙酸乙烯酯共聚物、丙烯酸-2-乙基己酯/丙烯酸羟乙酯/丙烯酸缩水甘油酯/乙酸乙烯酯共聚物、丙烯酸-2-乙基己酯/乙酸乙烯酯/丙烯酸-2-羟乙酯共聚物、丙烯酸-2-乙基己酯/乙酸乙烯酯/丙烯酸-2-羟乙酯/甲基丙烯酸缩水甘油酯共聚物等,但并不限于这些。
考虑到含药物的粘合剂层的形成和充分的药物释放性,相对于含药物的粘合剂层整体,含药物的粘合剂层中的基质成分的含量为60~98.9质量%、优选为63~98质量%、更优选为66~96质量%。小于60质量%时,投锚性等作为贴剂的物理特性降低,另外,在超过98.9%的量时,无法充分掺混有效成分和其他添加剂,不优选。
在含药物的粘合剂层中,根据需要可含有吸收促进剂。作为吸收促进剂,可以是以往在经皮给药中发现有吸收促进作用的化合物中的任一种,例如可列举:月桂酸、油酸、异硬脂酸、肉豆蔻酸异丙酯、肉豆蔻酸辛基十二烷基酯、甘油油酸单酯、异硬脂酸己基癸酯等脂肪酸及其酯类,油醇、丙二醇、单油酸聚乙二醇酯等醇及其酯类或醚类,脱水山梨糖醇倍半油酸酯、单油酸聚氧乙烯脱水山梨糖醇酯、脱水山梨糖醇单月桂酸酯、脱水山梨糖醇单油酸酯等脱水山梨糖醇酯类或醚类,聚氧乙烯壬基苯基醚、聚氧乙烯辛基苯基醚等苯酚醚类,蓖麻油或氢化蓖麻油、油酰肌氨酸、月桂基二甲基氨基乙酸甜菜碱、十二烷基硫酸钠等离子性表面活性剂,聚氧乙烯油基醚、聚氧乙烯十二烷基醚等非离子性表面活性剂,二甲基亚砜、癸基甲基亚砜等烷基甲基亚砜,1-十二烷基氮杂环庚-2-酮、1-香叶基氮杂环庚-2-酮等氮杂环烷烃类,除聚乙烯吡咯烷酮以外的吡咯烷酮类等。
对本发明的贴剂中使用的支撑体没有特别限定,例如可使用药物不透过性且伸缩性或非伸缩性的支撑体。作为支撑体,例如可列举:聚乙烯、聚丙烯、聚丁二烯、乙烯乙酸乙烯酯共聚物、聚氯乙烯、聚酯(聚对苯二甲酸乙二醇酯等)、尼龙、聚氨酯等合成树脂膜或片或它们的层叠体、多孔体、发泡体、纸、有纺布、无纺布等。
对本发明的贴剂中使用的剥离衬垫没有特别限定,例如可使用药物不透过性的剥离衬垫。作为剥离衬垫,例如可列举:由聚乙烯、聚丙烯、聚酯等高分子材料制成的膜、在膜上蒸镀铝而得到的产品、在纸上涂布硅油等而得到的产品等。其中,在有效成分不会透过、加工性、低成本等方面,优选聚酯膜,特别优选聚对苯二甲酸乙二醇酯(PET)膜。而且,剥离衬垫也可使用将多种材料贴合而得到的层合膜等。
本发明的贴剂在使用之前保存在包装材料中。对包装材料没有特别限定,可列举:塑料膜、金属(铝等)层叠塑料膜、金属蒸镀塑料膜、陶瓷(氧化硅等)蒸镀塑料膜、铝箔等金属箔、不锈钢等金属、玻璃等。其中,在制造成本等方面,优选使用金属层叠塑料膜、金属蒸镀塑料膜等。
在本发明的贴剂中,还可根据需要,为了控制有效成分的经皮吸收而在含药物的粘合剂层的皮肤贴附侧追加释放控制膜,或为了贴附于皮肤而追加粘合层。
本发明的贴剂优选由支撑体、含药物的粘合剂层和剥离衬垫构成,支撑体为1~1000μm、优选10~700μm的厚度,含药物的粘合剂层为10~200μm、优选30~150μm的厚度,剥离衬垫为1~500μm、优选10~200μm的厚度。
本发明的贴剂可按照已知的贴剂的制造方法进行制造。作为本发明的贴剂的优选制造方法,例如可列举以下的方法。
<方法1>
将作为有效成分的东莨菪碱的盐和/或其水合物、胺化合物、聚乙烯吡咯烷酮、基质成分、以及基于需要的吸收促进剂等溶解于例如乙酸乙酯、甲醇等有机溶剂或它们的混合溶剂,将所得溶解物铺展于剥离衬垫或支撑体上,使溶解物中的有机溶剂蒸发以形成含药物的粘合剂层,之后贴合支撑体或剥离衬垫,从而得到贴剂。
<方法2>
将作为有效成分的东莨菪碱的盐和/或其水合物、胺化合物、聚乙烯吡咯烷酮、基质成分、以及基于需要的吸收促进剂等加热溶解,将该熔融物铺展于剥离衬垫或支撑体上,形成含药物的粘合剂层,之后贴合支撑体或剥离衬垫,从而得到贴剂。
实施例
通过以下的实施例来具体地说明本发明,但本发明并不限定于这些实施例。
<实施例1>
按照表1所记载的掺混比,将东莨菪碱氢溴酸盐水合物、肉豆蔻酸异丙酯、十二烷基胺溶解于乙酸乙酯/甲醇混合液,加入丙烯酸系粘合成分(商品名:DURO-TAK 87-4287、Henkel制造)进行混合搅拌,得到了均匀的溶解物。接下来,使用刮刀涂布机将该溶解物以使干燥后的厚度为100μm的方式铺展于剥离膜上,进行干燥,形成含药物的粘合剂层,之后贴合支撑体。然后,剪裁成所期望的大小,得到了贴剂。
<实施例2>
按照表1所记载的掺混比,以东莨菪碱游离碱的量与实施例1为等量的方式,掺混二乙胺来代替十二烷基胺,除此以外,与实施例1同样地操作,得到了贴剂。
<实施例3>
按照表1所记载的掺混比,以东莨菪碱游离碱的量与实施例1为等量的方式,掺混甲基丙烯酸甲酯/甲基丙烯酸丁酯/甲基丙烯酸二甲基氨基乙酯共聚物(商品名:EudragitEPO、Evonik制造)来代替十二烷基胺,除此以外,与实施例1同样地操作,得到了贴剂。
<实施例4>
按照表1所记载的掺混比,以东莨菪碱游离碱的量与实施例1为等量的方式,掺混氢氧化钠来代替十二烷基胺,并进一步掺混聚乙烯吡咯烷酮,除此以外,与实施例1同样地操作,得到了贴剂。
<实施例5>
按照表1所记载的掺混比,以东莨菪碱游离碱的量与实施例1为等量的方式,掺混Eudragit EPO来代替十二烷基胺,并进一步掺混聚乙烯吡咯烷酮,除此以外,与实施例1同样地操作,得到了贴剂。
<实施例6>
按照表1所记载的掺混比,将东莨菪碱氢溴酸盐水合物、Eudragit EPO、聚乙烯吡咯烷酮溶解于乙酸乙酯/甲醇混合液,加入DURO-TAK87-4287进行混合搅拌,得到了均匀的溶解物。接下来,使用刮刀涂布机将该溶解物以使干燥后的厚度为100μm的方式铺展于剥离膜上,进行干燥,形成含药物的粘合剂层,之后贴合支撑体。然后,剪裁成所期望的大小,得到了贴剂。
<实施例7>
按照表1所记载的掺混比,增加聚乙烯吡咯烷酮的掺混量,除此以外,与实施例6同样地操作,得到了贴剂。
<实施例8>
按照表1所记载的掺混比,将东莨菪碱氢溴酸盐水合物、肉豆蔻酸异丙酯、Eudragit EPO、聚乙烯吡咯烷酮溶解于乙酸乙酯/甲醇混合液,加入DURO-TAK 87-4287进行混合搅拌,得到了均匀的溶解物。接下来,使用刮刀涂布机将该溶解物以使干燥后的厚度为100μm的方式铺展于剥离膜上,进行干燥,形成含药物的粘合剂层,之后贴合支撑体。然后,剪裁成所期望的大小,得到了贴剂。
<实施例9>
按照表1所记载的掺混比,将东莨菪碱氢溴酸盐水合物、肉豆蔻酸异丙酯、Eudragit EPO、聚乙烯吡咯烷酮溶解于乙酸乙酯/甲醇混合液,加入DURO-TAK 87-4287进行混合搅拌,得到了均匀的溶解物。接下来,使用刮刀涂布机将该溶解物以使干燥后的厚度为50μm的方式铺展于剥离膜上,进行干燥,形成含药物的粘合剂层,之后贴合支撑体。然后,剪裁成所期望的大小,得到了贴剂。
<实施例10>
按照表1所记载的掺混比,增加肉豆蔻酸异丙酯的掺混量,除此以外,与实施例9同样地操作,得到了贴剂。
[表1]
<试验例1>大鼠中的单次经皮给药的血浆中浓度测定试验(给药)
对5只雄性大鼠(Crl:CD(SD)系统:给药时周龄为6周龄)(动物编号10101~10105)单次经皮给予(封闭贴附24小时)东莨菪碱贴剂(实施例5)。在给药日的给药前用电动剃须刀剃毛。确认背部的状态后,将受试物质贴在背部(在正中线的右侧)。用绒布(约4.0cm×4.0cm)覆盖贴附部位,缠上伸缩性粘合绷带予以封闭。给药量为1片/大鼠(含量:0.75mg/片)。每1片的面积为2.5cm
(观察和测定)
在给药日的给药前和各采血时间点观察一般状态。在给药日的给药前测量体重。在给药后3、6、12和24小时的4个时间点采血,测定给药后3、6、12和24小时的血浆中东莨菪碱浓度。
(结果)
血浆中东莨菪碱浓度的测定结果示于表2。*表示因测定值超过定量的上限,因此对样品进行重新分析。a中,动物编号10101从平均值和SD的计算中排除。如表2所示,给药后3小时~24小时在血浆中检测到东莨菪碱。AUC
[表2]
/>
一般状态的观察结果(观察时间点:给药日的给药前和各采血时间点)和给药日的给药前的体重(g)分别示于表3和表4。在一般状态未见异常。
[表3]
[表4]
<试验例2>
(给药)
针对于对大鼠静脉内给予毛果芸香碱(pilocarpine)盐酸盐而引起的唾液分泌,研究了本发明的贴剂所产生的唾液分泌抑制作用。一组使用10只雄性Crl:CD(SD)大鼠(给药时:6周龄)。试验组设为对照组(未给药)、东莨菪碱安慰剂制剂(不含东莨菪碱的贴剂)、东莨菪碱贴剂(实施例5)(以东莨菪碱氢溴酸盐水合物计为0.75mg/2.5cm
[表5]
使用电动推剪和电动剃须刀除去动物背部的被毛。使用油性毛毡笔在给药部位标注点。在除毛部位的中心贴附东莨菪碱安慰剂或东莨菪碱。以与制剂重叠的方式贴附比所贴附的制剂更大的无纺布粘合绷带(Meshpore(注册商标)、NICHIBAN Co.,Ltd.)。缠上粘合性布伸缩绷带(Elastpore东莨菪碱、NICHIBAN Co.,Ltd.)以封闭贴附部位。对照组中,以与用于制剂时同样大小的无纺布粘合绷带(Meshpore(注册商标)、NICHIBAN Co.,Ltd.)覆盖除毛部位后,缠上粘合性布伸缩绷带(Elastpore(注册商标)、NICHIBAN Co.,Ltd.)进行封闭。腹腔内给予0.4mg/kg盐酸美托咪定(Domitor(注册商标)、日本全药工业株式会社)+2mg/kg咪达唑仑(咪达唑仑注射剂10mg、富士制药工业株式会社)+5mg/kg酒石酸布托啡诺(Vetorphale(注册商标)、Meiji Seika Pharma Co.,Ltd.)混合液。为了防止唾液所引起的窒息,在麻醉下切开皮肤,露出气管并插入插管。在东莨菪碱的血浆中浓度上升并稳定的贴附给药后4小时(允许范围:+10分钟以内)静脉内给予1mg/kg(2mL/kg)的毛果芸香碱盐酸盐,在口腔内插入事先用电子分析天平测定了重量的棉球(使用0.082~0.085g的范围的棉球)。在给予毛果芸香碱盐酸盐后30分钟取出被唾液润湿的棉球,快速地用电子分析天秤进行称量。减去插入前的重量,计作唾液分泌量。需要说明的是,根据唾液分泌量的程度,中途与新的棉球进行交换。
(结果和考察)
结果见以下的表6。1)为毛果芸香碱盐酸盐给药后30分钟后的唾液分泌量。*:P<0.05、**:P<0.01与对照组相比的显著差异(Dunnett的多重比较检验)
在对照组与东莨菪碱安慰剂组的唾液分泌量上并未发现统计学上显著的差异。与对照组相比,发现东莨菪碱的0.4和3.6mg/kg组的唾液分泌量显著减少。与对照组相比,东莨菪碱的1.2mg/kg组的唾液分泌量未见显著减少,但有唾液分泌量减少的倾向,由此判断,没有因受试物质的血浆中浓度的偏差而导致统计学上显著的唾液分泌量的减少。由以上结果证实:东莨菪碱通过0.4mg/kg以上的给药,显示对毛果芸香碱诱发唾液分泌的抑制作用。
[表6-1]
[表6-2]
<临床试验1>
(试验药)
东莨菪碱贴剂:1片(2.5cm
东莨菪碱安慰剂:不含东莨菪碱(有效成分)的与真实药剂在外观上无法辨别的制剂;
东莨菪碱注射剂:1管1mL中含有0.5mg东莨菪碱氢溴酸盐水合物的注射剂(Hysco皮下注射剂)。
(用法:用量)
东莨菪碱组
给予东莨菪碱的情况下:
0.75mg组;1次1片东莨菪碱贴剂,在耳廓后部贴附24小时。
1.5mg组;1次2片东莨菪碱贴剂,在耳廓后部贴附24小时。
3mg组;1次4片东莨菪碱贴剂,在耳廓后部贴附24小时。
6mg组;1次8片东莨菪碱贴剂,在耳廓后部贴附24小时。
9mg组;1次12片东莨菪碱贴剂,在耳廓后部贴附24小时。
给予东莨菪碱安慰剂的情况下:
将安慰剂按照各东莨菪碱贴剂给予用量的给予枚数给予1次,在耳廓后部贴附24小时。
东莨菪碱注射剂组:
皮下注射1次东莨菪碱注射剂,1次0.25mg。需要说明的是,受试者是与3mg组相同的受试者。
(给药时段)
设为单次给药。东莨菪碱贴剂贴附24小时。东莨菪碱注射剂则皮下给予1次。
(评价项目)
东莨菪碱贴剂组:
安全性:不良事件、皮肤所见(依据斑贴试验研究班判定标准)、生命体征、12导联心电图(包括QT/QTc评价)、临床检查值;
药效学:唾液量、唾液分泌得分(受试者的VAS)、心率(Holter心电图);
药物动力学:东莨菪碱原形的血浆中浓度、尿中排泄率和药物动力学参数(Cmax、Tmax、AUC和半衰期等);
其他:东莨菪碱贴剂中残留的药物量。
东莨菪碱注射组:
安全性:不良事件、生命体征、12导联心电图、临床检查值;
药物动力学:东莨菪碱原形的血浆中浓度、尿中排泄率和药物动力学参数(Cmax、Tmax、AUC和半衰期等)。
(唾液量的测定)
从测定1小时前起,使受试者的姿势呈卧位,使其安静并禁止摄取饮食品。在测定10分钟前使其呈坐位,之后,为了采集唾液,将脱脂棉固定在左右臼齿与脸颊之间和舌下共计3处,以吸收唾液。唾液分泌量通过测定吸收了唾液的脱脂棉的重量来算出。
测定时期:在给予前、给予后2、4、8、12、24(测定后,去除药剂)、26、28、32、36、48和72小时进行测定。另外,作为基线,在给予前1天的与给予第1天的测定时间相同的时刻测定。需要说明的是,在东莨菪碱注射组中,没有测定唾液量。
(血浆中浓度的测定)
测定东莨菪碱原形。
采血时期:
东莨菪碱贴剂组:在临给予前、给予后0.5、1、2、4、6、8、10、12、24(采血后,去除药剂)、26、28、32、36、48、72小时和第7天进行。东莨菪碱注射组:在临注射前、给予后0.08(5分钟)、0.25(15分钟)、0.5(30分钟)、1、2、4、6、12、24小时进行。
(尿中排泄)
测定东莨菪碱原形。
采尿时期:
东莨菪碱贴剂组:在给予前(随时尿)、给予后0~4、4~8、8~12、12~24(采尿后,去除药剂)、24~32、32~48、48~72小时收集尿。
东莨菪碱注射组:在给予前(随时尿)、给予后0~4、4~8、8~12、12~24小时收集尿。
<临床试验1的结果>
(1)药物动力学分析
(1-1)东莨菪碱的血浆中药物动力学(1-1-1)血浆中浓度变化
对健康成人男性单次给予(贴附24小时)NPC-22时的血浆中东莨菪碱浓度变化(平均值±标准偏差)示于图1。
对健康成人男性单次皮下给予0.25mg东莨菪碱氢溴酸盐水合物注射剂时的血浆中东莨菪碱浓度变化(平均值±标准偏差)示于图2。
给予NPC-22后,血浆中东莨菪碱浓度在给予时段中上升,在剥离NPC-22后仍上升,持续数小时后,大致在28小时(剥离后4小时)以后缓慢下降。血浆中东莨菪碱浓度随着给药量的增加而以高浓度变化。在1.5mg以上的给药组中,即使在第7天(剥离后第6天)仍确认到血浆中东莨菪碱浓度。在6和9mg给药组中,所有受试者在第7天的血浆中东莨菪碱浓度均为定量下限(1.0pg/mL)以上,血浆中浓度分别显示最高浓度的约13%和约11%。在0.75mg给药组中,6名中有2名的血浆中东莨菪碱浓度在所有测定时间点均小于定量下限。
剥离NPC-22时(给予后24小时)的血浆中东莨菪碱浓度的变动系数(CV%)为42.2%~90.6%,在受试者间发现了大的偏差。
单次皮下给予0.25mg东莨菪碱氢溴酸盐水合物注射剂后,血浆中东莨菪碱浓度快速上升,给予15分钟后最高浓度达到1337.5pg/mL。之后单相性减少,在给予后24小时,血浆中东莨菪碱浓度为最高浓度的1/500以下。
(1-1-2)药物动力学参数
对健康成人男性单次给予(贴附24小时)NPC-22时的血浆中东莨菪碱药物动力学参数(平均和标准偏差)示于表7。需要说明的是,在所有测定时间点均小于定量下限的0.75mg给药组的2例从分析中去除。
单次给予(贴附24小时)NPC-22后的血浆中东莨菪碱浓度的C
[表7]
(1-1-3)用量比例性
通过回归分析[幂模型:ln(C
C
(1-1-4)东莨菪碱的尿中浓度和排泄率
单次给予(贴附24小时)NPC-22时的东莨菪碱的累积尿中排泄率的变化(平均值±标准偏差)示于图6。
给予NPC-22后东莨菪碱的尿中排泄率到24小时为止为0.024%~0.065%、到72小时为止为0.093%~0.190%,仅为少量,在任一给药量下尿中排泄率均未发现大的差异。另外,剥离NPC-22后的尿中排泄率的变化与血浆中东莨菪碱浓度的变化充分对应。
单次皮下给予0.25mg东莨菪碱氢溴酸盐水合物注射剂时的东莨菪碱的累积尿中排泄率的变化(平均值±标准偏差)示于图7。
皮下给予0.25mg东莨菪碱氢溴酸盐水合物注射剂后24小时为止的东莨菪碱的尿中排泄率为5.767%,相较于给予NPC-22后72小时为止(0.093%~0.190%)显示出更高值。
(1-1-5)NPC-22和东莨菪碱氢溴酸盐水合物注射剂的暴露量的比较
利用药物动力学参数(C
在东莨菪碱皮下给药组中,血浆中东莨菪碱的C
若与NPC-22的3mg给药组相比,则东莨菪碱皮下给药组的C
[表8]
表8:东莨菪碱皮下给药组与NPC-22给药组的暴露量的比较
比=(东莨菪碱)/(NPC-22)
差异=(NPC-22)-(东莨菪碱)。
(2)药物的用量、药物浓度和它们与反应的关系
(2-1)血浆中东莨菪碱浓度与唾液分泌量的关系
对于给予了NPC-22带的NPC-22组的所有受试者的血浆中东莨菪碱浓度的测定值和同一时间点的唾液分泌量自基线的变化量和变化率,以散布图表示,算出回归参数、相关系数和90%置信区间的值,所得结果示于图8。
血浆中东莨菪碱浓度与唾液分泌量的变化量和变化率存在弱的负相关(相关系数:-0.248、-0.289),发现随着血浆中东莨菪碱浓度的升高,唾液分泌量有减少的倾向。
(2-2)血浆中东莨菪碱浓度与心率(12导联心电图)的关系
对于给予了NPC-22带的NPC-22组的所有受试者的血浆中东莨菪碱浓度的测定值与心率(12导联心电图)的自基线的变化量和变化率,以散布图表示,算出回归参数、相关系数和90%置信区间的值(图9)。
血浆中东莨菪碱浓度与心率的变化量和变化率存在弱的负相关(相关系数:-0.229、-0.230),发现随着血浆中东莨菪碱浓度的升高,心率有减少的倾向。
(3)药物残留量的分析
给予NPC-22后回收的制剂中残留的药物量的分析
单次给予(24小时贴附)0.75mg、1.5mg、3mg、6mg或9mg NPC-22时,给予后回收的制剂的东莨菪碱氢溴酸盐水合物残留量和残留率的摘要统计量示于表9。
NPC-22(0.75mg/1片)的平均残留率(最小值、最大值)为71.3%(58.3%、79.8%),变动系数(CV%)为6.88%,在残留的药物量上没有发现大的偏差。另外,由给予后的制剂中残留的药物量推定的东莨菪碱的平均吸收率(SD)为28.7%(4.90)。
[表9]
表9:药物残留量的摘要
* ** *** <安全性> (1)不良事件和副作用 本试验中出现的不良事件和副作用示于表10。就不良事件而言,发现NPC-22组4/30例(13.3%)、安慰剂组2/10例(20.0%)、东莨菪碱注射剂组5/8例(62.5%),但任何组均未发现严重的不良事件或导致试验中止等的不良事件。按NPC-22的给药量划分的不良事件为0.75mg组1/6例、1.5mg组1/6例、3mg组0/6例、6mg组1/6例、9mg组1/6例,其中判断为副作用的是0.75mg组的1/6例。0.75mg组的副作用如下:给药后第7天(剥离后第6天)看到的白细胞数增加、淋巴细胞数减少、嗜中性粒细胞数增加,分别在给药后第11天消失。 [表10] 表10:不良事件和副作用 (2)依据日本斑贴试验研究班判定标准的皮肤所见 依据日本斑贴试验研究班判定标准的皮肤所见示于表11。 在任何判定时期均只发现“轻度的红斑”。剥离后1小时以0.75mg组6/6名、1.5mg组1/6名、3mg组2/6名、6mg组5/6名、9mg组2/6名发现轻度的红斑,剥离后24小时依次以3/6名、0/6名、0/6名、0/6名、2/6名发现轻度的红斑,但随着用量的增加,皮肤所见并没有恶化,在临床上不会成为大的问题。另一方面,即使是安慰剂组的皮肤所见,也在剥离后1小时以7/10名发现了轻度的红斑,剥离后24小时以2/10名发现了轻度的红斑,是与NPC-22组同等程度的皮肤所见。 [表11] 表11:皮肤所见 *第2天:剥离后1小时;第3天:剥离后24小时。 <关于药物动力学、药效学和药物残留量以及安全性的成果的结论> 给予NPC-22后,血浆中东莨菪碱浓度在给药时段中上升,剥离NPC-22后仍上升,持续数小时后,大致在28小时(剥离后4小时)以后缓慢下降。血浆中东莨菪碱浓度随着给药量的增加而以高浓度变化,在1.5mg以上的给药组中,第7天(剥离后第6天)仍有确认到血浆中东莨菪碱浓度的例子。 剥离NPC-22时(给予后24小时)的血浆中东莨菪碱浓度的变动系数(CV%)为42.2%~90.6%,在受试者间发现了大的偏差。 单次给予NPC-22后的血浆中东莨菪碱浓度的C 给予NPC-22后72小时为止的东莨菪碱的尿中排泄率为0.093%~0.190%,向尿中的排泄仅为少量。 剥离NPC-22后的尿中排泄率变化与血浆中东莨菪碱浓度变化充分对应。 若与NPC-22的3mg、6mg和9mg给药组相比,则东莨菪碱皮下给药组的C 若与NPC-22的3mg、6mg和9mg给药组相比,则东莨菪碱皮下给药组的AUC 发现血浆中东莨菪碱浓度与唾液分泌量的变化量和变化率呈弱的负相关(相关系数:-0.248、-0.289),随着血浆中东莨菪碱浓度的升高,发现了唾液分泌量减少的倾向。 发现血浆中东莨菪碱浓度与心率的变化量和变化率呈弱的负相关(相关系数:-0.229、-0.230),随着血浆中东莨菪碱浓度的升高,发现了心率减少的倾向。 NPC-22(0.75mg/1片)的平均残留率(最小值、最大值)为71.3%(58.3%、79.8%)、变动系数(CV%)为6.88%,在残留的药物量上没有发现大的偏差。另外,由给药后的制剂中残留的药物量推定的东莨菪碱的平均吸收率(SD)为28.7%(4.90)。 NPC-22的不良事件也没有用量依赖性的增加,所出现的不良事件的程度为轻度,在耐受性上没有发现问题。 <临床试验2> (试验药) 东莨菪碱贴剂:1片(2.5cm (用法:用量) 通过4部位4期交叉法(非盲检)在同一受试者的耳廓后部、胸部、上臂部或腹部分别单次贴附9mg NPC-22(12片NPC-22)24小时。停药时段(从剥离药剂起到下次贴附药剂前的时段)设为14天。 (给药时段) 设为单次给药。贴附24小时。 (评价项目) 安全性:不良事件、皮肤所见(依据日本斑贴试验研究班判定标准)、生命体征、12导联心电图、临床检查; 药物动力学:东莨菪碱原形的血浆中浓度和药物动力学参数(Cmax、Tmax、AUC和半衰期等); 其他:东莨菪碱贴剂中残留的药物量。 (血浆中浓度的测定) 测定东莨菪碱原形。 采血时期: 在给药前、给药后8、12、24(在剥离试验药前采血)、26、28、32、36、48、72小时、第7天和第14天进行。 <临床试验2的结果> 本试验的1名受试者因在交叉法I期的耳廓后部给药时出现的不良事件而成为中止例,故在2期以后没有对预定的胸部、上臂部和腹部给药。因此,按本试验的给药部位划分的例数如下:耳廓后部16名、胸部、上臂部或腹部各15名。 (1)药物动力学分析 (1-1)东莨菪碱的血浆中药物动力学 (1-1-1)血浆中浓度变化 对健康成人男性单次给予(贴附24小时)NPC-22时的各给药部位的血浆中东莨菪碱浓度变化(平均值±标准偏差)示于图10。 对耳廓后部给予NPC-22后,血浆中东莨菪碱浓度在给药时段中上升,剥离NPC-22后仍上升,持续数小时后,大致在28小时(剥离后4小时)以后缓慢下降。 在对除耳廓后部(Postauricular)以外的胸部(Chest)、上臂部(Upper Arm)和腹部(Abdomen)给药时,与耳廓后部相比,任一个部位的血浆中东莨菪碱的最高浓度均显示极低的值,从血浆中消除也慢。 (1-1-2)药物动力学参数 对健康成人男性单次给予(24小时贴附)NPC-22时的各给药部位的血浆中东莨菪碱药物动力学参数(平均和标准偏差)示于表12。 关于血浆中东莨菪碱浓度的Cmax和AUC [表12] (2)药物残留量的分析 给予NPC-22后回收的制剂中残留的药物量 根据给予NPC-22后回收的制剂,研究了药物残留率和推定吸收率。 NPC-22(0.75mg/1片)在每个给药部位的平均残留率为66.8~68.5%、变动系数(CV%)为6~9.29%,在残留率上没有发现大的偏差。另外,由给药后的制剂中残留的药物量推定的东莨菪碱的平均推定吸收率为31.5~33.2%,无关乎给药部位,在平均残留率和平均推定吸收率上都没有发现差别。 <安全性> (1)不良事件和副作用 本试验中出现的不良事件示于表13。 以耳廓后部给药时的2/16名(12.5%)、腹部给药时的1/15名(6.7%)发现了不良事件,但均为轻度,没有出现严重的不良事件或导致试验中止等的不良事件。另外,任何不良事件与药剂的因果关系均判定为“无关”,不视为副作用。 [表13] 表13:不良事件 *1:对耳廓后部给药时成为中止例,没有对其他部位进行给药; *2:给药前1天的检查值为CPK:124U/L、AST:23U/L、LDH:177U/L。 (2)依据日本斑贴试验研究班判定标准的皮肤所见 将依据日本斑贴试验研究班判定标准的皮肤所见示于表14。 各部位在任何判定时期均只发现了“轻度的红斑(±)”。剥离后1小时以耳廓后部1/16名、胸部4/15名、上臂部8/15名、腹部1/15名发现了轻度的红斑,剥离后24小时在上臂部以1/15名发现了轻度的红斑,但在临床上均未成为大的问题。 [表14] 表14:皮肤所见 在耳廓后部给药时的1例发生不良事件而中止给药,因此没有对其他部位进行给药; *1:第2天:剥离后1小时,第3天:剥离后24小时; -:无反应,±:轻度的红斑,+:红斑,++:红斑+浮肿、丘疹, +++:红斑+浮肿+丘疹+小水疱,++++:大水疱。 <关于药物动力学和药物残留量以及安全性的成果的结论> 在各给药部位单次给予NPC-22时的血浆中东莨菪碱浓度,在耳廓后部给药时以高浓度变化,但在胸部、上臂部和腹部则以极低的浓度变化。与胸部、上臂部和腹部给药时相比,在耳廓后部给药时的血浆中东莨菪碱浓度的Cmax和AUC非常高,Cmax分别为12.4倍、16.4倍和27.1倍,AUC0-312分别为6.2倍、7.7倍和9.1倍。 对耳廓后部、胸部、上臂部和腹部给予(贴附24小时)NPC-22后回收的NPC-22的平均残留率为66.8%~68.5%,平均推定吸收率为31.5%~33.2%,在给药部位间没有大的差别。 在NPC-22给药中出现的不良事件均为轻度,耐受性没有发现问题,在给药部位间也没有大的差别。另外,皮肤所见也只看到了轻度的红斑,在临床上不会成为大的问题,在给药部位间没有大的差别。 在本试验之前实施的以健康成人为对象的NPC-22单次给药试验中,随着血浆中东莨菪碱浓度的提高,发现了唾液分泌量减少的倾向。 本试验中看到的不良事件和皮肤所见在给药部位间没有发现大的差别,但胸部、上臂部或腹部给药时的血浆中东莨菪碱浓度在任何部位相较于耳廓后部而言都非常低,因此NPC-22的给药部位以耳廓后部为宜。
- 对由神经退行性疾病、肌肉退行性疾病、或神经-肌肉退行性疾病所致的组织退化、伤害或损伤进行治疗或预防的方法、或对受到所述疾病的不利影响的组织进行恢复的方法
- 用于治疗炎性疾病、退行性疾病和神经退行性疾病的化合物、组合物和方法
