用于抑制透析转化或肾死亡的药剂
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及对特定的患者组给与的用于抑制透析转化或肾死亡的药剂。
背景技术
需要透析、肾移植的末期肾功能衰竭患者在全世界持续增加,其显著的社会负担成为问题。
导致末期肾功能衰竭的原发疾病中,有慢性肾小球肾炎等原发性肾小球疾病、糖尿病性肾病等继发性肾小球疾病、肾小管和间质性肾炎等。慢性肾功能衰竭之中,原发疾病为糖尿病性肾病和非糖尿病性肾病中病态存在不同,国际肾病指南Kidney Disease:Improving Global Outcomes(以下简称为KDIGO)于2012年修订的慢性肾病(以下简称为CKD)的重症度分类中,大致分为原发疾病为糖尿病的情况和为非糖尿病的情况。
该非糖尿病性的肾损伤或慢性肾功能衰竭之中,原发性肾小球疾病和肾硬化症占主要部分。近年来,伴随糖尿病的增加,糖尿病性肾病占透析的原因疾病的比例在全世界增加。另一方面,在东亚,以IgA肾病为首的原发性肾小球疾病占透析理由的首位或2位,特别是在中国占透析原因的首位。此外,肾硬化症也在亚洲的几乎所有国家占透析理由的第3位,除此之外,随着近年的动脉硬化性疾病的增加,持续存在全世界增大的倾向。
此外,近年来,针对糖尿病的治疗广泛使用新的糖尿病治疗剂,患者的血糖控制进一步良好进行,因此通过用这些药剂治疗而期待糖尿病性肾病的预后的改善,在部分药剂中在大规模临床试验中得到良好的成绩。然而,非糖尿病性的慢性肾损伤的治疗的方法的现状是未有进展。
一旦损坏的肾小球无法再生,因此针对慢性肾损伤的治疗的目的在于尽可能减缓肾损伤的进行。作为现行的实际治疗,除了盐分限制、低蛋白饮食中心的饮食疗法之外,还使用以血管紧张素转化酶抑制药(以下简称为ACEI)、血管紧张素受体拮抗药(以下简称为ARB)为首的降压药。此外,透析临近而确认到尿毒症症状的情况下,使用从消化道内吸附去除成为其原因的物质的球形吸附炭(在日本、韩国和中国台湾等国家和地区销售)。
然而,即使通过这些治疗,末期肾功能衰竭的患者数在全世界也持续增加,迫切期望能够切实延缓慢性肾功能衰竭的进行的新治疗法。
贝前列素钠(以下简称为BPS)是在日本发明的前列腺环素(也称为PGI
此外,报告了对慢性肾功能衰竭患者进行BPS 1次20μg、1日3次、6个月给与时,表示肾功能的降低速度的血清肌酐值的倒数的时间变化直线的斜率在BPS给与组中变缓(非专利文献2)。本临床例中使用的药剂是在当时日本作为医药品而获取制造销售许可的BPS速释片的Dorner(商标)片(Astellas制药株式会社)或者Procylin(商标)片(科研制药株式会社)。
进一步,接着非专利文献2,报告了对慢性肾功能衰竭患者将BPS进行1次20μg、1日3次、最大至54个月的长期持续给与的结果(非专利文献3)。根据本结果,BPS给与开始前的血清肌酐值为1.9mg/dl以下的患者组中,最大54个月未观察到透析转化,但BPS给与开始前的血清肌酐值为2.8mg/dl以上的患者组在24个月以内转移至透析,血清肌酐值为1.9~2.8mg/dl的患者组中,如果血清肌酐值为2.2mg/dl以上,则确认不到BPS的效果。
BPS速释片中,需要1日服药3次至4次,因此开发了1日2次给与型的BPS缓释片,以肺动脉性肺高血压症作为适应症在日本获得制造销售许可,作为Careload(商标)LA片(Astellas制药株式会社)或Berasus(商标)LA片(科研制药株式会社)而被临床应用。使用该BPS缓释片实施了将以原发性肾小球疾病和肾硬化症患者作为原发疾病的慢性肾功能衰竭患者作为对象的临床试验。
首先,作为剂量设定试验,使用BPS缓释片,作为1日用量,以120μg或240μg、1日2次给与的用法·用量,实施6个月给与的试验。作为主要评价项目的肌酐的倒数的时间变化直线的治疗期与观察期的斜率之差未确认到240μg组相对于安慰剂组的优越性。同样也未确认到120μg组相对于安慰剂组的优越性。然而,针对本评价项目,所有实药组均高于安慰剂组,但120μg组有效性更高,剂量响应性也不明确。作为有效性的指标,针对给与期间的血清肌酐值,安慰剂组与给与开始前相比上升1.169倍,与此相对地,BPS120μg和240μg给与组中,其上升各自抑制为1.069和1.064倍,暗示了有效性(非专利文献4)。
基于本结果,设计了P-IIb/III试验(非专利文献5),在包括日本在内的亚洲7国实施(CASSIOPEIR试验)。其是以血清肌酐值的加倍、到达6mg/ml、透析转化和肾移植作为肾复合终点,通过120μg或240μg的BPS缓释片的给与,以与安慰剂给与相比至其表现为止的期间是否被延长作为主要评价项目的试验,BPS的给与期间为2~4年。
对象患者与P-II试验相同,为以原发性肾小球疾病和肾硬化症患者作为原发疾病的慢性肾功能衰竭患者,入组时的血清肌酐值为2.0~4.5mg/dl。本试验的结果报告于非专利文献6,120μgBPS给与组和240μgBPS给与组的两组均显示出不仅肾复合终点,而且向透析转化为止的期间完全未得到抑制。
在人中,正在研究作为肾功能评价的指标,通过考虑血清肌酐值、性别、根据需要的人种而表示的估算肾小球过滤率(以下简称为eGFR)降低何种程度能够预测向透析的转移、肾死亡。其结果是,报告了如果以eGFR与初始值相比降低30%~40%(血清肌酐值中,相当于30%~40%以上的上升)为指标,则作为预测到达透析、移植的指标是有用的,但与其相比更少的降低率中,用于预测透析、移植是不妥当的(非专利文献7)。据此,作为P-II试验的结果,在人中,安慰剂组中,血清肌酐值与给与前相比上升至1.167倍,但通过给与BPS其上升抑制至1.069或者1.064倍,根据该见解,无法预测至透析、移植为止的期间的延长,事实上以透析转化作为事件的实际的临床试验中也未确认透析、肾死亡的抑制(非专利文献6)。
近年来特别受到关注的是,慢性肾功能衰竭患者的营养障碍、特别是低营养状态不仅是慢性肾功能衰竭的进行,而且是预后的重要风险因素。作为慢性肾功能衰竭患者的营养障碍被认为与单纯的低营养存在本质差异,国际肾疾病营养代谢学会和国际肾脏学会在2008年提出了蛋白质能量消耗(以下简称为PEW)这一新概念。PEW是指在肾功能衰竭患者中,体蛋白(骨骼肌·血液中的蛋白质)、能量源(体脂肪)的储存量减少而引起的低营养状态。此外,PEW中发生伴随消化道·中枢神经系的食欲相关激素的异常的食欲降低,除此之外,因由于代谢性酸中毒·炎症等而导致的蛋白分解代谢·能量代谢亢进,从而形成发生不仅脂肪、而且肌肉等体蛋白也损失的肌肉减少症(肌肉量减少)的病态。
此外,通常的低营养是因营养摄取量的相对不足而导致的,但在肾功能衰竭的患者中,尿毒症症状、炎症、体蛋白质的分解代谢亢进等与消耗相关的因素叠加,由此有时还确认到与营养摄取量的减少不相关的除脂肪体重的减少,其被认为是PEW的特征之一。
PEW可以通过以下的表1中示出的诊断基准诊断(非专利文献8)。大致有4个类别,分为“血清化学”、“体重”、“肌肉质量”“饮食摄入量”,符合各个类别中的至少一个项目的类别为4个之中3个以上的情况被诊断为PEW,据称保守期的CKD患者的约30至50%满足PEW的诊断基准。
[表1]
肾疾病患者的低营养状态PEW当然是预后不良因素,不引起PEW是非常重要的。进一步,一般的营养状态的评价项目也包括在该PEW诊断基准中,因此可以认为即使不满足PEW的诊断基准(符合至少一个项目的类别并非4个之中3个以上的情况下),进行营养管理以尽量减少符合的项目是重要的(非专利文献8)。
低营养的评价中,总淋巴细胞数(TLC)也大量使用,作为免疫能力的指标。TLC(/mm
慢性肾功能衰竭中,为了尽可能延缓肾功能的降低,大多实施以蛋白质的摄取的限制作为中心的饮食疗法,此外,作为营养障碍的风险患者的老年人多也成为导致营养障碍的风险因素。
恶病质是指被规定为“因基础疾病而引起,以无论有无脂肪量的减少、肌肉量均减少为特征的复合性代谢异常的综合征。”,被认为是PEW危重化的阶段。恶病质的临床的特征在成人的情况下表现为体重减少,儿童的情况下表现为生长障碍。
此外,肌肉减少症通过“在老年期观察到的骨骼肌量的减少和肌肉力量或身体功能(歩行速度等)的降低”定义。根据European Working Group on Sarcopenia in OlderPeople(欧洲老年人肌肉减少症工作组,以下简称为EWGSOP)而发表操作定义后,报告了基于包括日本人在内的亚洲的流行病学数据的Asian Working Group for Sarcopenia(亚洲肌肉减少症工作组,以下简称为AWGS)等各种定义。它们均以骨骼肌量的减少为必须,包括肌肉力量降低或身体功能降低中任一者或两者(非专利文献9)。近年来,因各种病态而导致的骨骼肌量的降低、即所谓继发性肌肉减少症受到关注,慢性肾病或者慢性肾功能衰竭也作为大量发生继发性肌肉减少症的疾病而已知。慢性肾病患者中的肌肉减少症的发病、进展中,可以认为与用于缓解肾功能的降低的蛋白质的摄取限制也相关。
虚弱被认为是“伴随老龄而身心的活力(运动功能、认知功能等)降低,存在多种慢性疾病的并发等影响,生活功能受到障碍,为出现身心的脆弱性的状态,但另一方面通过适当的介入·支援,能够维持提高生活功能的状态”(非专利文献10),是指在健康状态和日常生活中需要支持的看护状态的中间态。迄今针对虚弱,提出了多种定义(非专利文献11)。慢性肾功能衰竭患者中并发虚弱的情况下,被认为其预后不良。
最近,SGLT2抑制剂在糖尿病性肾病中极其有效的大规模临床试验成绩被发表,受到关注。然而,SGLT2抑制剂主要作用机制是抑制糖从肾小管的再吸收,导致体重的减少。该体重减少中,已知不仅体脂肪的减少,而且肌肉量的减少也同程度参与,因此对PEW等营养障碍的患者、肌肉量少的肌肉减少症、虚弱的患者给与时,无法否定助长这些障碍、肾功能衰竭的恶化、死亡风险的上升的风险,因此不能说必然容易使用。
此外,报告了大鼠慢性肾功能衰竭模型中,通过BPS和ARB、ACEI等血管紧张素系抑制剂的组合使用,增强了血管紧张素系抑制剂的肾损伤进行抑制效果、即血清肌酐值的上升抑制效果(专利文献2)。但是,本例中,仅记载了大鼠肾功能衰竭模型中,ARB和ACEI具有同等组合使用效果,针对临床中通过BPS和ACEI的组合使用而能够抑制透析或者肾死亡,没有任何教导。
像这样,根据以往的公知文献,可以认为在BPS的速释片或缓释片中任一情况下,在人中,未确认至透析转化、用透析或肾移植定义的肾死亡为止的期间的延长。
现有技术文献
专利文献
专利文献1:国际公开第2000/067748号
专利文献2:国际公开第2004/098611号
非专利文献
非专利文献1:Takenaka et al. J Vet Intern Med (2018) 32, 236.
非专利文献2:Fujita et al. Prostaglandins, Leukotrienes and EssentialFatty Acids (2001) 65 (4), 223-227.
非专利文献3:藤田等 血管医学(2006), Vol. 7, p.281.
非专利文献4:Koyama et al. BMC Nephrology (2015) 16, 165.
非专利文献5:Nakamoto et al. BMC Nephrology (2014) 15, 153.
非专利文献6:Nakamoto et al. Ther Apher Dial. 2019 May 23. doi:10.1111/1744-9987.12840.
非专利文献7:Levey et al. Am J Kidney Dis. (2014) 64, 821-835.
非专利文献8:滨田等 四国医志 69卷5,6号p.211~214,2013.
非专利文献9:肌肉减少症诊疗指南2017年版2页)
非专利文献10:平成27年度日本厚生劳动科学研究费补助金“后期老年人的保健事业走向相关研究”平成27年度总括·分担研究报告书
非专利文献11:野藤等,月刊地域医学 Vol.32 No. 4, p. 312-320, 2018.
非专利文献12:Kajikawa et al. Arzneimittelforschung (1989) 39, 495-9.
非专利文献13:Shimamura et al. J Clin Pharmacol. (2017) 57, 524-535.
非专利文献14:Levey, et al.AnnInternMed150(2009),604-612.
非专利文献15:日本肾脏学会,基于询证的CKD诊疗指南、(2009)、3页。
发明内容
发明要解决的课题
本发明的目的在于,提供通过对特定的患者组给与含有式(I)所示的化合物作为有效成分的缓释性制剂,从而抑制透析转化或肾死亡的药剂。
用于解决课题的手段
即,本发明的主旨如下。
(1)用于抑制透析转化或肾死亡的药剂,其为含有下述通式(I)所示的化合物作为有效成分的缓释性制剂,
[化1]
[式中,R表示氢或药理学可接受的阳离子]
前述通式(I)所示的化合物以每日给与220~260μg的方式用于血清肌酐值为2.0mg/dl以上且低于3.0mg/dl的原发性肾小球疾病或肾硬化症患者。
(2)根据上述(1)所述的药剂,其中,上述通式(I)所示的化合物为贝前列素钠。
(3)根据上述(1)或(2)所述的药剂,其中,上述原发性肾小球疾病或上述肾硬化症患者的通过慢性肾脏病流行病学共同研究(Chronic Kidney Disease EpidemiologyCollaboration:以下简称为CKD-EPI)式算出的估算肾小球过滤率为15ml/分钟/1.73m
(4)根据上述(1)~(3)中任一项所述的药剂,其中,将含有上述通式(I)所示的化合物作为有效成分的缓释性制剂向前述原发性肾小球疾病或前述肾硬化症患者以餐后1次的方式以前述通式(I)所示的化合物计给与120μg时的给与后2~6小时的血浆中浓度为平均50pg/ml以上。
(5)根据上述(1)~(4)中任一项所述的药剂,其中,组合血管紧张素转化酶抑制药作为有效成分。
(6)根据上述(1)~(4)中任一项所述的药剂,其与含有血管紧张素转化酶抑制药作为有效成分的另外的制剂以同时、分别或依次给与的方式使用。
(7)根据上述(1)~(4)中任一项所述的药剂,其为在用于抑制透析转化或肾死亡的治疗或预防中,用于以同时、分别或依次给与的方式使用的组合制剂,其分别包含以下的(a)和(b)的2种制剂:
(a)含有上述通式(I)所示的化合物作为有效成分的口服缓释性制剂
(b)含有血管紧张素转化酶抑制药作为有效成分的制剂。
(8)根据上述(1)~(4)中任一项所述的药剂,其与血管紧张素转化酶抑制药组合使用。
(9)用于抑制透析转化或肾死亡的药剂,其为含有下述通式(I)所示的化合物作为有效成分的缓释性制剂,
[化2]
[式中,R表示氢或药理学可接受的阳离子]
前述通式(I)所示的化合物向具有营养障碍的原发性肾小球疾病或肾硬化症患者以每日给与220~260μg的方式使用。
(10)根据上述(9)所述的药剂,其中,上述通式(I)所示的化合物为贝前列素钠。
(11)根据上述(9)或(10)所述的药剂,其中,上述营养障碍为蛋白质能量消耗(PEW)或其前期。
(12)根据上述(9)~(11)中任一项所述的药剂,其中,上述营养障碍为满足PEW的4个构成要素中至少1个的营养障碍。
(13)根据上述(9)~(12)中任一项所述的药剂,其中,上述营养障碍为满足身体质量指数(BMI)低于23或血清白蛋白低于3.8g/dl的营养障碍。
(14)根据上述(9)~(13)中任一项所述的药剂,其中,上述营养障碍为恶病质、肌肉减少症或虚弱。
(15)根据上述(9)~(14)中任一项所述的药剂,其中,对象患者的血清肌酐值为2.0mg/dl以上且低于3.0mg/dl。
(16)根据上述(9)~(14)中任一项所述的药剂,其中,对象患者的通过慢性肾脏病流行病学共同研究(Chronic Kidney Disease Epidemiology Collaboration:CKD-EPI)式算出的估算肾小球过滤率(eGFR)为15ml/分钟/1.73m
(17)根据上述(9)~(16)中任一项所述的药剂,其中,将含有前述通式(I)所示的化合物作为有效成分的缓释性制剂向前述原发性肾小球疾病或前述肾硬化症患者以餐后1次的方式以前述通式(I)所示的化合物计给与120μg时的给与后2~6小时的血浆中浓度为平均50pg/ml以上。
(18)根据上述(9)~(17)中任一项所述的药剂,其中,组合血管紧张素转化酶抑制药作为有效成分。
(19)根据上述(9)~(18)中任一项所述的药剂,其中,上述营养障碍为低营养状态。
(20)根据上述(9)~(19)中任一项所述的药剂,其中,上述营养障碍用总淋巴细胞数低于1500/mm
(21)用于抑制透析转化或肾死亡的药剂,其为含有下述通式(I)所示的化合物作为有效成分的缓释性制剂,
[化3]
[式中,R表示氢或药理学可接受的阳离子]
对通过慢性肾脏病流行病学共同研究(Chronic Kidney Disease EpidemiologyCollaboration:CKD-EPI)式算出的估算肾小球过滤率(eGFR)为15ml/分钟/1.73m
(22)根据上述(21)所述的药剂,其中,上述通式(I)所示的化合物为贝前列素钠。
(23)根据上述(21)或(22)所述的药剂,其中,将含有前述通式(I)所示的化合物作为有效成分的缓释性制剂向前述原发性肾小球疾病或前述肾硬化症患者以餐后1次的方式以前述通式(I)所示的化合物计给与120μg时的给与后2~6小时的血浆中浓度为平均50pg/ml以上。
(24)根据上述(21)~(23)中任一项所述的药剂,其中,组合血管紧张素转化酶抑制药作为有效成分。
(25)用于抑制透析转化或肾死亡的药剂,其包含含有下述通式(I)所示的化合物作为有效成分的缓释性制剂与血管紧张素转化酶抑制药作为有效成分的组合,
[化4]
[式中,R表示氢或药理学可接受的阳离子]
对原发性肾小球疾病或肾硬化症患者以1日给与220~260μg的方式使用上述通式(I)所示的化合物。
(26)根据上述(25)所述的药剂,其与含有血管紧张素转化酶抑制药作为有效成分的另外的制剂以同时、分别或依次给与的方式使用。
(27)根据上述(25)或(26)所述的药剂,其是在用于抑制透析转化或肾死亡的治疗或预防中,用于以同时、分别或依次给与的方式使用的组合制剂,分别包含以下的(a)和(b)的2种制剂,
(a)含有上述通式(I)所示的化合物作为有效成分的口服缓释性制剂
(b)含有血管紧张素转化酶抑制药作为有效成分的制剂。
(28)根据上述(25)~(27)中任一项所述的药剂,其与血管紧张素转化酶抑制药组合使用。
发明的效果
本发明的药剂通过对治疗开始前的血清肌酐值为2.0mg/dl以上且低于3.0mg/dl的原发性肾小球疾病或肾硬化症患者给与,能够抑制透析转化或肾死亡。
此外,本发明的组合制剂通过对慢性肾功能衰竭患者给与,能够抑制透析转化或肾死亡。
进一步,本发明的药剂通过对用CKD-EPI式算出的估算肾小球过滤率(eGFR)为15ml/分钟/1.73m
进一步,本发明的药剂通过对在治疗开始前并发营养障碍的原发性肾小球疾病或肾硬化症患者给与,能够抑制透析转化。
附图说明
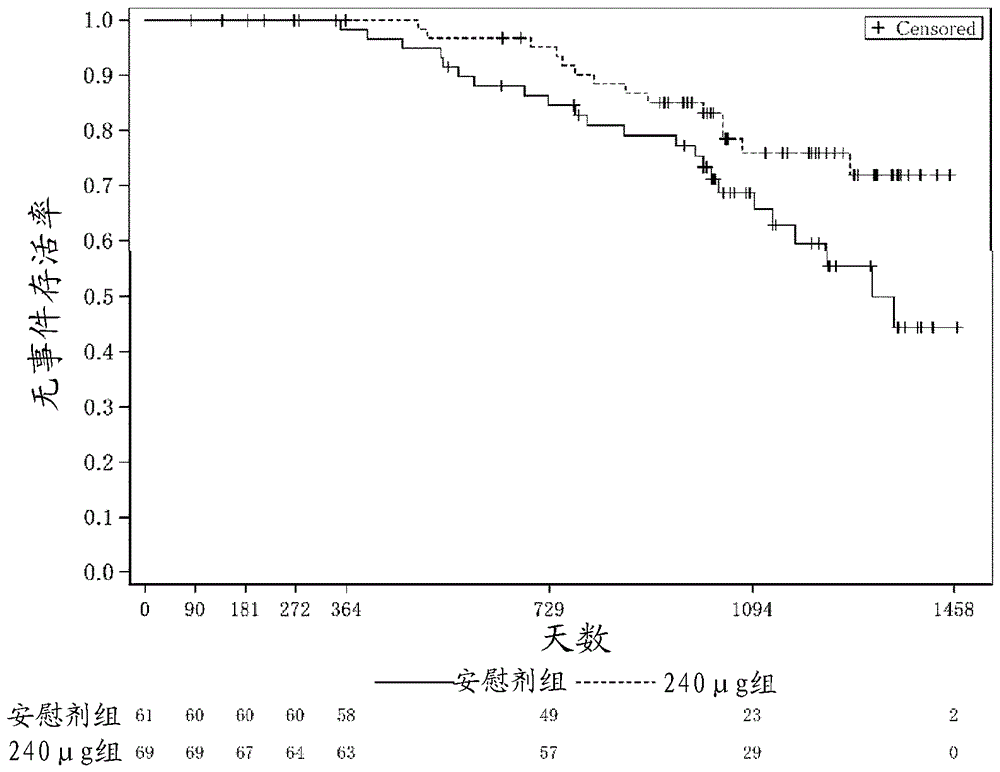
图1是示出对给与开始前的血清肌酐值为2.0mg/dl以上且低于3.0mg/dl的日本人患者组给与BPS或安慰剂后的无事件生存率(event-free survival)的推移的图。作为事件,设为透析转化。
图2是示出在餐后给与1次120μg的BPS缓释片时的给与后2~6小时的血浆中浓度为平均50pg/ml以上的日本人患者组中,将事件设为透析转化时的1日240μg的BPS给与组的结果的图。
图3是示出240μg的日本人和除了日本之外的亚洲人的BPS给与组之中,进行与ACEI的组合使用的患者组、和不进行组合使用的患者组中,将透析转化设为事件的情况的结果的图。
图4是示出对给与开始前的身体质量指数(以下简称为BMI)低于23的日本人和除了日本人之外的亚洲人的慢性肾功能衰竭患者,给与BPS240μg或安慰剂后的无事件生存率的推移的图。作为事件,设为透析转化。
图5是示出对给与开始前的BMI低于23的日本人的慢性肾功能衰竭患者,给与BPS240μg或安慰剂后的无事件生存率的推移的图。作为事件,设为透析转化。
图6是示出对给与开始前的血清白蛋白低于3.8g/dl的日本人的慢性肾功能衰竭患者,给与BPS240μg或安慰剂后的无事件生存率的推移的图。作为事件,设为透析转化。
图7是示出对给与开始前的总淋巴细胞数低于1500/mm
具体实施方式
本发明中能够使用的缓释性制剂含有下述通式(I)所示的化合物。
[化5]
[式中,R表示氢或药理学可接受的阳离子]
作为药理学上可接受的阳离子,可以举出钠、钾和钙等碱金属、碱土金属、单-,二-,三甲基胺、甲基哌啶、单-,二-,三乙醇胺和赖氨酸所代表的胺类以及碱性氨基酸等,其中,特别优选使用钠和钾。
此外,式(I)所示的化合物之中,优选使用贝前列素或其药理学可接受的盐。其中,除了贝前列素之外,特别优选使用作为贝前列素的钠盐的BPS或者贝前列素的钾盐。
BPS包含4个立体异构体,其药效主要由BPS-314d(钠(+)-(1R,2R,3aS,8bS)-2,3,3a,8b-四氢-2-羟基-1-[(E)-(3S,4S)-3-羟基-4-甲基-1-辛烯-6-炔基]-1H-环戊并[b]苯并呋喃-5-丁酸盐)承担(非专利文献12)。因此,还优选使用仅包含作为BPS的活性成分的BPS-314d的制剂。给与BPS的情况的BPS-314d的血浆中浓度已知AUC(area under theblood concentration time curve;表示血中浓度的时间经过的曲线(药物血中浓度-时间曲线)与横轴(时间轴)所包围的部分的面积)、Cmax(最高血中浓度)均为约1/4(非专利文献13)。因此,在给与单独包含BPS的活性体(例如BPS-314d)的制剂的情况下,有效的1日的BPS-314d的给与量达到BPS的给与量的1/4,为55~65μg。进一步,也特别优选使用贝前列素钾的活性体(钾(+)-(1R,2R,3aS,8bS)-2,3,3a,8b-四氢-2-羟基-1-[(E)-(3S,4S)-3-羟基-4-甲基-1-辛烯-6-炔基]-1H-环戊并[b]苯并呋喃-5-丁酸盐),但该情况的1日给与量为57~67μg。
BPS制剂中,速释片市售,但BPS的血中半衰期短达约1小时,因此需要1日服药3次至4次。此外,因血浆中浓度急剧上升,导致潮红、头痛等副作用的发生频率上升,因此能够给与的剂量受限。因此,作为本发明的药剂,使用贝前列素或其药理学可接受的盐、优选BPS的缓释性制剂、特别是口服缓释性制剂。
缓释性制剂如在日本药学会的药学术语解说中所记载的,是通过延缓有效成分从制剂的释放,减少服用次数,将血中的有效成分浓度长时间保持恒定,由此避免副作用的制剂。
本发明中的缓释性制剂被定义为满足以下的溶出试验的溶出行为的制剂。即,取1个本剂,作为试验液使用添加聚山梨酯80、0.5ml的水50ml,通过桨法(其中,使用沉降装置)以每分钟100转进行试验时,3小时溶出率达到25±10%、第6小时溶出率达到50±10%、第10小时溶出率达到70%以上的制剂,优选在pH1.2~pH7.5的pH的范围中,满足本溶出率。
通过满足这样的条件,通过BPS的有效血浆中浓度的持久化等,能够制成以1日1次或2次的口服给与示出有效性的制剂。
本发明中的缓释性制剂只要满足上述的溶出特性,则没有特别限制。举一例而言,WO98/41210、WO2004/103350中,记载了作为BPS的控释成分而配合了水凝胶基质的BPS缓释性制剂,通过本方法制作的BPS缓释性制剂已经作为肺动脉性肺高血压的治疗剂而获得制造销售许可,被广泛临床应用。
以下,针对上述的配合水凝胶基质的BPS缓释性制剂详细描述。即,控释成分是指具有通过配合在制剂中改变BPS的释放速度的功能的物质,针对配合方法等没有特别限定。作为这样的控释成分,包括用于引起释放速度的延迟的所谓缓释化基质、用于抑制消化道内的pH变动所代表的释放时的pH变动而避免释放速度的pH依赖性的缓冲剂、用于改善药效物质的溶解性而进行扩散控速从而实现释放速度的稳定化的增溶剂、和释放促进剂等。
作为上述控释成分,从稳定释放微量的BPS的观点出发,使用水凝胶基质。作为控释成分而使用水凝胶基质的情况下,即使是0.1~10000μg左右的微量的BPS,也能够实现释放速度的随时间变动极少的所谓0次释放。
作为这样的水凝胶基质,可以使用公知的物质。在此使用的水凝胶这一术语是指水溶胀性聚合物或2种以上的这样的聚合物的组合。适合于本发明的目的的这样的水凝胶包含如果与水或其他水性介质接触则吸收这样的水/介质从而一定程度溶胀的聚合物物质。这样的吸收是可逆性或非可逆性的,它们落入本发明的范围。作为水凝胶基质,已知各种各样的天然和合成来源的高分子物质,本发明中,作为水凝胶基质,期望通过分子量容易地控制制剂制造、控释能力、不具有交联结构作为共价键合的实质上线状的高分子,其不发生与药物的相互作用以及吸附。作为这样的水凝胶基质的例子,可以举出甲基纤维素、羟基丙基纤维素(以下简称为HPC)、羟基丙基甲基纤维素(以下简称为HPMC)、聚环氧乙烷(以下简称为PEO)、羧基甲基纤维素钠、海藻酸钠、透明质酸钠等水溶性高分子或者它们中2种以上的混合物。
作为优选的水凝胶基质,使用HPC、HPMC、PEO或者它们中2种以上的混合物等。这些水凝胶基质根据粘度的程度存在各种各样的类型,根据目的适当选择。
水凝胶基质在制剂中所占的含量相对于制剂重量优选为10重量%~BPS的余量(包含缓冲剂的情况下为BPS和缓冲剂的余量)、进一步优选为40~95重量%。
本发明中,缓冲剂是指如前所述,用于抑制消化道内的pH变动所代表的释放时的pH变动而避免释放速度的pH依赖性的物质,存在在酸性区域中具有缓冲作用的物质、在中性区域中具有缓冲作用的物质、在碱性区域中具有缓冲作用的物质,优选从它们中根据BPS的物性而适当选择。本发明中,BPS具有弱酸性基团的羧基,因此期望控制BPS的羧基的解离,将在水凝胶中的水系溶剂中的溶解性保持为恒定,优选为有机酸类、氨基酸类、无机盐类。作为这样的例子,可以举出作为有机酸类的柠檬酸、丁二酸、富马酸、酒石酸、抗坏血酸或其盐类,作为氨基酸类的谷氨酸、谷氨酰胺、甘氨酸、天冬氨酸、丙氨酸、精氨酸或其盐类,作为无机盐类的氧化镁、氧化锌、氢氧化镁、磷酸、硼酸或其盐类,或者它们中的1种或2种以上的混合物。特别地,为了作为缓释性制剂的缓冲剂而期待长时间的缓冲效果,优选为相对于水的溶解度为15重量%以下的难溶性的缓冲剂,可以举出丁二酸、富马酸、抗坏血酸、谷氨酰胺、谷氨酸、精氨酸、氧化镁、氧化锌、氢氧化镁、硼酸或其盐类、或者它们中的2种以上的混合物。进一步优选地,为了通过抑制BPS的羧基的解离,降低溶出速度,使释放持久化,可以举出酸性的缓冲剂。作为这样的例子,可以举出丁二酸、富马酸、抗坏血酸、谷氨酸、硼酸或其盐类、或者它们中的2种以上的混合物。这样的难溶性且酸性的缓冲剂抑制药物释放性的pH变动,同时还抑制释放速度的随时间变动,因此能够长时间维持恒定的释放速度,故而作为缓释性制剂的缓冲剂是特别优选的。
作为缓冲剂的配合量,例如以1制剂重量的0.1~30重量%的范围使用。作为优选的配合量,可以举出1~20重量%,特别优选为1~10重量%。
本发明中使用的缓释性制剂中,根据需要可以添加能够使用的赋形剂、润滑剂、粘合剂、稳定化剂、和增溶剂等添加剂。作为添加剂,只要是药理学可接受的物质则没有特别限定,例如作为赋形剂可以举出乳糖、白糖、蔗糖、D-甘露醇、山梨糖醇、木糖醇、结晶纤维素、玉米淀粉、明胶、聚乙烯基吡咯烷酮、葡聚糖、聚乙二醇(以下简称为PEG)1500、PEG4000、PEG6000、PEG20000、聚氧亚乙基聚氧亚丙基二醇(PEP101(商标)、Pluronic(商标))等。此外,作为润滑剂可以举出硬脂酸镁、硬脂酸钙、滑石等,作为粘合剂可以举出羟基丙基纤维素、羟基丙基甲基纤维素、甲基纤维素、硬脂酸、丙二醇等,作为稳定化剂可以举出丁基羟基甲苯、丁基羟基茴香醚、抗坏血酸、没食子酸丙酯、二丁基甲基苯酚、硫代硫酸钠等,作为增溶剂可以举出环糊精、聚乙烯氢化蓖麻油、单硬脂酸聚乙二醇等。这些添加剂的配合量根据其种类、目的等适当选择。
这些添加剂的含量没有特别限定,通常相对于1制剂重量为0重量%~BPS和水凝胶基质的余量(包含缓冲剂的情况下为BPS、水凝胶基质和缓冲剂的余量)左右,优选为5重量%~BPS和水凝胶基质的余量(包含缓冲剂的情况下为BPS、水凝胶基质和缓冲剂的余量)左右。
本发明中使用的缓释性制剂中配合的BPS、控释成分以及缓冲剂的组合没有特别限定,可以举出BPS、聚环氧乙烷和富马酸、谷氨酸等难溶性且酸性的缓冲剂的组合。
配合上述的水凝胶基质的BPS缓释性制剂的形态没有特别限定,可以优选举出片剂。
此外,满足上述的溶出特性的BPS缓释性制剂也可以通过下述那样的手段制备。即,WO2004/103350中,记载了BPS缓释性制剂,其是包含粒径1000μm以下的多个颗粒的口服缓释性医药组合物,该颗粒分别包含含有BPS的核颗粒和覆膜剂,该覆膜剂由包含(1)包含难水溶性高分子物质的覆膜层和(2)包含热熔融性低熔点物质的覆膜层的至少2层的覆膜层组成,上述核颗粒被该覆膜剂覆盖。
作为上述的包含多个颗粒的口服缓释性医药组合物中的BPS配合量,只要是具有治疗效果的量则没有特别限制,可以举出例如20~250μg/制剂的范围,作为优选的范围,优选为115~250μg/制剂。应予说明,在此“1制剂”是指1次口服给与的量的制剂,1制剂的重量没有特别限定,通常为20mg~1000mg左右。
构成上述覆膜层的难水溶性高分子物质是指具有覆膜形成能力和药物控释能力的水不溶性高分子物质。针对包衣方法或者配合添加剂,没有特别限定。作为这样的难水溶性高分子物质的例子,可以举出水不溶性烷基纤维素醚衍生物(例如乙基纤维素、丁基纤维素)、水不溶性乙烯基衍生物(例如聚乙烯基乙酸酯、聚乙烯基丁酸酯)和水不溶性丙烯酸系聚合物衍生物(例如丙烯酸-甲基丙烯酸共聚物)、以及它们中的2种以上的混合物。作为优选的难水溶性高分子物质,可以举出丙烯酸-甲基丙烯酸共聚物。
构成上述覆膜层的热熔融性低熔点物质是指熔点较低、优选为70℃以下、更优选为室温至70℃、且具有控释能力的热熔融性的物质。针对包衣方法和配合添加剂等,没有特别限定。作为这样的热熔融性低熔点物质的例子,可以举出高级脂肪酸(例如硬脂酸、癸酸、月桂酸、肉豆蔻酸和棕榈酸)、高级醇(例如硬脂醇、肉豆蔻醇、月桂醇和鲸蜡醇)、高级脂肪酸丙三醇酯(例如棕榈酸油酸丙三醇酯、单油酸丙三醇酯、单硬脂酸丙三醇酯、单肉豆蔻酸丙三醇酯、单山萮酸丙三醇酯、三肉豆蔻酸丙三醇酯、和三山萮酸丙三醇酯)、蜡类(例如巴西棕榈蜡)、饱和烃(例如石蜡)、以及它们中的2种以上的混合物。作为优选的热熔融性低熔点物质的例子,可以举出鲸蜡醇、硬脂酸、棕榈酸油酸丙三醇酯、单油酸丙三醇酯、单硬脂酸丙三醇酯、单肉豆蔻酸丙三醇酯、单山萮酸酸丙三醇酯、三硬脂酸丙三醇酯、三肉豆蔻酸丙三醇酯和三山萮酸丙三醇酯。
覆膜层中的(1)包含难水溶性高分子物质的覆膜层和(2)包含热熔融性低熔点物质的覆膜层的重量比、和覆膜层在颗粒中所占的覆盖率没有特别限定,根据所使用的药物和有效给与量等适当决定。通常,其比率处于1:9~9:1的范围内即可,优选为3:7~7:3的范围内。
上述覆膜层中,可以包含药理学可接受的添加剂。作为添加剂的例子,可以举出丙二醇、聚乙二醇(以下简称为PEG)1500、PEG4000、PEG6000、PEG20000、聚氧亚乙基聚氧亚丙基二醇(PEP101(商标)、Pluronic(商标))、丙三醇、柠檬酸三乙酯、柠檬酸三丁酯、三醋精、月桂基硫酸钠、山梨糖醇、聚乙烯基吡咯烷酮和聚山梨酯80那样的增塑剂。当前,对于能够在市场获取的制药的增塑剂,有效量在包衣材料的总干燥重量的1~30%之间变动。
作为减少形成该包衣的膜的弹力性的添加剂、即脆性诱导剂,可以举出滑石、硬脂酸镁、硬脂酸钙、Aerosil和氧化钛。脆性诱导剂的有效量依据所使用的脆性诱导剂的类型而变动。例如,使用滑石时为10~70%,Aerosil的情况下为1~40%,和硬脂酸镁的情况下为1~70%,在此所有的%基于包衣材料的总干燥重量。
作为含有上述BPS的核颗粒中能够配合的添加剂,只要是药理学可接受的,则没有特别限定。
作为优选的添加剂,可以举出粘合剂、赋形剂、稳定化剂、增溶剂或缓冲剂。
作为粘合剂的例子,可以举出羟基丙基纤维素、羟基丙基甲基纤维素、甲基纤维素、硬脂酸和丙二醇。作为赋形剂的例子,可以举出乳糖、白糖、蔗糖、D-甘露醇、山梨糖醇、木糖醇、结晶纤维素、玉米淀粉、明胶、聚乙烯基吡咯烷酮、葡聚糖、PEG1500、PEG4000、PEG6000、PEG20000和聚氧亚乙基聚氧亚丙基二醇(PEP101(商标)、Pluronic(商标))。含有BPS的核颗粒可以通过在ノンパレル(Nonpareil)(商标)(白糖)、スグレッツ(SUGLETS)(商标)(白糖)、或エチスフェアーズ(ETHISPHERES)(商标)(结晶纤维素)那样的已经制备的球形颗粒中将医药活性物质与粘合剂一起包衣而制备。或者,含有BPS的核颗粒也可以将BPS与赋形剂混合,将该混合物制成球形颗粒而制备。作为稳定化剂的例子,可以举出丁基羟基甲苯、丁基羟基茴香醚、抗坏血酸、没食子酸丙酯、二丁基甲基苯酚、硫代硫酸钠、和氧化钛。有效的配合量取决于医药活性物质而变动。作为增溶剂的例子,可以举出环糊精、聚乙烯氢化蓖麻油、单硬脂酸聚乙二醇酯、泊洛沙姆和聚山梨酯80。作为缓冲剂的例子,可以举出MgO那样的碱性反应剂、或例如柠檬酸、酒石酸之类的有机酸那样的酸性反应剂。
上述颗粒的粒径为1000μm以下、优选为100~850μm、更优选为300~750μm。
上述的包含多个颗粒的口服缓释性医药组合物分别由具有缓释性功能的粒径1000μm以下的多个颗粒粒子构成。通过控制为上述范围的粒径,能够维持消化道下部的稳定释放性。其最终形态没有特别限定,可以举出能够口服给与的形態、例如片剂、颗粒剂、细粒剂、胶囊剂和混悬剂等。
本发明的药剂是制剂稳定的持久性良好的制剂,通过1日1~2次口服给与,得到长时间稳定的药效,得到优异的生物利用度,此外服用容易。
作为口服给与的缓释性制剂,可以举出单一单位型和多单位型的缓释性制剂。单一单位型大多数在消化道内保持给与剂形的同时缓慢释放药物。作为单一单位型,存在蜡基质型、Gradumet型、Repetab型、lontab型、spantab型等。多单位型中,所给与的片剂、胶囊剂迅速崩解而释放颗粒,所释放的颗粒示出缓释性。作为多单位型,有spacetab型、Spansule型、颗粒型等。此外,根据控释机制,分为储库型和基质型。储库型是将含有药物的片剂或颗粒用高分子覆膜包衣得到的,药物的释放速度根据该覆膜的性质、厚度决定。Repetab型、spacetab型、Spansule型、颗粒型属于储库型。基质型是将药物分散在高分子、蜡等基质中,因此根据药物分子在基质内的扩散速度而决定释放速度。蜡基质型、Gradumet型、lontab型、spantab型等属于基质型。只要具有上述的释放特性,则无论其缓释化方法如何,均能够使用各种缓释性制剂。
本发明的药剂将含有式(I)所示的化合物作为有效成分的缓释性制剂以式(I)所示的化合物计以1日220~260μg的剂量1次或分2次给与。
包含式(I)所示的化合物作为有效成分的缓释性制剂针对包含BPS的缓释性制剂,以Careload(商标)LA片60μg(东丽株式会社)、Berasus(商标)LA片60μg(科研制药)市售。因此,如果将Careload(商标)LA片60μg(东丽株式会社)或Berasus(商标)LA片60μg(科研制药株式会社)1次2片、1日2次(总计4片)给与,则以BPS计1日给与240μg。
此外,作为本发明中能够使用的缓释性制剂,特别优选使用与作为Careload(商标)LA片60μg(东丽株式会社)或Berasus(商标)LA片60μg(科研制药株式会社)而在日本获得制造销售许可的缓释性制剂相比,按照“仿制医药品的生物学等效性性试验指南”或者SUPAC-MR(Modified Release Solid Oral Dosage Forms)等,通过溶出行为、临床上的药代动力学试验等示出生物学等效性的制剂。
本发明的药剂通过对治疗开始前的血清肌酐值为2.0mg/dl以上且低于3.0mg/dl、和/或治疗开始前的用CKD-EPI(Chronic Kidney Disease Epidemiology Collaboration)式算出的估算肾小球过滤率(eGFR)为15ml/分钟/1.73m
非专利文献3中,将BPS速释片20μg每1日3次对慢性肾功能衰竭患者给与时的长期随访的结果是,报告了BPS给与开始前的血清肌酐值为2.8mg/dl以上的患者组在24个月以内转化为透析,如果血清肌酐值达到2.2mg/dl以上,则无法确认BPS的效果。然而,本发明中,通过将应用对象限定为原发性肾小球疾病或肾硬化症患者,能够抑制透析转化或肾死亡,此外,非专利文献3中未确认到效果的血清肌酐值2.2mg/dl以上的患者中,也能够抑制透析转化或肾死亡。
本申请说明书中的透析中,除了血液透析之外,还包括腹膜透析。
本发明的药剂在上述的原发性肾小球疾病或肾硬化症患者之中,进一步对将BPS缓释性制剂以餐后1次的方式给与BPS 120μg时的给与后2~6小时的血浆中浓度为平均50pg/ml以上的患者示出特别优异的效果。
确认BPS的药理作用是BPS浓度依赖性的,因此可以推定BPS给与时的血浆中浓度越高则效果越高。根据给与240μg BPS缓释片时的Cmax与AUC的关系(Cmax为214.7±89.1pg/ml时,AUC为1225±343pg·hr/ml,是约5.7倍),缓释片的Cmax为50pg/ml时预想的AUC为286pg·hr/ml,1日给与2次,因此1日的AUC为572pg·hr/ml。
另一方面,将未确认到充分的透析延迟效果的速释片20μg向健康人给与时的Cmax和AUC由于1)将BPS速释片40μg向人进行1日2次连日餐后口服给与时的第7天最终给与时的Cmax为242.2±81.4pg/ml,AUC为550±148pg·hr/ml(Careload片药品信息表);2)BPS速释片的给与量与Cmax、AUC之间确认到线形性(非专利文献12),因此Cmax为121pg/ml,AUC为275pg·hr/ml左右。速释片通常1日给与3次,因此1日的AUC预想为825pg·hr/ml左右。进一步,肾损伤患者中,报告了与健康人相比,Cmax、AUC均上升(非专利文献13),因此可以认为将速释片20μg对慢性肾损伤患者给与时的Cmax、AUC进一步提高。
根据以上,以与速释片20μg每1日给与3次的情况相比更低的Cmax和AUC确认到BPS缓释片给与时的Cmax附近、即给与后2~6小时的血浆中浓度为平均50pg/ml以上(AUC中1日570pg·hr/ml以上)的患者中贝前列素缓释片的透析转化或肾死亡抑制方面的显著效果,是由以往的见解预想不到的。
本申请说明书中,“将BPS缓释性制剂进行餐后1次、以BPS计120μg餐后给与时的给与后2~6小时的血浆中浓度为平均50pg/ml以上”可以是指给与后2~6小时的过程中测定1次以上血浆中浓度,它们的测定值的平均为50pg/ml以上,也可以是将“120μg 1次餐后给与”进行1次以上,各自的测定值的平均为50pg/ml以上。此外,也可以是将它们进行组合的情况。
此外,将BPS向人给与时,作为BPS的活性主体的BPS-314d的Cmax已知为BPS的1/4(非专利文献13),因此本发明中作为特别有效的BPS的血浆中浓度为50pg/ml以上也可以替换为作为BPS-314d的血浆中浓度为12.5pg/ml以上。特别是在仅包含BPS-314d的制剂的给与时,需要用BPS-314d的血浆中浓度规定。
本发明的药剂在原发性肾小球疾病或肾硬化症患者之中,对正在服用ACEI的患者示出特别优异的效果。进一步在给与前的血清肌酐值为2.0mg/dl以上且低于3.0mg/dl的患者、或基于CKD-EPI式的eGFR为15ml/分钟/1.73m
作为上述的ACEI,可以举出例如卡托普利、依那普利、贝那普利、咪达普利、赖诺普利、培哚普利、雷米普利、莫西普利、福辛普利和喹那普利。这些ACEI的用法·用量按照ACEI作为降压剂而批准的用法·用量即可。此外,只要作为有效成分而包含ACEI,则也可以是与ARB、钙拮抗剂、β受体阻滞剂、各种利尿剂的合剂。
本发明提供药剂,其是在用于抑制透析转化或肾死亡的治疗或预防中,用于以同时、分别或依次给与的方式使用的组合制剂,分别包含以下的(a)和(b)的2种制剂,
(a)含有上述通式(I)所示的化合物作为有效成分的口服缓释性制剂,用于将上述通式(I)所示的化合物1日给与220~260μg
(b)含有ACEI作为有效成分的制剂
本发明的分别包含2个制剂的药剂通过对慢性肾功能衰竭患者给与,能够抑制透析转化或肾死亡。
本发明的药剂对具有营养障碍的原发性肾小球疾病或肾硬化症患者特别有效使用。
本发明的药剂在营养障碍之中低营养状态时特别有效。低营养状态一般用血清蛋白质量、体格、肌肉量、营养摄取量等规定,提出了各种基准,因此未必局限于1个基准。
本发明中,作为营养障碍,在肾损伤患者中满足特征性指标、即PEW的基准的病例、满足构成PEW的要素的病例中特别有效使用。具体而言,满足构成PEW的4个要素、即“血清化学”、“体重”、“肌肉质量”、“饮食摄入量”之中任一者、进一步满足各要素之中的1个参数即可。当然,也可以满足多个构成要素,不如说在具有多个的典型的病例中,BPS的效果更明确被确认到。
进一步,具有营养障碍的患者在血清肌酐为2.0mg/dl以上且低于3.0mg/dl的病例;用CKD-EPI式算出的估算肾小球过滤率为15ml/分钟/1.73m
此外,本发明的药剂用于合并PEW危重化的前恶病质或者恶病质的慢性肾功能衰竭患者是有效的。进一步,对于合并营养障碍进行而产生的肌肉减少症或者虚弱的慢性肾功能衰竭患者也极为有用。
利用本发明的药剂的治疗不引起因SGLT2抑制剂而导致的治疗时的体重、肌肉量的降低,因此对合并PEW和恶病质、进一步肌肉减少症、虚弱的慢性肾功能衰竭病例的患者可以有效使用。
本发明的原发性肾小球疾病、肾硬化症中,即使合并糖尿病也没有特别问题。
(eGFR的算出方法)
本发明中的eGFR的值利用CKD-EPI式算出,记载于非专利文献14。具体而言,如下所示。即,将血清肌酐记作[Cr]ml/dl、[Age]记作年龄时,男性使用以下的式1,女性使用以下的式2,算出eGFR。
eGFR(ml/分钟/1.73m
eGFR(ml/分钟/1.73m
应予说明,CKD-EPI式另外为了与通过使用碘酞酸盐、菊粉的实测值一致乘以校正系数在以日本人为首的各国中进行,今后也预想提出。然而,本发明中,优选使用基于原始文献的上述的推算式。CKD-EPI式的算出中使用的血清肌酸原则上使用利用酶法测定的值,在利用Jaffe法测定的情况下,需要校正。
(血清肌酐值的测定方法)
血清肌酐值的测定利用酶法,具体而言,除了作为临床检查药销售的Cygnus AutoCRE(Shino-Test Corporation)之外,使用L-type Wako CRE·M(富士胶片·和光纯药)、Pureauto S CRE-N(Sekisui Medical Co., Ltd.)、Serotec CRE-N(Serotec Co., Ltd.)、Aqua-auto Kainos CRE-III plus(Kainos Laboratories, Inc.)、Shikarikid-N CRE(关东化学)等,只要使用酶法,则没有特别限制。
如果对比以往使用的Jaffe法与酶法,则需要注意特异性更低的Jaffe法高0.2mg/ml。(非专利文献15)。因此,使用用Jaffe法测定的肌酐值的情况下,为了换算为酶法中的测定值,减去0.2mg/ml。
(血浆中BPS浓度的测定方法)
血浆中的BPS浓度的定量通过GC-MS法、LC-MS法或LC-MS-MS法等进行,只要是验证的方法,则通过任何方法都可以。
分析使用非专利文献5中规定的全分析集和意向治疗(以下简称为ITT),通过Cox的比例风险模型,算出本发明的药剂和安慰剂的风险比(以下简称为HR)。HR的值越小,则表示本发明的药剂的有效性越高。
实施例
接着,针对本发明示出实施例和比较例进一步详细说明,但本发明不因它们而受到限定。应予说明,以下的实施例和比较例中进行的测定方法示于以下。
(eGFR的算出方法)
本发明中的eGFR使用上述式1和式2算出。
(血清肌酐值的测定方法)
血清肌酐值的测定在株式会社SRL通过酶法实施。
(血浆中BPS浓度的测定方法)
血浆中的BPS浓度的定量在株式会社东丽研究中心通过LC-MS/MS法进行。
(实施例1)
作为BPS缓释片的TRK-100STP(与Careload(商标)LA片60μg(东丽株式会社)相同的制剂)是包含BPS60μg和作为添加物的聚环氧乙烷5000K、聚乙二醇6000、L-谷氨酸、硬脂酸镁的凝胶基质型缓释性制剂,与安慰剂片一起由东丽株式会社三岛工场制造。TRK-100STP的体外溶出行为如下所述测定。即,取1个本剂,作为试验液使用添加聚山梨酯80、0.5ml的蒸馏水50ml,通过桨式法(其中,使用沉降装置)以每分钟100转进行试验。此时,3小时的BPS的溶出率为25%,6小时为50%,10小时为83%。进一步,替代水而使用日本药典1液(pH1.2)和日本药典2液(pH6.8),通过相同方案进行溶出试验的结果是,得到同等溶出率。
使用按照非专利文献5所述的方案的CASSIOPEIR试验中获取的数据集。若概述CASSIOPEIR试验的方案,则是以原发性肾小球疾病和肾硬化症作为原发疾病的慢性肾功能衰竭患者作为对象,将作为BPS缓释片的TRK-100STP(与Careload(商标)LA片60μg(东丽株式会社)为相同制剂)以BPS计达到120μg或240μg/日的方式分为早晚2次给与。此外,本试验是多设施共同、随机化、安慰剂对照、双盲对比试验,在日本、中国、韩国、马来西亚和泰国等实施。
药剂的给与期间为2~4年,随机化的患者数为892例,实施设施为160设施。此外,以ITT团体作为主要分析对象团体。主要评价项目设为由血清肌酐的2倍化或末期肾功能衰竭定义的肾复合终点的出现为止的时间。透析转化时期的判断参照日本透析医学会的方针(2013)。即,按照“即使进行充分的保守治疗也确认肾功能的进行性恶化,在达到GFR<15ml/分钟/1.73m
进一步,CASSIOPEIR试验中,根据病例报告书的记载和血浆中浓度的测定结果,在确认服药依从率高的日本人团体中,给与开始前的血清肌酐值为2.0mg/dl以上且低于3.0mg/dl的患者组中的HR为0.51,P值为0.0429,确认抑制透析转化的效果(图1)。此外,将事件设为包含透析转化或移植的至肾死亡为止的期间的情况下,HR为0.54、P值为0.0624,低于0.1,确认到与透析转化的情况同样强的倾向。进一步,给与开始前的血清肌酐值大于2.2mg/dl且低于3.0mg/dl的患者中,将透析转化设为事件时的HR为0.51,P值为0.0495,也确认到显著的至透析转化为止的期间的延长效果。此外,CASSIOPEIR试验的日本人团体中,给与开始前的用CKD-EPI式算出的eGFR为15ml/分钟/1.73m
(比较例1)
CASSIOPEIR试验中,治疗开始前的血清肌酐值为3.0mg/dl以上的日本人中,将透析转化设为事件时的HR为0.91,P值为0.7219,未确认到TRK-100STP给与的效果。同样地,治疗开始前的用CKD-EPI式算出的eGFR低于15ml/分钟/1.73m
(实施例2)
参加CASSIOPEIR试验的全部日本人之中,将BPS缓释片在餐后给与1次以BPS计120μg 时的给与后2~6小时的血浆中浓度确认为平均50pg/ml以上的患者中,将事件设为至透析转化为止的期间,研究1日给与240μg的效果。其结果是,HR=0.63,P值=0.0315,通过给予BPS 240μg,示出延迟透析转化(图2)。此外,将事件设为肾死亡的情况下,也确认到同样的倾向。应予说明,本说明书的实施例1、本实施例中,将服药依从率高的日本人团体的数据用于分析,但只要遵循服药,则应用对象不限于日本人,在中国、韩国、马来西亚、泰国等亚洲和其他国家的患者中也得到同样的效果。例如,针对CASSIOPEIR试验的中国和泰国的病例,预想服药更切实的给与后2~6小时的血浆中浓度为平均50pg/ml以上的患者中,将透析转化设为事件时的HR均为0.74,示出与日本人部分团体几乎同等的有效性。
此外,确认到上述的BPS浓度的患者组中,作为治疗开始前的CKD阶段,用CKD-EPI式算出的eGFR为15ml/分钟/1.73m
(比较例2)
实施例2中,未示出BPS给与后的血浆中浓度为50pg/ml以上的患者中,除了日本人的情况之外,在中国的病例、进一步泰国的病例中,也未确认到基于BPS缓释片1日给与240μg的至透析转化为止的期间的延长。针对至肾死亡为止的期间的延长也同样如此。
(实施例3)
CASSIOPEIR试验中,组合使用BPS缓释片和ACEI(赖诺普利、替莫普利、地拉普利、培哚普利、贝那普利、依那普利、卡托普利、喹那普利、福辛普利、咪达普利或其盐酸盐、西拉普利、群多普利、喹那普利、雷米普利、替莫普利或其盐酸盐或群多普利)的全部受试者中,将至透析转化或肾死亡为止的期间设为事件的情况下,通过Cox Hazard模型分析1日240μg的BPS给与组的HR和P值。
1日240μg的BPS给与组之中,进行与ACEI的组合使用的患者组(进一步组合使用ARB的患者除外)中,HR=0.60,P值=0.0994(图3)。P值低于0.1,强烈暗示通过240μg的BPS和ACEI的组合使用,延长了至透析转化为止的期间。
进一步,患者组限于日本人的情况下,HR=0.49,P值=0.0882,进一步显著暗示了利用组合使用的至透析转化为止的期间的延长效果。
(比较例3)
CASSIOPEIR试验中,组合使用ARB(替米沙坦、缬沙坦、氯沙坦、厄贝沙坦、坎地沙坦、奥美沙坦或依普沙坦)、未组合使用ACEI的患者组的情况下,将至透析转化为止的期间设为事件时的BPS240μg给与组的风险比和P值为HR=0.88,P值=0.5401,日本人部分团体中,HR=0.79,P值=0.3597,ARB组合使用组中,未确认到利用BPS的1日、240μg给与的至透析转化为止的期间的延长效果。
(比较例4)
此外,组合使用作为降压剂而通用的钙拮抗剂(氨氯地平、阿雷地平、阿折地平、巴尼地平、贝尼地平、西尼地平、氯维地平、依福地平、非洛地平、伊拉地平、拉西地平、乐卡地平、马尼地平、尼卡地平、硝苯地平、尼伐地平、尼莫地平、尼索地平、尼群地平、nitrepin、普拉地平、芬地林、加洛帕米、维拉帕米、地尔硫卓、Micamlo复方(Micamlo Combination)、Sevikar、ecroforge或氨氯地平)的情况下,将BPS缓释片1日给与240μg时,将至透析转化为止的期间设为事件时,HR=0.85,P值=0.3718,也未确认到至透析转化为止的期间的延长效果。
(实施例4)
作为低营养状态的患者的指标,使用作为PEW的诊断基准之一的BMI低于23(参照以下的表2)。CASSIOPEIR试验中,BMI低于23的患者组,将透析转化设为事件时,HR=0.66,P值=0.0411,能够确认240μg的显著透析转化抑制效果(图4)。
[表2]
进一步,BMI低于23的日本人患者中,HR=0.38,P值=0.0048,确认到进一步显著的透析转化抑制效果(图5)。此外,BPS缓释片给与组和安慰剂组中,给与前后的BMI没有确认到显著变化,可以确认上述的透析转化抑制效果并非由试验期间中的BMI的变化导致。此外,这样的见解在将事件设为包含透析转化或移植的肾死亡的情况下也同样确认到。
(比较例5)
参加CASSIOPEIR试验的全部患者之中,BMI为23以上的患者中,将透析转化设为事件时,HR=1.38,P值=0.0754,未确认到BPS缓释片的至透析转化为止的期间的延长。设为日本人团体的情况下,HR=1.06,P值=0.8266,也同样未确认到BPS缓释片的效果。
(实施例5)
作为低营养状态的患者的指标,使用作为PEW的诊断基准之一的血清白蛋白值低于3.8g/dl(表2)。参加CASSIOPEIR试验的日本人患者之中,血清白蛋白低于3.8g/dl的患者中,将透析转化设为事件时,HR=0.50,P值=0.1567,示出240μg的透析转化抑制倾向(图6)。此外,BPS缓释片给与组和安慰剂组中,给与前后的血清白蛋白值未确认到变化,可以确认上述的透析转化抑制效果并非由血清白蛋白值的变化导致。
上述患者之中,进一步作为治疗开始前的CKD阶段,用CKD-EPI式算出的eGFR为15ml/分钟/1.73m
(比较例6)
参加CASSIOPEIR试验的日本人患者之中,血清白蛋白值为3.8g/dl以上的患者中,将透析转化设为事件时,HR=0.78,P值=0.2656,HR接近1,完全未确认到BPS缓释片的至透析转化为止的期间的延长。
(实施例6)
参加CASSIOPEIR试验的日本人患者之中,总淋巴细胞数低于1500/mm
上述患者之中,作为治疗开始前的CKD阶段,用CKD-EPI式算出的eGFR为15ml/分钟/1.73m
(比较例7)
参加CASSIOPEIR试验的日本人患者之中,总淋巴细胞数为1500/mm
(实施例7)
参加CASSIOPEIR试验的日本人患者之中,BMI低于23、血清白蛋白值低于3.8g/dl的患者中,将透析转化设为事件时,HR=0.29。如实施例4和实施例5中所述那样,BMI低于23的日本人患者组中HR=0.38,血清白蛋白值低于3.8g/dl的日本人患者组中HR=0.50,因此PEW的构成要素与单独相比存在多个症例时确认到BPS的效果更显著。这样的见解在将事件设为包含透析转化或移植的肾死亡的情况下也同样确认到。
(实施例8)
参加CASSIOPEIR试验的日本人患者组之中,总淋巴细胞数低于1500/mm
- 血管紧张肽-转化酶抑制剂和醛固酮拮抗剂用于降低心血管疾病的发病率和死亡率的联合疗法
- 3-羟基吡啶-4-酮类衍生物及在抑制肾细胞铁死亡中的应用
