一种基于多模成像的血管内热层析成像探针
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及一种基于多模成像的血管内热层析成像探针,属于生物医疗器械领域。
背景技术
新陈代谢是人体生命活动的基本特征,在新陈代谢过程中组织的温度分布会产生变化,观察组织温度分布变化有利于判断组织病变情况,因此对组织的非破坏性热层析成像在临床医疗中具有重要需求。当人体局部产生病灶时,其热特性将产生变化,热量传输至体表并向外辐射,在体外通过探测热辐射特性即可获得体内不同深度的热源分布,这就是热层析成像的基本原理。热层析成像以Pennes生物传热理论为基础,通过红外探测器获取病变部位的热源深度、大小等分布信息,在乳腺疾病检测诊断领域已获得了显著应用进展。在乳腺疾病检测中,通常使用现有的红外热像仪对患者乳腺部位进行红外成像获取红外辐射数据,并据此反演得到患者乳腺部位的热层析图像。该热层析成像方法对于体表病灶的检测具有操作方便、检测简单等特点,然而在体内病灶的检测中面临极大挑战。
血管内斑块易导致动脉粥样硬化、心肌梗死等,在脑血管性疾病和心血管性疾病中是一种常见的病症。对血管内斑块的精准检测和微创治疗一直是临床中亟待解决的重要问题。随着射频消融、激光消融等微创治疗技术的发展,血管内斑块的消融治疗技术也获得了研究人员的关注。在血管内斑块的消融过程中,对消融区域温度场三维分布的实时检测是实现反馈控制的手段和精准消融的前提。然而,目前尚缺乏血管内温度场三维分布的实时检测技术。
发明内容
本发明的目的是为了解决现有手术中无法实时温度监督导致血管内病理诊断精度低的问题,提供一种基于多模成像的血管内热层析成像探针,既能实现血管内OCT成像、IVUS成像和PA成像中的一种或多种成像功能,还能将成像的血管内形态学数据服务于血管内的三维温度场反演,进而达到血管内热层析成像目的。
为实现上述功能,本发明采取的技术方案如下:
一种基于多模成像的血管内热层析成像探针,包括:超声换能器引线、固定柱、GRIN聚焦透镜、反射棱镜、超声换能器、甘油、支撑底座、远红外光纤、可见-近红外光纤、封装壳、金属导丝和柔性导管。
所述探针具有如下连接方式:固定柱被固定于封装壳中,固定柱外径应与封装壳内径相吻合,用于固定远红外光纤和可见-近红外光纤。可见-近红外光纤具有功率容量大和传输波段宽的特点,其传输波段覆盖可见光至近红外光,可用于传输血管内OCT成像与PA成像的光信号。远红外光纤用于传输远红外光信号,当血管内具有病灶时,该区域会向外辐射温度异常的远红外信号,远红外光纤可将该信号实时接收,并与该区域处的形态学信息通过算法反演为热层析图像;GRIN透镜被固定于支撑底座上,用于准直和聚焦光信号,使光信号沿轴向聚焦传输,其输入端与两种光纤和紧贴放置,起到对光信号定向和聚焦功能;反射棱镜位于GRIN透镜前端用于将OCT成像、光声成像以及激光消融的光信号反射至血管组织;超声换能器固定于反射棱镜后面,用于发射和接收声学信号(发射/接收IVUS信号,接收PA信号)。所述超声换能器可通过正/逆压电效应实现IVUS信号发射和PA、IVUS双模式信号接收。所述超声换能器可利用压电单晶、压电复合材料、压电薄膜等具备高压电性、宽频带和高灵敏度的铁电材料进行制作,具有微弱声信号的感知能力;支撑底座被固定于封装壳底部,其内部为镂空结构,可用于安放并引出超声换能器引线;封装壳为透明密封结构,内部充满甘油用于探针内部绝缘和声学匹配性的提升;金属导丝用于控制探针的轴向转动,因此其一端连接支撑底座,另一端连接位移控制系统的转动马达;固定柱左侧连接一柔性导管,用于装载由支撑底座内引出的换能器引线和金属导丝。
本发明利用所述探针先通过一种或多种影像学检测技术(OCT、PA、IVUS等)获得血管内三维形态学信息,然后将其与血管内的热辐射信息相结合实现血管内的热层析成像,为血管内斑块等病灶提供诊断依据,并为血管内精准消融提供实时温度场三维分布信息和反馈控制手段,具有成像速度快、便携性大的优势。
本发明提供了一套适用于所述探针的体外控制系统,所述控制系统配合探针构成检测系统,在血管内的扫描可用于实现血管内OCT成像、IVUS成像和PA成像功能,并为血管内热层析成像提供温度场反演的形态学信息和坐标依据。包括所述探针、控制模块、多模成像模块、数据处理与图像重建模块、位移控制模块和显示模块。
进一步地,所述体外控制系统由控制模块、多模成像模块、数据处理与图像重建模块、位移控制模块和显示模块组成。
所述控制模块是以同步时分复用的方式对各路输出进行控制,其输出端分别连接所述多模成像模块、所述数据处理与图像重建模块和所述位移控制模块,具有实时性强、工作效率高的优点。当控制模块的指令发出后,所述成像模块的信号源(如激光器、脉冲发射/接收器等设备)产生光信号和声信号用于成像。所述数据处理与图像重建模块感知到成像模块的输出电信号后,将对信号读取、存储和计算。所述位移控制模块内含驱动马达,经所述控制模块的同步控制可改变所述探针在血管内的空间位置和轴向转速。
所述多模成像模块可实现OCT成像、PA成像、IVUS成像功能,其结构包括:可调节激光光源、可见-近红外光纤、远红外光纤、90:10耦合器、环形器、参考臂、50:50耦合器、光电探测器、远红外探测器和脉冲发射/接收器,所述参考臂由准直镜、透镜和反射镜组成。其中OCT成像、PA成像和IVUS成像均作为血管内热层析成像的辅助性成像手段,血管内热层析成像不能摆脱上述前三种成像而独立工作。
所述多模成像模块的连接关系如下:
所述激光光源的输入端连接所述控制模块,用于接收并读取控制模块的同步信号,其输出端连接一90:10耦合器,用于将光信号分束形成参考臂信号和样品臂信号;90:10耦合器有参考臂和样品臂两个输出端口,且分别连接一环形器用于定位OCT的光信号;所述参考臂由准直镜、透镜和反光镜组成,连接于环形器的输出端,用于调节参考臂信号;位于样品臂的环形器含一个输入端和两个输出端,其输入端连接所述90:10耦合器的输出端口,用于接收所述激光光源发出的OCT的样品臂信号和PA信号;位于样品臂的环形器一个输出端口与所述探针连接,可用于OCT、PA信号的发射和接收;50:50耦合器的输入端分别连接所述位于参考臂和样品臂的两个环形器的输出端,用于将样品臂和参考臂信号相干叠加;所述50:50耦合器的输出端连接一光电探测器用于接收并读取OCT信号;信号处理与图像重建模块的输入端连接所述光电探测器,输出端连接所述显示模块,分别实现检测系统的光电信号转换和图像显示功能;脉冲发射接收器用于为探针内的超声换能器提供电脉冲信号,其输入端连接所述控制模块,输出端与超声换能器引线相连;远红外探测器用于接收并读取血管内的热辐射信息,然后将该信息传递至数据处理与图像重建模块进行三维温度场反演,其输入端与所述探针内的远红外光纤相连,输出端连接数据处理与图像重建模块。
进一步地,所述激光光源、可见-近红外光纤、90:10耦合器、环形器、参考臂、50:50耦合器、光电探测器用于实现OCT成像功能。首先,控制激光光源产生近红外光信号,信号传输至90:10耦合器进行分束,即信号功率按90:10分成样品臂和参考臂,其中样品臂信号用于直接捕获血管内的信息,参考臂信号用于干涉携带血管内部信息的光信号。当样品臂信号沿可见-近红外光纤传输至所述探针后,经探针内的棱镜反射,可射入血管腔。携带血管腔信息的信号沿原光路返回后,通过一50:50耦合器与参考臂信号进行合束,合束后的信号被光电探测器接收并转换为模拟信号输出。所述模拟信号携带了血管内的OCT信息,经数据处理与图像重建模块储存和计算后可形成血管腔形态学信息和坐标信息,利用该信息既可以进行OCT实时成像,还可以为所述血管内热层析成像提供OCT三维形态学信息。
进一步地,所述激光光源、可见-近红外光纤、脉冲发射/接收器用于实现PA成像功能。将激光光源调节至可见光波段后输出光信号,该信号通过可见-近红外光纤传输至所述探针并射入至血管内的病灶区域,该区域将所述光信号吸收后可产生PA信号,PA信号由所述探针内的超声换能器接收,经正压电效应转换为电信号后传输至脉冲发射/接收器读取,该信号将携带血管内病灶的PA信息,经数据处理与图像重建模块处理后,不但可进行血管内PA实时成像,还能为所述血管内热层析成像提供PA三维形态学信息。
进一步地,所述脉冲发射/接收器用于实现IVUS成像功能。所述脉冲发射/接收器输出端与所述探针内部的超声换能器引线相连,当脉冲信号产生后,超声换能器通过逆压电效应将脉冲信号转换为高频声波并发射至血管内病灶区域。所述高频声波接触到病灶后形成回波,然后再次作用于所述超声换能器,经正压电效应后形成电信号被脉冲发射/接收器读取。该电信号携带了病灶的超声信息,经数据处理与图像重建模块处理后,可用于进行超声成像,还可为所述血管内热层析成像提供超声三维形态学信息。
所述OCT、PA和IVUS三种信息既可以分别为血管内热层析成像提供三维形态学信息,也可以选其中的两种或三种提供信息。值得注意的是,上述三种成像手段具有不同成像精度的特点,所以三者提供的形貌学信息将产生差异。(例如OCT信息具有轴向高分辨率特性,超声信息具有穿透深度大的特点,光声信号兼具分辨率高和穿透深度大的特点)。因此,使用所述体外系统时可根据实际需求对三种成像信息进行选择。
所述数据处理与图像重建模块可实现多模成像模块各路信号的降噪、模数转化、信号反演计算和存储功能。具体连接方式:其输入端分别连接所述光电探测器、所述脉冲发射/接收器和所述远红外探测器。
可选地,所述数据处理与图像重建模块可采用A/D转换器、降噪滤波器、数控微机、数据采集卡、RGB编码转换器,用于读取和处理输入的模拟信号。所述A/D转换器和降噪滤波器负责将接收的模拟信号进行降噪预处理;所述数控微机用于实时传递和反馈同步控制模块的信号,进而调节探针和金属导丝位置以及激光光源的波长;所述数据采集卡用于记录OCT、IVUS、PA的三维坐标信息,进而为热层析成像提供反演依据,其次可以储存血管内病灶的位置、形貌和成分等信息,以便于消融工作的有序进行;RGB编码转换器用于实现血管内多模式的彩色图像,将血管内的形貌通过二维或三维图的方式予以清晰展现。
所述显示模块用于显示血管内OCT、PA、IVUS和热层析图像。具体连接方式:其输入端与所述信号处理与图像重建模块输出端相连。经信号处理与图像重建模块处理后的数字信号由图像显示模块进行显示,使用者可根据实际需求对OCT成像、PA成像、IVUS成像和热层析成像的一种或多种成像方式进行选择。
本发明提供了一种利用血管内OCT、PA、IVUS三维形态学信息构建血管内热层析图像的方法,不仅能为血管内斑块等病灶提供诊断依据,还能为血管内精准消融提供实时温度场三维分布信息和反馈控制手段,具有集成度高和实用性强的应用特点,具体操作步骤如下:
步骤1、将所述探针送入至患者血管内;
步骤2、开启体外控制系统,控制同步控制模块使激光光源、脉冲发射/接收器分别产生近红外光、可见光以及超声信号;
步骤3、利用位移控制模块控制多模成像模块获取血管内的三维形态学信息(OCT、PA、IVUS),并将该信息(空间离散点坐标)存储于数据处理与图像重建模块,记血管内病灶处任意一点三维坐标为v
步骤4、利用位移控制器保持探针在血管内相对位置不变,将远红外探测器获取的血管内该病灶处热辐射信息存储于数据处理与图像重建模块,并记该点辐射强度值为w
步骤5、数据处理与图像重建模块内含三维温度场反演算法,利用步骤4中的某点辐射强度值w
步骤6、将步骤5中求得的三维温度场信息进行彩色编码,最终实现血管内热层析成像;
步骤7、调节图像显示模块,对血管内的成像方式进行选择(可选择OCT、PA、IVUS和热层析的一种或多种),并结合成像结果对血管内斑块进行病例剖析;
步骤8、关闭体外控制系统,将所述探针回撤至患者体外结束检测。
有益效果
1、本发明首次实现了血管内的热层析成像,通过利用一种或多种成像手段(OCT、PA和IVUS)来反演血管内三维温度场信息,为血管内斑块等病灶提供诊断依据,进一步提升了医学诊断的精准性和客观性。
2、血管内热层析成像的实现能够为血管内精准消融提供实时温度场三维分布信息和反馈控制手段,保障消融质量和精度。
3、与利用红外探测器从多角度来获取同一部位红外图像的传统热层析成像方法相比,本发明提供的热层析成像方法具有操作简单、便捷性高、实用性强的应用特点,特别适用于空间狭小的应用场景。
4、一种基于多模成像的血管内热层析成像探针及其体外控制系统,突破传统成像系统功能单一、内部结构复杂、器件利用率低等局限,实现了模块之间的器件或光路共用,具有器件利用率高、占用空间小等优势。
5、传统体外热层析成像技术仅凭红外探测器获取的单一角度的红外辐射图像难以反演血管内温度场三维分布信息。本发明提出利用血管内影像学技术先获得血管内的三维形态学信息,由血管内的三维形态学信息及红外辐射图像来反演血管内温度场三维分布信息,具有成像速度快、便携性大的优势。
附图说明
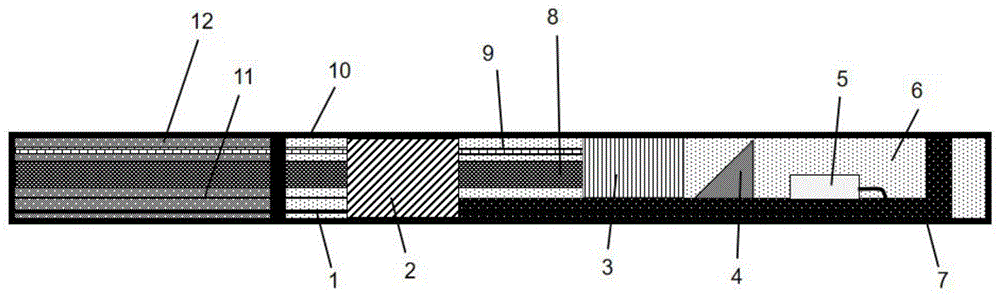
图1为本发明提供的探针二维剖面图;
图2为本发明提供的探针三维结构示意图;
图3为适用于本发明探针的体外控制系统原理图;
图4为本发明探针实现OCT-热层析成像的体外控制系统原理图;
图5为本发明探针实现PA-热层析成像的体外控制系统原理图;
图6为本发明探针实现IVUS-热层析成像的体外控制系统原理图;
图7为本发明探针为激光消融提供温度场反馈的工作示意图。
图中,1—超声换能器引线、2—固定柱、3—GRIN聚焦透镜、4—反射棱镜、5—超声换能器、6—甘油、7—支撑底座、8—远红外光纤、9—可见-近红外光纤、10—封装壳、11—金属导丝、12—柔性导管。
具体实施方式
为使本发明的目的、技术方案和优点更加清晰,下面结合具体实施例附图对本发明作进一步详细说明。
实施例1
请参照图1所示,本发明提供的一种基于多模成像的血管内热层析成像探针由超声换能器引线1、固定柱2、GRIN聚焦透镜3、反射棱镜4、超声换能器5、甘油6、支撑底座7、远红外光纤8、可见-近红外光纤9、封装壳10、金属导丝11和柔性导管12构成。固定柱2被固定于封装壳10中,固定柱2外径应与封装壳10内径相吻合,用于固定远红外光纤8和可见-近红外光纤9;GRIN透镜3被固定于支撑底座7上,其输入端与两种光纤8和9紧贴放置,起到对光信号定向和聚焦功能;反射棱镜4位于GRIN透镜3前端用于将OCT成像、光声成像以及激光消融的光信号反射至血管组织;超声换能器5固定于反射棱镜6后面,用于发射和接收声学信号(发射/接收超声信号,接收光声信号);支撑底座7内部为镂空结构,可用于安放并引出超声换能器引线1;封装壳10为透明密封结构,内部充满甘油6用于探针内部绝缘和声学匹配性的提升;金属导丝11用于控制探针的轴向转动,因此其一端连接支撑底座7,另一端连接位移控制系统的转动马达;固定柱2左侧连接一柔性导管12,用于装载由力学底座7内引出的换能器引线1和金属导丝11。图2为本发明提供的探针三维结构示意图,适用于图1的结构需求;
请参照图3连接系统,本发明提供了一套适用于多模成像的血管内热层析成像探针体外控制系统,可满足所述血管内OCT成像、PA成像、IVUS成像和热层析成像功能,其中数据处理模块与图像重建模块分别与光电探测器、脉冲发射接收器和远红外探测器相连,可实现血管内三维形态学信息的提取、存储和计算,并将其与远红外探测器获取的热源信息结合反演,得到血管内三维温度分布图。下面根据图3结构详述血管内热层析过程:
步骤1、将所述探针送入至患者血管内;
步骤2、开启体外控制系统,控制同步控制模块使激光光源、脉冲发射/接收器分别产生近红外光、可见光以及超声信号;
具体地,所述同步控制模块的输出端分别与激光光源、脉冲发射/接收器、位移控制模块和数据处理与图像重建模块相连,并采用同步时分复用的方式进行信号传输。所述激光光源同步产生近红外、可见光两种波长光信号,其分别用于该系统的OCT成像和PA成像;所述脉冲发射/接收器产生稳定的电脉冲信号,经超声换能器引线1传输至封装壳10内的超声换能器5产生逆压电效应形成超声波;所述位移控制模块的输入端与同步控制模块相连,成像过程中,同步控制模块控制位移控制模块实现探针在血管内的推进、回撤和轴向扫描;数据处理模块接收到光学、声学和热学信号后可实时完成数据采集、存储和计算。
步骤3、利用位移控制模块控制多模成像模块获取血管内的三维形貌学信息(OCT、IVUS、PA),并将该信息(空间离散点坐标)存储于数据处理与图像重建模块,记血管内病灶处任意一点三维坐标为v
具体地,该步骤可通过所述同步控制模块以同步时分复用的方式同时产生OCT、PA、IVUS以及热层析信号,其中近红外、可见光信号由同步控制模块分别控制激光光源产生,并作为OCT、PA的信号源,IVUS信号由同步控制模块控制脉冲发射/接收器产生。经血管组织返回的OCT光信号和IVUS、PA信号分别由光电探测器和脉冲发射/接收器接收读取,此时将血管的三维形貌信息记录于数据处理与图像重建模块进行运算和存储,一方面传递至图像显示模块进行数字编码成像,另一方面存储至数据处理与图像重建模块的数据存储器中用于提供血管内热层析成像的三维形貌学信息和坐标依据。
在成像过程中,位移控制模块的输出端分别连接金属导丝11和柔性导管12,所述金属导丝一端连接支撑底座7,另一端连接所述位移控制模块转动马达,可探针在血管内的轴向旋转;所述柔性导管12用于控制探针在血管内的位置,实现探针的推进和回撤;所述体外控制系统开启后,使用者可利用控制同步控制模块控制位移控制模块分别改变柔性导管12、支撑底座7在血管内、封装壳10中的位置来实现多模式成像功能。
步骤4、保持位移控制器在血管内相对位置不变,将远红外探测器获取的血管内该病灶处热辐射信息存储于数据处理与图像重建模块,并记该点热辐射强度值为w
具体地,当血管内局部产生病变时,该部分向外辐射的温度将有异于血管其他部位,利用远红外探测器可获取血管内局部病灶区域向外辐射的远红外信号,该信号携带的热辐射信息可用于血管内三维温度场的反演。所述体外控制系统开启后,远红外探测器将用于实时捕捉血管内的热辐射强度信息,并将其转化为电信号传输至数据处理与图像重建模块,然后记录并储存扫描处各点的温度值。
步骤5、数据处理与图像重建模块内含三维温度场反演算法,利用步骤4中的某点辐射强度值w
具体地,人体血管内信息可将其等效替换为温度信息来描述,一般情况下,人体血管内热学表达式为,它通过将组织的表征参数转换为等效的温度场模型来实现对病灶的诊断,其表达式为:
根据本发明使用条件,式中ρ代表密度;c为比热容;k为导热常数;T为温度场三维分布函数;w
设稳态情况下,血管组织内部的物理状态达到相对平衡,即
将其带入原传热模型,则有
若记w为血流因子、血管组织内外产生的总热量,则有
当病灶区域较小时,w可通过脉冲函数δ(r)表示为点热源结构,即
由于球坐标具有对称性,齐次方程
i)r=0时,对方程做体积分处理,即
式中V为任意小球体的半径。进一步地,由高斯定理得,
ii)r≠0时,方程通解为
进一步地,将
该式
其中T
步骤6、将步骤5中求得的三维温度场信息T’进行彩色编码,最终实现血管内热层析成像;
具体地,数据处理与图像重建模块中含有RGB彩色编码算法,按照获得的血管内温度强度进行归类计算,可实现血管内热层析图像,最后通过视频数据线连接到图像显示模块串口,在图像显示模块可显示清晰的血管内热层析图像。
步骤7、调节图像显示模块,对血管内的成像方式进行选择(可选择OCT、PA、IVUS和热层析的一种或多种),并结合成像结果对血管内斑块进行病例剖析;
具体地,所述体外控制系统采用同步时分复用方法传递信息,因此所述OCT、PA、IVUS和热层析四种成像可几乎同时实现,使用者可根据需求对血管内三维形貌学图像(OCT、IVUS、PA)和功能学图像(热层析)进行选择。
步骤8、关闭体外控制系统,将所述探针回撤至患者体外结束检测。
实施例2
请参照图4连接系统,在另一可选实施例中,本发明提供了一套适用于OCT-热层析的系统连接方案。所述系统由同步控制模块、激光光源、90:10耦合器、环形器、参考臂、50:50耦合器、可见-近红外光纤、远红外光纤、光电探测器、远红外探测器、位移控制系统、数据处理与图像重建模块和图像显示模块构成。OCT成像具有局部高分辨特性,其轴向分辨率可达10μm左右,因此可用于提供血管内斑块的高分辨率特征信息。
具体地,同步控制模块与激光光源输入端相连,经调节后光源可激发1310nm左右的近红外光信号用于OCT成像,该信号在90:10光纤耦合器中进行分束,其中10%功率射入参考臂(由准直镜、透镜和反射镜组成),90%功率进入样品臂。进入样品臂的光信号经探针射入血管组织,这一过程中可通过位移控制器对探针位置进行调节,以获取血管内斑块的形貌特征。经反射回的光信号将通过环形器,然后进入50:50的耦合器与10%参考臂信号进行干涉最后传入光电探测器对信号进行读取,读取的信息以电信号形式传入至数据处理与图像重建模块进行A/D转换、存储和计算,OCT的图像可呈现至图像显示模块。下面结合具体实施例进行详述:
首先,将所述探针送入至患者血管内;
第二,开启体外控制系统,调节激光光源使其发射近红外光信号;
第三,对血管内进行OCT成像,并将血管内的三维形态学信息以离散坐标形式储存于数据处理与图像重建模块,记为v
第四,保持探针在血管内的相对位置不变,利用远红外探测器获取血管内的点热源辐射信息,并将获取的辐射强度值记为w
第五,利用数据处理与图像重建模块对血管内三维温度场进行反演,并利用图像编码功能赋予温度场颜色信息;
第六,调节图像显示模块,观察血管内的斑块形貌及温度特征,分析和诊断斑块的病理信息,确定治疗方案;
第七,调节位移控制模块,改变探针在血管腔内的位置,并重复操作第二步至第六步,分析下一斑块病理特征;
第八,关闭体外控制系统,将探针回撤至患者体外,完成成像工作。
实施例3
请参照图5连接系统,在另一具体实施例中,本发明提供了一种适用于PA-热层析成像的系统连接方案。所述系统由同步控制模块、激光光源、可见-近红外光纤、远红外光纤、远红外探测器、位移控制系统、数据处理与图像重建模块和图像显示模块构成。PA激光可采用可见光波长,该波段光信号射入血管内的斑块位置时,可激发斑块产生超声波。所述超声波将由探针内的超声换能器5接收,以正压电效应的方式转换为脉冲信号传入脉冲发射/接收器进行读取后传输至数据处理与图像重建模块,对图像进行降噪、放大和A/D等作用后传输至图像显示模块完成PA成像。
数据处理与图像重建模块内部的储存卡将储存PA信号携带的血管内三维形态学信息,并将其与远红外探测器实时获取的温度信息结合反演,可获取PA成像条件下的血管内热层析图像,下面结合具体实施例进行详述:
首先,将所述探针送入至患者血管内;
第二,开启体外控制系统,调节激光光源使其发射可见光信号;
第三,对血管内进行PA成像,并将血管内的三维形貌学信息以离散坐标形式储存于数据处理与图像重建模块,记为v
第四,保持探针在血管内的相对位置不变,利用远红外探测器获取血管内的热辐射信息,并将辐射强度值记为w
第五,利用数据处理与图像重建模块对血管内三维温度场进行反演,并利用图像编码功能赋予温度场颜色信息;
第六,调节图像显示模块,观察血管内的斑块形貌及温度特征,分析和诊断斑块的病理信息,确定治疗方案;
第七,调节位移控制模块,改变探针在血管腔内的位置,并重复操作第二步至第六步,分析下一斑块病理特征;
第八,关闭体外控制系统,将探针回撤至患者体外,完成成像工作。
实施例4
请参照图6连接系统,在另一具体实施例中,本发明提高了一种适用于IVUS-热层析成像的系统连接方案。所述系统由所述系统由同步控制模块、脉冲发射/接收器、远红外光纤、远红外探测器、位移控制系统、数据处理与图像重建模块和图像显示模块构成。所述脉冲发射/接收器用于向探针内提供电脉冲信号,经超声换能器引线1传递至超声换能器5,然后以逆压电效应的形式向血管内发射超声波。所述超声波接触到血管内斑块后返回至超声换能器5接收,经正压电效应形成脉冲电流信号由引线1再次传输至脉冲发射/接收器读取,完成IVUS信号的获取工作,最后通过数据处理与图像重建模块对信号进行降噪、读取、储存和计算等一系列工作后,传输至图像显示模块完成IVUS成像。
特别地,IVUS信号具有比OCT、PA更大的穿透深度,可获得血管内斑块较多的深度方向形态学信息,获取的信息同样被储存于数据处理与图像重建模块中,用于热层析图像的反演。下面结合具体实施例进行详述:
首先,将所述探针送入至患者血管内;
第二,开启体外控制系统,调节脉冲发射/接收器,使其产生电脉冲信号;
第三,对血管内进行IVUS成像,并将血管内的三维形态学信息以离散坐标形式储存于数据处理与图像重建模块,记为v
第四,保持探针在血管内的相对位置不变,利用远红外探测器获取血管内的热辐射信息,并将获取辐射强度值记为w
第五,利用数据处理与图像重建模块对血管内三维温度场进行反演,并利用图像编码功能赋予温度场颜色信息;
第六,调节图像显示模块,观察血管内的斑块形貌及温度特征,分析和诊断斑块的病理信息,确定治疗方案;
第七,调节位移控制模块,改变探针在血管腔内的位置,并重复操作第二步至第六步,分析下一斑块病理特征;
第八,关闭体外控制系统,将探针回撤至患者体外,完成成像工作。
实施例5
请参照图7所示,在另一具体实施例中,本发明还可以通过血管内热层析成像对激光消融进行三维温度场实时检测,用于提供反馈,使消融温度达到精准可控,激光消融的光信号可通过可见-近红外光纤传输。
本发明探针还可用于消融工作,本实施例选取激光消融这一消融方式进行举例,此外还可以选择射频消融等其他消融方式。
具体地,所述激光消融利用近红外光对斑块进行灼烧,由于系统采用同步时分复用进行,因此该步骤能够和系统成像工作同时进行,即先通过成像方式定位斑块位置;然后通过数据处理与图像重建模块反演三维温度场分布信息,实现对血管内的热层析成像,并设置血管内激光消融的适宜温度范围;开启消融激光对斑块进行消融,数据处理与图像重建模块始终对血管内消融区域进行实时温度检测,当温度过高时,消融激光可降低功率或暂停,当温度过低时,消融激光可提高功率,以实现精准消融。
可选地,根据图7所示工作示意图,下面结合血管内热层析成像具体分析实现精准消融过程:
首先,确定消融方案,根据已知的血管内形态学信息和远红外探测器获得的热辐射信息来反演斑块区域的三维温度场分布信息;
第二,调节激光光源,将发射激光波长调节至消融用近红外光信号;
第三,调节探针位置对斑块进行激光消融,同时观察图像显示模块中热层析成像提供的血管内温度,直至斑块消融恰当。消融过程中,使用者应始终控制血管内温度于消融方案允许的范围之内,以防止损伤到健康的血管组织(当温度过高时,消融激光可降低功率或暂停,当温度过低时,消融激光可提高功率,以实现精准消融);
第四,关闭激光光源,完成消融过程。根据使用者需求进行血管内下一病灶的消融或将导管脱离至患者体内完成消融工作。
本发明所述并不局限于上述实例及应用,所应理解的是,以上所述仅为本发明的具体实施例而已,本领域技术人员可以对本发明的技术方案进行修改或等同替换,而不脱离本发明的原理和范围,本发明保护范围应与权力要求书所述为准。
- 一种基于阵列式单极电导探针的两相流层析成像系统
- 一种基于阵列式单极电导探针的两相流层析成像系统
