靶向外泌体及制备方法、应用、药物和药物递送系统
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及抗肿瘤领域,具体涉及一种靶向外泌体及制备方法、应用、药物和药物递送系统。
背景技术
表皮生长因子受体(epidermal growth factor receptor,EGFR)家族是一类跨膜蛋白受体,具有酪氨酸激酶活性,通过调节下游信号转导,在肿瘤细胞的发生、发展和转移中发挥重要作用。EGFR在肿瘤中高表达以及其在肿瘤生长分化中起的重要作用,使其成为肿瘤诊断、抗肿瘤治疗的重要靶点。目前,研发抑制恶性肿瘤中EGFR高表达的药物已成为治疗恶性肿瘤生长和转移的重要手段之一。然而,在EGFR抑制剂研发中,虽有吉非替尼、西妥昔单抗等已被应用于临床,但疗效并非理想,其它一些生物抑制剂仍处于基础研究和临床研究阶段。同时,以EGFR作为靶点,寻找抑制恶性肿瘤中EGFR高表达的药物是研发抗肿瘤新药或类似化合物的重要途径之一。
发明内容
针对现有技术的不足,本发明提出了一种基于抗EGFR单链抗体(single chainantibody fragment,scFv)及外泌体lamp2b膜蛋白的靶向外泌体及制备方法、应用、药物和药物递送系统,达到对肿瘤细胞起到特异性的杀伤作用。
本发明的目的可以通过以下技术方案实现:
第一个方面,本发明提供了一种靶向外泌体,包括通过单链抗体与外泌体膜蛋白融合表达得到的融合蛋白,其中单链抗体位于外泌体表面;所述融合蛋白的氨基酸序列如SEQ.ID.NO.1所示。
在一些实施例中,包括编码所述融合蛋白得到核苷酸,其能够在真核细胞中表达所述融合蛋白,所述核苷酸的序列如SEQ.ID.NO.2所示。
第二个方面,本发明提供了一种制备表达如上所述的靶向外泌体的融合蛋白的制备方法,包括以下步骤:
将如SEQ.ID.NO.2所示的核苷酸克隆入pcDNA3.1(-)表达载体,构建重组质粒;
将重组质粒转染大肠杆菌,并在含卡那霉素的培养基中培养,挑取克隆、扩增、提质粒;
通过质粒瞬时转染法转染HEK293T细胞系,将细胞培养液更换为含无外泌体血清的培养液并扩大培养,采用超速离心法提取传代培养的已转染HEK293T细胞分泌的外泌体。
在一些实施例中,可以通过电子显微镜及粒度仪测量外泌体理化性质;通过免疫荧光显微镜确定外泌体内化活性及细胞内定位;通过活体成像确定外泌体能够通过血液循环进入鼠荷瘤组织。
第三个方面,本发明提供了如上述的靶向外泌体在制备抗肿瘤药物、抗肿瘤辅助药物或肿瘤诊断药物中的应用。
第四个方面,本发明提供了如上述的靶向外泌体在制备靶向EGFR的药用外泌体载体中的应用。
在一些实施例中,所述载体通过携带siRNA或microRNA进入肿瘤细胞内部并释放所述靶向外泌体。
在一些实施例中,所述载体以纳米颗粒的形式进入肿瘤细胞内部。
在一些实施例中,所述纳米颗粒是脂质体。
第五个方面,本发明提供了一种药物,包括如上所述的靶向外泌体。
在一些实施例中,上述药物为抗肿瘤药物组合物。
在一些实施例中,药物组合物还包括药物活性成分,具体可以是基因、蛋白质或其它药物活性成分。
第六个方面,本发明提供了一种药物递送系统,包括作为递送载体的如上所述的靶向外泌体。
在一些实施例中,药物递送系统为抗肿瘤药物递送系统。
本发明的有益效果:
本发明提供的基于抗EGFR单链抗体及外泌体膜蛋白lamp2b的,利用真核细胞HEK293T细胞表达的,培养上清液超速离心后获得的靶向外泌体scFv-Exo,既保留了scFv与细胞EGFR结合的特异性和亲和力,又通过lamp2b确保了scFv-lamp2b融合蛋白在外泌体膜表面定位,电子显微镜及粒度仪测量scFv-Exo理化性质良好,免疫荧光显微镜及动物活体成像证实scFv-Exo实现了内化入EGFR阳性肿瘤细胞的可行性和准确性。实验结果表明其具有高靶向性,内化性效果良好。
本发明提供的基于抗EGFR单链抗体及外泌体lamp2b膜蛋白的靶向外泌体scFv-Exo,可以利用scFv对肿瘤细胞的靶向性和外泌体的运输作用,应用于制备靶向细胞EGFR的药用载体、携带载体,包括所述的靶向外泌体在携带siRNA、microRNA、脂质体、纳米颗粒、药物中的一种或几种进入肿瘤细胞内部并释放,用于制备抗肿瘤药物、抗肿瘤辅助药物或肿瘤诊断试剂,实现对肿瘤细胞特异性的识别和杀伤作用;其相对应的编码核苷酸,则可以参与载体的构建,或者进行表达。有良好的应用前景,为肿瘤的诊断、治疗提供了一种新的选择。
附图说明
下面结合附图对本发明作进一步的说明。
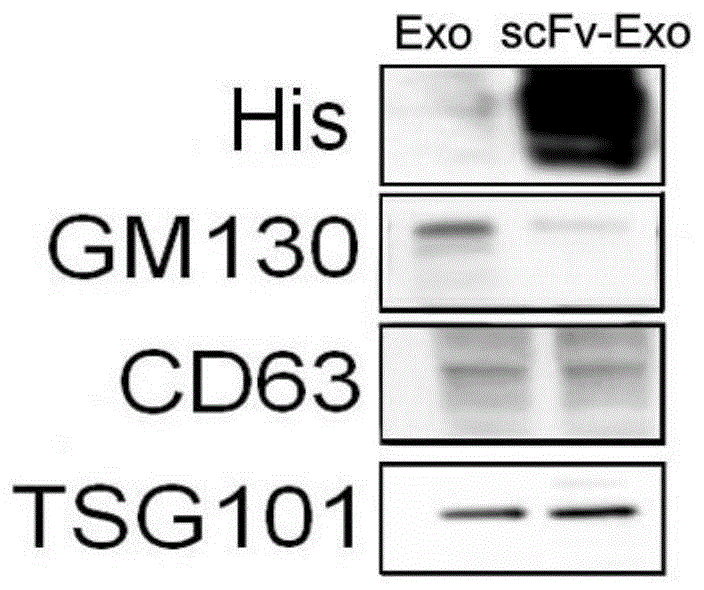
图1为本申请的western blot实验表明转染后HEK293T细胞外泌体表达scFv蛋白示意图;
图2为本申请的scFv-Exo外泌体电镜图;
图3为本申请的scFv-Exo外泌体粒径分布图;
图4为本申请的免疫荧光检测scFv-Exo体外靶向结合能力图;
图5为本申请的scFv-Exo的体内靶向性结合能力图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
1、基于抗EGFR单链抗体及外泌体膜蛋白的靶向外泌体的构建和制备
(1)序列的构建
本发明利用单链抗体scFv及外泌体lamp2b膜蛋白来实现外泌体的靶向输送作用。所构建的EGFR scFv及外泌体lamp2b膜蛋白融合蛋白,由连接肽连接scFv重链可变区、轻链可变区以及lamp2b而构成,融合蛋白末端带有检测所需6×His标签,所述的重链可变区、轻链可变区、外泌体膜蛋白和连接肽均经过大量的筛选,尤其是以融合表达之后的活性、表达量作为重要依据。
本发明所构建的抗EGFR单链抗体及外泌体lamp2b膜蛋白的融合蛋白氨基酸序列如下(SEQ.ID.NO.1)所示:
该单链抗体具有660个氨基酸残基,其中第1到第28aa为信号肽,第29到第147aa为重链可变区,第148到第162aa为连接肽,第163到第272aa为轻链可变区,第273到第654aa为外泌体lamp2b膜蛋白区,第655到660aa为6×His标签。
从氨基酸序列反向设计核酸表达序列,合成单链抗体与外泌体膜蛋白融合蛋白的融合基因,并进行密码子优化,所得的核苷酸序列如SEQ.ID.NO.2所示:
将SEQ.ID.NO.2所示的核苷酸序列克隆入pcDNA3.1(-)表达载体的NheI及XhoI位点之间,构建表达质粒。
(2)稳定表达scFv-lamp2b融合蛋白细胞系的构建
本发明采用真核表达载体在真核细胞中表达scFv-lamp2b融合蛋白,之后超速离心法提取细胞所分泌外泌体。
将构建好的表达质粒采用脂质体法转入HEK293T细胞,以转染空质粒的HEK293T细胞作为对照。
2、对scFv-Exo进行提取、鉴定
(1)外泌体的提取:将细胞培养液更换为含无外泌体血清的培养液并扩大培养,采用超速离心法提取传代培养的已转染/未转染HEK293T细胞分泌的外泌体:收集培养液,300g离心10min去除活细胞;4℃下2000g离心10min去除死细胞;4℃下10000g离心2h去除细胞碎片;上清用0.22μm滤膜过滤后,于4℃下100000g离心70min,弃上清并用PBS溶液重悬沉淀,收获外泌体。
(2)鉴定:
①Western blot实验检测scFv-lamp2b在外泌体膜表达:两组HEK293T细胞培养液上清经超速离心后取外泌体,加入上样缓冲液煮沸、电泳、转膜,封闭后与外泌体标记GM130抗体、TSG101抗体及scFv的标签6×His抗体共孵育,洗膜后加入辣根过氧化物酶(HRP)标记的二抗,化学发光法观察融合蛋白表达情况并照相。
如图1所示,结果表明:western blot能够在实验组HEK293T细胞培养液上清中检测到scFv-Exo融合蛋白6×His标签蛋白、外泌体CD63及TSG101蛋白表达,说明融合蛋白表达完整,外泌体提取成功,而对照组外泌体Exo仅有CD63及TSG101表达(图1)。
②电镜观察外泌体形态:将外泌体样品用2.5%的戊二醛/0.1M二甲砷酸盐溶液固定1h,PBS清洗后再经2%锇酸溶液固定,PBS洗后用50%、70%、80%及90%的乙醇各1ml脱水15min,再用无水乙醇脱水2次20min;用1ml丙酮溶液置换2次,每次15min;将样品置入包埋剂,37℃静置2h;37-65℃梯度温度固化后,用超薄切片机将样品切成50nm切片;3%醋酸铀、枸橼酸铅溶液各染色10min;清洗后使用透射电镜照相,同时测量外泌体直径。如图2及图3所示,结果显示:外泌体的提取成功,典型外泌体形态呈“茶托样”(图2)。
③外泌体粒径、浓度:粒径分析仪(Malvern,Zetasizer Ver.7.13)检测外泌体粒径,外泌体粒子分布较为均一,约为190.4±23.8nm(图3);PBS稀释后,BCA法测量外泌体浓度,为1.19±0.42μg/ul。
3、scFv-Exo靶向内化EGFR阳性PC9肺癌细胞
将PKH67荧光染料标记后的scFv-Exo、Exo与EGFR阳性PC9细胞共孵育,之后用4%多聚甲醛固定1h,0.5%Triton X100打孔,1%BSA溶液封闭30min后,与抗His抗体或抗lamp2b抗体4℃孵育8h,PBS洗后再与Cy3标记的二抗室温避光孵育1h,DAPI染核,免疫荧光显微镜下观察并照相,后用50%甘油封片,免疫荧光显微镜观察细胞荧光分布,确定scFv与exo在靶细胞膜表面及细胞内是否存在共定位。
如图4所示,结果表明:scFv与Exo在PC9细胞内存在共定位,Exo是由scFv引导进入EGFR阳性细胞质之内的。(蓝:DAPI标记细胞核;红:Cy3二抗标记scFv-lamp2b;绿:PKH67标记Exo)。对照组Exo进入PC9细胞内较少。
4、scFv-Exo体内靶向结合能力
将scFv-Exo、Exo经鼠尾静脉注射入已荷瘤(PC9细胞)一周的裸鼠右大腿皮下。经48小时后使用IVIS LuminaⅡ系统拍照。
结果表明:与注射了Exo的裸鼠相比,scFv-Exo可随时间延长逐渐靶向汇聚于移植瘤(红圈所示)(如图5A所示),定量分析表明scFv-Exo在移植瘤内荧光强度明显高于Exo(如图5B所示)。证明scFv-Exo具有良好的体内靶向亲和能力。
鉴于scFv-Exo对EGFR阳性肿瘤细胞的高靶向性、亲和力及内化活性,因此scFv-Exo可以进行以下应用:
在制备肿瘤诊断试剂抗肿瘤药物或抗肿瘤辅助药物中的应用。
具体的,抗scFv-Exo可运载示踪剂,发挥肿瘤示踪的诊断功能。
scFv-Exo可运载小分子物质,如siRNA、microRNA、脂质体、纳米颗粒、药物等进入肿瘤细胞内部并释放,发挥抑制、杀伤肿瘤细胞作用。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。
/>
/>
/>
/>
/>
/>
/>
/>
- 核酸-药物结合物、药物递送系统及其制备方法和应用
- 靶向外泌体及制备方法、应用、药物递送系统和药物
- 一种外泌体药物递送系统及其制备方法和应用
