一种基于普鲁士蓝纳米金的生物传感器及制备方法与应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于生物医学工程技术领域,涉及微生物的检测分析,具体涉及一种基于普鲁士蓝纳米金(PB@Au)的生物传感器及制备方法与应用。
背景技术
公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
传统的微生物培养方法是沙门氏菌检测的国家标准方法,虽然其准确度高,但费时费力、专业性强,不适用于现场快速检测。免疫分析方法如酶联免疫法和荧光免疫法等利用抗体作为识别分子,可以准确地识别目标待测物,但免疫测定的专业性和仪器依赖性使其难以用于现场快速检测。免疫层析方法具有操作方便、检测快速、成本低、对检测人员要求不高等优点,广泛应用于医疗诊断、食品安全、环境监测等领域检测。但免疫层析技术由于硝酸纤维素膜不均匀、易受环境影响等使其灵敏度和准确性仍有待提高,其定量检测方法仍有待探索。
发明内容
为了解决现有技术的不足,本发明的目的是提供一种基于普鲁士蓝纳米金的生物传感器及制备方法与应用,通过本发明提供的种基于普鲁士蓝纳米金的生物传感器能够实现对沙门氏菌等目标微生物的快速、灵敏、半定量检测。
为了实现上述目的,本发明的技术方案为:
一方面,一种基于普鲁士蓝纳米金的生物传感器,由检测探针、检测毛细管和双氧水组成;所述检测探针由普鲁士蓝纳米金和第一识别分子构成,所述第一识别分子连接在普鲁士蓝纳米金表面;所述检测毛细管从一端至另一端依次设置检测区和测量区,检测区内壁固定第二识别分子;双氧水与检测毛细管配合;
所述第一识别分子和第二识别分子均为能够与目标微生物特异性结合的材料。
本发明提供的生物传感器中,能够通过第一识别分子和第二识别分子与目标微生物特异性结合,从而使检测探针固定在检测毛细管的检测区,此时,再向检测毛细管中添加双氧水,双氧水被普鲁士蓝纳米金催化分解出O
所述第一识别分子可以为抗体、适配体等,所述第二识别分子可以为抗体、适配体等。当第一识别分子为抗体时,检测探针为免疫探针;当第二识别分子为抗体时,检测毛细管为免疫毛细管。
另一方面,一种基于普鲁士蓝纳米金的生物传感器的制备方法,包括检测探针的制备和检测毛细管的制备;
检测探针的制备:向普鲁士蓝纳米金的溶液中添加碱性化合物混合均匀,然后加入目标微生物抗体进行混合,即得;
检测毛细管的制备;将玻璃毛细管内表面进行氨基修饰,将目标微生物抗体溶液注入至氨基修饰的玻璃毛细管的检测区,孵育后即得。
第三方面,一种上述基于普鲁士蓝纳米金的生物传感器在检测目标微生物中的应用。
第四方面,一种沙门氏菌的检测方法,提供上述基于普鲁士蓝纳米金的生物传感器,所述目标微生物为沙门氏菌;包括如下步骤:
(1)将检测探针溶液与待测含有沙门氏菌的溶液混合,进行孵育;
(2)将步骤(1)获得的溶液添加至检测毛细管的检测区,进行孵育,孵育后清除溶液;
(3)将双氧水注入至步骤(2)获得的检测毛细管的检测区,对所述检测区进行光照,并记录双氧水液柱的移动距离ΔL;
(4)根据步骤(3)获得的ΔL进行沙门氏菌的检测。
第五方面,一种沙门氏菌的检测试剂盒,包括上述基于普鲁士蓝纳米金的生物传感器、缓冲液、光源。
本发明的有益效果为:
(1)本发明利用普鲁士蓝纳米金的类过氧化氢酶活性催化H
(2)本发明利用普鲁士蓝纳米金作为毛细管检测方法的标记材料构建检测探针,利用探针的过氧化物氢催化活性代替了传统生物大分子酶促反应,大大提高了酶的稳定性,降低了检测成本,同时提高了检测灵敏度。
(3)本发明建立了基于普鲁士蓝纳米金优异光热转换性能构建免疫毛细管快速检测方法,依据普鲁士蓝纳米金与免疫毛细管结合后测定气体体积转换的液柱移动距离与病原菌浓度的标准曲线来实现对待测物的快速、灵敏、半定量检测,其检测灵敏度较高。其整个检测时间约为30min,明显低于酶联免疫的检测过程(约3h)。
附图说明
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
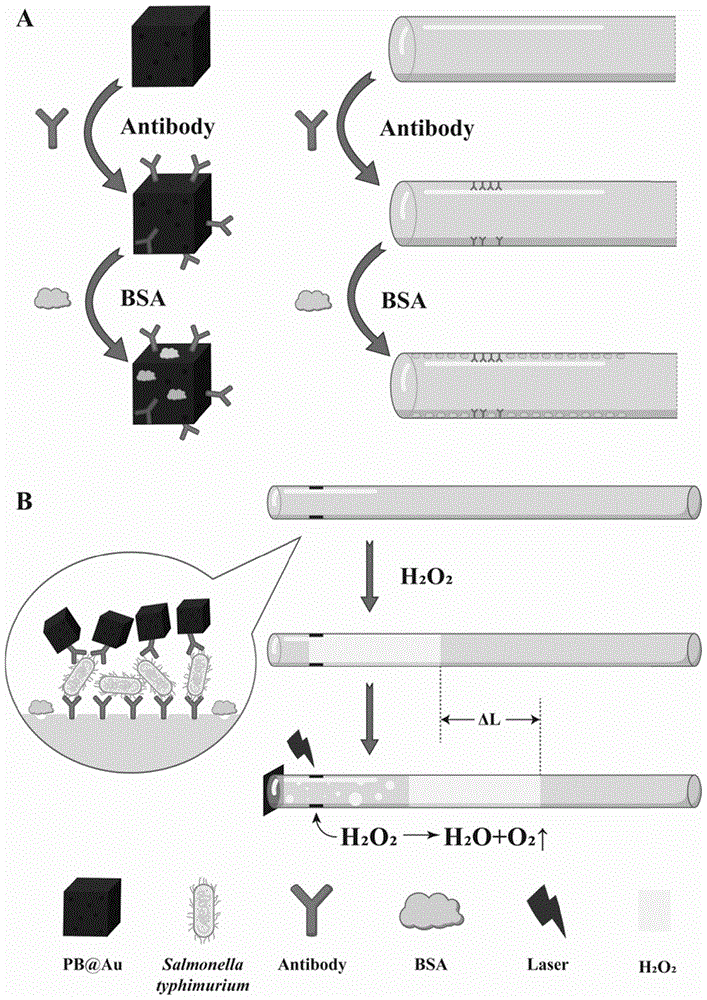
图1为本发明实施例中检测原理图;A为免疫探针和免疫毛细管的制备过程图,B为利用免疫探针和免疫毛细管检测鼠伤寒沙门氏菌的过程图。
图2为本发明实施例中普鲁士蓝(PB)制备过程的K
图3为本发明实施例中(A)PB@Au制备过程的PB浓度优化图和(B)PB@Au复合材料室温12h的稳定性表征图。
图4为本发明实施例中(A)PB和PB@Au的紫外-可见光吸收光谱图;插图:PB和PB@Au溶液图像;(B)PB和PB@Au的水合粒径;(C)PB和PB@Au的Zeta电位;(D)PB的透射电镜图;(E)PB@Au的透射电镜图;(F)PB的XPS能谱图;(G)PB@Au的XPS能谱图;(H)PB和PB@Au的光热转换效率图。
图5为本发明实施例中毛细管连接的PB@Au浓度优化图。
图6为本发明实施例中PB@Au催化H
图7为本发明实施例中不同激光照射方式的优化选择图。
图8为本发明实施例中激光照射功率优化图。
图9为本发明实施例中激光照射时间优化图。
图10为本发明实施例中PB@Au封闭液浓度优化图。
图11为本发明实施例中(A)PB@Au添加不同浓度NaOH的颜色变化图和(B)PB@Au添加的NaOH浓度优化图。
图12为本发明实施例中PB@Au连接抗体浓度优化图。
图13为本发明实施例中毛细管封闭液浓度优化图。
图14为本发明实施例中毛细管包被抗体浓度优化图。
图15为本发明实施例中不同浓度鼠伤寒沙门氏菌的检测图。
图16为本发明实施例中方法特异性考察图;****,P<0.0001。
图17为本发明实施例中方法重复性考察图。
图18为本发明实施例中37℃储藏稳定性考察图。
图19为本发明实施例中实际样品中鼠伤寒沙门氏菌的检测图。
具体实施方式
应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
为了提供一种新的定量检测沙门氏菌等微生物的方法,本发明提出了一种基于普鲁士蓝纳米金的生物传感器及制备方法与应用。
本发明的一种典型实施方式,提供了一种基于普鲁士蓝纳米金的生物传感器,由检测探针、检测毛细管和双氧水组成;所述检测探针由普鲁士蓝纳米金和第一识别分子构成,所述第一识别分子连接在普鲁士蓝纳米金表面以识别目标物;所述检测毛细管从一端至另一端依次设置检测区和测量区,检测区内壁固定第二识别分子;双氧水与检测毛细管配合;
所述第一识别分子和第二识别分子均为能够与目标微生物特异性结合的材料。
所述第一识别分子可以为抗体、适配体等,所述第二识别分子可以为抗体、适配体等。当第一识别分子为抗体时,检测探针为免疫探针;当第二识别分子为抗体时,检测毛细管为免疫毛细管。在一些实施例中,第一识别分子为抗体,检测探针为免疫探针;第二识别分子为抗体,检测毛细管为免疫毛细管。
在一种或多种实施例中,免疫毛细管检测区内壁经过氨基修饰,然后通过氨基与抗体进行连接。
在一种或多种实施例中,免疫毛细管检测区通过牛血清白蛋白(BSA)封闭非特异性位点。
在一种或多种实施例中,免疫探针表面通过BSA封闭非特异性位点。
本发明的另一种实施方式,提供了一种基于普鲁士蓝纳米金的生物传感器的制备方法,包括检测探针的制备和检测毛细管的制备;
检测探针的制备:向普鲁士蓝纳米金的溶液中添加碱性化合物混合均匀,然后加入目标微生物抗体进行混合,即得;
检测毛细管的制备;将玻璃毛细管内表面进行氨基修饰,将目标微生物抗体溶液注入至氨基修饰的玻璃毛细管的检测区,孵育后即得。
所述碱性化合物,例如氢氧化钾、氢氧化钠等。
在一些实施例中,检测探针的制备过程中,加入目标微生物抗体混合的温度为35~40℃。
在一些实施例中,检测探针的制备过程中,鲁士蓝纳米金溶液浓度为0.6~1.0mg·mL
在一些实施例中,当普鲁士蓝纳米金溶液浓度为0.75~0.85mg·mL
在一些实施例中,当普鲁士蓝纳米金溶液浓度为0.75~0.85mg·mL
在一些实施例中,检测探针的制备过程中,加入目标微生物抗体混合后,添加BSA进行混合。
在一些实施例中,当普鲁士蓝纳米金溶液浓度为0.75~0.85mg·mL
在一些实施例中,所述普鲁士蓝纳米金的制备方法为:将普鲁士蓝溶液与氯金酸溶液混合,加热至沸腾,再加入柠檬酸钠溶液,搅拌并保持沸腾,降温后即得。
在一种或多种实施例中,当加入155~165μL浓度为0.5~1.5%(w/v)的氯金酸(HAuCl
在一种或多种实施例中,普鲁士蓝的制备方法为:将聚乙烯吡咯烷酮与铁氰化钾溶解于水中混合获得前体液,向前体液中加入盐酸,加热至160~180℃进行反应,反应后即得。前体液中铁氰化钾的浓度为0.005~0.03mol·L
在一些实施例中,采用3-氨丙基三乙氧基硅烷(APTES)对玻璃毛细管内表面进行氨基修饰。具体地,将毛细管浸入至APTES的甲醇溶液中,浸泡9~15h,洗涤干燥。
在一些实施例中,当采用2.0~3.0μL的目标微生物抗体溶液注入至氨基修饰的玻璃毛细管的检测区时,目标微生物抗体溶液浓度不低于70μg·mL
在一些实施例中,将目标微生物抗体溶液注入至氨基修饰的玻璃毛细管的检测区,孵育后,加入BSA溶液进行封闭处理。
在一种或多种实施例中,采用2.0~3.0μL的目标微生物抗体溶液注入至氨基修饰的玻璃毛细管的检测区,目标微生物抗体溶液浓度不低于70μg·mL
第三方面,一种上述基于普鲁士蓝纳米金的生物传感器在检测目标微生物中的应用。
具体地,所述目标微生物为沙门氏菌。更为具体地,所述目标微生物为鼠伤寒沙门氏菌。
第四方面,一种沙门氏菌的检测方法,提供上述基于普鲁士蓝纳米金的生物传感器,所述目标微生物为沙门氏菌;包括如下步骤:
(1)将检测探针溶液与待测含有沙门氏菌的溶液混合,进行孵育;
(2)将步骤(1)获得的溶液添加至检测毛细管的检测区,进行孵育,孵育后清除溶液;
(3)将双氧水注入至步骤(2)获得的检测毛细管的检测区,对所述检测区进行光照,并记录双氧水液柱的移动距离ΔL;
(4)根据步骤(3)获得的ΔL进行沙门氏菌的检测。
在一些实施例中,所述光照为激光照射。优选地,激光照射的功率为1~4W,优选为3~4W。激光照射时间为不低于80s,优选为80~120s。
第五方面,一种沙门氏菌的检测试剂盒,包括上述基于普鲁士蓝纳米金的生物传感器、缓冲液、光源。
具体地,所述缓冲液为PBS缓冲液。
具体地,所述光源为激光器。
为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
实施例
本实施例基于双抗夹心原理构建了一种基于普鲁士蓝纳米金的生物传感器,并利用该生物传感器建立了用于鼠伤寒沙门氏菌快速检测的毛细管气体驱动分析法。该生物传感器中利用制备的普鲁士蓝纳米金(PB@Au)纳米复合材料的类过氧化氢酶活性和光热效应提高检测鼠伤寒沙门氏菌的灵敏度。在生物传感器的构建过程中,鼠伤寒沙门氏菌抗体连接在PB@Au纳米颗粒表面,并通过牛血清白蛋白(BSA)封闭未结合抗体的活性位点,得到用于检测的PB@Au免疫探针。经过3-氨丙基三乙氧基硅烷(APTES)修饰后的玻璃毛细管拥有丰富的氨基基团,易于与鼠伤寒沙门氏菌抗体结合,毛细管结合抗体后用BSA进行封闭,得到免疫毛细管。依据双抗夹心原理使免疫探针通过鼠伤寒沙门氏菌固定在免疫毛细管上,毛细管内添加的H
(1)PB纳米材料的制备
称取1.5g聚乙烯吡咯烷酮(PVP)和0.033g铁氰化钾(K
铁氰化钾浓度优化
K
K
分别称取0.033g、0.066g、0.132g和0.198g的K
(2)PB@Au复合材料的制备
首先将50mL烧杯用食人鱼溶液浸泡15min以上,并用大量超纯水冲洗至中性。将PB溶液稀释至0.12mg·mL
复合材料制备的普鲁士蓝浓度优化
PB拥有良好的催化性能,但表面缺乏足够的活性位点使其连接抗体的效率不高。金纳米粒子除了通过静电作用力结合抗体,还可以通过与抗体的氨基形成Au-NH
在PB@Au复合材料制备的过程中,固定HAuCl
(3)PB@Au复合材料光热转换效率的测定
将PB@Au溶液稀释至某浓度,测得此浓度下在808nm波长的吸光度值,记为A
(4)PB@Au复合材料的表征
为了分析PB和PB@Au复合材料的物理性质、证明材料的成功合成,利用紫外-可见光分光光度法、动态光散射(DLS)、Zeta电位测量、透射电子显微镜(TEM)拍摄和X射线光电子能谱分析(XPS)等方法,对PB和PB@Au纳米材料进行表征。
图4A的紫外-可见光吸收光谱图显示,合成的PB和PB@Au纳米材料分别在764nm和736nm波长处存在最大吸收峰,证明了PB的存在,合成的PB@Au复合材料的最大吸收峰较PB红移了约28nm,且插图中复合材料合成后的颜色变化,证明了PB@Au复合材料的成功合成。
图4B的动态光散射显示,合成的PB@Au复合材料的水合粒径比PB纳米颗粒扩大了75nm左右,证明了PB纳米颗粒和Au纳米颗粒的成功复合。
图4C中PB@Au复合材料Zeta电位较PB降低了约2mV,Zeta电位绝对值的增加证明了材料的成功复合。
在图4D和图4E的透射电镜图像中,PB纳米颗粒呈立方体形,并且长约200nm左右,纳米材料的尺寸较为均匀并且分散性良好;PB@Au纳米颗粒是由许多Au纳米颗粒包裹PB纳米颗粒而成,且Au纳米颗粒均匀分散在PB纳米颗粒表面。
在图4F和图4G的PB和PB@Au的XPS能谱图中,分别出现了Fe元素的峰以及和Fe元素和Au元素的峰,证明了PB的合成和PB@Au的成功复合。
图4H为PB和PB@Au的光热转换效率,通过计算,纳米材料经过复合后,光热性能由PB的19.5%提高至31.1%,证明合成后的复合材料具有比PB更强的光热转换能力。
(5)毛细管连接复合材料浓度优化
为了确定毛细管连接复合材料的最大量,减少材料和抗体浪费,对连接毛细管的材料浓度进行优化。将PB@Au溶液分别稀释至0.6mg·mL
(6)复合材料催化和光热性能的优化
①PB@Au催化过氧化氢浓度优化
具有类过氧化氢酶活性的PB@Au可分解H
②激光照射方式的选择
H
③激光照射功率的优化
激光的照射功率直接影响毛细管内H
H
④激光照射时间的优化
毛细管内H
(7)PB@Au免疫探针的制备
将PB@Au溶液稀释至0.8mg·mL
①PB@Au复合材料封闭液浓度优化
为了防止PB@Au复合材料通过Au-NH
②PB@Au复合材料连接抗体pH优化
溶液的pH影响抗体与纳米复合材料的连接效果,抗体通常在弱碱性环境与纳米材料达到最佳的连接效果,但在碱性条件下,PB易分解为氢氧化铁沉淀,使催化和光热能力降低,并且在PB分解过程中,环境中的OH-不断被消耗,导致溶液pH在PB被分解完毕之前几乎不发生变化,无法通过测定和调节pH优化抗体和PB@Au复合材料的连接效果。因此,选择向PB@Au溶液中添加不同浓度的NaOH溶液进行优化。
首先取浓度为0.8mg·mL
③PB@Au复合材料连接抗体浓度优化
与优化毛细管包被抗体浓度的目的相同,也需要对PB@Au复合材料连接的抗体浓度进行优化。选择浓度为25μg·mL
(8)毛细管的修饰
首先将毛细管清洗干净并烘干,浸没于食人鱼溶液中超声1h,结束后用大量超纯水清洗至中性,并放置于烘箱中110℃干燥1.5h。毛细管干燥后冷却至室温,浸泡于20%的APTES甲醇溶液中12h,结束后用无水甲醇清洗残留的APTES溶液,并将毛细管放置于通风橱中15min使甲醇蒸发。最后将毛细管放置于烘箱中50℃干燥30min,得到修饰有APTES的毛细管,保存在氮气环境中,放置于4℃待用。
(9)免疫毛细管的制备
将2.5μL浓度为400μg·mL
①毛细管封闭液浓度优化
为了防止毛细管内的活性位点与鼠伤寒沙门氏菌发生非特异性吸附,产生假阳性结果,需要用BSA对毛细管进行封闭,优化封闭液的浓度以达到最优的封闭效果。将修饰后的毛细管分别浸入超纯水和2%、4%、6%和8%的BSA溶液中,封闭结束后对鼠伤寒沙门氏菌进行检测。结果如图13所示,随着毛细管封闭的BSA浓度的上升,毛细管内未结合抗体的活性位点逐渐被封闭液封闭,使毛细管内H
②毛细管包被抗体浓度优化
抗体作为鼠伤寒沙门氏菌的特异性识别分子,其在毛细管上的连接量直接影响检测效率。抗体的连接量过少会影响检测的灵敏度;抗体的连接量过多造成浪费,提高检测成本。因此需要对毛细管连接的抗体浓度进行优化。
在毛细管一端分别注入2.5μL浓度为100μg·mL
(10)鼠伤寒沙门氏菌的检测
将PB@Au免疫探针溶液添加到含有浓度为10
(11)检测性能分析
①检测特异性分析
为了验证所建立的检测方法可以特异性识别鼠伤寒沙门氏菌,分析检测方法的特异性,选择四种常见的食源性致病菌:大肠杆菌、肠炎沙门氏菌、李斯特菌和金黄色葡萄球菌,作为非目标菌进行检测。检测的四种非靶标细菌的浓度被稀释到10
②检测重复性分析
为了分析检测方法的重复性,对浓度为10
③免疫毛细管稳定性分析
为了分析储存过程中抗体失活等原因对检测效率的影响,对检测方法的稳定性进行分析。选择37℃作为储藏温度,0、1、2、3天作为储藏时间对免疫毛细管的稳定性进行考察。结果如图18所示,随着储藏时间的延长,抗体的逐渐失活使检测效率下降,在37℃储藏3天后,最终检测效率保留了82%,表明所建立的检测方法具有良好的储藏稳定性。
(12)实际样品中鼠伤寒沙门氏菌检测
为了分析检测方法在实际样品中应用的可行性,选择了三种易感染鼠伤寒沙门氏菌的实际样品:自来水、牛奶和葡萄汁进行细菌加标的添加回收率测定。在三种阴性样品中分别添加不同浓度的鼠伤寒沙门氏菌(10
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种负载型普鲁士蓝电化学生物传感器标记物的制备方法
- 一种基于普鲁士蓝的智能可穿戴酶基生物传感器及其制备方法和应用
- 一种基于聚乙烯亚胺和普鲁士蓝的肿瘤纳米药物及其制备方法和应用
