一种桃仁中D-苦杏仁苷的提取方法及其应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及一种苦杏仁苷的提取方法,尤其是涉及一种桃仁中D-苦杏仁苷的提取方法及其应用。
背景技术
桃仁是蔷薇科(
苦杏仁苷是生氰糖苷家族中最常见的成员之一。它是α-羟基腈的衍生物,也是一种简单的天然化学物质,广泛存在于许多蔷薇科植物的种子中,如苹果、山楂、枇杷、杨梅、杏、桃、欧李和青梅等。苦杏仁苷的分子式为C
苦杏仁苷存在一对差向异构体,苦杏仁苷的天然存在形式为D型,且D-苦杏仁苷对酸较稳定,但在碱性条件下,尤其是pH11时,一部分D-苦杏仁苷会快速转化成为其差向异构体——L-苦杏仁苷,而在中性条件下,D、L-苦杏仁苷能够稳定共存;除受环境的酸、碱条件影响外,苦杏仁中苦杏仁苷的差向异构化还会发生在热水溶液中。苦杏仁苷经β-葡萄糖苷酶酶解后的酶解产物——氢氰酸和苯甲醛有较强的抗肿瘤效果,有研究表明,β-葡萄糖苷酶对于D-苦杏仁苷的亲和力显著高于L-苦杏仁苷,由此而造成两种构型苦杏仁苷在抗肿瘤活性方面的较大差异。因此,如何有效避免在桃仁苦杏仁苷提取过程中D-苦杏仁苷的异构化就显得尤为重要。苦杏仁苷的提取方法包括有机溶剂提取方法,水提取方法,超临界CO
发明内容
本发明所要解决的技术问题是提供一种提取效率高、产品纯度高,耗时短的桃仁中D-苦杏仁苷的提取方法及其应用。
本发明解决上述技术问题所采用的技术方案为:一种桃仁中D-苦杏仁苷的提取方法,包括以下步骤:
(1)将桃仁置于微波炉中,采用功率400-500W处理5min,对桃仁中的β-葡萄糖苷酶进行灭活处理,将灭酶后的桃仁采用高速冷冻研磨机粉碎处理,过100目筛,得到灭酶桃仁粉末;
(2)将灭酶桃仁粉末按质量体积比1g:10-15mL的比例加入到沸程为60-90℃的石油醚中混匀,在288W,40-50℃条件下超声处理30-40min后,过滤,取脱脂桃仁滤渣室温下干燥,挥发除去残留石油醚后研磨成细粉,得到脱脂桃仁粉末;除去桃仁粉中的油脂便于苦杏仁苷的提取;
(3)将脱脂桃仁粉末按质量体积比1g:20-25 mL的比例加入到70-80vt%乙醇溶液中混匀,在360-432W,40-50℃条件下超声40min后,将提取液真空抽滤去除滤渣,取滤液于60 rpm,50℃旋转蒸发除去乙醇,即得到总苦杏仁苷粗品。
优选的,步骤(3)中所述的脱脂桃仁粉末与所述的乙醇溶液的质量体积比为1g:25mL。
优选的,步骤(3)中所述的乙醇溶液浓度为70vt%。采用70vt%乙醇溶液作为提取溶剂,一方面能减少提取液中水溶性杂质,提高苦杏仁苷的相对含量;另一方面,70%乙醇能很大程度抑制提取过程中的D-苦杏仁苷转变为L-苦杏仁苷。
优选的,步骤(3)中所述的超声功率为432W。在该条件下提取效率最佳。
优选的,步骤(3)中所述的超声温度为40℃。在该条件下提取效率最佳。
上述方法提取的D-苦杏仁苷在制备HepG2细胞生长增殖抑制剂方面的应用。
与现有技术相比,本发明的优点在于
1、传统的热水煎煮灭酶法在灭酶过程的中就会引起苦杏仁苷的溶出,使苦杏仁苷得率降低,且会促进D-苦杏仁苷转变为L-苦杏仁苷。本发明采用微波灭酶法,对β-葡萄糖苷酶的灭酶效果更加彻底,灭酶过程无水介质存在,进一步降低了D-苦杏仁苷异构化比例,且经过微波灭酶后的桃仁无需再进行干燥处理。
2、利用高速研磨机进行低温粉碎并借助分级处理,得到颗粒度更均一、小且性质稳定的桃仁粉末,降低异构程度,增大了比表面积,从而提高优质苦杏仁苷的得率。
3、采用优化后的乙醇超声波辅助提取法,控制提取过程中的温度,提取溶剂的含水量,相比于传统的热水浸提法,总苦杏仁苷得率由1.62%提高至1.84%,其中D-苦杏仁苷在总苦杏仁苷的比例由52.7%提高至96.3%。
附图说明
图1为料液比对桃仁苦杏仁苷提取得率及异构率的影响;
图2为乙醇浓度对桃仁苦杏仁苷提取得率及异构率的影响;
图3为超声功率对桃仁苦杏仁苷提取得率及异构率的影响;
图4为超声温度对桃仁苦杏仁苷提取得率及异构率的影响;
图5为专利工艺与热水浸提法对桃仁苦杏仁苷的提取效果;
图6为微波灭酶与沸水灭酶对桃仁苦杏仁苷得率及异构率的影响;
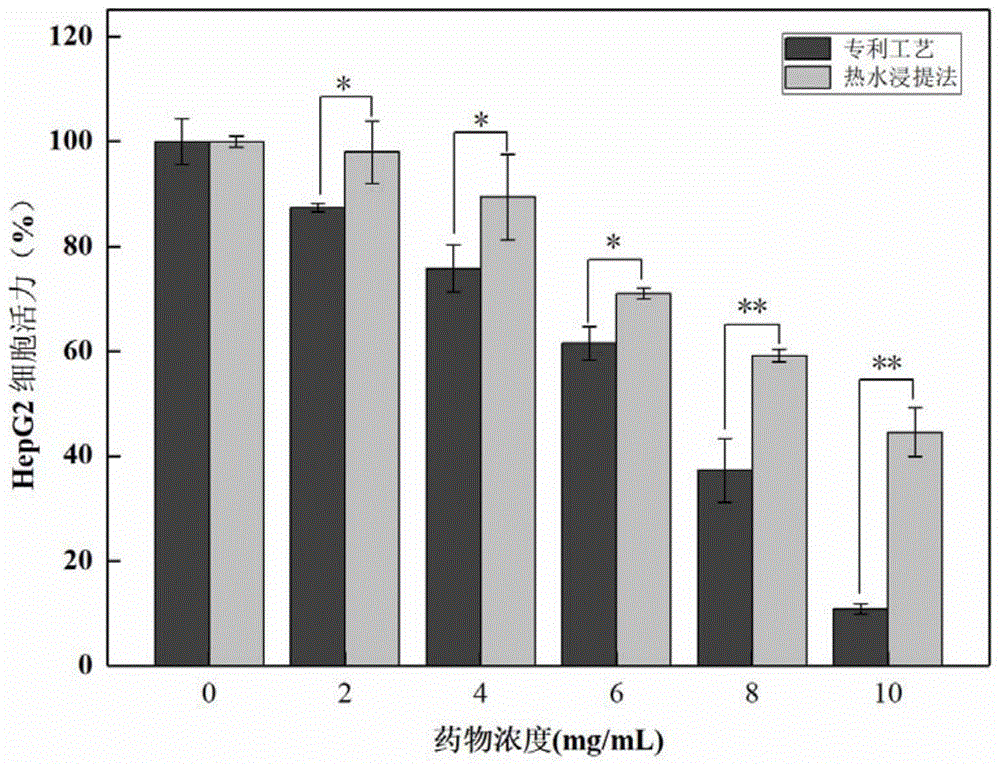
图7为专利工艺与热水浸提法提取的苦杏仁苷对HepG2细胞的抑制效果。
具体实施方式
以下结合附图实施例对本发明作进一步详细描述。
一、实验方法
参考宋帅的方法,并稍作修改,采用高效液相色谱法分析提取液中L、D-苦杏仁苷的含量,分析条件:色谱柱:Agilent poroshell 120 EC-C18 (4μm 4.6×150 mm),流 动相:10 mmol·L
(1)
(2)。
二、具体实施例
实施例1
一种桃仁中D-苦杏仁苷的提取方法,包括以下步骤:
(1)将桃仁置于微波炉中,采用功率400W处理5min,对桃仁中的β-葡萄糖苷酶进行灭活处理,将灭酶后的桃仁采用高速冷冻研磨机粉碎处理,过100目筛,得到灭酶桃仁粉末;
(2)将灭酶桃仁粉末按质量体积比1g:15mL的比例加入到60-90℃的石油醚中混匀,在288W,50℃条件下超声处理30-40min后,过滤,取脱脂桃仁滤渣室温下干燥,挥发除去残留石油醚后研磨成细粉,得到脱脂桃仁粉末;除去桃仁粉中的油脂便于苦杏仁苷的提取;
(3)将脱脂桃仁粉末按质量体积比1g: 25mL的比例加入到70vt%乙醇溶液中混匀,在432W,40℃条件下超声40min后,将提取液真空抽滤去除滤渣,取滤液于60 rpm,50℃旋转蒸发除去乙醇,即得到总苦杏仁苷粗品。对总苦杏仁苷粗品进行高效液相色谱仪分析,检测结果为:总苦杏仁苷的得率为1.86%,其中D-苦杏仁苷的占总苦杏仁苷的96.3%。
实施例2
同上述实施例1,其区别在于:步骤(3)液固比为1g: 10mL,经高效液相色谱仪分析得,总苦杏仁苷的得率为1.65%,其中D-苦杏仁苷的占总苦杏仁苷的96.1%。
实施例3
同上述实施例1,其区别在于:步骤(3)超声温度为70℃,经高效液相色谱仪分析得,总苦杏仁苷的得率为1.69%,其中D-苦杏仁苷的占总苦杏仁苷的82.1%。
三、试验结果分析
不同因素对桃仁苦杏仁苷提取率及异构率的影响
1、料液比
称取按实施例1方法制备的2g脱脂桃仁粉末,在料液比为1:10、1:15、1:20、1:25、1:30(w/v)条件下,控制温度为60℃,乙醇浓度为70%,超声功率为432W, 超声提取40min,提取液10000rpm离心10min,取上清测定苦杏仁苷含量,计算苦杏仁苷得率及异构率。
由图1可知,随着料液比的增大,桃仁总苦杏仁苷得率呈上升趋势,当料液比超过1:25(g/mL)时,苦杏仁苷的提取得率出现下降趋势,而异构率整体趋于平稳,故1:25(g/mL)为最佳的提取料液比。
2、乙醇浓度
称取按实施例1方法制备的2g脱脂桃仁粉末,在乙醇浓度为50、60、70、80、90%条件下,控制温度为60℃,料液比为1:25,超声功率为432W, 超声提取40min,提取液10000rpm离心10min,取上清测定苦杏仁苷含量,计算苦杏仁苷得率及异构率。
乙醇浓度对苦杏仁苷得率及异构比的结果如图2所示,当乙醇浓度在50%-70%之间,桃仁苦杏仁苷提取的得率随着乙醇浓度的增加而增加,当乙醇浓度为70%时,桃仁苦杏仁苷的得率最高为1.89%,苦杏仁苷异构比为16.7%。而当乙醇浓度超过70%后,苦杏仁苷的得率随着乙醇浓度的提高而降低,这可能是由于高浓度的乙醇对桃仁中的醇溶性杂质或亲脂性成分的溶解增加,使溶液的粘度增加,传质阻力增加,因而导致苦杏仁苷扩散到主体溶剂的速率减慢,导致得率降低。苦杏仁苷异构比随着乙醇浓度的提高而降低,这是由于随着乙醇浓度提高,提取溶剂含水量也相应降低。
3、超声功率
称取按实施例1方法制备的2g脱脂桃仁粉末,在超声功率为288、360、432、504、576W条件下,控制温度为60℃,料液比为1:25(g/mL),乙醇浓度为70%, 超声提取40min,提取液10000rpm离心10min,取上清测定苦杏仁苷含量,计算苦杏仁苷得率及异构率。
超声功率对苦杏仁苷异构化及得率的影响如图3所示,当超声功率在288W到432W之间时,苦杏仁苷得率随着超声功率增大而增大,超声功率为432W时苦杏仁苷得率达到最大值,而当超声功率超过432W时,苦杏仁苷得率开始呈现下降趋势,且随着超声功率增大,异构率也略微增大。这可能是由于当超声功率过大时,过度破碎使桃仁内细胞壁破裂,细胞碎片及细胞内大量不溶物混入提取液中,使提取液内杂质增多,不利于苦杏仁苷的溶出,且超声过程可能导致温度升高,故选择432W为最佳提取超声功率。
4、超声温度
称取按实施例1方法制备的2g脱脂桃仁粉末,在超声温度为30、40、50、60、70℃条件下,控制料液比为1:25(g/mL),乙醇浓度为70%,超声功率为432W,超声提取40min,提取液10000rpm离心10min,取上清测定苦杏仁苷含量,计算苦杏仁苷得率及异构率。由图4可知,随着超声温度的提高,桃仁苦杏仁苷得率及异构比也逐渐增大,40℃时,D-苦杏仁苷得率最高。
5、与热水浸提工艺的比较
分别称取称取按实施例1方法制备的2g脱脂桃仁粉末,设置两组,一组在超声功率为432W,超声温度为40℃,料液比为1:25(g/mL),乙醇浓度为70%条件下超声40min,将提取液真空抽滤去除滤渣,取滤液于60 rpm,50℃旋转蒸发除去乙醇,即得到总苦杏仁苷粗品;另一组在90-100℃超纯水中浸泡40min,提取液10000rpm离心10min,取上清测定苦杏仁苷含量,计算总苦杏仁苷得率及异构率,经过高效液相色谱仪分析,苦杏仁苷的得率为1.63%,异构率为47.7%。。
如图5所示,专利工艺提取的苦杏仁苷相比于热水浸提法能更好地避免桃仁中的D-苦杏仁苷在提取过程中发生异构化,并且在得率上也有一定的提高,更适用于桃仁D-苦杏仁苷的提取。
6、灭酶方法比较
对照组1:同上述实施例1,其区别在于省去步骤(1)。提取液未检出总苦杏仁苷。
对照组2:同上述实施例1,其区别在于步骤(1)调整为:取1kg桃仁,沸水煎煮5min灭酶,得到灭酶桃仁粉末。经过高效液相色谱仪分析,总苦杏仁苷的得率为1.69%,异构率为10.4%。
由图6可知,采用微波灭酶处理后的桃仁的苦杏仁苷得率明显高于沸水灭酶法,并且也在一定程度上减少了D-苦杏仁苷的异构化,这表明微波灭酶更适用于于桃仁苦杏仁苷的提取。
四、D-苦杏仁苷的应用
分别按照专利工艺与热水浸提法提取获得桃仁总苦杏仁苷粗品,并利用D101大孔吸附树脂对提取的桃仁总苦杏仁苷粗品进行纯化处理。最终获得纯度为83.9%的专利工艺提取的总苦杏仁苷,其中D-苦杏仁苷在总苦杏仁苷中的占比为96.7%。热水浸提法提取的总苦杏仁苷中纯度为84.1%,D-苦杏仁苷在总苦杏仁苷中的占比为52.3%。
将处于对数生长期的人肝癌细胞(HepG2)以1×10
给药处理24h后小心去除培养基,用DMEM-F12培养基小心润洗,每孔加入100μL含噻唑蓝(MTT 0.5mg/mL)的DMEM-F12培养基避光孵育4h,然后小心吸去培养基,每孔加入150μL二甲基亚砜溶液。震荡10min,用酶标仪在570 nm处测量吸光度,计算细胞活力,并通过Graph Pad Prism8软件计算IC
(3)
由图7可知,两种提取方法的总苦杏仁苷都能呈剂量依赖性抑制HepG2细胞的增殖,但是在2-10mg/mL 浓度范围内,专利组提取的总苦杏仁苷处理后的HepG2细胞的细胞活力显著低于热水浸提组的总苦杏仁苷,通过Graph Pad Prism8软件计算得出专利工艺提取的总苦杏仁苷对HepG2细胞的IC
上述说明并非对本发明的限制,本发明也并不限于上述举例。本技术领域的普通技术人员在本发明的实质范围内,做出的变化、改型、添加或替换,也应属于本发明的保护范围。
- 一种桃仁配方颗粒中D-苦杏仁苷的含量测定方法
- 一种ASE提取桃仁中苦杏仁苷的方法
