一种细菌色氨酸-5-羟化酶及其应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及生物技术领域,具体涉及一种新型细菌色氨酸-5-羟化酶及其在制备褪黑素中的应用。
背景技术
褪黑素(melatonin)是一种人体激素,化学结构为N-乙酰基-5-甲氧基色胺,如式(I)。人体中,褪黑素调解昼夜节律,调解睡眠和体温,促进乳汁分泌,保护皮肤。褪黑素还能保护淋巴细胞,防止电离辐射破坏DNA。此外,它具有抗炎、抗氧化、减轻糖尿病的功能。
当前,全球患有生理节律紊乱的人口数量庞大且仍在不断增加。在中国,至少有3亿人患有睡眠紊乱;在美国,大约有5~7千万人长期患有失眠或生理节律紊乱。服用褪黑素是治疗生理节律紊乱的重要方式。目前,全球褪黑素销量快速上升,呈现供不应求的趋势。因此,有必要改进褪黑素的工业合成方法,提高其产量。
植物和动物中褪黑素的生物合成分成四步。植物中,色氨酸脱羧变成色胺,然后色胺-5-羟化酶催化色胺形成血清素,乙酰转移酶催化血清素形成N-乙酰血清素,最后甲基转移酶催化形成褪黑素。衰老和环境压力下,植物中乙酰转移酶和甲基转移酶的催化顺序会发生改变。动物本身无法合成色氨酸,必须通过食物摄入,所以褪黑素产量较低。动物的褪黑素生物合成途径中,首先由色氨酸-5-羟化酶催化色氨酸形成5-羟基色氨酸,色氨酸脱羧酶催化脱羧形成血清素,然后血清素在乙酰转移酶催化下形成N-乙酰血清素,最后是甲基转移酶催化形成褪黑素。
微生物中有复杂的代谢网络和大量次级代谢产物,但只在少数几种微生物中能够产生褪黑素,其褪黑素生物合成途径未知。这些微生物包括几种酵母和假单胞菌,但是它们合成褪黑素的产量都很低。比如,荧光假单胞菌(Pseudomonas fluorescens)合成褪黑素,作为生长信号分子和抗氧化物质,产量最高只有1.32微克/升。酵母中,褪黑素与糖蛋白相互作用,可以增强酵母对氧化应激和电离辐射的耐受性,平均产量可达90微克/升。
目前,市场销售的褪黑素主要是化学合成的。褪黑素的化学合成主要分成4条途径,起始的原料分别是对取代苯肼、C3和C5双取代吲哚、单保护的环己二酮、N-烯丙基对甲氧基苯胺。这些化学合成方法步骤多,成本高,而且会造成严重环境污染。而直接从动物和植物提取褪黑素效率很低。在微生物中设计、优化褪黑素生物合成途径,有望成为廉价、环保的褪黑素工业生产方法。
中国科学院微生物研究所的研究团队将假单胞菌的蝶呤-4α-甲醇胺脱水酶、黄单胞菌的苯丙氨酸-4-羟化酶、链霉菌的脱羧酶、水稻的咖啡酸3-O-甲基转移酶和链霉菌的甲基转移酶导入大肠杆菌中,实现了褪黑素的生物合成(Zhang,Y.,He,Y.,Zhang,N.,Gan,J.,Zhang,S.,&Dong,Z.Combining protein and metabolic engineering strategies forbiosynthesis of melatonin in Escherichia coli.Microbial cell factories,2021,20(1),170.)。
总体来说,微生物宿主中异源表达褪黑素生物合成酶,存在表达量很低、可溶性蛋白少、催化活性差等问题,尤其是色氨酸-5-羟化酶。动物来源的色氨酸-5-羟化酶需要亚铁离子和四氢生物喋呤作为辅酶。这个酶催化的反应是褪黑素生物合成途径的第一步,而且是限速步骤。但是这个酶在微生物中表达量和酶活性都不足,需要应用蛋白质工程和代谢工程手段加以改造。也有研究人员将细菌中的铁离子和四氢生物喋呤依赖的苯丙氨酸-4-羟化酶改造成色氨酸-5-羟化酶,用于褪黑素的生物合成。此外,为了提高色氨酸-5-羟化酶的催化效率,需要同时引入四氢生物喋呤再生途径。
因此,如果能找到一种在微生物中表达量大、催化效率高的色氨酸-5-羟化酶,有望将褪黑素的产量进一步提高。微生物次级代谢途径解析是发现各种结构、功能新颖的酶的重要方法,为代谢工程提供了宝贵的工具。通过特定基因的异源组合高表达以及代谢流的调控来更高效合成褪黑素将是一种可行的方案。
发明内容
本发明的目的在于开发一种新型色氨酸-5-羟化酶,通过将其在微生物宿主细胞中异源表达以及代谢流的调控实现褪黑素的绿色高效制备。
为实现上述目的,本发明采用如下技术方案:
本发明通过基因组学分析以及分子生物学技术手段验证,鉴定得到三个新型的具有催化色氨酸生成5-羟基色氨酸活性的细菌色氨酸-5-羟化酶,其氨基酸序列如SEQ IDNO.1、SEQ ID NO.3、SEQ ID NO.5所示,分别来源于吕宋马杜拉放线菌(Actinomadura sp.)DSM 43766的Luz15、灰褐链霉菌(Streptomyces griseofuscus)NRRL 5324的PsmG、海绵动物共生菌(Entotheonella factor)的KerI。
通过对上述细菌色氨酸-5-羟化酶的序列比对以及光谱特征分析显示,所述细菌色氨酸-5-羟化酶,包含一个色氨酸双加氧酶样结构域(Tryptophan dioxygenase-likedomain),包含一个保守且必需的组氨酸残基(Luz15的375位组氨酸,PsmG的369位组氨酸,KerI的363位组氨酸),这个保守的组氨酸残基结合血红素(heme b)。该类酶以血红素作为辅因子参与催化色氨酸生成5-羟基色氨酸,该作用方式区别于现有报道以喋呤和亚铁离子作为辅因子的色氨酸-5-羟化酶。
因此,本发明提供了细菌色氨酸-5-羟化酶在催化色氨酸制备5-羟基色氨酸中的应用。
所述细菌氨基酸-5-羟化酶的氨基酸序列如SEQ ID NO.1、SEQ ID NO.3或SEQ IDNO.5所示;
或者,所述细菌氨基酸-5-羟化酶的氨基酸序列为与SEQ ID NO.1、SEQ ID NO.3和SEQ ID NO.5中任意一项所示氨基酸序列具有50%以上同源性且功能等价,序列中包含一个保守组氨酸残基,所述保守组氨酸残基对应SEQ ID NO.1所示序列的第375位、SEQ IDNO.3所示序列的第369位、SEQ ID NO.5所示序列的第363位。
任何对SEQ ID NO.1、SEQ ID NO.3和SEQ ID NO.5中任意一项所示氨基酸序列中的氨基酸进行缺失、插入或替换的处理获得的多肽片段或其变体,只要其与SEQ ID NO.1、SEQ ID NO.3和SEQ ID NO.5中任意一项所示氨基酸序列具有50%以上同源性,序列中包含色氨酸双加氧酶样结构域和保守组氨酸残基,且具有催化色氨酸生成5-羟基色氨酸的功能的,均属于本发明的保护范围。
本发明还提供了编码所述细菌氨基酸-5-羟化酶的基因序列,可以根据宿主细胞密码子偏好性,对核苷酸序列进行改造。
优选的,上述氨基酸序列如SEQ ID NO.1、SEQ ID NO.3、SEQ ID NO.5所示的细菌氨基酸-5-羟化酶的编码基因的核苷酸序列分别如SEQ ID NO.2、SEQ ID NO.4、SEQ IDNO.6所示。
进一步的,所述色氨酸为L-色氨酸。本发明研究表明,所述细菌色氨酸-5-羟化酶可在微生物体内或体外催化L-色氨酸生成L-5-羟基色氨酸。
进一步的,所述应用包括:以包含细菌氨基酸-5-羟化酶编码基因的工程菌经发酵培养后获得的湿菌体或者湿菌体破碎后提取的酶作为生物催化剂,以L-色氨酸为底物,过氧化氢为氧化剂,以pH为6~9的缓冲液为反应介质,30~40℃条件下反应,反应结束后对反应液进行分离纯化,获得L-5-羟基色氨酸。
优选的,反应介质采用HEPES缓冲液。
本发明还提供了所述细菌色氨酸-5-羟化酶在制备褪黑素中的应用,5-羟基色氨酸为褪黑素生物合成的前体物质,通过在微生物宿主细胞中引入所述细菌色氨酸-5-羟化酶编码基因以及下游基因,实现褪黑素的生物合成。
进一步的,所述应用包括:以放线菌为出发菌,通过基因失活技术敲低其编码色氨酸双加氧酶的基因,然后通过基因异源表达技术引入所述细胞色氨酸-5-羟化酶的编码基因、甲基转移酶基因和脱羧酶基因,构建得到重组菌,对重组菌进行发酵培养,对发酵产物进行分离纯化,制得褪黑素。
所述放线菌可以为但不限于白色链霉菌(Streptomyces albus)、天蓝色链霉菌(Streptomyces coelicolor)、委内瑞拉链霉菌(Streptomyces venezuelae)、谷氨酸棒状杆菌(Corynebacterium glutamicum)。
作为优选,以白色链霉菌J1074为出发菌。该菌株的色氨酸降解基因簇中,kynA是编码色氨酸双加氧酶的基因,其核苷酸序列如SEQ ID NO.7所示;以及抗霉素(antimycin)生物合成基因簇ant中的antN是编码色氨酸双加氧酶的基因,ant基因簇核苷酸序列如SEQID NO.8所示。
通过基因敲除或基因失活等策略实现白色链霉菌J1074中色氨酸双加氧酶基因kynA和抗霉素生物合成基因簇ant的破坏,以阻断色氨酸的降解。
所述基因失活技术可以为同源重组、CRISPR/Cas9等技术实现宿主细胞基因组中编码色氨酸双加氧酶的基因缺失突变;或转座子诱变、插入突变、点突变等技术使基因失活。
作为优选,采用同源双交换方法对白色链霉菌J1074中的色氨酸双加氧酶基因kynA和抗霉素生物合成基因簇进行基因失活。
所述异源表达技术可以利用整合型质粒、转座型质粒、链霉菌复制型质粒等工具实现。
作为优选,编码所述细胞色氨酸-5-羟化酶的基因采用来源于吕宋马杜拉放线菌(Actinomadura sp.)DSM43766中的luz15,其核苷酸序列如SEQ ID NO.2所示。
作为优选,所述甲基转移酶基因采用来源于吕宋马杜拉放线菌(Actinomadurasp.)DSM43766中的luz16,其核苷酸序列如SEQ ID NO.9所示。
作为优选,所述脱羧酶基因采用核苷酸序列如SEQ ID NO.10所示的脱羧酶基因SapsmH。
本发明提供了一种白色链霉菌工程菌株,其构建方法包括以下步骤:白色链霉菌J1074为出发菌,通过基因失活技术使色氨酸双加氧酶基因kynA和抗霉素(antimycin)生物合成基因簇ant失活,得到白色链霉菌ΔkynAΔant菌株;然后在ΔkynAΔant菌株中引入所述细菌色氨酸-5-羟化酶的编码基因、甲基转移酶基因luz16和脱羧酶基因SapsmH,得到高效生产褪黑素的白色链霉菌工程菌株。
具体的,所述色氨酸双加氧酶基因kynA的核苷酸序列如SEQ ID NO.7所示;抗霉素生物合成基因簇ant核苷酸序列如SEQ ID NO.8所示;所述甲基转移酶基因luz16的核苷酸序列如SEQ ID NO.9所示;所述脱羧酶基因SapsmH的核苷酸序列如SEQ ID NO.10所示;所述细菌色氨酸-5-羟化酶氨基酸序列如SEQ ID NO.1、SEQ ID NO.3或SEQ ID NO.5所示,或者与SEQ ID NO.1、SEQ ID NO.3和SEQ ID NO.5中任意一项所示氨基酸序列具有50%以上同源性且功能等价。
本发明还提供了一种利用上述工程菌株生产制备褪黑素的方法,包括以下步骤:将所述的白色链霉菌工程菌株接种于发酵培养基中,发酵培养,对发酵产物进行分离纯化,制得褪黑素。
作为优选,以每升培养基计,所述发酵培养基的组成包括:蛋白胨3~6g,酵母粉2~4g,麦芽浸出物2~4g,葡萄糖5~20g,色氨酸0.5~2g,余量为水。
发酵培养条件为27~37℃培养7~9天。优选的,发酵培养条件为30℃培养7~9天。
发酵结束后发酵产物用甲醇稀释,离心除去菌丝和沉淀蛋白,得到含有褪黑素的上清液,分离纯化制得褪黑素。
作为优选,采用高效液相色谱纯化褪黑素,以乙腈作为流动相,使用C18色谱柱,以0~25分钟5%~95%(乙腈+0.05%甲酸)/(水+0.05%甲酸)进行梯度洗脱,流速为0.6mL/min,褪黑素的保留时间为8分钟。
本发明具备的有益效果:
(1)本发明鉴定了一类新型的以血红素(heme b)为辅因子,可在体内或体外催化L-色氨酸生成L-5-羟基色氨酸的细菌色氨酸-5-羟化酶家族。
(2)本发明利用异源表达色氨酸-5-羟化酶基因、甲基转移酶基因和脱羧酶基因且缺失色氨酸双加氧酶基因的工程菌株作为发酵菌株,通过微生物发酵方法,专一性生产褪黑素,该方法绿色、经济、高效,具有工业生产前景。
(3)本发明提供了一种专一性生产褪黑素的白色链霉菌工程菌株,通过基因工程手段对白色链霉菌(Streptomyces albus)J1074的色氨酸双加氧酶基因kynA和抗霉素生物合成基因簇ant进行失活,阻断其色氨酸的降解过程,并通过基因异源表达技术引入色氨酸-5-羟化酶基因、甲基转移酶基因luz16和脱羧酶基因SapsmH,生物合成并积累褪黑素。
附图说明
图1为三种细菌色氨酸-5-羟化酶的十二烷基硫酸钠聚丙烯酰胺凝胶电泳检测图。
图2为三种细菌色氨酸-5-羟化酶的紫外可见光光谱。
图3为三种细菌色氨酸-5-羟化酶的体外生物化学反应的高效液相色谱测定结果。
图4为三种细菌色氨酸-5-羟化酶的序列比对结果。
图5为Luz15突变体(H375A)的十二烷基硫酸钠聚丙烯酰胺凝胶电泳检测图。
图6为Luz15突变体(H375A)的紫外可见光光谱。
图7为Luz15突变体(H375A)的体外生物化学反应的高效液相色谱测定结果。
图8为色氨酸双加氧酶基因kynA失活突变株的构建示意图,其中右侧小图为凝胶电泳检测图。
图9为ΔkynAΔant菌株的构建示意图,其中右侧小图为凝胶电泳检测图。
图10为突变株DS-1的构建示意图,其中右侧小图为凝胶电泳检测图。
图11为实施例2突变株DS-1浸提液组分的高效液相色谱测定结果。
具体实施方式
下面结合具体实施例对本发明做进一步说明。以下实施例仅用于说明本发明,不用来限制本发明的适用范围。在不背离本发明精神和本质的情况下,对本发明方法、步骤或条件所做的修改或替换,均属于本发明的范围。
下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
下面实施例中突变株DS-1的出发菌株白色链霉菌(Streptomyces albus J1074)为实验室保存的菌株,最初由文献K.F.Chater,L.C.Wilde,Microbiology,1980,116,323–334.描述。
LB培养基成分为1%胰蛋白胨、0.5%酵母提取物、1%氯化钠,固体培养基另加2%琼脂粉;
YEMET培养基成分为0.5%蛋白胨、0.3%酵母粉、0.3%麦芽浸出物、1%葡萄糖和0.1% L-色氨酸。
实施例1
三种新型细菌色氨酸-5-羟化酶的鉴定
一、基于大肠杆菌蛋白质表达载体pET22b进行细菌色氨酸-5-羟化酶的表达。
1、以吕宋马杜拉放线菌(Actinomadura sp.DSM43766,购买自德国微生物菌种保藏中心)的基因组DNA为模板,通过聚合酶链式反应扩增luz15(长度为1254bp,核苷酸序列如SEQ ID NO.2所示,NCBI登录号OM250071.1的序列中37598到38851部分,对应的氨基酸序列如SEQ ID NO.1所示),其中上游引物为15F(5’→3’:aagaaggagatatacatatgcgagccacgacgaacg),下游引物为15R(5’→3’:tggtggtggtggtgctcgagggcatgcgggcctcctggtgag)。
以北京擎科生物科技有限公司合成的psmG基因(长度为1206bp,核苷酸序列如SEQID NO.4所示,NCBI登录号KF201694.1的序列中5864到7069的部分,对应的氨基酸序列如SEQ ID NO.3所示)为模板,通过聚合酶链式反应扩增psmG,其中上游引物为GF(5’→3’:aagaaggagatatacatatgaccactccgactgagc),下游引物为GR(5’→3’:tggtggtggtggtgctcgagcaggagtggctcctcaaggtg)。
以北京擎科生物科技有限公司合成的kerI基因(长度为1278bp,核苷酸序列如SEQID NO.6所示,对应的氨基酸序列如SEQ ID NO.5所示)为模板,通过聚合酶链式反应扩增kerI,其中上游引物为IF(5’→3’:aagaaggagatatacatATGTATGAACAGCATCTGATTC),下游引物为IR(5’→3’:tggtggtggtggtgctcgagATTACCAACACCAACCAGCGG)。
2、用无缝克隆试剂盒(南京诺唯赞生物科技有限公司的ClonExpress MultiS OneStep Cloning Kit)将上述三个基因片段各自插入到pET22b,得到三个表达载体,pET22b-luz15、pET22b-psmG和pET22b-kerI。这三个表达载体测序验证后通过转化分别导入大肠杆菌菌株Transetta(DE3)(购买自TransGen Biotech)的感受态中,挑取单菌落接入试管培养基中培养12小时后按照1:50的比例转接到LB培养基内37℃、180rpm摇5小时,加入异丙基-β-D-硫代半乳糖苷至终浓度为0.1mM、5-氨基乙酰丙酸溶液至终浓度1mM、六水合硫酸亚铁铵至终浓度1mM,18℃、140rpm培养18小时,5000rpm、8min离心收集大肠杆菌菌体,用水洗涤一次,5000rpm、8min离心收集菌体。
二、细菌色氨酸-5-羟化酶的纯化
第一步所得的菌体,用约20mL 10mM咪唑缓冲液(含有10mM咪唑、50mM磷酸二氢钠、300mM氯化钠,pH为8.0)重悬菌体,用JY92-IIDN超声波细胞粉碎机(购买自宁波新芝生物科技股份有限公司)超声破壁。超声条件:6号变幅杆,20%功率,每轮2分钟,共5轮,每两轮之间间隔2分钟。每一轮超声时,超声3秒、停止3秒,交替进行。
超声破壁后将液体转入高速离心管中,15000rpm、40min离心。上清与3毫升Ni-NTA琼脂糖树脂(购买自生工生物工程有限公司)4℃颠倒混匀1小时,然后转入层析柱中,待Ni-NTA琼脂糖树脂沉降、液体流尽,依次用30mM咪唑缓冲液(含有30mM咪唑、50mM磷酸二氢钠、300mM氯化钠,pH为8.0)和50mM咪唑缓冲液(含有50mM咪唑、50mM磷酸二氢钠、300mM氯化钠,pH为8.0)冲洗,最后用300mM咪唑缓冲液(含有300mM咪唑、50mM磷酸二氢钠、300mM氯化钠,pH为8.0)洗脱,收集约6毫升洗脱液,在含有100mM氯化钠、25mM 4-羟乙基哌嗪乙磺酸、1mM二硫苏糖醇的pH为8.0的溶液中4℃透析15小时,用超滤离心管进行浓缩。
纯化得到的细菌色氨酸-5-羟化酶通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳进行验证,如图1所示。
三、色氨酸-5-羟化酶的体外生物化学反应
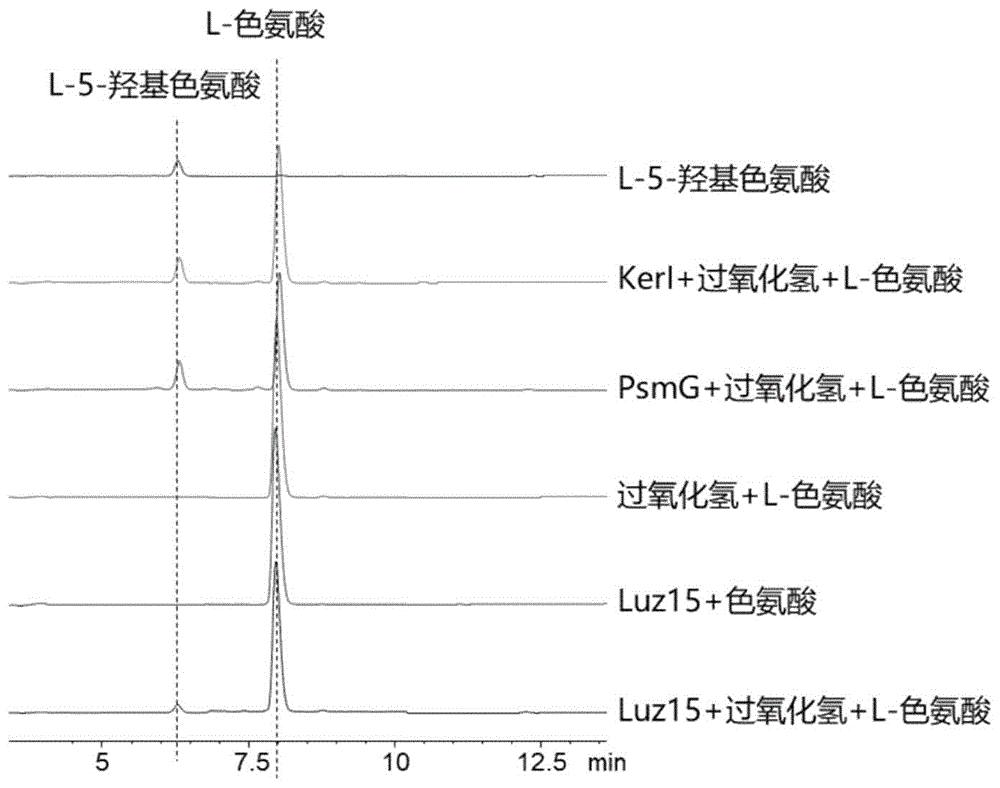
1、以含有100mM氯化钠、25mM 4-羟乙基哌嗪乙磺酸、1mM二硫苏糖醇的pH为8.0的溶液为空白,扫描第二步所得色氨酸-5-羟化酶在350nm到700nm的光谱。如图2所示,Luz15、PsmG和KerI都在425nm左右有最大吸收峰,在550nm附近也有吸收峰。这些光谱特征说明这些酶含有血红素。
而目前已知的色氨酸-5-羟化酶中,无论是来源于动物的,还是由细菌的苯丙氨酸-4-羟化酶改造而来的,辅因子都是喋呤和亚铁离子,从未报道过含有血红素,且序列也和上述三种新型的细菌色氨酸-5-羟化酶没有相似性。
然后用吡啶血红素分光光度法(参考Barr,I.&Guo,F.Bio Protoc.5,e1594(2015).)测定这些细菌色氨酸-5-羟化酶的血红素浓度。
2、体外生物化学反应体系为100微升,包括10微升40mM过氧化氢、20微升15mM L-色氨酸(溶解在50mM的HEPES缓冲液)和70微升的细菌色氨酸-5-羟化酶。其中加入的细菌色氨酸-5-羟化酶的浓度(以血红素浓度计)为:Luz15,38μM;PsmG,44μM;KerI,4μM。反应温度为30℃,反应时间为60分钟。反应结束后加入300微升甲醇淬灭,12000rpm、5min离心,上清用高效液相色谱(流动相比例:0~25min,乙腈:水=5:95~95:5。流动相均含0.05%甲酸,色谱柱为EC-C18分析柱,检测器为紫外检测器,波长254nm,流速为0.6mL/min)进行分析。
如图3所示,通过与阴性对照和L-5-羟基色氨酸的标准品进行对比,证明这些酶可以催化L-色氨酸生成L-5-羟基色氨酸,而且不需要喋呤辅因子参与。
四、细菌色氨酸-5-羟化酶的序列分析
用Clustal Omega工具对Luz15、PsmG、KerI和野油菜黄单胞菌的色氨酸双加氧酶(XcTDO,NCBI登录号WP_011035685.1)这四个酶进行序列比对,发现Luz15、PsmG、KerI的C端结构域包含一个色氨酸双加氧酶样结构域(Tryptophan dioxygenase-like domain),与XcTDO有同源性,如图4所示,且Luz15、PsmG、KerI有一个保守的组氨酸残基,该残基正好对应XcTDO结合血红素的240位组氨酸残基(参考文献Forouhar,F.,Anderson,J.L.,Mowat,C.G.,Vorobiev,S.M.,Hussain,A.,Abashidze,M.,Bruckmann,C.,Thackray,S.J.,Seetharaman,J.,Tucker,T.,Xiao,R.,Ma,L.C.,Zhao,L.,Acton,T.B.,Montelione,G.T.,Chapman,S.K.,&Tong,L.(2007).Molecular insights into substrate recognition andcatalysis by tryptophan2,3-dioxygenase.Proceedings of the National Academy ofSciences of the United States of America,104(2),473–478.),提示Luz15、PsmG、KerI中这个保守的组氨酸残基结合血红素。
体外生物化学反应结果中未发现这三个酶具有色氨酸双加氧酶的活性。
五、细菌色氨酸-5-羟化酶的定点突变实验
1、以第一步所得的pET22b-luz15质粒为模板,通过聚合酶链式反应进行扩增含有H375A变异的Luz15表达载体,其中上游引物为H375AF(5’→3’:acgcacggcctgggggatcaccctcaagatcatc),下游引物为H375AR(5’→3’:tgatcccccaggccgtgcgtttcatcgcgtgc)。所得扩增产物用DpnI内切酶进行酶切,然后通过转化导入大肠杆菌菌株Transetta(DE3)的感受态中,经测序鉴定后进行按照第二步进行蛋白质纯化,SDS凝胶电泳如图5所示。并扫描350nm到700nm的光谱。
如图6所示,当H375A变异蛋白质与野生型蛋白质的蛋白质浓度均为5μM时,H375A变异蛋白质在420nm附近只有微弱的吸收峰,与野生型蛋白质相差很大,提示这个保守的组氨酸残基与血红素辅因子形成配位键。
2、体外生物化学反应体系为100微升,包括10微升40mM过氧化氢、20微升15mM L-色氨酸(溶解在50mM的HEPES缓冲液)和70微升的色氨酸-5-羟化酶(Luz15的野生型蛋白质或H375A变异蛋白质,蛋白质浓度为10μM)。反应温度为30℃,反应时间为60分钟。反应结束后加入300微升甲醇淬灭,12000rpm、5min离心,上清用高效液相色谱(流动相比例:0~25min,乙腈:水=5:95~95:5。流动相均含0.05%甲酸,色谱柱为EC-C18分析柱,检测器为紫外检测器,波长为254nm,流速为0.6mL/min)进行分析,如图7所示,证明375位组氨酸是催化功能必需的氨基酸。
实施例2
一、突变株DS-1的构建,构建步骤如下:
1、基于大肠杆菌-链霉菌的穿梭质粒载体pSET152(NCBI序列号AJ414670.1)设计通过同源双交换方法进行kynA基因敲除的策略。
将pSET152用HindIII酶切,然后用T4连接酶自连,得到pSET152H载体。
在白色链霉菌(Streptomyces albus J1074)的色氨酸降解基因簇中,kynA是编码色氨酸双加氧酶的基因,其核苷酸序列如SEQ ID NO.7所示(NCBI登录号NZ_DS999645.1的序列中3190336到3191229的部分)。
以白色链霉菌J1074基因组DNA为模板,通过聚合酶链式反应扩增目的敲除区域上下游的两条同源臂(长度分别为2.1kb、2.0kb)。
其中长2.1kb的左同源臂用引物ALF(5’→3’:atgtcgtcatcaacaagcttatggccattcacgagaacctgc)和ALR(5’→3’:ggtaccggcgaagtcgagattc)扩增,长2.0kb的右同源臂用引物ARF(5’→3’:atctcgacttcgccggtaccaagacggtcttccccgagctg)和ARR(5’→3’:tatgacatgattacgaattcgcgatgtcgtcgaaggtgtcg)扩增。
用无缝克隆试剂盒(南京诺唯赞生物科技有限公司的ClonExpress MultiS OneStep Cloning Kit)将两个同源臂同时插入pSET152中,得到kynA的敲除载体pSET152H-ΔkynA。测序验证后通过转化导入大肠杆菌菌株ET12567/pUZ8002的感受态中。挑取单菌落接入试管中12小时后按照1:50的比例转接到LB内37℃、180rpm摇5小时,5000rpm、8min离心收集大肠杆菌菌体,用LB洗涤三次,每次用相同离心条件收集菌体。
同时取野生型白色链霉菌的孢子悬液50微升,5000rpm、5min离心后去上层甘油,然后加入800微升2×YT培养基重悬,放入45℃水浴锅中热激5分钟,然后用于将洗涤完毕的大肠杆菌重悬,两种菌混匀后铺于含有10mM氯化镁的MS培养基(2%D-甘露醇、2%黄豆粉、2%琼脂粉)平板上,30℃培养。18小时后用终浓度为50mg/L的阿泊拉霉素和25mg/L的萘啶酮酸进行覆盖。3天后挑取接合子在含阿泊拉霉素的MS平板使其产生孢子。然后收集孢子在无抗生素的MS平板上连续传代直至获得突变株。传代3次后每次传代时进行划线分离,获取单菌落。挑取单菌落分别在阿泊拉霉素的MS平板和无抗生素的MS平板上培养,挑取在无抗生素平板上生长而在阿泊拉霉素平板上不生长的单菌落进行PCR鉴定,鉴定引物分别为AF(5’→3’:cgtccacagctgtggacagg)和ULR(5’→3’:gtcacgctcatgtgctgattcc)。
如图8所示,出发菌株会产生1.3kb的目标条带,而突变株会产生0.5kb的预期条带。通过筛选,得到kynA缺失突变的ΔkynA突变株。
2、基于大肠杆菌-链霉菌的穿梭质粒载体pSET152H(第1步所得)设计通过同源双交换方法进行ant基因敲除的策略。
在白色链霉菌(Streptomyces albus J1074)的抗霉素(antimycin)生物合成基因簇ant中,antN是编码色氨酸双加氧酶的基因。基因簇ant的核苷酸序列如SEQ ID NO.8所示(NCBI登录号NZ_DS999645.1的序列中80271到109997的部分)。
以白色链霉菌J1074基因组DNA为模板,通过聚合酶链式反应扩增目的敲除区域上下游的两条同源臂(长度分别为2.7kb、2.4kb)。
其中长2.7kb的左同源臂用引物antLF(5’→3’:atgtcgtcatcaacaagcttggagacctccgtcatcgtcacctc)和antLR(5’→3’:acacgcggacgcgtgcctttc)扩增,长2.4kb的右同源臂用引物antRF(5’→3’:aaaggcacgcgtccgcgtgtcactacacgctcatcgagccag)和antRR(5’→3’:tatgacatgattacgaattcacggtggagcagtcgacatcgtc)扩增。
用无缝克隆试剂盒(南京诺唯赞生物科技有限公司的ClonExpress MultiS OneStep Cloning Kit)将两个同源臂同时插入pSET152中,得到抗霉素生物合成基因簇ant的敲除载体pSET152H-△ant。测序验证后通过转化导入大肠杆菌菌株ET12567/pUZ8002的感受态中。挑取单菌落接入试管中12小时后按照1:50的比例转接到LB内37℃、180rpm摇5小时,5000rpm、8min离心收集大肠杆菌菌体,用LB洗涤三次,每次用相同离心条件收集菌体。
同时取kynA缺失突变的白色链霉菌ΔkynA菌株的孢子悬液50微升,5000rpm、5min离心后去上层甘油,然后加入800微升2×YT培养基重悬,放入45℃水浴锅中热激5分钟,然后用于将洗涤完毕的大肠杆菌重悬,两种菌混匀后铺于含有10mM氯化镁的MS(2%D-甘露醇、2%黄豆粉、2%琼脂粉)平板上,30℃培养。18小时后用终浓度为50mg/L的阿泊拉霉素和25mg/L的萘啶酮酸进行覆盖。3天后挑取接合子在含阿泊拉霉素的MS平板使其产生孢子。然后收集孢子在无抗生素的MS平板上连续传代直至获得突变株。传代3次后每次传代时进行划线分离,获取单菌落。挑取单菌落分别在阿泊拉霉素的MS平板和无抗生素的MS平板上培养,挑取在无抗生素平板上生长而在阿泊拉霉素平板上不生长的单菌落进行PCR鉴定,鉴定引物分别为00250F(5’→3’:cactcactctgctgtgtctcg)和OR(5’→3’:cacaggtgctgttcgacgtgg)。
如图9所示,出发菌株不会产生条带,而突变株会产生0.7kb的预期条带。通过筛选,得到ant缺失突变的ΔkynAΔant菌株。
3、基于大肠杆菌-链霉菌的穿梭质粒载体pIJ8660-ermE*p-MCS(参考文献Du,Y.-L.,Dalisay,D.S.,Andersen,R.J.&Ryan,K.S.Chem.Biol.20,1002–1011(2013).)设计通过基因组整合的方法进行细菌色氨酸-5-羟化酶基因luz15(核苷酸序列如SEQ ID NO.2所示)、甲基转移酶基因luz16(核苷酸序列如SEQ ID NO.9所示)和脱羧酶基因SapsmH(核苷酸序列如SEQ ID NO.10所示)的异源表达。
以吕宋马杜拉放线菌DSM43766基因组DNA为模板,通过聚合酶链式反应扩增包含色氨酸-5-羟化酶基因luz15和甲基转移酶基因luz16的片段luz15-16(长度为2281bp,核苷酸序列为NCBI登录号OM250071.1的序列中36571到38851部分,其中37598到38851部分为luz15,36571到37605部分为luz16),扩增引物为15F(5’→3’:agcagcCATatgcgagccacgacgaacgtcg)和16R(5’→3’:agcagcTCTAGAGtcaattgccagcgccattgtcctg)。
利用NdeI和XbaI两个酶切位点将luz15-16片段插入pIJ8660-ermE*p-MCS中,得到pIJ8660-ermE*p-luz15-16。测序验证后通过XbaI的酶切将pIJ8660-ermE*p-luz15-16线性化。
以北京擎科生物科技有限公司合成的脱羧酶基因SapsmH(长度为1470bp,核苷酸序列如SEQ ID NO.10所示)为模板,通过聚合酶链式反应扩增SapsmH,再用无缝克隆试剂盒将SapsmH与线性化的pIJ8660-ermE*p-luz15-16连接,得到luz15-16和SapsmH的异源表达载体pIJ8660-ermE*p-luz15-16-SapsmH;
测序验证后通过转化导入大肠杆菌菌株ET12567/pUZ8002的感受态中。挑取单菌落接入试管培养基中培养12小时后按照1:50的比例转接到LB培养基内37℃、180rpm摇5小时,5000rpm、8min离心收集大肠杆菌菌体,用LB洗涤三次,每次用相同离心条件收集菌体。
同时取kynA和ant缺失突变的白色链霉菌ΔkynAΔant菌株的孢子悬液500微升,5000rpm、5min离心后去上层甘油,然后加入800微升2×YT培养基重悬,放入45℃水浴锅中热激5分钟,然后用于将洗涤完毕的大肠杆菌重悬,两种菌混匀后铺于含有10mM氯化镁的MS(2%D-甘露醇、2%黄豆粉、2%琼脂粉)平板上,30℃培养。18小时后用终浓度为50mg/L的阿泊拉霉素和25mg/L的萘啶酮酸进行覆盖。3天后挑取接合子在含阿泊拉霉素的MS平板使其产生孢子,并进行PCR鉴定,鉴定引物分别为HF(5’→3’:tggcgctggcaattgacTCTAGAAAAGGAGGCGGACATatgaag)和HMR(5’→3’:gtcggtggccacctcgcacatg)。
如图10所示,异源表达菌株会产生0.7kb的预期条带,从而确认得到了DS-1突变株。
二、DS-1突变株的发酵及褪黑素的鉴定
收集DS-1突变株的孢子涂布于含有YEMET液体培养基(0.5%蛋白胨、0.3%酵母粉、0.3%麦芽浸出物、1%葡萄糖和0.1% L-色氨酸)上,30℃培养7天后取培养物用4倍体积甲醇沉淀蛋白,并用离心法除去菌丝和变性蛋白得含有褪黑素的上清液,用高效液相色谱对上清液进行分析。流动相比例:0~25min,乙腈:水=5:95~95:5。流动相均含0.05%甲酸,色谱柱为EC-C18分析柱,检测器为紫外检测器,波长254nm,流速为0.6mL/min,褪黑素的保留时间为8分钟。
通过与褪黑素的标准品进行对比,如图11所示,证明突变株工程菌株DS-1可以合成褪黑素,其产量为238±29mg/L。
应当指出,对于本领域的普通人员来说,在不脱离本发明原理的前提下,还可以做出若干变型和改进,如用天蓝色链霉菌、委内瑞拉链霉菌、谷氨酸棒状杆菌等其他放线菌宿主,用不同培养基进行发酵,用CRISPR/Cas9等技术实现kynA或抗霉素生物合成基因簇的缺失突变,用转座子诱变、插入突变、点突变等原理使kynA或抗霉素生物合成基因簇的失活,利用转座酶或链霉菌复制型质粒将luz15、luz16和SaPsmH引入白色链霉菌中,用luz15的同源基因(氨基酸序列具有50%以上同源性)代替luz15。这些也应视为本发明的保护范围。
- 一种新的色氨酸羟化酶突变体及其应用
- 一种新的色氨酸羟化酶突变体及其应用
