包含具有模块化官能团的核酸纳米颗粒的组合物
文献发布时间:2023-06-19 19:30:30
相关申请的交叉引用
本申请要求于2020年4月27日提交的美国临时专利申请第63/015,735号的权益和优先权,其内容通过引用并入。
技术领域
本发明总体涉及包含用于递送货物的核酸纳米颗粒的治疗组合物及其使用方法。
背景技术
在过去的十年中,许多努力都集中在开发核酸纳米颗粒作为针对多种疾病的治疗药物(例如治疗癌症的抗肿瘤药物)的载体。然而,基于核酸纳米颗粒的疗法受到各种尚未克服的问题的困扰。许多有前景的治疗剂是生物大分子,需要完整地递送到体内正确的细胞,被这些细胞内化,然后转运到特定的细胞内位点,而核酸纳米颗粒通常无法执行其中的一项或多项功能。此外,当前基于寡核苷酸的早期疗法是专门为特定适应症设计的。在改变纳米颗粒的设计时,需要考虑各种因素,例如稳定性、合成的难易程度及其在生物环境中的潜在行为。因此,不断改变纳米颗粒的设计是不切实际的。
发明内容
本发明提供了用于将货物递送至靶细胞(例如癌细胞)的组合物,其使用通过多种不同类型的接头与一种或多种货物连接的纳米颗粒,例如核酸(DNA、RNA、PNA、LNA、GNA、TNA)纳米颗粒。核酸纳米颗粒(例如RNA纳米颗粒)充当了用于将货物递送到体内靶细胞的结构支架,又充当了在到达靶标的途中保持货物的活性,在到达时促进其活性,和/或抑制其在脱靶位点的活动的功能调节剂。
本发明的组合物可用于治疗多种病症,包括癌症。作用机制的实例包括降解mRNA、阻断DNA复制、促进细胞凋亡和标记细胞以供免疫系统破坏。因为本发明的组合物允许药剂的活性在靶细胞中被触发但在其他细胞中被阻断,所以它们非常适合于递送具有潜在危险的货物,例如化疗药物。
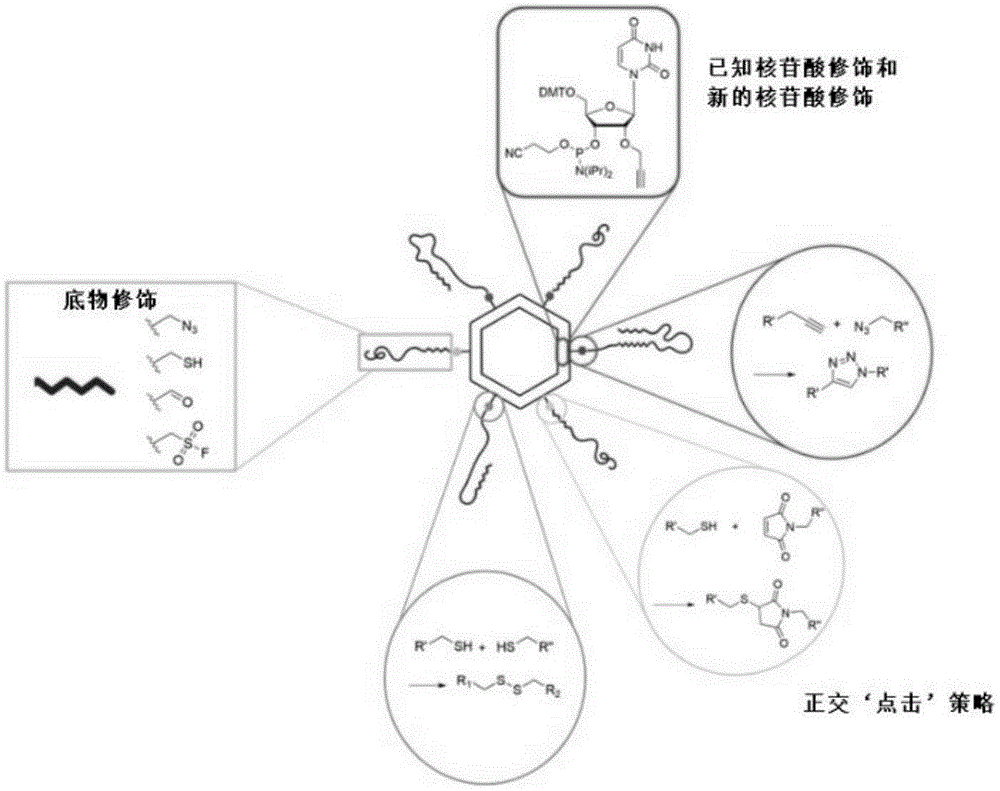
纳米颗粒组合物具有模块化设计,这是通过使用生物正交点击化学实现的(图1)。这些反应用于连接和稳定二者。“点击化学”包括任何高产、范围广泛且几乎不产生副产物的反应。产生的任何副产物都应该容易去除。本发明结合了被广泛认为是“点击化学”的多种不同的连接,这些在本文中进行了讨论。简而言之,这些包括但不限于铜(I)催化的炔烃-叠氮化物环加成(CuAAC)、应变促进的炔烃-叠氮化物环加成(SPAAC)、钌催化的叠氮化物-炔烃环加成(RuAAC)、逆电子需求狄尔斯-阿尔德反应(IEDDA)、硫氟交换(SuFEx)、应变促进炔-硝酮环加成(SPANC)、腙/肟醚形成、硫醇-烯自由基反应、硫醇-炔自由基反应、硫醇-迈克尔加成反应、硫醇-异氰酸酯反应、硫醇-环氧化物点击反应、亲核开环反应(弹簧加载反应)、无痕施陶丁格连接(traceless Staudinger ligation)。
本发明的模块化设计允许高度稳定的核心支架。当需要向递送系统添加额外官能团时,只需点击即可,而不必重新设计整个核酸纳米颗粒。许多当前一代的核酸纳米颗粒利用DNA/RNA立足点(toehold)来促进DNA/RNA杂交体的结合,并且这通常需要与核心支架相关联的组件的计算机设计(K.A.Afonin等人.The Use of Minimal RNA Toeholds toTrigger the Activation of Multiple Functionalities,Nano Lett.16(2016)1746–1753.https://doi.org/10.1021/acs.nanolett.5b04676.)。本发明的模块化设计允许更容易地连接货物分子,因此导致与开发过程相关的时间显著减少,因为在序列设计中需要较少的优化。模块化设计还导致合成和组装的更高可重复性,以及较少的批次间差异。
除了上述优点外,模块化设计还允许增加的货物容量和更高的治疗有效载荷。交替的连接位点允许结合多种独特的治疗方式,并且还允许每个纳米颗粒连接更大量的治疗有效载荷,从而产生更有效的组合疗法。例如,六聚体RNA纳米结构可以使用先前记录的立足点缀合策略限制为用于siRNA治疗性货物分子的六个连接位点(K.A.Afonin等人.Multifunctional RNA nanoparticles,Nano Lett.14(2014)5662-5671.https://doi.org/10.1021/nl502385k)。如本文所述,使用点击化学而不是立足点缀合将增加类似六聚体结构上的可用连接位点,从而导致货物分子的负载能力增加。
使用生物正交点击化学还允许将多个货物分子连接至核酸纳米颗粒。在一个实施方案中,这可以包括与纳米颗粒缀合的多于一个相同货物分子。在另一个实施方案中,这可以包括与纳米颗粒缀合的承担不同生物功能的多个货物分子。该组合物可以包括与相同核酸纳米颗粒缀合的siRNA分子、适体、化学治疗剂、细胞毒性核苷和内体逃逸分子的多种变体。这种多功能性允许在设计和制造用于诊断或治疗目的的纳米颗粒方面具有更大的灵活性。
货物分子也可以在“组合链”中相互连接,从而每个货物分子通过可逆或不可逆接头连接到另一个。这个概念将允许更高的治疗负荷。在一个实施方案中,连接两个或更多个包含相同序列的siRNA以形成同源多聚体以增加沉默效力并增强每个配体-受体相互作用的细胞摄取。在另一个实施方案中,连接两个或更多个包含靶向相同mRNA的不同序列的siRNA,从而形成单基因靶向异源多聚体,其允许更大的靶序列覆盖(包括剪接变体、非翻译区)以实现更完全的敲低和增加表型外显率以减少脱靶效应的影响。在另一个实施方案中,连接两个或更多个包含靶向不同mRNA的不同序列的siRNA以形成异源多聚体以组合沉默多个基因。通过使用这种多基因靶向异源多聚体作为联合疗法,可以实现协同治疗效果,特别是对于不能用单靶向siRNA有效治疗的更复杂的疾病。在另一个实施方案中,siRNA的线性同多聚体或异多聚体链进一步缀合到额外的货物分子,例如N-乙酰半乳糖胺(GalNAc),用于细胞类型特异性靶向肝细胞。在一个实施方案中,组合链连接至核酸纳米颗粒。一个或多个组合链可以连接至每个纳米颗粒。在另一个实施方案中,组合链不依赖于核心纳米颗粒。
核酸纳米颗粒可以包括缀合至纳米颗粒中的核酸的组分。该组分可以缀合至核酸纳米颗粒中核酸的2’位置。该组分可以缀合至核酸纳米颗粒中的核酸的碱基。该组分可以缀合至寡核苷酸的5’末端。该组分可以缀合至寡核苷酸的3’末端。该组分可以缀合至核酸纳米颗粒中核苷酸的含磷连接(linkage)。含磷连接可以是3-(2-硝基苯基)-丙基亚磷酰胺连接、3-苯基丙基亚磷酰胺连接、烷基硫代磷酸酯连接、氨基丁基亚磷酰胺连接、芳基硫代磷酸酯连接、二甲基氨基亚磷酰胺连接、胍基丁基氨基磷酸酯连接或硫代磷酸酯连接。
在一个实施方案中,本发明包括将上述修饰的核苷酸或亚磷酰胺上描述的位置之一与合适的偶联配偶体连接在一起。对于CuAAC、SPAAC和RuAAC,所述方法包括使炔基与叠氮基反应形成三唑连接。对于IEDDA,所述方法包括使1,2,4,5-四嗪与烯烃反应形成二氢哒嗪,其可进一步氧化成相应的哒嗪。对于SuFEx,所述方法包括使磺酰氟与亲核试剂反应以形成取代产物。对于SPANC,所述方法包括使二苯并环辛炔与硝酮反应得到N-烷基化异噁唑啉。对于腙形成,所述方法包括使肼与羰基反应以产生腙。对于肟醚形成,所述方法包括使羟胺与羰基反应。对于硫醇-烯自由基反应、硫醇-炔自由基反应、硫醇-异氰酸酯反应、硫醇-环氧化物点击反应,所述方法包括使硫醇与合适的偶联配偶体反应。对于亲核开环反应,所述方法包括使亲核试剂与合适的应变亲电试剂反应以产生所期望的连接。对于无痕施陶丁格连接,所述方法包括使膦(即(二苯基膦基)甲硫醇)与硫酯反应以形成所期望的连接。
除了使用上述化学连接一种或多种货物分子外,它还可用于稳定纳米颗粒中的核苷酸链。使用点击化学(特别是CuAAC)的热力学稳定性已在本领域中得到证明(参见WO2008/120016)。该组合物将使用上述方法的组合来稳定核酸纳米颗粒结构(图2)。
在另一个实施方案中,核酸纳米颗粒可以由通过点击化学或化学连接连接的寡核苷酸构建。这种基于寡核苷酸的结构是本领域已知的(WO 2015/177520;US2017/057415;M.Kollaschinski等人,Efficient DNA Click Reaction Replaces Enzymatic Ligation,Bioconjug.Chem.31(2020)507–512.https://doi.org/10.1021/acs.bioconjchem.9b00805.)。
在另一个实施方案中,本发明包括核酸纳米颗粒,其中单个寡核苷酸链具有可以与外部试剂偶联以产生荧光团的悬垂部分。
该组合物可以包括荧光点击部分,其可用于可视化和监测纳米颗粒组装和细胞摄取。这可包括荧光异吲哚交联(FlICk)化学。这种官能团可以通过胺或硫醇修饰的核苷酸引入。然后,这可以充当用于货物的稳定或连接位点。
该组合物可以包括上述修饰的任何组合。替代的点击反应可以与荧光团生成反应相结合。
该组合物可以包括多个RNA分子。例如,组合物可包含1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个或更多个RNA分子。
核酸纳米颗粒可以包括适体。
核酸纳米颗粒可以是RNA纳米颗粒、DNA纳米颗粒或包含RNA和DNA两者的颗粒。
自组装构建体可以采用任何数量的形态形式,包括但不限于三聚体、四聚体、五聚体或六聚体。
在另一个实施方案中,核酸纳米颗粒可以是具有多个生物正交点击连接的RNA分子的双链体。这些可能会或可能不会通过刺激反应性接头连接到货物。核心链可以是RNA、DNA、mRNA、siRNA或其他类型的寡核苷酸治疗剂(图3)。可以连接各种货物分子,包括细胞毒性药物(I)、RNA/siRNA(II)、靶向部分(例如适体)(III)、内体逃逸分子(IV)和荧光团(V)。这些部分可能会或可能不会通过刺激反应性接头(VI)连接。
在另一个方面,本发明提供了组合物,其包括货物分子和连接到货物分子以促进货物分子在受试者体内的生物活性的元件,例如刺激反应性接头(图4)。
货物分子可以是或包括RNA分子、DNA分子、肽、多肽、蛋白质、细胞毒性药物或其任意组合。RNA分子可以是mRNA分子、lnRNA分子、miRNA分子、siRNA分子或shRNA分子。货物分子可以是或可以编码CRISPR组分。货物分子可以是或可以编码嵌合抗原受体。
除了使用治疗冗余的RNA支架外,还可以修饰核心支架以引入多种功能以增强其治疗效果。例如,可以修饰核心纳米支架以促进细胞摄取和内体逃逸,从而增加货物的细胞质可用性。
附图说明
图1是显示具有模块化基于点击的官能团的简化的六聚体核酸纳米颗粒的示意图。可以将正交点击处理引入已知的核苷酸和新的核苷酸中。
图2是显示使用生物正交点击化学来稳定核酸纳米颗粒的示意图。
图3是显示双链RNA作为递送载体而不需要另外组装成纳米结构(如六聚体)的示意图。多种货物分子被显示直接连接,包括细胞毒性药物(I)、RNA/siRNA(II)、靶向部分(例如适体)(III)、内体逃逸分子(IV)和荧光团(V)。这些部分可能会或可能不会通过刺激反应性接头(VI)连接。
图4是显示具有通过生物正交点击化学缀合的货物的四聚体核酸纳米颗粒的示意图。显示的点击化学包括siRNA(II)和二硫化物连接物(disulphide attachments)(III)的炔烃叠氮化物(I)。靶向分子如适体(IV)的杂交也是可能的。
图5是概述核酸纳米颗粒内使用的DNA/RNA可能的2’修饰的表格。
图6显示了RNA核苷酸的结构修饰。这些已经用碱基上的叠氮化物进行了修饰。
图7是显示允许生物正交点击化学的可能的亚磷酰胺修饰的表格。
图8是显示寡核苷酸上的逆电子需求狄尔斯-阿尔德反应的示意图。
图9是显示可用硫醇修饰的寡核苷酸进行的可能的点击反应的示意图。这些包括二硫化物(I)、硫醇-烯(II)、硫醇-炔(III)、硫醇-马来酰亚胺(IV)、硫醇-异氰酸酯(V)和硫醇-环氧树脂(VI)。
图10是显示用一系列亲核试剂优化2,2’-脱水-1-(β-D-阿拉伯呋喃糖基)尿嘧啶的亲核开环的示意图。
图11是应用于核苷酸纳米颗粒的荧光异吲哚点击(FlICk)化学的示意图总结。用邻苯二甲醛处理相邻的胺和硫醇,由此产生的缩合反应产生可检测的荧光团。
图12是显示荧光团(罗丹明B)与邻苯二甲醛缀合以增加其荧光能力的示意图。
图13是显示内体逃逸介导肽通过酸不稳定接头连接至核酸纳米颗粒的示意图。
图14是显示待引入核酸纳米颗粒的可能的细胞毒性核苷酸的示意图。刺激反应性特性可以通过二硫键引入。
图15是显示可通过CuAAC产生的细胞毒性核苷酸的示意图。
图16是基于硼酸的细胞毒性核苷酸。
图17是显示可在5’末端与核酸复合的基于金属的部分的示意图。
图18是显示9-[2-(膦酰基甲氧基)乙基腺嘌呤的(S-酰基-2-硫乙基)酯衍生物的示意图,这是一种可以引入核酸纳米颗粒中的细胞毒性化合物。
图19是显示HepDirect的示意图,这是一种可以引入核酸纳米颗粒中的细胞毒性化合物。
图20是显示十八烷氧基乙基环状西多福韦的示意图,这是一种可以引入核酸纳米颗粒中的细胞毒性化合物。
图21是概述组合链理念的示意图;一种将两个或更多个货物分子连接在一起以增加治疗负荷能力的方法。给出了组合物的非详尽实例(A-D)。示意图中引用的是:I)组合链;II)纳米结构;III)接头;IV)治疗货物;V)靶向货物;VI)细胞进入货物;VII)其他功能货物。
图22是概述本发明的一个实施方案中组合物的核心支架的示意图(SQ-0000-001)。
图23是根据本发明的一个实施方案的二硫化物-降冰片烯5’修饰剂的合成示意图。
图24是概述用于用NHS-酯接头修饰5’氨基修饰的RNA的程序的示意图。
图25显示了5’氨基修饰的RNA与NHS-PEG-DBCO反应的RP-HPLC迹线。
图26显示了5’氨基修饰的siRNA的制备型RP-HPLC迹线。
图27显示了RNA链的分析性RP-HPLC迹线。
图28显示了5’降冰片烯修饰的C-4.4RNA与5’四嗪修饰的siRNA S-1.5(1:1摩尔当量)偶联后的时程实验的重叠分析RP-HPLC迹线。
图29显示了5’降冰片烯修饰的RNAC-4.4与5’四嗪修饰的siRNA S-1.5(1:2摩尔当量)偶联后的时程实验的重叠分析RP-HPLC。
图30显示了5’降冰片烯修饰的RNAC-4.4与5’四嗪修饰的siRNA S-1.5(1:4摩尔当量)偶联后的时程实验的重叠分析RP-HPLC迹线。
图31显示了5’降冰片烯修饰的RNAC-4.4与5’四嗪修饰的适体A-1.3偶联的分析RP-HPLC迹线。
图32显示了显示IEDDA偶联链(NA纳米颗粒核心链C-4.4+siRNA S-1.5)的纯化的HPLC迹线,相应的PAGE(15%变性,250V)显示纯化级分。
图33显示了18%MOPS PAGE(150V,2.5h,凝胶红色染色),显示退火的siRNA有义链和反义链。
图34显示了15%变性PAGE(250V,1h,凝胶红色染色),显示在30℃使用1:1摩尔当量的核心:适体通过IEDDA使核心NA纳米颗粒链C-4.4与适体A-1.3缀合。
图35显示了非变性PAGE(8%,150V,1h),显示具有完全组装的NA纳米颗粒(SQ1-0000-005)的代表性IEDDA缀合。
图36显示了核心链C-4.3与叠氮化物官能化的siRNA S-1.6的SPAAC缀合的变性PAGE(15%,250V,1h)。
图37显示了C-5.3的Cy7-NHS标记以形成C-5.2(302nm GelRed/Cy7通道)的变性PAGE(15%,250V,1h)。
图38显示了点击链(PEG和胆固醇在一个位置(链C-5.4)或八个位置(链C-5.5))的变性凝胶(15%,250V,1h)。
图39显示了变性PAGE(15%,250V,1h),显示纳米颗粒核心链C-1.1用5’-硫醇修饰的siRNA有义链S-1.1通过可逆二硫化物交联官能化。
图40显示了马来酰亚胺修饰的GFWFG在15分钟内的0至100%B(A=H2O+0.1%TFA;B=MeCN+0.1%TFA)中的RP HPLC迹线。
图41在左图中显示了硫醇-RNA C-2.1相对于相同链的肽缀合的RNA的变性PAGE,在右图中显示了缀合反应混合物的粗RPHPLC迹线。
图42显示了用于FlICk化学的含邻苯二甲醛的亚磷酰胺的合成方案。
图43是显示通过qPCR获得的、在用通过二硫化物或IEDDA偶联缀合至PLK1靶向siRNA的20nM RNA链转染后48小时MDA-MB-231乳腺癌细胞中PLK1 mRNA的表达水平的图。
图44显示了IEDDA偶联反应混合物的分析变性PAGE(250V,1h,凝胶红色染色)。
图45是显示通过qPCR获得的、在用20nM指示的siRNA转染后48小时MDA-MB-231乳腺癌细胞中PLK1 mRNA的表达水平的图。
图46显示了图表,显示在以浓度为200nM在具有10%热灭活FBS的细胞培养基中孵育2小时后,具有0个、1个、2个或4个靶向EGFR的适体(A-1.1)的Cy3标记的构建体与EGFR过表达A431癌细胞的结合。
图47显示了显微图像,显示在内化后适体在溶酶体中积累。
图48显示了显微图像,显示在细胞中内化后RNA纳米颗粒在核周空间中积累,表明内体摄取。
图49显示了自分解利巴韦林亚磷酰胺的合成方案。(i)DMTrCl、吡啶(ii)TBDMSCl、AgNO
图50显示了通过非变性PAGE组装的三种不同版本。
图51是通过GalNAc C35’亚磷酰胺(Glen)与单价和三价GalNAc偶联的组合货物(siRNA)的示意图。
图52是用于合成后IEDDA缀合的5’GalNAc修饰剂的合成示意图。GalNAc C3 CPG(Glen)用GalNAc C35’亚磷酰胺(Glen)和5’降冰片烯亚磷酰胺进行链延伸,然后是标准RNA脱保护条件(AMA/HF)。
图53是通过修饰的亚磷酰胺双缀合到胆固醇和三价GalNAc的组合货物(siRNA)的示意图。
具体实施方式
本发明提供了允许将货物递送至细胞的广泛范围的组合物。这些组合物装饰有允许货物的可互换连接的反应性位点。货物的实例包括允许在靶细胞中表达外源多肽的mRNA分子、允许调节靶细胞中的基因表达的其他类型的RNA分子、以及其他类型的治疗剂或诊断剂。本发明的组合物可以修饰生物分子的细胞特异性、细胞内化潜力、治疗功效并降低脱靶效应。
纳米颗粒,包括核酸纳米颗粒
在某些实施方案中,本发明的组合物包括纳米颗粒。如本文所用,“纳米颗粒”是指具有以纳米尺度测量的尺寸的颗粒。例如,纳米颗粒可具有1至1000nm的直径、长度、宽度或深度。
RNA纳米颗粒是由个体RNA分子的有序排列形成的,这些分子具有明确的二级结构。RNA分子形成各种结构基序,例如假结、吻式发夹和发夹环、3向和4向连接,它们影响分子的几何形状及其通过碱基配对与其他RNA分子形成稳定相互作用的能力。通常,个体RNA分子具有由分子内碱基配对产生的双链区域和可以与其他RNA分子形成碱基对或可以以其他方式与其他类型的分子结合的单链区域。
具有有序二维或三维结构的各种RNA纳米结构是已知的,包括例如但不限于纳米阵列、纳米笼、纳米立方体、纳米棱柱、纳米环、纳米支架和纳米管。纳米环可以是包括围绕轴排列的3个、4个、5个、6个、7个、8个或更多个RNA分子的对称或不对称结构。因此,纳米环可以是三聚体、四聚体、五聚体、六聚体、七聚体、八聚体或更高编号的聚合物。纳米环的形状可以是圆形、三角形、方形、五边形、六边形、七边形、八边形或其他多边形。其他类型的RNA纳米颗粒,例如片状、笼状、树状聚体和簇也是可能的,并且在本发明的范围内。“纳米支架”一般是指可以连接其他分子的纳米结构。各种结构排列的RNA纳米颗粒描述于例如WO2005/003,293;WO 2007/016,507;WO 2008/039,254;WO 2010/148,085;WO 2012/170,372;WO 2015/042,101;WO 2015/196,146;WO 2016/168,784;和WO 2017/197,009中,其各自的内容通过引用并入本文。
核酸纳米颗粒可以包含天然存在的核苷酸,或者它们可以包含化学修饰的核苷酸。化学修饰的核苷酸是本领域已知的并且描述于例如WO 2018/118587中,其内容通过引用并入本文。例如但不限于,核酸纳米颗粒、治疗剂和适体可以包含以下中的一种或多种:2’氟、2’O-甲基、2-硫尿苷、2’-O-甲氧基乙基、2’-胺、5-甲氧基尿苷、假尿苷、5-甲基胞苷、N1-甲基-假尿苷、锁核酸(LNA)、吗啉代和硫代磷酸酯修饰。其他修饰核苷酸包括5caC、5fC、5hoC、5hmC、5meC/5fu、5meC/5moU、5meC/thG、5moC、5meC/5camU、5meC、ψ、5meC/ψ、5moC/5moU、5moC/5meU、5hmC/5meU、me1ψ、5meC/me1ψ、5moU、5camU、m6A、5hmC/ψ、5moC/ψ、me6DAP、me4C、5fu、5-甲氧基尿苷、2-氨基腺嘌呤、2-硫胞嘧啶、2-硫胸腺嘧啶、2-硫尿嘧啶、3-甲基腺嘌呤、4-硫尿嘧啶、5,6-脱氢尿嘧啶、5-烯丙基胞嘧啶、5-烯丙基尿嘧啶、5-氨基烯丙基胞嘧啶、5-氨基烯丙基尿嘧啶、5-溴尿嘧啶、5-乙炔基胞嘧啶、5-乙炔基尿嘧啶、5-氟尿嘧啶、5-羟甲基胞嘧啶、5-羟甲基尿嘧啶、5-碘尿嘧啶、5-甲基胞嘧啶、5-甲基尿嘧啶、5-丙炔基胞嘧啶、5-丙炔基胞嘧啶、5-丙炔基尿嘧啶、5-丙炔基尿嘧啶、6-O-甲基鸟嘌呤、6-硫鸟嘌呤、7-脱氮-8-氮杂鸟嘌呤、7-脱氮腺嘌呤、7-脱氮鸟嘌呤、7-脱氮鸟嘌呤、8-氧代腺嘌呤、8-氧代鸟嘌呤、5-甲基胞苷、假尿苷、肌苷、2’-O-甲基腺苷、2’-O-甲基胞苷、2’-O-甲基鸟苷、2’-O-甲基尿苷、2’-O-甲基-假尿苷、2’-O-甲基3’-硫代磷酸腺苷、2’-O-甲基3’-硫代磷酸胞苷、2’-O-甲基3’-硫代磷酸鸟苷、2’-O-甲基3’-硫代磷酸尿苷、构象限制性核苷酸和2’-O-甲基3’-硫代磷酸假尿苷。
纳米颗粒的核酸可以包含糖修饰。例如但不限于,纳米颗粒的核酸可以包含以下中的一种或多种:2’-O-(2-甲氧基乙基)(2’MOE)、2’-甲氧基(2’OMe)、2’-氟(2’F)、2-’O-乙酸酯、2-胍基甲基-2-乙基丁酰氧基甲基(GMEBuOM)、2-氨基-2-甲基丙酰氧基甲基(AMPrOM)、2-氨基甲基-2-乙基丁酰氧基甲基(AMEBuOM)、2’-O-新戊酰氧基甲基(PivOM)、用上述胺或肽修饰的2’氨基锁核酸(LNA)、2’-O-[N,N-二甲基氨基)乙氧基]乙基、2’-N-[N,N-二甲基氨基)乙氧基]乙基、2’-N-咪唑乙酰胺、2’-O-[3-(胍)丙基]、2’-N-[3-(胍)丙基]、2’-O-[3-(胍)乙基]、2’-N-[3-(胍)乙基]、2’-O-(N-(氨基乙基)氨基甲酰基)甲基、2’-N-(N-(氨基乙基)氨基甲酰基)甲基、2’-O-[N-(2-((2-氨基乙基)氨基)乙基)]乙酰胺、2’-N-[N-(2-((2-氨基乙基)氨基)乙基)]乙酰胺、2’-N-2,2,3,3,4,4,5,5,6,6,7,7,8,8,8-十五氟辛酰胺、2’-N-咪唑乙酰胺、2’-O-咪唑甲基、2’-N-胍基苄基酰胺和4’-C-胍基甲酰肼甲基、2’-O-咪唑甲基、2’-N-咪唑甲基胺乙基。
点击化学
开发了点击化学以提供一种简单的方法将有机分子连接在一起,从而在温和的条件下提供高产率的产物。叠氮化物和炔烃之间反应形成双取代1,2,3-三唑最初分别由Meldal和同事(C.W.
纳米颗粒可以包含任何带有炔烃的部分。这可以通过化学或酶促修饰的核苷酸来实现。炔烃修饰的核苷酸是本领域已知的并且描述于例如WO/2017/189978中。炔烃修饰的核苷酸可以在糖、2’位置或核苷酸碱基上进行修饰。例如但不限于,糖修饰的核酸纳米颗粒可以包含以下中的一种或多种:4-氨基-1-((2R,3R,4R,5R)-4-羟基-5-(羟甲基)-3-(丙-2-炔-1-基氧基)四氢呋喃-2-基)嘧啶-2(1H)-酮(2’O炔烃C)、1-((2R,3R,4R,5R)-4-羟基-5-(羟甲基)-3-(丙-2-炔-1-基氧基)四氢呋喃-2-基)嘧啶-2,4(1H,3H)-二酮(2’O炔烃U),(2R,3R,4R,5R)-5-(6-氨基-9H-嘌呤-9-基)-2-(羟甲基)-4-(丙-2-炔-1-基氧基)四氢呋喃-3-醇(2’O炔烃A)、2-氨基-9-((2R,3R,4R,5R)-4-羟基-5-(羟基甲)-3-(丙-2-炔-1-基氧基)四氢呋喃-2-基)-1,9-二氢-6H-嘌呤-6-酮(2’O炔烃G)。还可以在炔烃部分和CH
其中修饰出现在碱基上的炔烃修饰的核苷酸可以包含以下中的一种或多种:(2R,3S,4R,5R)-2-(羟甲基)-5-(6-(丙-2-炔-1-基氨基))-9H-嘌呤-9-基)四氢呋喃-3,4-二醇(N6炔丙基A)、1-((2R,3R,4S,5R)-3,4-二羟基-5-(羟甲基)四氢呋喃-2-基)-4-(丙-2-炔-1-基氨基)嘧啶-2(1H)-酮(N4炔丙基C)、9-((2R,3R,4S,5R)-3,4-二羟基-5-(羟甲基)四氢呋喃-2-基)-2-(丙-2-炔-1-基氨基)-1,9-二氢-6H-嘌呤-6-酮(N2炔丙基G)、1-((2R,3R,4S,5R)-3,4-二羟基-5-(羟甲基)四氢呋喃-2-基)-3-(丙-2-炔-1-基)嘧啶-2,4(1H,3H)-二酮(N3炔丙基U)。
纳米颗粒可以包含并入寡核苷酸序列的5’或3’端的炔烃修饰的磷酸酯(图7)。此类亚磷酰胺描述于本领域中,例如,在US2009124571中。这些可以包括但不限于,2-氰乙基丙-2-炔-1-基二异丙基亚磷酰胺以及磷中心和炔部分之间的任何亚甲基延伸。也可以使用乙二醇单元代替亚甲基。
纳米颗粒可以包含任何带有叠氮化物的部分。这可以通过化学或酶促修饰的核苷酸来实现。炔烃修饰的核苷酸可以在糖、2’位置或核苷酸碱基上进行修饰。例如但不限于,糖修饰的核酸纳米颗粒可以包含以下中的一种或多种:(2R,3R,4R,5R)-5-(6-氨基-9H-嘌呤-9-基)-4-(叠氮基甲氧基)-2-(羟甲基)四氢呋喃-3-醇、4-氨基-1-((2R,3R,4R,5R)-3-(叠氮基甲氧基)-4-羟基-5(羟甲基)四氢呋喃-2-基)嘧啶-2(1H)-酮、2-氨基-9-((2R,3R,4R,5R)-3-(叠氮基甲氧基)-4-羟基-5-(羟甲基)四氢呋喃-2-基)-1,9-二氢-6H-嘌呤-6-酮(N2叠氮基G)、1-((2R,3R,4R,5R)-3-(叠氮基甲氧基)-4-羟基-5-(羟甲基)四氢呋喃-2-基)嘧啶-2,4(1H,3H)-二酮。
核苷酸碱基的叠氮化物修饰在本领域中是已知的并且例如在US 2006/0147924中有所描述。碱基修饰的叠氮基化合物可包含但不限于以下中的一种或多种:(2R,3R,4S,5R)-2-(6-叠氮基-9H-嘌呤-9-基)-5-(羟甲基)四氢呋喃-3,4-二醇(N6叠氮基A)、4-叠氮基-1-((2R,3R,4S,5R)-3,4-二羟基-5-(羟甲基)四氢呋喃-2-基)嘧啶-2(1H)-酮(N4叠氮基C)、2-叠氮基-9-((2R,3R,4S,5R)-3,4-二羟基-5-(羟甲基)四氢呋喃-2-基)-1,9-二氢-6H-嘌呤-6-酮(N2叠氮基G)(图6)。
纳米颗粒可以包含并入寡核苷酸序列的5’或3’端的叠氮化物修饰的磷酸酯。这些可包括但不限于叠氮基甲基(2-氰乙基)二异丙基亚磷酰胺以及磷中心和叠氮化物部分之间的任何亚甲基延伸。也可以使用乙二醇单元代替亚甲基。
由于痕量铜的潜在毒性问题,无铜叠氮化物-炔烃环加成在文献中对于生物学相关分子越来越流行。应变促进的叠氮化物-炔烃环加成(SPAAC)是解决此问题的便捷方法。不是使用Cu(I)来激活炔烃,而是将炔烃引入应变环辛炔衍生物中(N.J.Agard等人,Comparative study of bioorthogonal reactions with azides.,ACS Chem.Biol.1(2006)644–648.https://doi.org/10.1021/cb6003228.)。减轻这种环应变的愿望推动了与叠氮化物的反应。这种方法已用于寡核苷酸-叠氮化物衍生物的合成后标记(M.L.Winz.Site-specific one-pot triple click labeling for DNA and RNA,Chem.Commun.54(2018)11781–11784.https://doi.org/10.1039/c8cc04520h.),并且可以作为本发明的模块化设计的一部分应用。可以将叠氮化物修饰的核苷酸并入核酸纳米颗粒中。然后可以用环辛炔标记的底物标记组装的构建体。
逆电子需求狄尔斯-阿尔德已被确立为用于生物分子偶联的最强大的点击化学之一,并已用于DNA和RNA的合成后标记(J.Schoch等人,Post-Synthetic Modification ofDNA by Inverse-Electron-Demand Diels-Alder Reaction,J.Am.Chem.Soc.132(2010)8846–8847.https://doi.org/10.1021/ja102871p.);(A.M.Pyka等人,Diels-aldercycloadditions on synthetic RNA in mammalian cells,Bioconjug.Chem.25(2014)1438–1443.https://doi.org/10.1021/bc500302y.)。其内容通过引用并入本文。该环加成反应进行迅速,不使用过渡金属,并允许寡核苷酸在室温下有效官能化(图8)。
纳米颗粒可以包含任何降冰片烯(双环[2.2.1]庚-2-烯)部分。这可以通过化学或酶促修饰的核苷酸来实现。降冰片烯修饰的核苷酸可以在糖、2’位置或核苷酸碱基上进行修饰。例如但不限于,糖修饰的核酸纳米颗粒可以包含以下中的一种或多种:(2R,3R,4R,5R)-5-(6-氨基-9H-嘌呤-9-基)-4-(双环[2.2.1]庚-5-烯-2-基甲氧基)-2-(羟甲基)四氢呋喃-3-醇、4-氨基-1-((2R,3R,4R,5R)-3-(双环[2.2.1]庚-5-烯-2-基甲氧基)-4-羟基-5-(羟甲基)四氢呋喃-2-基)嘧啶-2(1H)酮、1-((2R,3R,4R,5R)-3-(双环[2.2.1]庚-5-烯-2-基甲氧基)-4-羟基-5-(羟甲基)四氢呋喃-2-基)嘧啶-2,4(1H,3H)-二酮(图5)。
纳米颗粒可以包含并入寡核苷酸序列的5’端的降冰片烯修饰的磷酸酯。这些可包括但不限于叠氮基甲基双环[2.2.1]庚-5-烯-2-基甲基(2-氰乙基)二异丙基亚磷酰胺,其在本领域中有描述(J.Schoch等人,Post-Synthetic Modification of DNA by Inverse-Electron-Demand Diels-Alder Reaction,J.Am.Chem.Soc.132(2010)8846–8847.https://doi.org/10.1021/ja102871p.)以及磷中心和叠氮化物部分之间的任何亚甲基延伸。也可以使用乙二醇单元代替亚甲基(图7)。
纳米颗粒可以包含任何硫醇部分。这可以通过化学修饰的核苷酸实现(图5)。硫醇修饰的核苷酸可以在糖、2’位置或核苷酸碱基上进行修饰。例如但不限于,糖修饰的核酸纳米颗粒可以包含以下中的一种或多种:(2R,3R,4R,5R)-5-(6-氨基-9H-嘌呤-9-基)-2-(羟甲基)-4-(2-巯基乙氧基)四氢呋喃-3-醇(硫醇A)、4-氨基-1-((2R,3R,4R,5R)-4-羟基-5-(羟甲基-3-(2巯基乙氧基)四氢呋喃-2-基)嘧啶-2(1H)-酮(硫醇C)、2-氨基-9-((2R,3R,4R,5R)-4-羟基-5-(羟甲基)-3-(2-巯基乙氧基)四氢呋喃-2-基)-1,9-二氢-6H-嘌呤-6-酮(硫醇G)、1-((2R,3R,4R,5R)-4-羟基-5-(羟甲基)-3-(2-巯基乙氧基)四氢呋喃-2-基)嘧啶-2,4(1H,3H)-二酮(硫醇U)。糖和硫原子之间可以有任意数量的亚甲基延伸。也可以使用乙二醇单元代替亚甲基并且可以使用以上的组合。
与硫修饰的核苷酸的可能缀合反应包括二硫化物形成(F.Gauthier等人,Conjugation of Small Molecules to RNA Using a Reducible Disulfide LinkerAttached at the 2′-OH Position through a Carbamate Function,EuropeanJ.Org.Chem.2019(2019)5636–5645.https://doi.org/10.1002/ejoc.201900740.)、硫醇-烯自由基反应(A.B.Lowe,Thiol-ene“click”reactions and recent applications inpolymer and materials synthesis:A first update,Polym.Chem.5(2014)4820–4870.https://doi.org/10.1039/c4py00339j.)、硫醇-炔自由基反应([1]A.B.Lowe,Thiol-yne’click’/coupling chemistry and recent applications in polymer andmaterials synthesis and modification,Polymer(Guildf).55(2014)5517–5549.https://doi.org/10.1016/j.polymer.2014.08.015.)、硫醇-迈克尔加成(R.M.Hensarling,Thiol-isocyanate“click”reactions:Rapid developmentoffunctional polymeric surfaces,Polym.Chem.2(2011)88–90.https://doi.org/10.1039/c0py00292e.)、硫醇异氰酸酯(R.M.Hensarling,Thiol-isocyanate“click”reactions:Rapid development of functional polymeric surfaces,Polym.Chem.2(2011)88–90.https://doi.org/10.1039/c0py00292e.)或硫醇环氧化物开环(M.C.Stuparu,Thiol-epoxy“click”chemistry:Application in preparation andpostpolymerization modification of polymers,J.Polym.Sci.Part A Polym.Chem.54(2016)3057–3070.https://doi.org/10.1002/pola.28195.)(图9)。
纳米颗粒可以包含任何胺部分。这可以通过化学或酶促修饰的核苷酸或亚磷酰胺来实现。胺修饰的核苷酸可以在糖、2’位置或核苷酸碱基上进行修饰。例如但不限于,糖修饰的核酸纳米颗粒可以包含以下中的一种或多种:(2R,3R,4R,5R)-5-(6-氨基-9H-嘌呤-9-基)-4-(2-氨基乙氧基)-2-(羟甲基)四氢呋喃-3-醇(氨基A)、4-氨基-1-((2R,3R,4R,5R)-3-(2-氨基乙氧基)-4-羟基-5-(羟甲基)四氢呋喃-2-基)嘧啶-2(1H)-酮(氨基C)、2-氨基-9-((2R,3R,4R,5R)-3-(2-氨基乙氧基)-4-羟基-5-(羟甲基)四氢呋喃-2-基)-1,9-二氢-6H-嘌呤-6-酮(氨基G)、1-((2R,3R,4R,5R)-3-(2-氨基乙氧基)-4-羟基-5-(羟甲基)四氢呋喃-2-基)嘧啶-2,4(1H,3H)-二酮。糖和氨基之间可以有任何数量的亚甲基延伸。也可以使用乙二醇单元代替亚甲基(图5)。
四氟化亚硫酰(SOF
亚硫酰四氟化物手柄可以与具有另一个点击官能团的分子缀合。
除了传统的点击化学之外,直接共价连接可以通过例如使用钯配合物的硫醇芳基化(E.V.Vinogradova等人,Organometallic palladium reagents for cysteinebioconjugation,Nature.526(2015)687–691.https://doi.org/10.1038/nature15739.)、肟连接(J.Y.Axup等人,Synthesis of site-specific antibody-drug conjugates usingunnatural amino acids,Proc.Natl.Acad.Sci.U.S.A.109(2012)16101–16106.https://doi.org/10.1073/pnas.1211023109.)、腙形成(D.K.
使用点击化学生成共价稳定结构
点击化学已被广泛用作寡核苷酸形成中的连接策略;例如,通过用三唑代替磷酸酯骨架而产生的材料具有高热力学稳定性和增强的抗酶降解性(A.H.El-Sagheer等人,Click nucleic acid ligation:Applications in biology and nanotechnology,Acc.Chem.Res.45(2012)1258–1267.https://doi.org/10.1021/ar200321n.)。本发明利用该原理赋予核酸纳米颗粒更高的稳定性。
纳米颗粒可以在假结、吻式发夹和发夹环、3向和4向连接处包含点击部分(图2)。这些修饰也可以散布在整个双链体中,并且可以在每个核酸链的不同点处代替磷酸酯骨架存在。
发夹和其他环状高阶结构也可以通过点击化学形成。炔烃和叠氮化物之间的1,3-偶极环加成生成由G-C和C-G碱基对组成的发夹茎干已在本领域中得到证明(A.Kiliszek等人,Stabilization ofRNA hairpins using non-nucleotide linkers andcircularization,Nucleic Acids Res.45(2017)4–12.https://doi.org/10.1093/nar/gkx122.)。该方法可用于本发明以产生环状结构。寡核苷酸的树脂上合成也可用于生成环状结构(J.Lietard等人,New strategies for cyclization and bicyclization ofoligonucleotides by click chemistry assisted by microwaves,J.Org.Chem.73(2008)191–200.https://doi.org/10.1021/jo702177c.)。
用于官能化核苷酸生产的方法
2,2’-脱水-1-(β-D-阿拉伯呋喃糖基)尿嘧啶已被广泛用作核苷化学中的关键中间体(A.Miah等人,2′,3′-Anhydrouridine.A useful synthetic intermediate,J.Chem.Soc.-Perkin Trans.1.(1998)3277–3283.https://doi.org/10.1039/a803563f.)并且其合成的各种途径已在本领域中展示(EP1992632A1)。这种中间体的亲核开环允许连接许多不同的官能团,并且其在通用核酸纳米颗粒的设计和开发中特别有用。该反应效率极低,并且需要使用苛刻的条件(>120℃,多当量的强路易斯酸)。
为了克服这些限制,用以下试剂中的一种或多种处理2,2’-脱水-1-(β-D-阿拉伯呋喃糖基)尿嘧啶:二甲基乙酰胺(DMA)、二噁烷、六甲基磷酰胺(HMPA)、DMF、二甲基亚砜(DMSO)、N,N'-二甲基丙烯脲(DMPU)、1,3-二甲基-2-咪唑啉酮(DMI)、四氢呋喃(THF)及其组合;温度:室温至160℃;碱(包括但不限于):叔丁醇钡、氢氧化苄基三甲基铵、2-叔丁基亚氨基-2-二乙基氨基-1,3-二甲基-过氢-1,3,2-二氮杂膦、正丁基锂、仲丁基锂、叔丁基锂、
FlICk化学
荧光异吲哚交联(FlICk)反应最近已成为稳定肽二级结构的重要工具(M.Todorovic等人,Fluorescent Isoindole Crosslink(FlICk)Chemistry:A Rapid,User-friendly Stapling Reaction,Angew.Chemie Int.Ed.(2019)14258–14262.https://doi.org/10.1002/anie.201909719.)。在该反应中,将邻苯二甲醛添加到具有游离胺基和硫醇基团的大分子中,由此产生的缩合反应会产生荧光异吲哚。然后,异吲哚基团可以稳定该肽的二级结构,并还产生可用于体外和体内研究的荧光信号。
这样的反应将允许核酸纳米颗粒构建体稳定化并且将为生物学研究提供内置荧光(图11)。荧光异吲哚染料是本领域已知的并且例如在US 9412955B2和WO 2012/022945中有所描述。这种方法优于其他装订方法,因为除了链稳定之外还产生了荧光团。它还否定了附加荧光部分的使用。
为了产生荧光部分,需要将含硫醇的核苷酸放置在具有胺修饰的相邻核苷酸附近。这些可以是同一寡核苷酸链上的核苷酸,或可以是双链体中相对的链上的核苷酸。这些也可以是吻式茎环的一部分。然后用邻苯二甲醛或其类似物处理组装的核酸纳米颗粒构建体。
邻苯二甲醛类似物可能包括与已知荧光染料缀合的二醛。这些可包括但不限于荧光素、Hoechst 33342、BODIPY-FL、级联黄(Cascade Yellow)、4-MU、芘、BODIPY-TR、Cy3、Cy5、SRh
FlICk装订将利用胺和硫醇修饰的核苷酸。此外,该组合物还可以包含荧光标签位点;基于硫醇胺的新型核苷酸,其中硫醇基和胺基在同一分子上相距4-5个键。下面给出的一个实例是1-((2R,3R,4R,5R)-3-(3-氨基-2-(巯基甲基)丙氧基)-4-羟基-5-(羟甲基)四氢呋喃-2-基)嘧啶-2,4(1H,3H)-二酮。
连接货物的功能
以上概述的修饰将允许连接各种官能团。这些包括但不限于细胞毒性药物和其他疗法、mRNAorigami、内体逃逸介质和操纵蛋白冠的部分。这些实体可以是小分子、肽、蛋白质、寡核苷酸或其组合。
进入细胞
货物分子的细胞内靶向是开发使用核酸纳米颗粒递送治疗性货物的组合物的关键挑战。本发明通过提供包括具有一种或多种细胞进入机制以提高货物分子的治疗功效的纳米颗粒的组合物具体地解决了这个问题并且是在USPTO 62/894,390中进行的工作的延伸。
胞吞作用涉及囊泡从质膜出芽和囊泡进入溶酶体,在溶酶体中胞吞的物质被降解。内体内的pH在通往溶酶体的途中降低,并且溶酶体的酸性环境支持大分子的降解。因此,使用pH敏感接头将货物分子连接到核酸纳米颗粒将允许在循环血液或其他细胞外环境的中性pH下安全连接,但在囊泡内吞途径中从纳米颗粒中释放货物。参见,例如,Gujrati M等人,Multifunctional pH-Sensitive Amino Lipids for siRNA Delivery,BioconjugChem.2016 Jan 20;27(1):19-35,doi:10.1021/acs.bioconjchem.5b00538,其内容通过引用并入本文。
一种促进内体逃逸的方法是修饰核苷酸和/或将具有特定性质的小分子缀合到RNA纳米颗粒中的核苷酸。修饰或添加可以在核苷酸的2’位置、核苷酸的碱基或含磷骨架。例如但不限于,缀合物可以是或包括以下:2’-O-咪唑乙酰基修饰、2’-O-[N,N-二甲基氨基乙氧基]乙基修饰、烷基-硫代磷酸酯、胺(例如,具有不同pKa值的伯胺、仲胺、叔胺和咪唑胺的组合)、胆固醇脂质、内体增强结构域、氟化炔烃链、胍基丁基氨基磷酸酯、疏水基团、带正电荷的部分、三甘醇和三氟甲基喹啉。这样的修饰已被用于促进其他类型大分子的内体逃逸。例如,由于与内体膜的相互作用和孔形成,疏水性氨基酸如色氨酸或苯丙氨酸可以增强内体逃逸。胺,包括具有不同pKa值的伯胺、仲胺、叔胺和咪唑胺的组合,在pH 5-7时被质子化,并通过破坏颗粒膜并将货物释放到胞质溶胶中来促进内体逃逸。许多上述促进内体逃逸的策略描述在例如以下中:Liu D和Auguste DT,Cancer targeted therapeutics:Frommolecules to drug delivery vehicles,J Control Release.2015Dec 10;219:632-643.doi:10.1016/j.jconrel.2015.08.041;Singh DD等人,CRISPR/Cas9 guided genomeand epigenome engineering and its therapeutic applications in immune mediateddiseases,Semin Cell Dev Biol.2019 Jun 19.pii:S1084-9521(18)30111-3.doi:10.1016/j.semcdb.2019.05.007;以及Lonn P等人,Enhancing Endosomal Escape forIntracellular Delivery of Macromolecular Biologic Therapeutics,SciRep.2016Sep 8;6:32301.doi:10.1038/srep32301;Gujrati M等人,Multifunctional pH-SensitiveAmino Lipids for siRNA Delivery,Bioconjug Chem.2016Jan 20;27(1):19-35,doi:10.1021/acs.bioconjchem.5b00538;Deglane,G等人,Impact of theguanidinium group on hybridization and cellular uptake of cationicoligonucleotides,Chembiochem,20067(4):p.684-92,DOI:10.1002/cbic.200500433;Prhavc,M等人,2'-O-[2-[2-(N,N-dimethylamino)ethoxy]ethyl]modifiedoligonucleotides:symbiosis ofcharge interaction factors and stereoelectroniceffects,Org Lett,2003.5(12):p.2017-20,DOI:10.1021/ol0340991;Shen,W等人,Journal of Materials Chemistry B,2016.4(39):p.6468-6474;以及Kurrikoff,K等人,Recent in vivo advances in cell-penetrating peptide-assisted drug delivery,Expert Opin Drug Deliv,2016,13(3):p.373-87,DOI:10.1517/17425247.2016.1125879;Gilleron J等人,Image-based analysis of lipid nanoparticle-mediated siRNAdelivery,intracellular trafficking and endosomal escape,NatBiotechnol.2013Jul;31(7):638-46.doi:10.1038/nbt.2612,其每篇文章的内容均通过引用并入本文。
一种或多种通过内吞作用或其他方式促进细胞进入的以下分子可以与纳米颗粒中的核酸缀合:UN 7938、三氟甲基喹啉、UN 2383、CPW1F10、CBN40D12、ADD41 D14、ADD29F15、CBN40H10、CBN40 K7、BADGE、CBN35 C21、CBNO53 M19、CPW1-J18、甲氧氯、CPW097 A20、LOMATIN、胍那苄(guanabenz)、UNC7938、CPM2、3-(全氟丁-1-基)-1-羟丙基、3-(全氟己-1-基)-1-羟丙基、3-脱氮蝶啶、α-生育酚、维拉帕米、尼日利亚菌素、3,3,4,4,5,5,6,6,7,7,8,8,9,9,9-十五氟壬-2-酮、或N1-乙基-N1-甲基-N2-(7-(三氟甲基)喹啉-4-基)乙烷-1,2-二胺、TfR-T12、蜂毒肽、HA2、叶酸、八精氨酸缀合硬脂酰-R8、锁核酸、肽转导结构域和氟化或全氟化合物。
在一些实施方案中,核酸纳米颗粒具有胍基丁基氨基磷酸酯,如下所示:
在一些实施方案中,核酸纳米颗粒具有2’-O-咪唑乙酰基修饰,如下所示:
在一些实施方案中,核酸纳米颗粒具有2’-O-[N,N-二甲基氨基)乙氧基]乙基修饰,如下所示:
在一些实施方案中,核酸纳米颗粒具有dsDNA,其具有通过作为核心NP上的臂连接的三甘醇(TEG)接头缀合的胆固醇脂质。
在一些实施方案中,核酸纳米颗粒具有直接连接于RNA分子的胆固醇。
在一些实施方案中,核酸纳米颗粒具有连接至dsDNA或dsRNA的烷基硫代磷酸酯(PPT)疏水带。
在一些实施方案中,核酸纳米颗粒具有pKa为约5.0至约7.0的组分。
在一些实施方案中,核酸纳米颗粒具有疏水组分。
在一些实施方案中,核酸纳米颗粒具有在约7.0的pH下带正电荷的组分。
在一些实施方案中,核酸纳米颗粒具有肽。所述肽可包括表1中的一个或多个序列。
表1–介导内体逃逸的肽序列
/>
在一些实施方案中,核酸纳米颗粒具有包括疏水部分、亲水部分和核苷酸连接部分(nucleotide attachment moiety)的组分。例如但不限于,组分可以具有以下结构:
亲水部分可以包括胺。亲水部分可以是精胺、乙二胺、甲基乙二胺、乙基乙二胺、咪唑、精胺-咪唑-4-亚胺、N-乙基-N'-(3-二甲基氨基丙基)-胍基亚乙基亚胺、丙烯酸二甲基氨基乙酯、氨基乙烯基醚、4-咪唑乙酸、二乙基氨基丙基酰胺、磺胺类药物(例如磺胺二甲氧嘧啶磺胺甲噁唑、磺胺嘧啶、磺胺二甲嘧啶)、氨基缩酮、N-2-羟丙基三甲基氯化铵、咪唑-4-亚胺、甲基-咪唑、2-(氨基甲基)咪唑、4-(氨基甲基)咪唑、4(5)-(羟甲基)咪唑、N-(2-氨基乙基)-3-((2-氨基乙基)(甲基)氨基)丙酰胺、2-(2-乙氧基乙氧基)乙-1-胺、双(3-氨基丙基)胺、[N,N-二甲基氨基)乙氧基]乙基、N-(2-氨基乙基)-3-((2-氨基乙基)(乙基)氨基)丙酰胺、(N-(氨基乙基)氨基甲酰基)甲基、N-(2-((2-氨基乙基)氨基)乙基)乙酰胺、3,3’-((2-氨基乙基)氮杂二基)双(N-(2-氨基乙基)丙酰胺)、胍基苯甲酰胺、[3-(胍)丙基]、二甲基乙醇胺、1-(2,2-二甲基-1,3-二氧戊环-4-基)-N,N-二甲基甲胺、2-(2,2-二甲基-1,3-二氧戊环-4-基)-N,N-二甲基乙-1-胺、N-(2-((2-(2-氨基乙氧基)丙-2-基)氧基)乙基)乙酰胺、氨基丁基、氨基乙基、1-(2-氨基乙基)-3-(3-(二甲基氨基)丙基)-2-乙基胍、1-(3-氨基-3-氧代丙基)-2,4,6-三甲基吡啶-1-鎓、1-(1,3-双(羧氧基)丙-2-基)-2,4,6-三甲基吡啶-1-鎓、胍基乙基胺、醚羟基三唑或β-氨基酯。
核苷酸连接部分可以是半胱氨酸。
核酸纳米颗粒可以以受体非依赖性方式促进货物分子进入细胞。核酸纳米颗粒可以以受体依赖性方式促进货物分子的内体逃逸。核酸纳米颗粒可包含与细胞中的受体结合的组分。与受体结合的组分可以是叶酸、TfR-T
该组合物可以包含任何上述接头。
在一些实施方案中,核酸纳米颗粒可通过叠氮甲基-甲基马来酸酐接头连接至可增加细胞摄取的部分(图13)(K.Maier等人,J.Am.Chem.Soc.134(2012)10169–10173.https://doi.org/10.1021/ja302705v.)。
组合物可以包含任何上述核酸纳米颗粒。核酸纳米颗粒可以包含任何上述修饰的核苷酸(及其衍生物)。衍生物可能包括2’位置的不同长度的接头,或碱基上取代的各种基团。
除了上述修饰外,以下部分(及其衍生物)可能直接连接到核苷酸骨架上:
/>
R=
衍生物可能包括2’位置的不同长度的接头,或碱基上取代的各种基团。
除了内体逃逸外,核酸纳米颗粒可以还装饰有可以与脂质双层动态相互作用的分子。DNA纳米孔已被证明能够穿透脂质双层并促进水溶性分子直接转运到细胞中(J.R.Bums等人,Membrane-spanning DNA nanopores with cytotoxic effect,Angew.Chemie-Int.Ed.53(2014)12466-12470.https://doi.org/10.1002/anie.201405719)。这些纳米孔利用锚定的胆固醇基团;每两个DNA双链体一个胆固醇基团会产生高穿孔活性(O.Birkholz等人,Multi-functional DNA nanostructures that puncture and remodel lipidmembranes into hybrid materials,Nat.Commun.9(2018)1521.https://doi.org/10.1038/s41467-018-02905-w)。上面的胆固醇部分可以与核酸纳米颗粒结合并帮助介导纳米颗粒的摄取。
细胞毒性核苷
除了细胞毒性货物的直接连接之外,本发明的组合物可以包括嵌入寡核苷酸链或核酸纳米颗粒中的细胞毒性核苷。这些核苷可包括但不限于芒霉素(aristomycin)、奈普诺辛A(neoplanocin A)、利巴韦林、吡唑霉素、阿糖胞苷(ara-C)、吉西他滨、2-CdA、焦土霉素和噻唑呋林(tiazofurin)及其组合(图14)。目前使用的治疗性核苷和核苷酸类似物利用与内源性核苷或核苷酸相同的代谢途径,并作为抗代谢物。进入细胞后,化合物被核苷激酶和/或核苷单磷酸激酶磷酸化,然后被进一步的细胞激酶或磷酸核糖基转移酶磷酸化。这通常会导致化合物活化。许多目前临床上的细胞毒性核苷和核苷酸容易产生耐药性,因此在核酸纳米颗粒递送系统中采用联合方法可能有助于规避这一问题。这些前核苷酸修饰在本领域中有描述,并通过引用并入本文;B.Colin等人,Synthesis and biologicalevaluation of some phosphate triester derivatives of the anti-cancer drugAraC,Nucleic Acids Res.17(18)(1989)7195-7201.doi:10.1093/nar/17.15.6065;C.McGuigan等人,Synthesis and biological evaluation ofsome phosphate triesterderivatives of the anti-viral drug AraA,Nucleic Acids Res.17(15)(1989)6065-6075.doi:10.1093/nar/17.15.6065;C.McGuigan等人,Aryl phosphate derivatives ofAZT retain activity against HIV1 in cell lines which are resistant to theaction of AZT,Antiviral Res.17(4)(1992)311-321.doi:10.1016/0166-3542(92)90026-2;J.Balzarini等人,Mechanism of anti-HIV action of masked alaninyl d4T-MP derivatives,Proc.Natl.Acad.Sci.93(14)(1996)7295-7299.doi:10.1073/pnas.93.14.7295;T.-F.Chou等人,Phosphoramidate pronucleotides:a comparison ofthe phosphoramidase substrate specificity of human and Escherichia colihistidine triad nucleotide bindingproteins,Mol.Pharm.4(2)(2007)208-217.doi:10.1021/mp060070y;T.W.Abraham等人,Synthesis and biological activity ofaromatic amino acid phosphoramidates of 5-fluoro-2‘-deoxyuridine and 1-β-arabinofuranosylcytosine:Evidence of phosphoramidase activity,J.Med.Chem.39(23)(1996)4569-4575.doi:10.1021/jm9603680;J.Kim等人,Direct Measurement ofNucleoside Monophosphate Delivery from a Phosphoramidate Pronucleotide byStable Isotope Labeling and LC-ESI--MS/MS,Mol.Pharm.1(2)(2004)102-111.doi:10.1021/mp0340338;C.Congiatu等人,Molecular modelling studies on the bindingofsomeprotides to the putative human phosphoramidase Hint1,NucleosidesNucleotides Nucleic Acids 26(8-9)(2007)1121-1124.doi:10.1080/15257770701521656;P.Wipf等人,Synthesis ofchemoreversible prodrugs of ara-Cwith variable time-release profiles.Biological evaluation of their apoptoticactivity,Bioorg.Med.Chem.4(10)(1996)1585-1596.doi:10.1016/0968-0896(96)00153-8;S.C.Tobias等人,Synthesis and biological evaluation of a cytarabinephosphoramidate prodrug,Mol.Pharm.1(2)(2004)112-116.doi:10.1021/mp034019v。
上述修饰可以直接嵌入形成核酸纳米颗粒的寡核苷酸中。
脱氧胞苷类似物ara-C容易产生耐药机制,从而降低其功效。为了抵消这一点,已经开发了ara-C的反油酸酯,称为艾西拉滨(A.C.Burke等人,Elacytarabine–lipidvectortechnology overcoming drug resistance in acute myeloid leukemia,ExpertOpin.Invest.Drugs 20(12)(2011)1707-1715.doi:10.1517/13543784.2011.625009;S.O'brien,Elacytarabine has single-agent activity inpatients with advanced acutemyeloidleukaemia,Br.J.Haematol.158(5)(2012)581-588.doi:10.1111/j.1365-2141.2012.09186.x)。本发明可以在5’末端、3’末端或嵌入寡核苷酸链中包括这种修饰。
许多核苷化合物缺乏细胞毒性的一个常见原因是它们不能被核苷激酶或其他激活酶激活到单磷酸酯水平(J.D.Rose等人,Enhancement of nucleoside cytotoxicitythrough nucleotide prodrugs,J.Med.Chem.45(2002)4505–4512.doi:10.1021/jm020107s.)。因此,这些核苷可能作为单磷酸酯前药作为悬垂部分连接。
细胞毒性核苷可能连接到刺激反应性接头,例如谷胱甘肽反应性二硫键。含二硫化物的亚磷酰胺,例如2-((3-((2-氰基乙基)(二异丙基氨基)磷酰基)丙基)二硫烷基)乙基甲基碳酸酯,可以并入5’末端、3’末端或嵌入寡核苷酸链内。与该二硫化物缀合的细胞毒性前药的一个实例是5-氟尿嘧啶(图14)。
点击化学也可用于产生细胞毒性化合物。岩藻糖基转移酶(Fuc-T)是催化许多重要糖类生物合成和表达中最终糖基化步骤的酶。它们与多种病理学有关,包括癌症转移,并且它们对核苷酸样化合物的抑制作用已得到广泛探索(L.V.Lee等人,A potent andhighly selective inhibitor of humanα-1,3-fucosyltransferase via clickchemistry,J.Am.Chem.Soc.125(2003)9588–9589.doi:10.1021/ja0302836.)。本发明可能包括三唑连接的核酸。通过三唑连接产生的细胞毒性化合物的实例包括N-([1,1'-联苯]-4-基甲基)-5-(((3-(((2R,3S,4R,5R)-5-(2-氨基-6-氧代-1,6-二氢)-3,4-二羟基四氢呋喃-2-基)甲氧基)-1,1,3,3-四氧代-1λ
纳米颗粒可以包含在5’或3’端并入的杂交体。这些可以包括Wang描述的硼酸载体(图16)(N.Lin等人,Design and synthesis of boronic-acid-labeled thymidinetriphosphate for incorporation into DNA,Nucleic Acids Res.35(4)(2007)1222-1229.doi:10.1093/nar/gkl1091;M.Li等人.Selecting aptamers for a glycoproteinthrough the incorporation of the boronic acid moiety,J.Am.Chem.Soc.130(38)(2008)12636-12638.doi:10.1021/ja801510d)以及链碳硼烷或金属碳硼烷络合物(图17)(A.Olejniczak等人,2′-deoxyadenosine bearing hydrophobic carboranepharmacophore,Nucleosides Nucleotides Nucleic Acids 26(10-12)(2007)1611-1613.doi:10.1080/15257770701548733;B.A.Wojtczak等人,“Chemical Ligation”:Aversatile method for nucleoside modification with boron clusters,Chemistry 14(34)(2008)10675-10682.doi:10.1002/chem.200801053)。
核酸纳米颗粒还可以携带任何磷酸盐前药,其并入在5’末端、3’末端或嵌入寡核苷酸链内,或通过点击化学进行后合成。这样的修饰包括9-[2-(膦酰基甲氧基)乙基]腺嘌呤(PMEA)的双(S-酰基-2-硫乙基)酯衍生物(图18)(S.Benzaria等人,Synthesis,in vitroantiviral evaluation,and stability studies of bis(S-acyl-2-thioethyl)esterderivatives of 9-[2-(phosphonomethoxy)ethyl]adenine(PMEA)as potential PMEAprodrugs with improved oral bioavailability,J.Med.Chem.39(25)(1996)4958-4965.doi:10.1021/jm960289o)、cycloSal前核苷酸(C.Meier等人,Application of thecycloSal-prodrug approach for improving the biological potential ofphosphorylated biomolecules,Antiviral Res.71(2-3)(2006)282-292.doi:10.1016/j.antiviral.2006.04.011;C.Meier等人,Chemistry and anti-herpes simplex virustype 1evaluation of cyclo Sal-nucleotides of acyclic nucleoside analogues,Antivir.Chem.Chemother.9(5)(1998)389-402.doi:10.1177/095632029800900503;O.R.Ludek等人,Divergent synthesis and biological evaluation of carbocyclicα-,iso-and 3′-epi-nucleosides and their lipophilic nucleotide prodrugs,Synthesis2006(08)(2006)1313-1324.doi:10.1055/s-2006-926411)。HepDirect前药;磷酸酯和膦酸酯前药,其导致直接肝脏靶向递送,然后在肝细胞中细胞色素P450催化的氧化裂解反应(图19)(M.D.Erion,Liver-targeted drug delivery using HepDirect prodrugs,J.Pharmacol.Exp.Ther.312(2)(2005)554-560.doi:10.1124/jpet.104.075903;S.H.Boyer,Synthesis and characterization of a novel liver-targeted prodrug ofcytosine-1-β-D-arabinofuranoside monophosphate for the treatment ofhepatocellular carcinoma,J.Med.Chem.49(26)(2006)7711-7720.doi:10.1021/jm0607449;M.D.Erion等人,Design,synthesis,and characterization ofa series ofcytochrome P4503A-activated prodrugs(hepdirect prodrugs)useful for targetingphosph(on)ate-based drugs to the liver,J.Am.Chem.Soc.126(16)(2004)5154-5163.doi:10.1021/ja031818y;K.Y.Hostetler,Alkoxyalkyl prodrugs of acyclicnucleoside phosphonates enhance oral antiviral activity and reduce toxicity:current state ofthe art,Antiviral Res.82(2)(2009)A84-A98.doi:10.1016/j.antiviral.2009.01.005),十八烷氧基乙基西多福韦(ODE-CDV)(图20)(G.R.Painter等人,Design and development of oral drugs for the prophylaxis and treatment ofsmallpox infection,Trends Biotechnol.22(8)(2004)423-427.doi:10.1016/j.tibtech.2004.06.008)。
本节中提到的所有治疗部分都可以直接嵌入形成核酸纳米颗粒的寡核苷酸中。
组合链
除了在纳米颗粒上的每个连接点处直接连接单个货物分子之外,本发明的组合物还可以包括与其他货物分子连接的货物分子(图21)。在没有纳米颗粒的情况下,货物分子也可以连接到其他货物分子。
这些连接的货物分子,也称为“组合链”(图21),可包括但不限于促进细胞内或外功能和/或生物效应的分子(例如IRES、核糖体募集、细胞因子刺激)、促进进入细胞的分子(例如肽、内体逃逸化合物)、与靶细胞结合的分子(例如适体、抗体、配体)、细胞毒性化合物(例如细胞毒性核苷)、在细胞内表达基因产物的分子(例如mRNA)、化学治疗化合物(例如烷化剂、抗代谢物、拓扑异构酶抑制剂)、沉默或改变细胞内基因的分子(例如siRNA、miRNA、反义疗法、lncRNA)、CRISPR分子(例如gRNA、Cas9蛋白、Cas9 mRNA)、小分子疗法(例如蛋白酪氨酸激酶抑制剂、蛋白酶体抑制剂)、蛋白质、肽和诊断剂。
组合链可以是货物分子的任何组合并且可以是任何长度。在一个实施方案中,它们可以包括siRNA、肽和适体组合链,它们可以连接或不连接到纳米结构。在另一个实施方案中,组合链可以是设计成沉默不同或相同靶基因的多种siRNA疗法。进一步的实施方案可以包括多种疗法,例如化学疗法和形成相同组合链的一部分的siRNA。在另一个实施方案中,货物分子可以线性排列或以分支排列连接以形成组合链。
组合链可以连接也可以不连接到纳米颗粒。多条链也可以连接到同一个纳米颗粒。组合链可以连接到核酸纳米颗粒和不是由核酸构建的纳米颗粒(例如脂质和聚合物纳米颗粒以及抗体-药物偶联物)。
组合链可以通过点击化学连接到纳米颗粒上。简而言之,这些包括但不限于CuAAC、SPAAC、RuAAC、IEDDA、SuFEx、SPANC、腙/肟醚形成、硫醇-烯自由基反应、硫醇-炔自由基反应、硫醇-迈克尔加成反应、硫醇-异氰酸酯反应、硫醇-环氧化物点击反应、亲核开环反应(弹簧加载反应)、无痕施陶丁格连接。
组合链也可以通过立足点相互作用连接到核酸纳米颗粒上(K.A.Afonin等人,TheUse of Minimal RNA Toeholds to Trigger the Activation of MultipleFunctionalities,Nano Lett.16(2016)1746–1753.https://doi.org/10.1021/acs.nanolett.5b04676.)。
形成组合链的货物分子可以通过接头分子相互连接。接头分子包括但不限于硫醇可切割接头如二硫代双马来酰亚胺乙烷、1,4-双[3-(2-吡啶基二硫基)丙酰氨基]丁烷和3-(2-吡啶基二硫基)丙酰肼、碱可切割接头如双[2-(N-琥珀酰亚胺基-氧羰基氧基)乙基]砜,或羟胺可切割接头例如(乙二醇双(琥珀酰亚胺基琥珀酸酯)。可逆点击部分,即米氏酸(Meldrum’s acid)衍生物5-(双(甲硫基)亚甲基)-2,2-二甲基-1,3-二噁烷-4,6-二酮也可用于交联货物分子(K.L.Diehl等人,Click and chemically triggered declickreactions through reversible amine and thiol coupling via a conjugateacceptor,Nat.Chem.8(2016)968–973.https://doi.org/10.1038/nchem.2601.)。也可以单独使用切丁酶底物或与上述底物组合使用。当治疗不需要细胞溶质释放时,也可以使用不可切割的接头;这些包括但不限于硫醇反应性马来酰亚胺(例如,1,8-双马来酰亚胺-二乙二醇、1,11-双马来酰亚胺-三乙二醇、1,4-双马来酰亚胺丁烷、双马来酰亚胺己烷、双马来酰亚胺乙烷、三(2-马来酰亚胺乙基)胺)、硫醇/胺反应性接头(例如,N-α-马来酰亚胺乙酰-氧基琥珀酰亚胺酯、N-β-马来酰亚胺丙基-氧基琥珀酰亚胺酯、N-ε-马来酰亚胺己酸、N-γ-马来酰亚胺丁酰-氧基琥珀酰亚胺酯、琥珀酰亚胺基4-(N-马来酰亚胺甲基)环己烷-1-羧基-(6-氨基己酸酯)、琥珀酰亚胺基6-(3(2-吡啶基二硫基)丙酰氨基)己酸酯、间马来酰亚胺苯甲酰基-N-羟基琥珀酰亚胺酯、琥珀酰亚胺基碘乙酸酯、琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯、PEG化长链SMCC交联剂、琥珀酰亚胺基4-(对马来酰亚胺苯基)丁酸酯和磺基-NHS等效物)、羟基/硫醇反应性接头(例如对马来酰亚胺苯基异氰酸酯)。
实施方案
在实施方案中,本发明提供了包含与一个或多个货物分子共价连接的寡核苷酸的组合物。
在实施方案中,所述组合物包含寡核苷酸,所述寡核苷酸被允许缀合的反应位点官能化并组装成核酸纳米颗粒。
在实施方案中,所述核酸纳米颗粒连接至货物分子,其中所述核酸纳米颗粒被官能化以促进货物分子在受试者体内的生物活性。
在实施方案中,所述核酸纳米颗粒是三聚体、四聚体、五聚体或六聚体。
在实施方案中,本发明提供了包括通过至少一个反应将核酸纳米颗粒连接到至少一个货物分子的方法,所述反应包括以下特征中的至少一个:反应在一锅中发生,反应不受水干扰,反应产生最少的副产物,以及反应包含提供单一反应产物的高热力学驱动力。
在实施方案中,所述方法包括通过包括所述特征中的至少一个的第一反应连接第一货物分子以及通过包括所述特征中的至少一个的第二反应连接第二货物分子,其中所述第一反应和所述第二反应是正交的。
在实施方案中,所述第一反应包括对核酸纳米颗粒中至少一个寡核苷酸的链进行修饰。
在实施方案中,所述核酸纳米颗粒通过铜(I)叠氮化物-炔烃环加成连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过应变促进的叠氮化物-炔烃环加成连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过逆电子需求狄尔斯-阿尔德反应连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过二硫键连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过硫(VI)氟交换连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过腙形成连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过硫醇-烯自由基加成连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过硫醇-炔反应连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过硫醇-迈克尔加成连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过硫醇-异氰酸酯化学连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过硫醇-环氧化物化学连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过亲核开环反应连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过无痕施陶丁格连接连接至所述第一货物分子。
在实施方案中,一个反应性官能团通过间隔区或接头连接到另一个。
在实施方案中,所述核酸纳米颗粒通过对刺激有反应的接头连接至第一货物。
在实施方案中,所述刺激选自由pH、光、温度、还原电位或氧浓度组成的组。
在实施方案中,所述核酸纳米颗粒是共价稳定的。
在实施方案中,本发明提供了包含与邻苯二甲醛复合以产生异吲哚的核酸的组合物。
在实施方案中,本发明提供了包含用胺和硫醇反应位点官能化的寡核苷酸和由这些官能化的寡核苷酸自组装的核酸纳米颗粒的组合物。
在实施方案中,胺和硫醇同时与邻苯二甲醛反应生成荧光异吲哚。
在实施方案中,所述荧光部分与额外的荧光团缀合。
在实施方案中,所述核酸纳米颗粒通过正交点击化学与货物缀合。
在实施方案中,本发明提供了包含核酸纳米颗粒的组合物,所述核酸纳米颗粒包含核酸双链体,所述核酸双链体包含与外部试剂复合以形成荧光团的反应性部分。
在实施方案中,胺和硫醇同时与邻苯二甲醛反应,其中荧光团是荧光异吲哚。
在实施方案中,所述荧光团与另外的荧光团缀合。
在实施方案中,所述核酸纳米颗粒通过正交点击化学与货物分子缀合。
在实施方案中,所述核酸纳米颗粒包含含有疏水部分、亲水部分和核苷酸连接部分的组分。
在实施方案中,所述疏水和亲水部分共价连接至所述核酸纳米颗粒。
在实施方案中,所述疏水和亲水部分通过酰胺、胺或醚键共价连接至核酸。
在实施方案中,所述亲水部分包含胺。
在实施方案中,亲水部分选自精胺、乙二胺、甲基乙二胺、乙基乙二胺、咪唑、精胺-咪唑-4-亚胺、N-乙基-N'-(3-二甲基氨基丙基)-胍基亚乙基亚胺、丙烯酸二甲基氨基乙酯、氨基乙烯基醚、4-咪唑乙酸、二乙基氨基丙基酰胺、磺胺类药物(例如磺胺二甲氧嘧啶磺胺甲噁唑、磺胺嘧啶、磺胺二甲嘧啶)、氨基缩酮、N-2-羟丙基三甲基氯化铵、咪唑-4-亚胺、甲基-咪唑、2-(氨基甲基)咪唑、4-(氨基甲基)咪唑、4(5)-(羟甲基)咪唑、N-(2-氨基乙基)-3-((2-氨基乙基)(甲基)氨基)丙酰胺、2-(2-乙氧基乙氧基)乙-1-胺、双(3-氨基丙基)胺、[N,N-二甲基氨基)乙氧基]乙基、N-(2-氨基乙基)-3-((2-氨基乙基)(乙基)氨基)丙酰胺、(N-(氨基乙基)氨基甲酰基)甲基、N-(2-((2-氨基乙基)氨基)乙基)乙酰胺、3,3’-((2-氨基乙基)氮杂二基)双(N-(2-氨基乙基)丙酰胺)、胍基苯甲酰胺、[3-(胍)丙基]、二甲基乙醇胺、1-(2,2-二甲基-1,3-二氧戊环-4-基)-N,N-二甲基甲胺、2-(2,2-二甲基-1,3-二氧戊环-4-基)-N,N-二甲基乙-1-胺、N-(2-((2-(2-氨基乙氧基)丙-2-基)氧基)乙基)乙酰胺、氨基丁基、氨基乙基、1-(2-氨基乙基)-3-(3-(二甲基氨基)丙基)-2-乙基胍、1-(3-氨基-3-氧代丙基)-2,4,6-三甲基吡啶-1-鎓、1-(1,3-双(羧氧基)丙-2-基)-2,4,6-三甲基吡啶-1-鎓、胍基乙基胺、醚羟基三唑和β-氨基酯。
在实施方案中,所述核苷酸用选自由以下的部分组成的组官能化:2-(2-(二甲基氨基)乙氧基)乙-1-醇、N-丁基-2-羟基乙酰胺、(1H-咪唑-5-基)甲醇、氨基((2-(2-羟基乙酰胺基)乙基)氨基)甲胺和1-(2-(2-羟基乙酰胺基)乙基)-2,4,6-三甲基吡啶-1-鎓。
在实施方案中,所述核苷酸连接部分是半胱氨酸。
在实施方案中,所述核酸纳米颗粒以受体非依赖性方式促进货物分子的内体逃逸。
在实施方案中,所述核酸纳米颗粒包含与细胞中的受体结合的组分。
在实施方案中,所述组分包含选自由叶酸、TfR-T12和血凝素肽组成的组中的一种。
在实施方案中,所述货物分子通过可在溶酶体中切割的接头连接至所述核酸纳米颗粒。
在实施方案中,所述货物分子连接至组织蛋白酶B可切割接头。
在实施方案中,所述货物分子连接至蛋白酶可切割接头。
在实施方案中,所述货物分子连接至焦磷酸二酯。
在实施方案中,本发明提供了用于合成2’-O取代的核苷的方法,该方法包括用基于醇的亲核试剂处理脱水尿苷。
在实施方案中,所述处理包括选自以下的碱:叔丁醇钡、氢氧化苄基三甲基铵、2-叔丁基亚氨基-2-二乙基氨基-1,3-二甲基-过氢-1,3,2-二氮杂膦、正丁基锂、仲丁基锂、叔丁基锂、
在实施方案中,所述处理包括选自以下的碱:溴化铝、氯化铝、异丙醇铝、三氯化硼(及其各种络合物)、三氟化硼(及其各种络合物)、二环己基硼、溴化铁(III)、氯化铁(III)、蒙脱石K10和K30、氯化锡(IV)、氯化钛(IV)、异丙醇钛(IV)、四氯化钛。
在实施方案中,本发明提供了包含货物分子和连接到所述货物分子的核酸纳米颗粒的组合物,其中所述核酸纳米颗粒被官能化以促进货物分子在受试者体内的生物活性。
在实施方案中,所述核酸纳米颗粒被官能化以促进内化到细胞中。
在实施方案中,所述货物分子被官能化以促进内化到细胞中。
在实施方案中,所述货物分子是锚定的胆固醇分子,其促进渗透穿过细胞的脂质双层。
在实施方案中,所述官能化促进通过以下内化到细胞中:网格蛋白介导的内吞作用、非网格蛋白/非胞膜小窝的内吞作用、胞膜小窝介导的内吞作用、被动扩散、简单扩散、易化扩散、转胞吞作用、巨胞饮作用、吞噬作用、受体介导的内吞作用、受体扩散、囊泡介导的转运、主动转运。
在实施方案中,所述核酸纳米颗粒可以通过内体、溶酶体、胞饮体或吞噬体进入细胞或被加工。
在实施方案中,所述核酸纳米颗粒可以穿过生物膜进入细胞。
在实施方案中,所述官能化可以在细胞质、细胞核、线粒体或其他细胞区室中起作用。
在实施方案中,所述货物分子选自由mRNA、gRNA/CRISPR、siRNA、ASO、miRNA、lnRNA、shRNA、核酶、适体、肽、蛋白质、抗体和治疗性小分子组成的组。
在实施方案中,所述细胞毒性核苷酸并入寡核苷酸骨架中。
在实施方案中,所述细胞毒性核苷酸选自芒霉素、奈普诺辛A、利巴韦林、吡唑霉素、阿糖胞苷(ara-C)、吉西他滨、克拉屈滨(2-CdA)、焦土霉素、艾西拉滨。
在实施方案中,磷酸盐前药被并入核酸骨架中。
在实施方案中,磷酸盐前药是9-[2-(膦酰基甲氧基)乙基]腺嘌呤的双(S-酰基-2-硫乙基)酯衍生物、cycloSal前核苷酸、HepDirect前药或十八烷氧基乙基-西多福韦。
在实施方案中,寡核苷酸组装成核酸纳米颗粒。
在实施方案中,本发明提供了包含第一货物分子和与所述第一货物分子连接的第二货物分子的组合物。
在实施方案中,所述第一货物分子具有生物学功能。
在实施方案中,所述第一货物分子选自由mRNA、gRNA/CRISPR、siRNA、ASO、miRNA、lnRNA、shRNA、核酶、适体、肽、蛋白质、抗体和治疗性小分子组成的组。
在实施方案中,所述第一货物分子是靶向细胞或组织的配体,其包含适体、凝集素、糖蛋白、脂质、抗体、纳米抗体或DARPIN。
在实施方案中,所述第一货物分子和所述第二货物分子中的至少一个包含通过单价、二价或三价支链接头连接的GalNAc或GalNAc衍生物。
在实施方案中,所述第一货物分子和所述第二货物分子中的至少一个包含胆固醇或其衍生物。
在实施方案中,所述第一货物分子和所述第二货物分子中的至少一个包含磷脂。
在实施方案中,所述第一货物分子和所述第二货物分子中的至少一个包含阳离子脂质,任选地包含季铵离子。
在实施方案中,所述第一货物分子和所述第二货物分子中的至少一个包含阴离子脂质,任选地包含磷酸酯基团。
在实施方案中,所述第一货物分子和所述第二货物分子中的至少一个包含可电离脂质。
在实施方案中,所述第一货物分子和所述第二货物分子中的至少一个包含支链脂质。
在实施方案中,所述第一货物分子通过可切割接头连接至所述第二货物分子。
在实施方案中,所述第一货物分子和所述第二货物分子是siRNA。
在实施方案中,所述第一货物分子和所述第二货物分子通过选自由(dT)n、(dA)n、d(C)n、d(G)n、(rU)n、(rA)n、(rC)n、(rG)n及其组合组成的组的寡核苷酸接头连接,其中n为1-16。
在实施方案中,所述第一货物分子和所述第二货物分子中的至少一个连接至第三货物分子。
在实施方案中,所述第一货物分子和所述第二货物分子中的至少一个通过包含二硫代双马来酰亚胺乙烷和1,4-双[3-(2-吡啶基二硫代)丙酰胺基]丁烷的硫醇可切割接头连接至所述第三货物分子。
在实施方案中,所述第一货物分子和所述第二货物分子中的至少一个通过包含乙二醇双(琥珀酰亚胺基琥珀酸酯)的羟胺可切割接头连接至所述第三货物分子。
在实施方案中,所述第一货物分子和所述第二货物分子中的至少一个通过包含双[2-(N-琥珀酰亚胺基-氧羰基氧基)乙基]砜的碱可切割接头连接至所述第三货物分子。
在实施方案中,所述第一货物分子和所述第二货物分子中的至少一个通过包含5-(双(甲硫基)亚甲基)-2,2-二甲基-1,3-二噁烷-4,6-二酮的米氏酸衍生物连接至所述第三货物分子。
在实施方案中,所述第一货物分子和所述第二货物分子中的至少一个通过共价键连接至所述第三货物分子。
在实施方案中,所述第一货物分子和所述第二货物分子中的至少一个通过切丁酶底物连接至所述第三货物分子。
在实施方案中,所述第一货物分子和所述第二货物分子中的至少一个通过选自以下的接头连接至所述第三货物分子:1,8-双马来酰亚胺-二乙二醇、1,11-双马来酰亚胺-三乙二醇、1,4-双马来酰亚胺丁烷、双马来酰亚胺己烷、双马来酰亚胺乙烷、三(2-马来酰亚胺乙基)胺)、N-α-马来酰亚胺乙酰-氧基琥珀酰亚胺酯、N-β-马来酰亚胺丙基-氧基琥珀酰亚胺酯、N-ε-马来酰亚胺己酸、N-γ-马来酰亚胺丁酰-氧基琥珀酰亚胺酯、琥珀酰亚胺基4-(N-马来酰亚胺甲基)环己烷-1-羧基-(6-氨基己酸酯)、琥珀酰亚胺基6-(3(2-吡啶基二硫基)丙酰氨基)己酸酯、间马来酰亚胺苯甲酰基-N-羟基琥珀酰亚胺酯、琥珀酰亚胺基碘乙酸酯、琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯、PEG化长链SMCC交联剂、琥珀酰亚胺基4-(对马来酰亚胺苯基)丁酸酯和磺基-NHS等效物)、对马来酰亚胺苯基异氰酸酯。
在实施方案中,所述第一货物分子和所述第二货物分子中的至少一个连接至纳米颗粒。
在实施方案中,本发明提供了包含至少两个货物分子和连接至至少两个货物分子中的每一个的核酸纳米颗粒的组合物。
在实施方案中,至少两个货物分子中的每一个都具有生物学功能。
在实施方案中,至少两个货物分子中的每一个选自由mRNA、gRNA/CRISPR、siRNA、ASO、miRNA、lnRNA、shRNA、核酶、适体、肽、蛋白质、抗体和治疗性小分子组成的组。
在实施方案中,至少两个货物分子中的多于一个缀合至同一核酸纳米颗粒。
在实施方案中,至少两个货物分子中的多于一个是不同的。
在实施方案中,多于一个货物分子是相同的。
在实施方案中,不同的货物分子以不等量缀合至纳米颗粒。
在实施方案中,至少两个货物分子通过稳定的共价键缀合。
在实施方案中,至少两个分子通过稳定的共价键缀合到刺激反应性接头。
在实施方案中,本发明提供了包含共价连接至一个或多个货物分子的寡核苷酸的组合物。
在实施方案中,所述寡核苷酸用允许缀合和缀合至核酸纳米颗粒的反应位点官能化。
在实施方案中,所述核酸纳米颗粒是三个或更多个连接处的三级结构,所述连接处由至少两条长度为3至200个核苷酸的寡核苷酸链形成,其中每条寡核苷酸链通过氢键或碱基堆积相互作用或两者与至少一条其他寡核苷酸链部分相互作用。
在实施方案中,每个核苷酸任选地包含修饰,所述修饰包括但不限于2’-O-甲基、2’-氟、2’-F-阿拉伯核酸、2’-O-甲氧基乙基、锁核酸、解锁核酸、4'-硫核糖核苷,4'-C-氨基甲基-2’-O-甲基、环己烯基核酸、己糖醇核酸、乙二醇核酸、硫代磷酸酯、硼烷磷酸酯、5’-C-甲基、5’(E)-乙烯基膦酸酯和2’硫尿苷。
在实施方案中,所述核酸纳米颗粒连接至货物分子,其中所述货物分子促进所述货物分子在受试者体内的生物活性。
在实施方案中,所述核酸纳米颗粒执行选自以下的至少一种生物活性:(i)结合血液中的血清蛋白,或细胞中或细胞表面的受体,(ii)以受体非依赖性方式促进以货物分子的内体逃逸,(iii)靶向动物或受试者中的组织,(iv)调节生物分布,(v)诱导或预防免疫反应,(vi)增强细胞摄取,(vii)调节基因表达,(viii)诱导细胞毒性,以及(ix)具有治疗效果,或其组合。
在实施方案中,一种或多种所述货物分子包含mRNA、gRNA/CRISPR、siRNA、shRNA、ASO、saRNA、miRNA、lnRNA、核酶、适体、肽、蛋白质、蛋白质结构域、抗体、抗体片段、抗体模拟物、凝集素、维生素、脂质、碳水化合物、苯甲酰胺和治疗性小分子中的至少一种,或其组合。
在实施方案中,所述官能化促进细胞内化,其中内化机制包括以下中的至少一种:网格蛋白介导的内吞作用、非网格蛋白/非胞膜小窝的内吞作用、胞膜小窝介导的内吞作用、被动扩散、简单扩散、易化扩散、转胞吞作用、巨胞饮作用、吞噬作用、受体介导的内吞作用、受体扩散、囊泡介导的转运和主动转运。
在实施方案中,所述核酸纳米颗粒与至少一个货物分子的连接可通过包括至少一个反应的方法获得,该反应包括至少一个以下特征:(i)反应在一锅中发生,(ii)反应不受水干扰,(iii)反应产生最少的副产物,以及(iv)反应包含提供单一反应产物的高热力学驱动力。
在实施方案中,连接反应包括:(i)通过包含至少一个上述特征的第一反应连接第一货物分子和(ii)通过包含至少一个上述特征的第二反应连接第二货物分子,其中所述第一反应和所述第二反应是正交的。
在实施方案中,寡核苷酸的5’、3’或内部位置(在核苷酸上的任何给定位置)被修饰有允许通过选自以下的反应形成共价键的官能团:CuAAC、SPAAC、RuAAC、IEDDA、SuFEx、SPANC、腙/肟醚形成、硫醇-烯自由基反应、硫醇-炔自由基反应、硫醇-迈克尔加成反应、硫醇-异氰酸酯反应、硫醇-环氧化物点击反应、亲核开环反应(弹簧加载反应)、无痕施陶丁格连接。这些连接(linkage)可以通过与用化学部分修饰的任何寡核苷酸或货物分子进行偶联反应而形成,所述化学部分来自但不限于由ADIBO-PEG4、N-[(1R,8S,9s)-双环[6.1.0]壬-4-炔-9-基甲氧基羰基]-1,8-二氨基-3,6-二氧杂辛烷、(1R,8S,9s)-双环[6.1.0]壬-4-炔-9-基甲醇、溴乙酰胺基-
在实施方案中,所述核酸纳米颗粒连接于第一货物分子、连接于第一货物分子的第二货物分子,以及任选地连接于所述第二货物分子或所述第一货物分子的其他货物分子。
在实施方案中,所述第一货物分子选自由mRNA、gRNA/CRISPR、siRNA、shRNA、ASO、saRNA、miRNA、lnRNA、核酶、适体、肽、蛋白质、蛋白质结构域、抗体、抗体片段、抗体模拟物、凝集素、维生素、脂质、碳水化合物、苯甲酰胺和治疗性小分子中的至少一种,或其组合组成的组。
在实施方案中,所述第一货物分子通过可切割接头连接至所述第二货物分子。
在实施方案中,所述第一货物分子和所述第二货物分子中的至少一个通过包含二硫代双马来酰亚胺乙烷和1,4-双[3-(2-吡啶基二硫代)丙酰胺基]丁烷的硫醇可切割接头、包含乙二醇双(琥珀酰亚胺基琥珀酸酯)的羟胺可切割接头、包含双[2-(N-琥珀酰亚胺基-氧羰基氧基)乙基]砜的碱可切割接头、或包含5-(双(甲硫基)亚甲基)-2,2-二甲基-1,3-二噁烷-4,6-二酮的米氏酸衍生物连接至第三货物分子。
在实施方案中,所述第一货物分子和所述第二货物分子中的至少一个通过切丁酶底物或易于切割的延伸核酸间隔区连接至第三货物分子,包括但不限于序列(T)k、(A)l、(G)m、(C)n及其组合,其中k、l、m和n是正整数。
在实施方案中,所述第一货物分子和所述第二货物分子中的至少一个通过选自以下的接头连接至第三货物分子:1,8-双马来酰亚胺-二乙二醇、1,11-双马来酰亚胺-三乙二醇、1,4-双马来酰亚胺丁烷、双马来酰亚胺己烷、双马来酰亚胺乙烷、三(2-马来酰亚胺乙基)胺)、N-α-马来酰亚胺乙酰-氧基琥珀酰亚胺酯、N-β-马来酰亚胺丙基-氧基琥珀酰亚胺酯、N-ε-马来酰亚胺己酸、N-γ-马来酰亚胺丁酰-氧基琥珀酰亚胺酯、琥珀酰亚胺基4-(N-马来酰亚胺甲基)环己烷-1-羧基-(6-氨基己酸酯)、琥珀酰亚胺基6-(3(2-吡啶基二硫基)丙酰氨基)己酸酯、间马来酰亚胺苯甲酰基-N-羟基琥珀酰亚胺酯、琥珀酰亚胺基碘乙酸酯、琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯、PEG化长链SMCC交联剂、琥珀酰亚胺基4-(对马来酰亚胺苯基)丁酸酯和磺基-NHS等效物)、和对马来酰亚胺苯基异氰酸酯。
在实施方案中,所述第二货物分子以聚合方式连接至任何给定数量的货物分子。
在实施方案中,所述第一货物分子通过选自以下的反应连接至所述核酸核酸纳米颗粒:CuAAC、SPAAC、RuAAC、IEDDA、SuFEx、SPANC、腙/肟醚形成、硫醇-烯自由基反应、硫醇-炔自由基反应、硫醇-迈克尔加成反应、硫醇-异氰酸酯反应、硫醇-环氧化物点击反应、亲核开环反应(弹簧加载反应)、无痕施陶丁格连接。这些连接(linkage)可以通过与用化学部分修饰的任何寡核苷酸或货物分子进行偶联反应而形成,所述化学部分来自但不限于ADIBO-PEG4、N-[(1R,8S,9s)-双环[6.1.0]壬-4-炔-9-基甲氧基羰基]-1,8-二氨基-3,6-二氧杂辛烷、(1R,8S,9s)-双环[6.1.0]壬-4-炔-9-基甲醇、溴乙酰胺基-
在实施方案中,至少两个货物分子中的每一个都具有生物学功能。
在实施方案中,本发明提供了包含共价连接至一个或多个货物分子的寡核苷酸的组合物。
在实施方案中,所述组合物包含寡核苷酸,所述寡核苷酸被允许缀合的反应位点官能化并组装成核酸纳米颗粒。
在实施方案中,所述核酸纳米颗粒连接于货物分子,其中所述核酸纳米颗粒被官能化以促进所述货物分子在受试者体内的生物活性。
在实施方案中,所述核酸纳米颗粒是三聚体、四聚体、五聚体或六聚体。
在实施方案中,本发明提供了包括通过至少一种反应将核酸纳米颗粒连接至至少一个货物分子的方法,所述反应包括以下特征中的至少一个:所述反应在一锅中发生,所述反应不受水干扰,所述反应产生最少的副产物,以及所述反应包含提供单一反应产物的高热力学驱动力。
在实施方案中,所述方法包括通过包含所述特征中的至少一个的第一反应连接第一货物分子以及通过包含所述特征中的至少一个的第二反应连接第二货物分子,其中所述第一反应和所述第二反应是正交的。
在实施方案中,所述第一反应包括对核酸纳米颗粒中至少一个寡核苷酸的链进行修饰。
在实施方案中,所述核酸纳米颗粒通过铜(I)叠氮化物-炔烃环加成连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过应变促进的叠氮化物-炔烃环加成连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过逆电子需求狄尔斯-阿尔德反应连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过二硫键连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过硫(VI)氟交换连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过腙形成连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过硫醇-烯自由基加成连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过硫醇-炔反应连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过硫醇-迈克尔加成连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过硫醇-异氰酸酯化学连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过硫醇-环氧化物化学连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过亲核开环反应连接至所述第一货物分子。
在实施方案中,所述核酸纳米颗粒通过无痕施陶丁格连接连接至所述第一货物分子。
在实施方案中,寡核苷酸的5’、3’或内部位置(在核苷酸上的任何给定位置)被修饰有允许形成通过这些方法概述的共价键的官能团。这些连接(linkage)可以通过与用化学部分修饰的任何寡核苷酸或货物分子进行偶联反应而形成,所述化学部分来自但不限于ADIBO-PEG4、N-[(1R,8S,9s)-双环[6.1.0]壬-4-炔-9-基甲氧基羰基]-1,8-二氨基-3,6-二氧杂辛烷、(1R,8S,9s)-双环[6.1.0]壬-4-炔-9-基甲醇、溴乙酰胺基-
在实施方案中,所述核酸纳米颗粒通过对刺激有反应的接头连接至所述第一货物。
在实施方案中,所述刺激选自由pH、光、温度、还原电位或氧浓度组成的组。
在实施方案中,所述核酸纳米颗粒是共价稳定的。
在实施方案中,本发明提供了包含与邻苯二甲醛复合以产生异吲哚的核酸的组合物。
在实施方案中,本发明提供了包含用胺和硫醇反应位点官能化的寡核苷酸和由这些官能化的寡核苷酸自组装的核酸纳米颗粒的组合物。
在实施方案中,胺和硫醇同时与邻苯二甲醛反应生成荧光异吲哚。
在实施方案中,荧光部分与额外的荧光团缀合。
在实施方案中,所述核酸纳米颗粒通过正交点击化学与货物缀合,如权利要求7所述。
在实施方案中,本发明提供了包含核酸纳米颗粒的组合物,所述核酸纳米颗粒包含核酸双链体,所述核酸双链体包含与外部试剂复合以形成荧光团的反应性部分。
在实施方案中,胺和硫醇同时与邻苯二甲醛反应,其中荧光团是荧光异吲哚。
在实施方案中,荧光团与另外的荧光团缀合。
在实施方案中,所述核酸纳米颗粒通过正交点击化学与货物分子缀合。
在实施方案中,所述核酸纳米颗粒包含含有疏水部分、亲水部分和核苷酸连接部分的组分。
在实施方案中,所述疏水部分和所述亲水部分共价连接至所述核酸纳米颗粒。
在实施方案中,所述疏水部分和所述亲水部分通过酰胺、胺或醚键共价连接至核酸。
在实施方案中,所述亲水部分包含胺。
在实施方案中,所述亲水部分选自由精胺、乙二胺、甲基乙二胺、乙基乙二胺、咪唑、精胺-咪唑-4-亚胺、N-乙基-N'-(3-二甲基氨基丙基)-胍基亚乙基亚胺、丙烯酸二甲基氨基乙酯、氨基乙烯基醚、4-咪唑乙酸、二乙基氨基丙基酰胺、磺胺类药物(例如磺胺二甲氧嘧啶磺胺甲噁唑、磺胺嘧啶、磺胺二甲嘧啶)、氨基缩酮、N-2-羟丙基三甲基氯化铵、咪唑-4-亚胺、甲基-咪唑、2-(氨基甲基)咪唑、4-(氨基甲基)咪唑、4(5)-(羟甲基)咪唑、N-(2-氨基乙基)-3-((2-氨基乙基)(甲基)氨基)丙酰胺、2-(2-乙氧基乙氧基)乙-1-胺、双(3-氨基丙基)胺、[N,N-二甲基氨基)乙氧基]乙基、N-(2-氨基乙基)-3-((2-氨基乙基)(乙基)氨基)丙酰胺、(N-(氨基乙基)氨基甲酰基)甲基、N-(2-((2-氨基乙基)氨基)乙基)乙酰胺、3,3’-((2-氨基乙基)氮杂二基)双(N-(2-氨基乙基)丙酰胺)、胍基苯甲酰胺、[3-(胍)丙基]、二甲基乙醇胺、1-(2,2-二甲基-1,3-二氧戊环-4-基)-N,N-二甲基甲胺、2-(2,2-二甲基-1,3-二氧戊环-4-基)-N,N-二甲基乙-1-胺、N-(2-((2-(2-氨基乙氧基)丙-2-基)氧基)乙基)乙酰胺、氨基丁基、氨基乙基、1-(2-氨基乙基)-3-(3-(二甲基氨基)丙基)-2-乙基胍、1-(3-氨基-3-氧代丙基)-2,4,6-三甲基吡啶-1-鎓、1-(1,3-双(羧氧基)丙-2-基)-2,4,6-三甲基吡啶-1-鎓、胍基乙基胺、醚羟基三唑和β-氨基酯组成的组。
在实施方案中,所述核苷酸用选自以下的部分官能化:2-(2-(二甲基氨基)乙氧基)乙-1-醇、N-丁基-2-羟基乙酰胺、(1H-咪唑-5-基)甲醇、氨基((2-(2-羟基乙酰胺基)乙基)氨基)甲胺和1-(2-(2-羟基乙酰胺基)乙基)-2,4,6-三甲基吡啶-1-鎓。
在实施方案中,所述核苷酸连接部分是半胱氨酸。
在实施方案中,所述核酸纳米颗粒以受体非依赖性方式促进所述货物分子的内体逃逸。
在实施方案中,所述核酸纳米颗粒包含与细胞中的受体结合的组分。
在实施方案中,所述组分包含选自由叶酸、TfR-T12和血凝素肽组成的组中的一种。
在实施方案中,所述货物分子通过可在溶酶体中切割的接头连接至所述核酸纳米颗粒。
在实施方案中,所述货物分子连接至组织蛋白酶B可切割接头。
在实施方案中,所述货物分子连接至蛋白酶可切割接头。
在实施方案中,所述货物分子连接至焦磷酸二酯。
在实施方案中,本发明提供了用于合成2’-O取代的核苷的方法,所述方法包括用基于醇的亲核试剂处理脱水尿苷。
在实施方案中,所述处理包括选自以下的碱:叔丁醇钡、氢氧化苄基三甲基铵、2-叔丁基亚氨基-2-二乙基氨基-1,3-二甲基-过氢-1,3,2-二氮杂膦、正丁基锂、仲丁基锂、叔丁基锂、
在实施方案中,所述处理包括选自以下的碱:溴化铝、氯化铝、异丙醇铝、三氯化硼(及其各种络合物)、三氟化硼(及其各种络合物)、二环己基硼、溴化铁(III)、氯化铁(III)、蒙脱石K10和K30、氯化锡(IV)、氯化钛(IV)、异丙醇钛(IV)、四氯化钛。
在实施方案中,本发明提供了包含货物分子和连接到所述货物分子的核酸纳米颗粒的组合物,其中所述核酸纳米颗粒被官能化以促进所述货物分子在受试者体内的生物活性。
在实施方案中,所述核酸纳米颗粒被官能化以促进内化到细胞中。
在实施方案中,所述货物分子被官能化以促进内化到细胞中。
在实施方案中,所述货物分子是锚定的胆固醇分子,其促进渗透穿过细胞的脂质双层。
在实施方案中,所述官能化促进通过以下内化到细胞中:网格蛋白介导的内吞作用、非网格蛋白/非胞膜小窝的内吞作用、胞膜小窝介导的内吞作用、被动扩散、简单扩散、易化扩散、转胞吞作用、巨胞饮作用、吞噬作用、受体介导的内吞作用、受体扩散、囊泡介导的转运、主动转运。
在实施方案中,所述核酸纳米颗粒可以通过内体、溶酶体、胞饮体或吞噬体进入细胞或被加工。
在实施方案中,所述核酸纳米颗粒可以穿过生物膜进入细胞。
在实施方案中,所述官能化可在细胞质、细胞核、线粒体或其他细胞区室中起作用。
在实施方案中,所述货物分子选自由mRNA、gRNA/CRISPR、siRNA、ASO、miRNA、lnRNA、shRNA、核酶、适体、肽、蛋白质、抗体和治疗性小分子组成的组。
在实施方案中,所述细胞毒性核苷酸并入寡核苷酸骨架中。
在实施方案中,所述细胞毒性核苷酸选自芒霉素、奈普诺辛A、利巴韦林、吡唑霉素、阿糖胞苷(ara-C)、吉西他滨、克拉屈滨(2-CdA)、焦土霉素、艾西拉滨。
在实施方案中,磷酸盐前药被并入核酸骨架中。
在实施方案中,所述磷酸盐前药是9-[2-(膦酰基甲氧基)乙基]腺嘌呤的双(S-酰基-2-硫乙基)酯衍生物、cycloSal前核苷酸、HepDirect前药或十八烷氧基乙基-西多福韦。
在实施方案中,所述寡核苷酸组装成核酸纳米颗粒。
在实施方案中,本发明提供了包含两个或更多个共价连接的货物分子的组合物。
在实施方案中,所述货物分子的链具有以下通式
其中C1和C2为货物分子,r为作为生物正交反应产物形成的生物缀合连接(linkage),L为直链接头或支链接头,k为0或1,m为1或任何大于1的正整数,n为1或任何大于1的正整数,并且对于任何m>1,或n>1,或m>1且n>1,以下适用:(i)每个r是相同的或为至少两个不同的生物缀合连接的混合物,(ii)每个L是相同的或为至少两个不同的接头分子的混合物;以及(iii)每个C2是相同的或为至少两个不同的货物分子的混合物。
在实施方案中,所述货物分子中的至少一个具有生物学功能。
在实施方案中,一个或多个货物分子为核酸、肽、蛋白质、脂质、碳水化合物、生物碱、聚酮化合物、四吡咯、萜烯/萜类、苯丙烷类、药物化合物或其组合。
在实施方案中,所述货物分子中的至少一个为mRNA、gRNA/CRISPR、siRNA、ASO、saRNA、miRNA、lnRNA,、shRNA、核酶、适体、肽、蛋白质、蛋白质结构域、抗体、抗体片段、抗体模拟物、凝集素、脂质、维生素、苯甲酰胺、小分子或其组合。
在实施方案中,所述货物分子中的至少两个为通过寡核苷酸间隔区连接的siRNA,所述寡核苷酸间隔区选自(dT)n、(dA)n、d(C)n、d(G)n、(rU)n、(rA)n、(rC)n、(rG)n或其组合,其中n为1至50的任何正整数。
在实施方案中,两个或更多个siRNA以5’到5’、3’到3’或5’到3’的方向彼此连接。
在实施方案中,所述货物分子中的至少一个靶向由肝细胞表达的去唾液酸糖蛋白受体,其中一个或多个靶向部分包含通过单价、二价或三价支链接头连接的N-乙酰半乳糖胺或N-乙酰半乳糖胺衍生物。
在实施方案中,至少一个N-乙酰半乳糖胺部分在固相合成期间或合成后连接至寡核苷酸货物分子,其中连接发生在所述寡核苷酸货物分子的5’末端、3’末端或一个或多个连续的内部位置。
在实施方案中,所述货物分子中的一个或多个包含以下脂质中的至少一种:(i)胆固醇或其衍生物,(ii)磷脂,(iii)阳离子脂质,任选地包含季铵离子,(iv)阴离子脂质,任选包含磷酸基团,(v)可电离脂质,以及(vi)支链脂质。
在实施方案中,所述货物分子中的至少一个通过可切割接头连接至另一货物分子。
在实施方案中,所述货物分子中的至少一个通过包含二硫代双马来酰亚胺乙烷和1,4-双[3-(2-吡啶基二硫代)丙酰胺基]丁烷的硫醇可切割接头连接至另一货物分子。
在实施方案中,所述货物分子中的至少一个通过包含乙二醇双(琥珀酰亚胺基琥珀酸酯)的羟胺可切割接头连接至另一货物分子。
在实施方案中,所述货物分子中的至少一个通过包含双[2-(N-琥珀酰亚胺基-氧羰基氧基)乙基]砜的碱可切割接头连接至另一货物分子。
在实施方案中,所述货物分子中的至少一个通过包含5-(双(甲硫基)亚甲基)-2,2-二甲基-1,3-二噁烷-4,6-二酮的米氏酸衍生物连接至另一货物分子。
在实施方案中,所述货物分子中的至少一个通过共价键连接至另一货物分子。
在实施方案中,所述货物分子中的至少一个通过切丁酶底物连接至另一货物分子。
在实施方案中,所述货物分子中的至少一个通过选自以下的接头连接至另一货物分子:1,8-双马来酰亚胺-二乙二醇、1,11-双马来酰亚胺-三乙二醇、1,4-双马来酰亚胺丁烷、双马来酰亚胺己烷、双马来酰亚胺乙烷、三(2-马来酰亚胺乙基)胺)、N-α-马来酰亚胺乙酰-氧基琥珀酰亚胺酯、N-β-马来酰亚胺丙基-氧基琥珀酰亚胺酯、N-ε-马来酰亚胺己酸、N-γ-马来酰亚胺丁酰-氧基琥珀酰亚胺酯、琥珀酰亚胺基4-(N-马来酰亚胺甲基)环己烷-1-羧基-(6-氨基己酸酯)、琥珀酰亚胺基6-(3(2-吡啶基二硫基)丙酰氨基)己酸酯、间马来酰亚胺苯甲酰基-N-羟基琥珀酰亚胺酯、琥珀酰亚胺基碘乙酸酯、琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯、PEG化长链SMCC交联剂、琥珀酰亚胺基4-(对马来酰亚胺苯基)丁酸酯和磺基-NHS等效物)、对马来酰亚胺苯基异氰酸酯。
在实施方案中,所述货物分子中的至少一个通过选自以下的反应连接至另一货物分子:CuAAC、SPAAC、RuAAC、IEDDA、SuFEx、SPANC、腙/肟醚形成、硫醇-烯自由基反应、硫醇-炔自由基反应、硫醇-迈克尔加成反应、硫醇-异氰酸酯反应、硫醇-环氧化物点击反应、亲核开环反应(弹簧加载反应)、无痕施陶丁格连接。这些连接(linkage)可以通过与用化学部分修饰的任何货物分子进行偶联反应而形成,所述化学部分来自但不限于ADIBO-PEG4、N-[(1R,8S,9s)-双环[6.1.0]壬-4-炔-9-基甲氧基羰基]-1,8-二氨基-3,6-二氧杂辛烷、(1R,8S,9s)-双环[6.1.0]壬-4-炔-9-基甲醇、溴乙酰胺基-
在实施方案中,所述货物分子的链与核酸纳米颗粒缀合,其中所述缀合物具有以下通式结构
其中P为RNA纳米颗粒,r为作为生物正交反应产物形成的生物缀合连接(linkage),L1和L2为直链接头分子或支链接头分子,j为0或1,C1和C2为货物分子,k为1或任何大于1的正整数,l为0或1,m为1或任何大于1的正整数,n为1或任何大于1的正整数,q为1或任何大于1的正整数,并且对于任何k>1或m>1或n>1或q>1或其组合,以下适用:(i)r是相同的或为至少两个不同的生物缀合连接(linkage)的混合物,(ii)L1是相同的或为至少两个不同的接头分子的混合物,(iii)L2是相同的或为至少两个不同的接头分子的混合物,(iv)L1和L2是相同或不同的接头分子,(v)C1是相同的或为至少两个不同的货物分子的混合物,(vi)C2是相同的或为至少两个不同的货物分子的混合物,以及(vii)C1和C2是相同或不同的接头分子。
在实施方案中,本发明提供了包含至少两个货物分子和连接到至少两个货物分子中的每一个的核酸纳米颗粒的组合物。
在实施方案中,至少两个货物分子中的每一个都具有生物学功能。
在实施方案中,至少两个货物分子中的每一个选自由mRNA、gRNA/CRISPR、siRNA、ASO、miRNA、lnRNA、shRNA、核酶、适体、肽、蛋白质、抗体和治疗性小分子组成的组。
在实施方案中,至少两个货物分子中的多于一个缀合至同一核酸纳米颗粒。
在实施方案中,至少两个货物分子中的多于一个是不同的。
在实施方案中,多于一个货物分子是相同的。
在实施方案中,不同的货物分子以不等量缀合至纳米颗粒。
在实施方案中,至少两个货物分子通过稳定的共价键缀合。
在实施方案中,至少两个分子通过稳定的共价键缀合到刺激反应性接头。
在实施方案中,所述货物分子中的至少一个通过选自以下的反应连接至另一货物分子:CuAAC、SPAAC、RuAAC、IEDDA、SuFEx、SPANC、腙/肟醚形成、硫醇-烯自由基反应、硫醇-炔自由基反应、硫醇-迈克尔加成反应、硫醇-异氰酸酯反应、硫醇-环氧化物点击反应、亲核开环反应(弹簧加载反应)、无痕施陶丁格连接。这些连接(linkage)可以通过与用化学部分修饰的任何货物分子进行偶联反应而形成,所述化学部分来自但不限于ADIBO-PEG4、N-[(1R,8S,9s)-双环[6.1.0]壬-4-炔-9-基甲氧基羰基]-1,8-二氨基-3,6-二氧杂辛烷、(1R,8S,9s)-双环[6.1.0]壬-4-炔-9-基甲醇、溴乙酰胺基-
实施例
实施例1-分子命名法
表2提供了用于本发明的构建体的命名格式。表4和表5提供了用于形成RNA纳米颗粒的示例性RNA单体的序列和每个RNA单体的官能团。表6概述了本发明中使用的肽。
表2.
本发明中涵盖的RNA链描述在表3中。
表3-构建体链
/>
/>
本发明中涵盖的siRNA链描述在表4中。
表4-siRNA链
/>
表5.适体链
/>
本文所用的肽描述在表6中。
表6-本发明中使用的肽
实施例2-RNA合成
使用H-16合成仪(K&A)合成RNA链。合成是在DMT-OFF模式下在1μmol柱上进行的,使用标准RNA偶联方案(720s用于2’-叔丁基二甲基甲硅烷基(TBDSM)-保护的酰胺和所有其他修饰。酰胺、四唑和乙腈的溶液在活化分子筛
将粗RNA链通过IEX-HPLC或IP-RP HPLC纯化。IEX使用半制备型DNAPac PA100(ThermoFisher)用22x250mm柱在75℃下以4.5mL/min的流速和260nm的UV检测进行。通常,每次运行注入100-250μL粗RNA溶液。在2至2.5个柱体积内以约Δ10%B的线性梯度进行洗脱,并将起始浓度调整为寡核苷酸的长度。缓冲液A:25mM Tris·HCl,pH 8.0,20%乙腈,10mM高氯酸钠;缓冲液B:25mM Tris·HCl,pH 8.0,20%乙腈,600mM高氯酸钠。
RP-HPLC使用Hypersil Gold(ThermoFisher)C18柱(10x150mm)在60℃下以5mL/min的流速和260nm的UV检测进行。通常,每次运行注入100-250μL粗RNA溶液。缓冲液A:TEAA(0.1M,pH=7);缓冲液B:MeCN。合并包含RNA的级分并在真空中除去乙腈。然后用Gel-Pak脱盐柱(Glen)将纯化的寡核苷酸脱盐。蒸发溶液,将RNA溶解在无核酸酶的水中,用于通过UV吸光度测定浓度,并通过变性PAGE评估质量。
适应修饰链的合成程序
5’氨基-将10%DEA的MeCN溶液施加到仍在CPG上的寡核苷酸上。处理5分钟后,用MeCN洗涤柱并进一步处理。
5’Cy3-在RPC MMT-ON纯化过程中去除了包含Cy3的序列5’-端的MMTr基团。
实施例3-优化的组装方案
这项工作中的关键支架方形SQ1是根据标准方案组装的。将等摩尔量的5种不同链(A、B、C、D、E-图22;这些对应于C-1.0、C-2.0、C-3.0、C-4.0和C-5.0和亚变体)组合在PBS+MgCl
图22是概述本发明一个实施方案中组合物的核心支架的示意图(SQ-0000-001)。
对于PAGE,将组装的支架在1X TBMg(890mM Tris Borate+20mM Mg(OAc)
对于DLS,使用Malvern Zetasizer Nano S ZEN 1600 Nano Particle SizeAnalysis分析组装的支架-使用20μL样品,并记录强度。计算三个试验的平均值。所有测量均在25℃下进行。分析前将样品以12000rpm离心5分钟,以去除灰尘和碎屑。
实施例4-修饰剂的合成以实现缀合化学
一般实验
在400MHz下记录
伦敦帝国理工学院记录了低分辨率和高分辨率质谱(EI、CI、FAB)。帝国理工学院化学质谱服务部使用Micromass Platform II和Micromass AutoSpec-Q光谱仪进行测量。
在BDH硅胶60上进行快速柱色谱,粒径为0.040–0.063mm。薄层色谱法(TLC)在预涂铝背板或玻璃背板(Merck Kieselgel 60 F254)上进行,并用紫外光(254nm)或高锰酸钾(KMnO
5’C6S-S降冰片烯修饰剂
图23是根据本发明的一个实施方案的二硫化物-降冰片烯5’修饰剂的合成示意图。
6,6'-二硫二基双(己-1-醇)
合成根据Varenikov及其同事概述的程序进行(A.Varenikov,M.Gandelman,Organotitanium Nucleophiles inAsymmetric Cross-Coupling Reaction:Stereoconvergent Synthesis of Chiralα-CF 3Thioethers,J.Am.Chem.Soc.141(2019)10994–10999.https://doi.org/10.1021/jacs.9b05671.)。获得了无色油状物(18.2g,92%)。
6-((6-羟基己基)二硫基)己基双环[2.2.1]庚-5-烯-2-羧酸酯
根据本领域(US2011/263526)中发现的改进程序合成。在0℃下经过5分钟将DCC溶液(1.15g在5mL无水DCM中,5.61mmol)滴加到5-降冰片烯-2-羧酸(500mg,3.62mmol)、6,6'-二硫二基双(己-1-醇)(1.93g,7.25mmol)和DMAP(89mg,0.72mmol)在无水DCM(20mL)中的搅拌溶液中。然后将反应混合物在0℃下搅拌3小时。完成后(TLC:25%EtOAc/戊烷),过滤反应混合物。然后用水(3×20mL)和盐水(3×20mL)洗涤滤液。然后将有机层干燥(MgSO
6-((6-(((2-氰基乙氧基)(二异丙基氨基)磷基)氧基)己基)二硫基)己基双环[2.2.1]庚-5-烯-2-羧酸酯
将6-((6-羟基己基)二硫基)己基双环[2.2.1]庚-5-烯-2-羧酸酯(496mg,0.87mmol)和N,N-二异丙基乙胺(451mg,609μL,3.49mmol)溶解在无水DCM(15mL)中并在活化分子筛上在0℃下搅拌1小时。加入2-氰乙基N,N-二异丙基氯代亚磷酰胺(413mg,1.74mmol),并将反应混合物在0℃下搅拌30分钟,然后经过1.5小时内缓慢升温至室温。完成后(TLC:25%EtOAc/戊烷),将反应混合物用饱和NaHCO
5’降冰片烯修饰剂
双环[2.2.1]庚-5-烯-2-基甲基(2-氰乙基)二异丙基亚磷酰胺
根据Schoch及其同事概述的程序合成。(J.Schoch,M.Wiessler,A.
4-(2-叠氮基乙基)-1H-咪唑
根据Yang及其同事概述的程序合成。(ALuo.ng,T.Issarapanichkit,S.D.Kong,R.Fong and J.Yang pH-Sensitive,N-ethoxybenzylimidazole(NEBI)bifunctionalcrosslinkers enable triggered release of therapeutics from drug deliverycarriers,Org.Biomol.Chem.,2010,8,5105–5109,doi.org/10.1039/C0OB00228C)。获得浅棕色油状物(360mg,95%)。
叠氮胍
(4-叠氮基丁基)氨基甲酸叔丁酯
根据Ramos及其同事概述的程序合成。(R.Swider,M.
1-(4-叠氮基丁基)胍
将(4-叠氮基丁基)氨基甲酸叔丁酯(360mg,1.0mmol)溶解在DCM/TFA(9:1,16.6mL)中并在室温下搅拌过夜。蒸发有机溶剂,再溶解在DCM(10mL)中,用K
将一半量的粗混合物(186mg,1.0当量,1.61mmol)溶解在DCM(15.5mL)中,然后溶解N,N'-双(苄氧基羰基)-1H-吡唑-1-甲脒(561mg,1.1当量,1.7nmol)、TEA(0.6mL)。将反应混合物在室温下搅拌过夜。将DCM(15mL)添加到反应混合物中,随后用水(2×15mL)、饱和NaHCO
实施例5-使用基于NHS酯的接头对胺修饰链进行5’修饰
为了安装适当的反应基团以实现缀合化学,5’氨基修饰的RNA链用包含其的异双功能NHS接头处理。
图24是概述用于用NHS-酯接头修饰5’氨基修饰的RNA的程序的示意图。修饰包括四嗪、叠氮化物和二苯并环辛炔(DBCO)。
一般偶联程序
将氨基修饰的寡核苷酸制备成储备溶液或干等分试样。将异双功能NHS-酯(NHS-SM)以100mM的浓度溶解在无水DMSO中。
将氨基修饰的寡核苷酸稀释至终浓度为100-200μM,然后加入DMSO(50%总体积)、碳酸氢盐缓冲液(0.5M,pH=8.4,20%总体积)和NHS-SM(5-20当量)。将反应混合物在30℃搅拌1-3小时,然后通过RP-HPLC纯化。对于更高的体积,建议在H
用于四嗪NHS的改进的偶联程序
将氨基修饰的寡核苷酸制备成储备溶液或干等分试样。将异双功能NHS-酯(NHS-SM)以100mM的浓度溶解在无水DMF中。
将氨基修饰的寡核苷酸稀释至100-200μM的最终浓度,然后稀释氯化钠/碳酸氢盐缓冲液(100mM NaCl,0.05M,pH=8.4)和NHS-四嗪(5-20当量)。将反应混合物在30℃搅拌1小时,然后通过RP-HPLC纯化。对于更高的体积,建议在H
图25显示了5’氨基修饰的RNA与NHS-PEG-DBCO反应的RP-HPLC迹线。上图显示了整个迹线C-4.2,下图显示了13min时的峰,其中包含产物C-4.3。
图26显示了5’氨基修饰的siRNA的制备型RP-HPLC迹线。顶部图显示起始材料S-1.2,第二图显示经NHS-PEG5-四嗪处理的材料,第三图显示经NHS-PEG4-叠氮化物处理的材料,底部图显示经NHS-Cy7处理的材料。
实施例6-siRNA和适体与RNA的IEDDA和SPAAC缀合
IEDDA点击程序的实例
降冰片烯修饰的核心链C-4.4(5nmol,1.0当量,50uM最终浓度)与通过四嗪-NHS官能化的siRNA(S-1.5,15nmol,3.0当量)在PBS缓冲液中混合。将反应混合物在室温下搅拌12小时,然后使用Hypersil Gold C18预制柱以5mL/min的流速通过反相HPLC进行纯化。在20分钟内5%至25%B(A:0.1M TEAA缓冲液pH 7,B:MeCN),将包含产物的级分浓缩和脱盐,得到44%的分离产率。
SPAAC点击程序的实例
将DBCO修饰的核心链(C-4.3、1nmol、1.0当量、50uM最终浓度)与叠氮化物官能化的siRNA S-1.6(2nmol,2.0当量)在PBS缓冲液中混合。将反应混合物在室温搅拌24小时,然后进行直接PAGE分析。
组装的NA纳米颗粒上的IEDDA
根据标准组装方案组装NA纳米颗粒(SQ1-0000-005),以提供浓度为10μM的构造体,其中一条链(C-4.4)在5’位置具有反应性降冰片烯部分。然后在PBS中分别用1、2和4摩尔当量的四嗪标记的siRNA S-1.5处理。将所得溶液在30℃下搅拌,然后通过8%天然PAGE进行直接分析(图35)。
图27显示了RNA链的分析性RP-HPLC迹线。顶部图显示未修饰的链C-4.0,中间图是用降冰片烯修饰的类似链C-4.4,底部图显示用四嗪修饰的类似链C-4.3。
图28显示了5’降冰片烯修饰的C-4.4RNA与5’四嗪修饰的siRNA S-1.5(1:1摩尔当量)偶联后的时程实验的重叠分析RP-HPLC迹线。
图29显示了5’降冰片烯修饰的RNAC-4.4与5’四嗪修饰的siRNA S-1.5(1:2摩尔当量)偶联后的时程实验的重叠分析RP-HPLC。
图30显示了5’降冰片烯修饰的RNAC-4.4与5’四嗪修饰的siRNA S-1.5(1:4摩尔当量)偶联后的时程实验的重叠分析RP-HPLC迹线。
图31显示了5’降冰片烯修饰的RNA C-4.4与5’四嗪修饰的适体A-1.3偶联的分析RP-HPLC迹线。顶部图显示了四嗪修饰的适体到14.2min的基线,中间图显示了IEDDA缀合物到12.2min的迹线,底部图显示了5’降冰片烯修饰RNA到11.5min的迹线。
图32显示了显示IEDDA偶联链(NA纳米颗粒核心链C-4.4+siRNA S-1.5)的纯化的HPLC迹线,相应的PAGE(15%变性,250V)显示纯化级分。
图33显示了18%MOPS PAGE(150V,2.5h,凝胶红色染色),显示退火的siRNA有义链和反义链。有义链通过IEDDA(C-4.4+S-1.5)与核心NA纳米颗粒链结合。泳道1,核心链-IEDDA-有义链(C-4.4+S-1.5);泳道2,反义链(S-2.1);泳道3,退火产物(C-4.4+S-1.5+S-2.1);泳道4,低范围ssRNA梯状物。
图34显示了15%变性PAGE(250V,1h,凝胶红色染色),显示在30℃使用1:1摩尔当量的核心:适体通过IEDDA使核心NA纳米颗粒链C-4.4与适体A-1.3缀合。左侧图显示6小时反应时间后的PAGE,右图显示12小时反应时间后的PAGE。泳道1,核心NA纳米颗粒链C-4.4;泳道2,适体A-1.3;泳道3,IEDDA反应混合物;泳道L,低范围ssRNA梯状物。
图35显示了非变性PAGE(8%,150V,1h),显示具有完全组装的NA纳米颗粒(SQ1-0000-005)的代表性IEDDA缀合。泳道1,起始材料;泳道2,1摩尔当量siRNA(S-1.5);泳道3,2摩尔当量siRNA(S-1.5);泳道4,4摩尔当量siRNA(S-1.5)。
图36显示了核心链C-4.3与叠氮化物官能化的siRNA S-1.6的SPAAC缀合的变性PAGE(15%,250V,1h)。
图37显示了C-5.3的Cy7-NHS标记以形成C-5.2(302nm GelRed/Cy7通道)的变性PAGE(15%,250V,1h)。
实施例7-5’修饰的RNA上的CuAAC
叠氮化铜-炔烃环加成(CuAAC)根据两种方案进行;(1)对于20μl反应,向预先用N
实施例8-内部修饰RNA上的CuAAC
在内部位置(C-5.4、C-5.5)用炔丙基修饰的RNA上尝试CuAAC。
内部点击修饰的一般程序
用20μL炔烃修饰的RNA(100μM在TEAA2M中,pH=7.0)、4μL七乙二醇(5mM,在DMSO中)、20μL抗坏血酸钠(10mM在TEAA2M中,pH=7.0)以及Cu
图38显示了点击链(PEG和胆固醇在一个位置(链C-5.4)或八个位置(链C-5.5))的变性凝胶(15%,250V,1h)。转移表明产物与一个或多个胆固醇单元偶联。泳道1,链C-5.4(未缀合,起始材料);泳道2,链C-5.4*胆固醇点击(C18纯化);泳道3,C-5.4链*胆固醇点击(EtOH沉淀);泳道4,链C-5.4*PEG7-点击(C18纯化);泳道5,链C-5.4*PEG7-点击(EtOH沉淀);泳道6,链C-5.5(未缀合,起始材料);泳道7,C-5.5链*胆固醇点击(C18纯化);泳道8,C-5.5链*胆固醇点击(EtOH沉淀);泳道9,链C-5.5*PEG7点击(C18纯化);以及泳道10,链C-5.5*PEG7点击(EtOH沉淀)。
图39显示了变性PAGE(15%,250V,1h),显示纳米颗粒核心链C-1.1用5’-硫醇修饰的siRNA有义链S-1.1通过可逆二硫化物交联官能化。泳道M,低范围ssRNA阶梯(NEB,#N0364S);泳道cr,粗偶联混合物;泳道1-6,级分1-6,在粗偶联混合物的IEX-HPLC纯化后获得。
实施例9-通过二硫键形成的含硫醇RNA的液相缀合
通过二硫键形成将siRNA分子连接于核心构建体。将含硫醇的RNA有义链(S-1.1)和核心链(C-1.1或C-4.1)与DTT(4mg DTT每20A260单位/mLRNA,总体积为250uL)混合,用三乙胺将溶液的pH调节至pH>8,并且在室温下进行还原30分钟至2.5小时。用Gel-Pak脱盐柱(Glen)对还原的RNA进行脱盐,脱盐级分中的RNA浓度通过纳米滴上的紫外线吸光度来确定。随后,将偶联配偶体(siRNA有义链和核心链)混合在一起,使得其中一条链(优选siRNA有义链)以2-5倍摩尔过量使用。将相当于最终体积10%的1M KCO
实施例10-肽合成和连接
固相肽合成-示例程序
制备以下溶液:脱保护溶液:DMF中的20%哌啶;活化剂溶液:DMF中的0.25M HATU;碱性溶液:DMF(5.54mL)中的2,6-二甲基吡啶(2.05mL)+DIPEA(1.96mL);封端溶液:DMF(18mL)中的Ac
将预加载的基于氨基的树脂(如上所述)(50mg)在DMF(3mL)中在室温下溶胀30分钟。然后排干DMF并将树脂浸入DMF中的20%哌啶中(重复该步骤)。然后将树脂用DMF(3x3mL)、DCM(3x3mL)洗涤,然后再次用DMF(3x3mL)洗涤。在单独的容器中,将期望的氨基酸溶液(1.29mL)、HATU(452μL,4.5当量)和碱溶液(110μL)混合,然后添加到树脂中。然后将所得悬浮液在室温下搅拌30分钟,冲洗注射器并重复偶联步骤。用Kaiser测试监测偶联成功。成功偶联后,用DMF(3x3mL)、DCM(3x3mL)和DMF(3x3mL)洗涤树脂。然后将树脂浸入封端溶液(见上文)中5分钟。冲洗注射器并用DMF(3x3mL)、DCM(3x3mL)和DMF(3x3mL)洗涤树脂。然后重复该过程(从脱保护步骤开始),直到获得期望序列。
通过将树脂浸没在TFA/苯酚/水/TIPS(88/5/5/2)的混合物中并搅拌3小时,然后逐滴沉淀到冰冷的乙醚中,实现从树脂上的切割。然后将所得沉淀物溶解在乙酸中并冻干,得到期望的肽,为乙酸盐。
纯化
在配备RESOURCE
使用15分钟内0-100%B的梯度,然后使用100%B 5分钟。
合成肽的质量分析
表7中描述了本文使用的肽。
表7.
图40显示了马来酰亚胺修饰的GFWFG在15分钟内的0至100%B(A=H2O+0.1%TFA;B=MeCN+0.1%TFA)中的RPHPLC迹线。
图41在左图中显示了硫醇-RNAC-2.1相对于相同链的肽缀合的RNA的变性PAGE,在右图中显示了缀合反应混合物的粗RPHPLC迹线。30分钟处的峰对应于硫醇RNA。50分钟处的峰是肽-RNA产物。
实施例11-马来酰亚胺官能化的肽与含硫醇的RNA的液相缀合
示例程序
将冻干的寡核苷酸C-2.1(234nmol)溶解在水(1mL)中并分到两个独立的小瓶中。向每个小瓶中加入Et
实施例12-FlICk化学
为了通过FlICk化学成功实现RNA-货物缀合,需要两种关键的官能团:邻苯二甲醛和带有末端胺和硫醇的“钳形”排列。寡核苷酸的5’端可以用任何含Cys-Lys的肽进行修饰,包括但不限于如下所示的Cys-Lys二肽。这种修饰将允许与带有邻苯二甲醛的分子发生装订反应(staplingreaction)。
文献中已使用邻苯二甲醛修饰的寡核苷酸将DNA与蛋白质偶联(Y.Ma,Z.Lv,T.Li,T.Tian,L.Lu,W.Liu,Z.Zhu,C.Yang,Design and synthesis of ortho-phthalaldehydephosphoramidite for single-step,rapid,efficient and chemoselective couplingofDNA with proteins under physiological conditions,Chem.Commun.54(2018)9434–9437.https://doi.org/10.1039/c8cc05037f.)。该方法可在此处应用以利用期望的官能团将RNA货物官能化,以引发FlICk化学反应。该合成中使用的中间体(下文)也可用于官能化替代货物,包括但不限于肽、蛋白质、抗体、脂质和治疗性小分子。
图42显示了用于FlICk化学的含邻苯二甲醛的亚磷酰胺的合成方案。基于Ma及其同事概述的文献方法(Y.Ma,Z.Lv,T.Li,T.Tian,L.Lu,W.Liu,Z.Zhu,C.Yang,Design andsynthesis of ortho-phthalaldehyde phosphoramidite for single-step,rapid,efficient and chemoselective coupling of DNA with proteins underphysiological conditions,Chem.Commun.54(2018)9434–9437.https://doi.org/10.1039/c8cc05037f)。
实施例13-细胞毒性核苷酸
细胞毒性核苷,包括但不限于芒霉素、奈普诺辛A、利巴韦林、吡唑霉素、阿糖胞苷(ara-C)、吉西他滨、克拉屈滨(2-CdA)、焦土霉素、艾西拉滨,可以通过刺激反应性接头如肟连接到核酸纳米颗粒。这些可以连接到核苷上的任何给定OH,并且将通过邻苯二甲酰亚胺-氧基修饰的寡核苷酸使用Meyer及其同事概述的方法连接(结构如下所示)。(Y.Ma,Z.Lv,T.Li,T.Tian,L.Lu,W.Liu,Z.Zhu,C.Yang,Design and synthesis of ortho-phthalaldehyde phosphoramidite for single-step,rapid,efficient andchemoselective coupling of DNA with proteins under physiological conditions,Chem.Commun.54(2018)9434–9437.https://doi.org/10.1039/c8cc05037f.)。
替代地,这些化合物可以通过亚磷酰胺化学并入到核酸骨架中,被易于切割的序列包围或直接连接到自焚接头(C.A.Blencowe,A.T.Russell,F.Greco,W.Hayes,D.W.Thornthwaite,Self-immolative linkers in polymeric delivery systems,Polym.Chem.2(2011)773–790.https://doi.org/10.1039/c0py00324g.)。例如,利巴韦林可以利用这种化学方法并入寡核苷酸的任何内部。这种化合物(下文)是本领域已知的(I.Dawson,A.N.Jina,S.Torkelson,S.Rhee,M.Moore,D.A.Zarling,P.D.Hobbs,Synthesisand characterization of a ribavirin-3′,5′-phosphate pentadecamerhomoribopolymer bearing a 5′-amino tether group and a 3′-thymidine,NucleicAcids Res.18(1990)1099–1102.https://doi.org/10.1093/nar/18.5.1099.)。
具有通式的化合物可以并入整个寡核苷酸链组分中:
/>
下文给出了具有自焚接头的利巴韦林亚磷酰胺的实例。与碳酸酯相邻的二硫化物长期以来一直被用作大分子前药(A.Kock,K.Zuwala,A.A.A.Smith,P.Ruiz-Sanchis,B.M.Wohl,M.Tolstrup,A.N.Zelikin,Disulfide reshuffling triggers the release ofa thiol-free anti-HIV agent to make up fast-acting,potent macromolecularprodrugs,Chem.Commun.50(2014)14498–14500.https://doi.org/10.1039/c4cc04280h.;X.Hu,J.Hu,J.Tian,Z.Ge,G.Zhang,K.Luo,S.Liu,Polyprodrug amphiphiles:Hierarchical assemblies for shape-regulated cellular internalization,trafficking,and drug delivery,J.Am.Chem.Soc.135(2013)17617–17629.https://doi.org/10.1021/ja409686x.;S.Bhuniya,S.Maiti,E.J.Kim,H.Lee,J.L.Sessler,K.S.Hong,J.S.Kim,An activatable theranostic for targeted cancer therapy andimaging,Angew.Chemie-Int.Ed.53(2014)4469–4474.https://doi.org/10.1002/anie.201311133.)。该化合物的提出的合成概述于图49中。
图49显示了自焚利巴韦林亚磷酰胺的合成方案。(i)DMTrCl、吡啶(ii)TBDMSCl、AgNO
实施例14-缀合的siRNA的生物活性
反义链的退火
将等摩尔量的(i)siRNA反义链(S-2.1)和(ii)有义链或有义链缀合物分别在无核酸酶水中以20μM的最终浓度混合。将混合物加热至95℃ 5分钟,然后在热循环仪中以每秒0.1℃的速率将温度降至20℃。通过在MOPS缓冲液(20mM MOPS、5mMNaOAc、2.25mM MgCl
转染、逆转录和qPCR
将人MDA-MB-231乳腺癌细胞在DMEM(补充有10%FBS和1%青霉素/链霉素)中进行分裂、计数和稀释,并以7×10
根据制造商的说明,使用RNeasy Plus Mini Kit(Qiagen)从冷冻转染细胞中分离RNA。根据供应商的方案在包含200U SuperScript III逆转录酶(Thermo FisherScientific)和0.5μl随机引物的20μl反应中由200ng RNA合成第一链cDNA。对于每种目的基因,通过将7.5μLPowerUp SYBR Green MasterMix(Thermo Fisher Scientific)与1μL 5μM组合正向和反向引物以及1.5μL不含RNA酶的水(用于单一反应)合并来制备qPCR预混液。然后,将10μL预混液等分到96孔板的孔中,并添加5μL 1:30稀释的cDNA。每种条件一式三份地移液。将板用光学粘合剂盖密封并加载到Quantstudio 5实时PCR仪中。循环条件为:50℃2分钟(1个循环);95℃ 2分钟,95℃ 1秒,以及60℃ 30秒(40个循环);随后进行熔解曲线分析(95℃ 1秒,60℃ 30秒,以及从60℃升温至90℃,并进行连续荧光测量)。
图43是显示通过qPCR获得的、在用通过二硫化物或IEDDA偶联缀合至PLK1靶向siRNA的20nM RNA链转染后48小时MDA-MB-231乳腺癌细胞中PLK1 mRNA的表达水平的图。第1列,无RNA对照(仅用Lipofectamine 2000处理的细胞);第2列,无Lipofectamine对照(用siRNA处理的细胞);第3列,仅有义链对照(用通过5’-至-5’二硫键形成与有义链S-1.1缀合的核心链C-4.1转染的细胞,未添加反义链);第4列,核心链与siRNA双链体的5’-至-5’二硫键缀合物(C-4.1+S-1.1+S-2.1);第5列,siRNA双链体(具有5’硫醇,S-1.1+S-2.1);第6列,核心链与siRNA双链体的5’-至-5’IEDDA偶联的缀合物(C-4.4+S-1.5+S-2.1);第7列,siRNA双链体(具有3’硫醇,S-1.7+S-2.1);第8列,核心链与siRNA双链体的5’-至-3’二硫键缀合物(C-4.1+S-1.7+S-2.1)。
如图43所示,在这项工作中测试的所有siRNA缀合物都保持生物活性,并导致MDA-MB-231乳腺癌细胞中PLK1 mRNA水平降低60-90%。
实施例15-组合货物-siRNA
为了增加核酸纳米颗粒的负载能力,使用组合接头设计将两个PLK1 siRNA(有义链)直接相互缀合。使用了两种缀合策略;TTTT间隔基和二硫化物。序列在表8中提供。
表8.
使用实施例2中概述的常规固相技术进行组合siRNA的合成。对于二硫键连接的链,在第一siRNA序列的5’端添加5’硫醇C6修饰剂(Glen)。然后移除DMT基团,并像往常一样延伸链。
按照实施例14中概述的方案对用组合siRNA转染的细胞进行RT-qPCR分析表明,与经典的单一siRNA设计相比,两种组合设计策略(4.和5.)导致MDA-MB-231细胞中更高的敲低活性(3)。
图44显示了IEDDA偶联反应混合物的分析变性PAGE(250V,1h,凝胶红色染色)。泳道1,RNA S-1.5(起始材料);泳道2,S-3.1(起始材料);泳道3,C-4.4(起始材料);泳道4,C-4.4缀合至S-1.5(IEDDA),脱盐;泳道5,C-4.4缀合至S-1.5(IEDDA),EtOH沉淀;泳道6,C-4.4缀合至S-3.1,脱盐;以及泳道7,C-4.4缀合至S-3.1,EtOH沉淀。
图45是显示通过qPCR获得的、在用20nM指示的siRNA转染后48小时MDA-MB-231乳腺癌细胞中PLK1 mRNA的表达水平的图。显示的数据是从2个生物重复获得的。乱序siRNA表示RISC相互作用能力受损的商业非靶向siRNA(siGENOME RISC-Free Control siRNA,Horizon Discovery,D-001220-01-20)。
图50显示了通过非变性PAGE的组装体的三种不同版本。在100V的6%非变性PAGE上以75分钟的运行时间对组装体的增加的负载进行表征。形成的构建体为(i)没有适体的S-A0构建体(也称为SQ1-0000-001,由链C-1.0、C-2.0、C-3.0、C-4.0、C-5.0组成),(ii)具有一个siRNA的SQ-0100-001构建体(也称为SQ16,由链C-1.0、C-2.0、C-3.0、C-4.4、C-5.0、S-1.5、S-2.0组成),(iii)具有两个siRNA的SQ-0200-001构建体(也称为SQ-17,由链C-1.0、C-2.0、C-3.0、C-4.4、C-5.0、S-3.1、S-2.0组成),在补充有2mM MgCl2的PBS中以等摩尔量混合,最终浓度为10μM。将链加热至95℃ 5分钟,然后缓慢冷却至室温。对于每个版本的组装体,在凝胶中加载1pmol。凝胶的运行后染色是用GelRed染色剂完成的。可以看出,随着组件上siRNA数量的增加,出现了凝胶位移。
实施例16-组合货物-GalNAc/siRNA
N-乙酰半乳糖胺(GalNAc)-siRNA缀合物已被广泛探索以克服与裸siRNA递送相关的挑战。典型的siRNA缀合物是GalNAc的三聚体,它与去唾液酸糖蛋白受体(ASGPR)结合(Springer,A.D.;Dowdy,S.F.GalNAc-SiRNA Conjugates:Leading the Way for Deliveryof RNAi Therapeutics.Nucleic Acid Ther.2018,28(3),109–118.)。这种基序可用作组合货物设计的一部分。这可以通过亚磷酰胺化学连接,作为例如S-3.0至S-4.1在5’端的延伸。这种修饰将通过标准固相合成用(4-(三甲氧基三苯甲基氧基甲基)-1-(6-(4-(3,4,6-O-三乙酰-2-乙酰氨基-2-脱氧-β-D-吡喃半乳糖)丁酰氨基)己酰基)哌啶-4-基)甲基-O-[(2-氰乙基)-(N,N-二异丙基)]亚磷酰胺(Glen Research)并入。
图51是通过GalNAc C35’亚磷酰胺(Glen)与单价和三价GalNAc偶联的组合货物(siRNA)的示意图。
图52是用于合成后IEDDA缀合的5’GalNAc修饰剂的合成示意图。GalNAc C3 CPG(Glen)用GalNAc C35’亚磷酰胺(Glen)和5’降冰片烯亚磷酰胺进行链延伸,然后是标准RNA脱保护条件(AMA/HF)。
也可以采用后合成方法。三价GalNAc可以通过固相合成廉价且容易地合成,然后用双环[2.2.1]庚-5-烯-2-基甲基(2-氰乙基)二异丙基亚磷酰胺直接延伸。
实施例17-组合货物-与胆固醇和GalNAc的双重缀合
大多数改善siRNA缀合物功效的策略或集中于增强缀合配体的效力-例如通过优化配体价态、间距、电荷、接头长度和接头疏水性-或旨在增强治疗性siRNA的化学稳定性。一种不同的方法是将多个配体和多个siRNA分子组合在一个缀合物中。
图53是通过修饰的亚磷酰胺双缀合到胆固醇和三价GalNAc的组合货物(siRNA)的示意图。
这种策略将增加治疗有效载荷,实现多基因沉默,同时允许微调缀合物的药代动力学特性。在寡核苷酸的固相合成过程中,胆固醇和三价或四价GalNAc部分与双siRNA的连接可用于靶向两个mRNA,因此由于GalNAc,缀合物的递送将仅限于肝细胞,并且潜在的肾毒性可以由于降低肾脏积累的胆固醇而受到限制(F.Wada,T.Yamamoto,T.Ueda,M.Sawamura,S.Wada,M.Harada-Shiba,S.Obika,Cholesterol–GalNAc Dual Conjugation Strategyfor Reducing Renal Distribution of Antisense Oligonucleotides,Nucleic AcidTher.28(2018)50–57.https://doi.org/10.1089/nat.2017.0698)。胆固醇和GalNAc配体将通过标准固相合成从如先前所述具有单个GalNAc部分的亚磷酰胺(K.G.Rajeev,J.K.Nair,M.Jayaraman,K.Charisse,N.Taneja,J.O’Shea,J.L.S.Willoughby,K.Yucius,T.Nguyen,S.Shulga-Morskaya,S.Milstein,A.Liebow,W.Querbes,A.Borodovsky,K.Fitzgerald,M.A.Maier,M.Manoharan,Hepatocyte-Specific Delivery of siRNAsConjugated to Novel Non-nucleosidic Trivalent N-Acetylgalactosamine ElicitsRobust Gene Silencing in Vivo,ChemBioChem.16(2015)903–908.https://doi.org/https://doi.org/10.1002/cbic.201500023)和5'-胆固醇-TEG-CE亚磷酰胺并入。双配体双siRNA可以在合成后点击反应中进一步连接到RNA纳米颗粒支架链,例如通过IEDDA介导的与链C-4.4的缀合。
实施例18-适体结合的评估
通过杂交的适体连接
将设计用于组装成(i)Cy3标记的S-A0构建体,不含适体(也称为SQ1-0000-001,由链C-1.0、C-2.0、C-3.0、C-4.0、C-5.1组成),(ii)具有一个适体的S-A1构建体(也称为SQ1-1000-001,由链C-1.3、C-2.0、C-3.0、C-4.0、C-5.1组成),(iii)具有两个适体的S-A2构建体(也称为SQ-2000-001,由链C-1.3、C-2.0、C-3.2、C-4.0、C-5.1组成),以及(iv)具有四个适体的S-A4构建体(也称为S-4000-001,由链C-1.3、C-2.3、C-3.2、C-4.5、C-5.1组成)的5种方形支架RNA链以等摩尔量组合在补充有2mM MgCl2的PBS中,终浓度为10μM。将5种链加热至95℃ 5分钟,然后缓慢冷却至室温。将适体(A-1.1)加热至75℃ 3分钟,然后分别以0、等摩尔、双摩尔或四摩尔当量混合到核心链组装体中。接下来,将混合物在55℃下孵育10分钟,以使适体链与构建体杂交。纳米颗粒的质量通过非变性PAGE评估。
适体结合试验
使A431表皮样癌细胞(一种表达高水平表皮生长因子受体(EGFR)的细胞系)在用适体构建体处理前48小时以0.75x10
流式细胞术
在装有FACS Diva软件的BD LSRFortessa
图46显示了图表,显示在以浓度为200nM在具有10%热灭活FBS的细胞培养基中孵育2小时后,具有0个、1个、2个或4个靶向EGFR的适体(A-1.1)的Cy3标记的构建体与EGFR过表达A431癌细胞的结合。A,适体A-1.1;(★),Cy3标签;(**),p≤0.01;(***),p≤0.001;(****),p≤0.0001;如果未注明则不显著。
实施例19-RNA纳米颗粒摄取的评估
在用200nM Cy5标记的E07min A-1.0适体(A-1.0)或200nM Cy5标记的构建体(SQ1-1000-001)处理后,通过共聚焦显微镜对细胞进行成像。对于适体摄取实验,将1x10
图47显示了显微图像,显示在内化后适体在溶酶体中积累。用E07min适体(A-1.0)处理增加时间长度后的活HeLa细胞的代表性共聚焦荧光显微镜图像,放大倍数为x60。溶酶体示踪剂和早期内体GFP染色用于识别每个隔室。比例尺,50μm。
共聚焦数据表明,带有E0O7min适体的Cy5标记的构建体(SQ1-1000-001)被表达EGFR的癌细胞特异性摄取(图47)。
对于进一步的摄取实验,对MDA-MB-231细胞进行计数并以3.4x10
图48显示了显微图像,显示在细胞中内化后RNA纳米颗粒在核周空间中积累,表明内体摄取。用带有单个适体(S-A1/S-1000-001)的200nM Cy3标记结构处理4小时、8小时和24小时后的活MDA-MB-231细胞的代表性荧光显微图像,放大倍数为x60。细胞核用Hoechst33342染色,构建体用Cy5标记(显示为亮白点)。比例尺,20μm。
图48中所示的显微镜数据表明,带有E0O7min适体的Cy5标记的构建体(SQ1-1000-001)被癌细胞摄取并集中在核周区域。熟练的技术人员将认识到,核周空间是已知富含内体囊泡和溶酶体的区域,并且诸如共定位测定的方法可用于证明摄取到内体和溶酶体中。
- 包含植物糖原纳米颗粒的抗感染组合物
- 具有改善的外观及翘曲特性的聚酰胺组合物及包含该组合物的制品
- 包含具有半乳聚糖酶活性的多肽和具有β-半乳糖苷酶活性的多肽的组合物
- 包含具有可交换交联点的交联有机硅的聚合物组合物、制备方法和用途
- 包含核酸酶和恶臭减少材料的清洁组合物
- 包含具有亚砜官能团的分子与具有酰胺官能团的分子的混合物的溶剂组合物
- 包含具有亚砜官能团的分子与具有酰胺官能团的分子的混合物的溶剂组合物
