具有P2X4受体拮抗活性的取代的N-苯乙酰胺
文献发布时间:2023-06-19 19:30:30
本发明涵盖如本文所述和定义的通式(I)的取代的N-苯乙酰胺化合物、制备所述化合物的方法、可用于制备所述化合物的中间体化合物、包含所述化合物的药物组合物和结合物,以及所述化合物用于制造药物组合物的用途,所述药物组合物用于治疗或预防疾病,特别是用于治疗或预防与疼痛相关的疾病、疼痛综合征(急性和慢性)、炎症诱发的疼痛、神经性疼痛、糖尿病性神经性疼痛、糖尿病性神经病、癌症相关疼痛、化学治疗或中毒诱发的疼痛、盆腔痛、子宫内膜异位症相关疼痛以及子宫内膜异位症本身、膀胱疼痛综合征;哮喘、闭塞性细支气管炎综合征、慢性阻塞性肺病(COPD)、慢性咳嗽、杯状细胞和肺纤维化相关疾病、肝纤维化、脂肪肝病症、NASH(非酒精性脂肪性肝炎);脑缺血、缺血性脑损伤、缺血性中风、出血性中风、外伤性脑损伤、脊髓损伤、动脉瘤;慢性瘙痒、瘙痒;骨关节炎、灼口综合征、偏头痛病症、肠易激疾病;泌尿外科相关综合征,如膀胱过度活动症、间质性膀胱炎、膀胱疼痛综合征。如本文所述和定义的本发明涵盖包含活性成分的药物组合物和结合物,所述活性成分是P2X4的拮抗剂或负变构调节剂。
背景技术
本发明涵盖通式(I)的取代的N-苯乙酰胺,其是P2X4的拮抗剂或负变构调节剂。三磷酸腺苷ATP被广泛认为是一种重要的神经递质,其通过嘌呤能受体的不同亚型起作用而涉及各种生理和病理生理作用(Burnstock 1993,Drug Dev Res 28:196-206;Burnstock2011,Prog Neurobiol 95:229-274)。迄今为止,已克隆了P2X家族的七个成员,包括P2X1-7(Burnstock 2013,Front Cell Neurosci 7:227)。P2X4受体是一种配体门控离子通道,在多种细胞类型上表达,这些细胞类型主要已知参与炎症/免疫过程,具体包括单核细胞、巨噬细胞、肥大细胞和小神经胶质细胞(Wang等人,2004,BMC Immunol 5:16;Brone等人,2007Immunol Lett 113:83-89)。此外,已知通过细胞外ATP活化P2X4会导致促炎性细胞因子和前列腺素(PGE2)的释放(2003Cell Tissue Res313:159-165;Ulmann等人,2010,EMBOJournal 29:2290-2300;de Ribero Vaccari等人,2012,J Neurosci 32:3058-3066)。文献中使用动物模型的许多条证据表明P2X4受体与伤害感受和疼痛有关。缺乏P2X4受体的小鼠在面对多种炎症攻击(例如完全弗氏佐剂(CFA)、角叉菜胶或福尔马林)时不会发生疼痛超敏反应(Ulmann等人,2010,EMBO Journal29:2290-2300)。此外,缺乏P2X4R的小鼠在周围神经损伤后不会发生机械性触诱发痛,表明P2X4在神经性疼痛病况中的作用非常突出(Tsuda等人,2009,Mol Pain 5:28;Ulmann等人,2008,J Neurocsci28:11263-11268)。Moehring等人(Elife.2018Jan 16;7”Keratinocytes mediate innocuous and noxious touch viaATP-P2X4 signaling”)报道了识别P2X4信号传导为基线哺乳动物触觉的关键组分的实验。这些实验为皮肤疼痛和瘙痒疾病中发生的功能失调信号传导的后续研究奠定了至关重要的基础。
除了广泛描述的P2X4在急性和慢性疼痛相关疾病中的作用之外(Trang和Salter,2012,Purinergic Signalling 8:621-628;Burnstock,2013Eur J Pharmacol 716:24-40),P2X4被认为是炎性疾病的极其重要的介质,例如呼吸疾病(例如哮喘、COPD)、肺疾病(包括纤维化)、癌症和动脉粥样硬化(Burnstock等人,2012Pharmacol Rev.64:834-868)。
EP 2 597088A1描述了P2X4受体拮抗剂,特别是式(III)的二氮杂卓(diazepine)衍生物或其药理学上可接受的盐。所述文献还公开了式(I)、(II)、(III)所代表的P2X4受体拮抗剂二氮杂卓衍生物或其药理学上可接受的盐(具有P2X4受体拮抗作用)作为有效的预防或治疗伤害性、炎症性和神经性疼痛的试剂的用途。更详细地,EP 2 597 088 A1描述了P2X4受体拮抗剂,可有效作为由各种癌症、糖尿病性神经炎、病毒性疾病(例如,疱疹)和骨关节炎所引起的疼痛的预防剂或治疗剂。根据EP2597088A1的预防剂或治疗剂还可以与其它试剂联用,例如阿片样物质类镇痛剂(例如,吗啡、芬太尼)、钠通道抑制剂(例如,盐酸普鲁卡因、利多卡因)或NSAID(例如,阿司匹林、布洛芬)。用于癌症所引起的疼痛的P2X4受体拮抗剂也可以与制癌剂(carcinostatic)(例如,化学疗法)联用。WO2013105608、WO2015005467和WO2015005468、WO2016198374、WO2017191000、WO2018/104305、WO2018/104307公开了其它P2X4受体拮抗剂和它们的用途。
“Discovery and characterization of novel,potent and selectiveP2X4receptorantagonists for the treatment of pain”发表于2014年神经科学学会年会(Society for Neuroscience AnnualMeeting 2014)(Carrie A Bowen等人;posterN.241.1)。所述海报(poster)描述了鉴定新的、有效的和选择性的抑制P2X4的小分子拮抗剂的方法,以及如何在神经性和炎性疼痛的实验模型中评价所选择的化合物。尤其是描述了基于人类、大鼠、小鼠P2X4R Flipr的筛选方法、人类P2X4R电生理学测定、合适的小鼠神经病模型和小鼠炎症模型。
WO2015088564和WO2015088565提供P2X4受体调节化合物、它们的合成方法、包含所述化合物的药物组合物以及它们的使用方法。所述P2X4受体调节化合物可用于治疗、预防和/或控制各种病症,包括但不限于慢性疼痛、神经病变、炎性疾病和中枢神经系统病症。
US2018/0280409描述用于治疗患有中风的人类受试者的方法,其通过向所述受试者施用包含P2X4受体拮抗剂的药物组合物。P2X4受体拮抗剂可以在中风的急性阶段施用,任选地与溶栓治疗或涉及血栓去除装置的受试者的手术结合施用。
WO2019081573A1还描述包含活性成分的药物组合物和结合物,所述活性成分是P2X4拮抗剂或负变构调节剂,用于治疗或预防脑缺血、缺血性脑损伤、缺血性中风(IS)、出血性中风、外伤性脑损伤、脊髓损伤。
WO2019177117A1描述一种用于预防或治疗咳嗽的药物,该药物含有作为活性成分的具有P2X4受体拮抗作用的化合物,所述化合物的互变异构体、立体异构体或药理学上可接受的盐,或其水合物或溶剂化物。
现有技术中未提及关于如本文描述和定义的通式(I)的取代的N-苯乙酰胺以及所述化合物用于制造用于治疗或预防疾病的药物组合物的用途,特别是通式(I)的取代的芳族磺酰胺作为单一试剂或与其他活性成分结合用于治疗或预防与疼痛相关的疾病,或用于治疗或预防疼痛综合征(急性和慢性)、炎症诱发的疼痛、神经性疼痛(包括糖尿病性神经性疼痛)、盆腔痛、癌症或化学治疗相关疼痛、子宫内膜异位症相关疼痛以及子宫内膜异位症本身、膀胱疼痛综合征、癌症本身和增殖性疾病本身(如子宫内膜异位症)的用途。
因此,本发明的P2X4抑制剂作为单一试剂或与其他药物结合代表应补充治疗选择的有价值的化合物。
发明内容
根据第一方面,本发明涵盖通式(I)的化合物,及其立体异构体、互变异构体、N-氧化物、水合物、溶剂化物及盐,及其混合物:
其中A为CH或N
R
R
R
R
在第二方面中,本发明涵盖通式(Ia)化合物,及其立体异构体、互变异构体、N-氧化物、水合物、溶剂化物及盐,及其混合物:
其中
R
R
R
R
在另一方面中,本发明涵盖通式(Ib)化合物,及其立体异构体、互变异构体、N-氧化物、水合物、溶剂化物及盐,及其混合物:
R
R
R
R
定义
当在本说明书中使用时,术语“包含”包括“由……组成”。
如果在本文中提及任何项目为“如本文所述”,则其意指可在本文中的任何地方提及。
本文中提及的术语具有以下含义:
术语“卤素原子”是指氟、氯、溴或碘原子,特别是氟、氯或溴原子,更特别是氟或氯原子。
在本发明的上下文中,除非另有说明,否则取代基和残基具有以下含义:
在本发明的上下文中,
在本发明的上下文中,
在本文中使用词语化合物、盐、多晶型物、水合物、溶剂化物等的复数形式的情况下,这也被认为意指单一化合物、盐、多晶型物、异构体、水合物、溶剂化物等。
通过“稳定的化合物”或“稳定的结构”是指一种化合物,该化合物足够稳定(robust),能够从反应混合物中分离到有用的纯度,并调配成有效的治疗剂。
本发明的化合物任选地包含一个或多个不对称中心,这取决于所需的各种取代基的位置和性质。(R)或(S)构型中可能存在一个或多个不对称碳原子,其可产生外消旋混合物。在某些情况下,由于绕特定键(例如,与指定化合物的两个取代芳环相邻的中心键)的旋转受限,也可存在不对称性。
这些物质的纯化和分离可以通过本领域已知的标准技术来实现。
本发明的光学活性化合物同样可以通过使用光学活性起始材料的手性合成获得。
为了彼此区分不同类型的异构体,参考IUPAC Rules Section E(Pure Appl Chem45,11-30,1976)。
本发明还涵盖本发明化合物的可用形式,例如代谢物、水合物、溶剂化物、前药、盐,特别是药学上可接受的盐,和/或共沉淀物。
本发明的化合物可以作为水合物或溶剂化物存在,其中本发明的化合物含有极性溶剂,特别是例如水、甲醇或乙醇,作为化合物晶格的结构元素。极性溶剂,特别是水的量可以化学计量或非化学计量比存在。在化学计量溶剂化物(例如水合物)的情况下,可分别为例如一水合物、半(hemi/semi)溶剂化物或水合物、单溶剂化物或水合物、倍半溶剂化物或水合物、二溶剂化物或水合物、三溶剂化物或水合物、四溶剂化物或水合物、五溶剂化物或水合物等。本发明包括所有此类水合物或溶剂化物。
此外,本发明的化合物可能以游离形式存在,例如作为游离碱,或作为游离酸,或作为两性离子,或以盐的形式存在。所述盐可以是任何盐,有机或无机加成盐,特别是任何药学上可接受的有机或无机加成盐,其通常用于药学,或用于例如分离或纯化本发明的化合物。
术语“药学上可接受的盐”是指本发明化合物的无机或有机酸加成盐。例如,参见S.M.Berge等人“Pharmaceutical Salts,”J.Pharm.Sci.1977,66,1-19。
本发明化合物的合适的药学上可接受的盐可以是例如在链或环中具有氮原子的本发明化合物的酸加成盐(例如其为足够的碱性的),诸如与无机酸或“矿物酸”如盐酸、氢溴酸、氢碘酸、硫酸、氨基磺酸、双硫酸(bisulfuric acid)、磷酸或硝酸的酸加成盐,或与有机酸如甲酸、乙酸、乙酰乙酸、丙酮酸、三氟乙酸、丙酸、丁酸、己酸、庚酸、十一烷酸、月桂酸、苯甲酸、水杨酸、2-(4-羟基苯甲酰基)-苯甲酸、樟脑酸、肉桂酸、环戊烷丙酸、二葡萄糖酸、3-羟基-2-萘甲酸、烟碱酸、双羟萘酸、果胶酸、3-苯基丙酸、特戊酸、2-羟基乙磺酸、衣康酸、三氟甲磺酸、十二烷基硫酸、乙磺酸、苯磺酸、对甲苯磺酸、甲磺酸、2-萘磺酸、萘二磺酸、樟脑磺酸、柠檬酸、酒石酸、硬脂酸、乳酸、草酸、丙二酸、琥珀酸、苹果酸、己二酸、藻酸、马来酸、富马酸、D-葡萄糖酸、扁桃酸、抗坏血酸、葡庚酸、甘油磷酸、天冬氨酸、磺基水杨酸或硫氰酸的酸加成盐。
此外,本发明化合物的另一合适的药学上可接受的盐是碱金属盐(其为足够酸性的),例如钠盐或钾盐、碱土金属盐,例如钙盐、镁盐或锶盐,或铝盐或锌盐,或衍生自氨或具有1至20个碳原子的有机伯胺、仲胺或叔胺的铵盐,例如乙胺、二乙胺、三乙胺、乙基二异丙胺、单乙醇胺、二乙醇胺、三乙醇胺、二环己胺、二甲基氨基乙醇、二乙氨基乙醇、三(羟甲基)氨基甲烷、普鲁卡因(procaine)、二苄基胺、N-甲基吗啉、精胺酸、赖氨酸、1,2-乙二胺、N-甲基哌啶、N-甲基-葡糖胺、N,N-二甲基-葡糖胺、N-乙基-葡糖胺、1,6-己二胺、葡萄糖胺、肌氨酸、丝氨醇、2-氨基-1,3-丙二醇、3-氨基-1,2-丙二醇、4-氨基-1,2,3-丁三醇或与具有1至20个碳原子的季铵离子的盐,例如四甲基铵、四乙基铵、四(正丙基)铵、四(正丁基)铵、N-苄基-N,N,N-三甲基铵、胆碱或苯甲烃铵。
本领域技术人员将进一步认识到要求保护的化合物的酸加成盐可通过多种已知方法中的任一种使所述化合物与合适的无机或有机酸的反应来制备。或者,本发明的酸性化合物的碱金属盐和碱土金属盐通过各种已知方法使本发明的化合物与合适的碱反应来制备。
本发明包括作为单一盐或作为所述盐以任何比例的任何混合物的本发明化合物的所有可能的盐。
在本文(特别是在“实验部分”)中,对于中间体和本发明的实施例的合成,当化合物作为与相应的碱或酸的盐形式被提及时,通过相应的制备和/或纯化方法获得的所述盐形式的确切化学计量组成在大多数情况下是未知的。
除非另有说明,否则与盐有关的化学名称或结构式的后缀,例如“盐酸盐”、“三氟乙酸盐”、“钠盐”或“×HCl”、“×CF
这类似地适用于合成中间体或实施例化合物或其盐已通过所描述的制备和/或纯化方法作为具有(如果定义的)未知化学计量组成的溶剂化物(例如水合物)获得的情况。
此外,本发明包括本发明化合物作为单一多晶型物、或者作为多于一种多晶型物以任何比例的混合物的所有可能的结晶形式或多晶型物。
此外,本发明还包括本发明化合物的前药。本文的术语“前药”是指本身可以具有生物活性或无生物活性,但是它们在体内停留期间被转化(例如代谢或水解)为本发明的化合物的化合物。
在第一方面的另一个实施方案中,本发明涵盖上述式(I)的化合物,其中R
根据本发明的另一个实施方案,R
此外,与本发明的另一种形式相关,R
在本发明的另一个特定实施方案中,R
本发明的一个特定实施方案是其中R
根据本发明的另一实施方案,R
在本发明的另一特定实施方案中,R
此外,与本发明的另一形式相关,R
本发明进一步包括特定实施方案,其中R
在本发明的另一特定实施方案中,R
在第一方面的进一步实施方案中,本发明涵盖在标题“本发明第一方面的其他实施方案”下的两个或更多个上述实施方案的结合物。
本发明涵盖上述通式(I)的化合物在本发明的任何实施方案或方面内的任何子结合。
本发明涵盖通式(VII)、(VIII)、(XIII)、(XIV)的中间体化合物在本发明的任何实施方案或方面内的任何子结合。
本发明涵盖通式(I)的化合物,其公开于本文下文的实施例部分中,即:
1.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-(3,4-二氟苯基)乙酰胺
2.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-(4-氟苯基)乙酰胺
3.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-[3-(二氟甲基)苯基]乙酰胺
4.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-[3-(二氟甲基)苯基]乙酰胺
5.N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}-N-[3-(二氟甲基)苯基]乙酰胺
6.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-[3-(三氟甲基)苯基]乙酰胺
7.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-[3-(三氟甲基)苯基]乙酰胺
8.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-[3-(三氟甲基)苯基]乙酰胺
9.N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}-N-[3-(三氟甲基)苯基]乙酰胺
10.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-[4-氰基-3-(三氟甲基)苯基]乙酰胺
11.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-[4-氰基-3-(三氟甲基)苯基]乙酰胺
12.N-[4-氰基-3-(三氟甲基)苯基]-N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
13.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-(3-氰基苯基)乙酰胺
14.N-(3-氰基苯基)-N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
15.N-{4-[2-(2-氯-6-氟苯基)乙酰氨基]吡啶-2-基}-N-(3-氰基苯基)乙酰胺
16.N-(4-氯-3-氰基苯基)-N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
17.N-(4-氯-3-氰基苯基)-N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}乙酰胺
18.N-(4-氯-3-氰基苯基)-N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}乙酰胺
19.N-(4-氯-3-氰基苯基)-N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
20.N-(4-{2-[2-氯-3-(三氟甲基)苯基]乙酰氨基}吡啶-2-基)-N-(3-氰基-4-氟苯基)乙酰胺
21.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-(3-氰基-4-氟苯基)乙酰胺
22.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(3-氰基-4-氟苯基)乙酰胺
23.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-(3-氰基-4-氟苯基)乙酰胺
24.N-(3-氰基-4-氟苯基)-N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
25.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-苯乙酰胺
26.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-苯乙酰胺
27.N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}-N-苯乙酰胺
28.N-{4-[2-(2-氯-6-氟苯基)乙酰氨基]吡啶-2-基}-N-苯乙酰胺
29.N-{4-[2-(2,3-二甲基苯基)乙酰氨基]吡啶-2-基}-N-(4-氟苯基)乙酰胺
30.N-(4-氟苯基)-N-(4-{2-[2-(三氟甲基)苯基]乙酰氨基}吡啶-2-基)乙酰胺
31.N-(4-{2-[4-氯-2-(三氟甲基)苯基]乙酰氨基}吡啶-2-基)-N-(4-氟苯基)乙酰胺
32.N-(4-氟苯基)-N-(4-{2-[3-氟-2-(三氟甲基)苯基]乙酰氨基}吡啶-2-基)乙酰胺
33.N-{4-[2-(2-氯-6-氰基苯基)乙酰氨基]吡啶-2-基}-N-(4-氟苯基)乙酰胺
34.N-{4-[2-(2,6-二甲基苯基)乙酰氨基]吡啶-2-基}-N-(4-氟苯基)乙酰胺
35.N-(4-{2-[2-氯-3-(三氟甲基)苯基]乙酰氨基}吡啶-2-基)-N-(4-氟苯基)乙酰胺
36.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-(4-氟苯基)乙酰胺
37.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(4-氟苯基)乙酰胺
38.N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}-N-(4-氟苯基)乙酰胺
39.N-{4-[2-(2,6-二氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(4-氟苯基)乙酰胺
40.N-{4-[2-(2-氯-6-氟苯基)乙酰氨基]吡啶-2-基}-N-(4-氟苯基)乙酰胺
41.N-{4-[2-(2-氯-4,6-二氟苯基)乙酰氨基]吡啶-2-基}-N-(4-氟苯基)乙酰胺
42.N-(4-氟苯基)-N-(4-{2-[2-(三氟甲氧基)苯基]乙酰氨基}吡啶-2-基)乙酰胺
43.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-(4-甲基苯基)乙酰胺
44.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(4-甲基苯基)乙酰胺
45.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-(4-甲基苯基)乙酰胺
46.N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}-N-(4-甲基苯基)乙酰胺
47.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-[4-(二氟甲氧基)苯基]乙酰胺
48.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-[4-(二氟甲氧基)苯基]乙酰胺
49.N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}-N-[4-(二氟甲氧基)苯基]乙酰胺
50.N-(3-氯-4-氟苯基)-N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
51.N-(3-氯-4-氟苯基)-N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}乙酰胺
52.N-(3-氯-4-氟苯基)-N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}乙酰胺
53.N-(3-氯-4-氟苯基)-N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
54.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-(3-氟苯基)乙酰胺
55.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(3-氟苯基)乙酰胺
56.N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}-N-(3-氟苯基)乙酰胺
57.N-{4-[2-(2,6-二氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(3-氟苯基)乙酰胺
58.N-(4-氯-3-氟苯基)-N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
59.N-(4-氯-3-氟苯基)-N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}乙酰胺
60.N-(4-氯-3-氟苯基)-N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}乙酰胺
61.N-(4-氯-3-氟苯基)-N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
62.N-(3,4-二氟苯基)-N-{4-[2-(2,3-二甲基苯基)乙酰氨基]吡啶-2-基}乙酰胺
63.N-(3,4-二氟苯基)-N-(4-{2-[2-(三氟甲基)苯基]乙酰氨基}吡啶-2-基)乙酰胺
64.N-{4-[2-(2,4-二氯-6-甲基苯基)乙酰氨基]吡啶-2-基}-N-(3,4-二氟苯基)乙酰胺
65.N-{4-[2-(2-氯-4,6-二甲基苯基)乙酰氨基]吡啶-2-基}-N-(3,4-二氟苯基)乙酰胺
66.N-(3,4-二氟苯基)-N-{4-[2-(2,6-二甲基苯基)乙酰氨基]吡啶-2-基}乙酰胺
67.N-{4-[2-(2,4-二氯苯基)乙酰氨基]吡啶-2-基}-N-(3,4-二氟苯基)乙酰胺
68.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(3,4-二氟苯基)乙酰胺
69.N-{4-[2-(2-氯-4-硝基苯基)乙酰氨基]吡啶-2-基}-N-(3,4-二氟苯基)乙酰胺
70.N-{4-[2-(2-氯-4-甲氧基苯基)乙酰氨基]吡啶-2-基}-N-(3,4-二氟苯基)乙酰胺
71.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-(3,4-二氟苯基)乙酰胺
72.N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}-N-(3,4-二氟苯基)乙酰胺
73.N-{4-[2-(2,6-二氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(3,4-二氟苯基)乙酰胺
74.N-{4-[2-(2,6-二氯-4-甲基苯基)乙酰氨基]吡啶-2-基}-N-(3,4-二氟苯基)乙酰胺
75.N-{4-[2-(2,6-二氯-4-乙基苯基)乙酰氨基]吡啶-2-基}-N-(3,4-二氟苯基)乙酰胺
76.N-(3,4-二氟苯基)-N-(4-{2-[2-(三氟甲氧基)苯基]乙酰氨基}吡啶-2-基)乙酰胺
77.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-(3-氟-4-甲氧基苯基)乙酰胺
78.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(3-氟-4-甲氧基苯基)乙酰胺
79.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-(3-氟-4-甲氧基苯基)乙酰胺
80.N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}-N-(3-氟-4-甲氧基苯基)乙酰胺
81.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-[3-氟-4-(甲基磺酰基)苯基]乙酰胺
82.N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}-N-[3-氟-4-(甲基磺酰基)苯基]乙酰胺
83.N-(3,5-二氟苯基)-N-{4-[2-(2,3-二甲基苯基)乙酰氨基]吡啶-2-基}乙酰胺
84.N-(3,5-二氟苯基)-N-(4-{2-[2-(三氟甲基)苯基]乙酰氨基}吡啶-2-基)乙酰胺
85.N-(3,5-二氟苯基)-N-{4-[2-(2,6-二甲基苯基)乙酰氨基]吡啶-2-基}乙酰胺
86.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-(3,5-二氟苯基)乙酰胺
87.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(3,5-二氟苯基)乙酰胺
88.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-(3,5-二氟苯基)乙酰胺
89.N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}-N-(3,5-二氟苯基)乙酰胺
90.N-{4-[2-(2,6-二氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(3,5-二氟苯基)乙酰胺
91.N-(3,5-二氟苯基)-N-(4-{2-[2-(三氟甲氧基)苯基]乙酰氨基}吡啶-2-基)乙酰胺
92.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-(3,5-二氟-4-甲基苯基)乙酰胺
93.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(3,5-二氟-4-甲基苯基)乙酰胺
94.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-(3,5-二氟-4-甲基苯基)乙酰胺
95.N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}-N-(3,5-二氟-4-甲基苯基)乙酰胺
96.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-(3,5-二氟-4-甲氧基苯基)乙酰胺
97.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(3,5-二氟-4-甲氧基苯基)乙酰胺
98.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-(3,5-二氟-4-甲氧基苯基)乙酰胺
99.N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}-N-(3,5-二氟-4-甲氧基苯基)乙酰胺
100.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-(3-甲氧基苯基)乙酰胺
101.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-(3-甲氧基苯基)乙酰胺
102.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-[3-(三氟甲氧基)苯基]乙酰胺
103.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-(4-氟-3-甲氧基苯基)乙酰胺
104.N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}-N-(4-氟-3-甲氧基苯基)乙酰胺
105.N-(2-氯苯基)-N-(4-{2-[2-氯-3-(三氟甲基)苯基]乙酰氨基}吡啶-2-基)乙酰胺
106.N-(2-氯苯基)-N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
107.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(2-氯苯基)乙酰胺
108.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-(2-氯苯基)乙酰胺
109.N-(2-氯苯基)-N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
110.N-(2-氯-5-氟苯基)-N-(4-{2-[2-氯-3-(三氟甲基)苯基]乙酰氨基}吡啶-2-基)乙酰胺
111.N-(2-氯-5-氟苯基)-N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
112.N-(2-氯-5-氟苯基)-N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}乙酰胺
113.N-(2-氯-5-氟苯基)-N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}乙酰胺
114.N-(2-氯-5-氟苯基)-N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
115.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-(2-氟苯基)乙酰胺
116.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(2-氟苯基)乙酰胺
117.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-(2-氟苯基)乙酰胺
118.N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}-N-(2-氟苯基)乙酰胺
119.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-[2-氟-4-(三氟甲基)苯基]乙酰胺
120.N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}-N-[2-氟-4-(三氟甲基)苯基]乙酰胺
121.N-(4-{2-[2-氯-3-(三氟甲基)苯基]乙酰氨基}吡啶-2-基)-N-(2,3-二氟苯基)乙酰胺.
122.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-(2,3-二氟苯基)乙酰胺
123.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(2,3-二氟苯基)乙酰胺
124.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-(2,3-二氟苯基)乙酰胺
125.N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}-N-(2,3-二氟苯基)乙酰胺
126.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-(2,4-二氟苯基)乙酰胺
127.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(2,4-二氟苯基)乙酰胺
128.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-(2,4-二氟苯基)乙酰胺
129.N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}-N-(2,4-二氟苯基)乙酰胺
130.N-{4-[2-(2-氯-6-氟苯基)乙酰氨基]吡啶-2-基}-N-(2,4-二氟苯基)乙酰胺
131.N-(3-氯苯基)-N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
132.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(3-氯苯基)乙酰胺
133.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-(3-氯苯基)乙酰胺
134.N-(3-氯苯基)-N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
135.N-{4-[2-(2-氯-6-氟苯基)乙酰氨基]吡啶-2-基}-N-(3-氯苯基)乙酰胺
136.N-(3-氯-5-氟苯基)-N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
137.N-(3-氯-5-氟苯基)-N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}乙酰胺
138.N-(3-氯-5-氟苯基)-N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}乙酰胺
139.N-(3-氯-5-氟苯基)-N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
140.N-(3-氯-5-氟苯基)-N-{4-[2-(2-氯-6-氟苯基)乙酰氨基]吡啶-2-基}乙酰胺
141.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(4-氟苯基)丁酰胺
142.N-{4-[2-(2-氯-6-氟苯基)乙酰氨基]吡啶-2-基}-N-(4-氟苯基)丁酰胺
143.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-(4-氟苯基)丁酰胺
144.N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}-N-(4-氟苯基)丁酰胺
145.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-(3-氰基-5-氟苯基)乙酰胺
146.N-(3-氰基-5-氟苯基)-N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
147.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-(3-氰基-5-氟苯基)乙酰胺
148.N-{4-[2-(2-氯-6-氟苯基)乙酰氨基]吡啶-2-基}-N-(3-氰基-5-氟苯基)乙酰胺
149.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(3-氰基-5-氟苯基)乙酰胺
150.N-(2-氯-4-氟苯基)-N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
151.N-(2-氯-4-氟苯基)-N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}乙酰胺
152.N-(2-氯-4-氟苯基)-N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
153.N-(2-氯-4-氟苯基)-N-{4-[2-(2-氯-6-氟苯基)乙酰氨基]吡啶-2-基}乙酰胺
154.N-(2-氯-4-氟苯基)-N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}乙酰胺
155.N-[3-氯-4-(甲基磺酰基)苯基]-N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
156.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-[3-氯-4-(甲基磺酰基)苯基]乙酰胺
157.N-[3-氯-4-(甲基磺酰基)苯基]-N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
158.N-{4-[2-(2-氯-6-氟苯基)乙酰氨基]吡啶-2-基}-N-[3-氯-4-(甲基磺酰基)苯基]乙酰胺
159.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-[3-氯-4-(甲基磺酰基)苯基]乙酰胺
160.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-(3-氟-5-甲氧基苯基)乙酰胺
161.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-(3-氟-5-甲氧基苯基)乙酰胺
162.N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}-N-(3-氟-5-甲氧基苯基)乙酰胺
163.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(3-氟-5-甲氧基苯基)乙酰胺
164.N-{4-[2-(2-氯-6-氟苯基)乙酰氨基]吡啶-2-基}-N-(3-氟-5-甲氧基苯基)乙酰胺
165.N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}-N-[2-(二氟甲基)苯基]乙酰胺
166.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-[2-(二氟甲基)苯基]乙酰胺
167.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-[2-(二氟甲基)苯基]乙酰胺
168.N-{4-[2-(2-氯-6-氟苯基)乙酰氨基]吡啶-2-基}-N-[2-(二氟甲基)苯基]乙酰胺
169.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-[2-(二氟甲基)苯基]乙酰胺
170.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-(2,4-二甲基苯基)乙酰胺
171.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-(2,4-二甲基苯基)乙酰胺
172.N-{4-[2-(2-氯-6-氟苯基)乙酰氨基]吡啶-2-基}-N-(2,4-二甲基苯基)乙酰胺
173.N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}-N-(2,4-二甲基苯基)乙酰胺
174.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(2,4-二甲基苯基)乙酰胺
175.N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-(3-氰基-5-甲基苯基)乙酰胺
176.N-(3-氰基-5-甲基苯基)-N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
177.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-(3-氰基-5-甲基苯基)乙酰胺
178.N-{4-[2-(2-氯-4-氟苯基)乙酰氨基]吡啶-2-基}-N-(3-氰基-5-甲基苯基)乙酰胺
179.N-{4-[2-(2-氯-6-氟苯基)乙酰氨基]吡啶-2-基}-N-(3-氰基-5-甲基苯基)乙酰胺
180.N-(3-氯-4-甲基苯基)-N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
181.N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-(3-氯-4-甲基苯基)乙酰胺
182.N-(3-氯-4-甲基苯基)-N-{4-[2-(2,6-二氯苯基)乙酰氨基]吡啶-2-基}乙酰胺
183.N-{4-[2-(2-氯-6-氟苯基)乙酰氨基]吡啶-2-基}-N-(3-氯-4-甲基苯基)乙酰胺
184.N-{4-[2-(2-氯-6-氟苯基)乙酰氨基]吡啶-2-基}-N-(4-氟-2,3-二甲基苯基)乙酰胺
185.N-{5-[2-(2,6-二氯苯基)乙酰氨基]哒嗪-3-基}-N-苯乙酰胺
186.N-{5-[2-(2-氯-3-氟苯基)乙酰氨基]哒嗪-3-基}-N-苯乙酰胺
187.N-{5-[2-(2-氯苯基)乙酰氨基]哒嗪-3-基}-N-苯乙酰胺
188.N-{5-[2-(2-氯-4-氟苯基)乙酰氨基]哒嗪-3-基}-N-苯乙酰胺
189.N-{5-[2-(2-氯-6-氟苯基)乙酰氨基]哒嗪-3-基}-N-(4-氟苯基)乙酰胺
190.N-{5-[2-(2-氯-4-氟苯基)乙酰氨基]哒嗪-3-基}-N-(4-氟苯基)乙酰胺
191.N-{5-[2-(2-氯-3-氟苯基)乙酰氨基]哒嗪-3-基}-N-(4-氟苯基)乙酰胺
192.N-{5-[2-(2-氯苯基)乙酰氨基]哒嗪-3-基}-N-(4-氟苯基)乙酰胺
193.N-{5-[2-(2,6-二氯苯基)乙酰氨基]哒嗪-3-基}-N-(4-氟苯基)乙酰胺
194.N-{5-[2-(2,6-二氯苯基)乙酰氨基]哒嗪-3-基}-N-(3-氟苯基)乙酰胺
195.N-{5-[2-(2-氯-3-氟苯基)乙酰氨基]哒嗪-3-基}-N-(3-氟苯基)乙酰胺
196.N-{5-[2-(2-氯苯基)乙酰氨基]哒嗪-3-基}-N-(3-氟苯基)乙酰胺
197.N-{5-[2-(2-氯-6-氟苯基)乙酰氨基]哒嗪-3-基}-N-(3-氟苯基)乙酰胺
198.N-{5-[2-(2-氯-4-氟苯基)乙酰氨基]哒嗪-3-基}-N-(3-氟苯基)乙酰胺
199.N-{5-[2-(2-氯苯基)乙酰氨基]哒嗪-3-基}-N-(3,4-二氟苯基)乙酰胺
200.N-{5-[2-(2,6-二氯苯基)乙酰氨基]哒嗪-3-基}-N-(3,4-二氟苯基)乙酰胺
201.N-{5-[2-(2-氯-3-氟苯基)乙酰氨基]哒嗪-3-基}-N-(3,4-二氟苯基)乙酰胺
202.N-{5-[2-(2-氯-4-氟苯基)乙酰氨基]哒嗪-3-基}-N-(3,4-二氟苯基)乙酰胺
203.N-{5-[2-(2-氯-6-氟苯基)乙酰氨基]哒嗪-3-基}-N-(3,4-二氟苯基)乙酰胺
204.N-{5-[2-(2,6-二氯苯基)乙酰氨基]哒嗪-3-基}-N-(3,5-二氟苯基)乙酰胺
205.N-{5-[2-(2-氯苯基)乙酰氨基]哒嗪-3-基}-N-(3,5-二氟苯基)乙酰胺
206.N-{5-[2-(2-氯-3-氟苯基)乙酰氨基]哒嗪-3-基}-N-(3,5-二氟苯基)乙酰胺
207.N-{5-[2-(2-氯-4-氟苯基)乙酰氨基]哒嗪-3-基}-N-(3,5-二氟苯基)乙酰胺
208.N-{5-[2-(2-氯-6-氟苯基)乙酰氨基]哒嗪-3-基}-N-(3,5-二氟苯基)乙酰胺
本发明的通式(I)化合物可根据下列方案1、2和3制备。以下所述的方案和方法说明了本发明的通式(I)化合物的合成途径且并非旨在限制。本领域技术人员清楚的是,如方案1、2和3中所示例的转化顺序可以各种方式修改。因此,这些方案中所示例的转化顺序并非旨在限制。此外,取代基R
方案1描绘了从式(II)的芳族胺和式(III)的合成子开始的合成,其中Hal代表Cl、Br、I或三氟甲磺酸盐(triflate),优选Br;且其中A代表CH。两种起始材料可通过本领域技术人员已知的Pd介导的反应(布赫瓦尔德-哈特维希(Buchwald-Hartwig)偶联)交叉偶联。使用合适的溶剂,如例如N,N-二甲基甲酰胺、1,4-二噁烷或甲苯,并加入碱,例如碳酸钾、磷酸钾、碳酸铯或叔丁醇钾。合适的钯催化剂与合适的膦配体结合被用作催化剂催化剂-配体体系,例如双(二亚苄基丙酮)钯(0)和4,5-双(二苯基膦基)-9,9-二甲基氧杂蒽(Xantphos)。反应在80℃与120℃之间的温度下,优选地在100℃的温度下进行直至完全转化,通常历时18小时。通式(IV)的芳族胺可根据标准方法与羧酸酐(V)或相应的乙酰氯(VI)反应,以得到通式(VII)的酰胺。在使用酸酐(V)例如乙酸酐的情况下,其也可用作溶剂。N,N-二甲基氨基吡啶可用作催化剂(0.1当量)。反应通常在100和130℃之间发生直至完全转化(2至18小时)。在使用酰氯(例如,乙酰氯)的情况下,可使用二氯甲烷作为溶剂,并加入碱,例如三乙胺。经由本领域技术人员已知的方法,例如,通过在合适的催化剂,如钯或铂,例如活性炭负载10% Pd的存在下氢化将通式(VII)化合物中的硝基还原成通式(VIII)化合物的相应氨基。优选地,利用大气氢气压力。使用合适的溶剂,如乙醇、甲醇或乙酸乙酯(其为优选)。或者,使用其他还原方法,最特别的是利用铁粉(5当量)于乙酸中还原。将混合物剧烈搅拌直至完全转化(2至18小时)。通式(VIII)的芳族胺可与通式(IX)的羧酸通过本领域技术人员已知的方法反应,以得到通式(I)的酰胺化合物。该反应是通过利用诸如二环己基碳二亚胺(DCC)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺(EDCI)、N-羟基苯并三唑(HOBT)、N-[(二甲基氨基)-(3H-[1,2,3]三唑并[4,5-b]吡啶-3-基氧基)亚甲基]-N-甲基甲铵六氟磷酸盐(N-[(dimethylamino)-(3H-[1,2,3]triazolo[4,5-b]pyridin-3-yloxy)methyliden]-N-methylmethanaminium hexafluorophosphate)(HATU)或丙基磷酸酐(T3P)的试剂将通式(IX)的羧酸活化来介导。例如,与HATU或T3P的反应在惰性溶剂,诸如N,N-二甲基甲酰胺、二氯甲烷或二甲亚砜中在合适的通式(VIII)的芳族胺和叔胺(诸如三乙胺或二异丙基乙胺)的存在下在-30℃和+80℃之间的温度下进行。
方案1(A=CH)
/>
其中A为CH且R
作为替代,方案1中所述的第一步也可使用通式(X)的芳族卤化物和通式(XI)的合成子进行(方案2)。
方案2(A为CH)
其中A为CH且R
可视情况改变合成步骤的顺序。
例如,在A=N的情况下,如方案3中所概述的进行该步骤。化合物(XII)用作起始材料。首先,使用(IX)型的羧酸进行酰胺偶联,然后进行Pd催化的与通式(II)的芳族胺的交叉偶联,以及与(VI)型的酰氯的酰化。
方案3-(A为N)
其中A为N且R
化合物(II)、(III)、(V)、(VI)、(IX)、(X)和(XI)为可商购的或可根据如本领域技术人员理解的公知领域可得的方法制备。具体实例描述于实验部分中。
合成通式(I)化合物的替代方法描述于方案3A中。
方案3A-(A为CH)
此合成从式(II)的芳族胺和式(XII)的合成子开始,其中Hal代表Cl、Br、I或三氟甲磺酸盐,优选Cl;且其中A代表CH。两种起始材料可通过在盐酸(1当量)的存在下在较高沸点溶剂中,优选地在环丁砜中加热(60℃至130℃,10至20小时,通常130℃,持续18小时)来偶联。或者,也可通过本领域技术人员已知的通过Pd介导的反应进行交叉偶联(布赫瓦尔德-哈特维希偶联)。
通式(XV)的芳族胺可与通式(IX)的羧酸通过本领域技术人员已知的方法反应,以得到通式(XIV)的酰胺化合物。特别地,偶联可通过利用1,1'-羰基二咪唑(1.0至1.5当量)在优选地N,N-二甲基乙酰胺作为溶剂中活化来进行。反应混合物通常在室温与80℃之间的温度(通常40℃)下搅拌10小时至24小时(通常18小时)。
通式(XIV)的芳族胺可根据标准方法与羧酸酐(V)或相应的酰氯(VI)反应,以得到通式(I)的酰胺。在使用酸酐(V),例如乙酸酐的情况下,其也可用作溶剂。可使用N,N-二甲基氨基吡啶作为催化剂(0.1当量)。反应通常在100与130℃之间发生直至完全转化(2至18小时)。在使用酰氯(例如乙酰氯)的情况下,可使用二氯甲烷或更优选地,外消旋-2-甲基四氢呋喃作为溶剂。加入碱,例如三乙胺或N,N-二异丙基乙胺(1至2当量,通常1.4当量)。转化通常在室温在1至24小时内,通常在18小时内发生。
特别地,本发明涵盖通式(VII)和(VIII)的中间体化合物:
其中A、R
本发明的通式(VII)的中间体化合物特别是:
39.N-(3,4-二氟苯基)-N-(4-硝基吡啶-2-基)乙酰胺
40.N-[3-(二氟甲基)苯基]-N-(4-硝基吡啶-2-基)乙酰胺
41.N-(4-硝基吡啶-2-基)-N-[3-(三氟甲基)苯基]乙酰胺
42.N-[4-氰基-3-(三氟甲基)苯基]-N-(4-硝基吡啶-2-基)乙酰胺
43.N-(3-氰基苯基)-N-(4-硝基吡啶-2-基)乙酰胺
44.N-(4-氯-3-氰基苯基)-N-(4-硝基吡啶-2-基)乙酰胺
45.N-(3-氰基-4-氟苯基)-N-(4-硝基吡啶-2-基)乙酰胺
46.N-(4-硝基吡啶-2-基)-N-苯乙酰胺
47.N-(4-氟苯基)-N-(4-硝基吡啶-2-基)乙酰胺
48.N-(4-甲基苯基)-N-(4-硝基吡啶-2-基)乙酰胺
49.N-[4-(二氟甲氧基)苯基]-N-(4-硝基吡啶-2-基)乙酰胺
50.N-(3-氯-4-氟苯基)-N-(4-硝基吡啶-2-基)乙酰胺
51.N-(3-氟苯基)-N-(4-硝基吡啶-2-基)乙酰胺
52.N-(4-氯-3-氟苯基)-N-(4-硝基吡啶-2-基)乙酰胺
53.N-(3-氟-4-甲氧基苯基)-N-(4-硝基吡啶-2-基)乙酰胺
54.N-[3-氟-4-(甲基磺酰基)苯基]-N-(4-硝基吡啶-2-基)乙酰胺
55.N-(3,5-二氟苯基)-N-(4-硝基吡啶-2-基)乙酰胺
56.N-(3,5-二氟-4-甲基苯基)-N-(4-硝基吡啶-2-基)乙酰胺
57.N-(3,5-二氟-4-甲氧基苯基)-N-(4-硝基吡啶-2-基)乙酰胺
58.N-(3-甲氧基苯基)-N-(4-硝基吡啶-2-基)乙酰胺
59.N-(4-硝基吡啶-2-基)-N-[3-(三氟甲氧基)苯基]乙酰胺
60.N-(4-氟-3-甲氧基苯基)-N-(4-硝基吡啶-2-基)乙酰胺
61.N-(2-氯苯基)-N-(4-硝基吡啶-2-基)乙酰胺
62.N-(2-氯-5-氟苯基)-N-(4-硝基吡啶-2-基)乙酰胺
63.N-(2-氟苯基)-N-(4-硝基吡啶-2-基)乙酰胺
64.N-[2-氟-4-(三氟甲基)苯基]-N-(4-硝基吡啶-2-基)乙酰胺
65.N-(2,3-二氟苯基)-N-(4-硝基吡啶-2-基)乙酰胺
66.N-(2,4-二氟苯基)-N-(4-硝基吡啶-2-基)乙酰胺
67.N-(3-氯苯基)-N-(4-硝基吡啶-2-基)乙酰胺
68.N-(3-氯-5-氟苯基)-N-(4-硝基吡啶-2-基)乙酰胺
69.N-(3-氰基-5-氟苯基)-N-(4-硝基吡啶-2-基)乙酰胺
70.N-(2-氯-4-氟苯基)-N-(4-硝基吡啶-2-基)乙酰胺
71.N-[3-氯-4-(甲基磺酰基)苯基]-N-(4-硝基吡啶-2-基)乙酰胺
72.N-(3-氟-5-甲氧基苯基)-N-(4-硝基吡啶-2-基)乙酰胺
73.N-[2-(二氟甲基)苯基]-N-(4-硝基吡啶-2-基)乙酰胺
74.N-(2,4-二甲基苯基)-N-(4-硝基吡啶-2-基)乙酰胺
75.N-(3-氰基-5-甲基苯基)-N-(4-硝基吡啶-2-基)乙酰胺
76.N-(4-氟-2,3-二甲基苯基)-N-(4-硝基吡啶-2-基)乙酰胺
77.N-(3-氯-4-甲基苯基)-N-(4-硝基吡啶-2-基)乙酰胺
78.N-(4-氟苯基)-N-(4-硝基吡啶-2-基)丁酰胺
此外,通式(VIII)的中间体化合物为:
79.N-(4-氨基吡啶-2-基)-N-(3,4-二氟苯基)乙酰胺
80.N-(4-氨基吡啶-2-基)-N-(4-氟苯基)乙酰胺
81.N-(4-氨基吡啶-2-基)-N-[3-(二氟甲基)苯基]乙酰胺
82.N-(4-氨基吡啶-2-基)-N-[3-(三氟甲基)苯基]乙酰胺
83.N-(4-氨基吡啶-2-基)-N-[4-氰基-3-(三氟甲基)苯基]乙酰胺
84.N-(4-氨基吡啶-2-基)-N-(3-氰基苯基)乙酰胺
85.N-(4-氨基吡啶-2-基)-N-(4-氯-3-氰基苯基)乙酰胺
86.N-(4-氨基吡啶-2-基)-N-(3-氰基-4-氟苯基)乙酰胺
87.N-(4-氨基吡啶-2-基)-N-苯乙酰胺
88.N-(4-氨基吡啶-2-基)-N-(4-甲基苯基)乙酰胺
89.N-(4-氨基吡啶-2-基)-N-[4-(二氟甲氧基)苯基]乙酰胺
90.N-(4-氨基吡啶-2-基)-N-(3-氯-4-氟苯基)乙酰胺
91.N-(4-氨基吡啶-2-基)-N-(3-氟苯基)乙酰胺
92.N-(4-氨基吡啶-2-基)-N-(4-氯-3-氟苯基)乙酰胺
93.N-(4-氨基吡啶-2-基)-N-(3-氟-4-甲氧基苯基)乙酰胺
94.N-(4-氨基吡啶-2-基)-N-[3-氟-4-(甲基磺酰基)苯基]乙酰胺
95.N-(4-氨基吡啶-2-基)-N-(3,5-二氟苯基)乙酰胺
96.N-(4-氨基吡啶-2-基)-N-(3,5-二氟-4-甲基苯基)乙酰胺
97.N-(4-氨基吡啶-2-基)-N-(3,5-二氟-4-甲氧基苯基)乙酰胺
98.N-(4-氨基吡啶-2-基)-N-(3-甲氧基苯基)乙酰胺
99.N-(4-氨基吡啶-2-基)-N-[3-(三氟甲氧基)苯基]乙酰胺
100.N-(4-氨基吡啶-2-基)-N-(4-氟-3-甲氧基苯基)乙酰胺
101.N-(4-氨基吡啶-2-基)-N-(2-氯苯基)乙酰胺
102.N-(4-氨基吡啶-2-基)-N-(2-氯-5-氟苯基)乙酰胺
103.N-(4-氨基吡啶-2-基)-N-(2-氟苯基)乙酰胺
104.N-(4-氨基吡啶-2-基)-N-[2-氟-4-(三氟甲基)苯基]乙酰胺
105.N-(4-氨基吡啶-2-基)-N-(2,3-二氟苯基)乙酰胺
106.N-(4-氨基吡啶-2-基)-N-(2,4-二氟苯基)乙酰胺
107.N-(4-氨基吡啶-2-基)-N-(3-氯苯基)乙酰胺
108.N-(4-氨基吡啶-2-基)-N-(3-氯-5-氟苯基)乙酰胺
109.N-(4-氨基吡啶-2-基)-N-(3-氰基-5-氟苯基)乙酰胺
110.N-(4-氨基吡啶-2-基)-N-(2-氯-4-氟苯基)乙酰胺
111.N-(4-氨基吡啶-2-基)-N-[3-氯-4-(甲基磺酰基)苯基]乙酰胺
112.N-(4-氨基吡啶-2-基)-N-(3-氟-5-甲氧基苯基)乙酰胺
113.N-(4-氨基吡啶-2-基)-N-[2-(二氟甲基)苯基]乙酰胺
114.N-(4-氨基吡啶-2-基)-N-(2,4-二甲基苯基)乙酰胺
115.N-(4-氨基吡啶-2-基)-N-(3-氰基-5-甲基苯基)乙酰胺
116.N-(4-氨基吡啶-2-基)-N-(3-氯-4-甲基苯基)乙酰胺
117.N-(4-氨基吡啶-2-基)-N-(4-氟苯基)丁酰胺
特别地,本发明涵盖了通式(XIII)的中间体化合物:
其中A、R
根据本发明的通式(XIII)的中间体化合物特别是:
118.N-(6-氯哒嗪-4-基)-2-(2,6-二氯苯基)乙酰胺
119.2-(2-氯-3-氟苯基)-N-(6-氯哒嗪-4-基)乙酰胺
120.2-(2-氯苯基)-N-(6-氯哒嗪-4-基)乙酰胺
121.2-(2-氯-4-氟苯基)-N-(6-氯哒嗪-4-基)乙酰胺
122.2-(2-氯-6-氟苯基)-N-(6-氯哒嗪-4-基)乙酰胺
特别地,本发明涵盖了通式(XIV)的中间体化合物:
其中A、R
根据本发明的通式(XIV)的中间体化合物特别是:
123.N-(6-苯氨基哒嗪-4-基)-2-(2,6-二氯苯基)乙酰胺
124.N-(6-苯氨基哒嗪-4-基)-2-(2-氯-3-氟苯基)乙酰胺
125.N-(6-苯氨基哒嗪-4-基)-2-(2-氯苯基)乙酰胺
126.N-(6-苯氨基哒嗪-4-基)-2-(2-氯-4-氟苯基)乙酰胺
127.2-(2-氯-6-氟苯基)-N-[6-(4-氟苯氨基)哒嗪-4-基]乙酰胺
128.2-(2-氯-4-氟苯基)-N-[6-(4-氟苯氨基)哒嗪-4-基]乙酰胺
129.2-(2-氯-3-氟苯基)-N-[6-(4-氟苯氨基)哒嗪-4-基]乙酰胺
130.2-(2-氯苯基)-N-[6-(4-氟苯氨基)哒嗪-4-基]乙酰胺
131.2-(2,6-二氯苯基)-N-[6-(4-氟苯氨基)哒嗪-4-基]乙酰胺
132.2-(2,6-二氯苯基)-N-[6-(3-氟苯氨基)哒嗪-4-基]乙酰胺
133.2-(2-氯-3-氟苯基)-N-[6-(3-氟苯氨基)哒嗪-4-基]乙酰胺
134.2-(2-氯苯基)-N-[6-(3-氟苯氨基)哒嗪-4-基]乙酰胺
135.2-(2-氯-6-氟苯基)-N-[6-(3-氟苯氨基)哒嗪-4-基]乙酰胺
136.2-(2-氯-4-氟苯基)-N-[6-(3-氟苯氨基)哒嗪-4-基]乙酰胺
137.2-(2-氯苯基)-N-[6-(3,4-二氟苯氨基)哒嗪-4-基]乙酰胺
138.2-(2,6-二氯苯基)-N-[6-(3,4-二氟苯氨基)哒嗪-4-基]乙酰胺
139.2-(2-氯-3-氟苯基)-N-[6-(3,4-二氟苯氨基)哒嗪-4-基]乙酰胺
140.2-(2-氯-4-氟苯基)-N-[6-(3,4-二氟苯氨基)哒嗪-4-基]乙酰胺
141.2-(2-氯-6-氟苯基)-N-[6-(3,4-二氟苯氨基)哒嗪-4-基]乙酰胺
142.2-(2,6-二氯苯基)-N-[6-(3,5-二氟苯氨基)哒嗪-4-基]乙酰胺
143.2-(2-氯苯基)-N-[6-(3,5-二氟苯氨基)哒嗪-4-基]乙酰胺
144.2-(2-氯-3-氟苯基)-N-[6-(3,5-二氟苯氨基)哒嗪-4-基]乙酰胺
145.2-(2-氯-4-氟苯基)-N-[6-(3,5-二氟苯氨基)哒嗪-4-基]乙酰胺
146.2-(2-氯-6-氟苯基)-N-[6-(3,5-二氟苯氨基)哒嗪-4-基]乙酰胺
148.2-(2-氯-3-氟苯基)-N-[2-(4-氟苯氨基)吡啶-4-基]乙酰胺
根据另一方面,本发明涵盖所述中间体化合物用于制备如上所定义的通式(I)化合物的用途。
本发明的通式(I)化合物可通过本领域技术人员已知的任何方法转化成任何盐,更特别地是药学上可接受的盐,如本文中所定义。类似地,本发明的通式(I)化合物的任何盐可通过本领域技术人员已知的任何方法转化成游离化合物。
本发明的化合物用于制造药剂。
本发明的通式(I)的化合物展示了不可预测的有价值的药理学作用谱。已出人意料地发现,本发明化合物作为拮抗剂或负变构调节剂可有效抑制P2X4,因此所述化合物可用于治疗或预防疾病。
可利用本发明化合物抑制、拮抗、负变构调节等P2X4受体。此方法包括向有需要的哺乳动物(包括人类)施用一定量的本发明化合物或其药学上可接受的盐、异构体、多晶型物、代谢物、水合物、溶剂化物或酯;其有效治疗病症。
本发明也提供治疗下列综合征、疾病或病症的方法:
·泌尿生殖器、胃肠、呼吸、增生性和疼痛相关疾病、病况和病症;
·妇科疾病,包括原发性和继发性痛经、性交疼痛、外阴痛、子宫内膜异位症和子宫腺肌症;子宫内膜异位症相关疼痛;子宫内膜异位症相关的症状,其中所述症状特别是腹痛、痛经、性交疼痛、排尿困难、大便困难或盆腔过敏;
·尿道疾病状态,包括与膀胱出口梗阻相关的那些;膀胱过度活动症或膀胱炎、间质性膀胱炎、膀胱疼痛综合征、尿失禁病况(诸如减少的膀胱容量、增加的排尿频率、急迫性尿失禁、压力性尿失禁或膀胱高反应性);良性前列腺肥大;前列腺增生;前列腺炎;逼尿肌反射亢进;膀胱过度活动症和与膀胱过度活动症相关的症状,其中所述症状特别是增加的泌尿频率、夜尿症、尿急或急迫性尿失禁;盆腔过敏;尿道炎;前列腺炎;前列腺痛;膀胱炎,特别地间质性膀胱炎;特发性膀胱过敏症;肾病,如高前列腺素E综合征、经典巴特(Bartter)综合征;
·癫痫,部分和全身性癫痫发作;
·呼吸病症,包括哮喘、慢性阻塞性肺病、肺纤维化、间质性肺纤维化、支气管痉挛、慢性咳嗽、难治性慢性咳嗽、特发性慢性咳嗽;
·胃肠病症,包括肠易激综合征(IBS)、炎性肠病(IBD)、胆绞痛和其他胆病症、肾绞痛、腹泻型IBS;胃食道逆流、胃肠扩张(gastrointestinal distension)、克罗恩氏病(Crohn’s disease)等;
·脂肪肝病症,特别是NASH(非酒精性脂肪性肝炎);纤维化疾病,包括肺纤维化、心脏纤维化、肾纤维化和其他器官的纤维化;代谢综合征,包括例如胰岛素抗性、高血压、难治性高血压、异常脂蛋白血症和肥胖症、糖尿病(特别地II型糖尿病)、心肌梗塞;动脉粥样硬化;脂质病症;
·神经退化性病症,诸如阿兹海默氏病(Alzheimer's disease)、帕金森氏病(Parkinson’s disease)、中风、脑缺血、缺血性脑损伤、缺血性中风(IS)、出血性中风、外伤性脑损伤、脊髓损伤;
·慢性瘙痒、瘙痒;
·伤口愈合、受损的伤口愈合;
·心脏病症,包括缺血性再输注损伤、心脏缺血;
·关节炎、慢性关节炎、幼年型关节炎、骨关节炎、类风湿性关节炎、幼年型类风湿性关节炎、强直性脊柱炎和相关神经痛,以及骨骼疾病,如关节退化、痛风和急性痛风、血友病性关节病(Burnstock等人,2012Pharmacol Rev.64:834-868)。
本发明也提供治疗下列疼痛综合征、疾病或病症的方法:
·疼痛相关综合征、疾病或病症,包括痛觉过敏、触摸痛、急性和慢性炎性和神经性疼痛、腹痛(诸如功能性肠病、肠易激综合征、炎性肠病)、膀胱疼痛综合征、炎性疼痛、下背疼痛、手术性疼痛、内脏疼痛、牙痛、牙周炎、经前疼痛、子宫内膜异位症相关疼痛、与纤维化疾病相关疼痛、中枢性疼痛;
·由于灼口综合征的疼痛、由于烧伤的疼痛;
·由于偏头痛的疼痛(急性和预防性治疗)、丛集性头痛,由于神经损伤、创伤性神经损伤、创伤后损伤(包括骨折和运动损伤)的疼痛;
·由于神经炎的疼痛、神经痛;
·由于中毒的疼痛;
·由于缺血性损伤的疼痛;
·由于间质性膀胱炎的疼痛;
·癌症疼痛、癌症恶液质、由于病毒、寄生虫或细菌感染的疼痛;
·由于创伤性神经损伤的疼痛、由于创伤后损伤(包括骨折和运动损伤)的疼痛、由于三叉神经痛的疼痛、与小纤维神经病变相关的疼痛、与糖尿病性神经病相关的疼痛、疱疹后神经痛、慢性下背疼痛、颈痛、幻肢疼痛、骨盆疼痛综合征、慢性骨盆疼痛、神经瘤疼痛、复杂性区域疼痛综合征、纤维肌痛、肌筋膜病症、与胃肠扩张相关的疼痛、慢性关节炎疼痛和相关神经痛;
·与癌症相关的疼痛、吗啡抗性疼痛、与化学治疗、HIV和HIV治疗诱导的神经病变相关的疼痛。
所述疼痛可为轻度疼痛、中度疼痛、重度疼痛、肌肉骨骼疼痛,特别地急性、亚急性和慢性肌肉骨骼疼痛综合征,诸如滑囊炎、烧伤、损伤和外科手术(手术后疼痛)和牙科手术后的疼痛以及手术性疼痛的先发治疗、复杂性区域疼痛综合征、神经性疼痛、背痛(诸如急性内脏疼痛)、神经病变、急性创伤、化学治疗诱导的单一神经病变疼痛状态、多神经病变疼痛状态(诸如糖尿病性外周神经病变和/或化学治疗诱导的神经病变)、自主神经病变疼痛状态、外周神经系统(PNS)病灶或中枢神经系统(CNS)病灶或疾病相关疼痛状态、子宫颈、腰椎或坐骨神经痛型的多神经根病变、马尾综合征、梨状肌综合征、截瘫、四肢麻痹、为各种感染的基础的与各种多发性神经炎病况有关的疼痛状态、化学损伤、辐射暴露、基础疾病或缺陷性病况(诸如脚气病、维生素缺乏、甲状腺功能减退、卟啉症、癌症、自身免疫病(诸如多发性硬化和脊髓损伤)、缺血、神经退化、中风、中风后疼痛、炎性病症、食道炎、胃食道逆流病症(GERD)、盆腔过敏、膀胱炎、胃溃疡、十二指肠溃疡)、肌肉疼痛、由于疝气痛的疼痛和牵涉性疼痛。
因此,期望本发明的化合物可用于治疗炎症。术语“炎症”还应理解为包含任何炎性疾病、病症或病况本身,具有与其相关的炎性组分的任何病况,和/或特征在于以炎症为症状的任何病况,尤其包括急性、慢性、溃疡性、纤维化、过敏性和自身免疫病、病原体感染、由于过敏症的免疫反应、进入异物、物理损伤、坏死、子宫内膜异位症和本领域技术人员已知的炎症的其他形式。
根据本发明的化合物可用于减轻各种病况的疼痛、发热和炎症,包括风湿热、与流感或其他病毒感染相关的症状、感冒、牙痛、扭伤和拉伤、肌炎、滑膜炎。
本发明的化合物也可用于治疗病毒感染(例如,流感、感冒、带状疱疹、C型肝炎和HIV)、细菌感染、真菌感染、外科或牙科手术、恶性肿瘤(例如,黑色素瘤、乳腺癌、结肠癌、肺癌和前列腺癌)、风湿热、霍奇金氏病(Hodgkin's disease)、全身性红斑狼疮、血管炎、胰脏炎、肾炎、滑囊炎、伤口愈合、受损的伤口愈合、皮肤炎、湿疹、糖尿病、自身免疫病、过敏性病症、鼻炎、溃疡、轻度至中度活动性溃疡性结肠炎、家族性腺瘤息肉病、冠心病、结节病和具有炎性组分的任何其他疾病。
还期望本发明的化合物可用于治疗受试者中与骨损失相关的病况或引起骨损失的病况。在这一点上可提及的病况包括骨质疏松症、佩吉特氏病(Paget's disease)和/或牙周病。
这些病症已在人类中得到良好的表征,而且在其他哺乳动物中也存在类似的病因,并且可通过施用本发明的药物组合物来治疗。
如本文中所用的术语“治疗(treating/treatment)”按惯例使用,如为了对抗、缓解、减少、减轻、改善疾病或病症(诸如上述那些)的状况的目的而管理或护理受试者。
本发明的化合物特别地可用于下列综合征、疾病或病症的疗法和防范(prevention)(即预防(prophylaxis)):
-疼痛、疼痛综合征(急性和慢性)、炎症诱发的疼痛、神经性疼痛(包括糖尿病性神经性疼痛和糖尿病性神经病)、癌症相关疼痛、化学治疗或中毒诱发的疼痛、盆腔痛、子宫内膜异位症相关疼痛以及子宫内膜异位症本身、膀胱疼痛综合征;
-肺病和呼吸病症,特别是哮喘、闭塞性细支气管炎综合征、COPD、慢性咳嗽、杯状细胞和肺纤维化相关疾病、肝病(特别是肝纤维化)、脂肪肝病症、NASH(非酒精性脂肪性肝炎);
-脑缺血、缺血性脑损伤、缺血性中风(IS)、出血性中风、外伤性脑损伤、脊髓损伤、动脉瘤;
-慢性瘙痒、瘙痒;
-骨关节炎、灼口综合征、偏头痛病症、肠易激综合征;
-泌尿外科学相关综合征,如膀胱过度活动症、间质性膀胱炎、膀胱疼痛综合征。
根据另一方面,本发明涵盖如上所述的通式(I)化合物,或其立体异构体、互变异构体、N-氧化物、水合物、溶剂化物及盐,特别是其药学上可接受的盐,或其混合物,其用于治疗或预防疾病,特别是上述疾病。
本发明化合物的药物活性可通过其作为抑制剂拮抗和/或负变构调节P2X4受体的活性来解释。
根据另一方面,本发明涵盖如上所述的通式(I)化合物,或其立体异构体、互变异构体、N-氧化物、水合物、溶剂化物及盐,特别地其药学上可接受的盐,或其混合物用于治疗或预防疾病,特别是上述疾病的用途。
根据另一方面,本发明涵盖如上所述的通式(I)化合物,或其立体异构体、互变异构体、N-氧化物、水合物、溶剂化物及盐,特别地其药学上可接受的盐,或其混合物在治疗或预防疾病,特别是上述疾病的方法中的用途。
根据另一方面,本发明涵盖如上所述的通式(I)化合物,或其立体异构体、互变异构体、N-氧化物、水合物、溶剂化物及盐,特别地其药学上可接受的盐,或其混合物用于制备用于预防或治疗疾病,特别是上述疾病的药物组合物,优选药剂的用途。
根据另一方面,本发明涵盖一种使用有效量的如上所述的通式(I)化合物,或其立体异构体、互变异构体、N-氧化物、水合物、溶剂化物及盐,特别地其药学上可接受的盐,或其混合物治疗或预防疾病,特别是上述疾病的方法。
根据另一方面,本发明涵盖药物组合物,特别地药剂,其包含如上所述的通式(I)化合物,或其立体异构体、互变异构体、N-氧化物、水合物、溶剂化物、盐(特别地药学上可接受的盐),或其混合物,和一种或多种赋形剂,特别是一种或多种药学上可接受的赋形剂。可以使用用于制备呈适当剂型的这种药物组合物的常规方法。
本发明还涵盖药物组合物,特别是药剂,其包含至少一种本发明的化合物,其通常与一种或多种药学上合适的赋形剂一起,以及它们用于上述目的的用途。
本发明的化合物可具有全身和/或局部活性。为此目的,它们可以以合适方式给药,例如通过口服、肠道外、肺、鼻、舌下、舌、口腔、直肠、阴道、皮肤、透皮、结膜、经耳途径或作为植入物或支架。
对于这些给药途径,本发明的化合物可以以合适的给药形式给药。
对于口服给药,可将本发明的化合物配制成本领域中已知的快速地和/或以改进的方式递送本发明的化合物的剂型,例如片剂(未包衣的或包衣的片剂,例如具有延迟溶解或不溶的肠溶包衣或控释包衣)、口腔崩解片剂、膜/薄片(wafer)、膜/冻干物(lyophylisate)、胶囊(例如硬明胶胶囊或软明胶胶囊)、糖衣片剂、颗粒剂、丸剂、粉剂、乳剂、混悬剂、气溶胶或溶液剂。可将本发明化合物以结晶和/或无定形(amorphised)和/或溶解形式掺入到所述剂型中。
肠胃外给药可在避免吸收步骤的情况下(例如静脉内、动脉内、心脏内、脊柱内或腰内(intralumbal))或在包括吸收的情况下(例如肌内、皮下、皮内、经皮或腹膜内)来进行。适用于肠胃外给药的给药形式尤其是以溶液、悬浮液、乳液、冻干物或无菌粉剂形式的注射和输注制剂。
适合于其他给药途径的实例为用于吸入的药物形式[尤其是粉末吸入剂、喷雾剂]、滴鼻剂、鼻用溶液、鼻用喷雾剂;用于舌、舌下或口腔给药的片剂/膜/薄片/胶囊;栓剂;滴眼剂、眼膏剂、洗眼液(eye bath)、眼用嵌入剂(ocular inserts)、滴耳剂、耳喷雾剂、耳粉剂、洗耳剂(ear-rinse)、耳塞(ear tampon);阴道胶囊、水性悬浮剂(洗剂、振荡混合物(mixturae agitandae))、亲脂悬浮剂、乳剂、软膏剂、霜剂、经皮治疗系统(例如贴剂)、乳液(milk)、糊剂、泡沫剂、撒布剂(dusting powder)、植入物或支架。
可将本发明化合物掺入到所述给药形式中。这可以本身已知的方式通过与药学上合适的赋形剂混合来实现。药学上合适的赋形剂尤其包括以下物质:
·填料和载体(例如纤维素、微晶纤维素(例如
·软膏基质(例如凡士林、石蜡、甘油三酯、蜡、羊毛蜡、羊毛蜡醇、羊毛脂、亲水性软膏、聚乙二醇);
·用于栓剂的基质(例如聚乙二醇、可可脂、硬脂);
·溶剂(例如水、乙醇、异丙醇、甘油、丙二醇、中链甘油三酯脂肪油、液体聚乙二醇、石蜡);
·表面活性剂、乳化剂、分散剂或润湿剂(例如十二烷基硫酸钠)、卵磷脂、磷脂、脂肪醇(例如
·缓冲剂,酸和碱(例如磷酸盐、碳酸盐、柠檬酸、乙酸、盐酸、氢氧化钠溶液、碳酸铵、氨丁三醇、三乙醇胺);
·等渗剂(例如葡萄糖、氯化钠);
·吸附剂(例如高分散二氧化硅);
·增粘剂、凝胶形成剂、增稠剂和/或粘合剂(例如聚乙烯吡咯烷酮、甲基纤维素、羟丙基甲基纤维素、羟丙基纤维素、羧甲基纤维素钠、淀粉、卡波姆(carbomer)、聚丙烯酸(例如
·崩解剂(例如改性淀粉、羧甲基纤维素钠、羧基乙酸淀粉钠(例如
·流动调节剂、润滑剂、助流剂和脱模剂(例如硬脂酸镁、硬脂酸、滑石、高分散二氧化硅(例如
·包衣材料(例如糖、虫胶)和快速地或以改性方式溶解的用于膜或扩散膜的成膜剂(例如聚乙烯吡咯烷酮(例如
·胶囊材料(例如明胶、羟丙基甲基纤维素);
·合成聚合物(例如聚丙交酯、聚乙交酯、聚丙烯酸酯、聚甲基丙烯酸酯(例如
·增塑剂(例如聚乙二醇、丙二醇、甘油、三醋精、柠檬酸三乙酰、邻苯二甲酸二丁酯);
·渗透促进剂;
·稳定剂(例如抗氧化剂,例如抗坏血酸、抗坏血酸棕榈酸酯、抗坏血酸钠、丁基羟基苯甲醚、丁基羟基甲苯、没食子酸丙酯);
·防腐剂(例如对羟基苯甲酸酯、山梨酸、硫柳汞、苯扎氯铵、乙酸氯己定、苯甲酸钠);
·着色剂(例如无机颜料,例如氧化铁、二氧化钛);
·调味剂、甜味剂、味道掩蔽剂和/或气味掩蔽剂。
本发明还涉及一种药物组合物,其包含至少一种本发明的化合物,其通常与一种或多种药学上合适的赋形剂一起,并且涉及它们根据本发明的用途。
本发明的化合物可作为单独药物试剂或与一种或多种其他药物活性成分结合施用,其中该结合不会引起不可接受的副作用。本发明也涵盖此类药物结合物。
基于已知的用于评估可用于治疗和防范(prevention)(即预防(prophylaxis))上述综合征、疾病或病症的化合物的标准实验室技术,通过标准毒性检验以及通过用于确定对哺乳动物中上述病况的治疗的标准药理学试验,并通过将这些结果与用于治疗这些病症的已知活性成分或药剂的结果进行比较,可以容易地确定本发明化合物用于治疗每种所期望的适应症的有效剂量。根据诸如所使用的具体化合物和剂量单位、给药方式、疗程、所治疗患者的年龄和性别以及所治疗病症的性质和程度的考虑因素,在治疗这些病况之一中活性成分的给药量可以在很大程度上改变。
待给予的活性成分的总量通常在每天约0.001mg/kg至约200mg/kg体重,优选每天约0.01mg/kg至约20mg/kg体重。临床上可用的给药方案在每天给药一至三次至每四周给药一次的范围内。此外,其中在一段时间内不给患者药物的“休药期”,可有益于药理学效果和耐受性之间的综合平衡。单位剂量可含有约0.5mg至约1500mg的活性成分,并且可以每天给药一次或多次,或少于每天一次。通过注射给药(包括静脉内、肌内、皮下和肠胃外注射以及使用输注技术)的平均日剂量,将优选为0.01至200mg/kg总体重。直肠给药方案的平均日剂量将优选为0.01至200mg/kg总体重。阴道给药方案的平均日剂量将优选为0.01至200mg/kg总体重。局部给药方案的平均日剂量将优选为0.1至200mg,每天给药一至四次。透皮浓度优选为维持0.01至200mg/kg的日剂量所需的浓度。吸入给药方案的平均日剂量将优选为0.01至100mg/kg总体重。
当然,每名患者的具体初始和后续给药方案将随主治诊断医师所确定的病症的性质和严重程度、所用具体化合物的活性、患者的年龄和一般状况、给药时间、给药途径、药物的排泄率、药物结合物等等而变化。本发明化合物或其药学上可接受的盐或酯或其组合物的所需的治疗模式和给药次数,可以由本领域技术人员通过常规的治疗试验来确定。
实验部分
NMR峰形式是按照它们在光谱中出现的形式说明的,尚未考虑可能的更高阶的效应。化学位移以ppm为单位给出;将所有光谱校准至溶剂残留峰。积分以整数给出。
或者,所选化合物的
尖锐信号的强度与打印的NMR谱中的信号高度(以cm计)有关。当与其他信号比较时,该数据可以与信号强度的实际比例相关。在宽信号的情况下,显示多于一个峰或信号中心以及它们与光谱中显示的最强信号相比的相对强度。
使用ACD/Labs的ACD/Name软件生成化学名称。在某些情况下,使用市售试剂的普遍接受的名称代替ACD/Name生成的名称。
下表1列出了本段和实施例部分中使用的缩写,只要它们没有在正文中进行解释。其他缩写具有对技术人员而言其本身惯用的含义。
表1:缩写
下表列出本文中所用的缩写。
/>
/>
其他缩写具有对技术人员而言其本身惯用的含义。
本申请中描述的本发明的各个方面通过下列实施例进行说明,所述实施例不意指以任何方式限制本发明。
本文中所述的实施例测试实验用于说明本发明且本发明不限于给定的实施例。
所有未在实验部分中描述其合成的试剂均可商购获得,或为已知化合物或可由本领域技术人员通过已知方法从已知化合物形成。
根据本发明的方法制备的化合物和中间体可能需要纯化。有机化合物的纯化是本领域技术人员所公知的,并且可能存在多种纯化相同化合物的方法。在一些情况下,可以不需要纯化。在一些情况下,所述化合物可以通过结晶来纯化。在一些情况下,可以利用合适的溶剂将杂质搅拌出来。在一些情况下,所述化合物可以通过色谱法,特别是快速柱色谱法进行纯化,使用例如预装填硅胶柱(cartidge),例如Biotage SNAP柱
在一些情况下,如上所述的纯化方法可提供呈盐形式的那些具有足够碱性或酸性官能度的本发明的那些化合物,例如,在足够碱性的本发明的化合物的情况下,例如三氟乙酸盐或甲酸盐,或者在足够酸性的本发明的化合物的情况下,例如铵盐。该类型的盐可以通过本领域技术人员已知的各种方法分别转化为其游离碱或游离酸形式,或者作为盐用于随后的生物测定中。应当理解,如分离和如本文所述的本发明的化合物的具体形式(例如盐、游离碱等)不必是唯一形式,其中所述化合物可以应用于生物测定以量化具体生物学活性。
UPLC-MS标准方法
如下所述进行分析型UPLC-MS。除非指定负模式(ESI-),否则从正模式电喷雾电离报告质量(m/z)。在大多数情况下,使用方法1。如果没有使用,则表明。
方法1:
仪器:Waters Acquity UPLCMS SingleQuad;柱:Acquity UPLC BEH C18 1.7μm,50x2.1mm;洗脱剂A:水+0.2体积%氨水溶液(32%),洗脱剂B:乙腈;梯度:0至1.6min 1至99% B,1.6至2.0min 99% B;流速0.8ml/min;温度:60℃;DAD扫描:210至400nm。
方法2:
仪器:Waters Acquity UPLCMS SingleQuad;柱:Acquity UPLC BEH C18 1.7μm,50x2.1mm;洗脱剂A:水+0.1体积%甲酸(99%),洗脱剂B:乙腈;梯度:0至1.6min 1至99%B,1.6至2.0min 99% B;流速0.8ml/min;温度:60℃;DAD扫描:210至400nm。
方法3:
仪器:Waters Acquity Platform ZQ4000;柱:Waters BEHC 18,50mm x 2.1mm,1.7μm;洗脱剂A:水/0.05%甲酸,洗脱剂B:乙腈/0.05%甲酸;梯度:0.0min 98% A→0.2min:98% A→1.7min:10% A→1.9min:10% A→2min:98% A→2.5min:98% A;流速:1.3ml/min;柱温:60℃;UV检测:200至400nm。
实验部分-通用方法
通用方法A:
从芳族酰胺和2-溴-4-硝基吡啶形成双芳基胺(GP A):
将芳族胺(1.0当量)和2-溴-4-硝基吡啶(1.4当量)溶解于甲苯或1,4-二噁烷或DMF(约70当量)中。在惰性气氛(氩气)下,加入双(二亚苄基丙酮)钯(0)(CAS[32005-36-0],0.03当量)、4,5-双-(二苯基膦基)-9,9-二甲基氧杂蒽(Xantphos,CAS[161265-03-8],0.07当量)和碳酸铯(1.6当量),并将混合物在100℃下搅拌约18小时。在冷却至室温后,将催化剂经由硅藻土过滤出并用乙酸乙酯冲洗。将滤液分配在水与乙酸乙酯之间并用乙酸乙酯萃取。将合并的有机层用盐水洗涤,经硫酸钠干燥并在真空中去除溶剂。将粗产物经由色谱法纯化。
通用方法B:
从芳基卤化物和2-氨基-4-硝基-吡啶形成双芳基胺(GP B):
将芳族溴化物(1.0至1.4当量,或者可使用对应碘化物)、4-硝基吡啶-2-胺(1.0当量)和碳酸铯(1.6当量)溶解于1,4-二噁烷或甲苯中。将混合物脱气,并在氩气气氛下,添加双(二亚苄基丙酮)钯(0)(CAS[32005-36-0],0.03当量)和4,5-双-(二苯基膦基)-9,9-二甲基氧杂蒽(Xantphos,CAS[161265-03-8],0.07当量)。将混合物在100℃下搅拌18小时。在冷却至室温后,过滤出固体并用乙酸乙酯冲洗。将滤液分配在水与乙酸乙酯之间并用乙酸乙酯萃取。将合并的有机层用盐水洗涤,经硫酸钠干燥并在真空中去除溶剂。将粗产物经由色谱法纯化。
通用方法C
双芳基胺的酰化(GP C):
将双芳基胺溶解于作为试剂和溶剂的乙酸酐(或各自对应同系物)(约50当量)中,添加4-N,N-二甲基氨基吡啶(0.1当量)并将混合物在110至130℃下搅拌直至完全转化(2至18小时)。在冷却至室温后,将混合物在真空中浓缩至干并经由色谱法直接纯化或进行水性处理。在此情况下,将混合物分配在乙酸乙酯与水之间,用乙酸乙酯萃取,用盐水洗涤,经硫酸钠干燥并在真空中去除溶剂。将粗产物通过色谱法纯化。
通用方法D:
通过催化氢化还原硝基化合物(GP D):
将硝基化合物溶解于乙酸乙酯中并添加钯催化剂(活性炭负载10%Pd,0.1当量Pd)。将混合物脱气并充入氢气并在1atm氢气压力下氢化直至完全转化。然后过滤出催化剂并将滤液浓缩至干燥。可获得产物未经进一步纯化。
通用方法E:
利用铁还原硝基化合物(GP E):
将硝基化合物溶解于乙酸中并添加铁粉(5当量)。将混合物剧烈搅拌2至18小时,直至完全转化。将固体经由硅藻土垫滤出并用乙酸乙酯冲洗。将有机相蒸发至干燥。任选地,将残余物与甲苯共蒸馏若干次直至去除所有乙酸,或将其分配在乙酸乙酯与水之间并添加饱和碳酸氢钠水溶液直至pH>7。分离各相,将水层用乙酸乙酯萃取,将合并的有机层用饱和碳酸氢钠水溶液和盐水洗涤并经硫酸钠干燥。在真空中去除溶剂,产物未经进一步纯化即用于下一步骤。
通用方法F:
氨基-哒嗪的酰化(GP F):
将6-氯-4-氨基哒嗪和羧酸(1至2当量)溶解于DMF中并添加T3P(1-丙烷次膦酸酐(propanephosphinic anhydride),50%于DMF中,CAS[68957-94-8],4.8当量)和N,N-二异丙基乙胺(6当量)并将混合物在80℃下搅拌直至完全转化。然后将混合物蒸发至小体积,倒入水中并过滤出。然后将固体原样或如果需要将其通过HPLC纯化用于下一步骤。
通用方法G:
氯哒嗪的芳族亲核取代(GP G):
将N-酰化(6-氯哒嗪-4-基)乙酰胺溶解于乙醇中并添加苯胺衍生物(1当量)。任选地,可添加4-甲基苯磺酸水合物(1当量)以提高转化率。然后将混合物在80℃下搅拌48小时并蒸发。将残余物通过HPLC纯化。
通用方法H:
利用HATU形成酰胺(GP H):
将胺和羧酸(1.2当量)溶解于DMF中并添加HATU(2-(7-氮杂-1H-苯并三唑-1-基)-1,1,3,3-四甲基脲鎓六氟磷酸盐,CAS[148893-10-1],1.2当量)和三乙胺(5当量)并将混合物在室温下搅拌直至完全转化。然后将混合物倒入水中,用乙酸乙酯萃取,将合并的有机层用盐水洗涤,经硫酸钠干燥并蒸发溶剂。将粗产物通过色谱法纯化。
通用方法I:
利用T3P形成酰胺(GP I):
将胺和羧酸(1至2当量)溶解于DMF中并添加T3P(1-丙烷次膦酸酐,50%于DMF中,CAS[68957-94-8],3当量)和三乙胺(6当量)并将混合物在室温下搅拌直至完全转化。然后将混合物倒入水中,用乙酸乙酯萃取,将合并的有机层用盐水洗涤,经硫酸钠干燥并蒸发溶剂。将粗产物通过色谱法纯化。
通用方法J:
乙酰化氨基-吡嗪(GP J):
将氨基吡嗪溶解于二氯甲烷中并添加乙缩醛氯化物(1.5当量)和三乙胺(1.8当量)并将混合物在室温下搅拌18小时。将混合物在真空中浓缩并经由色谱法直接纯化。
实验部分-中间体
中间体1:
N-(3,4-二氟苯基)-4-硝基吡啶-2-胺
根据GP A,将甲苯(25mL)中的3,4-二氟苯胺(454mg,3.52mmol)和2-溴-4-硝基吡啶(1.00g,4.93mmol,1.4当量)转化为658mg标题化合物(理论值的74%),为黄色固体。
1
LCMS(方法1):Rt=1.24min,MS(ESIpos)m/z=252[M+H]
中间体2:
N-(3-氟苯基)-4-硝基吡啶-2-胺
根据GP B,将甲苯(75mL)中的4-硝基吡啶-2-胺(2.00g,14.4mmol)和1-溴-3-氟苯(3.52g,20.1mmol,1.4当量)转化为810mg标题化合物(理论值的20%),为微红色固体。
1
LCMS(方法3):Rt=1.13min,MS(ESIpos)m/z=234[M+H]
表1-中间体3-38:
/>
/>
/>
/>
/>
/>
/>
中间体39:
N-(3,4-二氟苯基)-N-(4-硝基吡啶-2-基)乙酰胺
根据GP C,将655mg(2.61mmol)N-(3,4-二氟苯基)-4-硝基吡啶-2-胺(中间体1)溶解在13mL乙酸酐中,加入DMAP(0.1当量,32mg,0.26mmol)并将混合物在100℃下搅拌18h。冷却至室温后,将反应混合物在乙酸乙酯和水之间分配,用乙酸乙酯萃取,用盐水洗涤,用硫酸钠干燥并真空除去溶剂。将粗产物通过色谱法纯化,得到765mg(理论值的93%)的标题化合物。
1
LCMS(方法1):Rt=1.08min,MS(ESIpos)m/z=294[M+H]
表2-中间体40-77:
/>
/>
/>
/>
/>
/>
/>
表3–中间体78:
/>
中间体79:
N-(4-氨基吡啶-2-基)-N-(3,4-二氟苯基)乙酰胺
根据GP D,将N-(3,4-二氟苯基)-N-(4-硝基吡啶-2-基)乙酰胺(中间体39,745mg,2.54mmol)溶解在乙酸乙酯(15mL)中,添加钯催化剂(活性炭负载10% Pd,270mg,0.1当量)并将混合物在室温下氢化(1atm氢气)3小时。滤出催化剂并将溶剂蒸发至干燥,得到669mg(理论值的94%)的标题化合物。
1
LCMS(方法1):Rt=0.78min,MS(ESIpos)m/z=264[M+H]
中间体80:
N-(4-氨基吡啶-2-基)-N-(4-氟苯基)乙酰胺
根据GP E,将N-(4-氟苯基)-N-(4-硝基吡啶-2-基)乙酰胺(中间体47,1.70g,6.18mmol)溶解在乙酸(70mL)中并将铁粉(5等量,1.72g,30.9mmol)分批加入。将混合物在室温下剧烈搅拌2小时。然后通过硅藻土垫滤出固体,用乙酸乙酯冲洗,并将滤液真空浓缩。产物未经进一步纯化即可用于下一步。
1
LCMS(方法2):Rt=0.58min,MS(ESIpos)m/z=246[M+H]
表4–中间体81-116:
/>
/>
/>
/>
/>
/>
/>
表5–中间体117:通过使用适当的GP E还原对应硝基化合物中间体78,生成下列芳
中间体118–具有哒嗪核心的中间体:
N-(6-氯哒嗪-4-基)-2-(2,6-二氯苯基)乙酰胺
/>
根据GP F,将6-氯-4-氨基哒嗪(500mg,3.86mmol)和2,6-二氯苯基乙酸(1.8g,1.5当量)溶解在DMF(10mL)中并添加T3P(11ml,18.5mmol,4.8当量)和二异丙基乙胺(4ml,23mmol,6当量)。将混合物在80℃下搅拌18小时,然后将其蒸发至小体积,倒入水中并过滤出,得到为固体形式的标题化合物。
1
LCMS(方法1):Rt=1.01min,MS(ESIpos)m/z=314[M-H]
表6–中间体119-122:
中间体123:
N-(6-苯氨基哒嗪-4-基)-2-(2,6-二氯苯基)乙酰胺
根据GP G,将N-(6-氯哒嗪-4-基)-2-(2,6-二氯苯基)乙酰胺(100mg,0.31mmol)溶解在3ml乙醇中,添加苯胺(29μl,0.31mmol)并将混合物在80℃下搅拌48小时。然后蒸发混合物并通过HPLC纯化。产生75mg(63%)的标题化合物。
LCMS(方法1):Rt=1.10min,MS(ESIpos)m/z=373[M+H]
表7–中间体124-146:
/>
/>
/>
/>
中间体147:
N
将110mL(1.5当量,1.2mol)4-氟苯胺溶解于500mL环丁砜中。添加24mL(1.0当量,780mmol)浓缩的HCl水溶液并将悬浮液加热至60℃。分批添加100g(1.0当量,778mmol)2-氯吡啶-4-胺(1.0当量,778mmol)。将反应溶液在130℃下搅拌18小时。将仍温热反应混合物用水稀释并将pH值用半浓缩的NaOH水溶液调整至pH=10至11。将混合物倒入4000mL水中并剧烈搅拌2小时。过滤出沉淀并将其用水强烈洗涤。将固体物质在50℃真空干燥。获得159g的标题化合物(理论值的63%),为淡紫色固体。
1
LCMS(方法1):R
中间体148:
2-(2-氯-3-氟苯基)-N-[2-(4-氟苯氨基)吡啶-4-基]乙酰胺
将115g(1.15当量,610mmol)2-(2-氯-3-氟苯基)乙酸溶解于700mL N,N-二甲基乙酰胺中并在室温下分批添加103g(1.2当量,636mmol)1,1'-羰二咪唑。将反应混合物加热至40℃保持4小时。分批添加108g(1.0当量,530mmol)N
1
LCMS(方法1):R
实验部分–实施例
实施例1:
N-{4-[2-(2-氯苯基)乙酰氨基]吡啶-2-基}-N-(3,4-二氟苯基)乙酰胺
根据GP H,将N-(4-氨基吡啶-2-基)-N-(3,4-二氟苯基)乙酰胺(中间体79,70mg,0.27mmol)和2-氯苯乙酸(54mg,1.2当量)溶解于DMF(2mL)中并添加HATU(121mg,0.32mmol,1.2当量)和三乙胺(135mg,1.33mmol,5当量)。将混合物在室温下搅拌2小时,然后将其倒入水中,用乙酸乙酯萃取,将合并的有机层用盐水洗涤,经硫酸钠干燥并蒸发溶剂。将粗产物通过快速色谱法纯化,得到30mg(理论值的24%)的标题化合物,为浅黄色泡沫。
1
LC-MS(方法1):R
实施例2:
N-{4-[2-(2-氯-3-氟苯基)乙酰氨基]吡啶-2-基}-N-(4-氟苯基)乙酰胺
/>
根据GP I,将N-(4-氨基吡啶-2-基)-N-(4-氟苯基)乙酰胺(中间体80,200mg,0.82mmol)和2-(2-氯-3-氟苯基)乙酸(154mg,1当量)溶解于DMF(10mL)中并添加T3P(778mg,2.45mmol,3当量)和三乙胺(495mg,4.89mmol,6当量)。将混合物在室温下搅拌18小时,然后将其倒入水中,用乙酸乙酯萃取,将合并的有机层用盐水洗涤,经硫酸钠干燥并蒸发溶剂。将粗产物通过制备型HPLC纯化,得到191mg(56%之理论值)的标题化合物,为浅黄色固体。
在替代方法中,将250g(1.0当量,669mmol)2-(2-氯-3-氟苯基)-N-[2-(4-氟苯氨基)吡啶-4-基]乙酰胺(中间体148)和160mL(1.4当量,940mmol)N,N-二异丙基乙胺溶解于2000mL外消旋-2-甲基四氢呋喃中。在室温下,逐滴添加71mL(1.5当量,1.0mol)乙酰氯并将反应混合物在室温下搅拌18小时。将反应混合物用乙酸乙酯稀释并通过添加水进行淬灭。将有机相用饱和NaHCO3溶液和水各洗涤一次。在经硫酸镁干燥后,将滤液在真空下浓缩并将剩余残余物经由柱色谱法(Biotage自动纯化系统(Isolera
1
LC-MS(方法1):R
表8-实施例3-184:
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
实施例185(具有哒嗪核心的实施例):
N-{5-[2-(2,6-二氯苯基)乙酰氨基]哒嗪-3-基}-N-苯乙酰胺
根据GP J,将N-(6-苯氨基哒嗪-4-基)-2-(2,6-二氯苯基)乙酰胺(中间体123,56mg,0.15mmol)溶解于二氯甲烷(2mL)中并添加乙酰氯(18mg,0.22mmol,1.5eq)和三乙胺(27mg,0.27mmol,1.8eq)。将混合物在室温下搅拌18小时,然后在真空中浓缩并经由制备型HPLC纯化,得到45mg(理论值的73%)标题化合物。
1
LC-MS(方法1):R
表9-实施例186-208:
/>
/>
/>
/>
/>
/>
/>
/>
实验部分–生物学测定
在所选生物学测定中测试实施例一此或多次。当测试超过一次时,将数据报告为平均值或中值,其中
·平均值,也称作算术平均值,其表示所获得的值的总和除以测试次数,以及
·中值表示当以递增或递减顺序排列时值组的中间数。若数据集中的值的数目为奇数,则中值为中间值。若数据集中的值的数目为偶数,则中值为两个中间值的算术平均值。
将实施例合成一次或多次。当合成超过一次时,来自生物学测定的数据表示利用由一个或多个合成批次的测试中获得的数据集计算的平均值或中值。
体外研究
本发明化合物的体外活性可在下列测定中证明:
人类P2X4 HEK细胞FLIPR测定
将化合物在稳定表达人类P2X4的HEK293细胞系上测试。将细胞在经聚-D-赖氨酸涂覆的384孔板上以15,000个细胞/孔的密度培养并在37℃,5% CO
在Bz-ATP添加之前和之后,分别在470至495nm和515至575nm的激发和发射波长下记录反映细胞内钙变化的荧光强度。
一式三份地测试化合物并将荧光强度原始数据与激动剂对照进行归一化处理并拟合为四参数逻辑方程式(four-parameter logistic equation):
Y=底部+(顶部-底部)/(1+10^((LogIC50-X)*希尔斜率(HillSlope)))
将激动剂BzATP的饱和浓度(3μM)的功效设置为最大响应(100%Emax)并且底部通过用0.5% DMSO达成的信号定义。
测定板接受(Assay plate acceptance)是基于信号窗(S/B)≥1.8,Z’≥0.5和±3σ内的参考化合物pIC50,化合物的历史pIC50的平均值。未能满足三个标准中的两个标准,则确定排除该板的结果。
用于大鼠P2X4 1321N1星形细胞瘤细胞的FLIPR方法
将化合物在稳定表达大鼠P2X4的1321N1细胞系上测试。将细胞在经胶原-I涂覆的384孔板上以10,000个细胞/孔的密度培养并在37℃,5%CO
在MgATP添加之前和之后,在470至495nm和515至575nm的各自激发和发射波长下记录反映细胞内钙变化的荧光强度。
一式三份地测试化合物并将荧光强度原始数据与激动剂对照进行归一化处理并拟合为四参数逻辑方程式:
Y=底部+(顶部-底部)/(1+10^((LogIC50-X)*希尔斜率))
将激动剂MgATP的饱和浓度(5μM)的功效设置为最大响应(100%Emax)并且底部通过用0.5% DMSO达成的信号定义。
测定板接受是基于信号窗(S/B)≥1.5,Z’≥0.5和±3σ内的参考化合物pIC50,化合物的历史pIC50的平均值。未能满足三个标准中的两个标准,则确定排除该板的结果。
在下表10中报告了测定结果
表10:
/>
/>
/>
/>
/>
体内研究
具有疼痛行为读出的大鼠的CFA炎症模型
方法
在雄性Sprague Dawley大鼠的跖内完全弗氏佐剂(CFA)诱导的急性(48小时设置)炎性疼痛模型中测试化合物。简言之,将25μl CFA以1mg/ml注射至一只后爪的跖面。使用压力应用测量装置(Ugo Basile,Gemonio,Italy)测量机械性痛觉过敏。将线性增加压力施加至后爪跖侧约50mm
用实施例2的化合物的数据:
大鼠的跖内CFA诱发的急性炎性疼痛,其特征在于PWT在注射48小时后的显著(robust)减少。根据实施例2的化合物在3天期间QD的口服给药防止炎性疼痛在注射CFA后发生。在治疗后,50和100mg/kg剂量在最后给药2和4小时后显著减少疼痛(参见表11)。
表11:实施例2的大鼠CFA体内模型数据
将针对每个治疗组和在每个时间点的数据表示为平均PWT±标准偏差(SD)。*p<0.05,***p<0.001,****p<0.0001,不同在于相同时间点的载体组(Dunnett’s事后检验)。
用实施例68的数据:
大鼠的跖内CFA诱导急性炎性疼痛,其特征在于PWT在注射48小时后的显著减少。根据实施例68的化合物在3天期间BID的口服给药防止炎性疼痛在注射CFA后发生。在治疗后,10、30和100mg/kg剂量在最后给药2小时后显著减少疼痛(参见表12)。
表12:实施例68的大鼠CFA活体内模型数据
将针对每个治疗组和在每个时间点的数据表示为平均PWT±标准偏差(SD)。*p<0.05,**p<0.01,***p<0.001,****p<0.0001,不同在于相同时间点的载体组(Dunnett’s事后检验)。
具有疼痛行为读出的大鼠的慢性压迫性损伤(CCI)神经性疼痛模型(实施例68)
该研究的目标为测试实施例68在改善神经性机械性触摸痛方面的功效。使雄性Sprague-Dawley大鼠经受坐骨神经的慢性压迫性损伤以诱发神经性疼痛。在那些大鼠中,将10只/组分配到涉及BID药物给药10天和利用von Frey测试(vF)来行为评估触摸痛的机械敏感性的治疗条件。在给药前和给药后在第0、2、5和9天评估行为。将大鼠在第0天至第9天用载体或试验品BID治疗,加巴喷丁(gabapentin)治疗组中的大鼠在第0、2、5和9天接受加巴喷丁SID连同行为评估。
作为载体,采用Solutol/DMSO/WFI(40/10/50)。每次口服给药的施用体积为10ml/kg。
实验时间线:
第12至14天:模型创建(CCI手术)
第0天:
机械触摸痛(vF)
给药
机械触摸痛测试(vF,时间2小时)
第1天:给药
第2天:
机械触摸痛测试(vF)
给药
机械触摸痛测试(vF,时间2小时)
第3天:给药
第4天:给药
第5天:机械触摸痛测试(vF)
给药(时间0分钟)
机械触摸痛测试(vF,时间2小时)
第6天:给药
第7天:给药
第8天:给药
第9天:
机械触摸痛测试(vF)
给药
机械触摸痛测试(vF,时间2小时)。
方法
在雄性Sprague-Dawley大鼠中通过将深度麻醉的大鼠的总坐骨神经(commonsciatic nerve)周围的铬制肠线的四个松散的结扎线系紧来诱导神经病变,如Bennett,G.J.和Y.K.Xie."A Peripheral Mononeuropathy in Rat That Produces Disorders ofPain Sensation like Those Seen in Man."Pain 33(1988):87-107中所述。
根据由上而下的方法1,使用具有变化的刚度(0.4、0.6、1.0、2.0、4.0、6.0、8.0和15g)的8条赛姆斯-韦恩斯坦(Semmes-Weinstein)丝(
使用下式计算50%反应阈值:
50%反应阈值(g)=(10(Xf+kδ))/10,000
Xf=所用的最终von Frey filament丝的值(以对数单位)
k=阳性/阴性反应模式的表值(Chaplan等人,1994,附录1,第62页)。
δ=在刺激物之间的平均差(以对数单位)。
结果
本研究的成功标准为1)创建机械敏感性模型及2)证实加巴喷丁对机械敏感性的逆转作用。这些标准二者都满足。载体治疗的动物表明,通过与对侧50%缩爪阈值相比,同侧爪的反应阈值显著降低50%,证明显著机械敏感性。在所有给药后时间点,加巴喷丁给药显著增加缩爪阈值。
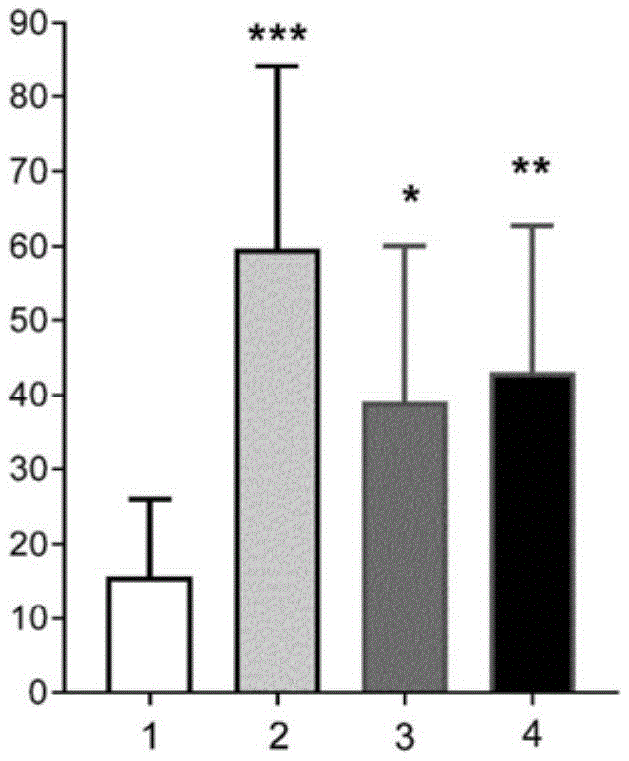
本研究证实给药根据实施例68的化合物显著增加50%缩爪阈值,该化合物减少通过用作神经性疼痛模型的CCI手术诱发的机械触摸痛(图1)。
参考图1,其显示根据本发明的化合物68的镇痛效应(50%缩爪阈值):
***p<0.005,**p<0.01,*p<0.05ANOVA,然后进行Dunnet`s事后检验相对于载体
Y轴表示:平均50%缩爪阈值AUC(第14至23天)+SD
X轴图例:1=载体,2=加巴喷丁100mg/kg体重,3=实施例68 30mg/kg体重,4=实施例68 100mg/kg体重。
小鼠的体内脑血浆比率
在雌性CD小鼠中在静脉内给药后评估测试化合物至脑的渗透。测试化合物以0.3至1mg/kg的标准剂量给药,使用DMSO/血浆制剂或增溶剂(诸如PEG400)以耐受良好的量调配成溶液。将动物的分开的组(3只动物/组)在给药后的至少3个不同时间点(例如,0.5、1及4小时)处死并对血液及脑采样。将血液收集至锂-肝素管(
从浓度-时间谱,计算血浆和脑中的AUC(浓度-时间曲线下面积)并计算比率AUC
蛋白结合:
通过平衡透析估计血浆蛋白结合。测试化合物与血浆蛋白的结合通过平衡透析以96孔形式使用由Teflon和半渗透膜(再生纤维素,MWCO12-14K)制得的ht-透析设备来测量。膜将各填充150μl的血浆和缓冲液侧(50mM磷酸盐缓冲液)分开。将测试化合物以3μM的浓度添加至血浆侧并结合至血浆蛋白。测试化合物的未结合部分通过该膜并在两侧分布直至达到平衡,其通常为在37℃下保持6至8小时后的情况。血浆和缓冲液侧的化合物浓度通过LC-MSMS分析进行测量。对于此,将两侧用缓冲液和血浆稀释以达成相同基质(10%血浆)并随后用甲醇沉淀。由缓冲液及血浆浓度的商,计算游离(未结合)分数(fu)。包含稳定性和恢复对照。此外,将测试化合物在缓冲液中抵抗缓冲液进行透析以估计对设备和/或膜的非特异性结合并研究平衡的建立。由于血浆蛋白的渗透压,血浆的稀释在孵育期间发生(体积变化)。潜在不精确通过在计算fu中纳入经验系数来解决。血浆中的平衡和稳定性的建立应为至少80%以及血浆的回收应为至少30%。指定<1%的游离分数为高血浆蛋白结合,1与10%之间为中等血浆蛋白结合以及>10%为低血浆蛋白结合。
- 具有P2X4受体拮抗活性的N-苯乙酰胺用于治疗某些眼部疾病的用途
- 杀线虫的N-(2-取代的2-苯乙基)甲酰胺和N-(2-取代的2-苯乙基)-硫代甲酰胺
