荧光定量PCR检测BCC的引物探针及其设计方法和试剂盒
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及针对洋葱伯克霍尔德菌群荧光定量PCR检测方法,特别是涉及洋葱伯克霍尔德菌群23个物种特异性片段的筛选和探针设计,及试剂盒应用。
背景技术
洋葱伯克霍尔德菌群(Burkholderia cepacia complex, Bcc)由伯克霍尔德菌属的23个种组成,分别为洋葱伯克霍尔德菌(
2022年10月国家药品监督管理局药品审评中心发布的《非无菌化学药品及原辅料微生物限度研究技术指导原则(征求意见稿)》明确要求“对于吸入用途德制剂以及口服、黏膜和鼻腔给药德水溶液非无菌制剂,应参考相关技术要求对洋葱伯克霍尔德菌群进行风险管理和控制研究,制定相应德控制策略,必要时将BCC订入产品放行/货架期标准”。为了实现对BCC过程控制和终端检测,需要专门的方法。BCC的生长速度相对较慢,容易被快速生长的其他菌群所掩盖,所以传统的培养方法难以筛查到。为了从产品中分离BCC,USP42 <60>“非无菌产品的微生物检验-洋葱伯克霍尔德复合群测试”提供了BCSA 选择性培养基的方法。该方法改变了之前BCC无从检测的状态,促进了BCC的终端控制,但是仍然具有周期较长,过程管控应用受到限制,且存在出现一定的假阳性的机率(如Flavobacterium spp.,Ralstonia spp., Burkholderia gladioli 等可以在BCSA 选择性培养基上生长)。
分子方法具有更高的灵敏度、稳定性和便捷性,在临床、食品等领域已经被广泛应用,具有作为药品微生物检测替代方法的潜力。但是,分子方法应用于BCC检测的困难在于,BCC不是单个物种,而是包含了23个物种的复合群,遗传多样性高,确定一个通用的靶标具有挑战性。
发明内容
为克服现有技术不足,本发明研发大规模的泛基因组数据分析技术,将23个BCC目标物种的基因组打碎成重叠片段群,使用非目标基因组作为对照,获得了覆盖Bcc 复合群全体的共有、排他性保守片段,并以此片段为靶点开发了核酸鉴定试剂盒DM-BCC Quester。
一种荧光定量PCR检测BCC的引物探针设计方法,
1)准备用于筛选BCC物种特异性DNA片段的基因组作为阳性集合,包含871个基因组,覆盖全部23个BCC物种;非BCC物种基因组作为阴性集合,包含19183个基因组,覆盖物种数量为13708,属数量为3092个;
2)基于BCC阳性集合基因组,采用RUCS软件筛选核心保守序列,再针对核心保守序列设计扩增引物,参数设定为:产物长度120-200 bp,k-mer设置为20;
3)核心保守序列和扩增引物的验证
采用软件mfeprimer v3.2.4进行引物验证,验证数据库包括1127个阳性基因组,含全部23个BCC物种,以及61927个阴性基因组,含11481个物种,覆盖2807个属;
4)Taqman探针设计,模拟提取所有BCC基因组中对应的扩增产物,设置kmer为15-35bp,统计出与所有阳性扩增产物错配个数为0,阴性扩增产物错配个数 >= 1的kmer作为探针序列,从而获得探针序列;
5)扩增引物和探针的评价,利用Wilson方法统计引物、引物+探针、引物+探针+长度过滤的特异性、灵敏性指标;
步骤2)中获得核心保守序列如SEQ ID No.1所示;
根据核心保守序列得到
正向扩增引物序列为:CAAGGTCGAGGAAGGCAAGAA,如SEQ ID No.2所示;
反向扩增引物序列为:CCGGGCACAACCTTTTCTTTG,如SEQ ID No.3所示。
所述的引物探针设计方法,步骤4)中获得的探针序列为:TACTGAGCGCCTGACGCAG,如SEQ ID No.4所示。
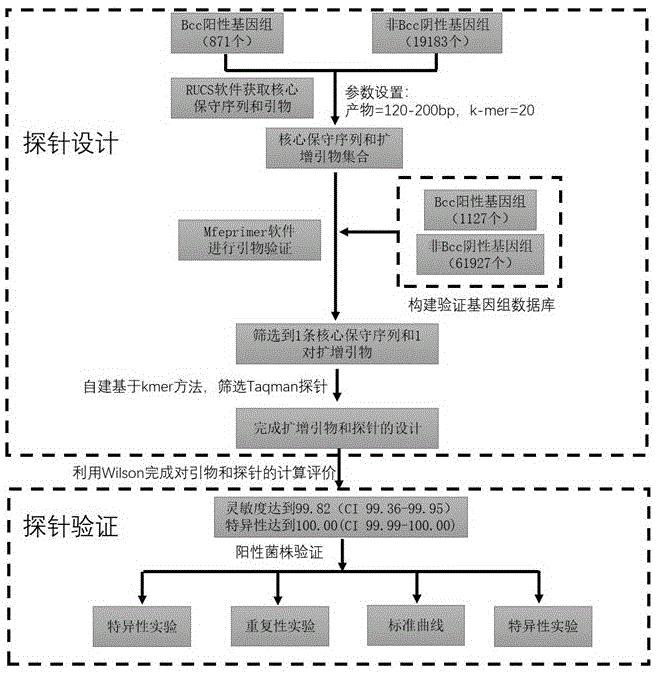
所述的引物探针设计方法,步骤5)中根据in-silico验证,灵敏度达到99.82,CI99.36-99.95,特异性达到100.00,CI 99.99-100.00。
一种荧光定量PCR检测BCC的引物探针,
正向扩增引物序列为:CAAGGTCGAGGAAGGCAAGAA,如SEQ ID No.2所示;
反向扩增引物序列为:CCGGGCACAACCTTTTCTTTG;如SEQ ID No.3所示;
荧光探针序列为:TACTGAGCGCCTGACGCAG,如SEQ ID No.4所示。
一种基于荧光定量PCR技术检测BCC的试剂盒,采用所述的引物和荧光探针组合,其中,正向扩增引物序列为:CAAGGTCGAGGAAGGCAAGAA,如SEQ ID No.2所示;
反向扩增引物序列为:CCGGGCACAACCTTTTCTTTG,如SEQ ID No.3所示;
荧光探针序列为:TACTGAGCGCCTGACGCAG,如SEQ ID No.4所示;荧光探针的5端标记有荧光基团,3端标记有淬灭基团。
所述的试剂盒,所述荧光基团为FAM,所述淬灭基团为BHQ1。
所述的试剂盒,设有对照探针,5端标记有荧光基团VIC,3端淬灭基团BHQ1;序列为CTTGCTCGCGTAATTAATGACAAGACGC,如SEQ ID No.5所述。
所述的试剂盒,设有PCR缓冲液,Taq酶,dNTPs,Mg
所述的试剂盒,设有标准阳性模板、阴性模板和对照扩增模板,阳性模板为构建的标准品阳性质粒,阴性模板为灭菌双蒸水,对照扩增模板序列如SEQ ID No.6所示。
本发明的有益效果:
对特定微生物种类进行准确的核酸鉴定的先决条件是扩增引物和探针的设计。本发明建立了一套基于泛基因组数据水平,设计覆盖BCC的23个物种的特异性引物,并完成了1127个阳性菌株(inclusively)及61927多个非目标基因组(exclusively)计算机模拟PCR验证,克服小样本量数据置信度低的缺点,诊断灵敏度和特异性达99.82%和100%;内置insilico 设计的无交叉反应Spike-in 对照和阳性对照,为检测结果提供更可靠的质量控制;周期短,检测最短仅需2-3小时即可获得结果(低浓度样本可能需要额外的6小时增菌步骤);操作简单,重复性好。
附图说明
图1是本发明的流程图。
图2是最低检出限结果;
图中,1:4.0×10
图3是增菌后最低检出限结果。
图中,1:7.8×10
图4是特异性实验结果。
具体实施方式
下面结合附图和实施例对本发明进行进一步阐述。
一种基于荧光定量PCR技术检测洋葱伯克霍尔德菌群的引物探针设计方法(图1):
1)准备用于筛选BCC物种特异性DNA片段的基因组文件作为阳性集合,包含871个基因组,覆盖23个BCC物种;非BCC物种基因组作为阴性集合,包含19183个基因组,覆盖物种数量为13708,属数量为3092个。
表1 引物设计阳性基因组集合
2)基于Bcc阳性集合基因组,采用RUCS软件筛选核心保守序列,再针对这些序列设计扩增引物,参数设定为:产物长度120-200 bp,k-mer设置为20。
其中核心保守序列如如SEQ ID No.1所示:
CAAGGTCGAGGAAGGCAAGAAGGTTCGCTTCCTGAAGACGACCGGTGCCGTACTGAGCGCCTGACGCAGCGGAGTAAAAAATGGCTCGTTTTCAAGAGTTTTACAAAGAAAAGGTTGTGCCCGG;
正向引物序列为:CAAGGTCGAGGAAGGCAAGAA,如SEQ ID No.2所示;
反向引物序列为:CCGGGCACAACCTTTTCTTTG,如SEQ ID No.3所示。
3)核心保守序列和扩增引物的验证。采用软件mfeprimer v3.2.4进行引物验证。验证数据库分别包括阳性基因组集合1127个基因组(含全部BCC物种23个)以及阴性基因组集合(非BCC)共计61927个基因组(含11481个物种,覆盖2807个属)。筛选获得到的核心保守序列,该区域包含rplX (50S ribosomal protein L24)的下游和rplE (50S ribosomalprotein L5)的上游,以及两个基因间区的序列。
4)Taqman探针设计。编写脚本提取各阳性基因组中对应的扩增产物,设置kmer(长度范围:15-35bp),统计出与所有阳性扩增产物错配个数为0,阴性扩增产物错配个数 >= 1的kmer作为探针序列,最终获得的探针序列为:TACTGAGCGCCTGACGCAG,如SEQ ID No.4所示。
5)扩增引物和探针的评价。自编脚本,利用Wilson方法统计引物、引物+探针、引物+探针+长度过滤的特异性、灵敏性指标。根据in-silico验证,灵敏度达到99.82(CI 99.36-99.95),特异性达到100.00(CI 99.99-100.00)。
洋葱伯克霍尔德菌群荧光定量PCR试剂盒建立
1)本发明提供一种基于荧光定量PCR技术检测Bcc的引物和荧光探针组合,所述引物包括正向引物、反向引物、探针和对照探针,如表2。
所述“探针”的5端标记有荧光基团,3端标记有淬灭基团;所述荧光基团包括
FAM,所述淬灭基团包括BHQ1。
所述对照探针,序列如SEQ ID No.5所示,5端标记有荧光基团,3端标记有淬灭基团;所述荧光基团包括VIC,所述淬灭基团包括BHQ1。
表2 Bcc荧光定量试剂盒探针列表
2)本发明提供一种肺炎链球菌核酸的实时荧光定量PCR检测试剂盒,包括上述的引物和荧光探针。
所述试剂盒还包括PCR缓冲液,Taq酶,dNTPs,Mg
优选地,所述试剂盒还包括标准阳性模板、阴性模板和对照扩增模板,阳性模板为构建的标准品阳性质粒,阴性模板为灭菌双蒸水,对照扩增模板序列为:
CAAGGTCGAGGAAGGCAAGAATGATTTAGAACTTGCTCGCGTAATTAATGACAAGACGCAGTCCGCGAGTCATGTCGTGGCAGCAGAGGAGTCCTTCGCTTGGCAAAGAAAAGGTTGTGCCCGG,如SEQ ID No.6所示。
对照模板序列采用同样的引物序列,并将原模板反向(不互补)合成自然界中未发现的序列,降低交叉反应的可能性。
3)本发明还提供检测肺炎链球菌的TaqMan实时荧光定量PCR方法,尤其是利用上述引物和探针,或所述试剂盒对Bcc进行TaqMan实时荧光定量PCR检测。
前述方法包括以下步骤:
A、提取纯化菌株或样品组织中细菌的总DNA;
B、以步骤A中的总DNA为模板,利用上述引物和探针,进行PCR扩增反应;
C、标准品的制备;
D、反应体系及反应参数的选定;
E、标准曲线的绘制;
F、对具体的样品进行检测。
实施例1荧光定量PCR最低检出限测定:
a)洋葱伯克霍尔德菌(Burkholderia cepacia,ATCC 25416)接种于胰酪大豆胨液体培养基(TSB)中培养48小时,取1 mL菌液提取DNA。
b)采用TaKaRa细菌基因组DNA提取试剂盒提取DNA,并使用数字PCR仪进行标定。将该DNA溶液10倍梯度稀释,0.4 copy/μL、4.0 copy/μL、4.0×10
c)各浓度DNA溶液进行荧光定量PCR检测,并以核酶水替代模板设置空白对照。使用ABI实时荧光定量PCR仪进行PCR扩增,扩增体系:2×Premix Ex Taq 10 μL,上下游引物各250 nM,探针125 nM,模板2 μL,用无核酶水补足至20 μL。反应条件:95℃预变性30 s;95℃变性10 s,60℃退火延伸30 s,40个循环。每个样本2个平行。
d)荧光定量PCR后得到每个浓度的Ct值,这个值对应荧光信号初次被检测到时的循环数(图2),说明本发明建立的检测方法可以准确检测样本中的伯克霍尔德菌,且检测限为4.0 copy/μL。
实施例2荧光定量PCR最低检出限测定(增菌):
a)使用洋葱伯克霍尔德菌(Burkholderia cepacia,ATCC 25416)作为最低检出限的模式细菌。将洋葱伯克霍尔德菌在胰酪大豆胨液体培养基中培养48小时,经10倍梯度稀释,通过平板计数法得到各稀释度菌液浓度:7.8×10
b)采用TaKaRa细菌基因组DNA提取试剂盒提取不同浓度菌液的基因组DNA;
c)使用ABI实时荧光定量PCR仪进行PCR扩增,扩增体系和反应条件同上。每个样本2个平行。
d)荧光定量PCR后得到每个浓度的Ct值,这个值对应荧光信号初次被检测到时的循环数(图3),说明本发明建立的检测方法可以准确检测样本中的伯克霍尔德菌,且检测限为7.8 CFU/mL。
实施例3特异性实验
阳性菌株:BCCs菌株8种、18株;阴性菌株:伯克霍尔德属内非BCC菌株3株,以及其他属细菌24株,见表1。使用ABI实时荧光定量PCR仪进行PCR扩增,反应体系和反应条件同上,并设立空白对照。结果显示,只有BCCs反应管中检测到特异性扩增信号,其它反应管均无荧光信号积累,表明该方法具有良好的特异性(图4)。
表1特异性实验菌株信息。所有的分离株菌采用全基因组测序,完成菌种鉴定。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明的保护范围应以所附权利要求为准。
- 用于检测A型猪轮状病毒的引物及探针、荧光定量PCR试剂盒及方法和应用
- 用于检测猪传染性胃肠炎病毒的引物及探针、荧光定量PCR试剂盒及方法和应用
- 基于荧光定量PCR检测鲟鱼的引物和探针及其试剂盒与方法
- 一种基于实时荧光PCR检测红串红球菌的引物和探针、试剂以及试剂盒与方法
- 一种基于实时荧光PCR检测短短芽孢杆菌的引物和探针、试剂及其试剂盒与方法
- 登革病毒分型检测用的多重实时荧光定量PCR引物、探针、试剂盒及试剂盒的使用方法
- 一种荧光探针、引物对、荧光定量PCR试剂盒及检测方法
