12个小核酸同管联合扩增检测方法与试剂盒
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于生物化学技术领域,涉及检测方法,尤其是涉及11个肿瘤相关小核酸及1个内参小核酸同管联合扩增检测方法,及利用该方法进行检测的试剂盒。
背景技术
癌症早筛,即在癌症早期或癌前病变阶段的早期检测和预警,是促进癌症防治和降低癌症死亡率的最有效方法。广义上的癌症早筛,横跨影像学、病理学、体检和健康管理等多个学科,检查手段非常多样,包括:影像学检查、内窥镜检查、组织活检、细胞学检查、液体活检等,但这些手段均存在一些不利于早筛应用的缺陷。例如:CT影像学检查假阳性高,有放射性损伤;PET-CT检查改善了CT假阳性高的缺陷,诊断性能良好,但仍有放射性损伤,且过程复杂,成本费用高昂;内窥镜检查和组织活检属于有创侵入式检查,过程复杂,有安全风险;细胞学检查性能和应用范围有限;癌症液体活检,通称抽血验癌,具有优良的便利性,是癌症筛查的主流发展方向,但性能依赖于标志物的选择和检测技术的发展,仍在持续改善和提高中。血液里跟癌症相关的标志物,主要有七大种类,包括:蛋白质标志物、循环肿瘤细胞(CTC)、循环肿瘤DNA(ctDNA)、游离总DNA(cfDNA)、cfDNA甲基化分析、外泌体、小核酸。这其中前5种标志物的癌症早筛敏感性低于50%,很难有进一步的提高。外泌体及其内容物小核酸则以体积小、具有穿过各种组织屏障的扩散能力和拷贝数高等优势,尤其是小核酸检测还能够利用PCR高达上亿倍的扩增放大能力,有望在癌症早筛检测性能上取得突破。
小核酸(miRNA,微小核糖核酸)是一类长约22个核苷酸(nt)的单链小分子RNA,广泛存在于人体组织和细胞内,并可通过外泌体或小囊泡分泌或细胞破裂等机制进入到血液等体液中,具有重要的基因调节和信号传递功能。在肿瘤的发生发展转移等过程中异常表达的小核酸被称为肿瘤相关小核酸。
大量研究表明,血液异常富集的肿瘤相关小核酸可发生在肿瘤早期阶段。肿瘤细胞通常比健康细胞释放高达10倍以上的外泌体,健康人群血液中外泌体的含量约为10
与单癌种筛查相比,泛癌早筛更适用于一般人群,不仅可以极大提高癌症早筛效率,而且,还可以减少抽血次数和用量,降低成本和费用,有利于促进癌症早筛的普及,也是未来血检趋势。肿瘤相关小核酸研究报道众多,具有泛癌早筛应用的理论基础,但受限于难以多靶标同管扩增检测等局限,尚未形成可普及应用的多靶标小核酸同管扩增检测方法和产品,相关的技术创新和突破是推动小核酸检测在泛癌早筛应用的关键,有望发展成为降低癌症发病率和死亡率的利器。
发明内容
本发明目的是针对性地解决肿瘤相关小核酸扩增检测存在的异常与正常差异较小、一致性较差、难以实现多靶标同管扩增检测等问题,提供一种操作简单、抗干扰和重复性好、便利易用的12个小核酸同管联合扩增检测方法及试剂盒。
为了实现上述目的,本发明采用以下技术方案:
本发明首先提供了12个小核酸同管联合扩增检测方法,所述检测方法包括:利用12个特异主探针、12个特异辅探针和1个通用锚探针,从样本中杂交捕获11个肿瘤相关小核酸和内参小核酸,再以绿豆核酸酶体系去除没有结合靶标小核酸的特异主探针,捕获靶标小核酸的特异主探针保持完整可被PCR扩增检测,阳性扩增Ct值指示肿瘤相关小核酸的存在;
其中,所述肿瘤相关小核酸为miR-10b-3p、miR-214、miR-196a、miR-761、miR-602、miR-522、miR-935、miR-765、miR-205、miR-1178与miR-638,所述内参小核酸为miR-let7a。
作为本发明的一种优选方案,所述12个特异主探针序列组成为:两端为通用序列,中间为额外添加的核苷酸序列加靶标小核酸特异互补序列,使得11个肿瘤相关小核酸特异主探针的Tm值比内参小核酸特异主探针的Tm值高8-12℃。
作为本发明的一种优选方案,PCR程序荧光读取温度设置在比肿瘤相关小核酸特异主探针的Tm值小3-6℃,比内参特异主探针的Tm值高3-6℃,使得扩增曲线和Ct值为源自肿瘤相关小核酸的扩增,而排除源自内参的扩增。
作为本发明的一种优选方案,阳性扩增熔解曲线有2个Tm相差8-12℃的峰;其中,Tm值低于扩增荧光读取温度3-6℃的峰,指示源自内参的扩增。
作为本发明的一种优选方案,所述特异主探针的序列依次如SEQ ID NO.1~SEQID NO.12所示,所述特异辅探针的序列依次如SEQ ID NO.13~SEQ ID NO.24所示,所述通用锚探针的序列如SEQ ID NO.27所示。
作为本发明的一种优选方案,所述检测方法具体为:
1)样本采集;
2)裂解杂交;
3)吸附,洗涤,酶切与再洗涤;
4)PCR反应与熔解曲线分析;
其中,PCR程序为:95℃10min预变性后,再40个循环的94℃6s、62℃30s、80℃34s,荧光读取温度设定在80℃。
作为本发明的一种优选方案,步骤4)中,熔解曲线分析的结果判断为:熔解曲线在80℃前有Tm峰,指示内参质控合格,结果可靠;Ct值<37,指示阳性,代表肿瘤相关小核酸有扩增;Ct值≥37或No Ct,指示阴性,代表肿瘤相关小核酸无扩增。
本发明还提供了12个小核酸同管联合扩增检测试剂盒,所述试剂盒包括:1×样本释放剂、1×磁珠液、10×洗涤液、1×绿豆核酸酶液、1×PCR液与1×阳性对照,可在一管反应体系中同步检测肿瘤相关小核酸miR-10b-3p、miR-214、miR-196a、miR-761、miR-602、miR-522、miR-935、miR-765、miR-205、miR-1178与miR-638和内参小核酸miR-let7a;所述样本释放剂包括上述的特异主探针、特异辅探针和通用锚探针,所述PCR液包括上下游引物,所述上游引物的序列如SEQ ID NO.25所示,所述下游引物的序列如SEQ ID NO.26所示。
作为本发明的一种优选方案,所述样本释放剂的组成为:42nM各特异主探针、42nM各特异辅探针、504nM通用锚探针、60mM氯化锌、60mM乙酸钠、60mM半胱氨酸、15%碳酸亚乙酯、6%十二烷基硫酸钠与6%聚乙二醇6000;绿豆核酸酶液的组成为pH5.0的50mM乙酸钠缓冲液中含有30mM氯化钠、1mM氯化锌与0.04U/μL绿豆核酸酶。
作为本发明的一种优选方案,所述PCR液的体系组成为50mM Tris-HCl pH8.8、50mM KCl、0.05U/μL热启动DNA聚合酶、4%甘油、4%甲酰胺、0.2mM dNTP、2.5mM MgCl
本发明从在普通人群血液中无表达或仅有极低表达的小核酸中筛选到在多种癌症表达上调的11个肿瘤相关小核酸,以放大异常与正常差异。鉴于液体活检的样本(通常为血液)组成中源自正常的部分远大于异常的部分,异常下调的信号通常会被正常本底覆盖而难以检测到差异,异常上调的信号则可以通过消除正常本底再扩增放大差异。在异常信号上调的情况下,若将正常本底消除至0,虽然异常信号也受损减少但仍可大于0,在经过扩增放大之后,0本底仍然是0,大于0的异常信号则有可能被放大至可检测的范围。首先对肺癌表达上调的小核酸进行miRmine小核酸表达数据库查询,选择在普通人群血液中无表达或仅有极低表达的小核酸,再检索其在其它10种癌症的表达情况,再继续对其它10种癌症也依次进行这样的分析,列表比对后,选择得到miR-10b-3p、miR-214、miR-196a、miR-761、miR-602、miR-522、miR-935、miR-765、miR-205、miR-1178、miR-638等11个在多种癌症中表达上调且正常本底很低的肿瘤相关靶标小核酸(表1),再进一步通过控制样本用量以达到0本底。
表1. 11个肿瘤相关小核酸在肿瘤或非肿瘤的相对表达
注:*非肿瘤,miRmine数据库查询得到普通人群血液相对表达平均值;N,非上调;Y,上调。
上述11个肿瘤相关靶标小核酸的序列见表8所示。
建立探针锚定双链扩增方法(Probe-Anchored and Double-StrandedAmplification,PADSA)以改善小核酸扩增检测的一致性,并实现多靶标同管扩增检测。其使用包含主探针、辅探针、锚探针的样本释放剂与样本混合保温,主探针可以同时杂交结合辅探针、锚探针和靶标小核酸,形成完整双链,并进一步通过锚探针5’末端的生物素标记结合于链霉亲和素磁珠上,在吸去上清并洗涤后,样本中过量的非靶标核酸被洗去,再加入绿豆核酸酶体系进行单链特异酶切反应,没有结合靶标小核酸的主探针处于单链或部分单链状态而被降解,已捕获靶标小核酸的主探针在双链中保持完整,再次洗涤之后,转移到PCR体系中,进行热变性和PCR扩增反应,阳性扩增结果指示靶标小核酸的存在。该方案利用探针锚定,通过洗涤和酶切去除包括rRNA、mRNA、非编码核酸和其它小核酸在内的各种非靶标核酸的干扰,不需要进行逆转录,也不需要提取外泌体,而且是使用标准的PCR条件,因此,能比茎环法达到更好的一致性,并且,该方案使用一对通用引物和荧光染料,可实现多靶标同管扩增检测。
利用较高的荧光读取温度归并分析源自肿瘤相关小核酸的扩增,并利用熔解曲线分析判断源自内参的扩增。荧光定量PCR根据荧光标记方法的不同分为2种,分别是荧光探针法和荧光染料法。相较于荧光探针法,荧光染料法具有敏感性更好、体系更简单和成本更低等优势。基于液体活检的癌症早筛只需要检测到有否阳性即可,并不需要分辨癌症种类,因为液体活检即使能直接分辨癌症种类,也仍然需要进行PET-CT影像学等后续手段进行组织定位,可同步判断癌症种类。同样地,泛癌早筛主要目标是预警,发现阳性后可以利用PET-CT等后续手段进行组织定位和同步癌症种类判断等诊断,因此,本发明采用归并分析只需检测到有肿瘤相关小核酸表达即可,不需要直接分辨具体是哪一种小核酸和哪一种癌症。本发明的归并分析方法是通过设置合适的荧光读取温度,使得内参扩增产物处于解链状态,而肿瘤相关扩增产物仍处于双链状态,这样,扩增曲线和Ct值排除了源自内参的扩增,而特异指示源自肿瘤相关扩增;然后,再进行熔解曲线分析,利用Tm值低于扩增荧光读取温度的峰,指示源自内参的扩增(参见下表2所示)。为此,考察了一系列常用的内参小核酸,发现其中miR-let7a的Tm值显著低于上述11个肿瘤相关小核酸,且表达水平稳定适中,所以,选择miR-let7a为本体系的内参小核酸。
表2.扩增结果分析
本发明中,特异主探针、特异辅探针、通用锚探针、通用引物设计。特异主探针序列组成为:两端为通用序列,中间为额外添加的核苷酸加靶标小核酸特异互补序列,使得11个肿瘤相关小核酸特异主探针的Tm值比内参小核酸特异主探针的Tm值高8-11℃。两端通用序列分别为上游引物同源序列和下游引物互补序列,并且,主探针3’末端额外增加一个“A”,以与通用锚探针5’末端“T”互补。特异辅探针序列组成为:上述额外添加的核苷酸序列的互补序列加上游引物互补序列。锚探针为通用,序列与通用下游引物相同,其5’末端标记有生物素。通用上下游引物为PCR优化设计。
准备样本释放剂和其它试剂材料。样本释放剂混合有适量的特异主探针、特异辅探针、通用锚探针、乙酸钠、氯化锌、半胱氨酸、碳酸亚乙酯、聚乙二醇6000(PEG6000)、十二烷基硫酸钠(SDS)。探针如前所述。乙酸钠、氯化锌、半胱氨酸、碳酸亚乙酯、聚乙二醇6000,提供合适的离子强度、pH值和核酸杂交条件。十二烷基硫酸钠、氯化锌、半胱氨酸,提供样本裂解、蛋白质变性和RNase酶抑制作用。
链霉亲和素磁珠特异吸附锚探针及其与主探针形成的双链。洗涤液由3-吗啉丙磺酸(MOPS)、半胱氨酸、甲酰胺、乙酸钠、吐温20、纯化水等成份组成。PCR液由包含通用上下游引物、荧光探针、热启动DNA聚合酶、dNTP、SYBR Green I、ROX等荧光定量PCR常规组分组成。
与现有技术相比,本发明的有益之处:
(1)本发明筛选到11个在肺癌、结直肠癌、胃癌、肝癌、食管癌、胰腺癌、甲状腺癌、乳腺癌、前列腺癌等9大常见癌症中表达上调且在普通人群血液中无表达或极低表达的肿瘤相关小核酸,和1个在癌症和普通人群血液中均稳定表达且Tm值较低的内参小核酸,利用探针锚定双链扩增(PADSA)和较高的荧光读取温度及熔解曲线分析,在国际上首次实现了12个小核酸的同管扩增检测。
(2)与一个样本需要进行12管反应的传统茎环法相比,本发明不仅检测效率提高12倍,而且,11个肿瘤相关小核酸和1个内参的同管联合扩增检测,便于消除管间误差及归并分析和比对,有利于分析发现异常变化。
(3)本发明方法在PCR前的处理过程中整合了裂解杂交、洗涤、酶切、再洗涤等步骤,能有效去除各种干扰物质,并且,不需要提取外泌体,不需要进行逆转录,因此,具有很好的抗干扰和可重复性。
(4)本发明方法操作过程以移液操作为主非常简单,PCR前处理过程仅需15~20分钟,单管反应可比传统茎环法单管反应缩短约83.3%的操作时间,比传统茎环法12管反应缩短约98.6%的操作时间。
(5)本发明仅需200μL抗凝全血或不超过100μL血浆就能同时检测与9大常见癌症相关的11个小核酸,并有内参小核酸同管全程质控,可有效避免检测操作过程相关的假阴性。体检或血常规等检查采血后通常可有约500μL/管的残余量,因此,本发明可整合进入体检或血常规,不需要专门采血,不需要扩大采血量,可避免给受检者造成额外损伤。
总之,本发明针对性地解决了小核酸联合扩增检测受限于外泌体提取和干扰、异常与正常差异较小、一致性较差、难以实现多靶标同管扩增检测等问题,具有操作简便、重复性好、性能提高、效率和成本改进等优势。本发明试剂盒可以在各种具备荧光定量PCR仪的实验室或检测单位使用,不需要额外添置设施设备,有利于普及推广应用。
附图说明
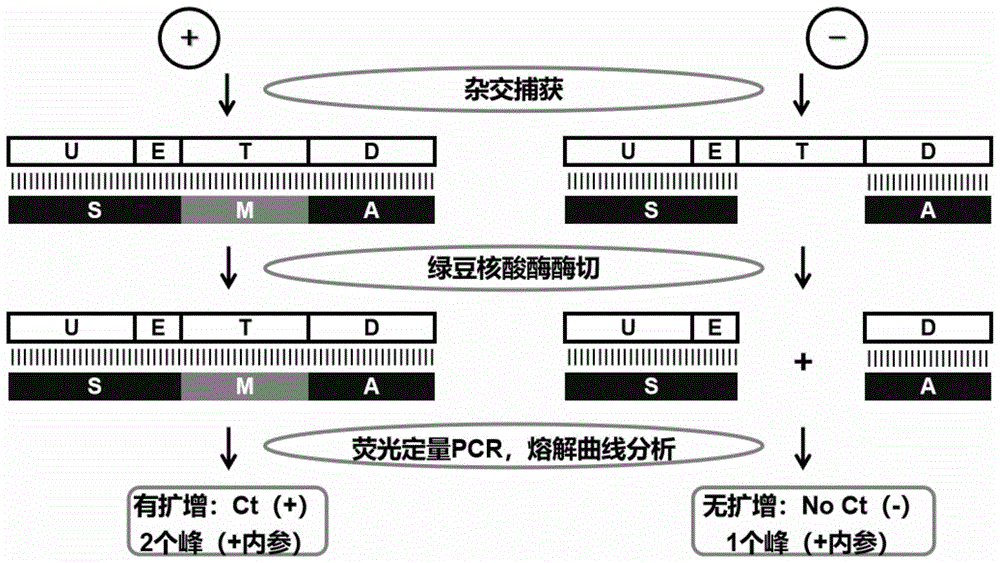
图1是本发明的流程图。
U-E-T-D:主探针,U:上游引物同源区,E:额外增加的核苷酸,T:靶标小核酸互补区,D:下游引物互补区,S:辅探针,M:靶标小核酸,A:锚探针。
具体实施方式
为了使本发明实现的技术手段、创作特征、达成目的与功效易于理解,下面结合具体实施例,进一步阐述本发明,但下述实施例仅仅为本发明的优选实施例,并非全部。基于实施方式中的实施例,本领域技术人员在没有做出创造性劳动的前提下所获得其它实施例,都属于本发明的保护范围。下述实施例中的实验方法,如无特殊说明,均为常规方法,下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
本发明建立探针锚定双链扩增方法(Probe-Anchored and Double-StrandedAmplification,PADSA)以改善小核酸扩增检测的一致性,并实现多靶标同管扩增检测。其使用包含主探针、辅探针、锚探针的样本释放剂与样本混合保温,主探针可以同时杂交结合辅探针、锚探针和靶标小核酸,形成完整双链,并进一步通过锚探针5’末端的生物素标记结合于链霉亲和素磁珠上,在吸去上清并洗涤后,样本中过量的非靶标核酸被洗去,再加入绿豆核酸酶体系进行单链特异酶切反应,没有结合靶标小核酸的主探针处于单链或部分单链状态而被降解,已捕获靶标小核酸的主探针在双链中保持完整,再次洗涤之后,转移到PCR体系中,进行热变性和PCR扩增反应,阳性扩增结果指示靶标小核酸的存在。
本发明的流程原理图参见附图1。主要步骤和试剂材料总结如下表3所示。
本发明的检测方法为:从180~200μL抗凝全血样本离心收集得到80~100μL血浆样本,转移至含有样本释放剂的管中,混匀室温放置5~10min;加入适量链霉亲和素磁珠混匀后,以磁铁吸附或12000rpm离心1min,吸去上清,加入洗涤液混匀,再以磁铁吸附或离心,吸去上清,加入适量体积的绿豆核酸酶液,室温放置1min;再以磁铁吸附或12000rpm离心1min,吸去上清,加入洗涤液混匀,再以磁铁吸附或12000rpm离心1min,吸去上清,加入适量体积的PCR液,吸打混匀并转移至PCR管中,在PCR热循环仪上进行荧光定量PCR反应,启用SYBR荧光检测通道,并开启ROX本底校准,PCR程序为:95℃10min预变性后,再40个循环的94℃6s、62℃30s、80℃34s,荧光读取温度设定在80℃,PCR完成后,进行熔解曲线分析。结果判断:熔解曲线在80℃前有Tm峰,指示内参质控合格,结果可靠;Ct值<37,指示阳性,代表肿瘤相关小核酸有扩增;Ct值≥37或No Ct,指示阴性,代表肿瘤相关小核酸无扩增。
表3.本发明的主要步骤和试剂材料
上文所述的样本释放剂,其组成为:42nM各主探针(TS1201~12)、42nM各辅探针(TA1201~12)、504nM通用锚探针、60mM氯化锌、60mM乙酸钠、60mM半胱氨酸、15%(w/v)碳酸亚乙酯、6%(w/v)十二烷基硫酸钠、6%(w/v)聚乙二醇6000。当用于80~100μL血浆样本检测时,用量为40μL。各探针终浓度为12nM。根据PCR反应引物浓度可以低至120nM,退火复性时间为30s计算,当探针浓度为12nM时,杂交时间约需5分钟,而本发明使用血浆样本可以快速裂解,因此,裂解杂交时间10分钟足以满足裂解杂交所需。体系中含有的碳酸亚乙酯、甲酰胺和十二烷基硫酸钠具有降低Tm的作用,使得杂交保温温度可为室温(约25℃)。
上文所述的磁珠液,其组成为10μg/μL链霉亲和素磁珠,当用于80~100μL血浆样本检测时,用量为5μL。该用量足以吸附20pmpol的生物素核酸探针。
上文所述的洗涤液,其组成为:10mM 3-吗啉丙磺酸、60mM半胱氨酸、60mM乙酸钠、5%(v/v)甲酰胺、0.1%(v/v)吐温20,当用于80~100μL血浆样本检测时,用量为1mL/次。
上文所述的绿豆核酸酶液,优选的组成为:pH5.0的50mM乙酸钠缓冲液中含有30mM氯化钠、1mM氯化锌、0.04U/μL绿豆核酸酶,当用于80~100μL血浆样本检测时,用量为50μL。该用量能够1分钟内完全降解100pmol长度为30nt的单链寡核苷酸,而本发明探针体系主探针裸露的单链部分不超过24nt(=小核酸的长度),含量为20pmpol。血液游离总RNA(cfRNA)浓度以核苷酸摩尔浓度计约为1μM,100μL血浆样本中约含有100pmol总RNA,在经过裂解杂交洗涤步骤后,至酶切时体系中残留量不超过1pmol。因此,体系中绿豆核酸酶的用量足以降解全部的单链主探针和残留总RNA。
上文所述的PCR液,优选的体系组成是:50mM Tris-HCl pH8.8、50mM KCl、0.05U/μL热启动DNA聚合酶、4%(v/v)甘油、4%(v/v)甲酰胺、0.2mM dNTP、2.5mM MgCl
本发明测试优化的主要验证点为样本体积和暂存时间,裂解杂交保温时间、荧光读取温度。检测阴性样本采集自健康志愿者,不超过200μL抗凝全血或100μL血浆。该样本量的确定系由采集30名健康志愿者肝素抗凝全血,经过自然沉淀或离心沉淀后,分别吸取80~100μL上清血浆样本用于检测,体系和操作过程如前所述,结果显示所有样本全部No Ct,无肿瘤相关小核酸扩增,熔解曲线分析显示所有样本在76.0~76.3℃有Tm峰,指示内参扩增正常,表明本发明能够从100μL健康志愿者血浆样本中完全消除本底,同时,不影响内参扩增。进一步测试表明抗凝全血样本可以在常温下保存4小时或4~8℃不超过24小时,分离得到的血浆样本可在-20℃下冻存1个月,-80℃下可长期保存,避免反复冻融。检测阳性样本采集自癌症患者志愿者200μL抗凝全血,其中,肺癌、肠癌、胃癌、肝癌各5例,食管癌、胰腺癌、乳腺癌、甲状腺癌、前列腺癌各2例,阳性对照为100μL蛋白质浓度为5mg/mL的A549细胞培养液上清,阴性对照为纯化水。200μL抗凝全血样本经5000rpm 2分钟离心沉淀后,分别吸取100μL上清血浆样本用于检测,体系和操作过程如前所述,结果显示癌症样本和阳性对照均有肿瘤相关小核酸扩增,Ct值<37,熔解曲线分析显示在75.8~76.5℃有1个Tm峰,有内参扩增。阴性对照无扩增,无Tm峰。
基于本发明的12个小核酸同管联合扩增检测试剂盒,由样本释放剂、磁珠液、洗涤液、绿豆核酸酶液、PCR液、1×阳性对照等主要组分组成,各组分的具体组成同上文所述。该试剂盒常规规格为8反应/包装,包含340μL 1×样本释放剂、40μL 1×磁珠液、1.7mL 10×洗涤液、420μL 1×绿豆核酸酶液、260μL 1×PCR液、100μL阳性对照。其中,“×”指示组分中具体组成的浓度系数,1×可以直接使用,否则需调至1×。该试剂盒用于从80~100μL血浆样本检测上文所述12个小核酸。使用时,用户需要向10×洗涤液加入15.3mL纯化水。1×阳性对照为100μL蛋白质浓度为5mg/mL的A549细胞培养液上清。其余组分具体组成及检测操作与前文相同。
实施例1
本发明试剂盒的配制生产
以按该试剂盒常规规格8反应/包装生产95套为例。按通常95%的得率计划量100套,各组分及所需量见下表4,进行物料准备(表5),按说明书正文试剂盒配方配制分装。
表4. 100套计划量组分表
表5.物料清单
/>
实施例2
本发明试剂盒的质检
按下表6准备质检用参考品。
表6.本发明试剂盒的参考品
/>
然后,从按实施例1生产的试剂盒抽取7个,按本发明说明书正文方法进行检测操作,样本及检测Ct值范围如下表7:
表7.本发明试剂盒质检结果
注:Tm
实施例3
应用本发明方法和试剂盒检测体检血常规剩余抗凝全血
体检血常规通常以乙二胺四乙酸(EDTA)抗凝采集静脉血约2mL,但是用量一般不超过1mL,超过血液标本一半的剩余血常温暂存,待化验结果报告后作为医学废物处理掉。EDTA可以有效地鳌合血液中的钙离子,阻止和终止内源性或外源性凝血过程。与其他抗凝剂比较而言,其对血球的凝集及血细胞的形态影响较小,故做血常规的话常用EDTA抗凝,但由于EDTA会螯合Mg
实施例4
应用本发明方法和试剂盒检测癌症患者血常规剩余抗凝全血
癌症患者住院期间血常规检验比较频繁,通常每周1~2次,特殊情况甚至隔日1次。剩余血量远不足以进行CTC或ct/cfDNA/甲基化等测序分析,但足够进行本发明检测。利用这些剩余血进行本发明检测,有利于及时跟踪癌症患者的肿瘤负载变化。取5名肺癌患者和5名肠癌患者住院初期血常规剩余血浆各100μL于1.5mL离心管中,使用实施例1试剂盒,按本发明说明书正文描述进行检测操作,结果显示,10例样本均显示明显扩增,Ct值范围处于15.13~32.49之间,符合Ct<37的阳性判断标准,表明各有不同程度的肿瘤负载,Tm
实施例5
应用本发明方法和试剂盒检测肝素抗凝全血
生化和免疫检验分析通常使用肝素抗凝血。肝素是一种含有硫酸基团的粘多糖,富有负电荷,具有加强抗凝血酶III灭活丝氨酸蛋白酶的作用,从而阻止凝血酶的形成,并有阻止血小板聚集等多种抗凝作用。肝素可抑制分子生物学中常用的一些工具酶,如限制性内切酶、Taq酶等,可影响PCR的实验结果,通常避免用于PCR实验,但肝素同时也是良好的RNase酶抑制剂,对于样本中的RNA有一定的保护作用,这是对于RNA相关检测有利的因素。本发明方法PCR前处理过程中整合了吸附洗涤步骤,而非直接利用血液样本进行PCR,样本需求体积为200μL全血,小于生化和免疫检验分析剩余抗凝血量,因此,可以使用生化和免疫检验分析剩余抗凝血量。从已在常温暂存约4小时待废弃处理的肝素抗凝剩余血中分别吸取约100μL上清存入1.5mL离心管中,共30例,使用本发明试剂盒按本发明说明书正文方法进行检测操作,结果显示,30例样本均No Ct,表明无肿瘤相关小核酸扩增,判断为阴性结果;熔解曲线分析显示30例样本Tm
实施例6
应用本发明方法和试剂盒检测枸橼酸盐抗凝全血
输血工作中所用的抗凝剂主要是枸橼酸盐(柠檬酸盐),最常用的是枸椽三钠(柠檬酸钠)。除抗凝作用外,枸橼酸盐还能阻止溶血的发生。枸橼酸盐与所采血液中钙离子螯合,使其在凝血中反应中失去作用,在输血后又可被身体安全代谢。枸橼酸盐是现在用的所有抗凝剂储存的基本抗凝物质。从医院收集输血残留血浆100μL共10例,使用实施例1试剂盒,按本发明说明书正文描述进行检测操作,结果显示,10例样本均No Ct,表明无肿瘤相关小核酸扩增,判断为阴性结果;熔解曲线分析显示10例样本Tm
实施例7
应用本发明方法和试剂盒进行唾液检测
唾液,俗称口水,由口腔内唾液腺分泌产生。唾液具有与血清相似的成分,其成分变化能反映疾病及健康状况。唾液化验的取样不必抽血,安全无创无痛,非常便利,所以很受病人欢迎。唾液中也含有外泌体和小核酸。但研究发现,与血液不同之处在于血液中的游离核酸以小核酸为主,含量超过游离核酸含量50%,而唾液中含有大量的tRNA及片段,含量甚至超过了小核酸(miRNA)。这给传统茎环法造成很大干扰。本发明方法PCR前处理过程中整合了吸附洗涤步骤,能排除各种非靶标核酸的干扰,因此,适用于唾液小核酸检测。从30例健康志愿者收集漱口后新鲜分泌的唾液各1~2mL,吸取200μL于1.5mL离心管中,12000rpm离心1分钟后,吸取100μL上清,使用实施例1试剂盒,按本发明说明书正文描述进行检测操作,结果显示,30例样本均No Ct,表明无肿瘤相关小核酸扩增,判断为阴性结果;熔解曲线分析显示30例样本Tm
以下是本发明涉及到的序列表
表8.miRNA序列
表9.特异主探针
表10.特异辅探针
表11.上下游引物序列与锚探针
*注:锚探针与下游引物序列相同,因为裂解杂交条件比PCR条件更严苛而Tm值较低。
以上所述,仅为本发明的较佳实施例,并非对本发明任何形式上和实质上的限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。凡熟悉本专业的技术人员,在不脱离本发明的精神和范围的情况下,当可利用以上所揭示的技术内容而做出的些许更动、修饰与演变的等同变化,均为本发明的等效实施例;同时,凡依据本发明的实质技术对上述实施例所作的任何等同变化的更动、修饰与演变,均仍属于本发明的技术方案的范围内。
- 核酸释放剂、核酸PCR扩增方法和PCR扩增试剂盒
- 一种核酸提取扩增检测试剂盒及其检测方法
- 基于高分辨率熔解的多重环介导等温核酸扩增检测方法及试剂盒
- 一种微小核酸联合扩增检测方法及试剂盒
- 核酸扩增方法、核酸提取用设备、核酸扩增反应用筒以及核酸扩增反应用试剂盒
