依沙替康衍生物及其连接子-负载物和缀合物
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及生物制药领域,特别地涉及依沙替康衍生物、其连接子-负载物和缀合物、抗体-药物缀合物,以及其相应的制备方法和用途。
背景技术
在传统的肿瘤治疗中,化疗是主要的治疗策略之一。然而,正常组织中非特异性累积导致的脱靶毒性、狭窄的治疗窗口和低耐受性限制了化疗药物的开发。近几十年来,使用单克隆抗体和结合肿瘤细胞表面特异性标记物的多肽的靶向治疗表现出了比化疗小的毒性。然而,它们都缺乏杀死肿瘤细胞的效力。
1970年首次提出携带毒素的抗体选择性杀伤靶细胞的治疗策略。肿瘤靶向药物缀合物主要包括ADC,其通常将特异性识别肿瘤细胞表面抗原的抗体通过连接子与化学毒素偶联,化学毒素有效地杀伤肿瘤组织。到2021年,已有120多种ADC处于临床开发中。
大部分细胞毒性负载物属于两大家族:微管蛋白抑制剂(美登素类化合物(maytansinoid)或奥利斯他汀(auristatin))和DNA损伤剂(主要是卡奇霉素(calicheamicin))。它们都是非常有效的细胞毒性药物,其特征是IC
一些ADC研究致力于增加DAR或利用旁观者效应,提出了一种有希望的新方法,可以将细胞毒性较小的药物用作弹头。
到目前为止,绝大多数已开发的弹头为抗微管剂如奥利斯他汀(例如,单甲基奥利斯他汀E(MMAE)和F(MMAF))。Rentuximab vedotin、polatuzumab vedotin和enfortumabvedotin均为经批准的携带MMAE负载物的ADC。
拓扑异构酶I(TOP1)抑制剂已用作多种ADC的弹头。Sacituzumab govitecan携带伊立替康的活性代谢物SN-38作为弹头。Enhertu(fam-trastuzumab deruxtecan(DS8201a)又称为T-Dxd)携带依沙替康衍生物deruxtecan(Dxd)作为弹头(WO2014057687A),并且最近批准用于治疗乳腺癌。在此基础上,无论是单独使用还是作为ADC的组分,本领域亟需具有更高活性、稳定性和理化性质的新型小分子拓扑异构酶I抑制剂。
然而,一方面,Enhertu以及其他市售ADC和临床试验中的大多数ADC是通过化学偶联制备的,使用硫代琥珀酰亚胺结构(硫代琥珀酰亚胺连接)将小分子药物与靶向抗体或蛋白偶联。硫代琥珀酰亚胺结构由巯基与马来酰亚胺反应形成。硫代琥珀酰亚胺连接不稳定。在生物体内,逆Michael加成或与其他巯基交换会导致细胞毒素从ADC脱落并产生脱靶毒性,从而降低安全性并限制临床应用。例如,尽管Enhertu的效力很好,但其导致超过10%的间质性肺病,这限制了其在部分患者中的使用。另一方面,化学偶联反应并不是位点特异性的,所产生的ADC表现出高度的异质性。
仍然迫切需要具有更高效力和更低毒性的新型ADC。
发明内容
在一方面,本发明提供式(I)的化合物:
其中,
opSu为
R
n为2-20的任意整数;
k1和k2独立地为1-7的整数;
i为1-100的整数;
j为1-100的整数;
P1和P2独立地为具有式(i’)结构的负载物:
其中,
a为0或1;
标记有p1*的碳原子和标记有p2*的碳原子各自为不对称中心,并且所述不对称中心为S构型、R构型或外消旋的;
L
M为-CH
L
R
在第二方面,本发明提供具有式(II)结构的缀合物:
其中,
A为抗体或其抗原结合片段;所述抗体或其抗原结合片段优选地经修饰以与式(I)的化合物中的(Gly)
z为1-20的整数,优选1-4,特别是2;
P1、P2、R
在第三方面,本发明提供一种药物组合物,其包含本发明的缀合物,以及至少一种药学上接受的载体。
在第四方面,本发明提本发明的缀合物或者药物组合物在制备用于治疗疾病的药物中的用途,其中所述疾病为肿瘤或自身免疫疾病,优选包含HER2-阳性肿瘤细胞的肿瘤。
在第五方面,本发明提供具有式(i)结构的化合物:
其中,
a、标记有p1*的碳原子、标记有p2*的碳原子、L
在第六方面,本发明提供式(1)的化合物:
其中,k为1-7的整数,优选1或3或5,特别是5;
P为具有式(i’)结构的负载物,其中式(i’)的结构如式(I)中所定义。
附图说明
图1示出缀合物在SK-BR-3高HER2细胞系中的效力。
图2示出缀合物在NCI-N87高HER2细胞系中的效力。
图3示出缀合物在MDA-MB-468HER2阴性细胞系中的效力。
图4a和图4b示出缀合物在SK-BR-3和MDA-MB-468共培养系统中的效力。图4a显示GFP荧光检测的结果。图4b显示荧光素酶底物化学发光检测的结果。在图4a和图4b中,从左至右分别是CH-2-589、CH-2-593、CH-2-518、LC1184(8)和LC302-2-4(4)。
图5示出通过GFP荧光检测的SK-BR-3和MDA-MB-468共培养系统中缀合物的效力。
图6示出给药5mg/kg缀合物的SCID Beige小鼠JIMT1 CDX模型的平均肿瘤体积随时间的变化。
图7示出给药5mg/kg缀合物的BALB/c裸鼠Capan-1 CDX模型的平均肿瘤体积随时间的变化。
图8a和图8b示出给药5mg/kg缀合物的BALB/c裸鼠Capan-1 CDX模型的平均肿瘤体积和体重随时间的变化。
图9a和图9b示出给药5mg/kg缀合物的BALB/c裸鼠NCI-N87 CDX模型的平均肿瘤体积和体重随时间的变化。
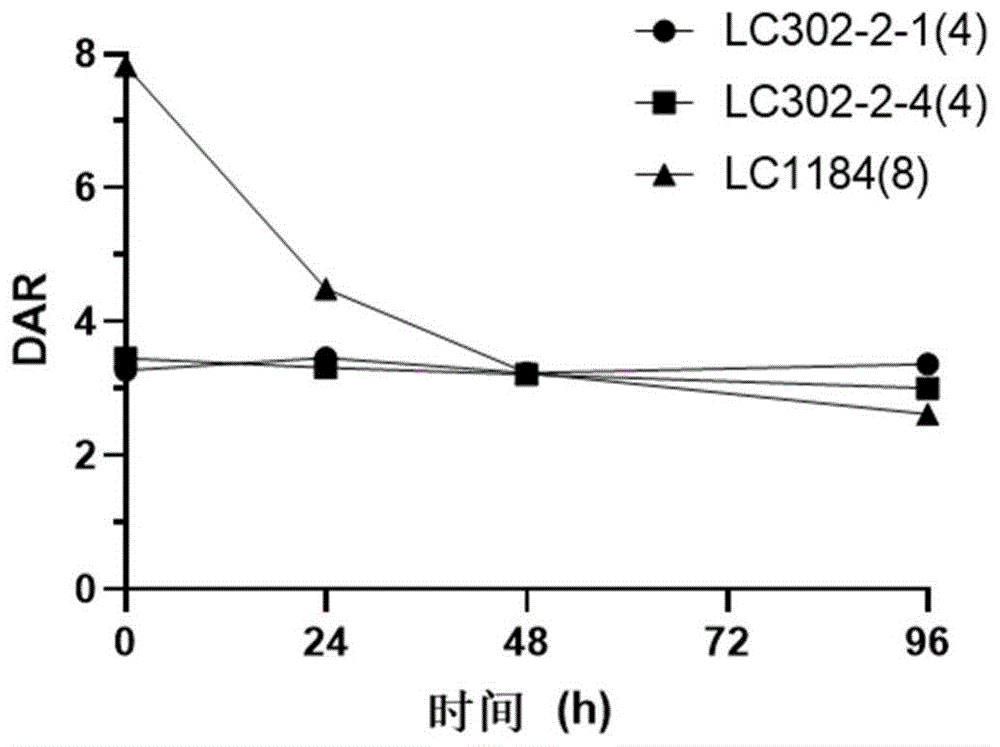
图10示出在混合的人血清中孵育0、24、48和96小时后缀合物的离体(ex-vivo)血清稳定性。
具体实施方式
下面提供具体实施方案来说明本发明的技术内容。本领域技术人员通过说明书中公开的内容可以很容易地理解本发明的其他优点和效果。本发明还可以通过其他不同的具体实施方式来实施或应用。本领域技术人员可以在不脱离本发明的精神的情况下进行各种修改和变化。
定义
除非下文另有定义,本文中使用的所有技术和科学术语与本领域技术人员通常理解的含义相同。本文使用的技术是指本领域通常理解的技术,包括对本领域技术人员显而易见的变体和等效替换。尽管相信以下术语是本领域技术人员容易理解的,但阐述以下定义以更好地说明本发明。当本文出现商品名称时,是指相应的商品或其活性成分。本文引用的所有专利、公开的专利申请和出版物均通过引用并入本文。
当以范围、优选范围或优选上限或优选下限的形式阐述某一量、浓度或其他数值或参数时,应理解为等同于具体揭示通过将任何上限或优选值与任何下限或优选值组合形成的任何范围,无论所述范围是否明确记载。除非另有说明,否则本文列出的数值范围旨在包括范围的端点以及范围内的所有整数和分数(小数)。例如,表述“i是1-20的整数”表示i是1-20的任意整数,例如i可以是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20。其他类似的表述例如j、k和g也应以类似的方式理解。
除非上下文另有明确规定,否则“一种(个)”和“该种(个)”等单数形式包括复数形式。表述“一种(个)或多种(个)”或“至少一种(个)”可表示1、2、3、4、5、6、7、8、9或更多。
术语“约”和“大约”当与数值变量一起使用时,通常意味着变量的值和变量的所有值都在实验误差范围内(例如,在平均值的95%置信区间内)或在指定值的±10%或更宽的范围内。
术语“可选”或“任选”是指随后描述的事件可能发生但不一定发生,并且描述包括其中所述事件或情况发生或不发生的情况。
表述“包含”、“包括”、“含有”和“具有”是开放式的,并且不排除额外的未列举的元素、步骤或成分。表述“由……组成”不包括未指定的任何元素、步骤或成分。表述“基本上由...组成”是指范围限于指定的元素、步骤或成分,以及任选存在的不会实质性地影响要求保护的主题的基本和新颖特征的元素、步骤或成分。应当理解,表述“包含”包括表述“基本上由……组成”和“由……组成”。
如本文所用,术语“抗体”以广泛的方式使用,特别包括完整的单克隆抗体、多克隆抗体、单特异性抗体、多特异性抗体(例如双特异性抗体)和抗体片段,只要它们具有所需的生物活性。抗体可以是任何亚型(例如IgG、IgE、IgM、IgD和IgA)或亚类,并且可以来源于任何合适的物种。在一些实施方案中,抗体是人或鼠源的。抗体也可以是全人抗体、人源化抗体或通过重组方法制备的嵌合抗体。
本文所用的单克隆抗体是指从基本上均质的抗体群获得的抗体,即除了少数可能的天然突变外,构成群体的个体抗体是相同的。单克隆抗体对单个抗原位点具有高度特异性。“单克隆”一词是指抗体的特征来源于基本上均质的抗体群,不应解释为需要一些特定的方法来产生抗体。
完整抗体或全长抗体基本上包含抗原结合可变区以及轻链恒定区(CL)和重链恒定区(CH),其可包括CH1,CH2、CH3和CH4,取决于抗体的亚型。抗原结合可变区(也称为片段可变区,Fv片段)通常包含轻链可变区(V
抗体片段可包含完整抗体的一部分,优选其抗原结合区或可变区。抗体片段的实例包括Fab、Fab'、F(ab')2、由V
本发明的抗体可以使用本领域熟知的技术制备,例如以下技术或其组合:重组技术、噬菌体展示技术、合成技术或本领域已知的其他技术。例如,基因工程重组抗体(或抗体模拟物)可以通过合适的培养系统(例如,大肠杆菌(E.Coli)或哺乳动物细胞)表达。所述工程化可以指例如在其末端引入连接酶特异性识别序列。
HER2是指人表皮生长因子受体-2,属于表皮生长因子(EGFR)受体酪氨酸激酶家族。在本申请中,术语ErbB2和HER2具有相同含义并且可以互换使用。
如本文所用,术语“抗体-药物缀合物”称为“缀合物”。
小分子化合物是指大小与通常用于药物的有机分子相当的分子。该术语不涵盖生物大分子(例如蛋白质、核酸等),但涵盖低分子量肽或其衍生物,例如二肽、三肽、四肽、五肽等。通常小分子化合物的分子量例如可以为约100-约2000Da、约200-约1000Da、约200-约900Da、约200-约800Da、约200-约700Da、约200-约600Da、约200-约500Da。
“间隔子(spacer)”是指位于不同结构模块之间,可以从空间上将结构模块间隔开的结构。间隔子的定义并不限定是否具有一定的功能,也不限定是否能在体内被切断或降解。间隔子的实例包括但不限于氨基酸和非氨基酸结构,其中非氨基酸结构可以但不限于是氨基酸衍生物或类似物。“间隔序列(Spacer sequence)”是指作为间隔子的氨基酸序列,其实例包括但不限于单个氨基酸、含有多个氨基酸的序列,例如含有两个氨基酸的序列,如GA等,或者例如GGGGS、GGGGSGGGGS、GGGGSGGGGSGGGGS等。自切除间隔子是共价组件,其使得前体中的保护性部分激活后两个化学键相继裂解:保护性部分(例如可切割序列)在激活后被去除,引发级联的分解反应,导致按先后顺序释放较小分子。自切除间隔子的实例包括但不限于PABC(对苄氧基羰基)、缩醛、杂缩醛及其组合。
术语“烷基”是指由碳原子和氢原子组成的饱和脂肪烃基团,其通过单键与分子的其余部分连接。烷基包括直链烷基、支链烷基或环状烷基(环烷基)或部分环状烷基(例如,环烷基-直链烷基和环烷基-支链烷基)。烷基可以含有1-10个碳原子,称为C
术语“环状烷基”和“环烷基”在本文中具有相同的含义,并且可以互换使用。环烷基可以包括单环或多环(例如具有2个或多于2个稠环)基团。在多环环烷基中,两个或更多个环可以稠合或桥接或螺合在一起。环烷基的形成环的碳原子可以任选地被氧代(即C(O))取代。环烷基可以具有3、4、5、6、7、8、9或10个成环碳原子(C
术语“部分环状”是指该基团含有一个或多个环状部分和一个或更多个非环状(即直链或支链)部分。部分环状烷基可以包含环烷基-直链烷基和环烷基-支链烷基。部分环状烷基可以具有4、5、6、7、8、9或10个碳原子(C
二价基团是指由相应的一价基团的具有自由价电子的碳原子去除一个氢原子从而获得的基团。二价基团具有两个与分子其余部分相连的连接位点,其中两个连接位点可以位于所述二价基团的相同原子或两个不同原子上。
“亚烷基(alkylene)”或“亚烷基(alkylidene)”指饱和二价烃基。亚烷基包括直链、支链、环状或部分环状基团。直链亚烷基的实例包括但不限于亚甲基(-CH
术语“亚环烷基”和“环状亚烷基”在本文中具有相同的含义,并且可以互换使用。亚环烷基的实例包括但不限于亚环丙基、亚环丁基、亚环戊基、亚环己基、亚环庚基和亚环辛基以及包含稠环、螺环或桥环的二价多环烷基。在一些实施方案中,亚环烷基为C
部分环状亚烷基可以包含二价基团,其中连接至分子其余部分的两个连接位点可以都在所述一个或多个直链或支链烷基部分上,或者都在所述一个或多个环烷基部分上,或者分别在环烷基部分和直链或支链烷基部分上。部分环状亚烷基的实例包括但不限于(1)亚环丙基、亚环丁基、亚环戊基、亚环己基、亚环庚基和亚环辛基以及包含稠环、螺环或桥环的二价多环烷基,其各自独立地被一个或多个直链或支链烷基取代;(2)直链或支链亚烷基,其各自独立地被一个或多个环烷基取代;和(3)通过组合一个或多个亚环烷基与一个或多个直链或支链亚烷基形成的基团,条件是形成化学上稳定的结构。在一些实施方案中,部分环状亚烷基为C
本发明化合物可以同位素标记或富集的形式存在,包含一个或多个与自然界最普遍原子质量和质量数不同的原子。同位素可以为放射性或非放射性同位素。原子如氢、碳、氮、氧、磷、硫、氟、氯和碘的同位素包括,但不仅限于,
如本文所用,表述“抗体缀合的药物”和“抗体药物缀合物”具有相同的含义。
式(i)的化合物
在一方面,本发明提供化合物或者其药学上接受的盐、立体异构体、溶剂化物、多晶型、互变异构体、同位素化合物、代谢物或前药,其中所述化合物具有式(i)的结构:
其中,
a为0或1;
标记有p1*的碳原子和标记有p2*的碳原子各自为不对称中心,并且所述不对称中心为S构型、R构型或外消旋的;
L
M为-CH
L
R
在一实施方案中,L
在一实施方案中,a为1,M为-CH
在一实施方案中,标记有p1*的碳原子为S构型或外消旋的,优选S构型。在另一实施方案中,标记有p2*的碳原子为S构型或外消旋的,优选S构型。
在一实施方案中,R
在一实施方案中,a为0,L
在一实施方案中,a为0,R
在一实施方案中,a为1,R
在一实施方案中,所述化合物选自:
/>
/>
在一实施方案中,所述化合物选自:
/>
在一优选的实施方案中,所述化合物选自:
/>
在一优选的实施方案中,所述化合物选自:
在更优选的实施方案中,所述化合物选自:
在一特别的实施方案中,所述化合物选自:
在一方面,本发明提供选自以下的化合物:
式(I)的化合物
在一方面,本发明提供具有式(I)结构的化合物:
其中,
opSu为
R
n为2-20的任意整数;
k1和k2独立地为1-7的整数;
i为1-100的整数;
j为1-100的整数;
P1和P2独立地为具有式(i’)结构的负载物:
其中,
a、标记有p1*的碳原子、标记有p2*的碳原子、L
在一实施方案中,负载物(payload)选自:
/>
/>
在一实施方案中,负载物选自:
/>
在一优选的实施方案中,负载物选自:
/>
在一优选的实施方案中,负载物选自:
在更优选的实施方案中,负载物选自:
在一特别的实施方案中,负载物选自:
在一实施方案中,R
在一实施方案中,n为2-5的整数。在一特别的实施方案中,n为3。
在一实施方案中,k1和k2独立地为1或3或5。在一特别的实施方案中,k1和k2独立地为5。
在一实施方案中,i独立地为1-20的整数,优选1-12,更优选2-8。在一特别的实施方案中,i为4。
在一实施方案中,j独立地为1-20的整数,优选1-12,更优选8-12,特别是8或12。在一特别的实施方案中,j为12。
在一实施方案中,式(I)化合物具有式(I-1)的结构
/>
其中,
P1、P2、R
在一实施方案中,式(I)化合物选自:
式(I)化合物的具体实施方式
在一实施方案中,式(I)化合物的结构如下表所示。
注:对于所有的化合物,P1和P2相同,并且如负载物所述。
式(I)化合物的制备
在一实施方案中,式(I)化合物可以通过将连接子与负载物连接,或者通过连接一系列合适的构建模块(building block)来制备。这样的构建模块可以通过逆向合成分析容易地设计,并且可以使用本领域已知的任何反应。
在一方面,本发明提供具有式(1)结构的化合物:
其中,
k为1-7的整数;
P为具有式(i’)结构的负载物,其中式(i’)的结构如上文所定义。
在一优选的实施方案中,k为1或3或5。在一特别的实施方案中,k为5。
式(1)化合物可以使用式(i)化合物和其他需要的构建模块,使用与EP2907824A中公开的合成方法类似的方法(例如,EP2907824A的式(2)或(2b)的合成方法)来合成。合适的构建模块包括但不限于连接单元HX20113和连接单元HX20111。
然后,其中的马来酰亚胺基团可以与式(I)化合物的另一构建模块上的巯基反应。所得的硫代琥珀酰亚胺在生理条件下是不稳定的,并且容易进行逆Michael加成,从而导致连接位点的裂解。此外,当系统中存在另一种巯基化合物时,硫代琥珀酰亚胺也可以与另一种巯基化合物进行巯基交换。这两种反应都会导致负载物脱落以及导致毒性副作用。然后对硫代琥珀酰亚胺进行开环反应。然后可以获得式(I)化合物。
开环反应的方法可见WO2015165413A1。包含开环琥珀酰亚胺部分的化合物可以通过半制备/制备HPLC或其他合适的分离手段进行纯化,以实现高纯度和确定的组成,而不管琥珀酰亚胺开环反应的效率如何。
在本发明中,当应用于连接子-负载物(连接子-小分子中间体)时,开环琥珀酰亚胺结构不再经历逆Michael加成或硫醇交换,因此产物更稳定。
包含连接酶受体或供体底物的识别序列的部分
在一实施方案中,式(I)化合物的(Gly)
在一实施方案中,连接酶是转肽酶。在一实施方案中,连接酶选自天然转肽酶、非天然转肽酶、其变体及其组合。非天然转肽酶可以是但不限于通过工程化天然转肽酶获得的那些。在一优选实施方案中,连接酶选自天然Sortase酶、非天然Sortase酶及其组合。天然Sortase酶的种类包括Sortase A、Sortase B、Sortase C、Sortase D、SortaseL.plantarum等(US20110321183A1)。连接酶的类型对应于连接酶识别序列,从而用于实现不同分子或结构片段之间的特异性缀合。
在一实施方案中,式(I)化合物的(Gly)
在一些实施方案中,连接酶是Sortase酶,其选自Sortase A、Sortase B、SortaseC、Sortase D和Sortase L.plantarum。
在一特别的实施方案中,连接酶是来自金黄色葡萄球菌(Staphylococcusaureus)的Sortase A。因此,连接酶识别序列可以是该酶的典型识别序列LPXTG。在又一特别的实施方案中,连接酶供体底物识别序列为LPXTGJ,连接酶受体底物识别序列为G
在一实施方案中,连接酶为来自金黄色葡萄球菌(Staphylococcus aureus)的Sortase B,对应的供体底物识别序列可以是NPQTN。在另一实施方案中,连接酶为来自炭疽杆菌(Bacillus anthracis)的Sortase B,对应的供体底物识别序列可以是NPKTG。
在又一实施方案中,连接酶为来自酿脓链球菌(Streptococcus pyogenes)的Sortase A,对应的供体底物识别序列可以是LPXTGJ,其中J如上文所定义。在另一实施方案中,连接酶为来自天蓝链霉菌(Streptomyces coelicolor)的Sortase subfamily 5,对应的供体底物识别序列可以是LAXTG。
在又一实施方案中,连接酶为来自植物乳杆菌(Lactobacillus plantarum)的Sortase A,对应的供体底物识别序列可以是LPQTSEQ。
连接酶识别序列也可以是人工筛选优化的其他全新的转肽酶识别序列。
缀合物及其制备
此外,具有包含连接酶识别序列的部分的带有负载物的化合物(式(I)化合物)可以与包含连接酶识别序列的其他分子缀合,从而可以用于例如抗体-小分子缀合物的制备,例如抗体-药物缀合物。因此,在又一方面,本发明提供了一种缀合物,其包含式(I)化合物以及抗体或抗原结合片段。
在另一方面,本发明提供一种缀合物,其具有式(II)的结构:
其中,
A为抗体或其抗原结合片段;
z为1-20的整数;
P1、P2、R
在一优选的实施方案中,抗体或抗原结合片段经修饰以与式(I)化合物中的(Gly)
在一优选的实施方案中,z为1-4。在一特别的实施方案中,z为2。
抗体或其抗原结合片段
在一实施方案中,抗体是抗CD19抗体,抗CD20抗体,抗CD22抗体,抗CD25抗体,抗CD30/TNFRSF8抗体,抗CD33抗体,抗CD37抗体,抗CD44v6抗体,抗CD56抗体,抗CD70抗体,抗CD71抗体,抗CD74抗体,抗CD79b抗体,抗CD117/KITk抗体,抗CD123抗体,抗CD138抗体,抗CD142抗体,抗CD174抗体,抗CD227/MUC1抗体,抗CD352抗体,抗CLDN18.2抗体,抗DLL3抗体,抗ErbB2/HER2抗体,抗CN33抗体,抗GPNMB抗体,抗ENPP3抗体,抗Nectin-4抗体,抗EGFRvⅢ抗体,抗SLC44A4/AGS-5抗体,抗CEACAM5抗体,抗PSMA抗体,抗TIM1抗体,抗LY6E抗体,抗LIV1抗体,抗Nectin4抗体,抗SLITRK6抗体,抗HGFR/cMet抗体,抗SLAMF7/CS1抗体,抗EGFR抗体,抗BCMA抗体,抗AXL抗体,抗NaPi2B抗体,抗GCC抗体,抗STEAP1抗体,抗MUC16抗体,抗Mesothelin抗体,抗ETBR抗体,抗EphA2抗体,抗5T4抗体,抗FOLR1抗体,抗LAMP1抗体,抗Cadherin6抗体,抗FGFR2抗体,抗FGFR3抗体,抗CA6抗体,抗CanAg抗体,抗integrinαV抗体,抗TDGF1抗体,抗EphrinA4抗体,抗TROP2抗体,抗PTK7抗体,抗NOTCH3抗体,抗C4.4A抗体,抗FLT3抗体,抗B7H3/4抗体,抗TissueFactor抗体或抗ROR1/2抗体;优选抗HER2抗体,抗FGFR3抗体,抗Trop2抗体,抗HER3抗体或抗FRɑ抗体。
在一优选的实施方案中,抗体是抗HER2抗体。在一实施方案中,抗体是抗人HER2抗体。抗人HER2抗体的实例包括但不限于帕妥珠单抗(Pertuzumab)和曲妥珠单抗(Trastuzumab)。帕妥珠单抗与HER2的第二个胞外结构域(ECD2)结合,并被批准用于治疗HER2阳性乳腺癌。曲妥珠单抗与HER2的第四个胞外结构域(ECD4)结合,被批准用于治疗HER2阳性乳腺癌和胃癌。
在一实施方案中,抗体是抗HER2抗体或其抗原结合片段,包含轻链可变区(V
在一优选的实施方案中,抗人HER2抗体是重组抗体,其选自单克隆抗体、嵌合抗体、人源化抗体、抗体片段和抗体模拟物。在一实施方案中,抗体模拟物选自scFv、微型抗体、双抗、纳米抗体。对于与式(I)化合物的缀合,本发明的抗体或其抗原结合片段可以包含修饰部分以与式(I)化合物中的(Gly)
在一可选的实施方案中,用于与式(I)化合物中的(Gly)
在一实施方案中,抗体或其抗原结合片段可以包含末端修饰。末端修饰是指在抗体的重链或轻链的C末端或N末端的修饰,其例如包含连接酶识别序列。在另一实施方案中,末端修饰可以进一步包含包含2-100个氨基酸的间隔子Sp,其中抗体、Sp和连接酶识别序列顺序连接。在一优选的实施方案中,Sp是包含2-20个氨基酸的间隔子序列。在一特别的实施方案中,Sp是选自GA、GGGGS、GGGGSGGGGS和GGGGSGGGGSGGGGS的间隔子序列,特别是GA。
在一优选的实施方案中,抗体或其抗原结合片段的轻链包括3种类型:野生型(LC);通过直接引入连接酶识别序列LPXTG进行修饰的C-端修饰轻链(LCCT)和通过引入短肽间隔子和连接酶供体底物识别序列LPXTG进行修饰的C-末端修饰轻链(LCCT
在一实施方案中,式(II)化合物选自:
缀合物具体实施方式
在一实施方案中,负载物是细胞毒素或其片段。在一实施方案中,抗体-药物缀合物如下表所示。
ADC的命名法:括号中的数字表示意图连接到抗体的负载物(药物)分子的数量。
注:1.对于列出的所有ADC,P1和P2相同,并且如负载物所述;z为2,;抗体为Ab0001-LCCT
2.当上述ADC由相应的上述连接子-负载物和相应的上述抗体(靶向分子)形成时,抗体中的LPETGG序列中GG的上游肽键被Sortase A裂解,生成的中间体连接到连接子-负载物中G
缀合物的制备
本发明的缀合物(即,式(II)化合物)可以通过本领域已知的任何方法制备。在一些实施方案中,缀合物通过抗体或抗原结合片段和式(I)化合物在连接酶催化下进行位点特异性缀合来制备,其中抗体或抗原结合片段被连接酶识别序列修饰。
抗体或其抗原结合片段与式(I)化合物通过底物的连接酶特异性识别序列相互连接。识别序列取决于所使用的特定连接酶。在一实施方案中,抗体或其抗原结合片段是在轻链和/或重链的C端引入基于识别序列的末端修饰的抗体,并且抗体或其抗原结合片段在野生型或优化的工程连接酶或其任何组合的催化下,以及在合适的催化反应条件下与式(I)化合物缀合。
在一具体的实施方案中,连接酶是Sortase A,缀合反应可以由以下方案表示:
三角形代表抗体的一部分;五边形代表式(II)化合物的一部分,G
因此,在一实施方案中,式(I)化合物中的G
优选地,
(a)连接酶是Sortase酶,其选自Sortase A、Sortase B、Sortase C、Sortase D和Sortase L.plantarum;优选来自金黄色葡萄球菌(Staphylococcus aureus)的Sortase A;和/或
(b)连接酶供体底物识别序列为LPXTGJ,J不存在或为G
LPXTGJ与G
本发明的式(I)化合物具有确定的结构、确定的组成和高纯度,因此当进行与抗体的缀合反应时,只会引入极少的杂质或不引入其他杂质。当这样的中间体用于与含有连接酶识别序列的修饰抗体进行连接酶催化的位点特异性缀合时,获得质量高度可控的均质ADC。
缀合物在生理环境中的代谢
当连接子的部分或整体在肿瘤细胞中被裂解时,负载物被释放。由于连接子在与抗肿瘤化合物连接的位置被裂解,抗肿瘤化合物以其固有结构释放以显示其固有的抗肿瘤作用。
在一实施方案中,式(I)化合物包含的GGFG(Gly-Gly-Phe-Gly)部分可以被溶酶体酶(例如组织蛋白酶B和/或组织蛋白酶L)裂解。
在一实施方案中,式(I)化合物包含自切除间隔子。在一实施方案中,自切除间隔子是缩醛或杂缩醛。在一实施方案中,式(I)化合物包含的-GGFG-NH-CH
药物组合物和药物制剂
本发明的另一目的是提供一种药物组合物,其包含本发明的缀合物,以及至少一种药学上接受的载体。
本发明的药物组合物可以以任何方式给药,只要其达到预防、缓解、预防或治疗人或动物症状的效果。例如,可根据给药途径制备各种合适的剂型,特别是注射剂,如注射用冻干粉、注射用无菌粉。
术语“药学上接受的”是指在正常医学判断范围内与患者组织接触时,不会产生过度毒性、刺激或过敏反应等,具有合理的利弊比,并对预期用途有效。
术语“药学上接受的载体”是指药学上可以接受且不干扰缀合物的生物活性和性质的那些载体材料。水性载体的实例包括但不限于缓冲盐水等。药学上可接受的载体还包括使组合物接近生理条件的载体材料,例如pH调节剂、缓冲剂、毒性调节剂等,以及乙酸钠、氯化钠、氯化钾、氯化钙、乳酸钠等。
在一实施方案中,本发明的药物组合物的药物/抗体比(DAR)为约1-约20的整数或非整数,例如约1-10、约1-8、约1-约6、约1-约4、约2-约5、约2-约4、或约3-约4的整数或非整数。在一特别的实施方案中,本发明的缀合物具有约4的DAR。在一特别的实施方案中,本发明的缀合物具有约3.3-约3.75,尤其是约3.4-约3.65的DAR。
治疗方法和用途
本发明的缀合物可用于治疗肿瘤和/或自身免疫疾病。对缀合物治疗敏感的肿瘤包括以特定肿瘤相关抗原或细胞表面受体为特征的肿瘤,这些肿瘤细胞能被缀合物中的靶向分子(抗体)识别,进而可以被缀合物中的负载物/细胞毒素杀伤。
因此,在又一方面,本发明还提供本发明的缀合物或本发明的药物组合物在制备治疗疾病、病症或病况的药物中的用途,所述疾病、病症或病况选自肿瘤或自身免疫疾病。
在另一方面,本发明提供本发明的缀合物或本发明的药物组合物,用于治疗肿瘤或自身免疫疾病。
在进一步的方面,本发明提供一种治疗肿瘤或自身免疫疾病的方法,所述方法包括向有此需要的个体给药有效量的本发明的缀合物或本发明的药物组合物。
在一优选的实施方案中,本发明提供的抗HER2抗体与小分子细胞毒素连接形成的缀合物可与肿瘤细胞表面的HER2特异结合,选择性杀伤表达HER2的肿瘤细胞。在另一优选的实施方案中,抗HER2抗体是抗人HER2抗体。在另一优选的实施方案中,本发明提供本发明的缀合物或本发明的药物组合物在制备治疗疾病、病症或病况的药物中的用途,所述疾病、病症或病况选自HER2阳性的肿瘤。在一更优选的实施方案中,所述疾病、病症或病状选自乳腺癌、胃癌、肺癌、卵巢癌和尿路上皮癌等。
给予受试者的缀合物的剂量可以在相当大的程度上进行调整。剂量可以根据具体的给药途径和受试者的需要而变化,并且可以经过医疗保健专业人员的判断。
如以上所定义,本发明的实施方案还可以描述如下[1]至[20]:
[1]式(I)的化合物:
其中,
opSu为
R
n为2-20的任意整数;
k1和k2独立地为1-7的整数;
i为1-100的整数;
j为1-100的整数;
P1和P2独立地为具有式(i’)结构的负载物:
其中,
a为0或1;
标记有p1*的碳原子和标记有p2*的碳原子各自为不对称中心,并且所述不对称中心为S构型、R构型或外消旋的;
L
M为-CH
L
R
[2]权利要求[1]的化合物,其具有式(I-1)的结构
其中,
P1、P2、R
[3]权利要求[1]或[2]的化合物,其中,在式(i’)中:
L
优选地,
L
优选地,L
更优选地,L
进一步优选地,L
特别地,L
和/或
卤素选自F、Cl和Br。
[4]权利要求[1]-[3]中任一项的化合物,其中,在式(i’)中
M为-CH
M为-CH
[5]权利要求[1]-[4]中任一项的化合物,其中,在式(i’)中
标记有p1*的碳原子为S构型或外消旋的,优选S构型;和/或
标记有p2*的碳原子为S构型或外消旋的,优选S构型。
[6]权利要求[1]-[5]中任一项的化合物,其中,在式(i’)中
R
优选地,R
更优选地,
R
R
进一步优选地,
a为0,R
a为0,R
a为1,R
[7]权利要求[1]-[6]中任一项的化合物,其中,所述负载物选自:
/>
优选选自:
更优选选自:
特别地选自:
[8]权利要求[1]-[7]中任一项的化合物,其中,
R
n为2-5的整数,特别是3;和/或
k1和k2独立地为1或3或5,特别是5;
i独立地为1-20的整数,优选1-12,更优选2-8,特别是4;和/或
j独立地为1-20的整数,优选1-12,更优选8-12,特别是8或12,尤其是12。
[9]权利要求[1]-[8]中任一项的化合物,其选自
/>
[10]一种缀合物,其具有式(II)的结构:
其中,
A为抗体或其抗原结合片段;所述抗体或其抗原结合片段优选地经修饰以与式(I)的化合物中的(Gly)
z为1-20的整数,优选1-4,特别是2;
P1、P2、R
[11]权利要求[10]的缀合物,其选自:
/>
[12]权利要求[10]或[11]的缀合物,其中
所述抗体是抗人HER2抗体,优选曲妥珠单抗。
[13]一种药物组合物,其包含预防或治疗有效量的权利要求[10]-[12]中任一项的缀合物,以及至少一种药学上接受的载体。
[14]权利要求[13]的药物组合物,其中所述缀合物的药物/抗体比(DAR)为1-8的整数或非整数,特别是3-4的整数或非整数。
[15]权利要求[10]-[12]中任一项的缀合物或者权利要求[13]或[14]的药物组合物在制备用于治疗疾病的药物中的用途,其中所述疾病为肿瘤或自身免疫疾病,优选包含HER2-阳性肿瘤细胞的肿瘤。
[16]权利要求[15]的用途,其中所述包含HER2-阳性肿瘤细胞的肿瘤还包含HER2低表达肿瘤细胞;
其中所述HER2低表达肿瘤细胞表达的HER2水平低于所述HER2-阳性肿瘤细胞。
[17]一种化合物或者其药学上接受的盐、立体异构体、溶剂化物、多晶型、互变异构体、同位素化合物、代谢物或前药,其中所述化合物具有式(i)的结构:
其中,
a、标记有p1*的碳原子、标记有p2*的碳原子、L
[18]权利要求[17]的化合物,其选自:
/>
优选选自:
更优选选自:
特别地选自:
[19]式(1)的化合物:
其中,
k为1-7的整数,优选1或3或5,特别是5;
P为具有式(i’)结构的负载物,其中式(i’)的结构如权利要求[1]-[7]中任一项所定义。
[20]权利要求[19]的化合物,其选自:
有益效果
本发明提供的新型小分子拓扑异构酶I抑制剂,单独使用或作为ADC的组分使用,可显示出比现有技术更高的活性、稳定性和理化性质。
本发明的抗体药物缀合物使用特别设计的连接子-负载物(Linker-payload),可以实现高效力和旁观者(bystander)杀伤效果。同时,其具有较低的DAR,因此可以减少副作用并提高治疗指数,这对于旁观者杀伤尤为重要。本发明的抗体药物缀合物在其结构例如开环琥珀酰亚胺结构方面更稳定。
本发明利用具有独特结构的连接子并使用连接酶催化靶向分子(抗体)与负载物缀合。本发明的缀合物的均质性好,活性高。此外,连接单元-负载物中间体的毒性远低于游离负载物,因此药物的制造过程危害较小,有利于工业化生产。
本发明的缀合物实现至少一种以下技术效果:
(1)对靶标细胞有高抑制活性,并有较强的旁观者杀伤作用。
(2)优异的物理化学性质(例如溶解度、物理和/或化学稳定性)。
(3)优异的药物代谢动力学性质(例如在血浆中良好的稳定性、合适的半衰期和作用持续时间)。
(4)优异的安全性(对非靶标的正常细胞或组织较低的毒性和/或较少的副作用,较宽的治疗窗)等。
(5)高度模块化设计,能简单地组装多种药物。
实施例
制备实施例
为了更清楚地说明本发明的目的和技术方案,下面结合具体实施例对本发明作进一步的说明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未提及的具体实验方法,均按照常规实验方法进行。
仪器、材料与试剂
除非特别说明,实施例中所使用的仪器和试剂均为可商购的。试剂可以不经进一步纯化而直接使用。
MS:Thermo Fisher Q Exactive Plus,Water2795-Quattro微型三重四级杆质谱仪
HPLC:Waters 2695,Agilent 1100,Agilent 1200
半制备HPLC:Lisure HP plus 50D
流式细胞仪:CytoFLEX S
HIC-HPLC:Butyl-HIC;流动相A:25mM PB,2M(NH
SEC-HPLC:色谱柱:TSK-gel G3000 SWXL,TOSOH 7.8mm ID×300mm,5μm;流动相:0.2M KH
CHO细胞获得自Thermo Fisher Scientific;pcDNA3.3获得自Life Technology;HEK293F获得自普瑞金(Prejin);PEIMAX转染试剂获得自Polyscience;MabSelect SureProA获得自GE;Capto S ImpAct获得自GE;Rink-amide-MBHA-树脂及二氯树脂获得自南开合成(Nankai synthesis);HCC1954获得自ATCC CAT#CRL-2338;SK-BR-3获得自ATCC CAT#HTB-30;BT-474获得自ATCC CAT#HTB-20;NCI-N87(ATCC Cat#CRL-5822);MCF7获得自ATCCCAT#HTB-22;MDA-MB-231获得自ATCC CAT#HTB-26;MDA-MB-468获得自ATCC CAT#HTB-132;CFPAC-1获得自ATCC CAT#CRL-1918;NCI-H2110获得自ATCC CAT#CRL-5924;JIMT-1获得自药明康德(Wuxi Apptech);Capan-1获得自ATCC CAT#CRL-1573;抗体曲妥珠单抗按照已知序列制备;在大肠杆菌(E.coli)中制备源自金黄色葡萄球菌(Staphylococcus aureus)的优化重组酶Sortase A。
在某些情况下,可以改变进行上述反应方案的顺序以促进反应或避免不需要的反应产物。提供以下实施例以便可以更充分地理解本发明。这些实施例仅是说明性的,不应解释为以任何方式限制本发明。
实施例1负载物小分子的制备
中间体11
步骤A:N-(2-溴-5-氟苯基)乙酰胺:搅拌下,向乙酸酐(214g,2.10mol)在乙酸(500mL)中的溶液添加浓H
步骤B:N-(5-氟-2-(1-羟基环丁基)苯基)乙酰胺:在-78℃下,搅拌下,于1h内,向N-(2-溴-5-氟苯基)乙酰胺(105g,452.48mmol)在THF(1000mL)中的溶液滴加n-BuLi(594mL,1.6M,正己烷中,950.22mmol)。完成后,将混合物在N
步骤C:N-(3-氟-8-氧代-5,6,7,8-四氢萘-1-基)乙酰胺:搅拌下,向N-(5-氟-2-(1-羟基环丁基)苯基)乙酰胺(24g,107.50mmol)在CH
步骤D:N-(3-氟-7-(羟基亚氨基)-8-氧代-5,6,7,8-四氢萘-1-基)乙酰胺:于0℃下,搅拌下,向N-(3-氟-8-氧代-5,6,7,8-四氢萘-1-基)乙酰胺(14g,63.28mmol)在THF(500mL)中的混合物添加1-亚硝酸丁酯(8.48g,63.28mmol),然后添加t-BuOK(8.52g,75.94mmol)。将混合物在0℃下搅拌2h。完成后,将混合物用HCl(2N)酸化以调节至pH=3。将混合物用乙酸乙酯(200mL x 3)萃取,用盐水(100mL x 2)洗涤,用Na
步骤E:N,N'-(3-氟-8-氧代-5,6,7,8-四氢萘-1,7-二基)二乙酰胺:向N-(3-氟-7-(羟基亚氨基)-8-氧代-5,6,7,8-四氢萘-1-基)乙酰胺(12g,47.96mmol)在乙酸酐(90mL)和THF(90mL)中的溶液添加10%Pd/C(1g),将混合物于25℃下,在H
步骤F:N,N'-(3-氟-8-氧代-5,6,7,8-四氢萘-1,7-二基)二乙酰胺:向N,N'-(3-氟-8-氧代-5,6,7,8-四氢萘-1,7-二基)二乙酰胺(7.9g,28.39mmol)在MeOH(150mL)中的溶液添加HCl水溶液(2N,150mL),将混合物在50℃下搅拌7h。冷却至0℃后,滴加饱和NaHCO
步骤G:N-(8-氨基-5-氯-6-氟-1-氧代-1,2,3,4-四氢萘-2-基)乙酰胺:在0℃下,向N,N'-(3-氟-8-氧代-5,6,7,8-四氢萘-1,7-二基)二乙酰胺(4.0g,16.93mmol)在DMF(80mL)中的溶液分批添加NCS(2.26g,16.93mmol),将混合物在室温下搅拌16h。将混合物倒入200mL冰水中。沉淀形成,将其通过过滤收集并在室温下真空干燥以获得黄色固体状的N-(8-氨基-5-氯-6-氟-1-氧代-1,2,3,4-四氢萘-2-基)乙酰胺(4.0g)。
步骤H:N-((9S)-4-氯-9-乙基-5-氟-9-羟基-10,13-二氧代-2,3,9,10,13,15-六氢-1H,12H-苯并[de]吡喃并[3',4':6,7]吲哚嗪并[1,2-b]喹啉-1-基)乙酰胺:向N-(8-氨基-5-氯-6-氟-1-氧代-1,2,3,4-四氢萘-2-基)乙酰胺(4.0g,14.78mmol)在甲苯(400mL)中的混合物添加(S)-4-乙基-4-羟基-7,8-二氢-1H-吡喃并[3,4-f]吲哚嗪-3,6,10(4H)-三酮(4.28g,16.25mmol)、对甲苯磺酸吡啶鎓(1.11g,4.43mmol)和邻甲酚(10mL),将混合物在N
步骤I:(9S)-1-氨基-4-氯-9-乙基-5-氟-9-羟基-1,2,3,9,12,15-六氢-10H,13H-苯并[de]吡喃并[3',4':6,7]吲哚嗪并[1,2-b]喹啉-10,13-二酮:在70℃下,将N-((9S)-4-氯-9-乙基-5-氟-9-羟基-10,13-二氧代-2,3,9,10,13,15-六氢-1H,12H-苯并[de]吡喃并[3',4':6,7]吲哚嗪并[1,2-b]喹啉-1-基)乙酰胺(2.0g,4.02mmol)在20mL浓HCl水溶液中的混合物在N
中间体12
中间体12:(9S)-1-氨基-4-溴-9-乙基-5-氟-9-羟基-1,2,3,9,12,15-六氢-10H,13H-苯并[de]吡喃并[3',4':6,7]吲哚嗪并[1,2-b]喹啉-10,13-二酮氢溴酸盐利用与中间体11类似的方法,从2-溴-5-氟苯胺合成。LCMS(ESI)m/z 500.0[M+H]
中间体13
中间体13:(9S)-1-氨基-9-乙基-5-氟-9-羟基-4-甲氧基-1,2,3,9,12,15-六氢-10H,13H-苯并[de]吡喃并[3',4':6,7]吲哚嗪并[1,2-b]喹啉-10,13-二酮盐酸盐与中间体11类似的方法,从2-溴-5-氟-4-甲氧基苯胺合成。LCMS(ESI)m/z 452.1[M+H]
C730和C731的方法
C730和C731通过制备HPLC,从(9S)-1-氨基-4-氯-9-乙基-5-氟-9-羟基-1,2,3,9,12,15-六氢-10H,13H-苯并[de]吡喃并[3',4':6,7]吲哚嗪并[1,2-b]喹啉-10,13-二酮盐酸盐(中间体11)制备得到TFA盐形式。
表I.
上述HPLC的条件:设备:Agilent 1200;色谱柱:Waters XBridge C18 4.6*50mm,3.5um;流速:2.0mL/min;梯度洗脱:5.0%-95.0%-95.0%-5.0%-5.0%,0.00min-1.50min-2.50min-2.52min-3.00min;温度:40℃;流动相:A:乙腈,B:H
C518的方法
步骤J:N-((1S,9S)-4-氯-9-乙基-5-氟-9-羟基-10,13-二氧代-2,3,9,10,13,15-六氢-1H,12H-苯并[de]吡喃并[3',4':6,7]吲哚嗪并[1,2-b]喹啉-1-基)-2-羟基乙酰胺:向粗品(9S)-1-氨基-4-氯-9-乙基-5-氟-9-羟基-1,2,3,9,12,15-六氢-10H,13H-苯并[de]吡喃并[3',4':6,7]吲哚嗪并[1,2-b]喹啉-10,13-二酮盐酸盐(50mg,0.10mmol)在2mL DMF中的溶液添加2-羟基乙酸(11.6mg,0.15mmol)、HATU(57.9mg,0.15mmol),然后在0℃下滴加Et
下表II中制备的化合物以和实施例C518相同的方式进行反应和后处理。
表II.
/>
/>
/>
上述HPLC的条件:设备:Agilent 1200;色谱柱:Waters XBridge C18 4.6*50mm,3.5um;流速:2.0mL/min;梯度洗脱:5.0%-95.0%-95.0%-5.0%-5.0%,0.00min-1.50min-2.50min-2.52min-3.00min;温度:40℃;流动相:A:乙腈,B:H
下表III中制备的化合物利用上文与C518类似的方法,从中间体12或中间体13合成。
表III.
/>
/>
/>
上述HPLC的条件:设备:Agilent 1200;色谱柱:Waters XBridge C18 4.6*50mm,3.5um;流速:2.0mL/min;梯度洗脱:5.0%-95.0%-95.0%-5.0%-5.0%,0.00min-1.50min-2.50min-2.52min-3.00min;温度:40℃;流动相:A:乙腈,B:H
C589的方法
步骤K:(S)-N-((1S,9S)-9-乙基-5-氟-9-羟基-4-甲基-10,13-二氧代-2,3,9,10,13,15-六氢-1H,12H-苯并[de]吡喃并[3',4':6,7]吲哚嗪并[1,2-b]喹啉-1-基)-3-羟基丁酰胺:向(1S,9S)-1-氨基-9-乙基-5-氟-9-羟基-4-甲基-1,2,3,9,12,15-六氢-10H,13H-苯并[de]吡喃并[3',4':6,7]吲哚嗪并[1,2-b]喹啉-10,13-二酮甲磺酸盐(50mg,0.10mmol,CAS:169869-90-3)在2mL DMF中的溶液添加(S)-3-羟基丁酸(15.6mg,0.15mmol)、HATU(57.9mg,0.15mmol),然后在0℃下滴加Et
下表IV中制备的化合物以和实施例C589相同的方式进行反应和后处理。
表IV.
/>
/>
上述HPLC的条件:设备:Agilent 1200;色谱柱:Waters XBridge C18 4.6*50mm,3.5um;流速:2.0mL/min;梯度洗脱:5.0%-95.0%-95.0%-5.0%-5.0%,0.00min-1.50min-2.50min-2.52min-3.00min;温度:40℃;流动相:A:乙腈,B:H
实施例2连接子的制备
2.1连接子HX20113的制备
HX20113是通过使用Rink-酰胺-MBHA-树脂的常规固相多肽合成方法合成的。Fmoc用于保护连接单元中的氨基酸。缀合试剂选自HOBT、HOAt/DIC、DCC、EDCI或HATU。合成后,使用三氟乙酸裂解树脂。将产物经HPLC纯化,冻干保存备用。理论质量:1207.59,测量值:[M-H]
连接子HX20111的制备
HX20111是通过使用Rink-酰胺-MBHA-树脂的常规固相多肽合成方法合成的。Fmoc用于保护连接单元中的氨基酸。缀合试剂选自HOBT、HOAt/DIC、DCC、EDCI或HATU。合成后,使用三氟乙酸裂解树脂。将产物经HPLC纯化,冻干保存备用。理论质量:1383.70,测量值:[M-H]
实施例3连接子-负载物中间体的制备
3.1中间体Mc-GGFG-Dxd的制备
中间体Mc-GGFG-Dxd可商购或按照EP2907824中所述的方法制备。该化合物用于制备连接子-负载物中间体(式(I)化合物),也用于直接连接(任选修饰的)抗体以制备参考ADC LC1184(8)和参考ADC LC1184(4)。
3.2 H0019的制备
HX21008-a的合成
称取4.33g Fmoc-Gly-Gly-OH和6.84g Pb(OAc)
将反应体系冷却至室温,过滤并将滤饼用EA洗涤三次。将滤液合并并浓缩至干。进行柱色谱(PE:EA=100:0-50:100)以获得约2000mg白色固体状的目标产物,收率为44%。
H0005-a的合成
称取200mg HX21008-a,并将其加入100ml单颈圆底烧瓶中。然后添加15ml THF并搅拌溶解。然后添加H0005(316mg,3.0eq)和TsOH·H
添加饱和碳酸氢钠溶液以淬灭反应。用EA萃取3次。将有机相合,用盐水洗涤,用无水硫酸镁干燥并浓缩。将粗产物通过柱色谱(PE:EA=5:1-1:1)纯化以获得约165mg无色油状的目标产物,收率为60%。MS:[M+H]
H0005-b的合成
称取200mg H0005-a,并将其加入100ml单颈圆底烧瓶中。然后添加10ml EtOH和5ml EA并完全溶解。然后在氮气气氛下向反应体系添加40mg钯碳,并将反应体系用氮气通气3次。将反应体系保持在氢气气氛下,并在室温下搅拌0.5h。取样并通过TLC(DCM/MeOH=10:1)检测以监控反应。原料基本上消失,并且检测到新的点。
将反应体系过滤,并将滤饼用EA洗涤3次。将滤液合并浓缩至干以获得200mg白色固体状的产物,收率为100%。将产物直接用于下一反应,无需纯化。[M+H]
H0005的合成
称取2.0g二氯树脂并放入多肽合成管中。添加DCM(10ml)并在室温下膨胀30分钟。通过真空抽吸除去溶剂。将树脂用DCM洗涤两次,每次洗涤的体积为7mL,时长为1分钟。通过真空抽吸除去溶剂。然后称取H0005-b(200mg)并加入50ml离心管中。添加DCM(约10ml),通过震荡使固体溶解。添加至上述树脂中。进行搅拌以将所有树脂浸泡在溶液中(如果管壁上附着有树脂,则用少量DCM清洗管壁)。搅拌4-5小时。反应完成后,加入适量的甲醇。搅拌30分钟。通过真空抽吸除去溶剂。将树脂依次如下洗涤:DMF一次、甲醇一次、DMF一次、甲醇一次和DMF两次,每次洗涤的体积为10mL,时长为1分钟。通过真空抽吸除去溶剂。取少量干燥树脂进行茚三酮检测。树脂为无色透明,溶液呈淡黄色,表明对于下一步偶联是合格的。
通过加入10mL现成的20%哌啶/DMF溶液进行两次脱保护,每次反应10分钟。反应完成后,通过真空抽吸除去溶液。将树脂依次如下洗涤:DMF两次、甲醇一次、DMF一次、甲醇一次和DMF两次,每次洗涤的体积为10mL,时长为1分钟。通过真空抽吸除去溶剂。取少量干燥树脂进行茚三酮检测。树脂和溶液均为深蓝色。
向50mL离心管添加563mg Fmoc-Phe-OH、197mg HOBt。然后添加约7mL DMF。通过震荡使固体溶解。然后添加0.24mL DIC。活化10-30分钟以获得活化的反应溶液。
将3摩尔当量的活化反应溶液加入到树脂中。进行搅拌以将树脂完全浸泡在溶液中(如果管壁上附着有树脂,则使用少量DCM清洗管壁)。搅拌2-3小时。反应完成后,通过真空抽吸除去溶剂。将树脂依次如下洗涤:DMF两次、甲醇一次、DMF一次、甲醇一次和DMF两次,每次洗涤的体积为10mL,时长为1分钟。通过真空抽吸除去溶剂。取少量干燥树脂进行茚三酮检测。树脂为无色透明,溶液呈淡黄色,表明对于下一步偶联是合格的。
通过加入10mL现成的20%哌啶/DMF溶液进行两次脱保护,每次反应10分钟。反应完成后,通过真空抽吸除去溶液。将树脂依次如下洗涤:DMF两次、甲醇一次、DMF一次、甲醇一次和DMF两次,每次洗涤的体积为10mL,时长为1分钟。通过真空抽吸除去溶剂。取少量干燥树脂进行茚三酮检测。树脂和溶液均为深蓝色。
向50mL离心管添加531mg Fmoc-GG-OH、197mg HOBt。然后添加约10mL DMF。通过震荡使固体溶解。然后添加0.24mL DIC。活化10-30分钟以获得活化的反应溶液。
将3摩尔当量的活化反应溶液加入到树脂中。进行搅拌以将树脂完全浸泡在溶液中(如果管壁上附着有树脂,则使用少量DCM清洗管壁)。搅拌2-3小时。反应完成后,通过真空抽吸除去反应溶液。将树脂依次如下洗涤:DMF两次、甲醇一次、DMF一次、甲醇一次和DMF两次,每次洗涤的体积为10mL,时长为1分钟。通过真空抽吸除去溶剂。取少量干燥树脂进行茚三酮检测。树脂为无色透明,溶液呈淡黄色,表明对于下一步偶联是合格的。
通过加入10mL现成的20%哌啶/DMF溶液进行两次脱保护,每次反应10分钟。反应完成后,通过真空抽吸除去溶液。将树脂依次如下洗涤:DMF两次、甲醇一次、DMF一次、甲醇一次和DMF两次,每次洗涤的体积为10mL,时长为1分钟。通过真空抽吸除去溶剂。取少量干燥树脂进行茚三酮检测。树脂和溶液均为深蓝色。
向50mL离心管添加462mg MC-OSu,添加约10mL DMF。通过震荡使固体溶解。然后向树脂添加0.24mL DIEA。进行搅拌以将树脂完全浸泡在溶液中(如果管壁上附着有树脂,则使用少量DCM清洗管壁)。搅拌2-3小时。反应完成后,通过真空抽吸除去反应溶液。将树脂依次如下洗涤:DMF两次、甲醇一次、DMF一次、甲醇一次和DMF两次,每次洗涤的体积为10mL,时长为1分钟。通过真空抽吸除去溶剂。取少量干燥树脂进行茚三酮检测。树脂为无色透明,溶液呈淡黄色,表明对于下一步偶联是合格的。
将树脂用10mL甲醇洗涤两次。然后通过真空抽吸完全除去溶剂。将树脂倒出并称重。在250mL锥形烧瓶中制备裂解缓冲液,其中:TFE/DCM的比例为80%/20%,并且体积为肽树脂重量的7-8倍。将裂解缓冲液加入肽树脂中,摇匀。将树脂完全浸泡在裂解缓冲液中,并在室温下裂解2-3小时。然后将裂解缓冲液用由注射器制成的简单滤器过滤,将树脂用1-2ml DCM洗涤并丢弃。然后向裂解缓冲液添加150mL预冷无水醚,摇匀,然后静置20-30分钟。使用50mL离心管,将上述体系在离心机中以3500rpm离心3分钟,倒出上清液并丢弃。将固体用预冷的无水醚震荡,在超声波下洗涤一次,以3500rpm离心3分钟,倒出上清液并丢弃。将固体置于离心管中并风干过夜,然后进行制备纯化以获得125mg白色固体产物,收率为40%。[M+H]
H0013的合成
称取150mg原料H0005和55mg TSTU,并将其加入10mL单颈圆底烧瓶中,在氮气气氛下加入无水DMF(3mL)并搅拌20min。然后向反应体系依次添加18mg TSN00643和20μl DIEA。于氮气气氛下,在室温下搅拌2h。取样并通过HPLC检测以监控反应。原料峰基本上消失,并且检测到新的峰。
将反应体系进行制备纯化,收集目标产物并冻干以获得约22mg淡黄色固体产物。[M+H]
H0019的合成
称取H0013(30mg),并将其加入10ml单颈圆底烧瓶中,加入纯化水(2ml)。进行搅拌以溶解。向反应体系添加含有HX20111(19.5mg)的DMF溶液(2ml)并搅拌。反应过夜后,用HPLC监测反应,直到所有原料转化为中间体。然后将反应体系冷却至0-10℃,在控制温度下向反应体系添加0.5%LiOH溶液,直至反应体系的pH值约为12。将反应搅拌20min,并通过HPLC监测反应,直到消耗所有中间体,然后向反应体系添加30%乙酸(1.5mL)以淬灭反应。
将反应体系进行制备纯化,收集目标产物并冻干以获得约25mg淡黄色固体产物。[(M+3H)/3]
3.3H0020、H0021、H0034和H0035
使用类似的合成路线和试剂,可以制备以下连接子-负载物中间体H0020、H0021、H0034和H0035。使用与H0013类似的方法,合成中间体H0014、H0015、H0026和H0032,然后分别用于合成H0020、H0021、H0034和H0035。
/>
/>
LC-Ms数据如下表所示:
3.4 LB302-2-4的制备
称取HX20111和中间体MC-GGFG-Dxd(摩尔比约1:2),分别溶解于水和DMF中,然后充分混合以得到混合物,在0-40℃下反应0.5-30h。反应完成后,直接向反应混合物添加适量的Tris-Base溶液或其他促进开环反应的溶液,然后在0-40℃下再反应0.2-20h。反应完成后,将产物通过半制备/制备HPLC纯化并冻干以获得连接子-负载物中间体LB302-2-4。理论质量:3486.52,测量值:[(M+3H)/3]
3.5 LB302-2-1的制备
LB302-2-1可以使用类似的合成路线和试剂制备。
实施例4抗体表达载体的构建、抗体表达、纯化和鉴定
4.1修饰的抗人HER2抗体Ab0001-LCCT
抗体Ab0001-LCCT
4.2抗体Ab0001-LCCT
Ab0001-LCCT
4.3抗体Ab0001-LCCT
上述通过SDS-PAGE纯化的抗体Ab0001-LCCT
4.4其他修饰的抗人抗体的制备
根据类似的方法,在曲妥珠单抗轻链和/或重链的C端分别引入基于连接酶识别序列的末端修饰,得到修饰的抗体。
基于Ab0001(曲妥珠单抗)的修饰的抗人HER2抗体列于下表。末端修饰序列中的LPETGG是连接酶供体底物的识别序列,GA是间隔子序列。
修饰的抗人HER2抗体
*:“-”表示无末端修饰
实施例5抗体-小分子缀合物的制备
5.1连接子-负载物中间体分别通过连接酶以位点特异性方式与抗体缀合形成ADC。缀合反应的方法可以在WO2015165413A1中找到。生成的ADC如下表所示:
5.2参考ADC LC1184(8)和LC1184(4)通过将中间体Mc-GGFG-Dxd直接连接到Ab0001-LCCT
效果例1小分子对细胞增殖的影响
研究目的:本实验使用CellTiter-Glo检测细胞活力,以评估小分子化合物对高HER2肿瘤细胞系SK-BR-3的增殖的影响,并分析小分子化合物对于肿瘤细胞增殖的影响。
材料和设备
PBS:Gibco,Cat#10010-023);胰蛋白酶:Gibco,Cat#25200056);FBS:Gibco,Cat#10270-106);
细胞接种–第1天
(1)细胞的显微镜检查;
(2)消化:用2mL 0.25%胰蛋白酶消化3分钟;
(3)离心:1000rpm,5min;
(4)细胞计数
A.细胞稀释:
B.细胞接种:100μl/孔
C.孵育:37℃,5%CO
细胞测试
(1)显微镜检查
(2)药物制备:
A.样品制备用缓冲液的制备:使用测试细胞的培养基(10%FBS)制备所需量的样品制备缓冲液;
B.样品制备:在96孔深孔板中将样品从第一浓度稀释至所需浓度。
测试化合物:用细胞培养基稀释制备10种最终浓度:1000、200、40、8、1.6、0.32、0.064、0.0128、0.00256和0.000512nM。
阳性对照嘌呤霉素(Puromycin):使用2.5mg/ml的储备溶液,并用细胞培养基稀释。进行250倍稀释,然后在施用化合物时进行2倍稀释,以达到嘌呤霉素的测试浓度5μg/ml。
(3)化合物的施用:对于稀释系列的每种浓度,化合物一式三份施用。100μl/孔。
(4)加入药物后,将细胞在培养箱中孵育120h。
细胞活力测试
(1)检测试剂的制备:将CellTiter-Glo Luminescent Cell Viability Assay检测试剂在避光的情况下升温至室温。
(2)细胞制备:从培养箱中取出待测细胞,在室温(25℃)下平衡30min。
(3)ATP检测:弃去培养基并添加100μl/孔的DMEM,将50μl/孔的CTG添加到96孔板中,使用铝箔遮光,并使用涡旋振荡器在室温下以200rpm振荡10min。
(4)检测程序:设置程序后,将黑壁透明底板放置在仪器中,不带盖子。
(5)数据采集
5.数据处理和分析
GraphPad软件用于处理数据。使用四参数曲线模型对对照样品或测试样品的浓度绘制细胞增殖抑制率图,进行数据拟合,并分别获得对照样品和试验样品的R
细胞增殖抑制率(%)=(药物处理组发光值-puro组发光值)/(空白对照组发光值–puro组的发光值)×100;(puro组即puromycin处理组)
样品的比活(%)=(对照样品IC
对照样品的比活(%)=(对照样品的IC
6.结果验证
R
结果:
结果如下表所示:
效果例2靶向HER2的缀合物对细胞增殖的影响
研究目的:采用CellTiter-Glo测定检测细胞活力,以评估ADC对两种高HER2肿瘤细胞系SK-BR-3、NCI-N87和HER2阴性肿瘤细胞系MDA-MB-468增殖的影响,并分析ADC对肿瘤细胞增殖的影响。
材料和设备
PBS:Gibco,Cat#10010-023);胰蛋白酶:Gibco,Cat#25200056);FBS:Gibco,Cat#10270-106);
细胞接种–第1天
(1)细胞的显微镜检查;
(2)消化:用2mL 0.25%胰蛋白酶消化3分钟;
(3)离心:1000rpm,5min;
(4)细胞计数
A.细胞稀释:
B.细胞接种:100μl/孔
C.孵育:37℃,5%CO
细胞测试
(1)显微镜检查
(2)药物制备:
A.样品制备用缓冲液的制备:使用测试细胞的培养基(10%FBS)制备所需量的样品制备缓冲液;
B.样品制备:在96孔深孔板中将样品从第一浓度稀释至所需浓度。
测试样品:用细胞培养基稀释制备10种最终浓度:200、40、8、1.6、0.32、0.064、0.0128、0.00256、0.000512和0.0001024nM。
阳性对照嘌呤霉素:使用10mg/ml的储备溶液,并用细胞培养基稀释。进行100倍稀释,然后在施用化合物时进行10倍稀释,以达到嘌呤霉素的测试浓度5μg/ml。
(3)化合物的施用:对于稀释系列的每种浓度,化合物一式三份施用。100μl/孔。
(4)加入药物后,将细胞在培养箱中孵育120h。
细胞活力测试
(1)检测试剂的制备:将CellTiter-Glo Luminescent Cell Viability Assay检测试剂在避光的情况下升温至室温。
(2)细胞制备:从培养箱中取出待测细胞,在室温(25℃)下平衡30min。
(3)ATP检测:弃去培养基并添加100μl/孔的DMEM,将50μl/孔的CTG添加到96孔板中,使用铝箔遮光,并使用涡旋振荡器在室温下以200rpm振荡10min。
(4)检测程序:设置程序后,将黑壁透明底板放置在仪器中,不带盖子。
(5)数据采集
5.数据处理和分析
GraphPad软件用于处理数据。使用四参数曲线模型绘制相对于对照样品或测试样品浓度的细胞增殖抑制率图,进行数据拟合,并分别获得对照样品和试验样品的R
细胞增殖抑制率(%)=(药物处理组发光值-puro组发光值)/(空白对照组发光值–puro组的发光值)×100;(puro组即puromycin处理组)
6.结果验证
R
结果:
结果如下表以及图1、图2和图3所示:
在HER2高表达SK-BR-3和NCI-N87中,缀合物(CH-2-589、CH-2-593、CH-2-518、LC302-2-1(4)和LC302-2-4(4))表现出显著的效力。缀合物的IC
效果例3旁观者杀伤效果评估
试验目的:在HER2阳性肿瘤细胞系SK-BR-3和HER2阴性肿瘤细胞系MDA-MB-468的共培养系统中测试ADC(CH-2-589、CH-2-593、CH-2-518和LC302-2-4(4))对MDA-MB-468细胞的旁观者杀伤活性,并将旁观者杀伤效果与结构类似于DS8201a的参考ADC(LC1184(8))进行比较。
材料和设备
L15:Hyclone,SH30525.01;McCoy's 5A:Gibco,16600-082;FBS:Gibco,10099-141;萤火虫荧光素酶报告基因检测试剂盒:Beyotime,RG006;50ml离心管:corning,430829;15ml离心管:corning,430791;96孔板:corning,3599;CO
实验方法
1)细胞收集和计数。
2)将细胞密度调整为1*10
3)制备细胞混合物,其中SKBR3:MDA-MB-468-Luc-GFP=4:1,5ml。
细胞接种:1*10
测试样品:用细胞培养基稀释制备3种最终浓度:50、10和1nM。
4)第二天给予药物,100μl/孔。
5)在37℃的5%CO
①用PBS洗涤以去除死细胞并用Cytation3板分析仪检测;
②碧云天荧光素酶报告基因检测试剂盒:用100μl裂解缓冲液在37℃培养箱中裂解10min。以2000rpm离心5分钟。取100μl上清液。加入100μl底物。化学发光由微板分析仪检测(增益:200)。
结果:
将两种方法(GFP荧光计数法和荧光素酶底物发光法)用于测定旁观者杀伤效果(图4a、4b和图5)。
缀合物(CH-2-593、CH-2-589、CH-2-518和LC302-2-4(4))在使用这两种方法的检测中均显示出显著的旁观者杀伤效果。CH-2-593显示出与LC1184(8)相当或更强的旁观者杀伤效果。
效果例4缀合物的体内评估
4.1JIMT-1人乳腺癌异种移植模型
将5x10
4.2Capan-1人胰腺癌异种移植模型(1)
将5x10
4.3Capan-1人胰腺癌异种移植模型(2)
研究目的:本研究的目的是评估CH-2-589、CH-2-593、CH-2-518和LC302-2-4(4)在雌性BALB/c裸鼠皮下Capan-1人胰腺癌异种移植模型的治疗中的体内抗肿瘤效力。
研究设计:
细胞培养:将Capan-1肿瘤细胞(ATCC-HTB-79),在37℃、空气中5%CO
动物:雌性BALB/c裸鼠,6-8周龄,体重约18-20g。研究总共需要48只(30加60%),购自Shanghai Lingchang Laboratory Animal Co.,LTD或其他认证的供应商。
肿瘤接种:将每只小鼠在右胁皮下接种包含Matrigel(1:1)的0.2mL PBS中的Capan-1肿瘤细胞(5×10
组和处理
N:动物数目;
给药体积:基于体重调整给药体积,10mL/kg。
实验时间根据肿瘤体积进行调整。
动物饲养:为了使动物适应实验室环境,在动物到达和肿瘤接种之间有约一周的适应期。将小鼠保持在特殊的无病原体环境和单独的通风笼中(每笼3只小鼠)。所有笼子、垫子和水在使用前都要消毒。在小鼠室工作时,研究人员会穿戴实验服和乳胶或乙烯手套。每个笼子都清楚地贴上卡片,标明动物数量、性别、品系、接收日期、处理、研究编号、组号和处理开始日期。装有食物和水的笼子每周更换两次。动物室环境和光周期的目标条件如下:
温度20~26℃
湿度40~70%
光照循环光照12小时,黑暗12小时
膳食材料:所有动物都可以自由获得标准认证的商品实验室膳食。膳食中污染物的最大允许浓度由制造商控制并定期分析。动物可以随意获取适合人类饮用的高压煮沸过的市政自来水。据认为,膳食材料中没有可能影响肿瘤生长的已知污染物。
分组:在开始处理之前,称重所有动物并测量肿瘤体积。由于肿瘤体积可能影响任何给定处理的有效性,因此使用基于Excel的随机化软件将小鼠分组,根据其肿瘤体积进行分层随机化。这确保了所有组在基线时具有可比性。
观察:本研究中涉及动物护理和使用的方案和任何修订或程序在开始之前由药明康德(WuXi AppTec)的机构动物护理和使用委员会(IACUC)审查和批准。在研究期间,动物的护理和使用按照实验室动物护理评估和认证协会(AAALAC)的规定进行。接种后,每天检查动物的发病率和死亡率。在常规监测时,检查动物的肿瘤生长和处理对正常行为的任何影响,如活动性、食物和水消耗、体重增加/减少(每周测量两次体重)、眼睛/毛发板结和任何其他异常影响。基于每个亚集内的动物数量,记录死亡和观察到的临床体征。
终点:主要终点是观察肿瘤的生长是否可以延迟,或者小鼠是否可以治愈。使用卡尺每周以两个维度测量两次肿瘤大小,体积表示为mm
每组的T/C(%)值采用以下公式计算:T/C%=T
终止:
1)体重损失:任何一天表现出20%体重下降的动物会被人道处死或与兽医人员联系。
2)肿瘤负担:肿瘤负荷不应超过3,000mm
溃疡:如果发生肿瘤溃疡,将采用以下程序:
·具有溃疡性肿瘤的动物每周至少监测3次,根据临床体征,监测频率增至每天。
·未完全结痂覆盖的溃疡性肿瘤应使用适当的伤口清洁溶液(如Novalsan)进行清洁。只有在兽医工作人员的指导下,才可将抗生素霜施用于溃疡/病变。
安乐死的标准包括,如果病变(符合一个或多个):
·1周内不愈合,或形成痂。
·直径大于5mm。
·形成空穴。
出现感染迹象(如存在脓)或出血,或动物出现不适迹象(如针对部位的过度舔咬)或全身疾病迹象(嗜睡、活动减少、食物消耗减少、身体状况下降或体重减轻)。联系兽医工作人员讨论任何可能的例外情况。
3)临床体征:如果发现动物濒临死亡,必须对其实施安乐死(除非IACUC基于充分的理由给予特别许可,这必须包括在方案中,并且必须提供更多的支持性护理,例如温暖的SQ液、Diet Gel食物杯置于动物旁边以便它们能够到食物、笼子置于保温垫上以补充热量等。注:濒死状态表明动物不太可能存活。有关这些终点的问题,请联系兽医工作人员。
发病的临床实例可以包括:
·弓背。
·持续躺卧,对处理或其他刺激缺乏反应。
·严重器官或系统衰竭的体征。
·消瘦。
·体温过低,
·CNS缺陷:痉挛。
·呼吸:呼吸速度快、呼吸困难、咳嗽、罗音。
·GI:腹泻>2天,黄疸。
任何表现出上述临床问题的动物都通过CO
如果意外死亡,则不会进行尸检。
统计分析:对于两组之间的比较,使用独立样本t-检验。对于三个或更多组之间的比较,进行单向ANOVA。如果获得显著的F统计量(处理方差与误差方差之比),则在ANOVA后进行多重比较。所有数据使用SPSS 17.0进行分析。p<0.05认为是统计学显著的。
结果:
所有缀合物均显示出显著的肿瘤抑制效果(图8a和图8b)。
4.4NCI-N87人胃癌异种移植模型
研究目的:本研究的目的是评估CH-2-589、CH-2-593、CH-2-518和LC302-2-4(4)在雌性BALB/c裸鼠皮下NCI-N87人胃癌异种移植模型治疗中的体内抗肿瘤效力。
研究设计:
细胞培养:将NCI-N87肿瘤细胞(ATCC,Manassas,VA,cat#CRL-5822),在37℃、空气中5%CO
动物:雌性BALB/c裸鼠,6-8周龄,体重约18-22g。研究总共需要36只(30加20%),购自Shanghai Lingchang Laboratory Animal Co.,LTD或其他认证的供应商。
肿瘤接种:将每只小鼠在右胁皮下接种包含Matrigel(1:1)的0.2mL PBS中的NCI-N87肿瘤细胞(10×10
组和处理
N:动物数目;
给药体积:基于体重调整给药体积,10mL/kg。
实验时间根据肿瘤体积进行调整。
结果:
所有缀合物均显示出显著的肿瘤抑制效果(图9a和图9b)。
效果例5缀合物的离体血清稳定性
对于离体血清稳定性研究,将缀合物LC302-2-1(4)、LC302-2-4(4)和LC1184(8)分别接种于37℃的混合人血清中。在0、24、48和96小时,用抗原捕获缀合物,然后用糖苷酶去糖基化并用酸解离。收集上清液并离心,然后通过高分辨率LC-MS检测以确定DAR。
LC302-2-1(4)和LC302-2-4(4)在血清中孵育96小时后非常稳定。孵育96小时后,LC302-2-1(4)和LC302-2-4(4)的DAR没有可观察到的降低。然而,LC1184(8)的DAR在孵育96小时后从7.8下降到2.6(图10)。连接子的稳定性表明更多负载物递送至靶向的肿瘤,而脱靶的游离负载物释放减少,从而提高了治疗指数。
序列表
SEQ ID NO:1:Ab0001-LCCT
RASQDVNTAVA
SEQ ID NO:2:Ab0001-LCCT
SASFLYS
SEQ ID NO:3:Ab0001-LCCT
QQHYTTPPT
SEQ ID NO:4:Ab0001-LCCT
DTYIH
SEQ ID NO:5:Ab0001-LCCT
RIYPTNGYTRYADSVKG
SEQ ID NO:6:Ab0001-LCCT
WGGDGFYAMDY
SEQ ID No.7:Ab0001-LCCT
DIQMTQSPSSLSASVGDRVTITCRASQDVNTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSRSGTDFTLTISSLQPEDFATYYCQQHYTTPPTFGQGTKVEIKRTV
SEQ ID NO:8:Ab0001-LCCT
EVQLVESGGGLVQPGGSLRLSCAASGFNIKDTYIHWVRQAPGKGLEWVARIYPTNGYTRYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCSRWGGDGFYAMDYWGQGTLVTVSS
SEQ ID No.9:Ab0001-LCCT
DIQMTQSPSSLSASVGDRVTITCRASQDVNTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSRSGTDFTLTISSLQPEDFATYYCQQHYTTPPTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGECGALPETGG
SEQ ID No.10:Ab0001-LCCT
EVQLVESGGGLVQPGGSLRLSCAASGFNIKDTYIHWVRQAPGKGLEWVARIYPTNGYTRYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCSRWGGDGFYAMDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
- 一种连接子化合物、聚乙二醇-连接子结合物及其衍生物和聚乙二醇-连接子-药物结合物
- 一种连接子化合物、聚乙二醇-连接子结合物及其衍生物和聚乙二醇-连接子-药物结合物
