一种结合PD-1和Siglec15的双特异性抗体
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于肿瘤免疫疗法和分子免疫学领域,具体涉及一种结合PD-1和Siglec15的双特异性抗体。
背景技术
程序性死亡分子1(programmed death-1,PD-1)是1992年发现的表达在T细胞表面的一个蛋白受体,参与到细胞的凋亡过程之中。PD-1有两个配体,分别为PD-L1和PD-L2。PD-L1主要表达于T细胞、B细胞、巨噬细胞和树突状细胞(dendritic cell,DC)上,也表达于非骨髓来源的细胞,如血管内皮细胞、上皮细胞、骨骼肌细胞、肝细胞、肾小管上皮细胞、胰岛细胞,脑部星状细胞和各类非淋巴系肿瘤如黑色素瘤、肝癌、胃癌、肾细胞癌。而PD-L2的表达相对较局限,主要表达在抗原呈递细胞上,如活化的巨噬细胞和树突状细胞。
当癌症肿瘤细胞表面上表达PD-L1分子,并且肿瘤组织中有浸润的淋巴细胞,PD-L1/PD-1通路就能使肿瘤细胞免于T细胞攻击,达到免疫逃脱的效果。而PD-1单抗就是为抑制PD-L1的表达,解决此类免疫逃脱而生。然而,并非所有肿瘤细胞都表达PD-L1,或者有PD-L1却缺乏肿瘤浸润淋巴细胞。对于这类癌症,PD-1单抗就无能为力。
Siglec15只在髓系细胞中正常表达,而在肿瘤细胞和肿瘤侵润髓系细胞中广泛高表达。进一步的研究表明,Siglec15特异性表达于M2-like巨噬细胞(抑制性免疫细胞)中,其胞外部分可以识别肿瘤抗原表面唾液酸,刺激M2-like巨噬细胞产生大量的TGF-β。肿瘤细胞分泌的M-CSF可诱导单核细胞分化为巨噬细胞,并伴有Siglec15的表达。TAM表面的Siglec15在识别肿瘤抗原后通过DAP12-Syk通路促进TGF-β的释放,促进免疫抑制环境的产生。
Siglec15的表达与PD-L1表达互斥,PD-L1高表达伴随着Siglec15不表达;而Siglec15高表达伴随着PD-L1的不表达。IFN-γ是诱导PD-L1表达的必需因子,却下调Siglec15的表达。因此,急需研发出一种结合PD-1和Siglec15的双特异性抗体,无论肿瘤细胞表达PD-L1还是Siglec15,都能使T细胞发挥免疫功能,杀伤肿瘤。
发明内容
本发明提供了一种双特异性抗体,包含:
(a)特异性结合第一抗原的第一抗体或其抗原结合片段;和
(b)特异性结合第二抗原的第二抗体或其抗原结合片段;
其中:
所述第一抗原为PD-1,并且所述第二抗原为Siglec15;或者,所述第一抗原为Siglec15,并且所述第二抗原为PD-1。
在可选的实施方案中,所述第一抗体或其抗原结合片段包含重链和轻链;和
第二抗体或其抗原结合片段包含scFv;
其中,所述scFv连接于第一抗体的重链或轻链的N端或C端。
在可选的实施方案中,所述第一抗体的一条重链的重链可变区与一条轻链的轻链可变区形成抗原结合部位,另一条重链的重链可变区与另一条轻链的轻链可变区形成抗原结合部位。
在可选的实施方案中,所述的双特异性抗体包含一个第一抗体和一个或多个所述的scFv。
在可选的实施方案中,所述的双特异性抗体包含一个第一抗体和一个所述的scFv,所述scFv连接于所述第一抗体或其抗原结合片段的重链或轻链的N端或C端。
在可选的实施方案中,所述的双特异性抗体包含一个第一抗体和两个所述的scFv。
在可选的实施方案中,两个所述scFv分别连接于所述第一抗体或其抗原结合片段的两条重链或两条轻链的N端;或者,两个所述scFv分别连接于所述第一抗体或其抗原结合片段的两条重链或两条轻链的C端。
在可选的实施方案中,两个所述scFv分别连接于所述第一抗体或其抗原结合片段的两条重链或两条轻链的C端。
在可选的实施方案中,所述双特异性抗体包含两条第一多肽链和两条第二多肽链,对于所述每条多肽链:
(a)所述第一多肽链各自独立地包含所述第一抗体或其抗原结合片段的轻链;和
(b)所述第二多肽链各自独立地包含所述第一抗体或其抗原结合片段的重链和所述scFv。
在可选的实施方案中,所述双特异性抗体包含两条第一多肽链和两条第二多肽链,对于所述每条多肽链:
(a)所述第一多肽链各自独立地包含所述第一抗体或其抗原结合片段的轻链和所述scFv;和
(b)所述第二多肽链各自独立地包含所述第一抗体或其抗原结合片段的重链。
在可选的实施方案中,两条第一多肽链相同或不同,和/或两条第二多肽链相同或不同。
在可选的实施方案中,所述scFv的重链可变区与轻链可变区通过连接子L2连接,和/或所述scFv通过连接子L1分别与所述第一抗体或其抗原结合片段的两条重链或两条轻链的N端或C端连接。
在可选的实施方案中,所述连接子L1和连接子L2相同或不同。
在可选的实施方案中,所述连接子L1和/或连接子L2具有如(G
在可选的实施方案中,所述scFv的重链可变区和轻链可变区之间存在二硫键。
在可选的实施方案中,所述第一抗体或其抗原结合片段的重链包含重链可变区和重链恒定区,并且所述轻链包含轻链可变区和轻链恒定区;优选地,所述第一抗体或其抗原结合片段为全长抗体。
在可选的实施方案中,所述第一抗体或其抗原结合片段的重链包含第一Fc区和第二Fc区。
在可选的实施方案中,第一Fc区和第二Fc区是相同的或不同的。
在可选的实施方案中,所述Fc区选自IgG、IgA、IgD、IgE和/或IgM。
在可选的实施方案中,所述Fc区选自IgG1、IgG2、IgG3和/或IgG4。
在可选的实施方案中,所述Fc区选自小鼠IgG1、IgG2a、IgG2b和/或IgG3,或选自大鼠IgG1、IgG2a、IgG2b和/或IgG2c。
在可选的实施方案中,所述Fc区选自人IgG1、IgG2、IgG3和/或IgG4。
在可选的实施方案中,所述第一抗体或其抗原结合片段特异性结合PD-1,并且所述scFv特异性结合Siglec15,其中,
所述第一抗体或其抗原结合片段的HCDR1选自SEQ ID NO:2、SEQ ID NO:10的任一氨基酸序列,或为与SEQ ID NO:2、SEQ ID NO:10的任一氨基酸序列具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;HCDR2选自SEQ ID NO:3、SEQ ID NO:11的任一氨基酸序列,或为与SEQ ID NO:3、SEQ ID NO:11的任一氨基酸序列具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;HCDR3选自SEQ ID NO:4、SEQ ID NO:12的任一氨基酸序列,或为与SEQ ID NO:4、SEQ ID NO:12的任一氨基酸序列具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;LCDR1选自SEQ ID NO:6、SEQ IDNO:14的任一氨基酸序列,或为与SEQ ID NO:6、SEQ ID NO:14的任一氨基酸序列具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;LCDR2选自SEQ ID NO:7、SEQ IDNO:15的任一氨基酸序列,或为与SEQ ID NO:7、SEQ ID NO:15的任一氨基酸序列具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;LCDR3选自SEQ ID NO:8、SEQ IDNO:16的任一氨基酸序列,或为与SEQ ID NO:8、SEQ ID NO:16的任一氨基酸序列具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;和/或,
所述scFv的HCDR1如SEQ ID NO:18所示,或为与SEQ ID NO:18具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;HCDR2如SEQ ID NO:19所示,或为与SEQ ID NO:19具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;HCDR3如SEQ ID NO:20所示,或为与SEQ ID NO:20具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;以及,LCDR1如SEQ ID NO:22所示,或为与SEQ ID NO:22具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;LCDR2如SEQ ID NO:23所示,或为与SEQ ID NO:23具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;LCDR3如SEQ ID NO:24所示,或为与SEQ ID NO:24具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列。
在可选的实施方案中,所述第一抗体或其抗原结合片段特异性结合PD-1,并且所述scFv特异性结合Siglec15,其中,
所述第一抗体或其抗原结合片段包含:
(a)如SEQ ID NO:2所示的HCDR1,如SEQ ID NO:3所示的HCDR2,如SEQ ID NO:4所示的HCDR3;以及,如SEQ ID NO:6所示的LCDR1,如SEQ ID NO:7所示的LCDR2,如SEQ ID NO:8所示的LCDR3;或
(b)如SEQ ID NO:10所示的HCDR1,如SEQ ID NO:11所示的HCDR2,如SEQ ID NO:12所示的HCDR3;以及,如SEQ ID NO:14所示的LCDR1,如SEQ ID NO:15所示的LCDR2,如SEQ IDNO:16所示的LCDR3;
并且,所述scFv包含:
如SEQ ID NO:18所示的HCDR1,如SEQ ID NO:19所示的HCDR2,如SEQ ID NO:20所示的HCDR3;以及,如SEQ ID NO:22所示的LCDR1,如SEQ ID NO:23所示的LCDR2,如SEQ IDNO:24所示的LCDR3。
在可选的实施方案中,所述第一抗体或其抗原结合片段的重链可变区VH选自SEQID NO:1、SEQ ID NO:9的任一氨基酸序列,或为与SEQ ID NO:1、SEQ ID NO:9的任一氨基酸序列具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;轻链可变区VL选自SEQ ID NO:5、SEQ ID NO:13的任一氨基酸序列,或为与SEQ ID NO:5、SEQ ID NO:13的任一氨基酸序列具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;和/或
所述scFv的重链可变区VH如SEQ ID NO:17所示,或为与SEQ ID NO:17具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;轻链可变区VL如SEQ ID NO:21所示,或为与SEQ ID NO:21具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列。
在可选的实施方案中,所述第一抗体或其抗原结合片段包含:
(a)如SEQ ID NO:1所示的重链可变区VH,如SEQ ID NO:5所示的轻链可变区VL;或
(b)如SEQ ID NO:9所示的重链可变区VH,如SEQ ID NO:13所示的轻链可变区VL;
并且,所述scFv包含:
如SEQ ID NO:17所示的重链可变区VH,如SEQ ID NO:21所示的轻链可变区VL。
在可选的实施方案中,所述第一抗体或其抗原结合片段特异性结合Siglec15,并且所述scFv特异性结合PD-1,其中,所述第一抗体或其抗原结合片段的HCDR1如SEQ ID NO:18所示,或为与SEQ ID NO:18具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;HCDR2如SEQ ID NO:19所示,或为与SEQ ID NO:19具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;HCDR3如SEQ ID NO:20所示,或为与SEQ ID NO:20具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;以及,LCDR1如SEQID NO:22所示,或为与SEQ ID NO:22具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;LCDR2如SEQ ID NO:23所示,或为与SEQ ID NO:23具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;LCDR3如SEQ ID NO:24所示,或为与SEQ IDNO:24具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;和/或
所述scFv的HCDR1选自SEQ ID NO:2、SEQ ID NO:10的任一氨基酸序列,或为与SEQID NO:2、SEQ ID NO:10的任一氨基酸序列具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;HCDR2选自SEQ ID NO:3、SEQ ID NO:11的任一氨基酸序列,或为与SEQ ID NO:3、SEQ ID NO:11的任一氨基酸序列具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;HCDR3选自SEQ ID NO:4、SEQ ID NO:12的任一氨基酸序列,或为与SEQ ID NO:4、SEQ ID NO:12的任一氨基酸序列具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;LCDR1选自SEQ ID NO:6、SEQ ID NO:14的任一氨基酸序列,或为与SEQ ID NO:6、SEQ ID NO:14的任一氨基酸序列具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;LCDR2选自SEQ ID NO:7、SEQ ID NO:15的任一氨基酸序列,或为与SEQ ID NO:7、SEQ ID NO:15的任一氨基酸序列具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;LCDR3选自SEQ ID NO:8、SEQ ID NO:16的任一氨基酸序列,或为与SEQ ID NO:8、SEQ ID NO:16的任一氨基酸序列具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列。
在可选的实施方案中,所述第一抗体或其抗原结合片段特异性结合Siglec15,并且所述scFv特异性结合PD-1,其中,
所述第一抗体或其抗原结合片段包含:
如SEQ ID NO:18所示的HCDR1,如SEQ ID NO:19所示的HCDR2,如SEQ ID NO:20所示的HCDR3;以及,如SEQ ID NO:22所示的LCDR1,如SEQ ID NO:23所示的LCDR2,如SEQ IDNO:24所示的LCDR3。
并且,所述scFv包含:
(a)如SEQ ID NO:2所示的HCDR1,如SEQ ID NO:3所示的HCDR2,如SEQ ID NO:4所示的HCDR3;以及,如SEQ ID NO:6所示的LCDR1,如SEQ ID NO:7所示的LCDR2,如SEQ ID NO:8所示的LCDR3;或
(b)如SEQ ID NO:10所示的HCDR1,如SEQ ID NO:11所示的HCDR2,如SEQ ID NO:12所示的HCDR3;以及,如SEQ ID NO:14所示的LCDR1,如SEQ ID NO:15所示的LCDR2,如SEQ IDNO:16所示的LCDR3。
在可选的实施方案中,所述第一抗体或其抗原结合片段的重链可变区VH如SEQ IDNO:17所示,或为与SEQ ID NO:17具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;轻链可变区VL如SEQ ID NO:21所示,或为与SEQ ID NO:21具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;和/或
所述scFv的重链可变区VH选自SEQ ID NO:1、SEQ ID NO:9的任一氨基酸序列,或为与SEQ ID NO:1、SEQ ID NO:9的任一氨基酸序列具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列;轻链可变区VL选自SEQ ID NO:5、SEQ ID NO:13的任一氨基酸序列,或为与SEQ ID NO:5、SEQ ID NO:13的任一氨基酸序列具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的序列。
在可选的实施方案中,所述第一抗体或其抗原结合片段包含:
如SEQ ID NO:17所示的重链可变区VH,如SEQ ID NO:21所示的轻链可变区VL;
并且,所述scFv包含:
(a)如SEQ ID NO:1所示的重链可变区VH,如SEQ ID NO:5所示的轻链可变区VL;或
(b)如SEQ ID NO:9所示的重链可变区VH,如SEQ ID NO:13所示的轻链可变区VL。
在可选的实施方案中,所述的双特异性抗体的第一多肽链选自SEQ ID NO:25-29、SEQ ID NO:34-38的任一氨基酸序列,或为与SEQ ID NO:25-29、SEQ ID NO:34-38的任一氨基酸序列具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的氨基酸序列;所述双特异性抗体的第二多肽链选自SEQ ID NO:30-33、SEQ ID NO:39-42的任一氨基酸序列,或为与SEQ ID NO:30-33、SEQ ID NO:39-42的任一氨基酸序列具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的氨基酸序列。
在可选的实施方案中,所述的双特异性抗体包含:
(1)如SEQ ID NO:25所示的第一多肽链,如SEQ ID NO:30所示的第二多肽链;
(2)如SEQ ID NO:26所示的第一多肽链,如SEQ ID NO:30所示的第二多肽链;
(3)如SEQ ID NO:27所示的第一多肽链,如SEQ ID NO:31所示的第二多肽链;
(4)如SEQ ID NO:28所示的第一多肽链,如SEQ ID NO:32所示的第二多肽链;
(5)如SEQ ID NO:29所示的第一多肽链,如SEQ ID NO:33所示的第二多肽链;
(6)如SEQ ID NO:34所示的第一多肽链,如SEQ ID NO:39所示的第二多肽链;
(7)如SEQ ID NO:35所示的第一多肽链,如SEQ ID NO:39所示的第二多肽链;
(8)如SEQ ID NO:36所示的第一多肽链,如SEQ ID NO:40所示的第二多肽链;
(9)如SEQ ID NO:37所示的第一多肽链,如SEQ ID NO:41所示的第二多肽链;或
(10)如SEQ ID NO:38所示的第一多肽链,如SEQ ID NO:42所示的第二多肽链。
本发明还提供了一种分离的核酸分子,其包含编码上述任一项所述的双特异性抗体的核苷酸序列;
优选地,所述分离的核酸分子包含编码上述任一项所述的双特异性抗体的第一多肽链的核苷酸序列;
优选地,所述分离的核酸分子包含编码上述任一项所述的双特异性抗体的第二多肽链的核苷酸序列。
本发明还提供了重组载体,其包含上述所述的分离的核酸分子。
本发明还提供了重组细胞,其包含上述所述的分离的核酸分子或上述所述的载体。
本发明还提供了一种双特异性抗体在制备用于治疗和/或预防和/或诊断疾病的药物中的用途。
本发明还提供了一双特异性抗体在制备治疗癌症的药物中的用途。
术语
术语“双特异性抗体”是指能够与两个目标抗原或目标抗原表位特异性结合的蛋白分子。在本发明中,包含抗体或抗原结合片段(例如Fab、scFv等)的“双特异性抗原结合蛋白”与“双特异性抗体”、“双抗”可以互换使用。
术语“抗体”通常是指,由两对多肽链(每对具有一条轻链和一条重链)组成的免疫球蛋白分子。重链可分类为μ、δ、γ、α或ε,并且分别将抗体的同种型定义为IgM、IgD、IgG、IgA和IgE。抗体轻链可分类为κ和λ轻链。各重链由重链可变区(VH)和重链恒定区(CH)组成,重链恒定区由3个结构域(CH1、CH2和CH3)组成。各轻链由轻链可变区(VL)和轻链恒定区(CL)组成,轻链恒定区由一个结构域CL组成。恒定结构域不直接参与抗体与抗原的结合,但展现出多种效应子功能。VH和VL区还可被细分为具有高变性的区域(称为互补决定区(CDR)),其间散布有较保守的称为构架区(FR)的区域。各VH和VL按下列顺序:FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4从氨基末端至羧基末端排列的3个CDR和4个FR组成。各重链/轻链对的可变区(VH和VL)分别形成抗原结合部位。
术语“互补决定区”或“CDR”是指抗体的可变结构域内主要促成抗原结合的6个高变区之一。所述6个CDR的最常用的定义之一由Kabat E.A.等人,((1991)Sequences ofproteins of immunological interest.NIH Publication91-3242)提供。如本文中一些实施方式中使用的,CDR可以以Kabat规则定义轻链可变结构域的CDR1、CDR2和CDR3(LCDR1、LCDR2、LCDR3),以及重链可变结构域的CDR1、CDR2和CDR3(HCDR1、HCDR2、HCDR3)。
术语“抗体”包括但不限于:单克隆抗体、鼠源抗体、骆驼抗体、嵌合抗体、人源化抗体、全人抗体、双特异性或多特异性抗体。这些抗体可以属于任何同种型/类型(例如,IgG、IgE、IgM、IgD、IgA和IgY)或亚类(例如,IgG1、IgG2、IgG3、IgG4、IgA1和IgA2)。
术语“抗原结合片段”或“抗原结合部分”是指抗体的一个或多个保留结合所述抗体结合的抗原的能力的部分。在某些实施例中,抗体的“抗原结合片段”包括(1)Fab片段,由VL、VH、CL和CH1结构域组成的单价片段;(2)F(ab′)2片段,包含在铰链区通过二硫桥连接的两个Fab片段的二价片段;(3)scFv片段,由抗体的VL和VH结构域组成,或由抗体的VH和VL结构域组成;(4)CDR,经分离互补决定区。
术语“多肽”是指任何长度的氨基酸链,而与修饰(例如磷酸化或糖基化)无关。术语多肽包括蛋白质及其片段。多肽可以是“外源的”,意指它们是“异源的”,即是所利用的宿主细胞外来的,例如由细菌细胞产生的人多肽。本文将多肽公开为氨基酸残基序列。那些序列按氨基末端到羧基末端的方向从左到右书写。根据标准命名法,氨基酸残基序列以三字母或单字母代码命名,如下所示:丙氨酸(Ala,A)、精氨酸(Arg,R)、天冬酰胺(Asn,N)、天冬氨酸(Asp,D)、半胱氨酸(Cys,C)、谷氨酰胺(Gln,Q)、谷氨酸(Glu,E)、甘氨酸(Gly,G)、组氨酸(His,H)、异亮氨酸(Ile,I)、亮氨酸(Leu,L)、赖氨酸(Lys,K)、甲硫氨酸(Met,M)、苯丙氨酸(Phe,F)、脯氨酸(Pro,P)、丝氨酸(Ser,S)、苏氨酸(Thr,T)、色氨酸(Trp,W)、酪氨酸(Tyr,Y)和缬氨酸(Val,V)。本文所述抗体中氨基酸位置的编号(例如Fc区的氨基酸残基)和目标区域(例如CDR),使用Kabat系统。
术语“scFv”指包含通过接头连接的抗体重链可变结构域(VH)和抗体轻链可变结构域(VL)的分子。此类scFv分子可具有一般结构:NH2-VL-连接子-VH-COOH或NH2-VH-连接子-VL-COOH。合适的现有技术连接子由重复的GGGGS氨基酸序列或其变体组成,例如使用1-6个重复的GGGGS氨基酸序列或其变体。
术语“同一性”通常是指两个或多个多核苷酸序列之间或两个或多个多肽序列之间的序列相似性或可交换性。在一些实施方案中,同一性高的多核苷酸是在严格条件下杂交的那些序列,并且相较于那些序列具有至少80%(如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)的序列同一性。
术语“宿主细胞”指已经或者能够用核酸序列转化并从而表达所选的目的基因的细胞。该术语包括亲本细胞的后代,无论该后代与原来的亲本细胞在形态或基因组成上是否相同,只要后代存在所选目的基因即可。常用的宿主细胞包括细菌、酵母、哺乳动物细胞等。
术语“载体”指能够增殖与其连接的另一种核酸的核酸分子。该术语包括作为自身复制型核酸结构的载体及并入接受其导入的宿主细胞的基因组中的载体。某些载体能够指导与其可操作连接的核酸的表达。
附图说明
图1a-1e描述双特异性抗体的结构示意图。其中,示意图1a-1c的IgG部分为抗PD-1抗体(抗PD-1IgG),将抗Siglec15抗体的轻重链可变区通过连接子L2连接,可形成scFv(VL
图2a-2d为双特异性抗体PD-1端的结合活性。
图3a-3d为双特异性抗体Siglec15端的结合活性。
图4a-4c为双特异性抗体两端的结合活性。
图5为给药后动物体重变化趋势图。
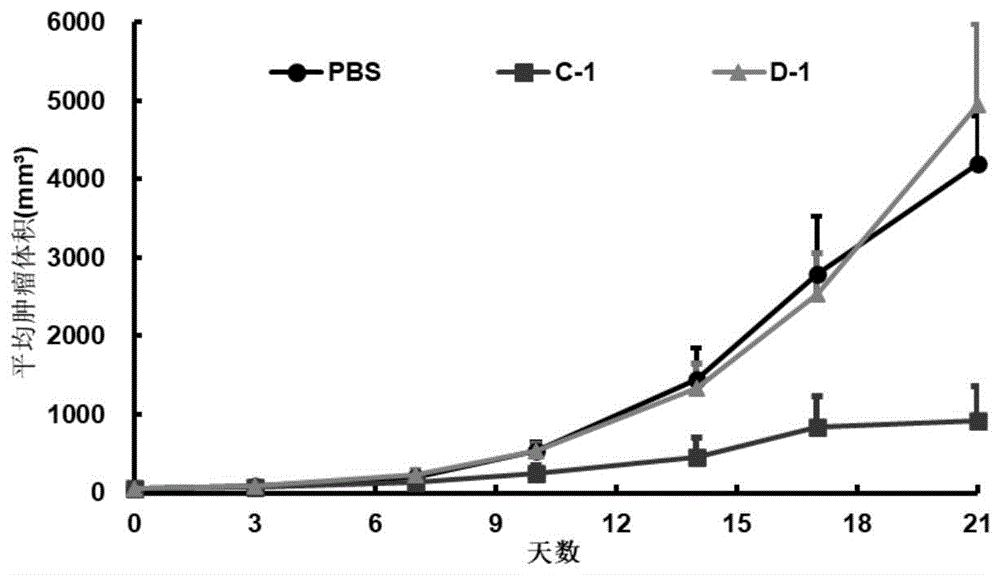
图6为给药后肿瘤体积增长趋势图。
具体实施方式
本发明的实施例中,序列1和序列2分别为PD-1单抗的序列,序列3为Siglec15单抗的序列。阳参Keytruda单抗的重链如SEQ ID NO:43所示,轻链如SEQ ID NO:44所示。阳参Siglec15单抗的重链如SEQ ID NO:45所示,轻链如SEQ ID NO:46所示。
实施例1不同结构的双特异性抗体的制备
序列1、序列2和序列3的CDR和可变区的氨基酸序列分别如表1所示。
表1
由序列1和序列3通过连接子L1和L2按照一定的顺序连接,可形成表2中的肽链。
表2
由序列2和序列3通过连接子L1和L2按照一定的顺序连接,可形成表3中的肽链。
表3
其中,在本实施例中,双特异性抗体中使用的连接子L1为2个GGGGS重复,即GGGGSGGGGS;连接子L2为3个GGGGS重复,即GGGGSGGGGSGGGGS。
由表2和表3中的肽链组合,可形成表4所示的双特异性抗体。
表4
将上述设计的不同结构的双特异性抗体各条链进行基因合成,构建到人IgG框架中,而后利用分子克隆技术,将抗体片段插入PCDNA3.1载体中,构建成哺乳动物细胞表达质粒,利用脂质体转染方式,导入宿主细胞株CHO细胞,利用细胞fed-batch获得发酵上清液,取发酵液上清进行亲和层析、离子交换层析等一系列步骤的纯化,最终纯化得到构建的抗体。对纯化后的抗体检测表达量、纯度、SDS-PAGE等,确认所述双特异性抗体。
实施例2双特异性抗体PD-1端的结合活性
用包被液(1×PBS,pH7.4)将Human-PD-1-His稀释为0.2μg/mL,包被到96孔酶标板中,4℃包被过夜。用3%BSA封闭,300μL/孔,37℃孵育1h。分别将构建的双特异性抗体和阳性对照Keytruda,用3%BSA稀释为0.3μg/mL,以此为初始浓度进行3倍稀释,共稀释11个梯度,100μL/孔,37℃孵育1h。用3%BSA将羊抗人Fc按1:20000稀释,100μL/孔,37℃孵育1h。加入TMB显色液,100μL/孔,37℃避光显色8分钟。加入终止液1M HCl终止显色反应,100μL/孔。在酶标仪上450nm处读数。结果如图2a-2d所示。
由图2a-2c可知,双特异性抗体A-1、B-1、C-1、D-1和E-1在PD-1端都有很好的结合活性,EC
由图2c-2d可知,双特异性抗体A-2、B-2和C-2在PD-1端都有很好的结合活性,EC
实施例3双特异性抗体Siglec15端的结合活性
用包被液(1×PBS,pH7.4)将Human-Siglec15-His稀释为0.2μg/mL,包被到96孔酶标板中,4℃包被过夜。用3%BSA封闭,300μL/孔,37℃孵育1h。分别将构建的双特异性抗体和阳性对照Keytruda,用3%BSA稀释为10μg/mL,以此为初始浓度进行3倍稀释,共稀释11个梯度,100μL/孔,37℃孵育1h。用3%BSA将羊抗人Fc按1:20000稀释,100μL/孔,37℃孵育1h。加入TMB显色液,100μL/孔,37℃避光显色8分钟。加入终止液1M HCl终止显色反应,100μL/孔。在酶标仪上450nm处读数。结果如图3a-3d所示。
由图3a-3c可知,双特异性抗体A-1、B-1、C-1、D-1和E-1在Siglec15端都有很好的结合活性,EC
由图3c-3d可知,双特异性抗体A-2、B-2和C-2在Siglec15端都有很好的结合活性,EC
实施例4双特异性抗体两端的结合活性
用包被液(1×PBS,pH7.4)将Human-Siglec15-His稀释为0.2μg/mL,包被到96孔酶标板中,4℃包被过夜。用3%BSA封闭,300μL/孔,37℃孵育1h。将构建的双特异性抗体用3%BSA稀释为10μg/mL,以此为初始浓度进行3倍稀释,共稀释11个梯度,100μL/孔,37℃孵育1h。用3%BSA将Bio-PD-1按1:20000稀释,100μL/孔,37℃孵育1h。加入TMB显色液,100μL/孔,37℃避光显色8分钟。加入终止液1M HCl终止显色反应,100μL/孔。在酶标仪上450nm处读数。结果如图4a-4c所示。
由结果可知,双特异性抗体A-1、B-1、C-1、D-1、E-1、A-2、B-2和C-2在Siglec15端和PD-1端都有很好的结合活性,EC
实施例5体内抗肿瘤药效评价
在小鼠结肠癌细胞系MC38-mSiglec15移植肿瘤C57BL/6-hSiglec15&hPD-1双人源化小鼠模型中,对优选抗体进行体内抗肿瘤药效评价。
过表达鼠Siglec15小鼠结肠癌MC38-mSiglec15细胞体外单层培养,培养条件为RPMI1640培养基中加10%胎牛血清,2mm谷氨酰胺,37℃ 5%CO2培养。一周两次用胰酶-EDTA进行常规消化处理传代。当细胞饱和度为80%-90%时,收取细胞,计数,接种。将0.1mL(5x10
给与荷瘤小鼠腹腔注射PBS、抗体C-1、D-1,每周给药2次,每次5.0mg/kg,分别给药7次、7次和5次。每周测量2次瘤径、称量动物体重,观察动物生活状态,对异常情况进行记录。
实验指标是考察肿瘤生长是否被抑制、延缓或治愈。每周三次用游标卡尺测量肿瘤直径。肿瘤体积的计算公式为:V=0.5a×b2,a和b分别表示肿瘤的长径和短径。化合物的抑瘤疗效用TGI(%)或相对肿瘤增殖率T/C(%)评价。TGI(%),反映肿瘤生长抑制率。TGI(%)的计算:TGI(%)=【(1-(某处理组给药结束时平均瘤体积-该处理组开始给药时平均瘤体积))/(溶剂对照组治疗结束时平均瘤体积-溶剂对照组开始治疗时平均瘤体积)】×100%。相对肿瘤增殖率T/C(%):计算公式如下:T/C%=TRTV/CRTV×100%(TRTV:治疗组RTV;CRTV:阴性对照组RTV)。根据肿瘤测量的结果计算出相对肿瘤体积(relative tumorvolume,RTV),计算公式为RTV=Vt/V0,其中V0是分组给药时(即d0)测量所得平均肿瘤体积,Vt为某一次测量时的平均肿瘤体积,TRTV与CRTV取同一天数据。
小鼠结肠癌细胞系MC38移植瘤模型荷瘤鼠给予抗体的体重变化趋势图如图5所述(其中横坐标表示开始治疗后的天数,纵坐标表示小鼠体重),肿瘤生长曲线如图6所述(其中横坐标表示开始治疗后的天数,纵坐标表示肿瘤体积)。
给药开始后第17天,组1、组2和组3小鼠的体重增长率分别为22.7%、3.5%和22.9%。
给药开始后第17天,组1肿瘤体积为2788.49±744.67mm
本发明的保护内容不局限于以上实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求为保护范围。
- 一种改进的能与PD-1特异性结合的肿瘤抑制肽及其用途
- 使用PD-1轴结合拮抗剂和抗CEA/抗CD3双特异性抗体治疗CEA阳性癌症的方法
- CEA CD3双特异性抗体和PD-1轴结合拮抗剂在治疗癌症的剂量方案中的用途
