一种重组人抗VEGF抗体融合蛋白的制备方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明具体涉及一种重组人抗VEGF抗体融合蛋白的制备方法。
背景技术
血管内皮生长因子(VEGF),是一种高度特异性的促血管内皮细胞生长因子,具有促进血管通透性增加、细胞外基质变性、血管内皮细胞迁移、增殖和血管形成等作用。VEGF家族有7个成员,分别是VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E、VEGF-F,和胎盘生长因子(placenta growth factor,PlGF),其受体包括酪氨酸激酶受体(VEGFR-1、VEGFR-2、VEGFR-3)和非酪氨酸激酶受体(NRP-1、NRP-2)。其中,VEGF-A是对血管生成影响最大的一种因子,主要与VEGFR-1、VEGFR-2结合发挥作用。将VEGFR-1胞外区第2个类免疫球蛋白结构域(VEGFR-1D2)、VEGFR-2胞外区第3个类免疫球蛋白结构域(VEGFR-2D3)与人的免疫球蛋白IgG1 Fc片段的基因相连,重组表达融合蛋白rhVEGFR-Fc。还有将IgG1的Fc片段以IgG2、IgG3或IgG4的Fc片段予以代替。这类融合蛋白均可以非常好地结合VEGF家族成员,竞争性抑制其与VEGF家族受体结合,阻止家族受体的激活,有效控制新生血管的生成,达到治疗湿性AMD、糖尿病黄斑水肿,病理性近视,视网膜静脉阻塞等相关疾病的作用。
目前用于眼科疾病的治疗性融合蛋白,主要包括阿柏西普、康柏西普等由人血管内皮生长因子VEGFR-1和VEGFR-2,与人免疫球蛋白Fc片段经过融合而成的蛋白。随着对这些治疗性融合蛋白生产要求的日益严格,培养制备方法得到了不同程度的改进,如通过改进细胞选择,优化培养基、控制培养过程和纯化工艺等手段来改善细胞生长和活力以及蛋白产量和质量。
在重组蛋白的生产和纯化过程中存在大量的修饰和降解等过程,如氧化脱酰胺、糖基化、C末端赖氨酸截除、N末端焦谷氨酸环化、二硫键修饰、序列变异等,上述异质性的组合可使重组蛋白产生大量异构体,当电荷基团数量或结构发生改变后,会造成重组蛋白在电荷分布方面的异质性,进而影响重组蛋白的生物学活性、药代动力学、免疫原性以及结构稳定性等,对药物的临床使用时的安全性和有效性都会产生重大影响,因此,重组蛋白产品的电荷异质性控制是整个生产工艺的关键质量属性。
现有技术CN114480492A,其通过在转染了重组人抗体融合蛋白表达载体的细胞培养阶段的第4或5天开始补加NH4
发明内容
为解决上述问题,本发明提供了一种重组人抗VEGF抗体融合蛋白的制备方法,它包括如下步骤:
1)基础培养:取基础培养基OPM CDP3 CHO,接种转染了重组人抗VEGF抗体融合蛋白表达载体的细胞培养;
2)补料培养:基础培养至第4天起,每隔一日补加补料培养基培养至第11天或细胞活率不低于80%;
3)收获培养液,即得;
所述补料培养基为VegaCHO Feed和/或CDFS36。
进一步地,每隔一日补加基础培养基体积3~5%的VegaCHO。
进一步地,每隔一日补加基础培养基体积分别为4%、4%、5%、5%的VegaCHOFeed。
进一步地,每隔一日补加基础培养基体积0.3~0.5%的CDFS36。
进一步地,每隔一日补加补加基础培养基体积分别为0.4%、0.4%、0.5%、0.5%的CDFS36。
进一步地,所述补料培养还包括在基础培养至第4天补加1~5uM的MnCl
进一步地,所述补料培养还包括在基础培养至第4天补加5~8mM的N-乙酰-D-甘露糖氨。
进一步地,所述培养的条件为:接种密度0.3×10
进一步地,所述细胞是转染了重组人抗VEGF抗体融合蛋白表达载体的CHO DG44细胞株。
进一步地,所述人抗VEGF抗体融合蛋白为VEGFR1和VEGFR2的Fc融合蛋白,其氨基酸序列如SEQ ID No:1所示。
本发明重组人抗VEGF抗体融合蛋白的制备方法,通过将特定的基础培养基和特定的补料培养工艺结合,有效降低了融合蛋白中碱性峰含量,同时提升蛋白的表达量,提高了重组人抗体融合蛋白的药效,具有实际推广应用价值。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
图1为实施例2的iCIEF检测图谱;
图2为实施例3的iCIEF检测图谱;
图3为实验例1的iCIEF检测图谱;
图4为对比例1的iCIEF检测图谱;
图5为对比例2的iCIEF检测图谱。
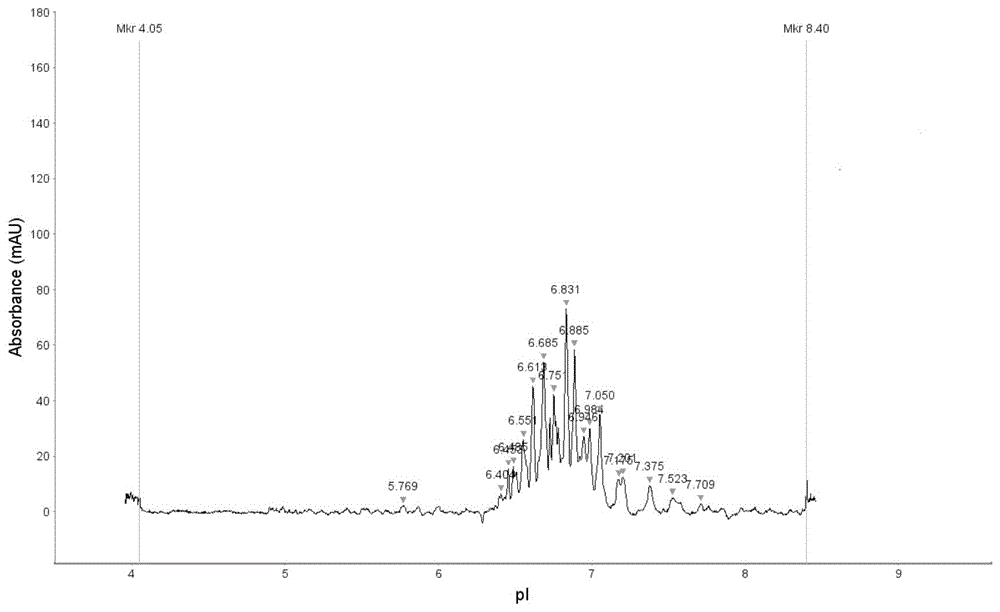
图6为本发明重组人抗体融合蛋白iCIEF检测典型图谱。
具体实施方式
原料来源:无特殊说明,本发明原材料均可商业购买,培养基均为商用培养基。
iCIEF检测:用超纯水将参比品和供试品稀释至20mg/ml,空白样品、稀释后的参比品和供试品各取5微升加入到已加入95微升预混液的样品管中离心,然后转入到样品盘中继续离心,向卡盒及系统盘中加入对应的缓冲液,放入毛细管电泳仪中,编辑Batch,设置检测方法,运行Batch进行检测,根据图谱计算蛋白酸性峰、主峰、碱性峰量,与典型图谱(典型图谱是采用阿柏西普进行iCIEF检测得到的图谱,图6)比对,将图谱中与典型图谱的M1-M6峰型一致的划定为主峰,与典型图谱中A1-A3峰型一致的划定为酸性峰,与典型图谱中B1-B5峰型一致的划定为碱性峰。
实施例1
本实施例通过VEGFR融合蛋白详细说明重组人抗体融合蛋白的发酵培养工艺。
重组人抗体融合蛋白为VEGFR(血管内皮生长因子受体)融合蛋白,即VEGFR1和VEGFR2的Fc融合蛋白,其是Ig G1的Fc片段融合蛋白,具体指在基因水平上将VEGFR1和VEGFR2基因同免疫球蛋白Ig G1的Fc片段基因相连,并在真核表达系统中表达的重组蛋白。蛋白是SEQ IDNo:1所示氨基酸序列。
一、重组人抗体融合蛋白基因的工程细胞株构建
pCHO 1.0载体经AvrII(CCTAGG)和PacI(TTAATTAA)双酶切后,与重组人抗体融合蛋白基因片段连接,连接产物转化DH5α大肠杆菌感受态细胞,涂布于含有氨苄抗性的LB琼脂培养板上,通过抗性筛选,平板上获得单菌落转化子。挑选单克隆菌落培养后提取重组质粒,提取的重组质粒AvrII/PacI双酶切进行DNA测序,重组质粒测序结果与预期序列比对一致。
将克隆正确的重组质粒Pvu I单酶切处理后转化到处于对数生长期的CHO-DG44宿主细胞(购自Invitrogen公司),获得工程菌株,将工程菌接种到含MTX(氨甲喋呤,500nM/L)的培养基中,培养到对数生长期,根据细胞状态和表达量选定本实施例重组人抗体融合蛋白产品的工程细胞株。选定表达水平大于3.0g/L,远远高于现有CHO-K1和CHO-S细胞的表达量;经原位杂交技术分析鉴定表明重组人抗体融合蛋白表达载体已经完全整合到工程细胞株的染色体内得到工程细胞株。其中,所述重组人抗体融合蛋白氨基酸序列为SEQ ID No.:1所示的序列。
SEQ ID No:1氨基酸序列:
SDTGRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDG
KRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTNTIIDVVL
SPSHGIELSVGEKLVLNCTARTELNVGIDFNWEYPSSKHQHKKLVNRDLK
TQSGSEMKKFLSTLTIDGVTRSDQGLYTCAASSGLMTKKNSTFVRVHEKD
KTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPE
VKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEY
KCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVK
GFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQG
NVFSCSVMHEALHNHYTQKSLSLSPG
二、三级细胞库建立
复苏工程细胞株,建立三级细胞库。
三、培养
取WCB 37.0℃水浴解冻,接种到装有C/B种子培养基的摇瓶中,复苏细胞活率>85%,复苏细胞后依次进行摇瓶种子扩增、WAVE扩增,WAVE扩增培养3天后接入200L反应器,通过基础培养和补料培养获得重组人抗体融合蛋白。
基础培养:培养基为OPM CDP3 CHO;
补料培养:包括在基础培养的Day4/6/8/10分别补基础培养基体积的3/3/4/4%的VegaCHO Feed;在基础培养的Day4/6/8/10分别补基础培养基体积的0.3/0.3/0.4/0.4%的CDFS36;在基础培养的Day4补2uM的MnCl
培养参数设定为:
pH:7.00±0.15;
T:37.0℃;
溶解氧DO:40%;
转速:95rpm;
空气流速:1.50lpm;
表层通气:2.00lpm;
培养11天,结束培养。
实施例2-3在实施例1基础条件下,实施例2-3在补料培养阶段分别添加5uM的和2uM的MnCl
表1实施例2-3工艺过程。
实施例2-3的得到的蛋白iCIEF检测图谱图1及图2,参照典型图谱,划定图谱中酸、碱及主峰区域,并采用峰面积归一化法对各峰进行定量计算,其结果统计在表2中。
表2实施例2-3蛋白质量及表达量结果
本发明结合下述实验例及对比例进一步说明本发明有益效果
实验例1
在实施例2的基础上,本实验例在补料培养中不补加MnCl
表3实验例1工艺过程
实验例1的蛋白iCIEF检测图谱图3,参照典型图谱,划定图谱中酸、碱及主峰区域,对各峰进行定量计算,其结果统计在表4中。
表4实验例1质量及蛋白表达量结果
结果分析:由表2及表4结果可看出,在基础培养基为OPM CDP3 CHO;补料培养的Day4/6/8/10分别补4/4/5/5%的VegaCHO Feed;Day4/6/8/10分别补0.4/0.4/0.5/0.5%的CDFS36;在培养的Day4补5mM的N-乙酰-D-甘露糖氨的并在培养的Day4补1-5uM的MnCl
实验例2-5
采用本发明实施例1的补料工艺,考察不同基础培养基对蛋白碱性峰的影响
表5实验例2-5工艺过程
表6实验例2-5蛋白质量及表达量结果
结果分析:从实验例2-5结果可以看出,在本发明补料培养基基础上,采用其他基础培养基培养,培养过程中添加或不添加MnCl
实验例6-9
采用本发明实施例1的基础培养基,考察不同补料工艺对蛋白碱性峰的影响
表7实验例6-9工艺过程
表8实验例6-9蛋白质量及表达量结果
结果分析:从实验例6-9结果可以看出,在本发明基础培养基的基础上,采用其他不同补料工艺培养,培养过程中添加或不添加MnCl
对比例1-2
设计对比例1-2,其中对比例2为CN114480492A中抗VEGF抗体融合蛋白的生产工艺,对比例1为在对比例2的基础上,在补料工艺中Day4补2uM的MnCl
表9对比例1-2工艺过程
对比例1-2的iCIEF检测图谱图4及图5,参照典型图谱,划定图谱中酸、碱及主峰区域,采用峰面积归一化法对各峰进行定量计算,其结果统计在表10中。
表10对比例1-2蛋白质量及表达量结果
结果分析:由表10的结果可知,在CN114480492A工艺的基础上,仅仅添加MnCl
同时,对比试验中还考察了CN114480492A中碱性峰含量较低的补料方案,即在以advanced+FortiCHO混合培养基为基础培养基,补加S66和C5,该方案得到的融合蛋白虽然碱性峰含量较低,但蛋白表达量也很低,只有0.745g/L。
综合本发明实施例、实验例及对比例结果可知,本发明特定的基础培养基、补料工艺结合培养的Day4补MnCl
- 抗VEGF单域抗体及其人源化、单域抗体和IgG1-Fc构建的融合蛋白和应用
- 抗VEGF单域抗体及其人源化、单域抗体和IgG1-Fc构建的融合蛋白和应用
