一种RI液体酶制剂及其制备方法和应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及生物技术领域,尤其涉及一种RI液体酶制剂及其制备方法和应用。
背景技术
核糖核酸酶(Ribonuclease,RNase)是一类能水解核糖核酸(RNA)磷酸二酯键的酶,不同来源的RNase,其专一性、作用方式都有所不同,分为核糖核酸酶A(RNase A)、核糖核酸酶T1(RNase T1)和核糖核酸酶H(RNase H)。RNase在环境中广泛存在且结构及其稳定,可耐受多种处理如煮沸、高压灭菌而不被灭活,因此极难消除。RNA分子上紧邻磷酸二脂键的2′羟基基团能直接被RNase利用作为活性因子,从而使得RNase无需金属离子等辅助因子就能发挥活性,因而RNA制剂中只要存在少量的RNase就会导致RNA在制备与分析过程中的降解,对保持RNA样品的完整性构成极大威胁,RNase的污染是导致实验失败的主要原因。
核糖核酸酶抑制剂(Ribonuclease Inhibitor,RI)是存在于动物胞浆中的酸性蛋白质,分子量约为50KDa,其氨基酸序列具有30个左右全部处于还原状态的巯基,并含有亮氨酸重复序列,其三级结果呈对称的马蹄形。RI能够抑制RNase家族中的多个成员,能够与RNase以非共价键的方式结合形成复合体,从而使RNase失活。RI能够保护mRNA结构的完整性,有利于提高转录及翻译的效率,同时避免了使用有机化合物抑制剂可能带来的不利影响,因此在下游检测试剂盒如LAMP(环介导等温扩增技术)试剂盒及mRNA疫苗生产过程中广泛应用。
目前,现有技术中公开的关于RNase抑制剂的信息大多是氨基酸序列、分子构建等上游信息或化合物类RNase抑制剂的合成使用方法等。例如现有技术公开了一种RNase抑制剂的单克隆抗体及其制备方法,提供了RNase抑制剂的氨基酸序列、RNase抑制剂的抗体制备方法。现有技术还公开了一种耐热小鼠RNase抑制剂突变体,提供了氨基酸序列及在PCR反应中的应用。上述现有技术均未提及RNase抑制剂的液体酶制剂配方及配制方法。
现有技术还公开了一种小分子RNase抑制剂的合成和使用方法,包括治疗和预防微生物感染以及抑制细菌RNase,该技术提及的小分子RNase抑制剂是化学合成物,而非蛋白类抑制剂。现有技术还公开了一种冻干或可用于冻干的人源核糖核酸酶抑制剂的生产和使用,该专利提供了可冻干制剂的有效配方及热稳定性,但由于实际应用中RNase抑制剂可能会以液体制剂形式保存,同时应用于其他体系时可能经历不止一次的冻融,该技术未提供其配方的液体制剂的长期稳定性及液体制剂冻融后的稳定性。
由于RNase抑制剂的应用场景多为RT-qPCR反应、RT-LAMP技术、cDNA链合成系统及体外转录和翻译试剂盒等,如在RT-qPCR反应的cDNA合成过程中被用于保护mRNA,在RT-LAMP反应体系中用于保护模板RNA的完整性等,这些反应体系目前多采用冻干剂型,而高浓度的甘油会影响冻干效果,因此亟待开发一种配方简单、稳定有效同时甘油含量尽量低的RNase抑制剂液体酶制剂配方。
发明内容
有鉴于此,本发明提出了一种RI液体酶制剂及其制备方法和应用,以解决现有技术中存在的技术问题。
第一方面,本发明提供了一种RI液体酶制剂,包括核糖核酸酶抑制剂、缓冲液、DTT、保护剂、表面活性剂。优选的是,所述的RI液体酶制剂,所述缓冲液为缓冲能力在pH4.0~9.0的缓冲体系。
优选的是,所述的RI液体酶制剂,所述保护剂为糖类物质。
优选的是,所述的RI液体酶制剂,所述表面活性剂为非离子型表面活性剂。
优选的是,所述的RI液体酶制剂,所述缓冲液包括乙酸-乙酸钠缓冲液、柠檬酸-柠檬酸钠缓冲液、柠檬酸-氢氧化钠-盐酸缓冲液、磷酸氢二钠-柠檬酸缓冲液、磷酸氢二钠-磷酸二氢钠缓冲液、甘氨酸-氢氧化钠缓冲液、Tris-盐酸缓冲液、HEPES缓冲液中的至少一种。
优选的是,所述的RI液体酶制剂,所述保护剂为二糖;
优选的,所述二糖包括蔗糖、海藻糖、乳糖、麦芽糖中的至少一种。
优选的是,所述的RI液体酶制剂,所述表面活性剂包括吐温系列表面活性剂、曲拉通系列表面活性剂、聚环氧乙烯月桂醚中的至少一种;
优选的,所述吐温系列表面活性剂包括吐温20和/或吐温80;
优选的,所述曲拉通系列表面活性剂为曲拉通X-100。
优选的是,所述的RI液体酶制剂,核糖核酸酶抑制剂的酶活力为40~400U/μL;
和/或,所述缓冲液的浓度为10~100mM;
和/或,所述DTT浓度为0.5~15mM;
和/或,所述表面活性剂的体积浓度为0.01~0.2%;
和/或,每100mL的RI液体酶制剂中含有0.2~1.5g保护剂;
和/或,所述RI液体酶制剂中不含有甘油。
第二方面,本发明还提供了一种所述的RI液体酶制剂的制备方法,包括以下步骤:
将核糖核酸酶抑制剂、缓冲液、DTT、保护剂和表面活性剂混合,即得RI液体酶制剂。
第三方面,本发明还提供了一种所述的RI液体酶制剂或所述的制备方法制备得到的RI液体酶制剂在RT-qPCR反应、RT-LAMP反应、cDNA链合成反应、制备体外转录试剂盒和翻译试剂盒中的应用。
本发明的一种RI液体酶制剂现有技术具有以下有益效果:
1、本发明的RI液体酶制剂,包括核糖核酸酶抑制剂、缓冲液、DTT、保护剂、表面活性剂;本发明的RI液体酶制剂具有储存稳定性好、储存时间长、不含甘油、冻融稳定性好的特性;本发明的RI液体酶制剂,具有活力稳定、储存时间长的特性,在常温(25℃)下储存90天,酶活保存率90%以上,在4℃下储存12个月,酶活保存率90%以上。同时配方中不含甘油,可应用于RT-PCR Mix、RT-LAMP试剂中用于制备冻干微珠等剂型,冻融稳定性好,冻融10次酶活保存率90%以上,以-20℃储存12个月,酶活保存率90%以上。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单的介绍。显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为RI液体酶制剂RI液酶、DTT、海藻糖、吐温-20、吐温-80、Triton X-100的RNase检测的电泳图;
图2为实施例3和对比例1中RI液体酶制剂在25℃储存过程酶活保存率;
图3为实施例3和对比例1中RI液体酶制剂在4℃储存过程酶活保存率;
图4为实施例3和对比例1中RI液体酶制剂在-20℃储存过程酶活保存率。
具体实施方式
下面将结合本发明实施方式,对本发明实施方式中的技术方案进行清楚、完整的描述,显然,所描述的实施方式仅仅是本发明一部分实施方式,而不是全部的实施方式。基于本发明中的实施方式,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施方式,都属于本发明保护的范围。
为了更好地理解本发明而不是限制本发明的范围,在本申请中所用的表示用量、百分比的所有数字、以及其他数值,在所有情况下都应理解为以词语“大约”所修饰。因此,除非特别说明,否则在说明书和所附权利要求书中所列出的数字参数都是近似值,其可能会根据试图获得的理想性质的不同而加以改变。各个数字参数至少应被看作是根据所报告的有效数字和通过常规的四舍五入方法而获得的。
需说明的是,以下实施例的描述顺序不作为对实施例优选顺序的限定。另外,在本申请的描述中,术语“包括”是指“包括但不限于”。本发明的各种实施例可以以一个范围的型式存在;应当理解,以一范围型式的描述仅仅是因为方便及简洁,不应理解为对本发明范围的硬性限制;因此,应当认为所述的范围描述已经具体公开所有可能的子范围以及该范围内的单一数值。例如,应当认为从1到6的范围描述已经具体公开子范围,例如从1到3,从1到4,从1到5,从2到4,从2到6,从3到6等,以及所数范围内的单一数字,例如1、2、3、4、5及6,此不管范围为何皆适用。另外,每当在本文中指出数值范围,是指包括所指范围内的任何引用的数字(分数或整数)。
本申请实施例提供了一种RI液体酶制剂,包括核糖核酸酶抑制剂、缓冲液、DTT、保护剂、表面活性剂。
在一些实施例中,缓冲液为缓冲能力在pH 4.0~9.0的缓冲体系。缓冲液用以维持RI液体酶制剂在相对稳定的pH环境以保证酶催化活性不受影响的效果。优选的,缓冲液的pH值范围为6.0~9.0,进一步优选pH范围为6.0~8.0。
需要说明的是,本申请的RI液体酶制剂包括缓冲能力在pH 4.0~9.0的缓冲液,RI液体酶制剂最终的pH与缓冲液pH保持一致,即最终的RI液体酶制剂的pH为4.0~9.0,优选的,pH值范围为6.0~9.0,进一步优选pH范围为6.0~8.0。
在一些实施例中,保护剂为糖类物质。保护剂可以保证储存过程中RI液体酶制剂的稳定性。
在一些实施例中,表面活性剂为非离子型表面活性剂。
在一些实施例中,缓冲液包括乙酸-乙酸钠缓冲液、柠檬酸-柠檬酸钠缓冲液、柠檬酸-氢氧化钠-盐酸缓冲液、磷酸氢二钠-柠檬酸缓冲液、磷酸氢二钠-磷酸二氢钠缓冲液、甘氨酸-氢氧化钠缓冲液、Tris-盐酸缓冲液、HEPES缓冲液中的至少一种。
在一些实施例中,保护剂为二糖,优选的,二糖包括蔗糖、海藻糖、乳糖、麦芽糖中的至少一种,进一步优选的,二糖为海藻糖。
在一些实施例中,表面活性剂包括吐温系列表面活性剂、曲拉通系列表面活性剂、聚环氧乙烯月桂醚(即Brij-35)中的至少一种;
优选的,吐温系列表面活性剂包括吐温20和/或吐温80;
优选的,曲拉通系列表面活性剂为曲拉通X-100(即Triton X-100)。
在一些实施例中,本申请的核糖核酸酶抑制剂(RI)为来源于小鼠,利用基因工程手段在动物细胞或微生物细胞中表达获得的;优选的,是通过大肠杆菌外源表达系统获得。
在一些实施例中,RI液体酶制剂中核糖核酸酶抑制剂的酶活力为40~400U/μL,酶活力优选范围为40~320U/μL。
在一些实施例中,RI液体酶制剂中缓冲液的浓度为10mM~100mM。
在一些实施例中,RI液体酶制剂中DTT(即二硫苏糖醇)浓度为0.5~15mM,优选范围为0.5~10mM,最佳浓度为8mM。
在一些实施例中,RI液体酶制剂中表面活性剂的体积浓度(即体积百分比)为0.01~0.2%。
在一些实施例中,每100mL的RI液体酶制剂中含有0.2~1.5g保护剂。
具体的,若保护剂为海藻糖,则海藻糖的质量体积浓度为0.3%~1.5%(即每100mL的RI液体酶制剂含有0.3~1.5g海藻糖),优选范围为0.5%~1.5%,最佳浓度为1%。
在一些实施例中,RI液体酶制剂中不含有甘油,即本申请的RI液体酶制剂为不含甘油的液体酶。
本申请的RI液体酶制剂,通过配方筛选和优化,所获得的RI液体酶具有储存稳定性好、储存时间长、不含甘油、冻融稳定性好的特性;本申请的RI液体酶具有活力稳定、储存时间长的特性,在常温(25℃)下储存90天,酶活保存率90%以上,在4℃下储存12个月,酶活保存率90%以上。同时本申请的RI液体酶制剂配方中不含甘油,可应用于RT-PCR Mix、RT-LAMP试剂中用于制备冻干微珠等剂型,冻融稳定性好,冻融10次酶活保存率90%以上,以-20℃储存12个月,酶活保存率90%以上。
基于同一发明构思,本申请实施例还提供了一种上述的RI液体酶制剂的制备方法,包括以下步骤:
将核糖核酸酶抑制剂、缓冲液、DTT、保护剂和表面活性剂混合,即得RI液体酶制剂。
在一些实施例中,核糖核酸酶抑制剂混合之前还对其进行纯化,本申请所提及的纯化是指从含目标组分的样品中去除杂质或污染物,以获得具有更高的绝对或相对浓度的目标组分。
在一些实施例中,将核糖核酸酶抑制剂、缓冲液、DTT、保护剂和表面活性剂混合后还经过无菌过滤及质检、分装,最终获得RI液体酶制剂;由于最终制备的RI液体酶制剂与缓冲液的pH保持一致,因此,可根据实际使用情况使用酸(如可为盐酸)或碱(如可为氢氧化钠)调节最终RI液体酶制剂的pH值使得其与缓冲液一致。
基于同一发明构思,本申请实施例还提供了一种上述的RI液体酶制剂在RT-qPCR反应、RT-LAMP反应、cDNA链合成反应、体外转录试剂盒和翻译试剂盒中的应用。
以下进一步以具体实施例说明本申请的RI液体酶制剂及其制备方法。本部分结合具体实施例进一步说明本发明内容,但不应理解为对本发明的限制。如未特别说明,实施例中所采用的技术手段为本领域技术人员所熟知的常规手段。除非特别说明,本发明采用的试剂、方法和设备为本领域常规试剂、方法和设备。
以下实施例中,酶活保存率(%):残余酶活性的百分比。也即,将酶经过一定条件下的处理,再根据实施例1测得处理后的酶活力与处理前的酶活力的比值。在本发明上下文中,4℃/常温的酶活保存率是指RI酶液在处理温度下(4℃/25℃)放置后的酶活与初始状态酶活的百分比;冻融的酶活保存率是指RI酶液在-20℃冷冻再溶解的酶活与初始状态酶活的百分比。冻融:利用低温将酶液温度降到冰点以下,使之冻结为固态,再取出升温恢复至液态的过程。处理方式为取1mL酶液,置于-20℃冰箱中冷冻3h至固态,然后取出置于室温放置,至完全溶解为液态,视为冻融1次;冻融10次的操作方式依此类推。
以下实施例中核糖核酸酶抑制剂为通过大肠杆菌外源表达获得的重组鼠源核糖核酸酶抑制剂(RI)。
实施例1
RI液体酶制剂的酶活力检测方法
活力检测原理:首先测定RNase A的活力,并加入RI液体酶制剂,以RNase A被抑制的活力来表示RI的活力。RNase A可以水解Cyclic2’,3’-CMP生成3’-CMP,通过测定单位时间内吸光值的变化,从而测得RNase A活力,进而得到RI液体酶制剂活力的酶活力。
酶活定义:RI液体酶制剂抑制5ng RNase A活性的50%所需要的酶量定义为1个活性单位(U)。RNase A活性通过水解Cyclic 2’,3’-CMP生成3’-CMP定量求得,RNase A在pH6.5、25℃条件下,1min内使反应液的286nm吸光度增加0.001所需要的酶量定义为一个RNase A活性单位。
操作步骤:配制两个反应混合液。反应体系1为空白体系,包括100mM Tris-HAC缓冲液,pH6.5;1mM EDTA;20μg RNase A;反应体系2为额外加入RI的反应体系,包括100mMTris-HAC缓冲液,pH6.5;1mM EDTA;20μg RNase A及一定体积的RI液体酶制剂。将两个反应体系置于25℃水浴反应2h,并用分光光度计在286nm下记录1min内的吸光度变化,从而分别计算出RNase A活力及RNase A被抑制的活力(即RI液体酶制剂的酶活力)。
实施例2
RNase检测方法
由于RI液体酶制剂的酶活力是通过测定RNase A的活性变化而得,因此RI液体酶制剂的配方体系中各物料不能存在RNase污染。
RNase检测:将待测样品和1.6μg MS2 RNA在37℃下反应16h,电泳谱带不发生变化,则判定无RNase污染。
RI液体酶制剂RNase检测操作步骤:配制反应混合液。反应体系1为阴性对照,包括100mM NaAc(pH 6.5)、25mM MgCl
RI液体酶制剂配方体系中各物料RNase检测操作步骤:反应体系参考以上,不同的是,将40U的核糖核酸酶抑制剂(RI)更换为待检物料,待检物料加入反应体系的终浓度分别为:50mM DTT、50mM海藻糖、2%吐温-20、2%吐温-80、2%Triton X-100,反应体系置于37℃中孵育16h,记录琼脂糖凝胶电泳谱带。
实验结果如图1所示,图1中1/2为核糖核酸酶抑制剂(RI);3/4为DTT;5/6为海藻糖;7/8为吐温20;9/10为吐温80;11/12为Triton X-100;13/14为阴性对照;15/16为阳性对照。图1中每种物质做两次平行试验,因此每种物质有两个电泳图。
图1中可以看出RI液体酶制剂(该RI液体酶制剂包括核糖核酸酶抑制剂(RI)、DTT、海藻糖、吐温20、吐温80、Triton X-100)中各物料均无RNase污染。
实施例3
本实施例提供了一种RI液体酶制剂,包括:核糖核酸酶抑制剂(RI)、缓冲液、DTT、保护剂和表面活性剂;
其中,缓冲液为pH为7.5的HEPES缓冲液;
保护剂为海藻糖;
表面活性剂为吐温20;
RI液体酶制剂中,核糖核酸酶抑制剂(RI)的酶活力为200U/μL、HEPES缓冲液的浓度为50mM、DTT的浓度为8mM、海藻糖质量体积浓度为1%(即每100mL的RI液体酶制剂含有1g海藻糖)、吐温20的体积浓度为0.05%。
上述RI液体酶制剂的配制方法为:按上述配比,将DTT、海藻糖加入至pH为7.5的HEPES缓冲液中,搅拌均匀,再加入吐温20,最后加入核糖核酸酶抑制剂(RI),并调节pH为7.5,再使用0.22μm滤膜过滤除杂,即得RI液体酶制剂。
实施例4
不同pH值对RI液体酶制剂的酶活力影响
制备RI液体酶制剂:在实施例3的基础上,将实施例3中缓冲液分别替换为:50mMpH为4.0的乙酸-乙酸钠缓冲液,50mM pH为5.0的乙酸-乙酸钠缓冲液,50mM pH为6.0的磷酸氢二钠-磷酸二氢钠缓冲液,50mM pH为7.0的磷酸氢二钠-磷酸二氢钠缓冲液,50mM pH为8.0的Tris-HCl缓冲液,50mM pH为9.0的甘氨酸-氢氧化钠缓冲液,50mM pH为10.0的甘氨酸-氢氧化钠缓冲液;RI液体酶制剂中其它组分与实施例3相同;
上述最终制备的RI液体酶制剂与缓冲液的pH保持一致。
测试实施例3~4中不同pH缓冲液形成的RI液体酶制剂的酶活力及25℃储存、冻融10次的酶活保存率,结果如表1所示。
表1-不同pH缓冲液对RI液体酶制剂的酶活力变化
表1中,25℃-15天、25℃-30天分别表示RI液体酶制剂在25℃下储存15天、30天。
由表1数据说明,RI液体酶制剂的酶活力在pH6.0~9.0时,酶活力处于较高水平,且25℃-30天及冻融10次酶活保存率达到85%以上;当pH高于9.0或低于6.0时,酶活测值偏低,且酶活下降很快;酶液保存可选择pH值范围为6.0~9.0,优选pH范围为6.0~8.0。
实施例5
本申请实施例提供的RI液体酶制剂,同实施例3,不同在于,DTT的浓度分别为0.5、1、3、5、10、15mM,其余组分均与实施例3相同。测试实施例3、5中不同DTT浓度形成的RI液体酶制剂的酶活力及25℃储存、冻融10次的酶活保存率,结果如表2所示。
表2-不同DTT浓度对RI液体酶制剂的酶活力变化
由表2可知,DTT浓度为0.5~15mM时,酶活力处于较高水平,且25℃-30天及冻融10次酶活保存率达到80%以上;当DTT浓度高于15mM时,酶活降低,且稳定性下降;DTT浓度可选择范围为0.5~15mM,优选范围为0.5~10mM,最佳浓度为8mM。
实施例6
本申请实施例提供的RI液体酶制剂,同实施例3,不同在于,海藻糖的质量体积浓度分别为0.1%、0.3%、0.5%、0.8%、1.5%,其余组分均与实施例3相同。测试实施例3、6中不同海藻糖的质量体积浓度形成的RI液体酶制剂的酶活力及25℃储存、冻融10次的酶活保存率,结果如表3所示。
表3-不同海藻糖浓度对RI液体酶制剂的酶活力影响
由表3数据说明,各个浓度的海藻糖对初始活性无影响,但海藻糖质量体积浓度为0.3%~1.5%时,稳定性较优,25℃-30天及冻融10次酶活保存率达到85%以上;当海藻糖质量体积浓度低于0.3%时,25℃及冻融的酶活保存率降低。海藻糖浓度可选择范围为0.3%~1.5%,优选范围为0.5%~1.5%,最佳浓度为1%。
实施例7
本申请实施例提供的RI液体酶制剂,同实施例3,不同在于,添加不同种类的非离子型表面活性剂,具体的,表面活性剂包括吐温20、吐温80、TritonX-100、Brij-35,表面活性剂的体积浓度分别为0.01%、0.05%、0.1%、0.2%,其余组分均与实施例3相同。测试实施例7中不同表面活性剂形成的RI液体酶制剂的酶活力及25℃储存、冻融10次的酶活保存率,结果如表4所示。
表4-不同表面活性剂对RI液体酶制剂的酶活力影响
由表4数据说明,不同种类的非离子型表面活性剂对活性及酶活保存率无明显影响,在设定浓度范围内(0.01%~0.2%),稳定性均较优,25℃-30天及冻融10次酶活保存率达到90%以上;浓度可选择范围为0.01%~0.2%,在四种可选的表面活性剂中,推荐最佳选择为吐温20,且最佳添加浓度为0.01%。
实施例8
本申请实施例提供的RI液体酶制剂,同实施例3,RI液体酶制剂中核糖核酸酶抑制剂(RI)的酶活力为40~400U/μL,其余组分均与实施例3相同。测试实施例8中不同酶活力的核糖核酸酶抑制剂(RI)形成的RI液体酶制剂的酶活力及25℃储存、冻融10次的酶活保存率,结果如表5所示。
表5-不同核糖核酸酶抑制剂(RI)的酶活力对RI液体酶制剂酶活力影响
由表5可知,在核糖核酸酶抑制剂(RI)的酶活力低于320U/μL时,RI液体酶制剂的酶活力稳定性较优,25℃-30天及冻融10次酶活保存率可达到90%以上;在核糖核酸酶抑制剂(RI)的酶活力高于320U/μL时,随着酶活力升高,稳定性逐渐下降;核糖核酸酶抑制剂(RI)的酶活力为360.6U/μL时,25℃-30天及冻融10次酶活保存率降至85%左右;酶活力为399.2U/μL时,25℃-30天及冻融10次酶活保存率降至80%左右;酶活力优选范围为40~320U/μL。
对比例1~7
本对比例提供的RI液体酶制剂,同实施例3,不同在于选择性添加DTT、海藻糖、吐温20中的一种或两种,其余组分包括缓冲液浓度以及pH、海藻糖浓度均与实施例3相同;测试对比例1~7中RI液体酶制剂的酶活力及25℃储存、冻融10次的酶活保存率,结果如表6所示。
表6-对比例1~7中RI液体酶制剂的酶活力
表6中+表示添加该物质,-表示不加入该物质。
从表6中可以看出,DTT、海藻糖、吐温-20均对最终酶活保存率有不同程度的影响,由对比例1、对比例3、对比例6、实施例3可知,其中海藻糖的提升效果最为明显,DTT、吐温-20的添加对酶活保存率有一定的提升。但总体上,三种物料的浓度选择尤为关键,优选方案(实施例3)相较于空白对照(对比例1),最终对25℃储存及冻融的酶活保存率有极大的提升。
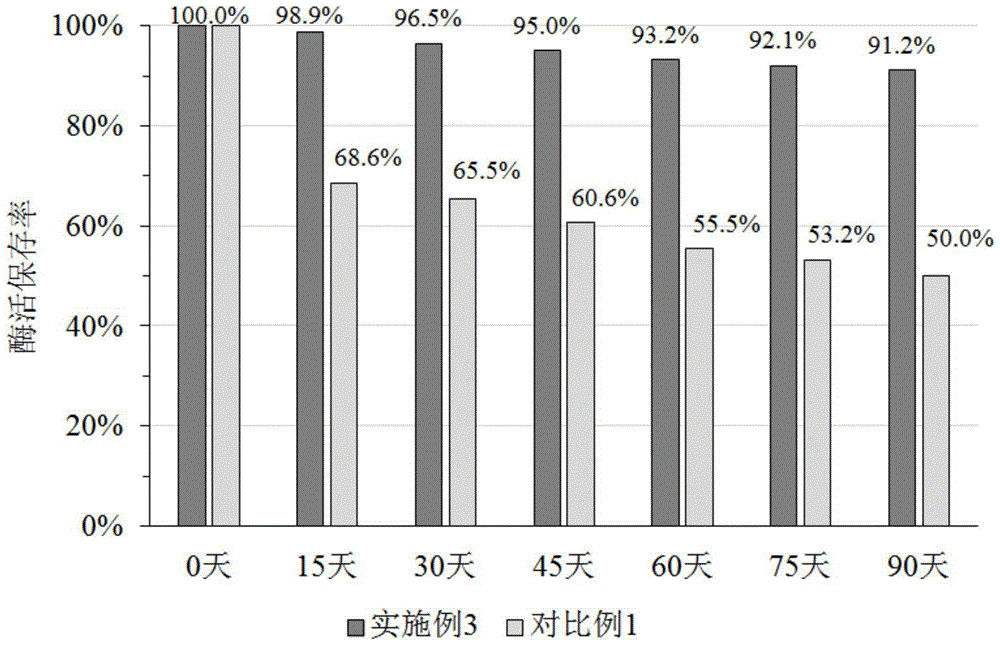
同时本发明还提供了优选方案(实施例3)中的RI液体酶制剂和对比例1中的RI液体酶制剂,在25℃-90天、4℃-12个月、-20℃-12个月的酶活保存率,结果如图2~4所示。
具体的,图2为实施例3和对比例1中RI液体酶制剂在25℃储存过程酶活保存率;图3为实施例3和对比例1中RI液体酶制剂在4℃储存过程酶活保存率;图4为实施例3和对比例1中RI液体酶制剂在-20℃储存过程酶活保存率。
从图2~4中可以看出,实施例3中RI液体酶制剂在25℃储存90天酶活保存率为91.2%,在4℃储存12个月酶活保存率为91.0%,在-20℃储存12个月酶活保存率为92.5%。
对比例8
检索到市面上两家同类型产品,并比较了竞品与优选实施例在25℃、冻融10次的酶活保存率,结果如表7所示。
表7-实施例3中RI液体酶制剂和竞品1~2的酶活力对比
表7中,竞品1为翌圣生物科技(上海)股份有限公司生产的型号为10703ES的产品,竞品2为翌圣生物科技(上海)股份有限公司生产的型号为10701ES的产品。
从表7中可以看出,竞品1~2与实施例3中RI液体酶制剂在25℃储存稳定性上无明显差异,但实施例3中的RI液体酶制剂在冻融稳定性上有绝对的优势,冻融10次后,竞品活力稳定性均低于90%,实施例3中的RI液体酶制剂冻融10次活力依然维持95%以上。
以上所述仅为本发明的较佳实施方式而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种液体酶制剂及其制备方法和应用
- 一种耐热型酶制剂及其制备方法和应用
- 一种超敏蛋白复合酶制剂及其制备方法与应用
- 一种高SOD活性的液体敷料、制备方法及其应用
- 一种液体酶制剂及其制备方法和应用
- 一种深层液体发酵制备葡萄糖氧化酶酶制剂的方法及应用
