一种利用水产粪渣酸解液培养耐酸微藻联产高蛋白生物质的方法及其应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于工业生物技术领域,特别涉及一种利用水产粪渣酸解液培养耐酸微藻联产高蛋白生物质的方法及其应用。
背景技术
水产养殖业产生的粪渣和尾水排放与环保的矛盾日益突出,处理不达标排放导致环境污染问题加剧,严重影响了水产养殖业的绿色健康发展。陆基推水式集装箱养殖新模式是水产养殖模式的根本性变革,具有节地、节水、节能和绿色环保等生态特点,可控性强,杜绝了药物使用,保证了水产品质量安全。其技术创新之一,就是发明了高效集污及尾水生态化处理耦合系统,有效保证养殖用水循环利用。然而,目前该模式在浓缩粪水处理和资源化利用技术方面仍然存在不足,主要表现在:集装箱养殖的特点是高密度养殖和高密度投饵,由于鱼类消化道较短,饲料消化能力有限导致粪污残饵中营养残余较高、产量较大(每吨饲料约产生0.42吨粪便残饵进入尾水)。而传统的畜禽粪便处理方式不仅处理周期长,占地面积大,处理效率低,且会造成资源的巨大浪费。因此,急需开发固形污染物资源化利用的创新技术,以满足粪污处理技术升级换代的需求。
微藻生长周期短、代谢迅速、环境适应性强,可吸收水体中的碳氮和磷等营养物质并快速转化为自身有机质,且运营成本低、副产物经济价值高,在处理废弃物及其资源化利用方面具有广阔前景。嗜硫原始红藻是一种来源于极端环境中的单细胞微藻,其胞内的蛋白质含量可达细胞干重的60~70%,同时含有丰富的对热稳定性高的藻胆蛋白。目前,逐渐有研究将嗜硫原始红藻应用于有机废水、化工无机废水、城市污水、矿山尾水的处理,但到目前为止,尚未发现有将其用于集装箱固形污染物资源化利用方面。
发明内容
本发明的首要目的在于克服现有技术的缺点与不足,提供一种利用水产粪渣酸解液培养耐酸微藻联产高蛋白生物质的方法。
本发明的另一目的在于提供所述利用水产粪渣酸解液培养耐酸微藻联产高蛋白生物质的方法的应用。
本发明的目的通过下述技术方案实现:
一种利用水产粪渣酸解液培养耐酸微藻联产高蛋白生物质的方法,包括如下步骤:
S1、制备酸解液
将水产养殖集装箱中收集的新鲜粪污离心、弃上清,得到粪渣;然后将粪渣加入到水中,控制起始固液比为1:5~15(g/mL),加入浓硫酸使体系中硫酸的浓度为0.1~0.5mol/L,于密闭容器、100~134℃条件下进行酸水解反应,反应时间为15~60min,待反应结束后固液分离,收集上清,得到酸解液;再将酸解液采用活性炭进行脱毒脱色预处理,经滤膜过滤,得到脱毒脱色预处理后的酸解液;
S2、配制非灭菌酸解液培养基
测定步骤S1中得到的脱毒脱色预处理后的酸解液中的铵根离子浓度和还原糖浓度,然后根据酸解液中铵根离子浓度和还原糖浓度,补加硫酸铵、葡萄糖和水,将其配制成pH值为1.0~2.0的非灭菌酸解液培养基;其中,酸解液的添加量为非灭菌酸解液培养基体积的50%以上;非灭菌酸解液培养基中铵根离子浓度为500~1500mg/L,还原糖浓度为10~35g/L;
S3、光发酵培养
将培养至对数生长期的嗜硫原始红藻的种子液接种到步骤S2中配制的非灭菌酸解液培养基中进行发酵培养,待培养结束后,离心收集藻泥,洗涤后真空冷冻干燥,得到富含藻胆蛋白的藻粉。
步骤S1中所述的水产养殖集装箱中养殖的水产优选为鱼类,包括彩虹鲷、生鱼(乌鳢)、鲫鱼、罗非鱼、草鱼等。
步骤S1中所述的离心的条件为:4000r/min离心5~10min;优选为4000r/min离心10min。
步骤S1中所述的粪渣和水的固液比优选为1:9~12(g/mL);更优选为1:10(g/mL)。
步骤S1中,酸水解反应体系中硫酸的浓度优选为0.4~0.5mol/L;更优选为0.5mol/L。
步骤S1中所述的酸水解反应的温度优选为120~134℃;更优选为134℃。
步骤S1中所述的酸水解反应的时间优选为15~30min,即从反应液升温到设定温度开始计时;更优选为30min。
步骤S1中所述的固液分离为采用离心的方式进行固液分离;所述离心的条件优选为:8000r/min离心3~5min;更优选为:8000r/min离心5min。
步骤S1中所述的活性炭的用量优选为按每100mL酸解液配比3.0~4.0g活性炭计算(即活性炭剂量3.0~4.0%(w/v));更优选为按每100mL酸解液配比3.0g活性炭计算。
步骤S1中所述的预处理的时间优选为10~20min;更优选为10min。
步骤S1中所述的滤膜优选为0.45μm滤膜。
步骤S2中所述的酸解液的添加量优选为占非灭菌酸解液培养基体积的50~75%;更优选为占非灭菌酸解液培养基体积的75%。
本发明非灭菌酸解液培养基中加入了脱毒脱色预处理后的酸解液,而脱毒脱色预处理后的酸解液中含有大量的磷(PO
步骤S2中所述的非灭菌酸解液培养基中铵根离子的浓度优选为1000~1500mg/L;更优选为1200mg/L。
步骤S2中所述的非灭菌酸解液培养基中还原糖的浓度优选为15~30g/L;进一步优选为15~20g/L;更优选为15g/L。
步骤S2中所述的pH值优选为采用氢氧化钠溶液进行调节;更优选为采用质量百分比40%的氢氧化钠溶液进行调节。
步骤S2中所述的非灭菌酸解液培养基的pH值优选为1.5~2.0;更优选1.5。
步骤S2中所述的非灭菌酸解液培养基为添加了脱毒脱色预处理后的酸解液,以及标准2MA培养基配方中除磷和镁外的其它营养元素和少量碳源(葡萄糖)、氮源(硫酸铵)配制的培养基;优选为包含如下组分:NH
步骤S3中所述的嗜硫原始红藻优选为嗜硫原始红藻(Galdieria sulphuraria)UTEX 2919。
步骤S3中所述的嗜硫原始红藻的种子液优选为通过如下方法获得:将嗜硫原始红藻接种到种子液培养基中进行活化培养,培养至对数生长期,得到种子液。
所述的种子液培养基为2MA培养基;优选为优化后的2MA培养基,包含如下组分:葡萄糖15~35g/L(优选20g/L);(NH
所述的培养的温度为30~40℃;优选为35℃。
所述的培养的光照强度为65~300μmol m
所述的光照为全光谱LED灯光照。
所述的培养的转速为100~150rpm;优选为150rpm。
步骤S3中所述的嗜硫原始红藻的种子液优选为经过适应性培养的种子液,具体步骤如下:
将活化后的嗜硫原始红藻的种子液接种到S2中配制的非灭菌酸解液培养基中,培养至有机碳源耗尽,得到培养液1(第一次适应性培养);然后取部分培养液1再次接种到非灭菌酸解液培养基中,重复上述操作四次以上,得到适应性培养后的种子液。
所述的酸解液的添加量占非灭菌酸解液培养基体积的50%以上;优选为占非灭菌酸解液培养基体积的50~75%;更优选为占非灭菌酸解液培养基体积的75%。
所述的嗜硫原始红藻的种子液的接种量为按其在发酵体系的终浓度为1×10
所述的培养的温度为30~40℃;优选为35℃。
所述的培养的光照强度为65~300μmol m
所述的培养的转速为100~150rpm;优选为150rpm。
步骤S3中所述的嗜硫原始红藻的种子液的接种量为按其在发酵体系的终浓度为1×10
步骤S3中所述的培养的温度为30~40℃;优选为35℃。
步骤S3中所述的培养的光照强度为65~300μmol m
步骤S3中所述的培养的转速为100~150rpm;优选为150rpm。
所述的利用水产粪渣酸解液培养耐酸微藻联产高蛋白生物质的方法在处理水产养殖集装箱粪渣和/或生产蛋白生物质方面的应用。
所述的蛋白生物质包括藻胆蛋白等。
所述的水产养殖集装箱中养殖的水产优选为鱼类,包括彩虹鲷、生鱼(乌鳢)、鲫鱼、罗非鱼、草鱼等。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明针对新鲜粪渣处理与资源化利用的技术瓶颈,以来自集装箱养殖的新鲜粪污为原料,提供了一种有别于传统养殖业粪便资源化利用的新方法,先通过酸解技术最大程度释放粪渣中的营养物质,可获得低pH且营养全面的酸解液,其原料水解率高达34.68%,进而将酸解液作为光发酵培养基用于耐酸微藻的培养,培养过程无需对酸解液进行灭菌处理,最终可收获高蛋白微藻生物质,并将酸解液培养基中的主要营养成分完全利用。
(2)本发明中经酸解液培养的红藻,其藻粉内积累了高含量的蛋白质和高价值的藻胆蛋白,其蛋白质含量高达70.12%干重,藻胆蛋白含量可达4.05%干重,该体系可为优质的高蛋白生物质及其下游产品生产(如高蛋白饲料添加剂)提供原材料,该方法在处理废弃物的同时联产可回收利用的高营养生物质,符合绿色循环经济和可持续发展战略。
(3)本发明将新鲜粪渣酸解技术与耐酸微藻培养相结合,在利用微藻处理废弃物联产高值生物质的同时也为动物粪便处理提供了一种新思路和新方法,该体系简单有效,处理周期短且绿色环保,实现了资源的综合开发利用。
附图说明
图1是集装箱养鱼新鲜粪渣酸解技术优化过程中不同粪渣添加量、酸解硫酸浓度、酸解温度、酸解时间以及正交实验过程中还原糖得率和粪渣水解率变化图;其中,A为不同粪渣添加量下还原糖得率和粪渣水解率变化图;B为不同酸解硫酸浓度下还原糖得率和粪渣水解率变化图;C为不同酸解温度下还原糖得率和粪渣水解率变化图;D为不同酸解时间下还原糖得率和粪渣水解率变化图;E为正交实验结果。
图2是非灭菌酸解液培养基中嗜硫原始红藻(Galdieria sulphuraria)在不同酸解液添加量和初始pH培养时细胞密度、生物量、蛋白质和藻胆蛋白产量图;其中,A1、B1和C1分别为不同酸解液添加量下的变化图;A2、B2和C2分别为不同初始pH条件下的变化图。
图3是非灭菌酸解液培养基中嗜硫原始红藻(Galdieria sulphuraria)在不同碳源和氮源添加量下培养时细胞密度、还原糖浓度、铵根浓度变化图;其中,A1和B1分别为不同碳源添加量下的变化图;A2和B2分别为不同氮源添加量下的变化图;A3、B3和C3分别为分批补糖条件下的变化图。
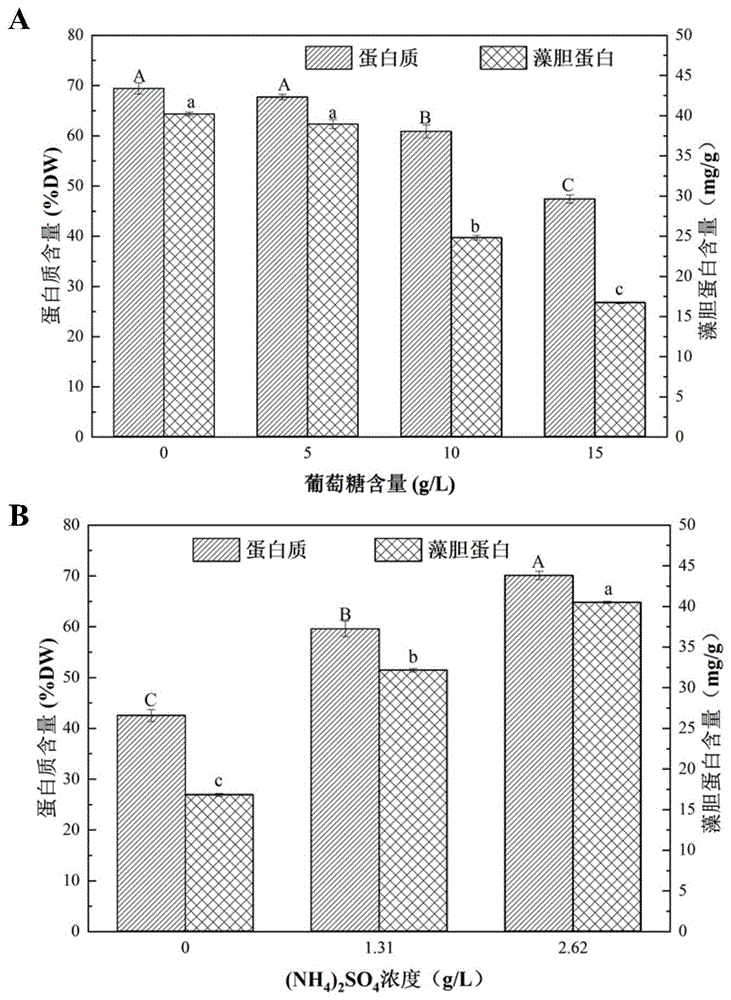
图4是非灭菌酸解液培养基中嗜硫原始红藻(Galdieria sulphuraria)在不同碳源和氮源添加量下培养时蛋白质和藻胆蛋白产量图;其中,A为不同碳源添加量下的变化图;B为不同氮源添加量下的变化图。
具体实施方式
下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。下列实施例中未注明具体实验条件的试验方法,通常按照常规实验条件或按照制造厂所建议的实验条件。除非特别说明,本发明所用试剂和原材料均可通过市售获得。
本发明实施例中的微藻均选用嗜硫原始红藻(Galdieria sulphuraria)UTEX2919,购于美国UTEX藻种库。
本发明实施例中涉及的集装箱为常规养鱼集装箱,采用20呎标准集装箱尺寸6.058m(L)×2.438m(W)×2.896m(H),养殖箱底面采用纵向坡度5°-10°设计。养殖鱼类一般为彩虹鲷、生鱼(乌鳢)、鲫鱼、罗非鱼、草鱼等。投喂相应的配合饲料,投喂系数大约为1.2~1.5(即鱼净增重1斤须喂食1.2~1.5斤饲料),一天排污收集两次(注:由于鱼类喂养的饲料为常规高蛋白饲料,因此经离心弃上清获得的新鲜粪渣,再经酸水解、活性炭脱毒脱色预处理后所获得的酸解液成分含量均相差不大);其中,所用到的活性炭,为市售麦克林A805338活性炭。
本发明实施例中所选用的酸解液为集装箱养鱼新鲜粪渣经酸解技术制备并进行脱毒脱色预处理的废水,其酸解液中还原糖浓度为16~22g/L,铵根(NH
本发明实例中采取的检测方法可参照如下说明:
(一)酸解还原糖浓度的测定
采用DNS法测量还原糖的含量。取烘干至恒重的葡萄糖配制不同浓度的葡萄糖标准液(注:还原糖中的各种糖经DNS和加热的双重作用,会转化成便于测定的葡萄糖,而除还原糖外的其他糖类由于红藻无法利用,故本实验只需测定还原糖的含量即可),并分别各取1mL加入具塞比色管中,然后加入2mL DNS试剂,充分混匀后于沸水浴中加热煮沸5min。流水冷却后再分别向各试管中加入蒸馏水9mL,混匀,利用多功能微孔板检测仪测定样品在540nm处吸光度,根据测定结果绘制吸收光-葡萄糖标准曲线,得到还原糖标准曲线为Y(g/L)=2.0672A540+0.0351(R
先测定酸解前粪渣的质量,然后将酸解液在8000r/min下离心5min获得上清液,用去离子水稀释至吸光度范围,取1mL加入DNS试剂2mL,其余操作同标准曲线的操作,540nm处测定吸光度,并根据上述标准曲线换算得到酸解液还原糖的浓度,最后计算还原糖得率。其中还原糖得率按照以下公式进行计算:
还原糖得率(mg/g)=[(C
式中:C
(二)酸解粪渣水解率的测定
采用差重法分析。先测定酸解前粪渣的质量,然后取酸解后混合料液于预先称重的50mL离心管中,在8000rpm转速条件下离心5min,弃上清,随后用去离子水重悬粪渣,再次离心弃去上清获得粪渣。将粪渣置于真空冷冻干燥机中2~3天冻干,最后用分析天平称重,按照以下公式计算水解率:
粪渣水解率(%)=[(M
式中:M
(三)嗜硫原始红藻细胞密度的测定
将样品进行稀释,并用300目滤布过滤,随后使用流式细胞仪测定细胞密度。流式细胞仪的激发光为488nm的氩离子激光,测定过程中对细胞的前向散射光信号(Forwardscatter,FSC)和侧向散射光信号(Side scatter,SSC)进行采集。流式细胞仪采集参数设置为:样本流速为30μL/min,记录时间为30sec,记录10000个以上的细胞数据,并使用CytExpert 1.2软件分析数据。
(四)嗜硫原始红藻生物量干重浓度的测定
取2ml嗜硫原始红藻藻液于预先称重的离心管中,在8000rpm转速条件下离心3min,弃上清,随后使用去离子水重悬藻泥,再次离心弃去上清获得藻泥。将藻泥置于烘箱中60℃烘干至恒重,测定并记录总重量,按照以下公式计算生物量和生物量产率:
生物量(g/L)=(M
式中:M
(五)酸解液中铵根浓度的测定
将一定体积的样品置于8000rpm转速条件下离心3min,取上清并稀释至可测定的范围(0.00~10.00mg/L),稀释至终体积为10mL。采用意大利HANNA HI83200多参数水质分析仪测定铵根浓度,记录读数,每个样品重复测定三次后取平均值。根据制作的标准曲线对测定读数进行换算,换算结果乘以稀释倍数即为样品的实际铵根浓度值。
(六)藻胆蛋白含量的测定
称取一定质量的藻粉于2mL离心管中,加入1mL磷酸盐缓冲液(0.05mol/LNa
c(PC)=(OD
c(APC)=(OD
c(PE)=(OD
PBP含量=(c(PC)+c(APC)+c(PE))×V/M;
式中:PBP含量单位为mg/g;V为定容体积,单位为mL;M为藻粉质量,单位为g。
(七)总蛋白含量的测定
此部分采用凯氏定氮法进行。称取100~150mg的藻粉,并使用称量纸包裹好;随后置于消化管中,加入8g硫酸铜-硫酸钾混合粉末(质量比=1:15)和10mL浓硫酸(质量百分数98%的浓硫酸),消化过夜。将消化过夜后的消化管置于消化炉中在150℃保持40min和420℃保持150min以进行消化,消化完毕后冷却消化管。随后,置于凯氏定氮仪中进行定氮,并使用0.1mol/L的盐酸标准液进行滴定。按照以下公式计算相应样品的蛋白含量和产量:
蛋白质含量(%DW)=((V
式中:V
蛋白质产量(g/L)=蛋白质含量×生物量产量;
式中:蛋白质含量单位为%DW;生物量产量单位为g/L。
实施例1集装箱养鱼新鲜粪渣酸解技术的优化
1.1粪渣添加量的优化
将从集装箱(饲养鱼类为罗非鱼,投喂的饲料为海大集团的罗非鱼配合饲料)收集到的新鲜粪污于4000r/min下离心10min,弃上清,获得新鲜粪渣,然后置于50mL蓝盖瓶中进行酸解条件优化。酸解粪渣添加量依次设置为5、10、15、20、25、30g(湿重),与去离子水混合,再加入浓硫酸(质量百分数98%)使原料液中硫酸浓度为0.5mol/L,酸解总体积控制为50mL,盖紧瓶盖后进行酸水解反应(下同)。反应温度120℃,反应时间为30min,反应结束后进行固液分离。
1.2酸解硫酸浓度优化
在酸解最优粪渣添加量的前提下与去离子水混合,加入浓硫酸使原料液中硫酸的浓度依次为0.1、0.2、0.3、0.4、0.5mol/L进行酸水解反应,反应温度120℃,反应时间为30min,反应结束后进行固液分离。
1.3酸解温度优化
在酸解最优粪渣添加量的前提下与去离子水混合,加入浓硫酸使原料液中硫酸的浓度为0.5mol/L进行酸水解反应,反应温度依次为100、120、134℃,反应时间为30min,反应结束后进行固液分离。
1.4酸解时间优化
在酸解最优粪渣添加量的前提下与去离子水混合,加入浓硫酸使原料液中硫酸的浓度为0.5mol/L进行酸水解反应,反应温度134℃,反应时间依次为15、30、45、60min,反应结束后进行固液分离。
1.5酸解正交实验优化
通过单因素实验对酸解过程关键步骤进行逐一探究,在此基础上对其进行正交实验设计,以求达到更好的酸解效果,酸解实验因素及水平如表1所示。
表1正交试验设计因素水平表
/>
1.6分析检测:酸解结束后于50mL离心管中8000r/min下离心5min进行固液分离,其中离心上清经脱毒脱色(活性炭剂量3.0%(w/v),混合时间10min)预处理,0.45μm滤膜过滤后进行还原糖得率测定,离心沉淀(酸解后粪渣)经真空冷冻干燥后进行粪渣水解率的测定。
1.7产能分析结果:通过对酸解过程关键工艺参数的优化,可得到集装箱养鱼新鲜粪渣酸解的最优条件。由实验结果R值分析可知,粪渣湿重(A)、硫酸浓度(B)、温度(C)、时间(D)对粪渣水解率的主次效应为:C>B>A>D,即温度对粪渣水解率的影响最大,其次是硫酸浓度,酸解时间对粪渣水解率的影响最小。最终最优组合为A
实施例2非灭菌培养体系中酸解液添加量和初始pH对嗜硫原始红藻生长的影响
2.1藻种的活化
将嗜硫原始红藻(Galdieria sulphuraria UTEX 2919)单藻落从固体培养基中挑出并接种于调整配方后的2MA培养基中进行培养,培养基pH值为2.5,葡萄糖浓度为20g/L,在培养温度为35℃、光照强度为210μmol m
表2调整配方后的2MA培养基配方
注:EDTA为乙二胺四乙酸;原2MA培养基配方中(NH
2.2酸解液培养基的配制
将实施例1中筛选得到的最优组合(粪渣湿重为20g/50mL(干重5g)、硫酸浓度0.5mol/L、温度134℃、时间30min)的酸解液经脱毒脱色(活性炭剂量3.0%(w/v),混合时间10min)预处理,0.45μm滤膜过滤后进行酸解液培养基的配制。根据酸解液中各营养物浓度进行调节(使用去离子水将酸解液稀释,其中酸解液添加量占酸解液培养基总体积的50%以上),并添加适量硫酸铵使其初始铵根浓度范围为1000~1500mg/L,随后添加调整配方后的2MA培养基配方(表2)中的营养元素于酸解液中(使除硫酸铵、磷酸二氢钾和硫酸镁外,培养基中的其他各营养元素的含量与表2中的相同),并添加适量葡萄糖使其还原糖终浓度为20g/L为主要碳源,得到酸解液培养基;然后利用40%(w/v)氢氧化钠溶液调节培养基pH值至2.0,并将酸解液培养基分装至250mL锥形瓶中,装液量为100mL,得到非灭菌酸解液培养基。
2.3适应性培养
混养培养:取一定体积的嗜硫原始红藻种子液于无菌离心管中并将其置于4000r/min条件下离心3min,弃上清,使用非灭菌酸解液培养基重悬细胞并接种,接种密度为1×10
2.4非灭菌体系下酸解液培养基酸解液添加量的优化
混养培养:将2.3适应性培养后的嗜硫原始红藻藻种接种至含100mL非灭菌酸解液培养基的250mL锥形瓶中,其中酸解液添加量依次为非灭菌酸解液培养基总体积的50%、75%、100%,红藻接种密度为1×10
2.5非灭菌体系下酸解液培养基初始pH的优化
混养培养:将2.3适应性培养后的嗜硫原始红藻藻种接种至含100mL非灭菌酸解液培养基的250mL锥形瓶中,其中在酸解液添加量最优(上述2.4)的前提下,红藻接种密度为1×10
2.6分析检测:培养期间每天取一次样,观察培养过程中细胞密度、生物量干重的变化情况。培养结束后回收剩余藻液,将其离心洗涤多次后收集藻泥。将藻泥进行真空冷冻干燥以获得藻粉,并对其藻胆蛋白和蛋白质含量进行测定。
2.7产能分析结果:酸解液培养基随酸解液添加比例的增加其营养物质含量不断增加,但由于酸解过程不可避免的会产生某些醛、酮、酸、重金属等不适合微藻生长的物质,使微藻无法正常生长,所以在酸解液培养基配制过程中控制酸解液添加量就显得尤为重要。从实验结果可知,酸解液添加量为培养基总体积的75%时,其细胞密度和蛋白质含量与酸解液添加量50%相差不显著,且均显著高于酸解液添加量100%,从降本增效的角度看,酸解液添加量为培养基总体积的75%为最优条件,在此条件下其生物量干重可达18.55g/L,蛋白质和藻胆蛋白含量分别为58.90% DW和24.53mg/g;对pH的探究可知,pH 1.5时,其蛋白质和藻胆蛋白含量最高,可达59.32% DW和28.22mg/g,此外当酸解液培养基pH高于2时便会出现絮状物沉淀,不利于微藻正常生长(图2)。
实施例3非灭菌培养体系下碳源和氮源补加对嗜硫原始红藻生长的影响
3.1藻种活化和酸解液培养基配制
嗜硫原始红藻(Galdieria sulphuraria UTEX 2919)活化和非灭菌酸解液培养基的配制分别按2.1和2.2所述方法进行。
3.2非灭菌体系下酸解液培养基碳源补加的优化
混养培养:将2.3适应性培养后的嗜硫原始红藻藻种接种至含100mL非灭菌酸解液培养基的250mL锥形瓶中,其中酸解液添加量为培养基总体积的75%,红藻接种密度为1×10
3.3非灭菌体系下酸解液培养基氮源补加的优化
混养培养:将2.3适应性培养后的嗜硫原始红藻藻种接种至含100mL非灭菌酸解液培养基的250mL锥形瓶中,其中酸解液添加量为培养基总体积的75%,红藻接种密度为1×10
3.4非灭菌体系下酸解液培养基的分批补糖培养
混养培养:将2.3适应性培养后的嗜硫原始红藻藻种接种至含100mL非灭菌酸解液培养基的250mL锥形瓶中,其中酸解液添加量为培养基总体积的75%,红藻接种密度为1×10
3.5分析检测:培养期间每天取一次样,观察培养过程中细胞密度、还原糖浓度、铵根浓度的变化情况。培养结束后回收剩余藻液,将其离心洗涤多次后收集藻泥。将藻泥进行真空冷冻干燥以获得藻粉,并对其藻胆蛋白和蛋白质含量进行测定。
3.6产能分析结果:由于酸解液本身含有还原糖和氨氮可作为微藻生长过程中的碳源和氮源,所以只需补加少量的碳源和氮源即可满足嗜硫原始红藻的正常生长。由实验结果可知,在初始还原糖浓度下补加硫酸铵2.62g/L使其在培养基的铵根终浓度为1200mg/L时,培养5天,酸解液培养基中可被微藻利用的还原糖已耗尽,此时嗜硫原始红藻生长进入稳定期,生物量干重为13.55g/L,其蛋白质和藻胆蛋白含量最高,可达70.12% DW和40.51mg/g。在上述最优培养条件下,酸解液培养基中仍有少量氨氮残留,故对其进行分批补糖模式的优化。由实验结果可知,非灭菌酸解液培养基中的嗜硫原始红藻可通过补糖分批培养的模式,使出水中的氨氮残留浓度极低(38.89mg/L),达到了集约化畜禽养殖业污水排放的标准。(图3、图4)。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 一种利用黄腐酸提高核桃壳提取液中微藻油脂含量的方法
- 一种利用碱性蛋白酶酶解海带渣蛋白制取抗氧化活性水解液的方法
- 一种利用核桃壳提取液提高微藻油脂产率的方法
- 利用自絮凝微藻收获城市污水培养系统中产油微藻的方法
- 一种利用产油微藻高效光合固碳联产高蛋白生物质的方法及其应用
- 一种利用污泥提取液耦合CO2定向培养富集高价值微藻生物质的方法及定向培养微藻装置
