一种检测猴痘病毒B.1 lineage的引物探针组、试剂盒及应用
文献发布时间:2023-06-19 19:32:07
技术领域
本发明涉及生物医药技术领域,具体涉及一种检测猴痘病毒B.1 lineage的引物探针组、试剂盒及应用。
背景技术
猴痘(monkeypox),一种传染性的人畜共患病,属于正痘病毒科,脊椎动物痘病毒亚科,正痘病毒属。猴痘首次在1958年从圈养的猴子体内被发现,1970年在刚果民主共和国的儿童体内检测到。自1970年人类消灭天花以来,猴痘病毒逐渐成为感染人类最严重的正痘病毒。经历10-14天的潜伏期,病人逐渐出现发热,乏力,头痛,肌肉痛和大面积皮疹等症状。几乎90%感染猴痘的病例都出现淋巴结肿大。该特征可区别于天花。猴痘可通过与病人的直接接触或者与病人污染的床上用品、衣物或表面覆盖物接触而传播,也可通过性接触传播。
自2022年5月13日起,西欧和北美多国报道了越来越多的猴痘病例。这是首次在中西非以外的国家出现大规模的猴痘病例和持续的人传人传播链。与过去的暴发相比,当前的病例大多出现在同性恋人群中,孕妇和婴儿也未能幸免。及早检测到该病毒对于控制猴痘的传播至关重要。
与2021年的人猴痘病毒尼日利亚毒株相比,2022年人猴痘病毒形成了一个独立的分支B.1。与2021年之前的人猴痘病毒相比,B.1 lineage有46个单核苷酸突变,其中24个突变引起了氨基酸的改变。加速的微进化事件可能增加病毒在人际间的传播。
一些血清学的检测方法,例如中和实验和血凝抑制实验被用来检测猴痘病毒刺激机体产生的抗体,但是猴痘病毒表面抗原之间的交叉反应使得血清学检测方法容易产生假阳性。目前尚无特异性检测猴痘病毒B.1 lineage的有效方法。
发明内容
有鉴于此,本发明的目的在于提供一种检测猴痘病毒B.1lineage的引物探针组,能在同一体系里快速检测并区分猴痘病毒B.1lineage,具有良好的特异性和灵敏度。
为解决上述技术问题,本发明提供了以下技术方案:
本发明提供了一种检测猴痘病毒B.1lineage的引物探针组,所述引物探针组包括以下正反向引物序列和两条探针序列:
正向引物序列:5'-AGTACACAGACCTCCACCAC-3';
反向引物序列:5'-AGTAATTGACCTACTGGTCTAGGG-3';
第一探针序列:5'HEX-AAACCAGTCCAAAATTCGCCACAA-BHQ13';
第二探针序列:5'FAM-AGTCCAAAATCCGCCA-MGB 3'。
优选的,所述第一探针和第二探针有一个核苷酸位点的差异。
本发明提供了一种检测猴痘病毒B.1lineage的多重荧光定量PCR试剂盒,所述试剂盒包括上述的正反向引物序列和两条探针序列。
优选的,所述正反向引物序列和两条探针序列在同一反应体系中进行反应。
优选的,所述试剂盒还包括多重荧光定量PCR反应体系,20μL所述反应体系包括如下组分:10μL 2×ChamQ Geno-SNPProbe Master Mix,0.4μL浓度为10μM的正向引物,0.4μL浓度为10μM的反向引物,0.4μL浓度为10μM的第一探针,0.4μL浓度为10μM的第二探针,2μL模板DNA,6.4μL无菌无酶水。
本发明提供了一种检测猴痘病毒B.1lineage的数字PCR试剂盒,所述试剂盒包括上述的正反向引物序列和两条探针序列。
优选的,所述正反向引物序列和两条探针序列在同一反应体系中进行反应。
优选的,所述试剂盒还包括数字PCR反应体系,35μL所述反应体系包括如下组分:7μL Digital LightCycler 5×DNAMaster,0.7μL浓度为10μM的正向引物,0.7μL浓度为10μM的反向引物,0.7μL浓度为10μM的第一探针,0.7μL浓度为10μM的第二探针,3.5μL模板DNA,21.7μL无菌无酶水。
本发明还提供了一种非诊断目的的检测猴痘病毒B.1lineage的方法,所述方法包括如下步骤:
提取待测样品的DNA,以所述待测样品的DNA作为模板,利用上述的引物探针组进行多重荧光定量PCR或数字PCR,即可检测猴痘病毒B.1lineage。
本发明还提供了上述的引物探针组或上述的试剂盒在快速检测并区分猴痘病毒B.1lineage中的应用。
本发明提供了一种检测猴痘病毒B.1lineage的引物探针组及试剂盒,设计了一对引物、两条探针在同一体系中进行反应,不仅能够同时利用多重荧光定量PCR和数字PCR方法实现猴痘病毒B.1lineage的检测,而且具有较高的特异性和灵敏度。经试验证实可知,利用本发明所述引物探针组能快速特异性检出猴痘病毒clade II并将猴痘病毒B.1lineage从其他lineages中区分开来,多重荧光定量PCR检测猴痘病毒B.1lineage质粒的下限为127copies/μL,数字PCR检测猴痘病毒B.1lineage质粒的下限为0.06copies/μL,具有良好的特异性和灵敏度,为开发猴痘病毒分支特异性检测试剂盒奠定了基础,具有重要的开发价值和推广意义。
附图说明
图1为猴痘病毒B.1lineage和猴痘病毒clade II中其他lineages之间的序列比对,其中,“点”代表与参考基因组序列相同的核苷酸,突变标记为“A”,“T”,“C”,或者是“G”;箭头代表了正向引物,反向引物和两条探针的方向和序列。
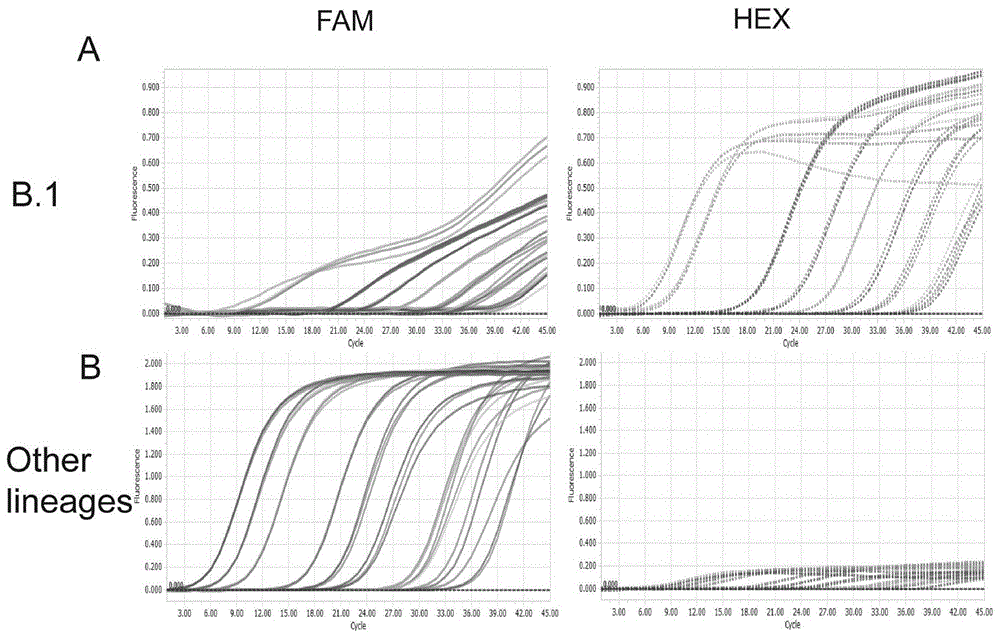
图2为多重荧光定量PCR反应特异性验证结果,其中,A为当投入梯度稀释的不同拷贝数的猴痘病毒B.1lineage质粒时,FAM通道和HEX通道的扩增曲线;B为当投入梯度稀释的不同拷贝数的猴痘病毒clade II中其他lineages质粒时,FAM和HEX通道的扩增曲线。
图3为多重荧光定量PCR反应的灵敏度验证结果,其中,横坐标为不同稀释度质粒的拷贝数的对数值,纵坐标为实时荧光定量PCR的循环阈值,A为不同稀释度猴痘病毒B.1lineage在HEX通道的标准曲线;B为不同稀释度猴痘病毒非B.1lineages在FAM通道的标准曲线。
具体实施方式
本发明提供了一种检测猴痘病毒B.1lineage的引物探针组,所述引物探针组包括以下正反向引物序列和两条探针序列:
正向引物序列:5'-AGTACACAGACCTCCACCAC-3';
反向引物序列:5'-AGTAATTGACCTACTGGTCTAGGG-3';
第一探针序列:5'HEX-AAACCAGTCCAAAATTCGCCACAA-BHQ13';
第二探针序列:5'FAM-AGTCCAAAATCCGCCA-MGB 3'。
本发明中,所述第一探针和第二探针优选的有一个核苷酸位点的差异;所述第一探针针对于猴痘病毒B.1lineage,所述第二探针针对于猴痘病毒clade II中其他lineages。
本发明提供了一种检测猴痘病毒B.1lineage的多重荧光定量PCR试剂盒,所述试剂盒包括上述的正反向引物序列和两条探针序列。本发明中,所述正反向引物序列和两条探针序列在同一反应体系中进行反应。所述试剂盒优选的还包括多重荧光定量PCR反应体系,20μL所述反应体系优选的包括如下组分:10μL 2×ChamQ Geno-SNP Probe MasterMix,0.4μL浓度为10μM的正向引物,0.4μL浓度为10μM的反向引物,0.4μL浓度为10μM的第一探针,0.4μL浓度为10μM的第二探针,2μL模板DNA,6.4μL无菌无酶水。本发明两条探针优选的标记有荧光基团,如果多重PCR检测结果中两通道都有扩增曲线,则为猴痘病毒B.1lineage;如只有FAM通道有扩增曲线而HEX通道无扩增曲线,则为其他猴痘lineages。
本发明提供了一种检测猴痘病毒B.1lineage的数字PCR试剂盒,所述试剂盒包括上述的正反向引物序列和两条探针序列。本发明中,所述正反向引物序列和两条探针序列在同一反应体系中进行反应。所述试剂盒优选的还包括数字PCR反应体系,35μL所述反应体系优选的包括如下组分:7μL Digital LightCycler 5×DNAMaster,0.7μL浓度为10μM的正向引物,0.7μL浓度为10μM的反向引物,0.7μL浓度为10μM的第一探针,0.7μL浓度为10μM的第二探针,3.5μL模板DNA,21.7μL无菌无酶水。
本发明还提供了一种非诊断目的的检测猴痘病毒B.1lineage的方法,所述方法包括如下步骤:提取待测样品的DNA,以所述待测样品的DNA作为模板,利用上述的引物探针组进行多重荧光定量PCR或数字PCR,即可检测猴痘病毒B.1lineage。本发明对所述提取待测样品DNA的方法并没有特殊限定,采用本领域常规的提取方法即可。
本发明还提供了上述的引物探针组或上述的试剂盒在快速检测并区分猴痘病毒B.1lineage中的应用。
为使本发明的目的、技术方案和优点更加清楚明白,下面结合实施例对本发明进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
下述实施例中,如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中未注明具体条件的实验方法,通常按照常规条件如《分子克隆实验指南》(第三版,科学出版社,2005)等本领域常用工具书中所述的条件或按试剂生产厂家所建议的条件进行。
实施例1
序列比对和引物探针设计
从NCBI上下载猴痘病毒B.1lineage以及其他lineages的序列,部分代表性序列比对结果如图1所示。以猴痘病毒MPXV_USA_2022_MA001的序列作为参考基因组序列。在MPXV_USA_2022_MA001全基因组183519-183542的位置上,猴痘病毒B.1lineage和其他lineages相比,有一个位点的差异。在该位置分别设计针对猴痘病毒B.1lineage和其他lineages的探针,其中针对B.1lineage的第一探针序列为5'HEX-AAACCAGTCCAAAATTCGCCACAA-BHQ1 3'(SEQ ID NO.3),针对其他lineages的第二探针序列为5'FAM-AGTCCAAAATCCGCCA-MGB 3'(SEQ ID NO.4);在探针序列上游参考基因组183491-183510的位置设计正向引物,正向引物序列为5'-AGTACACAGACCTCCACCAC-3'(SEQ ID NO.1);在探针序列下游参考基因组183548-183571的位置设计反向引物,反向引物序列为5'-AGTAATTGACCTACTGGTCTAGGG-3'(SEQ ID NO.2)。
实施例2
多重荧光定量PCR扩增检测并区分猴痘病毒B.1lineage与非B.1lineage
1.模板质粒构建、扩增和提取
将荧光定量PCR上下游引物扩增的序列基因合成(由生工生物工程(上海)股份有限公司完成),构建到质粒PUC57载体上,之后用E.coli DH5α感受态细胞进行转化,涂平板,挑选单克隆和大量扩增。用无内毒素的质粒大提试剂盒进行质粒提取,分装,冻存于-20℃备用。
2.检测步骤
多重荧光定量PCR反应体系为:10μL 2×ChamQ Geno-SNP Probe MasterMix,0.4μL正向引物(引物浓度10μM),0.4μL反向引物(引物浓度10μM),0.4μL第一探针(探针浓度10μM),0.4μL第二探针(探针浓度10μM),2μL模板质粒DNA,6.4μL无菌无酶水,总体积20μL。
PCR程序包括:37℃2min(污染消化),95℃30s(预变性),45个循环95℃10s、60℃30s(循环反应)。同时打开FAM和HEX通道,结果如图2。
判断标准:如果FAM通道和HEX通道都有扩增曲线或只有HEX通道有扩增曲线,则为猴痘病毒clade II B.1lineage;如果只有FAM通道有扩增曲线而HEX通道无扩增曲线则为猴痘病毒clade II非B.1lineage。
可以看出,当投入猴痘病毒B.1lineage质粒模板时,FAM通道和HEX通道都有扩增曲线;当投入猴痘病毒clade II中非B.1lineage质粒模板时,只有FAM通道有扩增曲线,而HEX通道无扩增曲线。表明本发明所述引物和探针利用多重荧光定量PCR可以检出并且很好地区分猴痘病毒B.1lineage和其他lineages。
实施例3
多重荧光定量PCR最低检测限确定
1.质粒构建、扩增和提取
将荧光定量PCR上下游引物扩增的序列基因合成(由生工生物工程(上海)股份有限公司完成),构建到质粒PUC57载体上,之后用E.coli DH5α感受态细胞进行转化,涂平板,挑选单克隆和大量扩增。用无内毒素的质粒大提试剂盒进行质粒提取,分装,冻存于-20℃备用。
2.质粒稀释
提取分装好的质粒用nanopore进行DNA浓度测定,根据公式copies/ml(拷贝数)=(6.02×10
3.多重荧光定量PCR
将上述浓度梯度稀释后的质粒DNA分别作为多重荧光定量PCR扩增的模板,每个浓度做三个复孔,按照实施例2中的方法和程序进行多重荧光定量PCR,得到不同荧光通道的扩增曲线和循环阈值,结果如图3。
根据得到的不同稀释浓度梯度的质粒对应的拷贝数与循环阈值拟合线性回归方程计算斜率、截距以及相关系数R
实施例4
数字PCR最低检测限确定
将实施例3中构建的B.1 lineage和非B.1 lineage的质粒先进行10倍比稀释,然后继续进行2倍比稀释得到的质粒作为模板进行数字PCR。
数字PCR反应体系如下:7μL Digital LightCycler 5×DNA Master,0.7μL正向引物(引物浓度10μM),0.7μL反向引物(引物浓度10μM),0.7μL第一探针(探针浓度10μM),0.7μL第二探针(探针浓度10μM),3.5μL模板DNA,21.7μL无菌无酶水,总体积35μL。
PCR程序包括:60℃2min,95℃2min(预变性),95℃10s,60℃30s 45个循环,40℃30s。同时打开FAM和HEX通道,在实际上样时只上32μL。用Roche Digital
表1 B.1 lineage质粒数字PCR定量
/>
表2非B.1lineage质粒数字PCR定量
其中,三个复孔都能检出拷贝数的最高稀释度对应的每微升中的拷贝数即为最终最低检测限。可以看出,B.1lineage的最低检测限为0.06copies/μL,非B.1lineage的最低检测限为0.1622copies/μL。
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
- 一种基于BTNAA体系检测犬瘟热病毒的引物对、引物和探针组合物、试剂及试剂盒
- 一种基于BTNAA体系检测犬细小病毒的引物对、引物和探针组合物、试剂及试剂盒
- 一种汉坦病毒极速荧光PCR检测试剂盒及其引物探针组合
- 用于检测A型猪轮状病毒的引物及探针、荧光定量PCR试剂盒及方法和应用
- 用于检测猪传染性胃肠炎病毒的引物及探针、荧光定量PCR试剂盒及方法和应用
- 一种引物探针组及其应用和一种检测非洲猪瘟病毒、猪瘟病毒、猪丹毒丝菌的试剂盒
- 一种引物探针组及其应用和一种检测非洲猪瘟病毒和猪流行性腹泻病毒的试剂盒
