一种重组腺相关病毒载体的药物组合物及其用途
文献发布时间:2024-01-17 01:13:28
本申请是基于申请号为202211467932.8,申请日为2022年11月22日,发明名称为“一种重组腺相关病毒载体的药物组合物及其用途”的中国发明专利申请的分案申请。
技术领域
本发明属于重组腺相关病毒载体药物制剂领域。本发明涉及一种重组腺相关病毒载体的药物组合物及其用途,特别是一种以重组腺相关病毒为载体的基因治疗药物的液体制剂及其用途。
背景技术
细胞与基因治疗(Cell and Gene Therapy,CGT)是一种通过基因表达、沉默或体外改造手段,克服传统小分子和抗体药物在蛋白质水平进行调控局限性,实现疗法升级或罕见病治疗的疗法。针对CGT疗法,非常重要的部分就是基因载体的体内递送,目前常见的基因载体分为非病毒载体和病毒载体。非病毒载体包括质粒或裸露DNA(非病毒)、LNP递送系统等,但体内转染效果差以及毒性过大,严重制约了非病毒载体的临床转化。病毒载体则包括常用的腺病毒AdV、腺相关病毒AAV、慢病毒LV和逆转录病毒RV等载体。
腺相关病毒(AAV)最早是在20世纪60年代中期从实验室腺病毒(AdV)制剂中发现的,并且很快就在人体组织中发现。重组腺相关病毒(rAAV)载体通常是将病毒的编码序列替换成目的基因。这些载体已被证明在体外和体内的一些不同部位具有高效的表达和基因靶向性。研究表明,AAV在呼吸道、中枢神经系统、骨骼肌、肝脏和眼睛的研究中是安全的,且可以稳定持续地表达。随着rAAV制剂滴度和纯度的提高,rAAV介导的转导的效率也在提高。
目前,全球开展的rAAV相关的临床试验数量总体上呈现递增趋势,迄今为止已有四款以rAAV为载体的基因治疗产品获得过上市批准:2012年,被EMA批准Glybera用于治疗脂蛋白脂肪酶缺乏症(LPLD),为第一个正式批准上市的人用AAV基因治疗产品。
2017年底,FDA批准Spark Therapeutics公司的Luxturna用于治疗遗传性视网膜疾病,成为首款在美国获批的“体内给药型”基因疗法。
2019年5月,诺华的Zolgensma获美国FDA批准上市,用于治疗2岁以下脊髓性肌萎缩症(SMA)患儿,患者存活运动神经元1(SMN1)基因存在双等位基因突变。2022年8月24日,BioMarin Pharmaceutical公司(BioMarin)宣布,欧盟委员会(EC)批准血友病A基因疗法ROCTAVIAN
以上的基因治疗产品都需要在冷冻状态储存,其运输和保存温度一般为-20℃或-60℃。将冷冻机温度维持在-20℃或-60℃是一项挑战,并且从物流的角度来看,其需要消耗较大的成本,如此低温要求会对将产品分发到广泛的临床场所的能力产生负面影响。因此,期望提供一种在一般冷藏温度条件下,保持在1年以上稳定的重组腺相关病毒为载体的基因治疗药物的药物组合物,以适合运输或临床场所解冻并将产品保存在冷冻机中,直到用于患者给药。
为解决上述问题,本发明提供了一种重组腺相关病毒载体的药物组合物,特别是一种以重组腺相关病毒为载体的基因治疗药物的液体制剂。该药物组合物能在一般冷藏温度,例如2~8℃的条件下保存1年以上,能使基因组滴度、生物学活性等指标保持稳定,且在室温条件下储存两周也具有良好的稳定性。
发明内容
本发明提供了一种重组腺相关病毒载体的药物组合物及其用途,所述的重组腺相关病毒载体的药物组合物包括重组腺相关病毒(rAAV)、离子盐、缓冲剂、稳定剂和表面活性剂。
在一些实施例中,所述重组腺相关病毒(rAAV)包括来自一种或多种选自由以下组成的组的腺相关病毒血清型的组分:AAV1、AAV2、AAV2tYF、AAV3、AAV4、AAV5、AAV6、AAV7、AAV8、AAV9、AAV10、AAV11和AAVrh10。在一些实施例中,所述rAAV包括AAV5血清型的衣壳蛋白。
在一些实施例中,所述离子盐可以是来自由以下组成的组的一种或多种组分:氯化钠、氯化钾、氯化镁、氯化钙、硫酸钠、硫酸镁、硫酸钙及其水合物。在一些实施例中,所述缓冲剂可以是来自由以下组成的组的一种或多种组分:磷酸二氢钾、磷酸钾、磷酸氢二钠、磷酸二氢钠、磷酸钠六水合物、磷酸二氢钠一水合物、氨丁三醇、三(羟甲基)氨基甲烷盐酸盐(Tris-HCl)、氨基酸、组氨酸、组氨酸盐酸盐(组氨酸-HCl)、琥珀酸钠、柠檬酸钠、乙酸钠以及4-(2-羟乙基)-1-哌嗪乙磺酸(HEPES)、柠檬酸钠、柠檬酸钾、柠檬酸钙。所述稳定剂是蔗糖、山梨醇、甲硫氨酸、海藻糖、甘露糖、甘露醇、棉子糖、拉克替醇、乳糖酸、葡萄糖、麦芽酮糖、异-麦芽酮糖、乳果糖、麦芽糖、乳糖、异麦芽糖、麦芽糖醇、水苏糖、松三糖、葡聚糖的一种或多种。所述表面活性剂是泊洛沙姆和/或聚山梨酯(吐温),优选的表面活性剂是泊洛沙姆188、聚山梨酯20、聚山梨酯80的一种或多种。在一些实施例中,所述离子盐的浓度可以是至少0.5mM,至少5mM,至少10mM,至少20mM,至少30mM,至少50mM,至少100mM,或至少150mM存在于溶液中。在一些实施例中,所述的离子盐的浓度可以是0.5-600mM,或1-300mM,或50-200mM存在于溶液中。在一些实施例中,所述的离子盐可以是约1mM存在于溶液中。在一些实施例中,所述的离子盐可以是约2mM存在于溶液中。在一些实施例中,所述的离子盐可以是约10mM存在于溶液中。在一些实施例中,所述的离子盐可以是约50mM存在于溶液中。在一些实施例中,所述的离子盐可以是约150mM存在于溶液中。在一些实施例中,所述的离子盐可以是约200mM存在于溶液中。在一些实施例中,所述的离子盐可以是约250mM存在于溶液中。
在一些实施例中,所述缓冲剂的浓度可以是至少1mM,至少5mM,至少10mM,或至少20mM存在于溶液中。在一些实施例中,所述的缓冲剂可以是1-50mM,或5-30mM,或10-25mM存在于溶液中。在一些实施例中,所述的缓冲剂可以是10mM存在于溶液中。在一些实施例中,所述的缓冲剂可以是约12.5mM存在于溶液中。在一些实施例中,所述的缓冲剂可以是约15mM存在于溶液中。在一些实施例中,所述的缓冲剂可以是约17.5mM存在于溶液中。在一些实施例中,所述的缓冲剂可以是约20mM存在于溶液中。在一些实施例中,所述的缓冲剂可以是约22.5mM存在于溶液中。在一些实施例中,所述的缓冲剂可以是约25mM存在于溶液中。
在一些实施例中,所述稳定剂的浓度可以是至少1mM,至少5mM,至少10mM,至少20mM,至少30mM,至少50mM,至少100mM,或至少200mM存在于溶液中。在一些实施例中,所述的稳定剂的浓度可以是10-500mM,或50-300mM,或100-250mM存在于溶液中。在一些实施例中,所述的稳定剂的浓度可以是约50mM存在于溶液中。在一些实施例中,所述的稳定剂的浓度可以是约100mM存在于溶液中。在一些实施例中,所述的稳定剂的浓度可以是约150mM存在于溶液中。在一些实施例中,所述的稳定剂的浓度可以是约200mM存在于溶液中。在一些实施例中,所述的稳定剂的浓度可以是约250mM存在于溶液中。在一些实施例中,所述的稳定剂的浓度可以是约300mM存在于溶液中。
在一些实施例中,所述表面活性剂的质量体积浓度(w/v)可以是至少0.001%,至少0.002%,至少0.005%或至少0.01%存在于溶液中。在一些实施例中,所述表面活性剂的质量体积浓度可以是0.001%-0.1%,或0.002%-0.05%,或0.005%-0.02%。在一些实施例中,所述表面活性剂的质量体积浓度可以是0.001%。在一些实施例中,所述表面活性剂的质量体积浓度可以是约00.002%。在一些实施例中,所述表面活性剂的质量体积浓度可以是约0.001%。在一些实施例中,所述表面活性剂的质量体积浓度可以是约0.002%。在一些实施例中,所述表面活性剂的质量体积浓度可以是约0.003%。在一些实施例中,所述表面活性剂的质量体积浓度可以是约0.005%。在一些实施例中,所述表面活性剂的质量体积浓度可以是约0.007%。在一些实施例中,所述表面活性剂的质量体积浓度可以是约0.008%。在一些实施例中,所述表面活性剂的质量体积浓度可以是约0.01%。在一些实施例中,所述药物组合物的pH为约7.0-9.0。在一些实施例中,所述药物组合物的pH为约7.2-8.8。在一些实施例中,所述药物组合物的pH为约7.4-8.6。在一些实施例中,所述药物组合物的pH为约7.5-8.5。在一些实施例中,所述药物组合物的pH为约7.7-8.3。在一些实施例中,所述药物组合物的pH为约7.7。在一些实施例中,所述药物组合物的pH为约7.8。在一些实施例中,所述药物组合物的pH为约7.9。在一些实施例中,所述药物组合物的pH为约8.0。在一些实施例中,所述药物组合物的pH为约8.1。在一些实施例中,所述药物组合物的pH为约8.2。在一些实施例中,所述药物组合物的pH为约8.3。在一些实施例中,所述药物组合物的pH为约8.4。在一些实施例中,所述药物组合物的pH为约8.5。在一些实施例中,所述药物组合物的pH为约8.6。
差示扫描荧光法(DSF)作为能够确定熔化温度(Tm)的良好生产规范(GMP)的应用,AAV5具有较窄的Tm分别位于不同缓冲区中的范围。载体稳定性仅由AAV的VP3决定,特别是碱性/酸性氨基酸的比例,并且与VP1和VP2含量或包装的基因组无关。此外,rAAV的稳定性因单个碱性或酸性氨基酸残基而异,是可以区分的。常用配方和储存缓冲液中rAAV1–rAAV9和rAAVrh.10的比较稳定性分析揭示了血清型特异性稳定性。对不同缓冲液中rAAV的比较分析表明,每种缓冲液对每种血清型都有不同的影响,即没有缓冲液导致所有测试的十种病毒的一致稳定或不稳定(参见Bennett,Antonette,et al."Thermal stability asadeterminant of AAV serotype identity."Molecular Therapy-Methods&ClinicalDevelopment 6(2017):171-182.)。
在一些实施例中,本文公开了一种重组腺相关病毒载体的药物组合物,其包括rAAV5、离子盐、缓冲剂、稳定剂和表面活性剂。所述离子盐是氯化钠、氯化钾。所述缓冲剂是三(羟甲基)氨基甲烷盐酸盐(Tris-HCl)。所述稳定剂是蔗糖。所述表面活性剂是泊洛沙姆188。所述药物组合物的pH为约7.0-9.0。
在一些实施例中,本文公开了一种重组腺相关病毒载体的药物组合物,其包括rAAV5、0.5-500mM的离子盐、1-50mM的缓冲剂、10-500mM的稳定剂和0.001%-0.1%(w/v)的表面活性剂。所述药物组合物的pH为约7.0-9.0。
在一些实施例中,本文公开了一种重组腺相关病毒载体的药物组合物,其包括rAAV5,1-500mM的氯化钠,0.1-100mM的氯化镁,1-50mM的Tris-HCl,10-500mM的蔗糖或山梨醇,0.001%-0.1%(w/v)的泊洛沙姆188。所述药物组合物的pH为约7.0-9.0。
在一些实施例中,本文公开了一种重组腺相关病毒载体的药物组合物,其包括rAAV5,10-300mM的氯化钠,0.5-5mM的氯化镁,10-25mM的Tris-HCl,50-300mM的蔗糖或山梨醇,0.001%-0.01%(w/v)的泊洛沙姆188。所述药物组合物的pH为约7.5-8.5。
在一些实施例中,本文采用的重组腺相关病毒(rAAV)携带人的凝血因子Ⅸ(hFⅨ),即rAAV-hFⅨ,优选rAAV5-hFⅨ。凝血因子Ⅸ是凝血级联的主要因子之一,由位于X染色体上的FⅨ基因编码,其功能缺失的突变导致B型血友病(HB)。血友病B是由于高活性凝血因子Ⅸ缺陷所导致的出血性疾病,重型病人的凝血因子Ⅸ活性往往低于正常的1%,经常发生自发的出血导致肌肉血肿或者关节畸形。输注凝血因子Ⅸ制剂(目前通常是体外重组表达的凝血因子Ⅸ蛋白)补充患者体内的凝血因子Ⅸ水平是目前唯一有效的治疗方法,但是需要频繁的给药。基因治疗是目前正在临床试验的治疗方法,通过病毒载体将正常的凝血因子Ⅸ基因导入患者体内长期表达,从而达到提高凝血因子Ⅸ水平,预防出血的目的。需要说明的是,本文所采用的人的凝血因子Ⅸ(hFⅨ)的序列为申请号CN201610898732.6(申请日2016年10月14日,发明名称为一种高活性凝血因子Ⅸ突变体、重组蛋白与融合蛋白的制备与应用)的专利中的高活性凝血因子Ⅸ突变体的序列(SEQ ID NO:1)或凝血因子Ⅸ表达编码优化序列(SEQ ID NO:3)。本申请实施例的hFⅨ的序列为凝血因子Ⅸ表达编码优化序列(SEQ ID NO:3),hFⅨ仅作为重组腺相关病毒载体(rAAV)导入的一种模型目的基因,重组腺相关病毒载体也可以携带其它适合的目的基因,用于治疗其他相应的疾病。
如本文中所述的药物组合物可以包含一种或多种重组载体,所述重组载体能够在递送给哺乳动物(合适的人)以后诱导针对所述载体所递送的转基因产物的免疫应答,例如体液(例如,抗体)应答和/或细胞介导的(例如,细胞毒性T细胞)应答。重组腺相关病毒可以包含(适当地在它的基因缺失中的任一个中)编码期望的免疫原的基因,且因此可以用在疫苗中。重组腺相关病毒可以用作针对任何病原体(已经为其鉴别出对于免疫应答的诱导而言关键性的且能够限制病原体的传播的抗原且可得到其cDNA)的预防性或治疗性疫苗。
在一些实施方案中,本文公开了一种重组腺相关病毒载体的药物组合物,其特征在于,包括rAAV5,1-500mM的氯化钠,0.1-100mM的氯化镁,1-50mM的Tris-HCl,10-500mM的蔗糖或山梨醇,0.001%-0.1%(w/v)的泊洛沙姆188,所述药物组合物的pH为7.0-9.0。优选的,所述氯化钠的浓度为10-300mM。优选的,所述氯化镁的浓度为0.5-5mM。优选的,所述Tris-HCl的浓度为10-25mM。优选的,所述蔗糖或山梨醇的浓度为50-300mM。优选的,所述泊洛沙姆188的浓度为0.001%-0.01%(w/v)。优选的,所述药物组合物的pH为7.6-8.6。更优选的,所述氯化钠的浓度为100-150mM;更优选的,所述氯化镁的浓度为1.0-1.5mM;更优选的,所述Tris-HCl的浓度为20-25mM;更优选的,所述泊洛沙姆188的浓度为0.003%-0.005%(w/v)。更优选的,所述药物组合物的pH为8.2-8.6。
在一些实施方案中,本文公开了一种重组腺相关病毒载体的药物组合物,其特征在于,包括rAAV5-hFⅨ,1-500mM的氯化钠,0.1-100mM的氯化镁,1-50mM的Tris-HCl,10-500mM的蔗糖或山梨醇,0.001%-0.1%(w/v)的泊洛沙姆188,所述药物组合物的pH为7.0-9.0。所述的重组腺相关病毒载体的药物组合物可以用于治疗B型血友病。优选的,所述氯化钠的浓度为10-300mM。优选的,所述氯化镁的浓度为0.5-5mM。优选的,所述Tris-HCl的浓度为10-25mM。优选的,所述蔗糖或山梨醇的浓度为50-300mM。优选的,所述泊洛沙姆188的浓度为0.001%-0.01%(w/v)。优选的,所述药物组合物的pH为7.6-8.6。
在一些实施方案中,本文公开了一种重组腺相关病毒载体的药物组合物,其包括rAAV5-hFⅨ,100-200mM的氯化钠,1.0-2.0mM的氯化镁,15-25mM的Tris-HCl,50-100mM的蔗糖或山梨醇,0.001%-0.005%(w/v)的泊洛沙姆188,所述药物组合物的pH为7.6-8.6。所述的重组腺相关病毒载体的药物组合物可以用于治疗B型血友病。优选的,所述氯化钠的浓度为100-150mM。优选的,所述氯化镁的浓度为1.0-1.5mM。优选的,所述Tris-HCl的浓度为20-25mM。优选的,所述泊洛沙姆188的浓度为0.003%-0.005%(w/v)。优选的,所述药物组合物的pH为8.2-8.6。
在一些实施方案中,本文描述的组合物用于对象(例如人)的免疫接种中。可以监测选择的基因的免疫水平以确定对强化的需要。在评估血清中的抗体滴度以后,任选的强化免疫接种可以是期望的。
任选地,可以将本发明的组合物配制成含有其它组分,包括药学上可接受的载体,例如,佐剂、防腐剂等。
在某些实施方案中,通过肌肉内注射、阴道内施用、静脉内注射、腹膜内注射、皮下注射、皮内施用、真皮内施用、鼻施用或口服施用,将如本文中所述的组合物施用给对象。
如果治疗方案包含一种或多种腺相关病毒载体和/或其它组分的共同施用,则这些可以共配制(即在相同混合物或组合物中)或各自配制在不同的组合物中。当单独配制时,它们有利地在相同部位处或附近共同位置地施用。例如,可以将所述组分施用至相同侧肢体(例如肌肉内、透皮、真皮内、皮下)(“同侧”施用)或相对侧肢体(“对侧”施用)。
病毒载体的剂量主要取决于因素诸如被治疗的病症,患者的年龄、重量和健康,且因而可以在患者之间变化。例如,病毒载体的治疗上有效的成年人或兽医学剂量通常含有1×105至1×1015个病毒颗粒,例如1×108-1×1013(例如,1×108、1×109、1×1010、1×1011、1×1012、1×1013个颗粒)。可替换地,可以通常为1×108至1×1013基因组滴度(vg/ml),(例如1×108vg/ml、1×109vg/ml、1×1010vg/ml、1×1011vg/ml、1×1012vg/ml或1×1013vg/ml)的剂量施用病毒载体。剂量可以根据动物的大小和施用途径而变化。例如,对于单个部位,用于肌肉内注射的合适的人或兽医学剂量(对于约80kg动物)是在约1×109至约5×1012个颗粒/mL的范围内。任选地,可以使用多个施用部位。在一些实施例中,对于口服制剂,合适的人或兽医学剂量可以是在约1×1011至约1×1015个颗粒/mL的范围内。
为了开发出重组腺相关病毒载体的液体制剂长期稳定储存的制剂处方,确保产品在有效期内(暂定24个月)的质量,开展了pH筛选、辅料筛选、表面活性剂筛选等处方研究实验,确定了重组腺相关病毒载体液体制剂的最终处方。根据文献资料显示病毒在反复冻融易发生聚集,粒径也变大,高温易失活等特性,处方筛选过程采用了反复冻融、25℃或40℃高温等考察条件加速病毒在各处方中的物理和生化特性变化,从而筛选出最稳定的处方。
重组腺相关病毒载体的药物组合物的稳定性的表征,可以观察或检测外观澄明度、渗透压、荧光定量PCR、体积排阻色谱-高效液相色谱(SEC-HPLC)、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)、不溶性微粒数量、体外活性hFⅨ表达量等指标。
荧光定量聚合酶链式反应分析(qPCR)是一种在DNA扩增感应中,以荧光化学物质测每次聚合酶链式反应(PCR)循环后产物总量的方法,通过内参或者外参法对供试品中的特定DNA序列进行定量分析的方法。qPCR可以定量腺相关病毒载体。不溶性微粒可以采用显微镜不溶性微粒检测仪进行测定。
体积排阻色谱-高效液相色谱(SEC-HPLC)检测重组腺相关病毒载体的药物组合物的纯度。
十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),是聚丙烯酰胺凝胶电泳中最常用的一种蛋白表达分析技术。此项技术的原理,是根据检体中蛋白质分子量大小的不同,使其在电泳胶中分离。SDS-PAGE通常用于检测蛋白的表达情况(表达量,表达分布),以及分析目的蛋白的纯度等。
体外活性hFⅨ表达量是采用双抗体夹心ELISA法测定重组腺相关病毒载体的药物组合物中hFⅨ的蛋白含量。用特异性抗体(即一抗,捕获抗体)包被于固相载体,形成固相抗体,封闭洗涤后加入待测样本,孵育洗涤后,加入生物素标记抗体(即二抗,检测抗体),再经孵育洗涤后加入链霉亲和素-过氧化物(SA-HRP),孵育洗涤后,加显色底物进行测定,通过比色得到待测样本中hFⅨ的蛋白含量。
附图说明
图1A、1B、1C和1D是实施例1-10的实验结果的图,其中N/A代表不适用,或未测。图2是实施例2的重组腺相关病毒载体的液体制剂放置在2~8℃进行长期稳定性考察的实验结果的图。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明公开的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1
一种重组腺相关病毒载体的液体制剂,其包括rAAV5-hFⅨ,100mM的氯化钠,1.5mM的氯化镁,15mM的Tris-HCl,50mM蔗糖,0.003%(w/v)的泊洛沙姆188,药物组合物的pH为7.6。
实施例2
一种重组腺相关病毒载体的液体制剂,其包括rAAV5-hFⅨ,150mM的氯化钠,1.0mM的氯化镁,20mM的Tris-HCl,50mM蔗糖,0.005%(w/v)的泊洛沙姆188,药物组合物的pH为8.2。
实施例3
一种重组腺相关病毒载体的液体制剂,其包括rAAV5-hFⅨ,200mM的氯化钠,2.0mM的氯化镁,25mM的Tris-HCl,100mM蔗糖,0.001%(w/v)的泊洛沙姆188,药物组合物的pH为8.6。
实施例4
一种重组腺相关病毒载体的液体制剂,其包括rAAV5-hFⅨ,150mM的氯化钠,1.0mM的氯化镁,20mM的Tris-HCl,50mM山梨醇,0.005%(w/v)的泊洛沙姆188,药物组合物的pH为8.2。
实施例5
一种重组腺相关病毒载体的液体制剂,其包括rAAV5-hFⅨ,200mM的氯化钠,1.0mM的氯化镁,10mM的磷酸氢二钠/磷酸二氢钠,50mM蔗糖,0.005%(w/v)的泊洛沙姆188,药物组合物的pH为6.5。
实施例6
一种重组腺相关病毒载体的液体制剂,其包括rAAV5-hFⅨ,200mM的氯化钠,1.0mM的氯化镁,10mM的磷酸氢二钠/磷酸二氢钠,50mM蔗糖,0.005%(w/v)的泊洛沙姆188,药物组合物的pH为7.5。
实施例7
一种重组腺相关病毒载体的液体制剂,其包括rAAV5-hFⅨ,150mM的氯化钠,1.0mM的氯化镁,20mM的Tris-HCl,0.005%(w/v)的泊洛沙姆188,药物组合物的pH为8.2。
实施例8
一种重组腺相关病毒载体的液体制剂,其包括rAAV5-hFⅨ,150mM的氯化钠,10mM的氯化镁,20mM的Tris-HCl,50mM蔗糖,0.005%(w/v)的泊洛沙姆188,药物组合物的pH为8.2。
实施例9
一种重组腺相关病毒载体的液体制剂,其包括rAAV5-hFⅨ,150mM的氯化钠,1mM的甲硫氨酸,20mM的Tris-HCl,50mM蔗糖,0.005%(w/v)的泊洛沙姆188,药物组合物的pH为8.2。
实施例10
一种重组腺相关病毒载体的液体制剂,其包括rAAV5-hFⅨ,150mM的氯化钠,1.0mM的氯化镁,20mM的Tris-HCl,50mM蔗糖,0.005%(w/v)的聚山梨酯80,药物组合物的pH为8.2。
实施例1-10的稳定性考察实验结果如图1A、1B、1C和1D所示,其中实施例1-4的重组腺相关病毒载体的液体制剂的稳定性较好,不溶性微粒数量较少,且体外活性hFⅨ表达量最高。与实施例2的液体制剂相比,实施例5的液体制剂的pH为6.5,其SEC-HPLC数据显示其纯度降低,且体外活性hFⅨ表达量也降低。与实施例1的液体制剂相比,实施例5的液体制剂的pH值接近,只是缓冲剂不同,为磷酸氢二钠/磷酸二氢钠,其SEC-HPLC数据显示其纯度降低,且体外活性hFⅨ表达量也降低。与实施例2的液体制剂相比,实施例7的液体制剂不含稳定剂蔗糖,其SEC-HPLC数据显示其纯度略降低,体外活性hFⅨ表达量也降低。与实施例2的液体制剂相比,实施例8的液体制剂将氯化镁的浓度增加至10mM,其SEC-HPLC数据显示其纯度略降低,体外活性hFⅨ表达量也降低。与实施例2的液体制剂相比,实施例9的液体制剂将氯化镁替换为甲硫氨酸,其SEC-HPLC数据显示其纯度略降低,体外活性hFⅨ表达量也降低。与实施例2的液体制剂相比,实施例10的液体制剂将氯化镁替换为甲硫氨酸,其SEC-HPLC数据显示其纯度略降低,体外活性hFⅨ表达量也降低。
实施例11
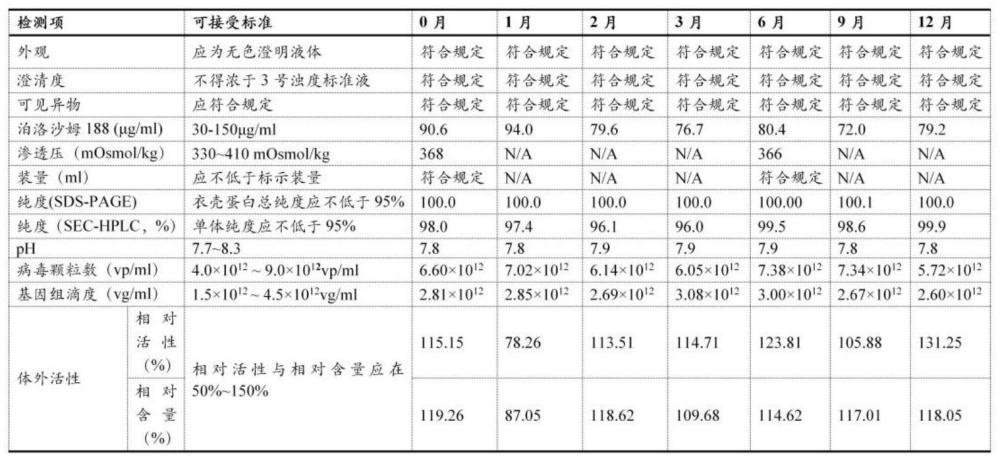
长期稳定性实验,实施例2的重组腺相关病毒载体的液体制剂放置在2~8℃条件下,分别在0、1、2、3、6、9和12个月测定产品的体外活性、基因组滴度等关键指标,其并无明显下降趋势,表明在实施例2的重组腺相关病毒载体的液体制剂能在2~8℃条件下长期保持稳定,比现在的需要在冻存的储存条件更具有优势,方便产品的运输及临床使用,降低各相关方的投资和使用成本。
除非另外定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。尽管与本文所述的那些相似或等同的任何方法和材料可用于本发明测试的实践中,但本文描述了优选的材料和方法。在描述和要求保护本发明时,将使用以下术语。
还应理解,本文使用的术语仅用于描述具体实施方式的目的,并不旨在是限制性的。
如本文所使用,当提及可测量值比如量、时间持续长度等时,术语“约”是指包括从规定值±20%或±10%,更优选地±5%,甚至更优选±1%,和仍更优选地±0.1%的变化,由此这些变化适合于进行所公开的方法。
如本文所使用,术语“药物组合物”是指本发明中有用的至少一种活性成分与其他化学组分的混合物,所述化学组分比如运载体、稳定剂、稀释剂、佐剂、分散剂、悬浮剂、增稠剂和/或赋形剂。药物组合物有助于将活性成分施用到生物体。本领域存在多种施用化合物的技术,其包括但不限于:静脉内、口服、气溶胶、肠胃外、眼内、肺部和外用施用。
如本文所使用,术语“药学上可接受的载体”包括药学上可接受的盐、药学上可接受的材料、组合物或运载体,比如液体或固体填充剂、稀释剂、赋形剂、溶剂或包封材料,其参与在受试者内或向受试者运送或运输本发明的化合物(一种或多种),使得它可以执行其期望的功能。通常地,这类化合物从一个器官或身体的一部分运送或运输到另一个器官或身体的一部分。在与制剂的其他成分相容的意义上,每种盐或运载体必须是“可接受的”,并且对受试者是无害的。可用作药学上可接受的运载体的材料的一些实例包括:糖,比如乳糖、葡萄糖和蔗糖;淀粉,比如玉米淀粉和马铃薯淀粉;纤维素及其衍生物,如羧甲基纤维素钠、乙基纤维素和醋酸纤维素;西黄蓍胶粉;麦芽;明胶;滑石;赋形剂,比如,可可脂和栓剂蜡;油,比如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油和豆油;二醇,比如丙二醇;多元醇,比如甘油、山梨糖醇、甘露醇和聚乙二醇;酯,比如油酸乙酯和月桂酸乙酯;琼脂;缓冲剂,比如氢氧化镁和氢氧化铝;藻酸;无热原水;等渗盐水;林格溶液;乙醇;磷酸盐缓冲溶液;稀释剂;成粒剂;润滑剂;粘合剂;崩解剂;润湿剂;乳化剂;着色剂;脱模剂;涂层剂;甜味剂;调味剂;加香剂;防腐剂;抗氧化剂;增塑剂;胶凝剂;增稠剂;硬化剂;沉降剂;悬浮剂;表面活性剂;保湿剂;运载体;稳定剂;和药物制剂中使用的其他无毒相容物质,或其任何组合。如本文所使用,“药学上可接受的运载体”还包括与化合物的活性相容的并且对于受试者是生理学上可接受的任何和所有包衣、抗细菌剂和抗真菌剂,以及吸收延迟剂等。补充活性化合物也可以并入组合物中。尽管参考其特定实施例详细描述了本发明,但应当理解,功能等效的变化均在本发明的范围内。实际上,除了本文显示和描述的那些之外,本发明的各种修改将根据前述说明和附图而对本领域的技术人员变得显而易见。本领域的技术人员将认识到或者使用仅常规实验能够确定,本文所描述的本发明的具体实施例的许多等效形式。
本说明书中提及的所有出版物、专利和专利申请在此通过引用并入到本说明书中,其程度与每个单独的出版物、专利或专利申请被具体和单独地通过引用以其整体并入本文的程度相同。
- 一种治疗甲状腺结节的药物组合物及其制备方法和用途
- 分离的重组溶瘤痘病毒、药物组合物及其在治疗肿瘤和/或癌症的药物中的用途
- 一种用于治疗抑郁症的中药组合物及其药物组合和用途
- 一种药物组合物及其提取方法、药物制剂、用途
- 一种重组腺相关病毒载体的药物组合物及其用途
- 一种重组腺相关病毒载体的药物组合物及其用途
