用于动脉粥样硬化斑块早期预警和动态监测的多模态分子成像纳米探针及其应用
文献发布时间:2024-01-17 01:16:56
技术领域
本发明属于荧光检测技术领域,具体涉及一种用于动脉粥样硬化斑块早期预警和动态监测的多模态分子成像纳米探针及其应用。
背景技术
《中国心血管健康与疾病报告2021》显示,我国心血管病的发病率与致死率目前仍高居榜首。心血管病现患人数约3.3亿,其中脑卒中(又称中风)1300万、冠心病1139万。2019年农村、城市心血管病死因分别占总死亡率的46.74%和44.26%,即平均每5例死亡中就有2例死于心血管病。因此,心血管病防控形势仍然十分严竣。
动脉粥样硬化斑块是缺血性心脏病和中风等心脑血管事件的主要病理改变。动脉粥样硬化(Atherosclerosis,AS)是一种多因素作用下的慢性炎症病变,斑块中的细胞成份及其整体结构是精准斑块分期、预警心血管事件风险以及干预疗效评估的重要基础,也是动脉粥样硬化斑块进展研究的重要信息。但目前用于斑块在微观细胞水平的评价设备局限于单一样本、横断面、单成分成像,不能满足动脉粥样硬化斑块基础研究的需求。而分子影像则能通过特探针,在活体状态下显示特定分子和细胞,并对其生物学行为进行定性和定量研究,实现动物活体连续、动态的监测,既可作为一种实用、方便的基础医学研究手段,又可为临床疾病的发生、发展、转归及早期诊断提供有效证据,起到连接分子生物学和临床医学桥梁的作用。
目前,临床识别斑块的影像学手段有CTA、超声、MRI、血管镜、OCT、IVIS、PET、SPECT等。这些传统影像学手段各有优劣,如CTA虽然无创,但存在辐射暴露,且组织学上的复杂性会使其检测准确性降低;MRI无创、无辐射,但空间分辨率有限,敏感度低,易受呼吸和心跳、不完全血流移植、不完全脂肪饱和等多种因素的影响,且需要截断面的对比才能测量狭窄;血管镜、OCT、IVIS可观察到斑块的成分和性质,但均为有创,价格昂贵,难以实现持续动态地监测斑块的发生发展;PET未给出解剖结构信息,且分辨率较低。而融合了两种或多种成像方式的多模态成像,可实现优势互补,比如SPECT/PET成像所采用的放射性示踪剂有非常高的敏感性,与其联合应用则能弥补成像敏感度不足的缺陷。当前针对两种或者多种成像模式结合的多模态成像可极大地提高对AS易损斑块的早期诊断。
公开号为CN110302400B的发明专利公开了在IONP粒子表面偶联MMP可剪切多肽(Ac-GPLGVRGKC-NH2,MMPsC)及64Cu构建的64Cu-NOTA-Fe
因此,需要提供一种能够实现动脉粥样硬化斑块早期预警以及动态监测的FLI/MPI/CTA多模态分子成像纳米探针。
发明内容
本发明的目的之一在于提供一种用于动脉粥样硬化斑块早期预警和动态监测的多模态分子成像纳米探针,以解决现有技术未能实现动脉粥样硬化斑块更早期预警和持续动态监测的问题。
本发明一种用于动脉粥样硬化斑块早期预警和动态监测的多模态分子成像纳米探针的技术方案如下:
一种用于动脉粥样硬化斑块早期预警和动态监测的多模态分子成像纳米探针,所述纳米探针为Fe
优选地,所述纳米探针Fe
本发明的目的之二在于提供一种用于动脉粥样硬化斑块早期预警和动态监测的多模态分子成像纳米探针的制备方法。
一种用于动脉粥样硬化斑块早期预警和动态监测的多模态分子成像纳米探针的制备方法,包括以下步骤:
(1)预处理,将Fe
(2)制备磁性纳米颗粒Fe
(3)制备纳米探针Fe
优选地,步骤(1)中,所述Fe
优选地,步骤(2)中,所述A12的制备方法,包括以下步骤:①将A12基因插入到表达载体pET30a中,再转到BL21表达菌株中;②将含有A12质粒的表达菌株涂布到LB平板上,倒置于培养箱中;③从上述平板中挑选单克隆,接种到LB培养基中培养,加入IPTG后,进行诱导表达;④取诱导后的培养液离心,去除上清液,加入PBS液重悬沉淀,再加入SDS-PAGE上样缓冲液加热样品,然后离心取上清电泳,即得。
进一步优选地,步骤(2)中,所述Fe
优选地,步骤(3)中,所述Fe
进一步优选地,步骤(3)中,所述纳米探针Fe
本发明的目的之三在于提供一种用于动脉粥样硬化斑块早期预警和动态监测的多模态分子成像纳米探针的应用。
一种用于动脉粥样硬化斑块早期预警和动态监测的多模态分子成像纳米探针在制备动脉粥样硬化斑块早期预警试剂或诊断试剂中的应用。
一种用于动脉粥样硬化斑块早期预警和动态监测的多模态分子成像纳米探针在制备动脉粥样硬化斑块疗效监控试剂中的应用。
有益效果:
(1)靶点的优化:PlexinD1能与其经典配体sema3e结合,在神经系统方面,能够参与轴突引导;在心血管系统方面,能够参与心血管的发育,还可通过抑制内皮细胞的增殖和迁移抑制血管出芽和血管新生;在免疫系统方面,则与白细胞(NK、DC、中性粒细胞、巨噬细胞)迁移、粘附相关,作为一种巨噬细胞保留因子,促进炎症的进展。已有研究表明,在斑块进展中促炎因子oxLDL/缺氧的作用下,sema3e由M1型巨噬细胞分泌并作用于自身的PlexinD1受体,通过改变细胞骨架,减少CCL2、CCL19作用下的斑块内迁出,从而促进炎症和斑块进展。
除了与配体sema3e结合以外,最新研究表明,PlexinD1还可以作为内皮细胞上的机械力感受器,能够感受力学的作用,通过形态的弯曲的改变,与NRP1/VEGFR2结合形成复合体,促进VEGFR2与丝氨酸酪氨酸激酶的结合,使VEGFR2磷酸化,进而引起内皮细胞一系列下游信号的改变,从而影响斑块在不同剪切力部位分布的特异性。
前期研究结果表明,PlexinD1还与巨噬细胞的极化密切相关,具体证据如下:在动物水平上,PlexinD1、sema3e和M1型巨噬细胞在颈动脉分叉处动脉粥样硬化斑块中高度共定位。在细胞水平上,巨噬细胞由LPS或oxLDL诱导极化为M1型巨噬细胞后,PlexinD1会明显上调。而干预plexind1后,巨噬细胞向M1型极化则会减少。本发明的探针为Fe
(2)成像平台的优化:体内荧光成像(In vivo fluorescence imaging,FLI)则具有灵敏度高、无电离、操作相对简单等优势。磁粒子成像(Magnetic particle imaging,MPI)作为一种新兴的断层扫描方法,以超顺磁性氧化铁纳米粒子(SPION)为成像剂,具有高灵敏度(毫摩尔级)、高空间分辨率(亚毫米级)、零组织深度信号衰减和无电离辐射的优势,且目前氧化铁纳米颗粒已被批准用于临床应用。计算机断层扫描血管造影(Computedtomographic angiography,CTA)能够提供血管的解剖信息并直接评估管腔狭窄的严重程度。本发明将因此FLI/MPI/CTA融合形成多模态成像,该多模态成像由于具有高灵敏度和高空间分辨率是的其能够准确识别斑块,可以作为一种富有前景的成像手段。同时,IVIS、MPI图像可实现与CT的3D融合成像,更为直观。本发明的多模态成像不仅具有高敏感度及高空间分辨率的优点,而且能够实现分叉部位动脉粥样硬化斑块的早期预警以及动态监测,还能够直观的反映3D立体成像,为基础研究提供理论支持和技术支持。
(3)功能验证的优化:动脉粥样硬化小鼠模型仅采用对ApoE
附图说明
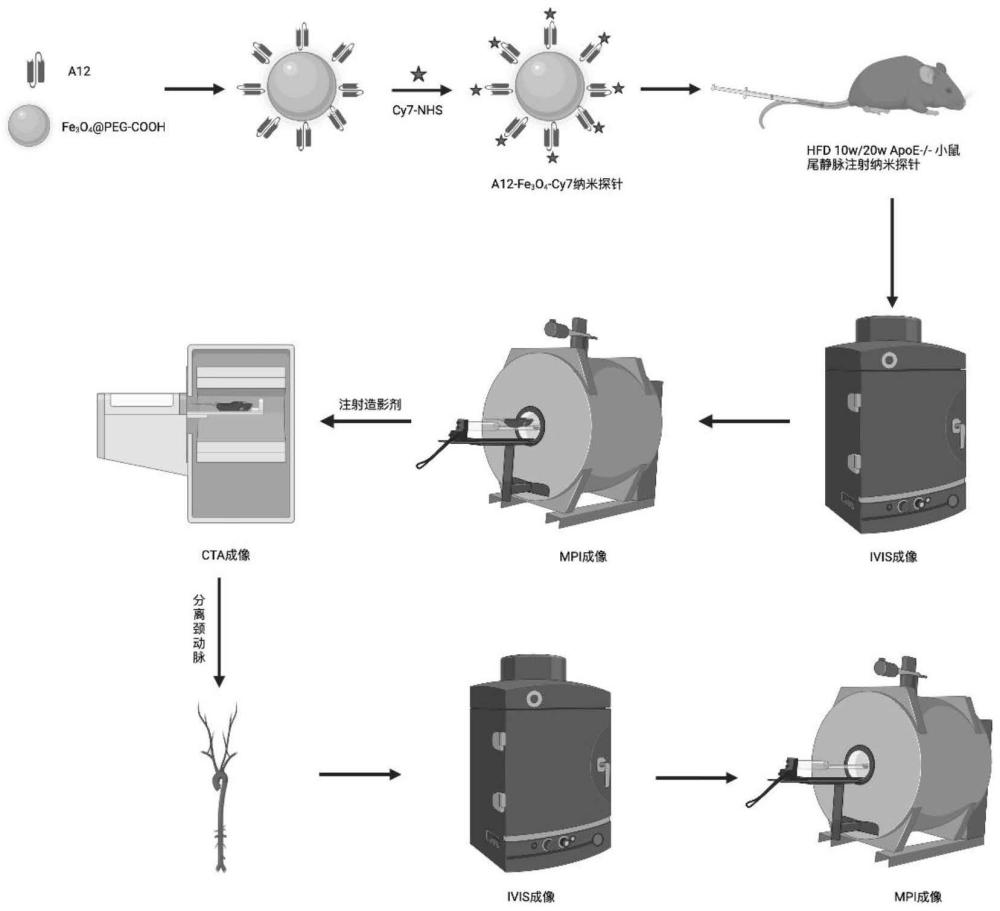
图1为本发明实施例1的流程图;
图2为本发明实施例1中A12蛋白表达与纯化结果,其中,A为SDS-PAGE分析A12蛋白于BL21(DE3)表达情况,Lane M:SDS-PAGE Protein Marker,Lane 0:对照(不加IPTG),Lane1:15℃诱导16h,Lane 2:全菌破菌后上清,Lane 3:全菌破菌后沉淀;B为SDS-PAGE分析A12蛋白上清纯化结果,Lane M:SDS-PAGE Protein Marker,Lane 1:全菌破菌离心后上清,Lane 2:上清同Ni-IDA孵育后流出液,Lane 3-4:100mM Imidazole的洗脱组分,Lane5:300mM Imidazole的洗脱组分;
图3为本发明实施例1中A12蛋白鉴定结果,其中,A为SDS-PAGE鉴定结果;B为Western Blot鉴定结果,Lane 1:BSA(.00μg),Lane 2:A12 protein(1.20μg),M1:SDS-PAGEMarker,M2:Western Blot Marker;
图4为本发明实施例1中纳米探针Fe
图5为本发明实施例1中Fe
图6为本发明实施例1中Fe
图7为本发明实施例1中纳米探针Fe
图8为本发明实施例1中纳米探针Fe
图9为本发明实施例1中纳米探针Fe
图10为本发明实施例1中体外细胞实验证明纳米探针Fe
图11为本发明实施例1中纳米探针Fe
图12为本发明实施例1中纳米探针Fe
图13为本发明实施例1中纳米探针Fe
图14为本发明实施例1中C57对照组小鼠及高脂喂养10w、20w的动脉粥样硬化模型小鼠的颈动脉分叉部位组织病理切片HE染色(A)及plexind1免疫组化染色结果图像(B);
图15为本发明实施例1中高脂喂养20w的动脉粥样硬化模型小鼠分别注射非靶对照探针Fe
图16为本发明实施例2中纳米探针Fe
图17为本发明实施例3中纳米探针Fe
图18为本发明实施例4中纳米探针Fe
图19为本发明实施例5中纳米探针Fe
具体实施方式
下面结合具体实施方式对本发明的技术方案进一步说明。
实施例1
一种用于动脉粥样硬化斑块早期预警和动态监测的多模态分子成像纳米探针的制备方法,包括以下步骤:
(1)制备A12蛋白
A12蛋白序列:MHHHHHHQVQ LQESGGGLVQ PGGSLRLSCAASGSSISINN WGWYRQAPGKQRERVAAISG GGKTVYADSV KGRFTISRDN AKNTVYLQMNSLKPEDTAVY YCRAVRSTG WLRGLDVWGQGTQVTVSAEP KTPKPQPAAAHHHHHHHHYT DIEMNRLGKG A
依照上述目的基因序列,密码子优化软件MaxCodonTM Optimization Program(V13)对提供的A12蛋白氨基酸序列进行优化,设计合成相互重叠的单链寡核苷酸,再通过重叠延伸PCR法拼接出全长。通过限制性酶切位点NdeI和HindIII将A12基因插入到表达载体pET30a中,并通过酶切法和测序确认最终表达载体的准确性,后转到BL21(DE3)表达菌株中。
将构建好的含有A12质粒的表达菌株均匀涂布到LB平板上(含50μg/mL的硫酸卡那霉素),再倒置于37℃培养箱过夜。从转化的平板中挑选单克隆,接种到4mL的LB培养基中(含50μg/mL的硫酸卡那霉素),待培养至OD600为0.5-0.8时,向培养液中加入浓度为0.2mM的IPTG,之后置于15℃下诱导表达。扩大培养,生长至OD600=0.8时,加入浓度为0.2mM的IPTG,15℃下诱导16h后收集菌体。取诱导后的培养液在12000rpm的转速下离心5min,去除上清液,加入PBS液重悬沉淀,最后加入SDS-PAGE上样缓冲液于100℃下加热样品10min,然后离心取上清电泳。
(2)探针制备
①取两组20nm Fe
②向上述Fe
③向上述两组磁性纳米颗粒20nm Fe
(3)动脉粥样硬化模型构建
ApoE
将小鼠分为三组,分别为:
对照组:C57小鼠+Fe
实验组1:ApoE
实验组2:ApoE
(4)在体、离体成像
①注射探针前图像采集
各组小鼠禁食24h,褪去颈前区毛发。设备初始化后,将小鼠放入麻药盒,异氟烷吸入麻醉1min,后放入IVIS暗箱中,头部连接麻醉管持续吸入麻醉。电脑端操作,选定Cy7荧光基团,采集IVIS 2D图像。
将1μL Fe浓度为100μg/mL的Fe
②注射探针后图像采集
小鼠尾静脉注射相应探针后24h,待设备初始化后,将小鼠放入麻药盒,异氟烷吸入麻醉1min,后放入IVIS暗箱中,头部连接麻醉管持续吸入麻醉。电脑端操作,选定Cy7荧光基团,依次采集IVIS 2D、IVIS3D-CT融合图像。
将1μL Fe浓度为100μg/mL的Fe
尾静脉注射造影剂后30min,将小鼠放置于CT设备动物床上,进行CTA图像采集。保持小鼠与动物床的相对位置不变,将动物床移至MPI设备研制,扫描范围设定为(-2±2cm),选择3D,isotropic模式,扫描次数为1,采集MPI3D图像,后期与CTA图像进行融合。
体视显微镜下分离小鼠颈动脉及主动脉,进行IVIS、MPI成像,操作同前。
分别用Living Image Software及VivoQuant software进行IVIS和MPI图像的分析和处理,其中,流程图如图1所示。
实施例2
一种用于动脉粥样硬化斑块早期预警和动态监测的多模态分子成像纳米探针的制备方法,与实施例1不同的是,步骤(1)中,Fe
实施例3
一种用于动脉粥样硬化斑块早期预警和动态监测的多模态分子成像纳米探针的制备方法,与实施例1不同的是,步骤(1)中,Fe
实施例4
一种用于动脉粥样硬化斑块早期预警和动态监测的多模态分子成像纳米探针的制备方法,与实施例1不同的是,步骤(1)中,Fe
实施例5
一种用于动脉粥样硬化斑块早期预警和动态监测的多模态分子成像纳米探针的制备方法,与实施例1不同的是,步骤(1)中,Fe
结果与分析
对实施例1中的结果进行表征与分析,结果如下:
(1)A12蛋白的表征结果与分析
将全菌采用20mM Tris(pH8.0),300mM NaCl,20mM Imidazole含1% Triton X-100,1mM DTT,1mM PMSF超声裂解,取上清与沉淀进行SDS-PAGE分析检测,分析检测结果如图2A所示。经全菌超声裂解分析,A12蛋白在上清和包涵体中均有表达。
将全菌采用20mM Tris(pH8.0),300mM NaCl,20mM Imidazole含1% Triton X-100,1mM DTT,1mM PMSF超声裂解,同时以20mM Tris(pH8.0),300mM NaCl,20mM Imidazole缓冲液平衡Ni-IDA亲和层析柱,之后用不同浓度咪唑的平衡缓冲液洗脱目标蛋白,并收集每个洗脱组分进行SDS-PAGE分析检测。分析检测结果如图2B所示。
经Ni-IDA亲和层析纯化分析,收集纯度相对较高的Lane 3-5,将其透析到超纯水中,透析结束后用0.22μm滤器过滤,SDS-PAGE、WB质检结果如图3所示A12分子量约20kDa,纯度>90%。
(2)探针表征结果与分析
采用透射电子显微镜(JEM-1200EX,JEOL,Tokyo,Japan)对Fe
采用Zetasizer Nano ZS90(Malvern Instruments,Malverm,UK)测量纳米颗粒解水合粒径和电位,结果如图5所示。由图5可知,Fe
使用UV-Vis-NIR分光光度计(UV-3600Plus,Shimadzu,Kumamoto,Japan)测量A12偶联前后的光学吸收光谱,结果如图6所示,计算偶联率为58.4%。
使用荧光分光光度计(F-7000,Hitachi,Tokyo,Japan)测试Fe
IVIS荧光成像设备(Caliper Life Sciences,PerkinElmer,Waltham,MA,USA)和MPI成像仪分析Fe
CCK8测量细胞毒性,将探针按照0、75、100、150、200、250、500μg/mL的浓度梯度与THP-1细胞共培养24h,加入CCK8后测量吸光度,计算细胞存活率。由图9可知,随着材料浓度的增加,细胞活率呈下降趋势,200μg/mL材料处理细胞时,细胞活率仍大于80%。
细胞验证探针靶向性,将THP-1诱导分化爬片后分为6组:a.巨噬细胞+基础培养基;b.巨噬细胞+非靶探针Fe
如图11A所示,连续观察注射纳米探针后的动脉粥样硬化模型小鼠颈动脉区域120h,相比非靶对照探针Fe
如图12、13所示,相比对照组,高脂喂养10w、20w的动脉粥样硬化模型小鼠在体颈动脉斑块MPI、IVIS信号比注射探针前均有明显升高,其中高脂喂养20w的动脉粥样硬化模型小鼠MPI、IVIS信号高于高脂喂养10w的模型小鼠。说明该纳米探针通过FLI/MPI/CTA多模态成像可以实现对颈动脉斑块的动态监测和早期预警。
图14是实施例1中C57对照组小鼠及高脂喂养10w、20w的动脉粥样硬化模型小鼠的颈动脉分叉部位组织病理切片HE染色及plexind1免疫组化染色结果图像,由图可知随着高脂喂养时间延长,斑块进展,plexind1阳性区域增多,这与MPI、IVIS信号趋势一致;图15是实施例1中高脂喂养20w的动脉粥样硬化模型小鼠分别注射非靶对照探针Fe
采用透射电子显微镜(JEM-1200EX,JEOL,Tokyo,Japan)测量实施例2-5中Fe
本发明的探针为Fe
以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
- 用于动脉粥样硬化易损斑块早期诊断的PET/MRI多模式分子成像纳米探针及其应用
- 用于动脉粥样硬化易损斑块早期诊断的PET/MRI多模式分子成像纳米探针及其应用
