一种可解释重症儿童死亡风险评估模型、装置及建立方法
文献发布时间:2024-01-17 01:23:17
技术领域
本发明涉及医疗技术领域,更具体地,涉及一种可解释重症儿童死亡风险评估模型、装置及其建立方法。
背景技术
儿童病死率是衡量一个国家或地区经济、文化、卫生等多项社会发展水平和文明进步的综合性、可行性指标。重症儿童因其高病死率威胁着人类的健康。因此寻求能够及时准确预测重症儿童死亡的指标对于积极采取有效措施防止儿童死亡及降低儿童病死率具有极其深远的意义。目前国内外临床上对重症儿童风险评估依然依赖于疾病严重程度评分如儿童死亡风险评分、儿童序贯器官衰竭评分或单一的临床指标例如血糖、血乳酸、血肌酐、容量超负荷或单一生物标志物例如尿胱抑素C、血可溶性尿激酶纤溶酶原激活剂受体等。然而,这些现有的儿童危重评估和预后判断指标/评分或受年龄、体重、性别等其他因素的影响,或不具有足够的敏感性与特异性,临床预测性能在多中心、大样本的临床研究中不能充分肯定。近年来基于电子病例档案的疾病预测模型研究极大的促进了开发更为精准的疾病风险评估模型/评分,但较多研究受限于有限的样本集(如单中心、小样本)使得模型的普适性、鲁棒性无法得到保证;或者研究主要针对于成人,儿童与成人存在一定的病理和生理差异,因而采用相同的评估标准可能会造成评估的偏差,针对于成人建立的风险评估模型,难以应用于儿童。
发明内容
鉴于上述问题,本发明针对入儿童重症监护病房(PICU)的重症患儿,基于多中心数据集开发可及时评估PICU住院期间死亡风险的预测模型,并同步呈现模型的推理分析原因便于医生的理解,以帮助儿科医生更加全面和及时的意识到患儿的潜在疾病紧急和危险程度,从而为下一步的决策治疗提供科学依据。
本发明采用如下技术方案:
一种可解释重症儿童死亡风险评估模型,包括:
(1)数据集构建模块:获取入住PICU的患儿的数据,确定特征变量;
(2)数据处理模块:将数据集中的数据进行清理合并、采样插值,获得多个统计特征;
(3)模型构建与评估模块:使用融合了SHAP方法的极端梯度提升XGBoost模型,将处理后的数据集进行模型的训练、参数调优,构建可解释重症儿童死亡风险评估模型;按照对预测结果的重要性,将多个统计特征由高到低排列。
一种建立可解释重症儿童死亡风险评估模型的方法,包括数据集构建、数据处理、模型构建与评估;在数据集构建中,获取入住PICU的患儿的数据集,确定特征变量,所述特征变量包括一般资料人口统计学、生命体征、重症儿童疾病严重程度评分、实验室检查和治疗;在数据处理中,将来自数据集的数据进行清洗整合、采样插值,获得多个统计特征;在模型构建与评估中,数据集进行基于融合了SHAP方法的极端梯度提升XGBoost模型的训练、参数调优,将多个统计特征中按照其对预测结果的重要性由高到低排列。
本发明中,所述特征变量包括一般资料人口统计学、生命体征、重症儿童疾病严重程度评分、实验室检查和治疗。
本发明中,数据处理模块为:对数据集的数据进行清理和合并,包括检查数据一致性、处理无效值和缺失值,通过中位数插补法插补缺失数据,若缺失比例大于等于20%则予以剔除;通过多重共线性检验排除具有显著共线性且对因变量贡献不大的自变量;基于规整后的数据,进行模型输入特征的构建,即构建统计特征,包括原值、均值、中位数、四分位数、最大值、最小值、总和,获得4~42个统计特征。优选的,所述输入特征为其多个特征中按照其重要性由高到低的前4、6、12、20或42个特征。
本发明中,统计特征包括年龄、体质量、身长、体质指数BMI、性别、心率、收缩压、舒张压、平均动脉压、体温、第三代儿童死亡风险评分、儿童序贯器官衰竭评分、格拉斯哥昏迷评分、吸入氧浓度FiO
本发明公开了一种计算机可读载体,包括计算程序,所述计算程序用于执行上述可解释重症儿童死亡风险评估模型。本发明公开了一种可解释重症儿童死亡风险评估装置,包括计算单元,所述计算单元用于执行上述可解释重症儿童死亡风险评估模型。具体载体以及计算机为常规技术。本发明中,数据处理模块自所述患儿入儿童重症监护病房(PICU)第一天的人口统计学信息、生命体征、重症儿童疾病严重程度评分和实验室检测指标及住PICU期间治疗的数据中经过处理获取输入特征,以输入所述评估模块。所述模型采用其所融合的SHAP方法获得单独重症患儿的风险因素贡献程度评估;其中,采用红色代表该因素当前处于异常状态,对患儿的结局产生危害影响;采用蓝色代表该因素当前处于正常状态,对患儿的结局不产生危害影响,且SHAP值越大对结局的影响程度越大。
本发明中,所述研究人群基于PICU收入标准和制定的纳入流程进行患儿的筛选,获得重症儿童数据集;在模型构建与评估中,模型针对重症患儿进行训练和调优,在训练模型时,将数据进行融合作为一个大样本、多中心的训练集,其中70~90%的患儿数据用于模型的训练和采用交叉验证调优预测模型的超参数,剩余的患儿数据用于模型性能的内部验证。
在模型性能验证时,所述8个评估指标为:受试者工作特征曲线下面积AUC、敏感性Sensitivity、特异性Specificity、准确性Accuracy、精确性Precision、F1值、精确-召回曲线下面积AUPRC、校准度曲线;所述1个功能指标为可解释性功能指标。内部验证采用多中心数据集30-10%的患儿数据进行评估;外部验证采用与训练数据集、内部验证数据集不一致的重症患儿数据进行评估;亚组分析对多中心数据集的群体分为年龄小于等于2岁和年龄大于2岁的重症患儿分别进行验证;以综合评估是否有偏倚及模型的普适性和鲁棒性。
本发明公开的可解释重症儿童死亡风险评估装置,能够执行上述可解释重症儿童死亡风险评估模型;所述模型采用其所融合的SHAP方法获得单独重症患儿的风险因素贡献程度评估;其中,采用红色代表该因素当前处于异常状态对患儿的结局产生危害影响,采用蓝色代表该因素当前处于正常状态对患儿的结局不产生危害影响,且SHAP值越大对结局的影响程度越大。该计算单元可以是中央处理器、单片机等。
本发明的优点在于:
(1)针对PICU中的重症患儿,可及时准确预测住PICU期间不良结局(死亡)发生概率和风险因素的贡献程度,进而辅助儿科医生对患儿进行及时干预和精准诊疗;
(2)经过多中心大样本数据集的训练,采用8个评估指标和1个功能指标,及内部验证、外部验证、校准曲线的对比以及关于年龄分层的亚组分析方式对模型的性能进行评估,模型性能良好、普适和稳健,且一致优于临床现有评分;
(3)可提供针对重症患儿与不良结局发生关联的重要因素和排名,帮助儿科医生理解疾病的发展过程;
(4)可根据实际应用场景选择输入数据的特征变量个数为4~42,均可获得满足临床需求的预测评估性能;
(5)风险预测装置可自动输出及时对重症患儿发生住PICU期间不良结局(死亡)的风险评估结果和可视化风险推理过程,可纳入医院电子病历信息系统,便于医生的操作和使用。
本发明的可解释重症儿童死亡风险评估模型、装置,经大样本、多中心训练,性能一致优于其他对比的模型和评分,在多种方式验证评估中表现出良好的普适性和鲁棒性,且在提供患儿出现不良结局的风险概率同时可获得分析原因,因而该装置有助于儿科医生获得对重症患儿的疾病紧急和危险程度更为及时准确的评估,有助于及时精准决策治疗患者,且适用于更多不同地区、不同中心的儿童医疗机构使用。
附图说明
图1为可解释重症儿童死亡风险评估模型的建立方法的执行流程图。
图2为研究人群的纳入排除标准、筛选流程图。
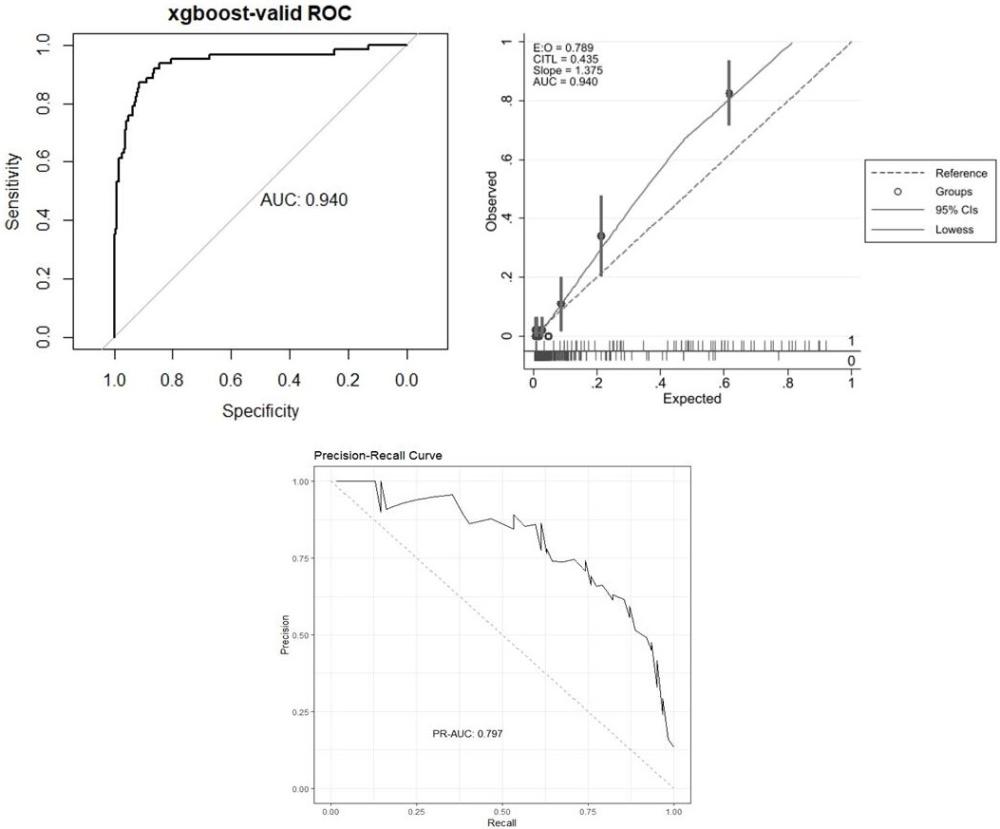
图3为死亡风险预测模型的内部验证的受试者工作特征曲线ROC、校准度曲线和精准‐召回曲线(Precision-Recall Curve)。
图4为风险预测模型与同步纳入的其他机器学习模型对比(内部验证ROC和Precision-Recall Curve曲线)。
图5为同步纳入的其他机器学习模型及临床疾病评分对比(内部验证ROC和Precision-Recall Curve曲线)。
图6为死亡风险预测模型的外部部验证的受试者工作特征曲线ROC、校准度曲线和精准‐召回曲线(Precision-Recall Curve)。
图7为风险预测模型与同步纳入的其他机器学习模型及临床疾病评分对比(外部验证:AUC比较)。
图8为预测模型在内部验证中的年龄亚组分析(受试者工作特征曲线和校准度曲线)。
图9为基于SHAP方法的预测模型的评估疾病风险的Top 20重要特征排名及解释特征对模型预测的影响的SHAP值。
图10为预测模型的推理可解释分析呈现(非存活患儿)。
图11为预测模型的推理可解释分析呈现(存活患儿)。
图12为基于可解释机器学习的重症患儿PICU风险评估模型应用示意图,图中数据为结果示意,不影响本领域技术人员对本发明技术效果的理解。
具体实施方式
本发明通过多中心前瞻性的队列研究,基于重症儿童电子病历档案,采用融合可解释方法的机器学习模型,针对重症儿童开发经过多中心训练、验证的具备普适性、鲁棒性和可解释性的重症儿童死亡风险预测模型,并获得与住PICU期间不良结局相关的危险因素和模型的推理过程,最终可见该模型集成入可自动、及时评估重症儿童死亡风险的装置,比如计算机。本发明的步骤如下:(1)构建可支持开发优良评估性能的模型的大样本多中心数据集,根据临床诊断标准和临床以及文献知识分别构建针对重症儿童的研究数据集;(2)进行数据的清洗和整理,包含数据合并、数据采样、异常值去除、插值、构建统计特征,根据数据的采集和变化特性分别构建了一般资料、生命体征、重症儿童疾病严重程度评分、实验室检查和治疗5类数据;(3)基于3种机器学习模型(集成学习模型方法之随机森林RF和极端梯度提升XGBoost及支持向量机SVM)分别训练模型,本发明为性能最优模型,然后通过8个评估指标(受试者工作特征曲线下面积AUC、敏感性、特异性、准确性、精准性、F1值、精准-召回曲线下面积AUPRC、校准度曲线)和1个功能指标(可解释性)对模型的性能进行评估。与儿科临床常用的评分(第三代儿童死亡风险评分PRISM Ⅲ和儿童序贯器官衰竭评分pSOFA)进行对比;(4)采用内部验证、外部验证、亚组分析(年龄小于等于2岁和年龄大于2岁的重症患儿)和纳入部分特征(42~4个)的方式对预测模型的普适性、鲁棒性进行评估;(5)基于可解释方法SHAP获得与重症患儿出现住PICU期间不良结局相关联的风险评估因素。并将上述过程进行封装,获得便于医生理解、操作的可全自动及时评估儿童重症监病房PICU中患儿出现不良结局的风险,帮助医生更加全面和及时的意识到患儿的潜在机体状态,从而为进一步的精准决策治疗提供科学依据。
本发明及时评估重症患儿的死亡风险的模型方法,具体包括以下几个步骤:
(1)数据集构建模块
获取来自中国四个代表性儿童医疗中心PICU重症儿童的临床医疗数据。根据下述纳入和排除标准获得重症患儿。入选标准:①年龄1个月~18岁;②体重大于4kg;③符合入住PICU标准。排除标准:①入PICU不满24小时,包括入PICU 24小时内死亡、转院及放弃治疗自动出院的患儿;②患有严重先天性发育畸形。进一步根据临床诊断标准和临床以及文献知识,结合儿童患者临床特性和电子病历数据中记录的患儿资料,确定后续用于发展预测模型的特征。包括:一般资料人口统计学信息(共5维)、生命体征(共5维)、重症儿童疾病严重程度评分(共3维)、实验室检查(共32维)和治疗干预(共6维)。并将住PICU期间死亡患儿标注为正样本,其余为负样本。
(2)数据处理模块
针对步骤1确定的研究人群和研究数据集,分别对来自4个中心的数据进行清理和合并,包括检查数据一致性、处理无效值和缺失值:通过中位数插补法插补缺失数据,若缺失比例大于等于20%则予以剔除;通过多重共线性检验排除具有显著共线性(Sperman相关系数r>0.6或共线性检验方差膨胀因子VIF>10)且对因变量贡献不大的自变量。基于规整后的数据,进行模型输入特征的构建,即构建统计特征(原值、均值、中位数、四分位数、最大值、最小值、总和),进而获得42个研究特征(人口统计学信息3个、重症儿童疾病严重程度评分2个、生命体征5个、实验室指标24个和治疗信息8个)。
(3)模型构建与评估模块
本方法采用融合了SHapley Additive exPlanations(SHAP)方法的集成学习方法之极端梯度提升XGBoost模型对重症患儿的死亡风险进行及时评估;性能最优模型为XGBoost模型。①本发明同步纳入了3个机器学习模型(极端梯度提升XGBoost模型、随机森林RF模型、支持向量机SVM模型),预测模型通过将多中心数据进行模型的训练和调优,并进行内部的验证评估;随后采用8个评估指标(AUC、敏感性、特异性、准确性、精准性、F1值、AUPRC、校准度曲线)和1个可解释性功能指标对模型性能进行评估;进一步将与训练数据集不一致的不同时期的重症患儿数据用于模型的外部验证;②模型的性能评估:对同步纳入的2个机器学习模型(随机森林RF和支持向量机SVM模型)和2个常用的临床评分(第三代儿童死亡风险评分PRISM Ⅲ和儿童序贯器官衰竭评分pSOFA),与本发明选定的模型(XGBoos模型)进行对比;并通过获得模型的校准曲线比较模型拟合度,及进一步评估儿科临床重点关注的年龄性能对模型预测性能的影响(年龄小于等于2岁和年龄大于2岁的重症患儿);③同时基于SHAP方法获得和重症患儿死亡相关的风险因素及排名;并评估模型减少纳入特征变量预测性能的改变(全部特征42个至4个特征)。 最终将经过充分验证的模型和数据处理环节的相关模块进行封装获得针对重症儿童的死亡风险评估模型和装置。
本发明提供了具备可解释功能的针对PICU重症患儿的死亡风险评估模型和装置,具体包括以下步骤:获取患儿住PICU第一天的一般人口统计学信息3个、重症儿童疾病严重程度评分2个、生命体征5个、实验室检查指标24个和住PICIU期间治疗信息8个;上述特征变量经过装置的数据处理模块获得了可以直接输入模型的特征,进一步经过死亡风险评估模块的计算,和可解释方法对模型评估过程的可视化即重要的风险因素对患儿结局的贡献比;最终获得重症儿童发生不良结局(死亡)的风险和模型推理的解释。
下面将结合附图对本发明进行详细说明,具体数据获取、输入/输出操作以及算法为常规技术。
本发明提出的基于多中心高质量的电子病历档案数据,发展用于及时准确评估和预测在PICU场景中重症患儿群体在住PICU期间出现不良结局的风险,并经过全面的评估指标和外部验证获得稳健、普适及临床可落地、可被理解和信任的风险评估模型。结合儿童特性,全自动地对重症儿童的疾病严重程度进行及时的评估,为及早干预和精准诊疗提供科学依据。
本发明利用电子病历档案收集的丰富信息,这些立体的数据可表征患儿住PICU期间的疾病发展轨迹,通过机器学习模型挖掘数据与结局之间的复杂非线性关联性,获得相比于临床使用的疾病评分性能更为良好的预测模型,可作为一种系统。同时由于数据来自多个中心,可开发更为普适通用的模型,这是传统的线性相加临床评分所无法具备的优势。经过多中心和外部验证以及亚组分析等,最终将性能最优的模型进行封装,可以集成到现有的医院电子病历信息系统,可自动的获取分析结果,并进行可视化的解释和危险因素排名,为儿科医生的治疗评估提供参考依据,且不增加儿科医护人员的工作负荷。
本发明中提出的过程主要包括3个模型:(1)数据集构建模块,基于研究人群的纳入和排除标准以及特征变量,获取多中心重症患儿的研究数据集;(2)数据处理模块:根据步骤(1)获取的原始研究数据集,对数据进行清洗、规整、采样和插值。进一步根据数据特性完成统计特征的构建,获得了5类研究特征数据;(3)模型构建和评估模块,基于(2)中获得的数据,将其输入选定的机器学习模型,基于选定的模型训练集完成模型的构建和参数调优,并进行内部验证的性能评估。随后基于外部验证数据集和已确定的8个评估指标及1个功能指标,以及亚组分析、纳入部分特征的内容,对模型的预测性能进行进一步的评估,以获取模型的稳健性、普适性和可推广性。进而将性能表现最为优良的模型程序进行封装,写入计算设备,获得可以全自动帮助儿科医生及时获取患儿死亡风险和危险因素排名,以辅助儿科医生疾病诊断和治疗。
本发明提出的源自多中心的电子病历数据集开发针对重症患儿的PICU死亡风险评估方法,其预测性能一致优于基线模型和临床评分,可为儿科医生及时评估重症患儿病情提供更加便捷、精确的评估方法。其首次针对重症儿童构建风险评估模型,采用了多中心的数据集进行模型训练,并经过外部验证,性能均表现出良好的普适性和稳健性;同时该方法获得了与重症患儿死亡风险相关联的危险因素排名,其中儿童序贯器官衰竭评分、是否使用机械通气、乳酸脱氢酶、C-反应蛋白、丙氨酸氨基转移酶十分关键且位于危险因素排名的前5位;对于患儿的结局具有重要的评估作用;最后该方法可以自动化、便捷地早期评估重症儿童出现住PICU期间不良结局(死亡)的风险。
实施例一
本发明提出的一种基于电子病历档案的重症儿童死亡风险可解释评估和危险因素排名的方法,其具体的实现如图1所示,具体步骤如下。
数据集构建模块。将来自中国四个代表性儿童医疗中心PICU重症患儿作为基础人群,进一步根据图2所示的筛选标准(筛选流程)获取本研究所涉及的群体(年龄1个月-18岁、体重>4kg;且入住PICU时长 ≥24小时)。本队列中,共纳入947例重症患儿,住PICU期间死亡79例(8.3%)。存活和死亡患儿一般资料比较见表1。本发明研究经四个儿童医院的医学伦理委员会批准,并经患儿监护人签署知情同意书。
建立数据集:采集PICU重症儿童的临床医疗数据。根据临床诊断标准和临床以及文献知识,结合儿童患者临床特性和电子病历数据中记录的患儿资料,确定后续用于发展预测模型的特征。如表2所示,包括5个人口统计学 (年龄、体质量、身长、BMI指数、性别)、3个重症儿童疾病严重程度评分(第三代儿童死亡风险评分PRISM Ⅲ、儿童序贯器官衰竭评分pSOFA、格拉斯哥昏迷评分GCS)、5个生命体征(心率、收缩压、舒张压、平均动脉压、体温)、34个血氧指标和实验室检查指标(氧分压PaO
Age:年龄,AKI:急性肾损伤,BMI:身体质量指数,Body weight:体重,GCS:格拉斯哥昏迷评分;Male:男,MODS:多器官功能障碍,PICU:儿童重症监护病房,PRISM Ⅲ:第三代儿童死亡风险评分,pSOFA:儿童序贯器官衰竭评分,Sepsis:脓毒症,Shock/DIC:休克/弥散性血管内凝血。
数据处理模块。通过上述过程获得的研究群体和确定的研究变量的原始数据,输入到数据处理模块完成模型构建前的准备工作。(1)数据清洗,包括检查数据一致性,确定4个中心各个变量的统一名称,同时也将相同变量的多种表达方式进行合并;(2)处理无效值和缺失值。数据插值,将研究人群中缺失比例低于20%的变量采用有条件中位数插补法进行插补,由于缺失值为临床实验室指标,多数为临床医生判断不需要检测所致,且变量为非正态分布,因此采用有条件中位数插补法:根据年龄、性别将总体分层后,用患儿所在层的变量中位数代替缺失数据;(3)超过20%缺失比例的变量予以剔除;(4)共线性分析,对于存在显著共线性的变量(Sperman相关系数r>0.6或共线性检验方差膨胀因子VIF>10),采用逐步回归分析剔除具有共线性的自变量;(5)统计特征构建,抽取统计特征,将最终获得的特征变量名称例入表3:包括人口统计学信息指标3个、重症儿童疾病严重程度评分2个、生命体征指标5个、实验室检查指标24个和治疗8个。
PRISM Ⅲ:第三代儿童死亡风险评分PRISM Ⅲ,pSOFA:儿童序贯器官衰竭评分。
模型构建与训练:模型构建采用源自80%的研究人群。本研究选用集成学习之极端梯度提升XGBoost模型,输入数据处理模块中获取的特征变量,在此基础上80%数据集用于模型的训练和模型参数的调优,最终获得的模型运行函数和超参数设置为:
model_use=xgboost.XGBClassifier (**params)
params= {booster=gbtree,
eta=0.1, gamma=0.001,
max_depth=6, min_child_weight=1,
colsample_bytree=0.5,
objective=binary:logistic
subsample=0.85,
nrounds=100,
seed=0, silent=0,
watchlist=watchlist,
verbose=1,
print_every_n=100,
early_stopping_rounds=200,
num_boost_round=10}
explainer=shap.TreeExplainer(model_use)
20%的研究人群用于模型的内部验证。为了后续对比模型的性能,同步训练了3个机器学习模型(XGBoost、随机森林RF和支持向量机SVM模型)。图3呈现死亡风险预测模型的内部验证结果。预测模型ROC曲线、精准-召回曲线及校准曲线。图4与图5呈现本发明风险预测模型与同步纳入的其他机器学习模型及临床疾病评分对比的内部验证结果:极端梯度提升模型(XGBoost,本发明)性能一致优于2个机器学习模型(随机森林RF和SVM模型)和临床疾病评分(第三代儿童死亡风险评分PRISM Ⅲ和儿童序贯器官衰竭评分pSOFA)。AUC:XGBoost (0.935)、RF (0.894)、SVM (0.912)、临床疾病评分 (0.845)。
模型的性能验证,采用外部验证和亚组分析进行性能评估。将与训练数据集不一致的不同时期的重症患儿作为评估人群,建立外部验证数据集。将本发明选定模型分别与2个上述提及的机器学习模型(随机森林RF和SVM模型)和临床疾病评分(第三代儿童死亡风险评分PRISM Ⅲ和儿童序贯器官衰竭评分pSOFA)进行对比。选取了8个评估指标用于定量和定性的评估模型和其他对比模型/评分的性能。图6呈现了本研究选定预测模型外部验证结果。预测模型ROC和精准-召回曲线及校准曲线。外部验证的校准曲线性能显示模型的结果与y=x曲线具有较好的贴近。图7呈现了本发明风险预测模型与同步纳入的其他机器学习模型及临床评分对比的外部验证结果,XGBoost模型明显优于临床评分。AUC: XGBoost(0.940)、RF (0.951)、SVM (0.911)、PRISM III和pSOFA (0.892)。图8呈现模型在两个年龄分层(年龄小于等于2岁和年龄大于2岁的重症患儿)的偏倚情况。在两个年龄分层,模型预测性能差别较小。表4为预测模型的内部验证和外部验证7个指标的详细性能呈现(AUC、特异性、敏感性、准确性、精准性、F1值、AUPRC)。 表5呈现了本发明预测模型与其他2个机器学习模型和临床评分的预测性能对比。
评估模块,基于SHAP方法获得预测模型在评估疾病风险的危险因素排名。图9呈现了基于SHAP值的评估疾病风险的Top 20个重要特征。风险因素排名为:儿童序贯器官衰竭评分pSOFA、机械通气MV、乳酸脱氢酶LDH、C-反应蛋白CRP、丙氨酸氨基转移酶ALT、第三代儿童死亡风险评分PRISM Ⅲ、最高二氧化碳分压PaCO
AUC:受试者工作特征曲线下面积,AUPRC:精准‐召回曲线下面积。
AUC:受试者工作特征曲线下面积,AUPRC:精准‐召回曲线下面积;PRISM Ⅲ:第三代儿童死亡风险评分PRISM Ⅲ,pSOFA:儿童序贯器官衰竭评分。
表6 预测模型基于SHAP方法的特征排名
实施例二
本发明公开了可解释重症儿童死亡风险评估装置,能够执行上述可解释重症儿童死亡风险评估模型;所述模型融合的SHAP方法获得单独重症患儿的风险因素贡献程度评估;其中,采用红色代表该因素当前处于异常状态对患儿的结局产生危害影响,采用蓝色代表该因素当前处于正常状态对患儿的结局不产生危害影响,且SHAP值越大对结局的影响程度越大。该计算单元可以是中央处理器、单片机等。 如图12所示,将上述提及的数据处理过程、预测模型、可解释功能进行程序封装,形成可以自动进行数据清洗、计算、评估和给出分析原因的装置;本发明可解释重症儿童死亡风险评估模型作为程序写入计算设备,比如计算机或者手机,具体为常规技术,临床应用时,医生根据具体患者的数据(特征),就能得到风险评估结果,包括这些特征对预测结果的重要性。
除非另有定义,本申请中使用的所有技术和/或科学术语具有与由本发明所涉及的领域的普通技术人员通常理解的相同含义。本申请中提到的装置、方法和实施例仅为说明性的,而非限制性的。虽然已结合具体实施方式对本发明进行了描述,在本申请的发明主旨下,本领域的技术人员可以进行适当的替换、修改和变化,这种替换、修改和变化仍属于本申请的保护范围。
- 用于重症老年患者的可解释公平早期死亡风险评估模型、装置、及其建立方法
- 可解释分层老年MODS早期死亡风险评估模型、装置及其建立方法
