一株短双歧杆菌及其应用
文献发布时间:2024-04-18 19:52:40
技术领域
本发明涉及一株短双歧杆菌及其应用,属于微生物技术领域。
背景技术
益生菌是指一类对宿主产生有益作用的活性微生物,通过定植于宿主肠道、生殖系统内,能够对宿主产生确切的健康功效,进而改善宿主体内的微生态平衡、活性微生物的总称。乳酸菌作为益生菌中最具代表性的菌属,具有帮助消化、促进营养物质的吸收、缓解乳糖不耐症、预防和治疗腹泻、调节肠道菌群和缓解便秘、调节机体免疫功能、降低血液总的胆固醇、改善食物引起的过敏性疾病、延缓衰老及抗肿瘤等生理活性。
早期的研究主要关注于益生菌的发现及益生菌对肠道菌群的调节作用。近年来,越来越多的研究表明,益生菌可以通过调节肠道微生物群落结构和功能,增强免疫功能。在动物模型和临床试验中,益生菌可以通过增加免疫细胞的数量和功能,促进免疫球蛋白的产生和释放,增强黏膜免疫屏障,减轻炎症反应等多种途径,发挥调节免疫活性的作用。市场上改善免疫的双歧杆菌种类很多,其中一些比较常见的菌株包括:丹麦科汉森公司的动物双歧杆菌BB12、芬兰维利奥公司的鼠李糖乳杆菌LGG,但是国内研发的具有自主知识产权的调节免疫力的菌株少之又少,能够成功上市的菌株更是凤毛麟角。目前,国内外研究比较多的有双歧杆菌、干酪乳杆菌等。然而,由于乳酸菌的益生活性具有菌株特异性,不同菌株之间的益生活性差别较大。因此,亟需筛选对于机体的免疫活性调节作用的益生菌。
发明内容
本发明提供了一株具有免疫增强能力的短双歧杆菌(Bifidobacterium breve)CCFM1310,已于2023年6月7日保藏于广东省微生物菌种保藏中心,保藏编号为GDMCC No:63536,保藏地址为广州市先烈中路100号大院59号楼5楼。
本发明提供了含有所述短双歧杆菌CCFM1310的药物。
本发明还提供了所述短双歧杆菌CCFM1310在制备增强机体免疫力的药物的应用。
在一种实施方式中,所述应用包括调节机体的非特异性免疫功能、特异性免疫功能与肠道免疫功能。
在一种实施方式中,所述应用包括但不限于如下至少一方面作用:
(1)恢复白细胞和中性粒细胞的异常降低;
(2)改善脾组织损伤;
(3)提高体液免疫球蛋白含量;
(4)恢复脾脏LDH酶活性、ACP酶活性的异常降低。
在一种实施方式中,所述应用还包括调节肠道菌群。
在一种实施方式中,所述药物中,短双歧杆菌CCFM1310的活菌数为不低于1×10
在一种实施方式中,所述药物含有所述短双歧杆菌CCFM1310、药物载体和/或药用辅料。
本发明还提供了含有所述短双歧杆菌CCFM1310的组合物。
在一种实施方式中,所述组合物包括但不限于食品、保健品或微生物制剂。
在一种实施方式中,所述组合物为含短双歧杆菌CCFM1310的发酵剂。
在一种实施方式中,所述发酵剂是将所述短双歧杆菌CCFM1310在培养基中培养一段时间,收集细胞培养液中的菌体细胞,直接作为发酵剂或对菌体细胞进行处理后获得发酵剂。
在一种实施方式中,所述处理包括但是不限于:洗涤、添加保护剂、干燥等处理方式中的一种或多种。
在一种实施方式中,所述发酵剂的制备方案为:将短双歧杆菌CCFM1310按照培养基总质量的1%~5%的接种量接种到培养基中,于37℃下培养18h,得到的培养液进行离心得到菌体;将菌体用生理盐水重悬,得到发酵剂。
在一种实施方式中,所述培养基为mMRS培养基;所述mMRS培养基是添加了半胱氨酸盐酸盐的MRS培养基。
在一种实施方式中,所述食品包括使用所述短双歧杆菌CCFM1310的发酵剂生产得到的乳制品、豆制品、肉制品或果蔬制品。
本发明还提供所述短双歧杆菌CCFM1310在制备有助于增强免疫力的保健品中的应用。
本发明还提供短双歧杆菌CCFM1310在食品添加剂中的应用,所述应用包括但不限于作为食品发酵剂。
有益效果:本发明提供了一株具有免疫调节功能的短双歧杆菌CCFM1310,该菌株可以以单一菌株的方式调节免疫,并通过调节机体的非特异性免疫功能与特异性免疫功能,从而达到提高机体免疫力的目的。此外,短双歧杆菌CCFM1310还可以有效提高机体的免疫球蛋白IgA、IgG、IgM水平,改善环磷酰胺引起的胸腺萎缩及脾脏肿大,使外周血中白细胞增多,调节免疫相关酶的活性及肠道菌群。本发明的菌株可作为日常摄入的益生菌,代替现有的药物达到提高人体免疫力的效果,可作为治疗免疫力低下患者的新选择。本发明的菌株还可以作为食品或药品形式的组合物质,并可为发酵食品提供特殊的风味与口感。
生物材料保藏
短双歧杆菌(Bifidobacterium breve)CCFM1310,分类命名为Bifidobacteriumbreve,已于2023年6月7日保藏于广东省微生物菌种保藏中心,保藏地址为广州市先烈中路100号大院59号楼5楼,保藏编号为GDMCC No:63536。
附图说明
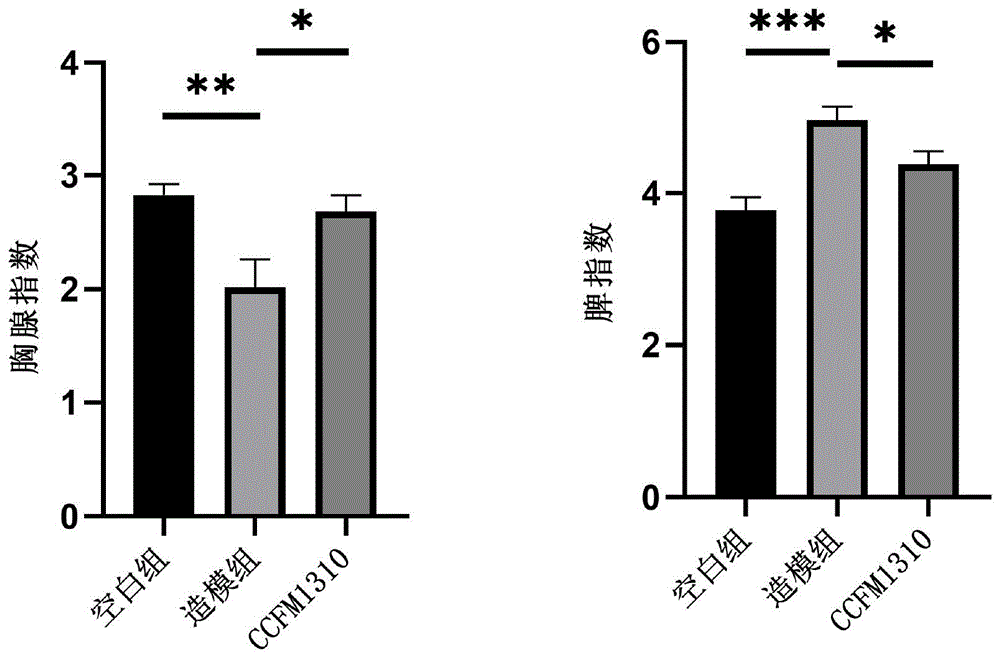
图1所示为BALB/c小鼠灌喂本发明短双歧杆菌CCFM1310后,对免疫器官指数的影响。
图2所示为外周血中白细胞的数量分布情况,表明短双歧杆菌CCFM1310可以增加白细胞的数量。
图3所示为各组脾组织的H&E染色,表明短双歧杆菌CCFM1310能够缓解造模所致的脾脏损伤。
图4所示为各组小肠组织的H&E染色,表明短双歧杆菌CCFM1310能够缓解造模所致的小肠损伤。
图5所示为血清中的免疫球蛋白水平,表明短双歧杆菌CCFM1310能够提高机体的免疫球蛋白IgA、IgG及IgM的水平。
图6所示为脾脏中乳酸脱氢酶(LDH)的活性,表明短双歧杆菌CCFM1310可以提高LDH的活性。
图7所示为脾脏中酸性磷酸酶(ACP)的活性,表明短双歧杆菌CCFM1310可以提高ACP的活性。
图8所示为肠道菌群α多样性的结果,表明短双歧杆菌CCFM1310可以提高菌群多样性。
图9所示为小鼠粪便中Lachnospiraceae NK4A136 group的相对丰度,表明短双歧杆菌CCFM1310可以提高该属的相对丰度。
(图1~9中,“*”、“**”、“***”、“****”均表示与CTX组对比具有显著性差异,误差以Mean±SEM的形式展现。)
具体实施方式
下面通过具体实施例进一步说明本发明的技术特点,图中显示的具体实施例是目前最佳的,但这些实施例并非以限定本发明的保护范围。
下述实施例中涉及的小鼠为6周龄雌性SPF(Specific pathogen free,无特定病原体)级BALB/c小鼠,购自维通利华;下述实施例中涉及的配制培养基所需试剂均购自国药集团化学试剂有限公司;下述实施例中涉及造模用药的环磷酰胺(CTX)购自无锡莱弗思公司。
下述实施例中涉及的培养基如下:
mMRS液体培养基:胰蛋白胨10g/L、牛肉膏10g/L、酵母粉5g/L、葡萄糖20g/L、无水乙酸钠2g/L、七水硫酸镁0.5g/L、一水硫酸锰0.25g/L、柠檬酸氢二铵2g/L、三水磷酸氢二钾2.6g/L、Tween80 mL/L、半胱氨酸盐酸盐0.5g/L。
mMRS固体培养基:胰蛋白胨10g/L、牛肉膏10g/L、酵母粉5g/L、葡萄糖20g/L、无水乙酸钠2g/L、七水硫酸镁0.5g/L、一水硫酸锰0.25g/L、柠檬酸氢二铵2g/L、三水磷酸氢二钾2.6g/L、Tween80 mL/L、半胱氨酸盐酸盐0.5g/L,琼脂20g/L。
实施例1:菌株的筛选、鉴定与保存
(1)菌株的筛选
取1g来源于湖南健康人体粪便,梯度稀释后涂布于mMRS固体培养基(含10μg/mL莫匹罗星抗生素)中,置于37℃厌氧环境中培养72h,观察并记录菌落形态;挑取表面湿润、有凸起的、白色泛黄的菌落在mMRS固体培养基上划线,于37℃厌氧的条件下进行纯化培养,重复此操作3次,获得纯化后的单菌落;挑取单菌落在mMRS固体培养基上划线,37℃厌氧培养36h,对所得菌落进行革兰氏染色(革兰氏染色方法参考教科书《工业微生物育种学》作者:诸葛健著)保留革兰氏阴性、菌落呈凸起且白色泛黄状、过氧化氢酶阴性以及果糖-6-磷酸激酶阳性的菌株,此次筛选得到一株菌株。
(2)鉴定
提取步骤(1)筛选得到的菌株的基因组,将菌株的16S rDNA进行扩增和测序,将获得的序列在NCBI-Blast中进行核酸序列比对,结果显示菌株为短双歧杆菌(Bifidobacterium breve)。
其中,16S rDNA扩增所用引物如下:
27F:5’-AGAGTTTGATCCTGGCTCAG-3’;
1492R:5’-TACGGCTACCTTGTTACGACTT-3’;
16S rDNA扩增程序如下:
95℃5min;35个循环(95℃30s;55℃30s;72℃2min);72℃10min。
(3)保存
挑取单菌落接入mMRS液体培养基中,于37℃厌氧的条件下培养24h,得到菌液;将菌液置于离心管中3000rpm离心10min收集菌体;在菌体中加入灭菌后的PBS缓冲溶液后置于离心管中3000rpm离心10min进行洗涤,得到洗涤后的菌体,重复此操作3次,在所得菌体中加入灭菌后的30%(v/v)甘油后-80℃保存于甘油管中。
经鉴定后该菌于2023年6日7日保藏于中国微生物菌种保藏管理委员会普通微生物菌种保藏中心,保藏编号为CGMCC No.63536。同时,该菌留存于江南大学食品生物技术中心菌种库,保藏号为CCFM1310。
实施例2:短双歧杆菌CCFM1310菌悬液的制备
(1)从甘油管中蘸取短双歧杆菌CCFM1310的菌液在mMRS固体培养基上划线,厌氧环境下37℃培养48h,得到单菌落;挑取单菌落接种于mMRS液体培养基中,厌氧环境下37℃培养48h进行活化培养,重复此操作3次,得到活化后的菌液。
(2)将上述步骤得到的活化后的菌液按照按2%(v/v)的接种量接种至mMRS液体培养基中,37℃培养24h后得到发酵液,将发酵液离心收集菌体,用生理盐水重悬菌体,并调整活菌数5×10
实施例3:短双歧杆菌CCFM1310对免疫抑制模型小鼠免疫器官的影响
(1)实验动物为雌性SPF级BALB/c小鼠(6周龄,体重19-20g),来自中国浙江维通利华实验动物技术有限公司。小鼠饲养在聚丙烯笼子里,每组8只小鼠,笼子里装有食物和水,控制温度(22℃),相对湿度(50±10%),自由饮水。
(2)免疫抑制小鼠模型的建立
将BALB/c小鼠分为空白组、造模组与CCFM1310组,8只/组。造模组与CCFM1310组每只小鼠结束适应期后均腹腔注射环磷酰胺(80mg/kg bw),空白组则注射相同剂量生理盐水,连续三天。
(3)实验分组及给药
空白组与造模组结束三天造模后开始每天灌胃无菌生理盐水(0.2mL/只),CCFM1310组每天灌胃菌株悬液(1×10
(4)免疫脏器指数(immune organs index,IOI)的测定
于实验第14d,颈椎脱臼致死后立刻解剖,摘取胸腺和脾脏,小心去除粘附的其它组织,用吸水纸轻轻吸取表面粘液后进行称重。试验结果以平均值±SEM表示。
结果如图1所示,经CTX处理后造模组的胸腺指数比空白组降低了28.59%,而脾脏由于发生脾肿大而指数高于空白组31.9%。与造模组相比,CCFM1310组小鼠的胸腺指数高于造模组32.91%,同时脾脏指数比造模组低11.99%(p<0.05)。
实施例4:短双歧杆菌CCFM1310对免疫抑制模型小鼠白细胞数目的影响
眼球取血于加有抗凝剂的1.5mL离心管中,然后采用血细胞分析仪测定小鼠全血中白细胞的数量。白细胞是人体重要的免疫细胞,根据形态可以分为粒细胞、单核细胞以及淋巴细胞。结果如图2所示,CTX可以使小鼠血液中白细胞数量减少,造模组的白细胞数目比空白组低40.69%(p<0.01),而CCFM1310组的白细胞数目比造模组高56.34%(p<0.05)。从淋巴细胞数可见,CCFM1310的数目高于造模组89.52%(p<0.01),CCFM1310组的中性粒细胞数目比造模组数量增加了57.83%,说明该菌能够提高CTX造模小鼠的免疫能力。
实施例5:短双歧杆菌CCFM1310对免疫抑制模型小鼠脾组织的影响
处死小鼠后,取部分脾脏组织,利用生理盐水将血液冲洗干净,4%多聚甲醛固定24h,石蜡包埋后切成5μm切片。切片经二甲苯脱蜡,然后用苏木精和伊红(H&E)染色进行观察。结果如图3所示,空白组脾组织各层结构清晰,白髓数量以及大小无明显变化,红髓与白髓分界清楚,未见明显异常。而造模组白髓数量少;红髓分布均匀与白髓分界稍有不清,红髓中可见多量粒细胞,并可见少量髓外造血细胞。而经过CCFM1310处理后,脾组织所受损伤情况均有所改善。
实施例6:短双歧杆菌CCFM1310对免疫抑制模型小鼠小肠组织的影响
处死小鼠后,取部分小肠组织,利用生理盐水将血液冲洗干净,4%多聚甲醛固定24h,石蜡包埋后切成5μm切片。切片经二甲苯脱蜡,然后用苏木精和伊红(H&E)染色进行观察。结果如图4所示,空白组小肠形态结构正常,上皮细胞之间有杯状细胞分布,肠绒毛基部上皮内陷形成李氏隐窝,双层平滑肌细胞构成的黏膜肌层将肠隐窝与黏膜下层分隔开。而造模组小肠组织可见局部肠腺排列疏松,排列不规则,少量肠绒毛脱落,结构不清,固有层裸露,少量肠绒毛黏膜上皮与固有层分离;黏膜层可见少量淋巴细胞浸润;灌菌组则症状均有所改善。
实施例7:短双歧杆菌CCFM1310对免疫抑制模型小鼠免疫球蛋白含量的影响
小鼠眼球取血,分装于洁净干燥EP管中,室温静置2h后,4℃2000rpm/min离心10min,取血清保存于-80℃冰箱中备用。通过ELISA试剂盒测定血清中免疫球蛋白(IgA、IgG、IgM)含量,具体操作按试剂盒的说明书进行。实验结果如图5所示,经过CTX的造模处理显著降低血清中免疫球蛋白的水平,与空白组相比,造模组的IgA、IgG、IgM水平分别降低了34.81%、42.62%以及18.28%;而经灌胃本发明菌株后,血清中IgA、IgG、IgM的含量分别升高了115.3%、75.17%以及58%(p<0.05),并超出空白组的水平,说明本发明菌株具有提高机体体液免疫的功能。
实施例8:短双歧杆菌CCFM1310对免疫抑制模型小鼠脾脏中LDH活性的影响
取出冻存于-80℃的脾脏组织,按1:9加入组织裂解液,利用高通量破碎仪破碎组织得到匀浆,然后12000g、4℃离心15min,收集上清,根据购自南京建成的试剂盒说明书测定脾脏LDH酶活性。LDH是糖酵解的一种酶,有利于促进巨噬细胞发挥免疫功能。结果如图6显示,经过CTX处理,造模组的LDH活力低于空白组27.06%,而经过CCFM1310处理后,LDH的酶活性高于造模组55.26%(p<0.05)。
实施例9:短双歧杆菌CCFM1310对免疫抑制模型小鼠脾脏中ACP活性的影响
取出冻存于-80℃的脾脏组织,按1:9加入组织裂解液,利用高通量破碎仪破碎组织得到匀浆,然后12000g、4℃离心15min,收集上清,根据购自南京建成的试剂盒说明书测定脾脏ACP酶活性。ACP作为巨噬细胞溶酶体酶的标志酶,可以将巨噬细胞激活。结果如图7显示,经过CTX处理,造模组的ACP活力低于空白组24.76%,而经过CCFM1310处理后,ACP的酶活性高于造模组32.96%(p<0.05)。
实施例10:短双歧杆菌CCFM1310对免疫抑制模型小鼠肠道菌群的影响
使用粪便DNA提取试剂盒对小鼠粪便中的细菌基因组进行提取,对提取得到的基因组DNA的V3-V4区进行特异性PCR扩增(上游引物341F:CCTAYGGGRBGCASCAG;下游引物806R:GGACTACNNGGGTATCTAAT),16S rDNA测序,分析肠道菌群多样性变化,分析结果见图8所示,与空白组小鼠相比,造模组小鼠肠道的Chao 1指数低于空白组,而CCFM1310组的Chao1指数与造模组没有显著差异。此外,与空白组相比,造模组的Shannon指数与Simpson指数分别降低了4.38%与1.59%,而与造模组相比,CCFM1310的Shannon指数与Simpson指数分别增加了5.87%与2.33%(p<0.05)。
此外,通过Welch t检验确定相对丰度变化显著的菌属,结果如图9所示,与空白组相比,造模组Lachnospiraceae NK4A136 group的相对丰度显著降低(p<0.05),而CCFM1310组该属的相对丰度高于造模组37.14%,呈显著水平差异(p<0.05)。
实施例11短双歧杆菌CCFM1310冻干制剂的制备
具体步骤如下:
(1)菌株的活化:从甘油管中蘸取短双歧杆菌CCFM1310的菌液在mMRS固体培养基上划线,厌氧环境下37℃培养48h,得到单菌落;挑取单菌落接种于mMRS液体培养基中,厌氧环境下37℃培养24h进行活化培养,重复此操作3次,得到活化后的菌液。
(2)将步骤(1)得到的菌液按2%的接种量接种到mMRS液体培养基中,37℃厌氧培养24h得到发酵液,将得到的发酵液在8000rpm下离心20min后收集菌泥,将菌泥用生理盐水清洗3次后备用,并调整活菌数1×10
(3)冻干保护剂的配制:将100g/L脱脂乳粉、100g/L海藻糖、160g/L蔗糖和余量的水混合后得到冻干保护剂。
(4)向步骤(2)中得到的菌泥中添加上述配置好的冻干保护剂,其中冻干保护剂的重量为菌泥重量的3倍,混合均匀后进行真空冷冻干燥,最后将冻干得到的制剂真空包装。
对比例1
具体实施方式同实施例3,区别在于,将短双歧杆菌CCFM1310替换为鼠李糖乳杆菌LV108(公开于公开号为CN101407835A、CN110317891A的专利申请文件中),结果显示,鼠李糖乳杆菌组小鼠脾脏指数和胸腺指数为4.7±0.1、1.1±0.1,造模组为4.33±0.1、0.86±0.09,分别高于造模组7.87%、27.9%。
对比例2
具体实施方式同实施例3~4,区别在于,将短双歧杆菌CCFM1310替换为凝结芽孢杆菌13002(公开于公开号为CN110734873A的专利申请文件中),结果显示,凝结芽孢杆菌组小鼠的淋巴细胞百分比为72.68%±3.48%,造模组为59.30%±6.65%,高于造模组15.68%。
对比例3
具体实施方式同实施例3、7,区别在于,将短双歧杆菌CCFM1310替换为乳双歧杆菌M8(公开于公开号为CN110157650A的专利申请文件中),结果显示,乳双歧杆菌组小鼠的IgA、IgG水平分别为126±16μg/mL、7.05±0.76μg/mL,造模组的水平为42±5μg/mL、4.92±0.91μg/mL,较造模组分别增加了200%、43.29%。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 一种用于电缆敷设的牵引辅助装置及其使用方法
- 气膜建筑外模锚固方法和牵引装置及该装置的使用方法
- 一种轨道车辆牵引座及含有该牵引座的牵引装置
- 一种铲粪装置和一种具有用于铲粪装置的保持器的狗牵引带壳体
- 一种城市轨道交通牵引供配电装置及其使用方法
- 一种城市轨道交通牵引供配电装置
