一种高产β-烟酰胺单核苷酸的工程菌及其构建方法和应用
文献发布时间:2024-04-18 19:53:33
技术领域
本申请涉及一种高产β-烟酰胺单核苷酸的工程菌及其构建方法和应用,属于基因工程及生物工程技术领域。
背景技术
β-烟酰胺单核苷酸(nicotinamide mononucleotide,NMN)是一种天然存在于人体内的核苷酸类物质,属于B族维生素的衍生物,其分子量为334.22,在生物体中主要用于合成NAD
研究人员常通过酶催化法、发酵法合成NMN并可提取获得纯度大于99%的原料产品,使其用于化妆品、保健食品中,也在通过细胞、动物实验以及人体临床试验进一步探索NMN的应用,赋予NMN重要的经济价值。发酵法合成NMN是一种成本相对低廉、生产周期较短、可放大至工业化规模的生产方式。研究人员通过代谢工程研究,已经使NMN合成代谢通路逐渐清晰,加之基因工程、基因编辑技术的成熟,已有专利、文献报道多种工程菌株实现了NMN的合成。
在之前的研究中,发明人通过适应性实验室进化(adaptive laboratoryevolution,ALE)获得了可耐受高产物浓度和高底物浓度的工程菌株,该驯化菌株具有合成NMN的能力,相关内容已公开在专利公布号CN116042473A的专利申请文件中。其中构建的大肠杆菌ME59,可以以烟酰胺(nicotinamide,NAM)为底物合成NMN,经过前期多次发酵验证了ME59驯化菌在5L罐中的发酵情况,相对于出发菌株NMN02,驯化菌ME59除了有NMN以外还有副产物烟酸(nicotinic acid,NA),并积累浓度至2~8g/L以上,因此前述研究中所构建的工程菌株,存在副产物过多积累以及NMN产量有待提高的问题,为此,有必要提供一种既能够减少副产物积累从而方便产物分离,又可以提高NMN产量的高产β-烟酰胺单核苷酸的工程菌株。
发明内容
为了解决上述问题,提供了一种高产β-烟酰胺单核苷酸的工程菌及其构建方法和应用,本申请高产β-烟酰胺单核苷酸的工程菌的构建方法中,引入NA合成NMN途径的两个关键基因pncB、NadE,并成功通过质粒表达这两个关键基因,增加了从NA合成NMN的代谢通路,经过5L发酵罐的发酵验证,重组工程菌株最终NMN产量可达27g/L,且几乎未检测到副产物NA,使得底物烟酰胺向NMN的摩尔转化率从57.15%提升至99.2%,具有显著的改善效果,有利于节约生产成本,且适合工业化的扩大生产。
根据本申请的一个方面,提供了一种高产β-烟酰胺单核苷酸的工程菌,所述工程菌表达大肠杆菌来源的烟酸磷酸核糖基转移酶、Francisella tularensis来源的NAD+合酶。
可选的,所述烟酸磷酸核糖基转移酶为pncB;优选的,所述pncB基因的氨基酸序列包含如SEQ ID NO.4所示的氨基酸序列或与SEQ ID NO.4具有至少98%序列同一性的氨基酸序列;更优选的,所述pncB基因的核苷酸序列包含如SEQ ID NO.5所示的核苷酸序列或与SEQ ID NO.5具有至少98%序列同一性的核苷酸序列;和/或,
所述NAD+合酶为NadE;优选的,所述NadE基因的氨基酸序列包含如SEQ ID NO.6所示的氨基酸序列或与SEQ ID NO.6具有至少98%序列同一性的氨基酸序列;更优选的,所述NadE基因的核苷酸序列包含如SEQ ID NO.7所示的核苷酸序列或与SEQ ID NO.7具有至少98%序列同一性的核苷酸序列;再优选的,所述NadE基因的核苷酸序列包含如SEQ ID NO.8所示的核苷酸序列或与SEQ ID NO.8具有至少98%序列同一性的核苷酸序列。
可选的,所述工程菌还表达烟酰胺磷酸核糖转移酶、NMN转运蛋白和PRPP合酶中的一种或两种及以上。
可选的,所述烟酰胺磷酸核糖转移酶为VpNadV基因;优选的,所述VpNadV基因的核苷酸序列包含如SEQ ID NO.2所示的核苷酸序列或与SEQ ID NO.2具有至少98%序列同一性的核苷酸序列。
可选的,所述NMN转运蛋白为BMpnuC基因;优选的,所述BMpnuC基因的核苷酸序列包含如SEQ ID NO.3所示的核苷酸序列或与SEQ ID NO.3具有至少98%序列同一性的核苷酸序列。
可选的,所述PRPP合酶为BaPRS基因;优选的,所述BaPRS基因的核苷酸序列包含如SEQ ID NO.1所示的核苷酸序列或与SEQ ID NO.1具有至少98%序列同一性的核苷酸序列。
可选的,所述工程菌为谷氨酸棒杆菌、枯草芽孢杆菌、大肠杆菌中的一种;优选的,所述工程菌为大肠杆菌;可选的,所述大肠杆菌选自JM109、REL606、BW2952、DH10B、W3110、CPU210009、BL21(DE3)、K12、JM105、BM59中的任一种。
可选的,所述工程菌为大肠杆菌时,还敲除pncC、ushA、nadR和purR基因中的一种或多种。
根据本申请的另一个方面,提供了一种生物材料,所述生物材料包括下述任意一种:
E1)核酸分子,编码如上述的NAD+合酶;
E2)表达盒,含有E1)所述核酸分子;
E3)重组载体,含有E1)所述核酸分子和/或含有E2)所述表达盒;
E4)重组微生物,含有E1)所述核酸分子、含有E2)所述表达盒和/或含有E3)所述重组载体;
E5)重组细胞,含有E1)所述核酸分子、含有E2)所述表达盒和/或含有E3)所述重组载体;
E6)全细胞催化剂,含有E1)所述核酸分子、含有E2)所述表达盒、含有E3)所述重组载体、含有E4)所述重组微生物和/或含有E5)所述重组细胞,
优选的,所述的E1)的核酸分子包含如SEQ ID NO.8所示的核苷酸序列或与SEQ IDNO.8具有至少98%序列同一性的核苷酸序列。
根据本申请的又一个方面,提供了任一上述的工程菌或上述的生物材料在生产β-烟酰胺单核苷酸中的应用。
根据本申请的又一个方面,提供了大肠杆菌来源的烟酸磷酸核糖基转移酶和/或Francisella tularensis来源的NAD+合酶在提高β-烟酰胺单核苷酸产量的应用。
可选的,所述烟酸磷酸核糖基转移酶为pncB;优选的,所述pncB基因的氨基酸序列包含如SEQ ID NO.4所示的氨基酸序列或与SEQ ID NO.4具有至少98%序列同一性的氨基酸序列;更优选的,所述pncB基因的核苷酸序列包含如SEQ ID NO.5所示的核苷酸序列或与SEQ ID NO.5具有至少98%序列同一性的核苷酸序列;和/或,
所述NAD+合酶为NadE;优选的,所述NadE基因的氨基酸序列包含如SEQ ID NO.6所示的氨基酸序列或与SEQ ID NO.6具有至少98%序列同一性的氨基酸序列;更优选的,所述NadE基因的核苷酸序列包含如SEQ ID NO.7所示的核苷酸序列或与SEQ ID NO.7具有至少98%序列同一性的核苷酸序列;再优选的,所述NadE基因的核苷酸序列包含如SEQ ID NO.8所示的核苷酸序列或与SEQ ID NO.8具有至少98%序列同一性的核苷酸序列。
可选的,所述提高β-烟酰胺单核苷酸的过程包括烟酸转化为β-烟酰胺单核苷酸的过程。
根据本申请的又一个方面,提供了一种生产β-烟酰胺单核苷酸的方法,所述方法包括利用任一上述的工程菌或上述的生物材料进行发酵生产β-烟酰胺单核苷酸。
根据本申请的又一个方面,提供了任一上述的工程菌或上述的生物材料或上述方法在制备含β-烟酰胺单核苷酸的药品、食品或化妆品中的应用。本申请的有益效果包括但不限于:
1.根据本申请的高产β-烟酰胺单核苷酸的工程菌,基于发明人前述公开研究,引入pncB、NadE两个关键基因,增加了从NA合成NMN的代谢通路,成功构建了更加高产β-烟酰胺单核苷酸的工程菌株,不仅能够消耗副产物NA,从而方便简化纯化过程且提高能量利用率,底物烟酰胺向NMN的摩尔转化率高达99.2%,而且能够在前述研究基础上再次大幅提高β-烟酰胺单核苷酸的产量,NMN产量高达27g/L,且几乎未检测到副产物NA,具有重要的工业化应用价值。
2.根据本申请的高产β-烟酰胺单核苷酸的工程菌,经过5L发酵罐的发酵验证,能够显著提高β-烟酰胺单核苷酸的产量,能够有效节约生产成本、提高发酵生产效率,适合用于工业化的扩大生产,对β-烟酰胺单核苷酸在食品、药品、化妆品和饲料等领域的应用具有重要的社会价值和经济意义。
3.根据本申请的高产β-烟酰胺单核苷酸的工程菌,针对发酵生产β-烟酰胺单核苷酸中存在的产NA副产物通路影响目的产物产量的问题,采用基因工程及生物工程技术对工程菌株进行改造,成功解决了副产物通路影响底物利用率的问题,本申请公开的相关技术内容及解决思路,为解决其他微生物发酵工艺中存在的类似问题提供了可行的解决方案,具有重要的借鉴意义。
附图说明
此处所说明的附图用来提供对本申请的进一步理解,构成本申请的一部分,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。在附图中:
图1为本申请实施例1涉及的重组载体pET28a-BaPRS-VpNadV-Amp的示意图;
图2为本申请实施例1涉及的重组载体pCDFDuet-BMpnuC的示意图;
图3为本申请实施例1涉及的重组载体pRSFDeut-EcpncB-FtNadE的示意图;
图4为本申请实施例1涉及的发酵过程中OD
图5为本申请对比例1涉及的发酵过程中OD
具体实施方式
下面结合实施例详述本申请,但本申请并不局限于这些实施例,如无特别说明,本申请的实施例中的原料和催化剂均通过商业途径购买。
本方案中,用到培养基及其制备方法如下。LB培养基:蛋白胨10g/L、NaCl 10g/L、酵母提取物5g/L,若为LB固体培养基则另外加入琼脂粉20g/L;带抗性的平板分别为额外添加氨苄青霉素(Solobio,50μg/mL)、卡那霉素(Solobio,50μg/mL)、链霉素(Solobio,50μg/mL)的LB平板,以下简称氨苄平板、卡纳平板、链霉素平板,另根据需要,有时添加其中的两种或三种;发酵培养基:葡萄糖5~20g/L、MgSO
本方案中,NMN的HPLC检测方法包括如下参数设置:采用Agilent 1260InfinityII检测系统,Agilent 4.6×250mm,5μm色谱柱,流动相为95%20mM乙酸铵、5%乙腈,流速0.8mL/min;柱箱温度30℃;检测波长259nm。
本方案中,大肠杆菌感受态制备方法包括如下步骤:将大肠杆菌JM109划线于固体LB平板上,37℃过夜培养,挑选单菌落接种于液体LB培养基中,37℃,220r/min生长10h,以1%的接种量转接至新鲜的20mL液体LB培养基中,37℃培养1.5~2h,待OD
本方案中,PCR扩增体系设置如下:采用Phanta Flash Master Mix(购自Vazyme公司)高保真DNA聚合酶,体系为2×Phanta Flash Master Mix 25μL、上游引物F 2μL、下游引物R 2μL以及模板DNA 10ng,并用超纯无菌水补足至50μL。
本方案中,质粒无缝克隆组装方法包括如下步骤:使用
本方案中,NMN转化率计算方法为:摩尔转化率=(生产获得NMN质量/烟酰胺消耗质量)×(烟酰胺相对分子质量/NMN相对分子质量)×100%。
需要说明的是,在下述的具体实施方式中,烟酸磷酸核糖基转移酶NadE包括由如SEQ ID NO.6所示氨基酸序列及在此基础上进行1个或多个氨基酸取代而得到的同功能氨基酸序列,而本领域技术人员可以根据本申请公开的FtNadE的氨基酸序列,基于现有的分子生物学技术,采用克隆或合成的方法或其他适合的方法获得本申请的FtNadE基因。同时,对于本领域技术人员可以理解的是,不同菌株、菌种或其他物种来源的NadE基因具有与本申请中使用的NadE的相似功能,因此本申请方案中所指的NadE基因并不仅限于如SEQ IDNO.7或SEQ ID NO.8所示的核苷酸序列,通过其他序列编码得到的、但是与SEQ ID NO.6所述蛋白没有明显功能差异的其他蛋白,也理应包括在本发明的范围内。不需额外赘述的是,pncB也与NadE同理。
此外,本发明具体实施方式中所用的未进行具体说明试验材料均为本领域常规的试验材料,均可通过商业渠道购买得到。本发明具体实施方式中未注明具体实验条件和方法的,通常按照常规条件,如J.萨姆布鲁克等主编,科学出版社,2002,分子克隆实验指南(第三版);D.L.斯佩克特等主编,科学出版社,2001,细胞实验指南;或者按照制造厂商建议的条件。
在发明人之前的研究中,通过适应性实验室进化(adaptive laboratoryevolution,ALE)已经获得了可耐受高产物浓度和高底物浓度的工程菌株,该驯化菌株具有合成NMN的能力,相关内容已公开在专利公布号CN116042473A的专利申请文件中,该大肠杆菌ME59,可以以烟酰胺(nicotinamide,NAM)为底物合成NMN。
然而发明人经多次发酵验证ME59驯化菌在5L罐中的发酵情况后,发现其相比于出发菌株NMN02,除了成功发酵生产出NMN以外,还会有副产物烟酸(nicotinic acid,NA)产生,且烟酸的积累浓度高达2g~8g/L以上,副产物过多积累不仅导致底物烟酰胺的利用率下降,导致生产成本提高、产物产量降低,还会导致后续的分离纯化难度增加,需要对烟酸进行分离去除,导致分离纯化的工序增加、成本提高。
为此,在本发明方案中,发明人通过引入NA合成NMN途径的两个关键基因pncB、NadE,具体采用质粒在改造工程菌株中表达这两个关键基因,成功在改造工程菌株中增加了从NA合成NMN的代谢通路。更进一步,发明人还对改造菌株进行了扩大发酵培养,采用5L发酵罐的发酵验证方式,成功证明了该重组工程菌株能够显著提高NMN的产量,高达27g/L,并且几乎未检测到副产物NA,使得底物烟酰胺向NMN的摩尔转化率高达99.2%,明显降低了生产成本、提高了发酵收益,非常适合工业化的扩大生产。
下面通过具体的实施例、实验例和对比例对本发明的方案进行具体说明。
实施例1
(1)质粒pET28a-BaPRS-VpNadV的构建
PRPP合酶(PRS)基因BaPRS来源于解淀粉芽孢杆菌(Bacillusamyloliquefaciens),经突变后具有抗ADP等反馈抑制的能力。以合成的BaPRS基因序列SEQID NO.1为模板,利用引物PRS-F1/R1扩增BaPRS基因片段,该引物携带组装的同源臂序列,同源臂部分用下划线标出。使用高保真DNA聚合酶(Phanta Flash Master Mix,购自Vazyme公司)扩增,扩增程序包括:预变性98℃,30s;变性98℃,10s;退火56℃,5s;延伸72℃,5s;共30个循环;后延伸72℃,1min。扩增后将PCR产物进行纯化,得到BaPRS片段。
烟酰胺磷酸核糖转移酶(Nampt)基因VpNadV基因来源于弧菌噬菌体(Vibriobacteriophage KVP40)。以合成的VpNadV基因序列SEQ ID NO.2为模板,利用引物Nad-F1/R1扩增VpNadV基因片段,该引物携带组装的同源臂序列,同源臂部分用下划线标出。使用高保真DNA聚合酶(Phanta Flash Master Mix,购自Vazyme公司)扩增,扩增程序包括:预变性98℃,30s;变性98℃,10s;退火58℃,11s;延伸72℃,5s;共30个循环;后延伸72℃,1min。扩增后将PCR产物进行纯化,得到VpNadV片段。
以pET-28a(+)空载体为模板,利用引物F1/R1扩增pET-28a(+)的骨架部分,该引物携带组装的同源臂序列,同源臂部分用下划线标出。使用高保真DNA聚合酶(Phanta FlashMaster Mix,购自Vazyme公司)扩增,扩增程序包括:预变性98℃,30s;变性98℃,10s;退火57℃,11s;延伸72℃,27.5s;共30个循环;后延伸72℃,1min。扩增后将PCR产物进行纯化,得到pET-28a(+)的骨架片段。
将以上获得的纯化后的DNA片段进行无缝克隆组装,反应后将产物转化至大肠杆菌JM109(购自生工生物工程(上海)股份有限公司)中,提取质粒送至安升达公司测序,获得序列正确的重组载体pET28a-BaPRS-VpNadV。
(2)质粒pET28a-BaPRS-VpNadV-Amp的构建
以步骤(1)构建的pET28a-BaPRS-VpNadV为模板,引物p28-F/R,使用高保真DNA聚合酶(Phanta Flash Master Mix,购自Vazyme公司)扩增BaPRS-VpNadV的表达框及载体骨架。扩增程序包括:预变性98℃,30s;变性98℃,10s;退火48℃,5s;延伸72℃,35s;共30个循环;后延伸72℃,1min。
以pETDuet-1空质粒为模板,扩增其氨苄抗性基因序列,引物Amp-F/R,使用高保真DNA聚合酶(Phanta Flash Master Mix,购自Vazyme公司)扩增。扩增程序包括:预变性98℃,30s;变性98℃,10s;退火48℃,5s;延伸72℃,5s;共30个循环;后延伸72℃,1min。
将各自获得的PCR产物进行产物纯化。通过无缝克隆组装,将氨苄抗性序列片段组装在载体pET28a-BaPRS-VpNadV上,替换掉其原来的卡那霉素抗性基因。将重组后的载体转化到大肠杆菌JM109中,提取质粒送至安升达公司测序,获得序列正确的重组载体pET28a-BaPRS-VpNadV-Amp,重组载体如图1所示。
(3)质粒pCDFDuet-BMpnuC的构建
NMN转运蛋白基因BMpnuC来源于类霉菌芽孢杆菌(Bacillus mycoides)。以合成的BMpnuC基因序列SEQ ID NO.3为模板,利用引物pnuc-F1/R1扩增BMpnuC基因片段,该引物携带组装的同源臂序列,同源臂部分用下划线标出。使用高保真DNA聚合酶(Phanta FlashMaster Mix,购自Vazyme公司)扩增,扩增程序包括:预变性98℃,30s;变性98℃,10s;退火58℃,5s;延伸72℃,5s;共30个循环;后延伸72℃,1min。扩增后将PCR产物进行纯化,得到BMpnuC片段。
以pCDFDuet-1空载体为模板,利用引物pCD-F1/R1扩增pCDFDuet-1的骨架部分,该引物携带组装的同源臂序列,同源臂部分用下划线标出。使用高保真DNA聚合酶(PhantaFlash Master Mix,购自Vazyme公司)扩增,扩增程序包括:预变性98℃,30s;变性98℃,10s;退火60℃,20s;延伸72℃,27.5s;共30个循环;后延伸72℃,1min。扩增后将PCR产物进行纯化,得到pCDFDuet-1的骨架片段。
将以上获得的纯化后的DNA片段进行无缝克隆组装,反应后将重组产物转化至大肠杆菌JM109中,提取质粒送至安升达公司测序,获得序列正确的重组载体pCDFDuet-BMpnuC,重组载体如图2所示。
上述步骤中所使用到的引物序列参见下表1。
表1引物序列表一
(4)从NA合成NMN途径载体的构建
烟酸磷酸核糖基转移酶(pncB)催化烟酸合成烟酸单核苷酸,该基因来源于Escherichia coli K-12MG1655,Gene ID:946648,核苷酸序列SEQ ID NO.5。以大肠杆菌MG1655(购自生工生物工程(上海)股份有限公司)的基因组为模板,利用引物pncB-F/R扩增获得pncB片段,该引物携带组装的同源臂序列,同源臂部分用下划线标出。使用高保真酶扩增,扩增程序包括:预变性98℃,30s;变性98℃,10s;退火56℃,7s;延伸72℃,5s;共30个循环;后延伸72℃,1min。扩增后将PCR产物进行纯化,得到EcpncB片段。
NAD
载体选用pRSFDuet-1,以pRSFDuet-1质粒为模板,利用引物pRSF-F/R扩增线性化的载体骨架片段,该引物携带组装的同源臂序列,同源臂部分用下划线标出。使用高保真酶扩增,扩增程序包括:预变性98℃,30s;变性98℃,10s;退火58℃,18s;延伸72℃,5s;共30个循环;后延伸72℃,1min。扩增后将PCR产物进行纯化,得到线性化的载体片段。
将以上获得的载体片段、EcpncB片段、FtNadE片段通过无缝克隆组装的方法进行组装,获得质粒pRSFDeut-EcpncB-FtNadE,将其转化到大肠杆菌JM109中,提取质粒送至安升达公司测序,对比测序正确的质粒即获得重组载体pRSFDeut-EcpncB-FtNadE,重组载体如图3所示。
上述步骤中所使用到的引物序列参见下表2。
表2引物序列表二
(5)ME59的质粒丢失
ME59是经过高浓度NMN培养驯化的一株大肠杆菌,能够在含30g/L NMN的培养基中正常生长,已公布在专利申请号为CN116042473A的专利中。ME59已于2022年12月23日保藏于中国典型培养物保藏中心,保藏编号为CCTCCNO:M 20222060,保藏地址为中国湖北省武汉市,武汉大学。
ME59中包含两个质粒,一个是pET28a-BaPRS-VpNadV,携带卡那霉素抗性,另一个是pCDFDuet-BMpnuC,携带链霉素抗性。先将菌种在添加卡纳霉素和链霉素的双抗平板上划线分离单菌落,再挑单菌落至链霉素平板划线传代,传2~3代后挑选单菌落,分别点涂在含卡那霉素的平板和无抗平板上,筛选保留既能在无抗平板又能在卡纳平板上生长的菌株,此菌株即已丢失卡纳质粒。继续将菌株在无抗平板上划线培养,传2~3代后挑选单菌落,分别点涂在含链霉素的平板和无抗平板上,筛选保留既能在无抗平板又能在链霉素平板上生长的菌株,此菌株即已丢失链霉素质粒和卡纳质粒。将此菌株作为底盘细胞,并命名为BM59。
(6)高产β-烟酰胺单核苷酸的大肠杆菌的构建及其培养
将pET28a-BaPRS-VpNadV-Amp、pCDFDuet-BMpnuC和pRSFDeut-EcpncB-FtNadE转化至底盘细胞BM59中。
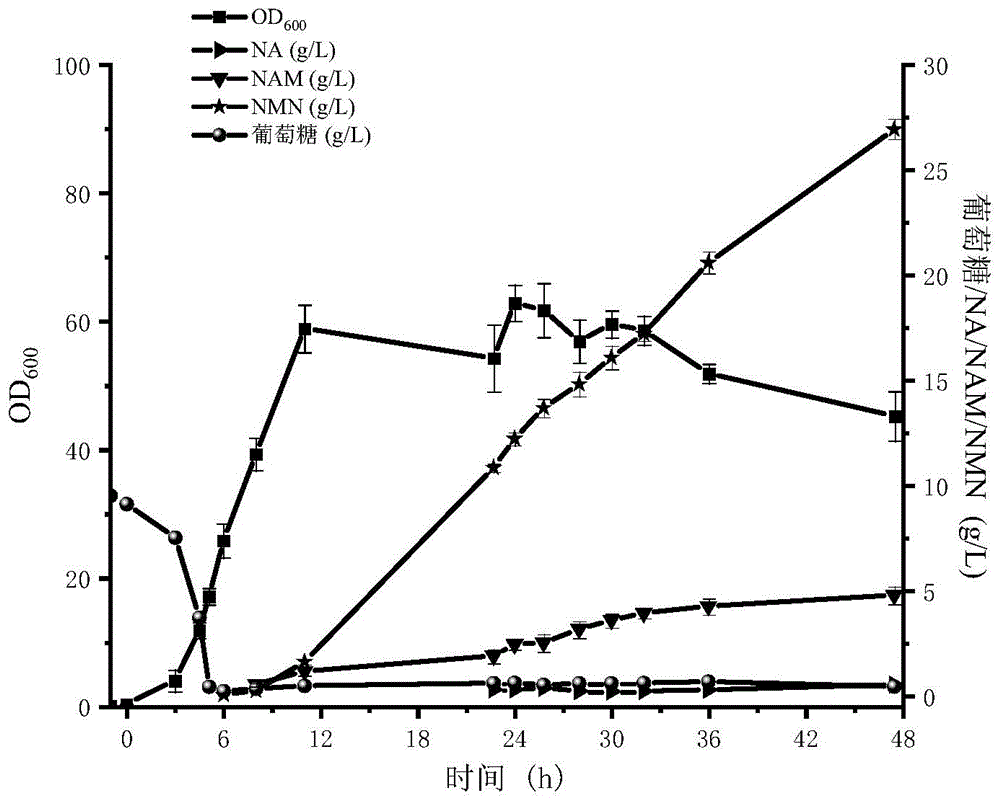
利用5L发酵罐进行扩大培养。将转化后的菌株在含有氨苄、链霉素、卡那霉素的LB固体平板上划线,于37℃培养12h;挑选单菌落至含有对应抗生素的液体LB中,培养10~12h;将发酵好的种子液以5~20%的接种量转接至含有2.5L发酵培养基(含卡那霉素50μg/μL、链霉素50μg/μL和氨苄青霉素50μg/μL)的5L发酵罐中,37℃培养;用氨水调节pH在6.0~7.2,通气量控制到0.2~4vvm,溶氧与转速关联控制到5~40%,转速控制范围为200~1000r/min。接种后4~6h,测定菌体OD,当OD
如图4所示,为发酵过程中OD
对比例1
对比例1与实施例1的区别仅在于,大肠杆菌的构建过程不同,具体不之处如下。
在对比例1中,将构建好的载体pET28a-BaPRS-VpNadV-Amp、pCDFDuet-BMpnuC以及空载体pRSFDeut-1转化到NMN驯化菌ME59的底盘细胞BM59中,发酵条件及控制方法与实施例1中一致。
如图5所示,为发酵过程中OD
本申请方案中,基于发明人前述研究中获得的产NMN工程菌株的基础上,对ME59驯化菌存在的副产物烟酸累积的问题进行了解决,通过引入NA合成NMN途径的两个关键基因pncB、NadE,具体采用质粒表达这两个关键基因,在重组工程菌株中成功增加了从NA合成NMN的代谢通路,经过5L发酵罐发酵验证,该重组工程菌株NMN产量高达27g/L,且几乎未检测到副产物NA,使得底物烟酰胺向NMN的摩尔转化率从57.15%提升至99.2%,具有显著的改善效果,
本申请中公开的重组工程菌株,能够有效降低生产成本并提高β-烟酰胺单核苷酸产量,且适合工业化的扩大生产。不仅具有重要的工业应用价值,将对β-烟酰胺单核苷酸在食品、药品、化妆品和饲料等领域的应用具有重要的社会价值和经济意义,也对其他发酵工艺中存在的类似问题提供了可行的解决思路,具有重要的借鉴意义。
以上所述,仅为本申请的实施例而已,本申请的保护范围并不受这些具体实施例的限制,而是由本申请的权利要求书来确定。对于本领域技术人员来说,本申请可以有各种更改和变化。凡在本申请的技术思想和原理之内所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
- 一种永磁同步电机定子和转子的装配装置
- 一种用于永磁同步电机装配装置及装配方法
- 一种大型混流式水轮发电机组转子联轴销套孔对心装置及使用方法
- 涡轮转子的装配装置及装配方法
- 电机转子组件、电机以及电机转子组件的装配方法
- 电机转子组件、电机以及电机转子组件的装配方法
