使用深度学习评定体外组织样品中的皮肤毒性
文献发布时间:2024-04-18 19:53:33
优先权
本申请根据35U.S.C.§119(e)要求2020年7月31日提交的美国临时专利申请号63/059486的权益,该临时专利申请以引用方式并入本文。
技术领域
本公开涉及使用诸如深度学习的机器学习算法来评估包括多层的组织样品的系统和方法。
背景技术
皮肤由两个主要层组成:表皮,即主要由角质形成细胞构成的薄层上皮,以及真皮,即由间充质细胞形成的厚层。对细胞周期或角质形成细胞的分化的任何破坏都会导致皮肤屏障受损,从而导致表皮厚度的改变和功能受损。表皮生长因子受体(EGFR)调节角质形成细胞的多种功能,包括增殖、粘附和迁移、存活和分化。因此,EGFR突变体经常与多种癌症相关联,包括乳腺癌、肺癌、卵巢癌、宫颈癌、膀胱癌、食道癌、脑癌、头癌和颈癌。针对突变型EGFR的疗法在皮肤上显示出靶向效应,并有皮疹迹象,使皮肤毒性成为在皮疹的严重程度危及生命的情况下剂量减少或治疗终止,以及接受癌症疗法的患者预后不良的主要原因。类似地,在用靶向丝裂原活化蛋白激酶(MAPK)和磷酸肌醇3激酶(PI3K)通路的药物治疗的患者中观察到不同严重程度的斑丘疹和/或痤疮样皮疹,并且在其发病、病程和治疗中密切反映了EGFR靶向化合物的皮肤毒性特征。皮肤毒性是与抑制表皮生长因子受体以及其他参与表皮生长和分化的靶标的药物相关联的常见安全问题。严重的皮肤毒性可能导致诸如添加到药物标签的警告语、剂量减少或终止,或EGFR靶向癌症疗法的预后不良等结果。最近,使用3D重建人体表皮模型实现了大规模药物筛选,并且展现了预测皮肤毒性的潜力。
为了克服手动收集数据的缺点,设计成识别并分类数据的机器学习模型现在被跨学科使用,从癌症检测和监测到药物开发和安全评定,以及被跨组织样品类型使用。然而,传统的机器学习算法无法对原始数据进行训练,而是需要对具有明确数据特征的输入数据集进行时间密集型训练。这些特征必须迭代细化以提高模型的预测能力。已经开发出基于神经网络的深度学习模型来克服这些限制。深度学习利用大型数据集和通用的非线性学习算法来训练多个隐藏的处理层,这些处理层负责识别不同的数据特征。模型本身基于输入数据来定义这些特征。
深度学习模型也可用于图像分析、分割和分类,前提是足够大的图像训练集可用于对应经注释像素级数据。深度学习已经应用于医学成像和药物毒理学的许多领域。其他深度学习方法利用细胞或组织中毒性引起的结构变化。此方法已经在体外用于基于荧光染色细胞核的改变来评定毒性,并且识别药物引起的心肌细胞和肝细胞的结构改变,所述结构改变对于标准图像分析来说过于细微。基于深度学习的图像分析也已经应用于卵巢毒性以及药物引起的视网膜萎缩和心肌病的体内啮齿动物模型。此外,开发了一种深度学习模型来预测接受肝胆系统癌症治疗的患者的辐射引起的毒性。最后,深度学习方法已经被建议作为一种使用已经针对脑成像开发的强大分割框架来识别神经毒性的方法。
发明内容
本文提供了涉及包括多层的组织样品的评估的系统和方法,包括但不限于重建人类表皮样品的皮肤毒性的确定。
相对于人类表皮样品,虽然在3-D重建组织暴露于引起皮肤毒性的药物时观察到表皮厚度减少,但病理学家对表皮层的厚度的评估是主观的,并且不易重现或不可扩展。此外,当采用人工评估策略时,组织当中细微的厚度差异以及大量待测试的样品可能会使交叉研究比较变得困难。本文所公开的实施例使用深度学习和图像处理算法来评定和测量组织样品的特定层的厚度,并且确定样品所指示的特定条件或效果。例如,在特定实施例中,可以使用深度学习和图像处理算法来测量来自多项研究的有活力的表皮厚度。实证研究表明,使用本文所述的技术测量的厚度不仅与病理学家的半量化评估显著相关,而且与病理学家所执行的量化测量密切一致。此外,当使用本文所公开的实施例的表皮厚度测量方法通过临床观察预测18种化合物的毒性时,实现了0.8的灵敏度和0.75的特异性。本文所公开的实施例中的方法可以是全自动的、可重现的、可转移的和高度可扩展的,这不仅在预测皮肤毒性方面展现出合理的准确性,而且还能够进行交叉研究比较、高通量化合物筛选和扩展到其他类型的组织样品。
在特定实施例中,数字病理图像处理系统可接收与在药物化合物的治疗之后的组织样品相关联的查询图像。数字病理图像处理系统然后可以基于经训练以识别组织样品层的机器学习模型来识别组织样品的目标层。数字病理图像处理系统可以进一步计算识别的目标层的归一化厚度。在特定实施例中,数字病理图像处理系统可以基于识别的目标层的归一化厚度来确定药物化合物的治疗的毒性指示。
附图说明
图1示出了根据本公开的一些实施例的可以使用的交互计算机系统的网络,如本文所述。
图2示出了用于确定重建人类表皮样品的皮肤毒性的示例性方法。
图3A示出了示例性重建人类表皮(RHE)模型。
图3B示出了RHE样品的示例性图像。
图3C示出了用于组织样品片段的测量的示例性测量位置。
图4A示出了用于训练机器学习模型的示例性RHE样品。
图4B示出了具有示例性块的RHE样品的示例性注释。
图5A示出了具有组织切片的RHE样品的示例性注释。
图5B示出了组织样品的厚度的示例性提取。
图5C示出了组织厚度的示例性归一化。
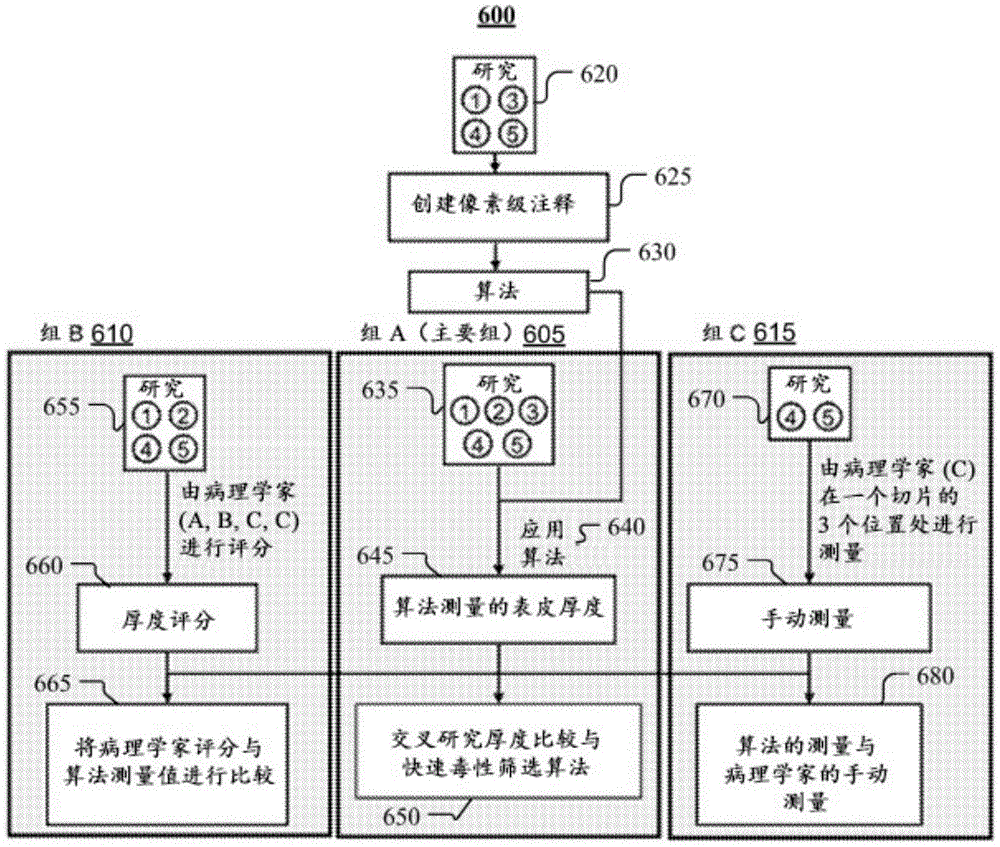
图6示出了回顾性研究的设计的示例性工作流程。
图7示出了来自使用图像查看器测量有活力的表皮厚度的病理学家的示例性代表性图像。
图8示出了机器学习模型对有活力的表皮区域的示例性分割。
图9示出了基于机器学习模型测量的归一化表皮厚度与来自病理学家的归一化评分之间的示例性箱线图。
图10示出了使用机器学习模型测量的有活力的表皮厚度与由病理学家测量的有活力的表皮厚度之间的示例性比较。
图11A示出了来自不同浓度下的各种化合物的示例性归一化有活力的表皮厚度。
图11B示出了显示皮肤毒性和未显示皮肤毒性的化合物的体外测试浓度对表皮厚度的示例性影响。
图12示出了组织样品的示例性分割。
图13A至图13C示出了示例性组织分割。
图14A至图14B示出了示例性测量的组织切片厚度。
图15示出了计算系统的示例。
具体实施方式
图1示出了根据本公开的一些实施例的可以使用的交互计算机系统的网络100,如本文所述。
数字病理图像生成系统120可以生成对应于特定样品的一个或多个全载玻片图像或其他相关数字病理图像。例如,由数字病理图像生成系统120生成的图像可以包括活检样品的染色切片。作为另一示例,由数字病理图像生成系统120生成的图像可以包括液体样品的载玻片图像(例如,血涂片)。作为另一示例,由数字病理图像生成系统120生成的图像可以包括荧光显微镜,诸如描绘荧光探针已经与靶DNA或RNA序列结合之后的荧光原位杂交(FISH)的载玻片图像。
一些类型的样品(例如,活检、固体样品和/或包括组织的样品)可以由样品制备系统121处理以固定和/或嵌入样品。样品制备系统121可以促进用固定剂(例如,液体固定剂,诸如甲醛溶液)和/或包埋物质(例如,组织学蜡)浸润样品。例如,样品固定子系统可通过将样品暴露于固定剂达至少阈值时间量(例如,至少3小时、至少6小时或至少13小时)来固定样品。脱水子系统可以使样品脱水(例如,通过将固定样品和/或固定样品的一部分暴露于一种或多种乙醇溶液)并可能使用澄清中间剂(例如,包括乙醇和组织学蜡)清除脱水样品。样品包埋子系统可以用加热的(例如,因此呈液体状)组织学石蜡来浸润样品(例如,一次或多次达对应的预定义时间段)。组织学蜡可以包括石蜡和可能的一种或多种树脂(例如,苯乙烯或聚乙烯)。然后可以冷却样品和蜡,然后可以将蜡浸润样品封闭。
样品切片器122可以接收固定和嵌入的样品并且可以产生一组切片。样品切片器122可以将固定和嵌入的样品暴露在低温或冷温下。然后样品切片器122可以切割冷冻样品(或其修剪版本)以产生一组切片。每个切片可以具有(例如)小于100μm、小于50μm、小于10μm或小于5μm的厚度。每个切片可以具有(例如)大于0.1μm、大于1μm、大于2μm或大于4μm的厚度。冷冻样品的切割可以在温水浴中(例如,在至少30℃、至少35℃或至少40℃的温度下)执行。
自动化染色系统123可以通过将每个切片暴露于一种或多种染色剂来促进对一个或多个样品切片的染色。每个切片可以在预定义时间段内暴露于预定体积的染色剂。在一些情况下,单个切片被同时或依次暴露于多种染色剂。
可以将一个或多个染色切片中的每个染色切片呈现给图像扫描仪124,该图像扫描仪可以捕获该切片的数字图像。图像扫描仪124可以包括显微照相机。图像扫描仪124可以在多个放大级别(例如,使用10x物镜、20x物镜、40x物镜等)捕获数字图像。图像的操作可用于在所需的放大倍率范围内捕获样品的选定部分。图像扫描仪124可以进一步捕获由人类操作员识别的注释和/或形态度量。在一些情况下,在捕获一个或多个图像之后,切片被返回到自动化染色系统123,使得切片可以被清洗、暴露于一种或多种其他染色剂并再次成像。当使用多种染色剂时,可以选择具有不同颜色配置的染色剂,使得可以将图像的对应于吸收大量第一染色剂的第一切片部分的第一区域与图像(或不同的图像)的对应于吸收大量第二染色剂的第二切片部分的第二区域区分开来。
应当理解,在一些情况下,数字病理图像生成系统120的一个或多个部件可以结合人类操作者进行操作。例如,人类操作员可以跨各个子系统(例如,样品制备系统121或数字病理图像生成系统120的子系统)移动样品和/或启动或终止一个或多个子系统、系统或数字病理图像生成系统120的部件的操作。作为另一示例,数字病理图像生成系统的一个或多个部件(例如,样品制备系统121的一个或多个子系统)的一部分或全部可以部分或全部用人类操作者的动作代替。
此外,应当理解,虽然数字病理图像生成系统120的各种描述和描绘的功能和部件涉及固体和/或活检样品的处理,但其他实施例可以涉及液体样品(例如,血液样品)。例如,数字病理图像生成系统120可以接收液体样品(例如,血液或尿液)载玻片,该载玻片包括基础载玻片、涂抹的液体样品和盖玻片。然后图像扫描仪124可以捕获样品载玻片的图像。数字病理图像生成系统120的其他实施例可以涉及使用本文所述的诸如FISH的高级成像技术来捕获样品的图像。例如,一旦将荧光探针引入样品并使其与靶序列结合,就可以使用适当的成像来捕获样品的图像以供进一步分析。
给定样品可以在处理和成像期间与一个或多个用户(例如,一个或多个医师、实验室技术人员和/或医疗提供者)相关联。关联用户可以包括,例如但不限于,订购产生被成像样品的测试或活检的人、有权接收测试或活检的结果的人,或对测试或活检样品进行分析的人等。例如,用户可以对应于医师、病理学家、临床医生或受试者。用户可以使用一个或一个用户装置130来提交以下一个或多个请求(例如,其识别受试者):由数字病理图像生成系统120处理样品并且由数字病理图像处理系统110处理所得图像。
数字病理图像生成系统120可以将图像扫描仪124所产生的图像传输回用户装置130。用户装置130然后与数字病理图像处理系统110通信以起始图像的自动处理。在一些情况下,数字病理图像生成系统120将图像扫描仪124所产生的图像直接提供到数字病理图像处理系统110,例如在用户装置130的用户的指示下。尽管未示出,但也可以使用其他中间装置(例如,连接到数字病理图像生成系统120或数字病理图像处理系统110的服务器的数据存储区)。除此之外,为了简单起见,在网络100中仅示出了一个数字病理图像处理系统110、图像生成系统120和用户装置130。本公开预期使用每种类型的系统和其部件中的一个或多个而不一定背离本公开的教导。
图1所示的网络100和相关联系统可以用于其中数字病理图像,诸如全载玻片图像的扫描和评估是工作的基本组成部分的各种情境。作为示例,网络100可以与临床环境相关联,其中用户出于可能的诊断目的评估样品。用户可以使用用户装置130来审查图像,之后将图像提供到数字病理图像处理系统110。用户可以将附加信息提供到数字病理图像处理系统110,该附加信息可以用于指导或指示数字病理图像处理系统110对图像的分析。例如,用户可以提供扫描内特征的预期诊断或初步评定。用户还可以提供附加情境,例如被检查的组织类型。作为另一示例,网络100可以与正在检查组织,例如,以确定药物的功效或潜在副作用的实验室环境相关联。在此情境下,提交多种类型的组织进行审查以确定该药物对全身的影响可能是司空见惯的事情。这可能会给人类扫描审查员带来特别的挑战,他们可能需要确定图像的各种情境,这可能高度依赖于被成像的组织类型。这些情境可以任选地提供到数字病理图像处理系统110。
数字病理图像处理系统110可以处理数字病理图像,包括全载玻片图像,以对数字病理图像进行分类并针对数字病理图像和相关输出生成注释。作为示例,数字病理图像处理系统110可以处理数字病理图像处理系统110所生成的组织样品的全载玻片图像或组织样品的全载玻片图像的块,以识别每个组织样品的层,计算每个层的厚度,并且基于计算出的厚度来提供毒性评定。数字病理图像处理系统110可以使用滑动窗口来在层之上生成掩模。除了用于识别组织切片外,掩模还可以用于测量厚度、确定层的面积、确定不同端点的长度、确定弯曲度的曲率,以及测量三维场景中的体积。数字病理图像处理系统110然后可以将查询图像裁剪成多个图像块。块生成模块111可以针对每个数字病理图像定义块的集合。为了定义块的集合,块生成模块111可以将数字病理图像分割成块的集合。如本文所体现,块可以是非重叠的(例如,每个块包括不包括在任何其他块中的图像的像素)或重叠的(例如,每个块包括在至少一个其他块中的图像的像素的某一部分)。除了每个块的尺寸和窗口的步幅(例如,块与后续块之间的图像距离或像素)之外,诸如是否块重叠的特征也可以增加或减少用于分析的数据集,其中更多块(例如,通过重叠或更小块)增加最终输出和可视化的潜在分辨率。在一些情况下,块生成模块111针对图像定义块的集合,其中每个块具有预定义尺寸和/或块之间的偏移是预定义的。继续以组织样品为示例,对于每个组织切片,可以将识别的组织区域裁剪成具有一定数量的像素的宽度和高度的图像块。此外,块生成模块111可以针对每个图像创建具有不同尺寸、重叠、步长等的块的多个集合。作为示例,像素的宽度和高度可以基于诸如评估任务、查询图像本身或任何合适的因素等因素来动态地确定(即,不固定)。在一些实施例中,数字病理图像本身可以包含块重叠,这可能是由成像技术引起的。无块重叠的平均分割可以是平衡块处理要求并避免影响本文讨论的嵌入生成和加权值生成的优选解决方案。可以例如通过计算每个尺寸/偏移的一个或多个性能度量(例如,精确度、召回率、准确度和/或误差),并且通过选择与高于预定阈值的一个或多个性能度量相关联和/或与一个或多个性能度量(例如,高精确度、高召回率、高准确度和/或低误差)相关联的块尺寸和/或偏移来确定块尺寸或块偏移。
块生成模块111还可以取决于检测到的异常的类型而定义块尺寸。例如,块生成模块111可以被配置为了解数字病理图像处理系统110将搜索的组织异常的类型并且可以根据组织异常定制块尺寸以改进检测。例如,图像生成模块111可以确定当组织异常包括搜索肺组织中的炎症或坏死时,应减小块尺寸以提高扫描速率,而当组织异常包括肝组织中的库普弗细胞的异常时,应增加块尺寸以增加数字病理图像处理系统110整体分析库普弗细胞的机会。在一些情况下,块生成模块111定义块的集合,其中对于每个图像的集合中的块的数量、集合中的块的尺寸、集合的块的分辨率或其他相关属性经定义,并且对于一个或多个图像中的每一个保持恒定。
如本文所体现,块生成模块111可以进一步沿着一个或多个颜色通道或颜色组合定义每个数字病理图像的块的集合。作为示例,由数字病理图像处理系统110接收到的数字病理图像可以包括大格式多色通道图像,这些图像具有针对若干颜色通道中的一个指定的图像的每个像素的像素颜色值。可以使用的示例性颜色规范或颜色空间包括RGB、CMYK、HSL、HSV或HSB颜色规范。可以基于分割颜色通道和/或生成每个块的亮度图或灰度图来定义块的集合。例如,对于图像的每个片段,块生成模块111可以提供红色块、蓝色块、绿色块和/或亮度块,或所使用的颜色规范的等效物。如本文所解释,基于图像的片段和/或片段的颜色值来分割数字病理图像可以提高用于生成块和图像的嵌入并产生图像分类的网络的准确度和识别率。此外,数字病理图像处理系统110,例如,使用块生成模块111,可以在颜色规范之间转换和/或使用多个颜色规范准备块的副本。可以基于所需类型的图像增强(例如,强调或增强特定颜色通道、饱和度水平、亮度水平等)来选择颜色规范转换。还可以选择颜色规范转换以提高数字病理图像生成系统120和数字病理图像处理系统110之间的兼容性。例如,特定图像扫描组件可以提供HSL颜色规范的输出,并且如本文所述,数字病理图像处理系统110中使用的模型可以使用RGB图像进行训练。将块转换成兼容的颜色规范可以确保仍可以分析块。另外,数字病理图像处理系统可以对以特定颜色深度(例如,8位、1位等)提供的图像进行上采样或下采样,以供数字病理图像处理系统使用。此外,数字病理图像处理系统110可以使得根据已捕获的图像的类型(例如,荧光图像可以包括关于颜色强度的更多细节或更广泛的颜色)转换块。
如本文所述,块嵌入模块112可以在对应特征嵌入空间中为每个块生成嵌入。嵌入可以由数字病理图像处理系统110表示为块的特征向量。块嵌入模块112可以使用神经网络(例如,卷积神经网络)来生成表示图像的每个块的特征向量。在特定实施例中,块嵌入神经网络可以基于对基于自然(例如,非医学)图像的数据集(诸如ImageNet数据集)进行训练的ResNet图像网络。通过使用非专门的块嵌入网络,块嵌入模块112可以利用在有效处理图像以生成嵌入方面的已知进展。此外,使用自然图像数据集允许嵌入神经网络学习在整体水平上辨别块片段之间的差异。
在其他实施例中,块嵌入模块112使用的块嵌入网络可以是经定制以处理大格式图像,诸如数字病理全载玻片图像的大量块的嵌入网络。另外,可以使用自定义数据集来训练由块嵌入模块112使用的块嵌入网络。例如,块嵌入网络可以使用全载玻片图像的各种样品进行训练,或甚至使用与嵌入网络将生成嵌入的主题(例如,特定组织类型的扫描)相关的样品进行训练。使用专门的或定制的图像的集合来训练块嵌入网络可以允许块嵌入网络识别块之间更细微差异,这可使得特征嵌入空间中的块之间的距离更详细和准确,但代价是需要附加时间来获取图像以及训练多个块生成网络以供块嵌入模块112使用的计算和经济成本。块嵌入模块112可以基于数字病理图像处理系统110正在处理的图像的类型来从块嵌入网络库中进行选择。
如本文所述,可以使用块的视觉特征来从深度学习神经网络生成块嵌入。可以根据与块关联的情境信息或根据块中显示的内容进一步生成块嵌入。例如,块嵌入可以包括一个或多个特征,这些特征指示和/或对应于所描绘对象的尺寸(例如,所描绘细胞或像差的尺寸)和/或所描绘对象的密度(例如,所描绘细胞或像差的密度)。尺寸和密度可以被绝对测量(例如,宽度以像素表示或从像素转换成纳米)或相对于来自同一数字病理图像、来自一类数字病理图像(例如,使用类似技术或通过单个数字病理图像生成系统或扫描仪来产生),或来自相关的数字病理图像系列的其他块。此外,可以在块嵌入模块112针对块生成嵌入之前对块进行分类,使得块嵌入模块112在准备嵌入时考虑分类。
为了一致性,块嵌入模块112产生预定义尺寸的嵌入(例如,512个元素的向量、2048字节的向量等)。块嵌入模块112可以产生各种且任意尺寸的嵌入。块嵌入模块112可以基于用户方向来调整嵌入的尺寸,或可以例如基于计算效率、准确度或其他参数来进行选择。在特定实施例中,嵌入尺寸可以基于生成嵌入的深度学习神经网络的限制或规范。较大的嵌入尺寸可以用于增加嵌入中捕获的信息量并且提高结果的质量和准确度,而较小的嵌入尺寸可以用于提高计算效率。
数字病理图像处理系统110可以通过将一个或多个机器学习模型应用于嵌入,即,将嵌入输入到机器学习模型来执行不同的推断。作为示例,数字病理图像处理系统110可以基于经训练以识别皮肤组织样品的层的机器学习模型来识别皮肤组织样品的表皮层。另外,角蛋白区域和表皮区域可以被分割。在一些实施例中,可能没有必要将图像裁剪成图像块,针对这些块生成嵌入,然后基于此类嵌入来执行推断。相反,数字病理图像处理系统110可以将机器学习模型直接应用于全载玻片图像的嵌入以用足够的GPU存储器进行推断。机器学习模型的输出可以调整成输入图像的形状。
全载玻片图像访问模块113可以管理来自数字病理图像处理系统110的其他模块以及用户装置130的访问全载玻片图像的请求。例如,全载玻片图像访问模块113接收请求以基于特定块、块的标识符或全载玻片图像的标识符来识别全载玻片图像。全载玻片图像访问模块113可以执行以下任务:确认全载玻片图像对请求的用户可用,识别从中检索请求的全载玻片图像的适当数据库,以及检索请求用户或模块可能感兴趣的任何附加元数据。另外,全载玻片图像访问模块113可以有效地处理将适当数据流式传输到请求装置。如本文所述,可以基于用户将希望看到全载玻片图像的部分的可能性来将全载玻片图像以组块的形式提供给用户装置。全载玻片图像访问模块113可以确定提供全载玻片图像的哪些区以及确定如何提供这些区。此外,可以在数字病理图像处理系统110内授权全载玻片图像访问模块113以确保没有单独的组件锁定或以其他方式误用数据库或全载玻片图像而损害其他组件或用户。
数字病理图像处理系统110的输出生成模块114可以基于用户请求来生成对应于结果块和结果全载玻片图像数据集的输出。如本文所述,输出可以包括基于请求类型和可用的数据的类型的各种可视化、交互式图形和报告。在许多实施例中,输出将被提供给用户装置130以供显示,但在某些实施例中,输出可以直接从数字病理图像处理系统110访问。输出将基于适当数据的存在和访问,因此输出生成模块将被授权根据需要访问必要的元数据和匿名患者信息。与数字病理图像处理系统110的其他模块一样,输出生成模块114可以按模块化方式进行更新和改进,使得新输出特征可以提供给用户而无需大量停机时间。
本文所述的一般技术可以集成到各种工具和用例中。例如,如所述的,用户(例如,病理学家或临床医生)可以访问与数字病理图像处理系统110通信的用户装置130并且提供查询图像以供分析。数字病理图像处理系统110或到数字病理图像处理系统的连接可以提供为独立的软件工具或包,该软件工具或包搜索对应的匹配项、识别类似的特征并且根据请求为用户生成适当输出。作为可以在简化的基础上购买或许可的独立工具或插件,该工具可用于增强研究或临床实验室的能力。另外,该工具可以集成到数字病理图像生成系统的客户可用的服务中。例如,该工具可以提供为统一的工作流程,其中执行或请求自动创建全载玻片图像的用户接收图像和/或先前已索引的类似全载玻片图像内值得注意的特征的报告。因此,除了改进全载玻片图像分析之外,这些技术还可以集成到现有系统中,以提供先前未考虑或不可能的附加功能。
此外,数字病理图像处理系统110可以被训练和定制以用于特定设置。例如,数字病理图像处理系统110可以被专门训练以用于提供与特定类型的组织(例如,肺、心脏、血液、肝脏等)相关的见解。作为另一示例,数字病理图像处理系统110可以被训练以辅助安全评定,例如确定与药物或其他潜在治疗相关联的毒性水平或程度。一旦被训练以用于特定主题或用例,数字病理图像处理系统110不一定限于该用例。由于至少部分标记或注释的图像的相对较大集合,可以在特定情境,例如,毒性评定中执行训练。
图2示出了用于确定组织样品的皮肤毒性的示例性方法200。该方法可以在步骤210处开始,其中数字病理图像处理系统110可以接收与在物化合物的治疗之后的组织样品相关联的查询图像。作为示例,在评估皮肤组织的情境下,组织样品可以包括重建人类表皮(RHE)样品,诸如图3B中所示的RHE样品310。在步骤220处,数字病理图像处理系统110可以基于经训练以识别组织样品层的机器学习模型来识别组织样品的目标层。作为示例,对于重建人类表皮(RHE)样品310,识别的目标层可以包括表皮层312。数字病理图像处理系统110可以首先执行图像处理。对于每个RHE样品,两个RHE组织切片(即,角蛋白层和有活力的表皮层)均可以被识别。边界框可以用于识别组织切片。另外,数字病理图像处理系统110可以使用滑动窗口来在层之上生成掩模。数字病理图像处理系统110然后可以使用块生成模块111来将查询图像裁剪成多个图像块。数字病理图像处理系统110然后可以通过将机器学习模型应用于裁剪的图像块来执行模型推断。机器学习模型的输出可以被调整成输入图像的形状,即,将机器学习模型的输出调整成查询图像的形状。因此,RHE组织区域可以通过机器学习模型推断出,并且角蛋白区域和表皮区域可以被分割。
在步骤230处,数字病理图像处理系统110可以计算识别的目标层的归一化厚度。在特定实施例中,数字病理图像处理系统110可以测量识别的目标层的若干位置处的厚度,直至并包括每个位置。数字病理图像处理系统110可以量化若干位置处的厚度,直至并包括所有位置。数字病理图像处理系统110然后可以将厚度端点提供给病理学家。在特定实施例中,数字病理图像处理系统110可以按不同方式操作以完成测量。作为示例而非作为限制,通过数字病理图像处理系统110进行的测量可以是完全自动化的和端到端的。作为另一示例而非作为限制,通过数字病理图像处理系统110进行的测量可以是人类引导的(例如,人类可以使用数字病理图像处理系统110来选择要测量或绘制近似测量值的位置)。作为示例而非作为限制,通过数字病理图像处理系统110进行的测量可以是人类辅助的(例如,数字病理图像处理系统可以向病理学家建议测量)。
在步骤240处,数字病理图像处理系统110可以基于识别的目标层的归一化厚度来确定药物化合物的治疗的毒性指示。在特定实施例中,毒性指示可以指示是否存在毒性,即,药物化合物的治疗的副作用。作为示例而非作为限制,毒性指示可以是二进制结果,例如,0指示不存在毒性,而1表示存在毒性。作为另一示例而非作为限制,毒性指示可以是指示毒性概率的评分,例如,0.75指示比0.2更高的毒性概率。作为又一示例而非作为限制,毒性指示可以是毒性程度,例如,5指示比1更严重的毒性。在特定实施例中,基于识别的目标层的归一化厚度来确定毒性指示可以基于将归一化厚度与阈值进行比较。例如,归一化厚度小于阈值可以揭示目标层厚度的减少,这可以进一步指示存在毒性。作为另一示例,归一化厚度等于或大于阈值可以指示不存在毒性。基于识别的目标层的归一化厚度来确定毒性指示还可以基于将归一化厚度与药物化合物的治疗之前的目标层的厚度进行比较。例如,归一化厚度小于药物化合物的治疗之前的目标层的厚度可以指示存在毒性。作为另一示例,归一化厚度等于或大于药物化合物的治疗之前的目标层的厚度可以指示不存在毒性。基于识别的目标层的归一化厚度来确定毒性指示还可以基于通过将归一化厚度除以药物化合物的治疗之前的目标层的厚度来计算出的百分比。例如,百分比小于10%可以指示非常严重的毒性;百分比在10%与50%之间可以指示严重毒性;百分比在50%与80%之间可以指示轻微毒性;并且百分比大于90%可以指示极少或无毒性。基于识别的目标层的归一化厚度来确定毒性指示还可以基于另一机器学习模型。例如,归一化厚度可以输入到该机器学习模型,该机器学习模型经训练以基于归一化厚度的输入来输出毒性指示。特定实施例可以在适当情况下重复图2的方法的一个或多个步骤。尽管本公开将图2的方法的特定步骤描述并示出为以特定顺序发生,但本公开考虑了图2的方法的任何合适步骤以任何合适顺序发生。此外,尽管本公开描述并示出了用于确定组织样品的皮肤毒性的示例性方法,包括图2的方法的特定步骤,但本公开考虑了用于确定组织样品的皮肤毒性的任何合适方法,包括任何合适步骤,这些步骤可以包括图2的方法的所有、一些步骤或不包括其步骤。此外,尽管本公开描述并示出了执行图2的方法的特定步骤的特定组件、装置或系统,但本公开考虑了执行图2的方法的任何合适步骤的任何合适组件、装置和系统的任何合适组合。
皮肤的表皮厚度的减少可以是皮肤毒性以及皮肤疾病的毒性指示。例如,可以通过将药物化合物的治疗之后的皮肤的表皮厚度除以治疗之前的表皮厚度来计算百分比。如果百分比小于10%,则可以指示非常严重的毒性;如果百分比在10%与50%之间,则可以指示严重毒性;如果百分比在50%与80%之间,则可以指示轻微毒性;并且如果百分比大于90%,则可以指示极少或无毒性。用于在临床试验之前评估体内皮肤毒性的临床前方法很少。过去二十年见证了体外人体皮肤模型的出现,这些模型在准确预测临床皮肤毒性方面有着可靠的记录。图3A示出了示例性重建人类表皮(RHE)模型300。这些重建人类表皮(RHE)模型300可以是源自培养的人类表皮角质形成细胞的正常人类表皮的代谢和有丝分裂活性3D模型。RHE模型300可以具有体内样形态和生长特征。在特定实施例中,使用RHE模型300可以对皮肤毒性具有合理的预测值。RHE模型300可以仅具有角质形成细胞,但没有真皮、脉管系统或免疫/炎症细胞。如图3A中所示,RHE模型300可以包括三个部分,即培养插入物302、组织304和介质306。
图3B示出了RHE样品310的示例性图像。如图3B中所示,RHE样品310可以包括有活力的表皮层312。由于表皮层312的厚度可以反映潜在毒性,因此可以测量RHE样品310中的表皮厚度以支持EGFR分子的皮肤毒性评定。在用感兴趣的药物培养之后,病理学家可以评估RHE样品310的皮肤毒性迹象,并且使用半量化方法来识别表皮厚度的改变。然而,此方法可能既费时又主观,从而导致药物开发时间更长,并且阻碍了皮肤毒性的交叉研究比较的能力。
除了基于RHE样品310来评估皮肤毒性之外,本文所公开的实施例还可以具有各种应用。作为示例而非作为限制,视网膜由多层构成,并且本文所公开的实施例可以用于评估视网膜厚度的改变。作为另一示例而非作为限制,本文所公开的实施例可以用于诊断设置(例如,使用活检样品)或评估潜在治疗和/或患者对可能开出的药物的不良反应。另外,本文所公开的实施例可以在实验室和/或安全评定环境之外使用。作为示例而非作为限制,组织样品的层的评定可以用作一套可用分析技术的部分以应用于数字病理学图像。在本文所公开的实施例中,将描述与皮肤组织的评估,且特别是与毒性指示相关的表皮厚度的评估相关的特定示例,但类似的技术可以应用于皮肤组织中任何其他合适指示的评估、皮肤组织的任何其他合适层的评估和/或在足够训练样品可用的情况下任何其他合适类型的组织的评估。
为了解决RHE样品310的皮肤毒性的人工评估的问题,本文所公开的实施例使用深度学习来识别RHE样品310的有活力的表皮并且辅助病理学家确定量化端点。使用本文所公开的实施例,执行了评估临床开发中的药物化合物的五项皮肤毒性研究。首先分析RHE样品310,并且然后提取量化表皮厚度端点。使用四项人工病理学家评估的研究来评定算法提取的表皮厚度。还将基于机器学习模型来提取的测量值与具有人工病理学家测量值的两项研究进行比较。最后,使用各自用已知或可疑皮肤毒性的化合物治疗的RHE样品310来评估本文所公开的实施例在识别具有高皮肤毒性风险的化合物中的效用。基于该模型与病理学家评估的成功比较,已开发出一种准确、可转移的模型,该模型用于评估与特定临床结果和适应症相关的组织样品片段厚度。
图3C示出了用于组织样品片段的测量的示例性位置。作为示例,在评估皮肤组织的情境下,组织样品可以包括重建人类表皮(RHE)样品310,并且识别的目标层可以包括表皮层312。在特定实施例中,数字病理图像处理系统110可以测量若干位置,例如,位置320a、位置320b、位置320c、位置320d、位置320e、位置320f、位置320g和位置320h处的厚度。作为示例,数字病理图像处理系统110可以测量每个预定或有活力的位置处的厚度。上述测量可以是图2中所示的步骤230的部分。
在特定实施例中,可以基于多个训练图像来训练机器学习模型。每个训练图像可以与RHE样品相关联。在特定实施例中,每个训练图像可以包括多个图像块。多个图像块中的每一个可以包括多个像素。多个像素中的每一个可以与指示对应像素属于第一层还是第二层(例如,目标层)的注释相关联。作为示例,在评估皮肤组织的情境下,第一层可以是角蛋白层,并且第二层可以是表皮层。换句话说,为了训练机器学习模型,可能需要来自多个样品的各种层的像素级注释,诸如来自多个RHE样品310的角蛋白层和有活力的表皮层312的多个注释。在特定实施例中,在训练期间,可以将各种数据增强应用于训练图像。作为示例而非作为限制,此类数据增强可以包括添加噪声、改变色调、改变对比度或弹性变换中的一个或多个。
注释可以由病理学家创建。作为示例而非作为限制,可以使用九个RHE样品310,并且可以按40X分辨率提取具有1024个像素的宽度和高度的图像块以及这些RHE样品310的对应像素级注释以用于训练机器学习模型。作为另一示例而非作为限制,可以使用四个RHE样品310,并且可以按2X、5X、10X、20X或60X分辨率提取具有128个、256个或512个像素的宽度和高度的图像块以及这些RHE样品310的对应像素级注释以用于训练机器学习模型。尽管本公开描述了与以特定方式按特定分辨率提取的具有特定宽度和高度的图像块以及对应像素级注释一起使用的特定数量的RHE样品,但本公开考虑了与以任何合适方式按任何合适分辨率提取的具有任何合适宽度和高度的图像块以及对应像素级注释一起使用的任何合适数量RHE样品。图4A示出了用于训练机器学习模型的示例性RHE样品310。图4B示出了具有示例性块的RHE样品310的示例性注释。如图4B中所示,示出了两个RHE样品310中的每一个中的带注释的表皮层312。另外,图像块410可以是提取的具有1024个像素的宽度和高度的块。
在特定实施例中,机器学习模型可以基于一个或多个不同的深度学习架构。具体地,机器学习模型可以基于深度学习算法。深度学习算法的架构可以基于U-net、Resnet U-net或深度残差神经网络中的一个或多个。作为示例而非作为限制,U-Net的变体Resnet U-net可以用于训练机器学习模型。Resnet U-net可以使用Keras或Tensorflow来进行训练。U-Net的编码器可以替换为深度残差神经网络(例如,50层版本),而U-Net架构的其余部分可以保持不变。在特定实施例中,使用GPU来用批尺寸8,以512的步长执行90个时期的模型训练。在训练过程期间还可以应用数据增强技术,包括随机旋转、裁剪、缩放、移位、添加噪声和改变颜色对比度。在特定实施例中,焦点损失和Adam优化器(例如,具有1x10
图5A至图5C示出了用于量化表皮层厚度的示例性步骤。在特定实施例中,一旦训练机器学习模型,数字病理图像处理系统110就可以使用该机器学习模型来识别目标层(例如,RHE样品310的表皮层312),这可以是图2中所示的步骤220。在评估皮肤组织的情境下,数字病理图像处理系统110可以接收与在药物化合物的治疗之后的重建人类表皮(RHE)样品310相关联的查询图像,这可以是图2中所示的步骤210。数字病理图像处理系统110可以首先执行图像处理,这可以是图2中的步骤220的部分。在特定实施例中,对于每个RHE样品310,两个RHE组织切片(即,角蛋白层和有活力的表皮层312)两者均可以被识别。在特定实施例中,边界框可以用于识别组织切片。另外,数字病理图像处理系统110可以使用滑动窗口来在层之上生成掩模。除了用于识别组织切片外,掩模还可以用于测量厚度、确定层的面积、确定不同端点的长度、确定弯曲度的曲率,以及测量三维场景中的体积。在特定实施例中,数字病理图像处理系统110可以将查询图像裁剪成多个图像块,这可以是图2中的步骤220的部分。作为示例而非作为限制,对于每个RHE组织切片,可以将识别的组织区域裁剪成具有1024个像素的宽度和高度的图像块。在特定实施例中,像素的宽度和高度可以基于诸如评估任务、查询图像本身或任何合适的因素等因素来动态地确定(即,不固定)。尽管本公开描述了以特定方式生成具有特定像素的宽度和高度的图像块,但本公开考虑了以任何合适方式生成具有任何合适像素的宽度和高度的任何合适图像块。数字病理图像处理系统110然后可以通过将经过训练的机器学习模型应用于裁剪的图像块,即,将多个图像块输入到机器学习模型来执行模型推断,这可以是图2中步骤220的部分。换句话说,数字病理图像处理系统110可以基于经训练以识别RHE样品的层的机器学习模型来识别RHE样品310的表皮层312。可以使用GPU来执行推断。在特定实施例中,可能不必将图像裁剪成图像块。相反,数字病理图像处理系统110可以将机器学习模型直接应用于查询图像以用足够的GPU存储器进行推断。机器学习模型的输出可以被调整成输入图像的形状,即,将机器学习模型的输出调整成查询图像的形状。RHE组织区域可以通过机器学习模型推断出,并且角蛋白区域和表皮区域312可以被分割。在特定实施例中,可以使用任何合适图像处理技术。作为示例而非作为限制,此类技术可以包括根据所使用的染色剂调整样品的颜色。在特定实施例中,病理学家可以检查分割以确保捕获角蛋白区域和表皮区域两者。
图5A示出了具有组织切片的RHE样品310的示例性注释。如图5A中所示,组织切片可以包括角蛋白层510和表皮层312。在识别表皮区域之后,可以计算有活力的表皮区域的厚度,例如,基于距离变换。在特定实施例中,中值厚度值可以用于表示每个组织切片的有活力的表皮区域的厚度,并且RHE样品310的两个组织切片的平均厚度可以用于表示单个RHE样品310。图5B示出了组织样品的厚度的示例性提取。如图5B中所示,数字病理图像处理系统110可以首先确定识别的目标层(例如,表皮层312)的中心线520,并且然后基于中心线520来计算其厚度。数字病理图像处理系统110可以识别与识别的目标层(例如,表皮层312)相关联的多个位置。数字病理图像处理系统110然后可以基于中心线来量化多个位置中的每一个的厚度值。数字病理图像处理系统110可以进一步基于多个位置的多个厚度值来确定识别的目标层(例如,表皮层312)的平均厚度值。在特定实施例中,数字病理图像处理系统110可以将识别的目标层(例如,表皮层312)的平均厚度值除以来自对照组的组织样品(例如,RHE样品310)的平均厚度值。这样,每个组织样品(例如,RHE样品310)的厚度可以被归一化。图5C示出了组织厚度的示例性归一化。如图5C中所示,可以存在包括四个样品的对照组,即包括四个样品的组A和包括四个样品的组B。图5C的左子图可以展示最初测量的厚度,而图5C的右子图可以展示归一化厚度。尽管本公开描述了以特定方式计算归一化厚度,但本公开考虑了以任何合适方式计算归一化厚度。作为示例而非作为限制,数字病理图像处理系统可以确定沿着基于表皮层确定的轴的多个逐步厚度测量,计算其中厚度从其导出的表皮层的长度和面积,并且然后相应地计算归一化厚度。
本文所公开的实施例进一步基于来自评估各种化合物的皮肤毒性的五项研究的RHE样品310来进行回顾性研究。表1总结了五项研究和每项研究可用的端点。3D体外人类皮肤模型用于所有研究。对总共31种已知或疑似临床皮肤毒性的化合物进行了皮肤毒性评估,其中一些化合物在多于一项研究中进行了评估。在接收到RHE样品310后,就将每个组织培养插入物转移到含有1mL/孔的预热维护介质的6孔板的孔中,并且在顶部保持干燥以维持气液界面。RHE样品310在37℃、5% CO
表1:研究样品量和注释的总结。
表2:化合物、剂量和样品量的总结。
/>
图6示出了回顾性研究的设计的示例性工作流程600。如图6中所示,回顾性研究可以基于三个组,即组A 605、组B 610和组C 615。工作流程600可以从RHE样品310的角蛋白层和有活力的表皮层312的像素级注释开始。作为示例而非作为限制,在创建像素级注释625的步骤处,可以有来自四项皮肤毒性研究620(即,研究1、研究3、研究4和研究5)的九个RHE样品310被注释。基于深度学习的机器学习模型(例如,如图6中所示的算法630)可以从这些样品进行训练以分割角蛋白层和有活力的表皮层312两者。然后可以使用经过训练的机器学习模型来分割有活力的表皮区域。接下来,可以处理由机器学习模型分割的有活力的表皮区域以计算厚度。在组A 605中,来自研究635(即,研究1-5)的分割的有活力的表皮层312可以用图像处理算法640进行量化。另外,在步骤650处,比较来自研究的每种化合物的样品的计算出的有活力的表皮厚度645,以便能够相对于组A进行快速毒性筛选。使用组B 610和组C 615来理解手动端点与基于机器学习模型的测量厚度之间的关系。在组B 610中,病理学家A、B、C和C分别对四项研究655(即,研究1、2、4和5)中RHE样品310的有活力的表皮厚度进行评分。研究3未由病理学家进行评分。在步骤665处,将厚度评分660与厚度的对应算法测量值(即,基于机器学习模型)进行比较。在组C 615中,向病理学家C提供了图像查看软件以测量两项研究670(即,研究4-5)的有活力的表皮厚度。在步骤680处,将病理学家测量的表皮厚度675与算法测量(即,基于机器学习模型)的厚度进行比较。
研究1、2、4和5中的RHE样品310由病理学家用光学显微镜进行评估。病理学家A、B、C和C分别对研究1、2、4和5中RHE样品310的有活力的表皮区域的厚度进行评分。每个病理学家使用不同的评分系统来评估有活力的表皮区域的厚度。病理学家A使用以下系统:明显表皮变薄、中度表皮变薄、轻度表皮变薄、可能的最小减少、无显著发现(与对照组相同)和可能的表皮厚度增加。病理学家B使用2至8的评分量表,范围如下:2至3(最薄)、3至4、4至5、6至7和7至8(与对照组相同)。病理学家C使用0–4的量表,其中0与对照组相同,增加到4,这是最薄的样品。为了能够进行交叉研究比较,病理学家的评分被归一化。对照组的评分被设置成1,并且然后重新调整,使得评分越高,有活力的表皮厚度越薄。表3总结了从病理学家评分到归一化评分的映射。
表3:病理学家评分到归一化评分的映射。
*:对无显著发现的样品进行评分。
除了手动评分之外,研究4和5中每个样品的有活力的表皮厚度由病理学家C使用图像查看软件进行测量。图7示出了来自使用图像查看器测量有活力的表皮厚度的病理学家的示例性代表性图像。如图7中所示,病理学家C从每个样品选择三个代表性区,即,区710、区720和区730,并且测量RHE组织的厚度,这导致每个样品有三个测量的表皮厚度端点。作为示例而非作为限制,这三个区的测量厚度可以分别为34.26um、37.97um和26.51um。将这三个测量值与基于机器学习模型确定的测量值进行比较。这些手动测量值还用于验证基于机器学习模型的厚度测量值,从而让病理学家了解基于机器学习模型的测量厚度与手动测量的厚度有多接近。为了帮助解释表皮厚度的任何有意义的改变,评定了特定微观特征的存在。评估由三位病理学家执行,并且包括对角质层和颗粒层的定性评估、角化不全的存在、单个或广泛的角质形成细胞坏死,以及角质形成细胞肿胀的证据,通常是由于空泡形成。
本文所公开的实施例还针对回顾性研究执行了统计分析。可以用不同的软件工具,诸如Python执行图像分析和统计分析。为了基于机器学习模型来评估病理学家评分与测量厚度之间的关系,计算了Kendall的Tau-b相关性系数。计算对于研究1、2、4和5的归一化病理学家评分与基于机器学习模型测量的归一化平均厚度之间的相关性。
还比较了来自机器学习模型和病理学家C的研究4-5中的量化厚度测量值。由于机器学习模型测量了整个RHE样品310的厚度,而手动测量仅在三个感兴趣区(ROI)处进行,因此两种测量之间的差异预计会随着进行更多的手动测量而减少。因此,首先从病理学家得出的三个测量值中随机选择一个厚度测量值。将每个样品的随机选择的测量值与该样品的机器学习模型的平均测量值进行比较。接下来,对于每个样品,将来自病理学家C的三个测量值的平均值与机器学习模型的平均测量值进行比较。例如,通过使用Bland-Altman方法,评定了研究4-5中模型测量的表皮厚度与病理学家C手动测量的厚度之间的一致性。
为了比较研究中的评级顺序,将对照样品的评级顺序设置成1。此外,随着有活力的表皮厚度的减少,评级顺序增加到最大值5。零或负评级顺序可以表明有活力的表皮厚度增加。为了简单起见,本文所公开的实施例将转换后的评级称为归一化病理学家评分。
将来自每个研究的归一化有活力的表皮厚度的平均厚度组合在一起,并且与每个测试化合物的归一化有活力的表皮厚度进行比较。来自不同研究的相同测试化合物和相同实验方案被组合。另外,使用了传统的多重比较方法。
基于回顾性研究,本文所公开的实施例发现基于机器学习模型测量的有活力的表皮厚度与病理学家评分显著相关。可以如下发现相关性。首先,机器学习模型可以针对来自每项研究的样品分割有活力的表皮区域。图8示出了机器学习模型对有活力的表皮区域的示例性分割。如图8中所示,经过训练的机器学习模型可以分割出有活力的表皮区域。当归一化表皮厚度大于1.0或小于0.75时,可准确识别有活力的表皮区域和角蛋白层。
图9示出了基于机器学习模型测量的归一化表皮厚度与来自病理学家的归一化评分之间的示例性箱线图。图9A示出了对于研究1的基于机器学习模型测量的归一化表皮厚度与来自病理学家A的归一化评分之间的示例性箱线图。图9B示出了对于研究2的基于机器学习模型测量的归一化表皮厚度与来自病理学家B的归一化评分之间的示例性箱线图。图9C示出了对于研究4的基于机器学习模型测量的归一化表皮厚度与来自病理学家C的归一化评分之间的示例性箱线图。图9D示出了对于研究5的基于机器学习模型测量的归一化表皮厚度与来自病理学家C的归一化评分之间的示例性箱线图。对照组的病理学据评分被设置成1,并且然后调整评分,使得评分越高,有活力的表皮厚度越薄。在每项研究中,将算法测量的表皮厚度归一化成对照组的平均厚度。计算了Kendall的Tau-b相关性系数。在基于机器学习模型测量的有活力的表皮厚度与来自病理学家的评分之间观察到显著相关性(研究1的R=-0.62,研究2的R=-0.76,4的-0.67,5的-0.84,所有研究的p<0.01)。值得注意的是,研究1中以临床相关浓度的10倍给药的三个样品被诊断为全厚度表皮坏死。这三个样品的测量厚度是零(图9A)。另外,在研究4中,由于显微镜下发现七个样品中角质形成细胞空泡变性和相关联的细胞肿胀,厚度评分的手动减少低于预期,这反映在基于机器学习模型计算的评分中。
回顾性研究还指示,表皮厚度的差异可能会随着手动测量的增加而减少。为了在病理学家厚度评估和基于机器学习模型的表皮区域的测量之间提供更准确的比较,病理学家C使用软件来手动测量RHE组织的三个ROI(位置)的表皮厚度。从三个ROI随机选择一个手动测量值,并且将该手动测量值与基于机器学习模型测量的厚度进行比较。比较基于Bland-Altman图,并且计算了绝对误差和标准偏差。图10示出了使用机器学习模型测量的有活力的表皮厚度与由病理学家测量的有活力的表皮厚度之间的示例性比较。图10A示出了在研究4中每个样品的单个组织切片的一个随机位置处由病理学家测量的有活力的表皮厚度与基于机器学习模型测量的有活力的表皮厚度之间的示例性比较。对于研究4,基于机器学习模型测量的表皮厚度与由病理学家测量的表皮厚度之间的绝对误差是1.55±0.959μm。图10B示出了在研究5中每个样品的单个组织切片的一个随机位置处由病理学家测量的有活力的表皮厚度与基于机器学习模型测量的有活力的表皮厚度之间的示例性比较。对于研究5,基于机器学习模型测量的表皮厚度与由病理学家测量的表皮厚度之间的绝对误差是1.25±1.200μm。图10C示出了在研究4中每个样品的单个组织切片的三个随机位置处由病理学家测量的有活力的表皮厚度与基于机器学习模型测量的有活力的表皮厚度之间的示例性比较。从多个位置测量的厚度被平均。图10D示出了在研究5中每个样品的单个组织切片的三个随机位置处由病理学家测量的有活力的表皮厚度与基于机器学习模型测量的有活力的表皮厚度之间的示例性比较。对于图10C至图10D,从多个位置测量的厚度被平均。对于研究4和研究5,当使用所有三个ROI来计算来自病理学家的平均测量厚度时,算法测量的表皮厚度与病理学家测量的表皮厚度之间的绝对误差分别减少到1.33±0.918μm和1.02±0.943μm。这些结果可以表明,随着手动病理学家测量和ROI的数量增加,测量的厚度可能会变得更类似于基于机器学习模型测量的结果。
在特定实施例中,归一化表皮厚度可以实现交叉研究比较并且揭示潜在临床毒性。从研究1、2、3、4和5提取具有临床观察结果的化合物的归一化表皮厚度,并且回顾性分析表皮厚度与临床皮肤毒性的相关性。临床皮肤毒性可被定义为市售化合物标签或报告临床开发中化合物安全性的出版物中描述的皮疹、瘙痒、痤疮、皮炎、脱发和/或皮肤干燥。图11A示出了来自不同浓度下的各种化合物的示例性归一化有活力的表皮厚度。基于机器学习模型获得归一化厚度。结果按研究中每个实验的中值表皮厚度排序。使用了传统的多重比较方法。在图11A中,括号中的数字表示样品尺寸(*:p<0.05,**:p<0.01)。研究1中以临床相关浓度的10倍给药的三个样品从该分析中移除。表皮厚度显著降低的总共八种化合物(阿法替尼、阿培利司、厄洛替尼、考比替尼、奥希替尼、波齐替尼、拉帕替尼和皮克利司)显示出临床毒性。相反,表皮厚度显著降低的三种化合物(托法替尼、鲁索替尼、Pf-04217903)没有表现出临床毒性。除Pf-04217903(10μM)外,归一化表皮厚度减少大于20%的所有化合物均显示出临床毒性。因此,基于识别的目标层(例如,表皮层312)的归一化厚度来确定药物化合物的治疗的毒性指示可以包括将归一化厚度与阈值厚度值进行比较。在特定实施例中,阈值可以基于机器学习方法来确定。作为示例而非作为限制,此类方法可以基于无监督学习。在替代性实施例中,基于识别的目标层(例如,表皮层312)的归一化厚度来确定药物化合物的治疗的毒性指示可以基于经训练以基于归一化厚度来确定毒性指示的另一机器学习模型。图11B示出了显示皮肤毒性和未显示皮肤毒性的化合物的体外测试浓度对表皮厚度的示例性影响。水平虚线指示归一化厚度减少20%。竖直虚线指示与临床暴露相比浓度增加5倍。在特定实施例中,数字病理图像处理系统110可以接收药物化合物的治疗的毒性的确认。作为示例而非作为限制,此类确认可以包括基于药物化合物的患者结果、进一步测试(诸如基于毒性指示起始的药物化合物的更集中测试)的结果或交叉研究比较中的一个或多个。数字病理图像处理系统110可以进一步基于确认来重新训练机器学习模型。
表4示出了测试化合物的测试浓度和临床血浆暴露的比较。显示了在测试浓度和临床暴露的情境下不同化合物的归一化厚度的平均值。大多数皮肤毒性化合物在浓度大于临床暴露(血浆中测量到的最大游离浓度,C
表4:测试化合物的测试浓度和临床血浆暴露的比较。
/>
*:血浆蛋白结合不可用。倍数计算中使用的总浓度。
表5总结了单独使用表皮厚度和结合测试浓度来回顾性识别皮肤毒性化合物的性能。鉴于在此回顾性分析中仅一种化合物引起增生性毒性,可能无法识别表皮厚度增加的阈值以捕获皮肤毒性。因此,XL-281未包括在性能分析中。
表5.单独表皮厚度和结合测试浓度来回顾性识别皮肤毒性化合物的性能总结。
本文所公开的实施例显示了与RHE模型中表皮厚度减少20%相对应的皮肤毒性风险阈值。尽管组织病理学表示生物医学研究中描述性数据的重要来源,但组织评分的使用可能会提高研究的可重现性。然而,此传统的病理评分方法可能是半量化的,因此存在主观偏差,并且非常耗时。另外,病理学家可能经常使用不同的评分系统来评估包括皮肤厚度的微观变化(如表3中所示),这使得区分表皮厚度的细微减少变得具有挑战性,并且无法对不同病理学家评分的研究进行比较。如所收集的数据所显示的,通过利用基于机器学习模型测量的厚度,可以更好地理解评分并且进一步归一化评分。本文所公开的实施例可以实现表皮厚度的快速、量化和准确测量,以捕获在传统的病理评估中通常不会被注意到的微米级的细微减少。除了改进表皮厚度的评分之外,从本文所公开的实施例导出的评分还可以帮助评估诸如视网膜等其他多层组织的厚度。
厚度的细微变化以及缺乏量化端点可能使评估厚度变得困难,特别是对于具有大样品量的研究。在本文所公开的回顾性研究中,可以观察到对于研究1、2、4和5的算法测量的组织厚度(例如,表皮厚度)与病理学家评分之间存在显著相关性。另外,样品量越小,相关性越强(在图9中,分别当N=16、44、64和96时,R=-0.84、-0.76、-0.67和-0.62)。这可以表明随着样品量增加,手动评估组织厚度(例如,表皮厚度)可能更具挑战性。组织厚度可能因组织样品内的位置而异。作为示例,在评估皮肤组织的情境下,表皮厚度在RHE样品310内可能因位置而异。尽管组织的中心部分可能存在更一致的厚度,但样品的边缘处的采集相关的伪影和基底层的分离可能进一步对评分过程造成挑战。为了捕获任何有意义的变化,病理学家通常可以在充分保存的区域中选择多个感兴趣区,进行测量并且报告所选择区的中值。图10显示数字工具可以将手动测量与基于机器学习模型的测量之间的差异最小化到小于二微米。此外,随着进行更多的手动测量,此差异可以减少。
若干因素可能潜在地影响由病理学家进行的手动测量。作为示例而非作为限制,不同的手动方法可能导致不同的厚度测量值。对于同一样品,从基底膜竖直测量的厚度可能容易与垂直于基底膜进行的测量不同。由于表皮区域的厚度变化,测量区的数量也可能影响测量值。最后,ROI选择以及测量起点和终点可能难以重现。因此,在重复实验期间,同一样品可能会产生不同的厚度值。尽管我们的结果显示手动测量与基于机器学习模型的测量之间的差异很小,但手动测量可能是主观的、不可重现的、耗时的、不可扩展的,并且因此不推荐使用,特别是当涉及大样品量时。
RHE模型300的一个警告可能是它不包含黑素细胞或免疫成分。人类皮肤的特点是表皮和毛发黑素细胞的数量不定,并且它包含各种免疫细胞群,包括朗格汉斯细胞、巨噬细胞、肥大细胞和真皮中的T细胞。缺乏上述成分可能使RHE模型300的免疫学意义有限,并且排除了黑素细胞对药物诱导的皮肤毒性的贡献的评估。然而,角质形成细胞的单独存在可能提供检查药物对单个细胞群的影响而不受其他细胞群的任何混杂影响的优势。除了测量表皮厚度外,样品的定性显微评估还可以进一步了解可能影响厚度本身的病理发现。作为示例而非作为限制,广泛表皮坏死的存在以及没有剩余的可测量层转换为零分。相反,存在空泡变性以及角质形成细胞增大、肿胀转换成表皮厚度轻微减少,从而导致得分低于预期。因此,定性显微评估可能仍然是揭示可能影响表皮厚度的自动评分系统的解释的潜在因素的关键。
在肿瘤学领域中,据报道,在接受EGFR抑制剂治疗的患者中,大部分患者出现了主要影响面部和上躯干的丘疹脓疱性皮疹。此中靶向效应可能并不令人惊讶,并且鉴于此毒性表示临床功效的指标,患者可能经常因给药而导致皮疹。本文所公开的回顾性分析可能已经证实,RHE模型300可以是测量EGFR抑制(例如阿法替尼、厄洛替尼、拉帕替尼、奥希替尼和波齐替尼)后皮肤毒性的有用工具。另外,RHE模型300可以对抑制PI3Kα/δ(皮克利司)、PI3Kα(阿培利司)和MEK(考比替尼)的药物有响应,概括了临床皮肤毒性表型8、14、31。相比之下,激酶抑制剂伊马替尼(比临床C
RHE模型300的预测值可能还需要置于化合物测试浓度的情境下。无论测试浓度如何(从临床C
在本文所公开的实施例中,RHE模型300用测试化合物处理四天,这比临床上皮肤毒性表现的时间过程更短。由于这些考虑,在RHE模型300中引起表皮变厚改变所需的化合物浓度可能高于临床上看到的最大暴露。因此,RHE模型300可能仅在化合物在等效于治疗性临床暴露的5倍或更高的浓度下进行测试时才具有良好的预测值。
如上所述,深度学习和图像处理算法可以提供表皮厚度的量化端点。本文所公开的实施例显示,从RHE模型300计算出的此表皮厚度可以反映潜在的临床皮肤毒性。本文所公开的实施例可以是完全自动化的、可扩展的和可重现的。因此,本文所公开的实施例可能潜在地提高化合物筛选的通量。随着时间的推移,随着收集到更多的量化数据,预测临床皮肤毒性的置信度可能只会增加。
在特定实施例中,机器学习模型可以用于识别RHE样品310的其他特征。作为示例而非作为限制,此类特征可以包括颜色、细胞尺寸、细胞形态、不同的细胞类型等。机器学习模型也可以用于体内皮肤,诸如来自动物或人类的活检,只要厚度测量感兴趣。作为示例而非作为限制,本文所公开的实施例可以提供更多评估或向病理学家提供体内活检的诊断。本文所公开的实施例还可以用于确定给定足够高分辨率的有活力的表皮层内的细胞的密度,并且在分割过程期间识别不同的细胞类型(例如,寻找特定类型的细胞死亡)。作为示例而非作为限制,本文所公开的实施例可以用于执行核计数而不是仅对层进行计数。机器学习模型可以进一步用于其他器官的分析。作为示例而非作为限制,此类器官可以包括眼球(即,视网膜中的不同层)。图12示出了组织样品的示例性分割。组织样品是食蟹猴皮肤。组织样品可能已被切割成一定角度。本文所公开的实施例可以利用食蟹猴皮肤中存在毛囊的信息来估计皮肤的厚度。
在特定实施例中,机器学习模型还可以用于基于一个或多个识别的层,诸如表皮层312的厚度来确定治疗功效。数字病理图像处理系统110可以接收与在药物化合物的治疗之后的重建人类表皮(RHE)样品310相关联的查询图像。数字病理图像处理系统110然后可以基于经训练以识别RHE样品310的层的机器学习模型来识别RHE样品310的表皮层312。在特定实施例中,数字病理图像处理系统110可以计算识别的表皮层312的归一化厚度。数字病理图像处理系统110可以进一步基于识别的表皮层312的归一化厚度来确定药物化合物的治疗的功效指示。在特定实施例中,基于识别的表皮层的归一化厚度来确定药物化合物的治疗的功效指示可以包括将归一化厚度与阈值厚度值进行比较。在特定实施例中,阈值可以基于机器学习方法,诸如无监督学习来确定。在替代性实施例中,基于表皮层312的归一化厚度来确定药物化合物的治疗的功效指示可以基于经训练以基于归一化厚度来确定功效指示的另一机器学习模型。在特定实施例中,数字病理图像处理系统110可以接收药物化合物的治疗的功效的确认。作为示例而非作为限制,此类确认可以包括基于药物化合物的患者结果、进一步测试(诸如基于功效指示起始的药物化合物的更集中测试)的结果或交叉研究比较中的一个或多个。数字病理图像处理系统110可以进一步基于确认来重新训练机器学习模型。
在特定实施例中,机器学习模型可以另外用于视网膜的视网膜分割和视网膜的厚度测量。在此情况下,组织样品可以包括重建眼睛样品,并且识别的目标层可以包括视网膜层。在特定实施例中,数字病理图像处理系统110可以基于多个训练图像来训练机器学习模型。每个训练图像可以与重建眼睛样品相关联。每个训练图像可以包括多个图像块。在特定实施例中,多个图像块中的每一个可以包括多个像素。多个像素中的每一个可以与指示对应像素是否属于视网膜层的注释相关联。基于此类机器学习模型,可以在眼睛图像内分割视网膜,例如,八个视网膜层。在特定实施例中,数字病理图像处理系统110可以进一步测量分割的视网膜的厚度。测量厚度也可以是相对厚度,而不仅仅是原始值。图13A至图13C示出了示例性组织分割。图13A示出了来自第一研究的示例性视网膜分割。在第一研究中,视网膜分割可以对应于具有不同层的理想眼球。图13B示出了来自第二研究的示例性视网膜分割。在第二研究中,视网膜分割可以对应于具有伪影的眼球或在眼球边缘切割组织的眼球。这些眼球可能不太适合评估,即,厚度比较。图13C示出了来自第三研究的示例性视网膜分割。在第三研究中,视网膜分割可以对应于比第一研究不理想但比第二研究更理想的眼球。
图14A至图14B示出了示例性测量的组织切片厚度。图14A示出了来自第一研究的示例性测量的视网膜厚度。特别地,右上方柱状图中的组3和组4展示与组1和组2相比更小的厚度。此观察结果可以表明可能存在影响视网膜正常病理的毒性。相比之下,对于其余柱状图,四组的厚度看起来类似。图14B示出了来自第二研究的示例性测量的视网膜厚度。
可以看出,由于本文所公开实施例检测特定层的厚度的改变的内在能力,因此当感兴趣的组织由多层(例如,视网膜)构成时,本文所公开的实施例可能有益于各种应用。
图15示出了示例性计算机系统1500。在特定实施例中,一个或多个计算机系统1500执行本文描述或示出的一种或多种方法的一个或多个步骤。在特定实施例中,一个或多个计算机系统1500提供本文描述或示出的功能。在特定实施例中,在一个或多个计算机系统1500上运行的软件执行本文描述或示出的一种或多种方法的一个或多个步骤,或者提供本文描述或示出的功能。特定实施例包括一个或多个计算机系统1500的一个或多个部分。在本文,在适当的情况下,对计算机系统的引用可包括计算设备,反之亦然。此外,在适当的情况下,对计算机系统的引用可包括一个或多个计算机系统。
本公开设想了任何合适数量的计算机系统1500。本公开设想了采用任何合适的物理形式的计算机系统1500。作为示例而非限制,计算机系统1500可为嵌入式计算机系统、片上系统(SOC)、单板计算机系统(SBC)(诸如例如模块上计算机(COM)或模块上系统(SOM))、台式计算机系统、膝上型电脑或笔记本计算机系统、交互式信息亭、大型机、计算机系统网格、移动电话、个人数字助理(PDA)、服务器、平板计算机系统或其中两个或更多个的组合。在适当的情况下,计算机系统1500可包括一个或多个计算机系统1500;可为一体的或分布式的;可跨越多个位置;可跨越多个机器;可跨越多个数据中心;或可驻留在云中,该云可包含一个或多个网络中的一个或多个云部件。在适当的情况下,一个或多个计算机系统1500可在无实质性空间或时间限制的情况下执行本文描述或示出的一种或多种方法的一个或多个步骤。作为示例而非限制,一个或多个计算机系统1500可实时地或以成批模式执行本文描述或示出的一种或多种方法的一个或多个步骤。在适当的情况下,一个或多个计算机系统1500可在不同的时间或在不同的位置执行本文描述或示出的一种或多种方法的一个或多个步骤。
在特定实施例中,计算机系统1500包括处理器1502、存储器1504、存储装置1506、输入/输出(I/O)接口1508、通信接口1510和总线1512。尽管本公开描述并示出了在特定布置中具有特定数量的特定部件的特定计算机系统,但本公开设想了在任何合适布置中具有任何合适数量的任何合适部件的任何合适计算机系统。
在特定实施例中,处理器1502包括用于执行指令的硬件,诸如构成计算机程序的那些硬件。作为示例而非限制,为了执行指令,处理器1502可从内部寄存器、内部高速缓存、存储器1504或存储装置1506检索(或提取)指令;可将这些指令解码并执行;并且然后可将一个或多个结果写入内部寄存器、内部高速缓存、存储器1504或存储装置1506。在特定实施例中,处理器1502可包括用于数据、指令或地址的一个或多个内部高速缓存。在适当的情况下,本公开设想了包括任何合适数量的任何合适内部高速缓存的处理器1502。作为示例而非限制,处理器1502可包括一个或多个指令高速缓存、一个或多个数据高速缓存以及一个或多个转换后备缓冲器(TLB)。指令高速缓存中的指令可为存储器1504或存储装置1506中的指令的副本,并且指令高速缓存可加速处理器1502对那些指令的检索。数据高速缓存中的数据可为:存储器1504或存储装置1506中的数据的副本,以供在处理器1502处执行的指令进行操作;在处理器1502执行的先前指令的结果,以供在处理器1502执行的后续指令进行访问或写入存储器1504或存储装置1506;或其他合适的数据。数据高速缓存可加速处理器1502的读取或写入操作。TLB可加速处理器1502的虚拟地址转换。在特定实施例中,处理器1502可包括用于数据、指令或地址的一个或多个内部寄存器。在适当的情况下,本公开设想了包括任何合适数量的任何合适内部寄存器的处理器1502。在适当的情况下,处理器1502可包括一个或多个算术逻辑单元(ALU);可为多核处理器;或可包括一个或多个处理器1502。尽管本公开描述并示出了特定处理器,但本公开设想了任何合适的处理器。
在特定实施例中,存储器1504包括主存储器,该主存储器用于存储供处理器1502执行的指令或供处理器1502对其进行操作的数据。作为示例而非限制,计算机系统1500可将来自存储装置1506或另一来源(诸如例如另一计算机系统1500)的指令加载到存储器1504。然后,处理器1502可将来自存储器1504的指令加载到内部寄存器或内部高速缓存。为了执行指令,处理器1502可从内部寄存器或内部高速缓存检索指令并将这些指令解码。在指令执行期间或之后,处理器1502可将一个或多个结果(其可为中间结果或最终结果)写入内部寄存器或内部高速缓存。然后,处理器1502可将那些结果中的一个或多个写入存储器1504。在特定实施例中,处理器1502仅执行一个或多个内部寄存器或内部高速缓存中或存储器1504(而非存储装置1506或其他地方)中的指令,并且仅对一个或多个内部寄存器或内部高速缓存中或存储器1504(而非存储装置1506或其他地方)中的数据进行操作。一个或多个存储器总线(其可各自包括地址总线和数据总线)可将处理器1502耦接至存储器1504。总线1512可包括一个或多个存储器总线,如下所述。在特定实施例中,一个或多个存储器管理单元(MMU)驻留在处理器1502和存储器1504之间,并且促进处理器1502所请求的对存储器1504的访问。在特定实施例中,存储器1504包括随机存取存储器(RAM)。在适当的情况下,该RAM可为易失性存储器。在适当的情况下,该RAM可为动态RAM(DRAM)或静态RAM(SRAM)。此外,在适当的情况下,该RAM可为单端口或多端口RAM。本公开设想了任何合适的RAM。在适当的情况下,存储器1504可包括一个或多个存储器1504。尽管本公开描述并示出了特定存储器,但本公开设想了任何合适的存储器。
在特定实施例中,存储装置1506包括用于数据或指令的海量存储装置。作为示例而非限制,存储装置1506可包括硬盘驱动器(HDD)、软盘驱动器、闪存存储器、光盘、磁光盘、磁带或通用串行总线(USB)驱动器或其中两个或更多个的组合。在适当的情况下,存储装置1506可包括可移动或不可移动(或固定)介质。在适当的情况下,存储装置1506可在计算机系统1500的内部或外部。在特定实施例中,存储装置1506为非易失性固态存储器。在特定实施例中,存储装置1506包括只读存储器(ROM)。在适当的情况下,该ROM可为掩模编程ROM、可编程ROM(PROM)、可擦除PROM(EPROM)、电可擦除(EEPROM)、电可改写ROM(EAROM)或闪存存储器或者其中两个或更多个的组合。本公开设想了采用任何合适的物理形式的海量存储装置1506。在适当的情况下,存储装置1506可包括一个或多个存储器控制单元,其促进处理器1502和存储装置1506之间的通信。在适当的情况下,存储装置1506可包括一个或多个存储装置1506。尽管本公开描述并示出了特定存储装置,但本公开设想了任何合适的存储装置。
在特定实施例中,I/O接口1508包括硬件、软件或两者,其提供用于在计算机系统1500与一个或多个I/O设备之间进行通信的一个或多个接口。在适当的情况下,计算机系统1500可包括这些I/O设备中的一者或多者。这些I/O设备中的一个或多个可实现人与计算机系统1500之间的通信。作为示例而非限制,I/O设备可包括键盘、小键盘、麦克风、监视器、鼠标、打印机、扫描仪、扬声器、静止相机、触控笔、平板计算机、触摸屏、轨迹球、摄像机、另一合适的I/O设备或其中两个或更多个的组合。I/O设备可包括一个或多个传感器。本公开设想了任何合适的I/O设备以及针对它们的任何合适的I/O接口1508。在适当的情况下,I/O接口1508可包括一个或多个设备或软件驱动器,使得处理器1502能够驱动这些I/O设备中的一者或多者。在适当的情况下,I/O接口1508可包括一个或多个I/O接口1508。尽管本公开描述并示出特定的I/O接口,但本公开涵盖任何合适的I/O接口。
在特定实施例中,通信接口1510包括硬件、软件或两者,其提供用于在计算机系统1500与一个或多个其他计算机系统1500或一个或多个网络之间的通信(诸如例如基于分组的通信)的一个或多个接口。作为示例而非限制,通信接口1510可包括用于与以太网或其他基于导线的网络进行通信的网络接口控制器(NIC)或网络适配器,或者用于与无线网络(诸如WI-FI网络)进行通信的无线NIC(WNIC)或无线适配器。本公开设想了任何合适的网络和针对它的任何合适的通信接口1510。作为示例而非限制,计算机系统1500可与自组织网络、个人局域网(PAN)、局域网(LAN)、广域网(WAN)、城域网(MAN)或者因特网的一个或多个部分或其中两个或更多个的组合进行通信。这些网络中的一个或多个的一个或多个部分可以是有线或无线的。作为示例,计算机系统1500可与无线PAN(WPAN)(诸如例如BLUETOOTHWPAN)、WI-FI网络、WI-MAX网络、蜂窝电话网络(诸如例如全球移动通信系统(GSM)网络)或其他合适的无线网络或其中两个或更多个的组合。在适当的情况下,计算机系统1500可包括用于这些网络中的任一个的任何合适的通信接口1510。在适当的情况下,通信接口1510可包括一个或多个通信接口1510。尽管本公开描述并示出特定的通信接口,但本公开涵盖任何合适的通信接口。
在特定实施例中,总线1512包括硬件、软件或计算机系统1500的两个相互耦合的部件。作为示例而非限制,总线1512可包括加速图形端口(AGP)或其他图形总线、增强型工业标准结构(EISA)总线、前端总线(FSB)、超传输(HT)互连、工业标准架构(ISA)总线、INFINIBAND互连、低引脚数(LPC)总线、存储器总线、微通道架构(MCA)总线、外围部件互连(PCI)总线、PCI-Express(PCIe)总线,串行高级技术附件(SATA)总线、视频电子设备标准协会本地(VLB)总线或另一种合适的总线或其中两个或更多个的组合。在适当的情况下,总线1512可包括一个或多个总线1512。尽管本公开描述并示出了特定总线,但本公开设想了任何合适的总线。
在本文,一种或多种计算机可读的非暂时性存储介质可包括一个或多个基于半导体或其他集成电路(IC)(诸如例如现场可编程门阵列(FPGA)或专用IC(ASIC))、硬盘驱动器(HDD)、混合硬盘驱动器(HHD)、光盘、光盘驱动器(ODD)、磁光盘、磁光盘驱动器、软盘、软盘驱动器(FDD)、磁带、固态驱动器(SSD)、RAM驱动器、SECURE DIGITAL卡或驱动器、任何其他合适的计算机可读的非暂时性存储介质或其中两个或更多个的任何合适组合。在适当的情况下,计算机可读的非暂时性存储介质可为易失性存储介质、非易失性存储介质或易失性存储介质和非易失性存储介质的组合。
在本文,“或”是包含性的而非排他性的,除非另有明确说明或上下文另有说明。因此,在本文,“A或B”指“A、B或两者”,除非另有明确说明或上下文另有说明。此外,在本文,“和”既是共同的又是各自的,除非另有明确说明或上下文另有说明。因此,在本文,“A和B”是指“A和B,共同地或各自地”,除非另有明确说明或上下文另有说明。
本公开的范围涵盖本领域普通技术人员将理解的对在本文描述或示出的示例性实施例的所有改变、替换、变化、变更和修改。本公开的范围不限于在本文描述或示出的示例性实施例。此外,尽管本公开将本文中的相应实施例描述和示出为包括特定的部件、元件、特征、功能、操作或步骤,但这些实施例中的任一个可包括本领域普通技术人员将理解的在本文任何地方描述或示出的任何部件、元件、特征、功能、操作或步骤的任何组合或排列。此外,在所附权利要求书中,对装置或系统或装置或系统的部件适配为、布置为、能够、配置为、使能够、可操作为或操作为执行特定功能的引用,涵盖该装置、系统、部件,无论其或该特定功能是否被激活、开启或解锁,只要该装置、系统或部件是如此适应、布置、能够、配置、使能、可操作或操作即可。另外,尽管本公开将特定实施例描述或示出为提供特定优点,但特定实施例可不提供这些优点、某些优点或全部优点。
- 用于使用比色免疫传感器检测来自上呼吸道的样品中SARS-CoV-2的体外方法及相关的比色免疫传感器
- 一种提取动物组织样品中病原核酸的试剂盒及其使用方法
