检测神经丝蛋白轻链的试剂盒与方法
文献发布时间:2024-04-18 19:58:21
技术领域
本申请属于免疫分析技术领域,尤其涉及一种检测神经丝蛋白轻链的试剂盒以及一种检测神经丝蛋白轻链的方法。
背景技术
神经丝(Neurofilaments,NFs)是专门位于神经元细胞质中的圆柱形蛋白质,以10nm细丝的形式存在于树突和神经元胞体以及轴突中,并赋予了神经元结构稳定性。NFs主要由三种多肽组成,其大小分别为200kDa、150kDa和68kDa,分别为神经丝重链(Neurofilament heavy chain,NF-H)、神经丝中链(Neurofilament medium chain,NF-M)和神经丝轻链(Neurofilament light chain,NF-L)。
NF-L是NFs的骨架,它是最丰富的亚基,也是最可溶的亚基。在正常条件下,NF-L以年龄依赖的方式不断从轴突中释放,在老年时会产生较高水平的NF-L。当机体处于炎症、神经退行性疾病、创伤或血管损伤引起的中枢神经系统(Central nervous system,CNS)轴突损伤的反应中,NF-L的释放急剧增加。神经系统疾病患者CSF中NF-L的浓度高于对照组,并且现有结果已证实血清NF-L水平与CSF中的NF-L水平密切相关。NF-L的潜在诊断价值在于对中枢神经系统疾病的损伤程度、疾病进展以及神经退行性疾病和非神经退行性病变的区分。相比较PET-CT、MRI等影像学手段,NF-L的免疫学监测有助于加强医生对CNS损伤的动态追踪,提升诊疗效果,优化预后管理并可带来显著的社会效益与经济效益。
然而,目前现有的NF-L的检测平台主要有以下几个缺点:
(1)检测时间过长
目前NF-L的检测平台主要为酶联免疫和化学发光(包含管式和板式化学发光)等平台。对于酶联免疫和板式化学发光平台,常需要一个较长的孵育时间,一般为0.5~2h。现有管式化学发光平台常使用两步法来提升检测性能,但是相应的会增加检测时间。如刘志敏等人的数据显示其神经丝轻链蛋白含量的直接化学发光法试剂盒为30分钟内,邱春明等人开发的定量检测神经丝轻链蛋白的试剂盒需要37℃分别孵育15分钟和17分钟。这样的检测时长无疑为临床检验科室/体检科室的高通量、高效率NF-L检测带来了困扰。
(2)线性范围窄
更宽的线性范围可以保证样本无需稀释即可完成检测,这样无疑可以减少检测次数并消除因样本稀释而造成的检测偏差。唐雨德等人开发的NF-L板式化学发光免疫检测系统的线性区间为1.6~1000pg/mL,而王国武等人开发的一种测定人体神经丝轻链蛋白含量的磁微粒化学发光检测试剂盒线性区间仅为0~500pg/mL。根据Norgren等人在2003年发表的数据,其多发性硬化(MS)脑脊液NF-L浓度均值达到2500pg/mL,远高于现有报道中的检测上限。因此还需要借助技术改良来大幅扩大试剂盒的线性范围。
(3)检测样本局限
Gaetani在2019年发表的NF-L系统性综述中写道:脑脊液和血液NF-L可以指导临床医生对潜在神经退行性疾病患者进行进一步诊断和检查;脑脊液和血清NF-L均增加也是多发性硬化症最常见的鉴别诊断之一。但是目前大部分相关专利和文献中,所涉及的NF-L测定试剂盒主要针对血清或脑脊液而并不能够同时检测二者。
发明内容
基于上述描述,当前NF-L检测系统还有很多不足,限制了NF-L免疫学检测在CNS损伤诊断、疗效评估和预后评估等方向的应用。针对现有技术中存在的不足,本申请提供一种检测神经丝蛋白轻链的试剂盒,以及所述试剂盒在制备用于检测神经丝蛋白轻链和/或用于诊断神经系统疾病的产品中的用途,还提供一种检测样品中神经丝蛋白轻链含量的方法,本申请的试剂盒以一对高亲和力且性能稳定的重组抗体作为核心原料,线性范围宽,检测时间短,且能同时检测血清和脑脊液中的NF-L。
本申请的具体技术方案如下:
1.一种检测神经丝蛋白轻链的试剂盒,其中,所述试剂盒包括:
生物素偶联的靶向神经丝蛋白轻链的第一抗体、经标记物标记的靶向神经丝蛋白轻链的第二抗体和磁珠,其中所述磁珠为链霉亲和素磁珠;或者
靶向神经丝蛋白轻链的第一抗体包被的磁珠和经标记物标记的靶向神经丝蛋白轻链的第二抗体,其中所述磁珠为甲苯磺酰活化的磁珠。
2.根据项1所述的试剂盒,其中,所述磁珠的粒径为1~5μM;
优选地,所述甲苯磺酰活化的磁珠的粒径为1.5~3μM;
优选地,所述链霉亲和素磁珠的粒径为1.5~3μM,进一步优选为1.5~2μM。
3.根据项1或2所述的试剂盒,其中,所述靶向神经丝蛋白轻链的第一抗体与生物素的物质的量之比为1:(3~40),优选为1:(3~9)。
4.根据项1~3中任一项所述的试剂盒,其中,所述靶向神经丝蛋白轻链的第一抗体与磁珠的质量比为1:(100~5000),优选为1:(500~2000);
优选地,所述靶向神经丝蛋白轻链的第二抗体与标记物的物质的量之比为1:(3~40),优选为1:(3~9);
5.根据项1~4中任一项所述的试剂盒,其中,所述试剂盒还包括神经丝蛋白轻链标准品、底物、洗涤液、磁珠稀释液、偶联抗体稀释液、标记抗体稀释液和样品稀释液;或者,所述试剂盒还包括神经丝蛋白轻链标准品、底物、封闭液、包被抗体稀释液、标记抗体稀释液和样品稀释液。
6.根据项1~5中任一项所述的试剂盒,其中,
所述靶向神经丝蛋白轻链的第一抗体包含三个重链互补决定区(CDR-H1、CDR-H2、CDR-H3)和三个轻链互补决定区(CDR-L1、CDR-L2、CDR-L3),其中:
所述CDR-H1的氨基酸序列如SEQ ID No:1所示;
所述CDR-H2的氨基酸序列如SEQ ID No:3所示;
所述CDR-H3的氨基酸序列如SEQ ID No:5所示;
所述CDR-L1的氨基酸序列如SEQ ID No:7所示,
所述CDR-L2的氨基酸序列如SEQ ID No:9所示;
所述CDR-L3的氨基酸序列如SEQ ID No:11所示;
所述靶向神经丝蛋白轻链的第二抗体包含三个重链互补决定区(CDR-H1、CDR-H2、CDR-H3)和三个轻链互补决定区(CDR-L1、CDR-L2、CDR-L3),其中:
所述CDR-H1的氨基酸序列如SEQ ID No:2所示;
所述CDR-H2的氨基酸序列如SEQ ID No:4所示;
所述CDR-H3的氨基酸序列如SEQ ID No:6所示;
所述CDR-L1的氨基酸序列如SEQ ID No:8所示;
所述CDR-L2的氨基酸序列如SEQ ID No:10所示;
所述CDR-L3的氨基酸序列如SEQ ID No:12所示。
7.根据项1~6中任一项所述的试剂盒,其中,
所述靶向神经丝蛋白轻链的第一抗体包含重链可变区和轻链可变区,其中:重链可变区的氨基酸序列如SEQ ID No:13所示,或为与SEQ ID No:13具有90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的氨基酸序列;轻链可变区的氨基酸序列如SEQ ID No:15所示,或为与SEQ ID No:15具有90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的氨基酸序列;
所述靶向神经丝蛋白轻链的第二抗体包含重链可变区和轻链可变区,其中:重链可变区的氨基酸序列如SEQ ID No:14所示,或为与SEQ ID No:14具有90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的氨基酸序列;轻链可变区的氨基酸序列如SEQ ID No:16所示,或为与SEQ ID No:16具有90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的氨基酸序列。
8.根据项1~7中任一项所述的试剂盒,其中,其用于诊断神经系统疾病;
优选地,所述神经系统疾病为中枢神经系统疾病;
优选地,所述神经系统疾病为神经退行性疾病。
9.项1~8中任一项所述的试剂盒在制备用于检测神经丝蛋白轻链和/或用于诊断神经系统疾病的产品中的用途;
优选地,所述神经系统疾病为中枢神经系统疾病;
优选地,所述神经系统疾病为神经退行性疾病。
10.一种检测样品中神经丝蛋白轻链含量的方法,其中,所述方法包括以下步骤:
反应:将待测样品、生物素偶联的靶向神经丝蛋白轻链的第一抗体、经标记物标记的靶向神经丝蛋白轻链的第二抗体混合,孵育后加入磁珠,再进行孵育;
测定发光值:洗涤后加入底物,测定待测样品的发光值;
计算含量:利用神经丝蛋白轻链标准品的发光值计算出待测样品中神经丝蛋白轻链的含量;
其中,所述磁珠为链霉亲和素磁珠。
11.一种检测样品中神经丝蛋白轻链含量的方法,其中,所述方法包括以下步骤:
反应:将待测样品、生物素偶联的靶向神经丝蛋白轻链的第一抗体、经标记物标记的靶向神经丝蛋白轻链的第二抗体和磁珠混合,孵育;
测定发光值:洗涤后加入底物,测定待测样品的发光值;
计算含量:利用神经丝蛋白轻链标准品的发光值计算出待测样品中神经丝蛋白轻链的含量;
其中,所述磁珠为链霉亲和素磁珠。
12.一种检测样品中神经丝蛋白轻链含量的方法,其中,所述方法包括以下步骤:
反应:将待测样品、靶向神经丝蛋白轻链的第一抗体包被的磁珠和经标记物标记的靶向神经丝蛋白轻链的第二抗体混合,孵育后进行磁分离;
测定发光值:洗涤后加入底物,测定待测样品的发光值;
计算含量:利用神经丝蛋白轻链标准品的发光值计算出待测样品中神经丝蛋白轻链的含量;
其中,所述磁珠为甲苯磺酰活化的磁珠。
13.根据项10~12中任一项所述的方法,其中,所述磁珠的粒径为1~5μM,优选为1.5~3μM。
14.根据项10或11所述的方法,其中,所述链霉亲和素磁珠的粒径为1.5~2μM。
15.根据项10或11所述的方法,其中,所述靶向神经丝蛋白轻链的第一抗体与生物素的物质的量之比为1:(3~40),优选为1:(3~9)。
16.根据项10~12中任一项所述的方法,其中,
所述靶向神经丝蛋白轻链的第一抗体与磁珠的质量比为1:(100~5000),优选为1:(500~2000);
优选地,所述靶向神经丝蛋白轻链的第二抗体与标记物的物质的量之比为1:(3~40),优选为1:(3~9)。
17.根据项10~16中任一项所述的方法,其中,所述待测样品为血清或脑脊液;
优选地,所述待测样品至少为50μL,优选至少为100μL;
更优选地,每微升待测样品,需要使用0.1~0.5ng靶向神经丝蛋白轻链的第一抗体和0.05~0.25ng靶向神经丝蛋白轻链的第二抗体。
18.根据项10~17中任一项所述的方法,其中,所述靶向神经丝蛋白轻链的第一抗体、靶向神经丝蛋白轻链的第二抗体为项6或7中所述的靶向神经丝蛋白轻链的第一抗体、靶向神经丝蛋白轻链的第二抗体。
发明的效果
本申请的检测NF-L的试剂盒,以一对性能优异且稳定、亲和力高、灵敏度高、生产周期短的重组抗体作为核心原料,并使用特定的磁珠,更适合应用于体外诊断试剂领域。其中,本申请采用的高亲和力抗体对抗原表位识别能力更强,与抗原之间的结合程度更高,从而具备更强的低丰度靶抗原捕获的能力,为试剂盒提供一个更低的检出限。同时,高亲和力抗体可以增强单位质量磁珠或其他介质的抗原抓取能力,进而不产生Hook效应的前提下明显提升试剂盒的线性范围。本申请所使用的磁珠为特定的甲苯磺酰活化的磁珠或链霉亲和素磁珠,检出限数值更低,线性范围更宽,检测灵敏度高。进一步地,本申请的试剂盒操作简单、自动化程度高以及均相反应体系等优势,借助一步法的反应系统可以进一步缩短检测时间。本申请的试剂盒既能够检测血清中的NF-L水平,也能够检测脑脊液中的NF-L水平。
附图说明
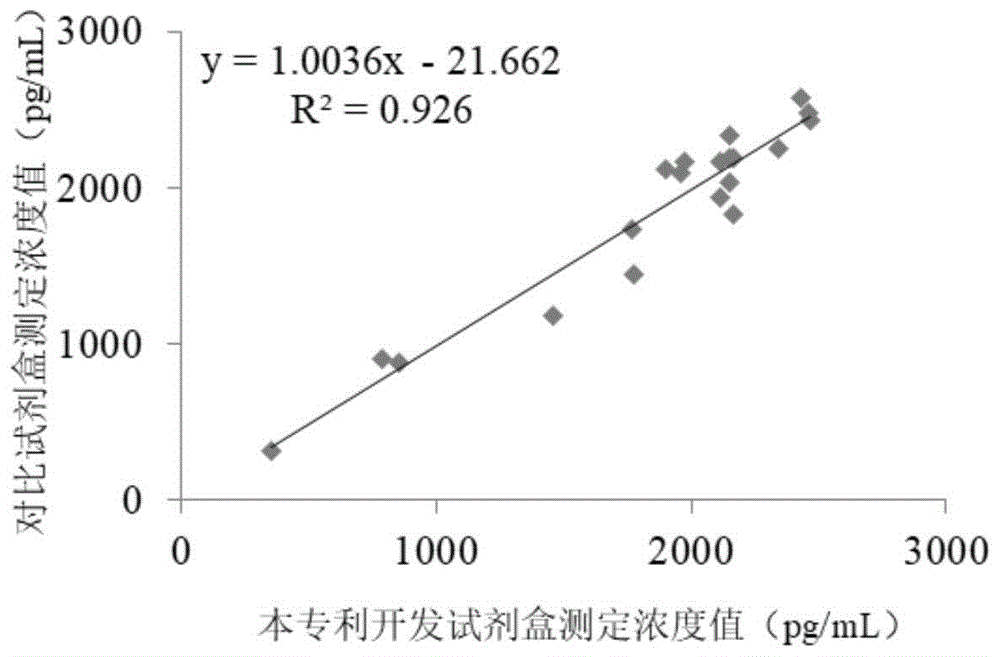
图1为采用本申请的NF-L试剂盒与采用进口高敏检测平台产品检测的脑脊液样本中NF-L含量的一致性分析结果。
图2为采用本申请的NF-L试剂盒与采用进口高敏检测平台产品检测的血液样本中NF-L含量的一致性分析结果。
具体实施方式
下面结合具体实施方式对本申请做进一步的详细描述,给出的实施方式是为了能够更透彻地理解本申请,并且能够将本申请的范围完整的传达给本领域的技术人员。本说明书中提及的科技术语具有与本领域技术人员通常理解的含义相同的含义,如有冲突以本说明书中的定义为准。
在本文中,“神经丝蛋白”是构成神经细胞轴突起骨架作用的中间丝蛋白,位于神经细胞轴突中,作为骨架成分之一参与轴突的纤维系统组成,其作用是稳定轴突的形态,保持其直径及维持其稳定的传导速度,并在神经细胞分化、轴突生长和再生等过程中发挥作用。神经丝蛋白包括神经丝蛋白轻链(NF-L)、神经丝蛋白中链(NF-M)、神经丝蛋白重链(NF-H)三种亚结构。其中NF-L虽然分子量最小,但功能却最重要,因为NF-L是三种亚结构蛋白中唯一可完成功能性纤维自我组装的神经丝蛋白。NF-L是专门位于神经元细胞质中的圆柱形蛋白。在正常情况下,低水平的NF-L不断地从轴突中释放出来,在年老时释放出更高水平的NF-L。然而,在中枢神经系统轴突因炎症、神经退行性、创伤或血管损伤而受损时,NF-L的释放急剧增加。
在本文中,术语“重组抗原”是指在将抗原基因连接至载体后转入原核或真核细胞中,体外重组表达纯化得来的抗原。在一个实施方式中,本申请使用的重组抗原为商业化NF-L重组抗原。
在本文中,术语“重组抗体”是将免疫特异性重链和轻链抗体基因克隆到高效表达载体,再将这些载体引入表达宿主(例如细菌、酵母或哺乳动物)中进行抗体表达而得到的抗体。本申请的抗体可以是全人源化抗体、人源化抗体、嵌合抗体等。
在一些实施方式中,本申请的NF-L重组抗体是利用NF-L重组抗原免疫动物后获得的抗体。
在一些实施方式中,本申请的重组抗体为全长抗体,全长抗体典型地是指由两条“重链”和两条“轻链”组成的抗体。“重链”通常是这样的多肽,其在N端到C端方向由重链可变区(VH)、重链恒定区1(CH1),铰链区(HR),抗体重链恒定区2(CH2),和重链恒定区3(CH3)组成,缩写为VH-CH1-HR-CH2-CH3;在一些实施方式中,“全长抗体重链”是在N端到C端方向由VH,CH1,HR,CH2和CH3组成的多肽。“全长抗体轻链”通常是在N端到C端方向由轻链可变区(VL),和轻链恒定区(CL)组成的多肽,缩写为VL-CL。
本申请中,所述轻链恒定区、重链恒定区可以为任意的轻链恒定区、重链恒定区。所述轻链恒定区(CL)可以是κ(kappa)或λ(lambda)。所述重链恒定区可以是IgG、IgM、IgA、IgE、IgD中的任意一种的重链恒定区。
本领域技术人员公知,每个重链可变区可由三个互补决定区(CDR)和四个框架区(FR)区构成,每个轻链可变区可由三个互补决定区(CDR)和四个框架区(FR)区构成,互补决定区(CDR,通常有CDR1、CDR2及CDR3)是可变区中对抗体的亲和力和特异性影响最大的区域。在一些实施方式中,从N-末端至C-末端,重链可变区与轻链可变区均包含FR1、CDR1、FR2、CDR2、FR3、CDR3与FR4。重链可变区或轻链可变区的CDR序列有两种常见的定义方式,即Kabat定义和Chothia定义,例如参见Kabat et al.,“Sequences of ProteinsofImmunological Interest”,National Institutes of Health,Bethesda,MD.(1991);Al-Lazikani et al.,J MolBiol 273:927-948(1997);以及Martin et al.,Proc.Natl.Acad.Sci.USA 86:9268-9272(1989)。对于给定抗体的可变区序列,可以根据Kabat定义或者Chothia定义来确定重链可变区或轻链可变区序列中CDR序列。在本申请的实施方案中,利用Chothia定义确定CDR序列。
在本文中,术语“同一性”或被定义为经过序列比对和引入空位后,氨基酸或核苷酸序列变体中相同的残基的百分比。用于比对的方法和计算机程序在本领域内是公知的。在本文中,提及的与氨基酸序列具有百分比同一性的氨基酸序列是指在所提及的氨基酸序列的整个长度上具有所述百分比同一性的序列。
在本文中,术语“载体”通常是指能够在合适的宿主中自我复制的核酸分子,其将插入的核酸分子转移到宿主细胞中和/或宿主细胞之间。所述载体可包括主要用于将DNA或RNA插入细胞中的载体、主要用于复制DNA或RNA的载体,以及主要用于DNA或RNA的转录和/或翻译的表达的载体。所述载体还包括具有多种上述功能的载体。所述载体可以是当引入合适的宿主细胞时能够转录并翻译成多肽的多核苷酸。通常,通过培养包含所述载体的合适的宿主细胞,所述载体可以产生期望的表达产物。
在本文中,术语“核酸”或“多核苷酸”或“核酸分子”通常是指脱氧核糖核酸(DNA)或核糖核酸(RNA)及其单链形式或双链形式的聚合物。除非特别限定,否则该术语可以包括含天然核苷酸的类似物的核酸,所述核酸具有与参考核酸(例如示出了序列信息)相似的结合特性并且按照与天然存在核苷酸相似的方式代谢。除非另外说明,核酸的序列可以包括其保守方式修饰的变体,例如简并密码子置换、等位基因、直向同源物、SNP和互补序列,以及明确指出的序列。
在本文中,术语“EC50值”是指半数最大效应浓度(concentration for 50%ofmaximal effect,EC50),指能引起50%最大效应的浓度。
在本文中,“亲和力”表示分子(例如,抗体)的单个结合位点和它的结合配偶体(例如,抗原)之间的非共价相互作用的总和的强度。除非另外指出,否则本说明书中使用的“结合亲和力”表示反映结合对(例如,抗体和抗原)的成员之间的1:1相互作用的固有结合亲和力。分子X对它的配偶体Y的亲和力通常可以由平衡解离常数(K
在本文中,术语“单克隆抗体”表示得自基本上同源的抗体的群体的抗体,即,构成所述群体的各个抗体是相同的和/或结合相同表位,除了可能的变体抗体(例如,含有天然存在的突变或在单克隆抗体制品的生产过程中产生)以外,这样的变体通常以微量存在。与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制品不同,单克隆抗体制品的每种单克隆抗体针对抗原上的单个决定簇。因而,修饰语“单克隆”指示所述抗体得自基本上同源的抗体群体的特征,并且不应解释为需要通过任何特定方法生产所述抗体。
在本文中,术语“靶向神经丝蛋白轻链的重组抗体”表示能够以足够的亲和力结合神经丝蛋白轻链、能够用作靶向神经丝蛋白轻链的诊断剂和/或治疗剂的重组抗体。
本申请的靶向神经丝蛋白轻链的重组抗体与靶标无关的蛋白不结合。这里,“无关的蛋白”是指除作为靶标的神经丝蛋白轻链以外的其他蛋白;这里,“不结合”是指:在将本申请的靶向神经丝蛋白轻链的重组抗体与作为其靶标的神经丝蛋白轻链的结合能力作为100%的情况下,本申请的靶向神经丝蛋白轻链的重组抗体与所述无关蛋白的结合能力小于10%,例如为9%、8%、7%、6%、5%、4%、3%、2%、1%或者0。
可通过本领域已知的多种标准的蛋白纯化或重组表达技术中的任何一种来产生适于产生抗体的神经丝蛋白轻链。其他的β-淀粉样蛋白的形式还可包括神经丝蛋白轻链表达细胞、含有神经丝蛋白轻链的制品或细胞提取物或级分、部分纯化的神经丝蛋白轻链。
在一些实施方式中,本申请采用磁微粒化学发光免疫分析法测定样品中神经丝蛋白轻链水平,具体原理是:用化学发光剂(化学发光标记物)直接标记抗体,与待测样品中相应抗原、磁颗粒性(磁珠)的抗体反应,通过磁场把结合状态(沉淀部分)和游离状态的化学发光标记物标记的抗体分离开来,然后加入发光促进剂(发光底物)进行发光反应,通过对发光值的检测进行定量或定性检测。
在一些实施方式中,本申请还可以采用POCT、ELISA、SERS、质谱、微流控和光化学等平台测定样品中神经丝蛋白轻链水平。
在本文中,ELISA(enzyme linked immune sorbent assay),即酶联免疫吸附测定,是指利用抗体分子能与抗原分子特异性结合的特点,将游离的杂蛋白和结合于固相载体的目的蛋白结合,并利用特殊的标记物对其定性或定量分析的一种检测方法。其原理是抗原或抗体能物理性地吸附于固相载体表面,并且保持其免疫活性;抗原或抗体能与酶通过共价键形成酶结合物,同时保持各自的免疫活性或酶活性;酶结合物与相应的抗原或抗体结合后,能通过加入底物的颜色反应来确定免疫反应的发生,颜色反应的深浅与标本中相应抗原或抗体的量成正比。
第一方面,本申请提供一种检测神经丝蛋白轻链的试剂盒,其中,所述试剂盒包括:生物素偶联的靶向神经丝蛋白轻链的第一抗体、经标记物标记的靶向神经丝蛋白轻链的第二抗体和磁珠;其中,所述磁珠为链霉亲和素磁珠。
在本文中,术语“生物素(Biotin)”为B族维生素之一,又称维生素H、维生素B7、辅酶R(Coenzyme R)等。是20世纪30年代在研究酵母生长因子和根瘤菌的生长与呼吸促进因子时,从肝中发现的一种可以防治由于喂食生鸡蛋蛋白诱导的大鼠脱毛和皮肤损伤的因子。生物素是水溶性维生素B群成员。在肝、肾、酵母、牛乳中含量较多,是生物体固定二氧化碳的重要因素。容易同鸡蛋白中一种蛋白质结合,大量食用生蛋白可阻碍生物素的吸收导致生物素缺乏,如脱毛、体重减轻、皮炎等。生物素在脂肪合成、糖质新生等生化反应途径中扮演重要角色。
在本文中,术语“甲苯磺酰活化的磁珠(Tosyl磁珠)”是指具有甲苯磺酰基活化基团的磁珠,磁珠上的甲苯磺酰基活化基团可与巯基和胺基反应。在pH值为7.0至8.0左右时,发生巯基反应。在较高的pH值(如8.5至9.5),可与胺基发生反应。与传统磁珠相比,甲苯磺酰活化的磁珠具有更快的磁响应性同时保持微球良好的分散性、极低的非特异性吸附和预活化的反应位点等特性,可以直接用来与多种生物配体(蛋白、多肽、寡聚核苷酸、药物分子等)进行高载量结合,实现共价键偶联在磁珠表面的目的。该磁珠具有长亲水性间隔臂,且反应条件比较温和,使它特别适用于生物活性大分子的固定化。
在本文中,术语“链霉亲和素磁珠(SA磁珠)”是指将链霉亲和素(streptavidin)固定在聚合物磁性微球上,借助链霉亲和素-生物素高亲和力结合特性,与生物素化蛋白、抗体及核酸(统称生物素化分子)等形成固定层,进而分离和与生物素化分子相互作用的靶分子,其可用于亲和纯化,细胞分选,蛋白互作,DNA-蛋白质相互作用,探针捕获和mRNA分离等多方面应用,有利于方便、快捷地捕获目标分子以及实现磁性分离。
在一些实施方式中,所述靶向神经丝蛋白轻链的第一抗体与生物素的物质的量之比为1:(3~40),优选为1:(3~9),例如可为1:3、1:3.5、1:4、1:4.5、1:5、1:5.5、1:6、1:6.5、3:20、1:7、1:7.5、1:8、1:8.5、1:9、1:9.5、1:10、1:10.5、1:11、1:11.5、1:12、1:12.5、1:13、1:13.5、1:14、1:14.5、1:15、1:15.5、1:16、1:16.5、1:17、1:17.5、1:18、1:18.5、1:19、1:19.5、1:20、1:20.5、1:21、1:21.5、1:22、1:22.5、1:23、1:23.5、1:24、1:24.5、1:25、1:26、1:27、1:28、1:29、1:30、1:31、1:32、1:33、1:34、1:35、1:36、1:37、1:38、1:39、1:40或其间任意范围。
在一些实施方式中,所述试剂盒还包括神经丝蛋白轻链标准品、底物、洗涤液、磁珠稀释液、偶联抗体稀释液、标记抗体稀释液和样品稀释液。在一些实施方式中,底物包括发光激发液A和发光激发液B,其中发光激发液A为硝酸和过氧化氢水溶液,发光激发液B为氢氧化钠水溶液。在一些实施方式中,磁珠稀释液为含有BSA和Proclin300的磷酸盐缓冲液。在一些实施方式中,偶联抗体稀释液和标记抗体稀释液为TBS-T缓冲液。在一些实施方式中,洗涤液为PBS和吐温-20。在一些实施方式中,样品稀释液为PBS缓冲液。在一些实施方式中,样品稀释液为含有BSA和Proclin-300的PBS缓冲液。在一些实施方式中,所述试剂盒还包括保存缓冲液和淬灭缓冲液,其中,保存缓冲液用于提供稳定的pH环境、减弱抗体降解、防腐等;猝灭缓冲液用于淬灭掉未与抗体结合的标记物。在一些实施方式中,保存缓冲液为TBS-T缓冲液,猝灭缓冲液为5%DL-赖氨酸。
在一些实施方式中,所述靶向神经丝蛋白轻链的第一抗体与磁珠的质量比为1:(100~5000),优选为1:(500~2000),例如可为1:100、1:200、1:300、1:400、1:500、1:600、1:700、1:800、1:900、1:1000、1:1100、1:1200、1:1300、1:1400、1:1500、1:1600、1:1800、1:2000、1:2500、1:3000、1:3500、1:4000、1:4500、1:5000或其间任意范围。
在一些实施方式中,所述靶向神经丝蛋白轻链的第二抗体与标记物的物质的量之比为1:(3~40),优选为1:(3~9),例如可为1:3、1:3.5、1:4、1:4.5、1:5、1:5.5、1:6、1:6.5、3:20、1:7、1:7.5、1:8、1:8.5、1:9、1:9.5、1:10、1:10.5、1:11、1:11.5、1:12、1:12.5、1:13、1:13.5、1:14、1:14.5、1:15、1:15.5、1:16、1:16.5、1:17、1:17.5、1:18、1:18.5、1:19、1:19.5、1:20、1:20.5、1:21、1:21.5、1:22、1:22.5、1:23、1:23.5、1:24、1:24.5、1:25、1:26、1:27、1:28、1:29、1:30、1:31、1:32、1:33、1:34、1:35、1:36、1:37、1:38、1:39、1:40或其间任意范围。
在一些实施方式中,所述链霉亲和素磁珠的粒径为1~5μM,优选为1.5~3μM,进一步优选为1.5~2μM,例如可为1μM、1.5μM、2μM、2.5μM、3μM、3.5μM、4μM、4.5μM、5μM或其间任意范围。相较于Tosyl磁珠,SA磁珠具有更优的信噪比。进一步地,使用较小粒径的磁珠能够进一步有效提升信噪比,有效提升试剂盒的线性区间。
在一些实施方式中,所述的标记物可为化学发光标记物、电化学发光标记物等。优选地,所述的标记物为化学发光标记物,进一步优选地,所述化学发光标记物为吖啶酯。
在一些实施方式中,所述靶向神经丝蛋白轻链的第一抗体包含三个重链互补决定区(CDR-H1、CDR-H2、CDR-H3)和三个轻链互补决定区(CDR-L1、CDR-L2、CDR-L3),其中:所述CDR-H1的氨基酸序列如SEQ IDNo:1(GFSLTGM)所示;所述CDR-H2的氨基酸序列如SEQ IDNo:3(YWDED)所示;所述CDR-H3的氨基酸序列如SEQ ID No:5(RPFHRYYVEALDY)所示;所述CDR-L1的氨基酸序列如SEQ ID No:7(RSSQSIVHSNGATSLE)所示,所述CDR-L2的氨基酸序列如SEQ ID No:9(KVSWRFS)所示;所述CDR-L3的氨基酸序列如SEQ ID No:11(FNGSRVPLT)所示;所述靶向神经丝蛋白轻链的第二抗体包含三个重链互补决定区(CDR-H1、CDR-H2、CDR-H3)和三个轻链互补决定区(CDR-L1、CDR-L2、CDR-L3),其中:所述CDR-H1的氨基酸序列如SEQ ID No:2(GFIFSIR)所示;所述CDR-H2的氨基酸序列如SEQ IDNo:4(APSGN)所示;所述CDR-H3的氨基酸序列如SEQ IDNo:6(APDGNYGPFFY)所示;所述CDR-L1的氨基酸序列如SEQIDNo:8(RASETITNSLH)所示;所述CDR-L2的氨基酸序列如SEQ IDNo:10(YATNSIS)所示;所述CDR-L3的氨基酸序列如SEQ IDNo:12(QQSDSWPLT)所示。
在一些实施方式中,所述靶向神经丝蛋白轻链的第一抗体包含重链可变区和轻链可变区,其中:重链可变区的氨基酸序列如SEQ IDNo:13(QVSLRESGPGILQPSNTLSLTCSFSGFSLTGMGVSWIRQPSGKGIEWI AHIYWDEDKTYNPSLKSHLSITRDTSRNQVFLHVTNVDTPDSVTYYQARRPFHRYYVEALDYWGQGLAVTVDS)所示,或为与SEQ ID No:13具有90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的氨基酸序列;轻链可变区的氨基酸序列如SEQ IDNo:15(EIMTQTPLSLPVSLGEQASISCRSSQSIVHSNGATSLEWYLQKPRQH PKLLIYKVSWRFSGVPDRFSGSGSGTDFTLHISRVEADELGVYYCFNGSRV PLTFGAGTKLELKKA)所示,或为与SEQ ID No:15具有90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的氨基酸序列;所述靶向神经丝蛋白轻链的第二抗体包含重链可变区和轻链可变区,其中:重链可变区的氨基酸序列如SEQID No:14(DVKLVESGCNLVHPGGSPRLSCTATGFIFSIRAMSWVYCTPDHRLE WIASIAPSGNTHYPDYVKGRPTISRADATNVLYLQMSTLKSEDTAMYYCT GAPDGNYGPFFYWGQGTLVTVTA)所示,或为与SEQ ID No:14具有90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的氨基酸序列;轻链可变区的氨基酸序列如SEQ IDNo:16(EVVLTQSPVSLTVTPGDSVSLSCRASETITNSLHWYQHKSHESPRLL IKYATNSISGIPSRFSASGTGTDFTLTIDTVETEDFGVYPCQQSDSWPLTFSA GTKLNLKRA)所示,或为与SEQ ID No:16具有90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的氨基酸序列。
第二方面,本申请提供另一种检测神经丝蛋白轻链的试剂盒,其中,所述试剂盒包括:靶向神经丝蛋白轻链的第一抗体包被的磁珠和经标记物标记的靶向神经丝蛋白轻链的第二抗体;其中,所述磁珠为甲苯磺酰活化的磁珠。
在一些实施方式中,所述试剂盒还包括神经丝蛋白轻链标准品、底物、封闭液、包被抗体稀释液、标记抗体稀释液和样品稀释液。在一些实施方式中,底物、洗涤液、样品稀释液如前述第一方面中所述。在一些实施方式中,包被抗体稀释液和标记抗体稀释液为TBS-T缓冲液。封闭液用于封闭掉未偶联的空位,防止后期非特异结合,在一些实施方式中,封闭液为BSA封闭液。在一些实施方式中,所述试剂盒还包括保存缓冲液和淬灭缓冲液,其中,保存缓冲液用于提供稳定的pH环境、减弱抗体降解、防腐等;猝灭缓冲液用于淬灭掉未与抗体结合的标记物。在一些实施方式中,保存缓冲液为TBS-T缓冲液,猝灭缓冲液为5%DL-赖氨酸。
在一些实施方式中,所述甲苯磺酰活化的磁珠的粒径为1~5μM,优选为1.5~3μM,例如可为1μM、1.5μM、2μM、2.5μM、3μM或其间任意范围。
在一些实施方式中,所述靶向神经丝蛋白轻链的第一抗体与磁珠的质量比、所述靶向神经丝蛋白轻链的第二抗体与标记物的物质的量之比、所述的标记物、所述靶向神经丝蛋白轻链的第一抗体、所述靶向神经丝蛋白轻链的第二抗体均如第一方面中所述。
在一些实施方式中,前述第一和第二方面的任一种试剂盒可为磁微粒化学发光试剂盒、磁颗粒电化学发光试剂盒、电化学发光试剂盒、ELISA试剂盒、POCT检测试剂盒、SERS检测试剂盒,质谱试剂盒,微流控试剂盒和光化学试剂盒等,优选为磁微粒化学发光试剂盒。
在一些实施方式中,前述第一和第二方面的任一种检测NF-L的试剂盒用于诊断神经系统疾病。在一些实施方式中,所述神经系统疾病为中枢神经系统疾病。在一些实施方式中,所述神经系统疾病为神经退行性疾病。所述神经系统疾病例如可为脑萎缩、阿尔茨海默病、帕金森病、肌萎缩性侧索硬化、前颞叶痴呆、亨廷顿病、脑损伤相关疾病等。所述脑损伤相关疾病例如可为原发性颅脑损伤或继发性颅脑损伤。
本申请的前述第一和第二方面的任一种试剂盒还可用于区分神经退行性疾病和非神经退行性病变。
第三方面,本申请提供了前述第一和第二方面的任一种试剂盒在制备用于检测神经丝蛋白轻链和/或用于诊断神经系统疾病的产品中的用途。在一些实施方式中,所述神经系统疾病为中枢神经系统疾病。在一些实施方式中,所述神经系统疾病为神经退行性疾病。所述神经系统疾病例如可为脑萎缩、阿尔茨海默病、帕金森病、肌萎缩性侧索硬化、前颞叶痴呆、亨廷顿病、脑损伤相关疾病等。所述脑损伤相关疾病例如可为原发性颅脑损伤或继发性颅脑损伤。
第四方面,本申请还提供一种检测样品中神经丝蛋白轻链含量的方法,其中,其包括以下步骤:
反应:将待测样品、生物素偶联的靶向神经丝蛋白轻链的第一抗体、经标记物标记的靶向神经丝蛋白轻链的第二抗体混合,孵育后加入磁珠,再进行孵育;
测定发光值:洗涤后加入底物,测定待测样品的发光值;
计算含量:利用神经丝蛋白轻链标准品的发光值计算出待测样品中神经丝蛋白轻链的含量;
其中,所述磁珠为链霉亲和素磁珠。
第五方面,本申请还提供一种检测样品中神经丝蛋白轻链含量的方法,其中,其包括以下步骤:
反应:将待测样品、生物素偶联的靶向神经丝蛋白轻链的第一抗体、经标记物标记的靶向神经丝蛋白轻链的第二抗体和磁珠混合,孵育;
测定发光值:洗涤后加入底物,测定待测样品的发光值;
计算含量:利用神经丝蛋白轻链标准品的发光值计算出待测样品中神经丝蛋白轻链的含量;
其中,所述磁珠为链霉亲和素磁珠。
第六方面,本申请还提供一种检测样品中神经丝蛋白轻链含量的方法,其中,其包括以下步骤:
反应:将待测样品、靶向神经丝蛋白轻链的第一抗体包被的磁珠和经标记物标记的靶向神经丝蛋白轻链的第二抗体混合,孵育后进行磁分离;
测定发光值:洗涤后加入底物,测定待测样品的发光值;
计算含量:利用神经丝蛋白轻链标准品的发光值计算出待测样品中神经丝蛋白轻链的含量;
其中,所述磁珠为甲苯磺酰活化的磁珠。
在第四至六个方面的一些实施方式中,所述靶向神经丝蛋白轻链的第一抗体与磁珠的质量比为1:(100~5000),优选为1:(500~2000),例如可为1:100、1:200、1:300、1:400、1:500、1:600、1:700、1:800、1:900、1:1000、1:1100、1:1200、1:1300、1:1400、1:1500、1:1600、1:1800、1:2000、1:2500、1:3000、1:3500、1:4000、1:4500、1:5000或其间任意范围。
在第四和五方面的一些实施方式中,所述链霉亲和素磁珠的粒径为1~5μM,优选为1.5~3μM,进一步优选为1.5~2μM,例如可为1μM、1.5μM、2μM、2.5μM、3μM、3.5μM、4μM、4.5μM、5μM或其间任意范围。相较于Tosyl磁珠,SA磁珠具有更优的信噪比。进一步地,使用较小粒径的磁珠能够进一步有效提升信噪比,有效提升试剂盒的线性区间。相较于Tosyl磁珠,SA磁珠具有更优的信噪比。使用较小粒径的磁珠能够有效提升信噪比,有效提升试剂盒的线性区间。
在第六方面的一些实施方式中,所述甲苯磺酰活化的磁珠的粒径为1~5μM,优选为1.5~3μM,例如可为1μM、1.5μM、2μM、2.5μM、3μM或其间任意范围。
在第四至六方面的一些实施方式中,所述的标记物可为化学发光标记物、电化学发光标记物等。优选地,所述的标记物为化学发光标记物,进一步优选地,所述化学发光标记物为吖啶酯。
在第四和五方面的一些实施方式中,所述靶向神经丝蛋白轻链的第一抗体与生物素的物质的量之比为1:(3~40),优选为1:(3~9),例如可为1:3、1:3.5、1:4、1:4.5、1:5、1:5.5、1:6、1:6.5、3:20、1:7、1:7.5、1:8、1:8.5、1:9、1:9.5、1:10、1:10.5、1:11、1:11.5、1:12、1:12.5、1:13、1:13.5、1:14、1:14.5、1:15、1:15.5、1:16、1:16.5、1:17、1:17.5、1:18、1:18.5、1:19、1:19.5、1:20、1:20.5、1:21、1:21.5、1:22、1:22.5、1:23、1:23.5、1:24、1:24.5、1:25、1:26、1:27、1:28、1:29、1:30、1:31、1:32、1:33、1:34、1:35、1:36、1:37、1:38、1:39、1:40或其间任意范围。
在第四至六方面的一些实施方式中,所述靶向神经丝蛋白轻链的第二抗体与标记物的物质的量之比为1:(3~40),优选为1:(3~9),例如可为1:3、1:3.5、1:4、1:4.5、1:5、1:5.5、1:6、1:6.5、3:20、1:7、1:7.5、1:8、1:8.5、1:9、1:9.5、1:10、1:10.5、1:11、1:11.5、1:12、1:12.5、1:13、1:13.5、1:14、1:14.5、1:15、1:15.5、1:16、1:16.5、1:17、1:17.5、1:18、1:18.5、1:19、1:19.5、1:20、1:20.5、1:21、1:21.5、1:22、1:22.5、1:23、1:23.5、1:24、1:24.5、1:25、1:26、1:27、1:28、1:29、1:30、1:31、1:32、1:33、1:34、1:35、1:36、1:37、1:38、1:39、1:40或其间任意范围。
在第四至六方面的一些实施方式中,待测样品为血清或脑脊液,即,本申请的试剂盒既能够检测血清中的NF-L水平,也能够检测脑脊液中的NF-L水平。血液NF-L浓度大约是CSF的1/40,由于本申请的试剂盒有较大的线性区间,因此能够同时检出血清和脑脊液样本的NF-L浓度;血液NF-L浓度相对较低,由于本申请的试剂盒具有更好的灵敏度,因此能够保证其测值稳定且准确;血清和脑脊液包含的主要蛋白并不相同,因此会带来不同的检测干扰,由于本申请的试剂盒所使用的重组抗体具有足够的亲和力,因此能够保证检测物质的精准检出。
在第四至六方面的一些实施方式中,待测样品至少为50μL,例如可为50μL、60μL、70μL、80μL、90μL、100μL、110μL、120μL、130μL、140μL、150μL、160μL、170μL、180μL或其间任意范围,优选至少为100μL。
在第四至六方面的一些实施方式中,待测样品为血清或脑脊液,待测样品至少为50μL,优选至少为100μL,每微升待测样品,需要使用0.1~0.5ng靶向神经丝蛋白轻链的第一抗体和0.05~0.25ng靶向神经丝蛋白轻链的第二抗体,每微升待测样品需要使用的靶向神经丝蛋白轻链的第一抗体例如可为0.1ng、0.15ng、0.2ng、0.25ng、0.3ng、0.35ng、0.4ng、0.45ng、0.5ng或其间任意范围,每微升待测样品需要使用的靶向神经丝蛋白轻链的第二抗体例如可为0.05ng、0.07ng、0.09ng、0.1ng、0.12ng、0.14ng、0.16ng、0.18ng、0.2ng、0.21ng、0.23ng、0.25ng或其间任意范围。
在第四至六方面的一些实施方式中,所述靶向神经丝蛋白轻链的第一抗体、靶向神经丝蛋白轻链的第二抗体为前述第一方面中所述的靶向神经丝蛋白轻链的第一抗体、靶向神经丝蛋白轻链的第二抗体。
实施例
以下将结合具体实施例说明本申请内容,但本申请范围不限于此。如果没有特殊说明,以下实施例中使用的试剂和仪器都是本领域常规试剂和仪器,可以通过商购方式获得。所使用的方法均为常规实验方法,本领域技术人员根据实施例内容可以毫无疑问地实施所述方案并获得相应结果。
实施例1
重组抗体rNF-L-A和rNF-L-B的制备
本实施例中重组抗体的制备方法为:使用商业化NF-L重组抗原对小鼠进行免疫。获得灵敏度最高的鼠源单克隆抗体细胞系组合后进行抗体可变区序列测序。根据可变区序列完成嵌合载体构建并转染至CHO细胞系中进行重组抗体表达。其中,所用的轻链载体为pFUSE2ss-CLIg-mk,重链载体为pFUSEss-CHIg-mG1,上述两个载体均为商业化载体,自带恒定区序列,无需额外处理;重组抗体在CHO细胞系中表达后,经由Protein A填料得到纯化后的重组抗体rNF-L-A和rNF-L-B。其中,rNF-L-A重链可变区的氨基酸序列如SEQ ID No:13所示,rNF-L-A轻链可变区的氨基酸序列如SEQ ID No:15所示,rNF-L-B重链可变区的氨基酸序列如SEQ ID No:14所示,rNF-L-B轻链可变区的氨基酸序列如SEQ ID No:16所示。
实施例2
重组抗体rNF-L-A和rNF-L-B亲和力检测
借助Elisa技术对多批次的重组抗体进行亲和力检测。酶标板每孔包被100ng NF-L重组抗原,加入倍比稀释的重组抗体37℃温育1小时。温育结束后加入带有HRP标记的羊抗人二抗,最后加入TMB显色,加入2M硫酸终止反应,置酶标仪波长为450nm并进行检测,根据SigmaPlot12.5软件计算重组抗体各批次EC50,作为重组抗体的K
表1
实施例3
SA磁珠系统试剂盒的制备和检测过程
(1)磁珠工作液的制备
选择SA磁珠(M-270),涡旋混匀后超声处理5min并充分重悬。磁分离去除液体后,加入磁珠稀释液(0.1M磷酸盐缓冲体系,pH7.4,补充有0.1%BSA和0.1%Proclin300)使其终浓度为0.5mg/mL,作为M工作液4℃保存待用。
(2)抗体的生物素偶联
吸取rNF-L-A重组抗体0.5mg,与3.33μL 10mM Sulfo-NHS-LC-LC-Biotin充分混匀后室温静置60min。借助超滤管去除未与重组抗体偶联的生物素,超滤过程中使用PBS(pH7.4)进行3次冲洗,随即加入等体积甘油,-20℃保存待用。rNF-L-A重组抗体与生物素的物质的量比为1:20、1:10、1:6.7。将偶联后的母液继续用TBS-T缓冲液稀释1000倍配置为R1工作液使用。
(3)抗体的标记
吸取rNF-L-B重组抗体0.5mg,与8.25μL 4mM NSP-SA-NHS(溶于DMF中)溶液充分混合2h。向溶液中补充200μl 5%DL-赖氨酸,继续混和30min。使用Sephadex G-25脱盐,缓冲液TBS-T(0.1M磷酸盐缓冲体系,pH7.4,补充有0.1%BSA,0.5%吐温-20和0.1%Proclin300)。补加等体积甘油充分混匀后,
-20℃保存待用。rNF-L-B重组抗体与NSP-SA-NHS的物质的量比为1:20、1:10、1:6.7。需将标记后的母液继续用TBS-T缓冲液稀释2000倍配置为R2工作液使用。
(4)样品溯源
在进口高敏检测平台对NF-L抗原进行溯源。
(5)校准品和质控品的分装
NF-L的校准品及质控品均由样品稀释液配置而成。其中NF-L校准品的浓度为1000pg/ml和3000pg/ml;NF-L质控品的浓度为1000pg/ml和3000pg/ml。样品稀释液为pH7.4的PBS缓冲液,且每升样品稀释液还含有1% BSA和0.1%Proclin-300。
(6)试剂盒组装
将3个批次小试生产的偶联抗体、标记抗体分装于试剂仓内,与校准品、质控品一并组装成试剂盒。具体信息如下表2所示:
表2
(7)上机检测
检测流程:以全自动化学发光免疫分析仪为检测工具,检查并补充耗材,开机后完成自检。手动或扫码输入NF-L测试所需参数及试剂批号,并将试剂放于相应试剂位。使用NF-L校准品对主曲线进行校准,随后使用NF-L质控品对检测系统进行质控。质控合格后,在样本位依次加入待测样本进行检测。检测完毕后进行数据输出及分析整理。
两步法反应:机器自动吸取样本100μL并与50μL R1工作液和50μL R2工作液充分混匀,并于37℃孵育10min。随即加入M工作液50μL,充分混匀后继续于37℃孵育10min。弃掉上清后加入免疫分析仪配套洗涤液(PBS和吐温-20),重复清洗4次。随后将反应液送入暗室,并加入免疫分析仪配套发光激发液A(PBS和吐温-20)、发光激发液B(氢氧化钠水溶液)各100μL进行发光反应,并记录发光值。结合已录入并校准后的计算曲线计算得到样本对应浓度值。
实施例4
甲苯磺酰活化磁珠系统试剂盒的制备和检测过程
(1)磁珠工作液的制备
选择甲苯磺酰活化的磁珠(M-280),原始浓度为100mg/mL。涡旋混匀后超声处理5min并充分重悬。用移液枪吸取充分重悬的磁珠母液100μL(约10mg磁珠),磁分离5min去除液体。加入0.1M硼酸盐缓冲液(pH 9.5)165μL和rNF-L-A重组抗体200μg充分混匀并于37℃孵育过夜。孵育结束后,磁分离5min去除液体。加入10% BSA 37℃封闭3h。封闭结束后,磁分离5min去除液体。最后加入缓冲液TBS-T(0.1M磷酸盐缓冲体系,pH7.4,补充有0.1%BSA,0.5%吐温-20和0.1%Proclin300)4℃保存待用。rNF-L-A重组抗体与磁珠的质量比1:50。需将包被后的母液继续稀释20倍配置为M工作液使用。
(2)抗体的标记
分别吸取rNF-L-B重组抗体0.25mg,与8.25μL 4mM ASDFGH(溶于DMF中)溶液充分混合2h。向溶液中补充200μl 5% DL-赖氨酸,继续混和30min。使用Sephadex G-25脱盐,缓冲液TBS-T(0.1M磷酸盐缓冲体系,pH7.4,补充有0.1%BSA,0.5%吐温-20和0.1%Proclin300)。补加等体积甘油充分混匀后,-20℃保存待用。rNF-L-B重组抗体与NSP-SA-NHS的物质的量比1:20。需将标记后的母液继续稀释2000倍配置为R1工作液使用。
(3)样品溯源:参照实施例3。
(4)校准品和质控品的分装:参照实施例3。
(5)试剂盒组装:参照实施例3。
(6)上机检测
检测流程:参照实施例3。
一步法反应:机器自动吸取样本150μL并与50μL M工作液和50μL R1工作液充分混匀,并于37℃孵育20min后进行磁分离。弃掉上清后加入免疫分析仪配套洗液(PBS和吐温-20),重复清洗3次。随后将反应被送入暗室,并加入免疫分析仪配套发光激发液A(硝酸和过氧化氢水溶液)、发光激发液B(氢氧化钠水溶液)各100μL进行发光反应,并记录发光值。结合已录入并校准后的计算曲线计算得到样本对应浓度值。
实施例3和4的两种不同磁珠系统试剂盒的检测结果如下表3所示。
表3
上述结果显示相比较Tosyl磁珠,SA磁珠有着更佳的信噪比。使用SA磁珠的试剂盒可获得相对更优的线性区间。
实施例5
本实施例与实施例3的区别仅在于,将M-270磁珠替换为MS160磁珠,检测结果如下表4所示。
表4
上述结果显示相比较M-270磁珠,使用较小粒径的MS160后RLU虽然有下降,但是信噪比得到了有效提升,从而可有效提升试剂盒的线性区间。
实施例6-1~实施例6-2
实施例6-1与实施例5的区别仅在于,rNF-L-A重组抗体使用量为0.25mg。
实施例6-2与实施例5的区别仅在于,rNF-L-A重组抗体使用量为0.75mg。
实施例5以及实施例6-1~实施例6-2的检测结果如下表5所示。
表5
上述结果显示rNF-L-A重组抗体与生物素偶联工艺中,将抗体使用量提升至0.75mg,能够有效检测更低浓度的抗原,有效提升检测灵敏度。
实施例7-1~实施例7-3
实施例7-1与实施例5的区别仅在于,rNF-L-A重组抗体使用量为0.75mg,rNF-L-B重组抗体使用量为0.25mg;
实施例7-2与实施例5的区别仅在于,rNF-L-A重组抗体使用量为0.75mg,rNF-L-B重组抗体使用量为0.5mg;
实施例7-3与实施例5的区别仅在于,rNF-L-A重组抗体使用量为0.75mg,rNF-L-B重组抗体使用量为0.75mg。
实施例7-1~实施例7-3的检测结果如下表6所示。
表6
上述结果显示rNF-L-B标记工艺中,将rNF-L-B抗体使用量提升至0.75mg,能够进一步提升检测灵敏度。
实施例8
本实施例与实施例7-3的区别在于,上机检测步骤中的反应为一步法反应:机器自动吸取样本100μL并与50μL M工作液、50μL R1工作液和50μL R2工作液充分混匀,并于37℃孵育10min。弃掉上清后加入免疫分析仪配套洗液(PBS和吐温-20),重复清洗4次。随后将反应被送入暗室,并加入免疫分析仪配套发光激发液A(硝酸和过氧化氢水溶液)、发光激发液B(氢氧化钠水溶液)各100μL进行发光反应,并记录发光值。结合已录入并校准后的计算曲线计算得到样本对应浓度值。实施例7-3与实施例8的检测结果总结于下表7中。
表7
上述结果显示将反应程序更改为一步法并缩短检测时间后,其检测性能与两步法相近,并未影响整体线性范围。
将实施例3~8的试剂盒制备工艺参数、检测方法参数等列于下表8中。
表8
实施例9试剂盒性能评估
(1)准确度
分别将溯源后的NF-L抗原配置成1500pg/mL溶液,重复检测3次并进行数据分析。准确度结果如下表9所示(浓度单位为pg/mL)。
表9
综上,测量结果的相对偏差在±10%范围内,且3次结果都符合要求,以上3批试剂盒的准确度合格。
(2)精密度
依据美国临床实验室标准化委员会(NCCLS/CLSI)文件EP5-A2方案进行,批内精密度和实验室间精密度采用多因素整合的嵌套设计进行实验,不同操作者,不同设备,不同地点,每天上、下午各检测一次,每个样本重复检测2次,连续检测20天,累计每批试剂盒各收集160个数据结果,计算其精密度。同时将溯源后的NF-L抗原配置成1000pg/mL和3000pg/mL溶液,重复检测3次并进行数据分析。检测结果如下表10所示。
表10
/>
综上,上述试剂盒对低、高浓度样本重复进行检测结果显示,其批内精密度和批间精密度CV均小于5%,说明上述试剂盒符合精密度性能评估要求。
(3)线性范围
分别选择1例补充NF-L抗原的脑脊液,采用稀释液稀释12个浓度水平,每个稀释后的样本重复测试3次,计算其均值。依据结果逐渐减少浓度点计算相应的线性关系,确定试剂盒的最宽线性范围,检测结果如下表11所示(浓度单位为pg/mL)。
表11
上述表10显示,NF-L试剂盒在[1~5000]pg/mL的范围内相关系数r不低于0.9900且无离群值,NF-L试剂盒线性范围为[1~5000]pg/mL。
(4)灵敏度
用上述试剂盒检测空白样本重复检测20次,进行灵敏度确定,检测结果如下表12所示(浓度单位为pg/mL):
表12
NF-L试剂盒测定的空白样本平均发光值平均值为424.45,将Mean+2SD带入反应曲线,得NF-L试剂盒灵敏度为0.73pg/mL。
(5)脑脊液检测结果
检测经进口高敏检测平台赋值的脑脊液样本20例以确定试剂盒与该平台产品的一致性。对于超出对标试剂线性范围部分采用稀释上机的方式进行检测。分析结果如图1所示(浓度单位为pg/mL),回归分析数据显示其y=1.0036x-21.662且R
(6)血液检测结果
检测经进口高敏检测平台赋值的血液样本40例以确定试剂盒与该平台产品的一致性。分析结果如图2所示(浓度单位为pg/mL),回归分析数据显示其y=1.0227x+0.7245且R
由上述各实施例可以看出,本申请的NF-L试剂盒稳定性好、准确度高、精密度高,灵敏度高、检测时间短。本申请通过试剂盒制备过程中的偶联或包被工艺、标记工艺以及检测体系的优化还能够在原有基础上进一步提升试剂盒的检出限和线性范围,并进一步缩短检测时长。本申请的试剂盒线性范围为[1~5000]pg/mL,试剂盒的线性范围远宽于现有技术的线性范围,试剂盒的检测上限为现有技术检出上限的至少2倍,同时本申请的试剂盒与商业化产品还具有良好一致性。
以上所述,仅是本申请的较佳实施例而已,并非是对本申请作其它形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更或改型为等同变化的等效实施例。但是凡是未脱离本申请技术方案内容,依据本申请的技术实质对以上实施例所作的任何简单修改、等同变化与改型,仍属于本申请技术方案的保护范围。
- 一种测定游离轻链Kappa浓度的试剂盒及制备方法
- 一种测定轻链Kappa浓度的试剂盒及制备方法
- 一种测定游离轻链Lambda浓度的试剂盒及制备方法
- 神经丝蛋白轻链的检测试剂在制备检测颅内感染试剂中的应用
- 神经丝蛋白轻链在梅毒血液检测中的应用
