治疗或预防出血性中风后不良继发性神经学后果的方法
文献发布时间:2024-04-18 19:58:21
技术领域
一般而言,本发明涉及用于治疗和/或预防出血性中风进入脑脊液(CSF)隔室后,特别是蛛网膜下出血(SAH)后受试者的不良继发性神经学后果的方法和组合物。
背景
本说明书中引用的所有参考文献,包括任何专利或专利申请,在此通过引用并入本申请,以使得能够完全理解本发明。尽管如此,这些参考文献不应被解读为构成如下承认:这些文件中的任何一篇形成澳大利亚或任何其他国家的本领域公知常识的组成部分。
出血性中风牵涉脑内或脑表面上的血管破裂,伴随出血到周围组织中。出血性中风的实例包括i)脑内出血(本申请中称作ICH),其牵涉脑爆裂中的血管;ii)脑室内出血(本申请中称作IVH),其出血到脑脑室系统;以及iii)蛛网膜下出血(本申请中称作SAH),其牵涉脑与覆盖脑的组织之间的空间(称作蛛网膜下腔)中的出血。最常见的SAH由爆裂动脉瘤引导致(本申请中称作aSAH)。SAH的其他原因包括头部损伤、出血障碍和使用血液稀释剂。
动脉瘤蛛网膜下出血(aSAH)为SAH的最常见原因,并且与最高死亡率和长期神经失能相关。尽管在动脉瘤修复和神经重症监护方面取得了进展,但住院病例死亡率中位数在欧洲为44.4%,在美国为32.2%。35%的幸存者在出血事件后1年报告总体生活质量差,83-94%不能恢复工作。在美国,由破裂的颅内动脉瘤引起的aSAH的估计发生率为每10,000人1例,每年产生约27,000例新病例。
此外,aSAH在女性中比在男性中更常见(2:1);峰值发病率在55至60岁的人中。
除最初72小时内的早期脑损伤(Sehba等人,2012)外,aSAH后的患者后果由在动脉瘤破裂后第4天至第10天之间发生的迟发性继发性脑损伤确定(Macdonald,2014)。迟发性继发性脑损伤被认为是多因素的,其牵涉大血管和微血管功能障碍、神经炎症、神经元凋亡和脑的病理性电活动(Macdonald,2014)。在aSAH后三分之二的患者发生大脑动脉血管造影性血管痉挛(aVSP)(Dorsch和King,1994)。在三分之一的患者中发现具有缺血性脑区域的放射学分界的迟发性脑缺血(DCI)和临床上明显的迟发性缺血性神经功能缺损(DIND)(Rowland等人,2012)。这些继发性表现中的至少一种的发生定义了蛛网膜下出血相关的继发性脑损伤(SAH-SBI)。
动脉瘤破裂与SAH-SBI发作之间的时间差提供了预防性和治疗性干预的机会窗口,定义了鉴定SAH-SBI高风险患者以及新的药物靶标的未满足的需要。到目前为止,已显示了在aSAH后适度改善神经学后果的唯一预防性干预是口服尼莫地平(I类,A级)(Diringer等人,2011;Connolly等人,2012)。在有症状的患者中,治疗选择目前限于诱导全身性动脉高血压的挽救疗法,并且在选定的患者中,限于机械或化学血管成形术以解决aVSP(Diringer等人,2011;Connolly等人,2012)。因此,对于治疗和/或预防aSAH后患者的SAH-SBI的特定疗法存在迫切且未满足的需求。
尽管进行了巨大的研究努力,但仍然没有临床上确定的用于可靠监测SAH-SBI的生物标志物。尽管被广泛使用,但临床评分(Hunt和Hess,1968;Teasdale等人,1988)、放射学评分(Fisher等人,1980;Frontera等人,2006;Wilson等人,2012)和使用经颅多普勒超声检查(TCD)的日复一日评估(Diringer等人,2011;Connolly等人,2012)显示了出检测有风险的患者的准确度有限(de Rooij等人,2013)。
无细胞血红蛋白(Hb)在患者CSF中蓄积,并且被认为是SAH-SBI的上游驱动物(Pluta等人,2009;Hugelshofer等人,2019;Buehler等人,2020)。在18名患者中使用每日CSF分光光度法进行的小型先导研究的数据表明,在动脉瘤破裂后两周内具有高累积CSF-Hb暴露的患者可能存在发生SAH-SBI的增加风险(Hugelshofer等人,2018)。然而,到目前为止,临床上尚未证明患者的CSF中的无细胞Hb浓度(CSF-Hb)与蛛网膜下出血相关的继发性脑损伤(SAH-SBI)的发生率之间的相关性。特别地,没有临床相关的CSF-Hb浓度是已知的,其可以用作SAH-SBI的相关生物标志物。
总体而言,对于预测和监测SAH-SBI的诊断工具以及预防和治疗SAH-SBI的靶向治疗方法存在迫切临床需求。
发明概述
本发明人在患有aSAH的患者群组中进行了前瞻性研究,并且出乎意料地发现这些患者的CSF中无细胞Hb浓度(CSF-Hb)与蛛网膜下出血相关的继发性脑损伤(SAH-SBI)的发生率之间的显著相关性。在狭窄的临床相关CSF-Hb浓度范围内鉴定了CSF-Hb与SAH-SBI的相关性的诊断准确性,并且发现其显著超过aSAH的其他生理和生物化学生物标志物,以及放射学评分和临床评分。值得注意的是,对于SAH-SBI的所有三种表现,观察到CSF-Hb与SAH-SBI发生率之间的显著相关性;即大脑动脉的血管造影性血管痉挛(aVSP)、迟发性脑缺血(DCI)和迟发性缺血性神经功能缺损(DIND)。本发明人还进行了深入的CSF蛋白质组分析和离体功能测定,其将CSF-Hb鉴定为病理生理学驱动物和治疗靶标。
本发明人还令人惊奇地发现,血红素结合蛋白(Hx)可以减少或以其他方式预防无细胞血红素介导的不良继发性神经学后果(例如氧化性组织损伤、神经炎症),包括功能性和放射学神经学损伤。发现Hx能够在本申请中所鉴定的CSF-Hb的临床相关浓度范围内选择性中和患者CSF-Hb的脂质氧化活性。本发明人进一步令人惊奇地发现,触珠蛋白(Hp)在本申请中所鉴定的临床相关CSF-Hb浓度范围内发挥其抗血管痉挛和抗氧化作用。此外,本发明人还令人惊奇地发现,触珠蛋白(Hp)和血红素结合蛋白(Hx)可以协同发挥它们的保护功能。
因此,在本发明的一方面,提供了治疗或预防伴有血管外红细胞溶解和无细胞血红素和/或无细胞血红蛋白(Hb)释放到脑脊液(CSF)中的出血性中风后受试者的不良继发性神经学后果的方法,该方法包括使有此需要的受试者的CSF暴露于治疗有效量的血红素结合蛋白(Hx)并持续足以允许Hx与无细胞血红素形成复合物且由此中和无细胞血红素的一段时间。在一个实施方案中,所述方法还包括使受试者的CSF暴露于治疗有效量的触珠蛋白(Hp)并持续足以允许Hp与无细胞Hb形成复合物且由此中和无细胞Hb的一段时间。
在本申请中所公开的另一方面,提供了用于根据本申请中所述的方法治疗或预防出血性中风后受试者的不良继发性神经学后果的药物组合物,所述组合物包含治疗有效量的血红素结合蛋白(Hx)和药学上可接受的载体。在一个实施方案中,所述组合物还包含治疗有效量的触珠蛋白(Hp)。
在本申请中所公开的另一方面,提供了用于根据本申请中所述的方法治疗或预防出血性中风后受试者的不良继发性神经学后果的药物组合物,所述组合物包含治疗有效量的血红素结合蛋白(Hx)和药学上可接受的载体。在一个实施方案中,所述组合物还包含治疗有效量的触珠蛋白(Hp)。
在本申请中所公开的另一方面,提供了治疗有效量的血红素结合蛋白(Hx)在制备用于根据本申请中所述的方法治疗或预防出血性中风后受试者的不良继发性神经学后果的药物中的用途。在一个实施方案中,治疗有效量的HX被配制用于与治疗有效量的触珠蛋白(Hp)一起施用。
在本申请中所公开的另一方面,提供了治疗有效量的血红素结合蛋白(Hx),其用于根据本申请中所述的方法治疗或预防出血性中风后受试者的不良继发性神经学后果。在一个实施方案中,治疗有效量的Hx被配制用于与治疗有效量的触珠蛋白(Hp)一起使用。
在本申请中所公开的另一方面,提供了包含Hx和任选的Hp的人工CSF,其如本申请中所述。本公开还扩展至包含本申请中所述的人工CSF或组合物的试剂盒。
在本申请中所公开的另一方面,提供了一种确定受试者是否处于在伴有血管外红细胞溶解和无细胞血红素和/或无细胞血红蛋白(Hb)释放到脑脊液(CSF)中的出血性中风后发生不良继发性神经学后果的风险中的方法,该方法包括(i)从出血性中风后的受试者获得CSF样品;(ii)测量步骤(i)中获得的CSF样品中无细胞Hb的量;以及(iii)将步骤(ii)中测定的CSF样品中无细胞Hb的量与参考值进行比较,其中基于步骤(iii)中的比较确定受试者发生不良继发性神经学后果的风险。
在一些实施方案中,所述方法还包括治疗被确定处于不良继发性神经学后果的风险中的受试者,其中所述的治疗包括使受试者的CSF暴露于(i)治疗有效量的血红素结合蛋白(Hx)并持续足以允许Hx与无细胞血红素形成复合物且由此中和无细胞血红素的一段时间,其如本申请中所述;以及/或(ii)治疗有效量的触珠蛋白(Hp)并持续足以允许Hp与无细胞Hb形成复合物且由此中和无细胞Hb的一段时间,其如本申请中所述。因此,在本申请中所公开的另一方面,提供了一种使受试者分层进行在伴有血管外红细胞溶解和无细胞血红素和/或无细胞血红蛋白(Hb)释放到脑脊液(CSF)中的出血性中风后受试者的不良继发性神经学后果的治疗的方法,其中所述的方法包括(a)确定受试者是否处于发生不良继发性神经学后果的风险中,其如本申请中所述,和(b)根据本申请中所述的方法治疗确定处于不良继发性神经学后果风险中的受试者。
附图简述
图1显示了动脉瘤蛛网膜下出血后脑脊液蛋白质组的改变;A.脑脊液(CSF)氧合血红蛋白(oxyHb)、胆红素、胆绿素和高铁血红蛋白(MetHb)的短暂曲线。A.用LC-MS/MS在aSAH后在CSF中鉴定的蛋白质的k-均值聚类。B.具有CSF蛋白质组中的总体倍数变化和组合p-值的火山图。颜色表示簇,且点的大小表示蛋白质的原始平均强度(未归一化)。C.aSAH后在CSF蛋白质组的GSEA中鉴定的最高负富集标志基因集凝血的富集图。D.aSAH后CSF中触珠蛋白(HP)、触珠蛋白相关蛋白(HPR)、血红素结合蛋白(HPX)和白蛋白(ALB)的归一化蛋白质强度的短暂过程。E.aSAH后在CSF蛋白质组的GSEA中鉴定的最高正富集标志基因集糖酵解的富集图。F.aSH后在CSF蛋白质组的GSEA中鉴定的标志基因集血红素代谢的富集图。G.CSF中碳酸酐酶1(CA1)、碳酸酐酶2(CA2)、过氧化氢酶(CAT)和醛缩酶A(ALDOA)的归一化蛋白质强度的短暂过程。H.CSF中CD163、集落刺激因子1受体(CSF1R)、CD14和金属蛋白酶抑制剂1(TIMP)的归一化蛋白质强度的短暂过程。
图2显示了CSF-Hb的决定因素。A.3D演示的蛛网膜下血肿的示例。B.根据广义加性模型,CSF Hb水平对动脉瘤大小、动脉瘤位置、血肿体积、脑室内出血(IVH)的存在和aSAH后天数的部分依赖性。C.对IVH的存在分层的aSAH后CSF血红蛋白的暂时过程。D.比较没有(蓝色插图)或具有(红色插图)IVH的情况的源自前交通动脉的动脉瘤破裂的蛛网膜下出血的示意图。
图3显示了动脉瘤蛛网膜下出血后脑脊液血红蛋白与继发性脑损伤的联系;A.根据血管造影性血管痉挛(aVSP)、迟发性脑缺血(DCI)、迟发性缺血性神经功能缺损(DIND)和每天复合后果继发性脑损伤(SAH-SBI)分层的动脉瘤蛛网膜下出血后患者中的脑脊液血红蛋白(Hb)。B.根据广义加成性模型,SAH-SBI对CSF-Hb(对数标度)和aSAH后天数的部分依赖性。C.对于DIND、DCI和aVSP的存在,Hb的接受者操作特征(ROC)曲线和曲线下面积(AUC)(左)。具有SAH-SBI的出现的相应值的Hb的ROC曲线。D.在3个月随访时由GOSE分层的CSF Hb的短暂过程(好相对于差)。
图4显示了血红蛋白的血管收缩和氧化电位;A.对血红蛋白(Hb)的血管张力剂量响应。B.在患者中测量的与CSF Hb水平相关的经颅多普勒(TCD)速度(按比例调节的最大TCD)。aVSP的存在以颜色叠加给出。C.在TBARS测定中响应于不同浓度的Hb的丙二醛的形成。D.CSF中测量的Hb浓度与继发性脑损伤(SBI)发生率的相关性。
图5显示了触珠蛋白对血管和氧化性Hb-作用的保护作用;A.使用Hp-亲和柱的CSF的Hb耗竭。B.来自浸入耗竭的CSF和包含Hb的CSF中的血管的血管张力。C.具有(来自图4A的数据)或没有触珠蛋白(Hp)的对Hb的剂量反应。D.使用硫代巴比妥酸反应性物质(TBARS)测定法通过丙二醛评估的添加和不添加Hp或血红素结合蛋白(Hpx)的aSAH后患者CSF的氧化电位的暂时过程。
图6显示了动脉瘤蛛网膜下出血后脑脊液血红蛋白和血红素代谢物的病理生理学;A.动脉瘤蛛网膜下出血后蛛网膜下微环境中的病理生理过程的示意图。吞噬红细胞作用和血红蛋白变性和血红素代谢的连续细胞内过程显示了在底部区域中。胆绿素还原酶的饱和和吞噬红细胞作用用红色条表示。蛛网膜下CSF腔中的红细胞溶解显示了在示意图的上部。释放的氧合血红蛋白在血红素释放之前被氧化成高铁血红蛋白。B.Hb、胆红素、胆绿素和MetHb随时间的CSF浓度,胆绿素还原酶饱和和吞噬作用的推定时间由垂直条表示。
图7显示了A.临床观察性研究的流程图。B.经由EVD的每日CSF取样、CSF离心和使用光谱法和LC-MS/MS的上清液的蛋白质组分析的图示。C.用于容量分析的蛛网膜下出血分段的步骤。D.确定蛋白质簇的最佳数量的肘形图。E.神经血管功能实验设置的图示。F.记录的血管张力相对于相应血管的个体NO储备容量的归一化方法。G.TBARS测定中步骤的图示。
图8显示了CSF-Hb和血红素代谢物的个体曲线;A.氧合血红蛋白(oxyHb)的个体短暂曲线。B.胆红素的个体短暂曲线。C.胆绿素的个体短暂曲线。D.高铁血红蛋白(MetHb)的个体短暂曲线。
图9显示了通过aVSP、DCI和DIND分层的氧合血红蛋白的短暂曲线;A.通过血管造影性血管痉挛(AVSP)分层的氧合血红蛋白(OxyHb)的短暂过程。B.通过迟发性脑缺血(DCI)分层的OxyHb的短暂过程。C.通过迟发性缺血性神经功能缺损(DIND)分层的oxyHb的短暂过程。
图10显示了脑脊液血红蛋白、临床评分和放射学评分与动脉瘤蛛网膜下出血后继发性脑损伤的联系;A-C.CSF-Hb的受试者操作特征(ROC)曲线和曲线下面积(AUC),以及血管造影性血管痉挛(aVSP,A.)、迟发性缺血性神经功能缺损(DIND,B.)和迟发性缺血性神经功能缺损(DIND,C.)的发生率的相应值。最佳Youden-Index及其95%置信区间以红色表示。D.aVSP、DCI、DIND和SAH-SBI发生的CSF-Hb的ROC曲线和AUC,其中数据限于高风险期(第4-14天)。E-G.CSF-胆红素(E)、CSF-胆绿素(F)、CSF-高铁血红蛋白(MetHb)(G)对于aVSP、DCI、DIND和SAH-SBI发生率的ROC曲线和AUC。H-K.对于aVSP、DCI、DIND和SAH-SBI发生率的WFNS(H.)、Hunt和Hess(I.)、BNI(J.)和Fisher(K.)等级的ROC曲线和AUC。L.在3个月随访时通过改良的Rankin量表(mRS)分层的CSF-Hb的短暂过程(好相对于差)。
图11显示了患者CSF样品中血红蛋白和血红素清除蛋白的定量。从左到右的上图显示了与健康对照样品(ctrls)相比,来自以周表示的收集的时间点的患者CSF中的无细胞Hb、触珠蛋白、血红素结合蛋白和白蛋白的定量。从左到右的下图显示了与血红蛋白(Hb:Hp复合物)或与血红素(血红素:血红素结合蛋白或血红素结合蛋白;血红素蛋白)复合的清除蛋白。数据表示为表示平均值±Min至Max的箱式图和须状图,包括单独的数据点(重叠)。虚线表示相应测定法的定量下限(LLOQ)。
图12显示了纹状体注射触珠蛋白、血红素或血红素:血红素结合蛋白后24小时的神经功能。分别注射10μL触珠蛋白(5mM Hp,蛋白质对照)(黑色)、血红素1mM(深灰色)或血红素:Hx 1mM(浅灰色)后,旷场测试(A)、旋转杆测试(B)和平衡杆步行测试(C)的评分(每组n=6)。血红素而不是血红素:Hx注射后小鼠在24小时后显示了出受损的神经行为功能。
图13显示了纹状体注射血红素或血红素:血红素结合蛋白后24小时的放射学改变。在纹状体分别注射血红素(A)或血红素:Hpx(B)后24小时观察到的放射学改变的示例性实例。在注射血红素后,在T2-加权序列(左)上注意到病灶周围水肿,伴随ADC图中的扩散限制(中间)和动脉脊柱标记(ASL)图像上的局灶灌注缺陷(右)。注射血红素:Hpx后,在所有三个序列上仅观察到微小的放射学改变。
图14显示了纹状体注射血红素或血红素:血红素结合蛋白后24、48和72小时水肿大小和灌注的定量。(A.)在分别注射血红素(黑色)和血红素:Hpx(深灰色)后24、48和72小时,T2-加权图像上水肿大小的半自动定量,ns:p>0.05;*:p≤0.05,**:p≤0.01;***:p≤0.001,****:p≤0.0001。(B.)在注射血红素(圆形)和血红素:Hpx(正方形)后24、48和72小时动脉脊柱标记图像上的归一化灌注(每组n=4)。纹状体注射血红素与脑水肿的形成和局部减少灌注有关,这在注射血红素:Hpx后不存在。
详细描述
在贯穿于本说明书中,除非上下文另有要求,否则词语“包含(comprise)”或例如“含有(comprises)”或“包括(comprising)”这样的变化形式将被理解为暗示包括所述要素或整数或要素或整数的组,但不排除任何其他要素或整数或要素或整数的组。
本说明书中对任何在先出版物(或从其导出的信息)或任何已知事项的引用不是也不应被视为自认或承认或以任何形式暗示该在先出版物(或从其导出的信息)或已知事项形成本说明书所涉及的努力领域中的公知常识的一部分。
必须注意,如在本说明书中所使用的,单数形式“一”、“一个”和“该”包括复数方面,上下文另有明确规定的除外。因此,例如,提及“一种试剂”包括单一树脂,以及两种或多种试剂;提及“组合物”包括单一组合物,以及两种或多种组合物等。
在没有任何相反指示的情况下,在整个本说明书中提及“%”含量应被视为意指%w/w(重量/重量)。例如,包含总蛋白的至少80%的触珠蛋白含量的溶液是指包含总蛋白的至少80%w/w的触珠蛋白含量的组合物。
至少部分地基于本发明人的如下令人惊讶的发现预期本发明:血红素结合蛋白(Hx)可以在体内减少或以其他方式预防无细胞血红素介导的不良继发性神经学后果,例如脑血管痉挛。因此,在本申请中所公开的一方面,提供了治疗或预防伴有血管外红细胞溶解和无细胞血红素和/或无细胞血红蛋白(Hb)释放到脑脊液(CSF)中的出血性中风后受试者的不良继发性神经学后果的方法,该方法包括使有此需要的受试者的CSF暴露于治疗有效量的血红素结合蛋白(Hx)并持续足以允许Hx与无细胞血红素形成复合物且由此中和无细胞血红素的一段时间。
出血性中风
出血性中风或出血进入CSF隔室在本申请中也可互换地称作脑出血、脑性出血或颅内出血。其典型特征在于脑中血管破裂,导致局部出血。出血的位置可以变化。例如,进入CSF隔室的出血可能由脑室内出血、实质内出血和/或蛛网膜下出血引起。
如本领域技术人员所熟知的,出血性中风由具有不同自然过程、评估和管理的一系列病理学情况构成。根据病因学的不同,一般将其分类为原发性或继发性。
在一个实施方案中,所述的出血性中风为脑室内出血(IVH)或蛛网膜下出血(SAH)。在一个实施方案中,所述的出血性中风为动脉瘤蛛网膜下出血(aSAH)。
诊断受试者的出血性中风且特别是SAH的方法是本领域技术人员熟知的,其示例性实例包括脑血管造影术、计算机断层扫描(CT)和受试者的CSF中oxyHb和胆红素的分光光度分析(参见,例如,Cruickshank AM.,2001,ACP Best Practice No 166,J.Clin.Path.,54(11):827-830)。
本领域技术人员将理解,出血性中风可以是自发性出血(例如作为破裂动脉瘤的结果)或创伤性出血(例如作为头部创伤的结果)。在一个实施方案中,所述的出血性中风是自发性出血,也称作非创伤性出血。在一个实施方案中,所述的出血性中风是创伤性出血。
术语“脑脊液”或CSF应理解为意指脑室以及颅和脊髓蛛网膜下腔内的流体。脑室、颅和脊髓蛛网膜下腔在本申请中统称为“CSF隔室”。因此,在本申请中所公开的一个实施方案中,所述的方法包括:使有此需要的受试者的CSF隔室暴露于治疗有效量的Hp。
CSF主要但不排他地由脉络丛分泌,脉络丛由进入心室腔的粒状脑膜突起组成,其上皮表面与室管膜连续。研究还提示脑间质液、室管膜和毛细血管也可能在CSF分泌中起作用。估计人类成人的CSF体积为约150mL,典型地在颅腔和脊髓蛛网膜下腔中125mL和在脑室中25mL之间分布,尽管个体之间具有显著的差异。人类成人的CSF分泌可以在每天400-600mL之间变化,其中约60-75%的CSF由侧脑室的脉络丛以及第三脑室和第四脑室的脉络丛产生。CSF的脉络膜分泌典型地包含两个步骤:(i)根据压力梯度将血浆从脉络膜毛细血管被动过滤到脉络膜间质隔室,和(ii)从间质隔室穿过脉络膜上皮主动转运到心室腔,涉及碳酸酐酶和膜离子载体蛋白。CSF通过调节电解质平衡、活性分子的循环和分解代谢物的消除在脑间质液和神经元环境的稳态中起重要作用。CSF将脉络丛分泌产物转运到其作用部位,从而通过浸渍调节脑的某些区域的活性,而突触传递产生更快速的活性变化。脑代谢、过氧化产物和糖基化蛋白的废物随着年龄相关的CSF周转减少而蓄积(Sakka等人,2011,European Annals of Otorhinolaryngology,Head and Neck Diseases,128(6):309-316)。
蛛网膜下出血相关的继发性脑损伤(SAH-SBI)
除了前72小时内的早期脑损伤之外,aSAH患者的后果可以通过迟发性继发性脑损伤来确定,其通典型地发生在动脉瘤破裂后第4天至第10天之间。迟发性继发性脑损伤被认为是多因素的,涉及大血管和微血管功能障碍、神经炎症、神经元凋亡和脑的病理性电活动。大约三分之二的患者在aSAH后发生大脑动脉血管造影性血管痉挛(aVSP)。在aSAH后约三分之一的患者中通常发现具有缺血性脑区域的放射学分界的迟发性脑缺血(DCI)和临床上明显的迟发性缺血性神经功能缺损(DIND)。在本申请中所述的研究中,这些继发性表现中的至少一种的发生定义了蛛网膜下出血相关的继发性脑损伤(SAH-SBI)。
不良继发性神经学后果
在出血性中风(例如SAH)中存活的患者具有发生一种或多种不良继发性神经学后果或并发症的显著风险。如本申请中所用,术语“不良继发性神经学后果”是指出血性中风后的不良神经学事件(脑组织的继发性损伤)。出血性中风后的继发性损伤可能是由原发性损伤引发的一连串事件(例如,质量效应和物理破坏)、通过对血肿的生理反应(例如炎症),和/或通过血液和血液成分的释放导致。不良继发性神经学后果是本领域技术人员熟知的,其示例性实例包括迟发性缺血性神经功能缺损(DIND)、迟发性脑缺血(DCI)、神经毒性、细胞凋亡、炎症、一氧化氮耗竭、氧化性组织损伤、脑血管痉挛、脑血管反应性、水肿和扩散性去极化(参见,例如,Al-Tamimi等人,World Neurosurgery,73(6):654-667(2010);Macdonald等人,Neurocrit.Care,13:416-424(2010);和Macdonald等人,J.Neurosurg.99:644-652(2003))。
术语“治疗(treating)”、“治疗(treatment)”、“治疗(treat)”等在本申请中可互换使用,意指减轻、最小化、减少、缓解、改善或以其他方式抑制不良继发性神经学后果,包括其一种或多种症状,其如本申请中所述。术语“治疗(treating)”、“治疗(treatment)”等在本申请中也可互换使用,意指在可能倾向于发生不良继发性神经学后果或处于发生不良继发性神经学后果的风险中但尚未被诊断为患有不良继发性神经学后果的受试者中预防不良继发性神经学后果发生或延迟不良继发性神经学后果的发作或后续进展。在该上下文中,术语“治疗(treating)”、“治疗(treatment)”等可与术语诸如“预防(prophylaxis)”、“预防(prophylactive)”和“预防性(preventative)”互换使用。然而,应当理解,本申请中所公开的方法不需要完全预防在被治疗的受试者中发生不良继发性神经学后果。可能足够的是,本申请中所公开的方法仅缓解、减少、缓解、改善或以其他方式抑制受试者中的不良继发性神经学后果至与在没有治疗的情况下观察到的不良继发性神经学后果相比存在更少的不良继发性神经学后果和/或更不严重的不良继发性神经学后果的程度。因此,本申请中所述的方法可以减少出血性中风后受试者中不良继发性神经学后果的数量和/或严重程度。
应当理解,本申请中对受试者的提及并不意味着受试者已经患有出血性中风,而且还包括处于出血性中风风险中的受试者。在一个实施方案中,受试者患有(即,正在经历)出血性中风或其症状。在另一个实施方案中,受试者在治疗时未患有出血性中风,但处于出血性中风的风险中。作为一个示例性实例,受试者具有尚未破裂但有破裂风险的动脉瘤。在这种情况下,受试者可以经历手术干预以使动脉瘤破裂的风险最小化(例如,通过手术夹持或血管内盘曲)。因此,如果在手术干预之前、期间或之后动脉瘤破裂,本申请中描述的方法可以适当地被处方给受试者作为预防措施,以最小化、减少、消除或以其他方式抑制不良继发性神经学后果。在这种情况下,本申请中所述的方法可以在手术干预之前、期间或之后用作预防措施。
本申请中所公开的方法提供出血性中风后不良继发性神经学后果的数量和/或严重程度的主观、定性和/或定量降低的程度可以表示为百分比降低,例如,当与使CSF暴露于治疗有效量的Hp之前的不良继发性神经学后果的数量和/或严重程度相比时,降低至少10%,优选约10%至约20%,优选约15%至约25%,优选约20%至约30%,优选约25%至约35%,优选约30%至约40%,优选约35%至约45%,优选约40%至约50%,优选约45%至约55%,优选约50%至约60%,优选约55%至约65%,优选约60%至约70%,优选约65%至约75%,优选约70%至约80%,优选约75%至约85%,优选约80%至约90%,优选约85%至约95%,或最优选约90%至100%。
可以在出血性中风后测量不良继发性神经学后果的数量和/或严重程度的主观、定性和/或定量降低的合适方法是本领域技术人员熟知的,并且将在很大程度上取决于待测量的不良继发性神经学后果的性质。本申请其他部分中描述了示例性实例。
在一个实施方案中,所述不良继发性神经学后果选自迟发性缺血性神经功能缺损(DIND)、迟发性脑缺血(DCI)、神经毒性、炎症、一氧化氮耗竭、氧化性组织损伤、脑血管痉挛、脑血管反应性降低、水肿和扩散性去极化。
在一个实施方案中,所述不良继发性神经学后果为迟发性缺血性神经功能缺损(DIND)。SAH后DIND的是一种严重且知之甚少的脑缺血综合征,其特征在于头痛、脑膜炎和体温升高,通常随后是意识波动下降和出现局灶性神经症状。DIND被特征性地定义为在出血性发作后至少3至4天观察到的神经功能恶化。它也称作临床/症状性血管痉挛。DIND仍然是初始出血幸存者的发病率和死亡率的重要原因。据报道,DIND的患病率为约20%至35%,尽管在血液负荷较高的患者中,这可能高达40%。DIND已被归因于约20%患者的脑梗塞和aSAH后所有死亡和残疾的约13%。确定DIND的合适方法是本领域技术人员熟知的,其示例性实例描述在Dreier等人,Brain,2006;129(12):3224–3237中,其内容通过引用全部并入本申请。在一个实施方案中,通过扩散质量去极化来确定DIND,作为证据,例如,根据皮层脑电图描记法扩散负慢电压。在一个实施方案中,DIND与至少两个GCS水平的意识延迟降低和/或新的局灶性神经功能缺损相关。
在一个实施方案中,所述不良继发性神经学后果为脑血管痉挛。脑血管痉挛或CV(也称作“血管造影脑血管痉挛”)为出血性中风后局灶性缺血的最常见原因之一,并且可以占高达约23%的SAH相关残疾和死亡。CV的特征典型地在于在出血性中风进入蛛网膜下腔后由血管,特别是脑基部的大容量动脉(即脑动脉)的持续收缩引起的血管变窄。因此,术语“血管痉挛”典型地参考血管造影确定的动脉狭窄来使用。血管的持续收缩减少了远端脑区域的灌注并增加了脑血管阻力。如果不治疗,CV可最终导致脑缺血和梗塞形式的神经毒性(脑细胞损伤),主要归因于对脑组织的血液供应受限。CV可以通过本领域技术人员已知的任何合适的手段来检测,其示例性实例包括数字减影血管造影(DSA)、计算机断层扫描(CT)血管造影术(CTA)、磁共振(MR)血管造影(MRA)、经颅多普勒超声检查和导管(脑)血管造影术(CA)。在一个实施方案中,通过数字减影血管造影术(DSA)检测CV。不受理论或特定应用模式的束缚,脑动脉的血管痉挛典型地在SAH后约3天开始,在约7至8天后达到峰值并在截止到约14天消退(参见,例如Weir等人,J.Neurosurg.,48:173-178(1978)),在SAH后4至12天之间具有血管造影术的患者的至少三分之二中发生一定程度的血管造影术狭窄。
CV的发生率取决于SAH后的时间间隔。如本申请其他部分中所述,峰值发病率典型地发生在SAH后约7-8天(范围3-12天)。除SAH后的时间外,影响血管痉挛患病率的其他主要因素为:蛛网膜下腔血液的体积、密度、短暂持续性和分布。CV的预后因素可包括CT扫描时蛛网膜下血的量、高血压、解剖和全身因素、临床等级和患者是否正在接受抗纤维蛋白溶解剂。
CV的症状典型地以亚急性方式发生并且可能波动,并且可以包括过度嗜睡、昏睡、木僵、轻偏瘫或偏瘫、失语症、语言障碍、视野缺陷、注视障碍和颅神经麻痹。尽管一些症状是局部的,但它们通常不能诊断任何特定的病理过程。脑血管造影术典型地用作可视化和研究脑动脉的金标准,尽管也可以使用经颅多普勒超声检查。
在一个实施方案中,所述不良继发性神经学后果为迟发性脑缺血(DCI)。DCI典型地发生在约三分之一的aSAH患者中,并且在这些患者中的一半中导致死亡或永久性残疾(Dorsch和King,Journal of Clinical Neuroscience,1:19-26(1994))。DCI典型地定义为在aSAH患者中放射学检测到的脑梗塞,而没有其他可识别的原因(例如术后干预)。
正如Vergouwen等人报道(Stroke.2010;41:2391-2395),“由迟发性脑缺血引起的临床恶化”和“脑梗塞”的统一定义应在形态学和临床特征方面捕获最相关的要素,而无需假设其发病机理。因为CT/MRI上的脑梗死与SAH后3个月的功能结果强烈相关,并且考虑到其预期的高观察者间符合率、其在镇静和昏迷患者中检测DCI的能力以及其对DCI后果的客观量化,神经成像上的脑梗死可能是比单独由DCI引起的临床恶化更好的结果量度。尽管DCI的先前定义通常将DCI的临床特征与血管造影/经颅多普勒发现或神经成像或尸检中的脑梗死相结合,但作者建议这些应单独报告。他们还建议,由DCI引起的临床恶化不应仅仅是结果的次要量度,因为怀疑观察者间符合率较低。根据Vergouwen等人,由DCI引起的临床恶化的建议定义是:“发生局灶性神经损伤(例如偏瘫、失语症、失用症、偏盲或忽视),或格拉斯哥昏迷量表(总评分或其各个组成部分之一[眼睛、任一侧运动、言语])上至少2分的降低。这应持续至少1小时,在动脉瘤闭塞后即刻不明显,并且不能通过临床评估、脑的CT或MRI扫描以及适当的实验室研究归因于其他原因。”
出血性中风(包括SAH)后的不良继发性神经学后果也已显示了与炎症相关,包括免疫细胞活化和浸润到CSF隔室中以及炎性细胞因子的释放。正如Miller等人(Biomed ResInt.2014;2014:384342)所述,研究表明炎症是SAH后神经损伤的直接介体和SAH后血管痉挛的致病因素。牵涉SAH病理生理学的关键炎性分子是本领域技术人员熟知的,其示例性实例包括选择蛋白(L-选择蛋白和P-选择蛋白)、整联蛋白(例如,淋巴细胞功能相关抗原1(LFA-1)和Mac-1整联蛋白(CD11b/CD18))、TNFα、单核细胞趋化蛋白1(MCP-1)、细胞间粘附分子1(ICAM-1)、促炎性白介素(例如,IL-1、IL-6、IL-1B、IL-8)和内皮素1(ET-1)。在本申请中所公开的一个实施方案中,不良继发性神经学后果与选自以下的一种或多种炎性标志物的差异表达相关:选择蛋白(例如,L-选择蛋白和P-选择蛋白)、整联蛋白(例如,淋巴细胞功能相关抗原1(LFA-1)和Mac-1整联蛋白(CD11b/CD18))、TNFα、单核细胞趋化蛋白1(MCP-1)、细胞间粘附分子1(ICAM-1)、促炎性白细胞介素和内皮缩血管肽1(ET-1)。在一个实施方案中,促炎性白细胞介素选自IL-1、IL-6、IL-1B和IL-8。
Nissen等人此前已经显示了,当与无DIND的患者相比时,DIND患者中P-选择蛋白的血清浓度显著更高(J Neurol Neurosurg Psychiatry2001;71:329–333)。作者还证实,当与无DIND的患者相比时,患有DIND的患者中L-选择蛋白的血清浓度显著更低。因此,在一个实施方案中,本申请中所述的方法减少出血性中风后不良继发性神经学后果的数量和/或严重性的程度根据受试者的血清或CSF中P-选择蛋白浓度的降低来确定,例如,当与治疗前受试者中的P-选择蛋白的浓度相比时,降低至少10%,优选约10%至约20%,优选约15%至约25%,优选约20%至约30%,优选约25%至约35%,优选约30%至约40%,优选约35%至约45%,优选约40%至约50%,优选约45%至约55%,优选约50%至约60%,优选约55%至约65%,优选约60%至约70%,优选约65%至约75%,优选约70%至约80%,优选约75%至约85%,优选约80%至约90%,优选约85%至约95%,或最优选约90%至100%。在另一个实施方案中,本申请中所述的方法减少出血性中风后不良继发性神经学后果的数量和/或严重性的程度根据受试者的血清或CSF中L-选择蛋白浓度的增加来确定,例如,当与治疗前受试者中L-选择蛋白的浓度相比时,增加至少10%,优选约10%至约20%,优选约15%至约25%,优选约20%至约30%,优选约25%至约35%,优选约30%至约40%,优选约35%至约45%,优选约40%至约50%,优选约45%至约55%,优选约50%至约60%,优选约55%至约65%,优选约60%至约70%,优选约65%至约75%,优选约70%至约80%,优选约75%至约85%,优选约80%至约90%,优选约85%至约95%,或最优选约90%至100%。可以测量P-选择蛋白和L-选择蛋白浓度的方法是本领域技术人员熟知的,其示例性实例描述在Nissen等人(J Neurol Neurosurg Psychiatry 2001;71:329–333)中,其内容通过引用全部并入本申请。
促炎性细胞因子IIL-1B、IL-6、IL-8、TNFα和MCP-1以及内皮缩血管肽-1的水平也已显示了在SAH后的患者中升高(Miller等人Biomed Res Int.2014;2014:384342)。因此,在本申请中所公开的实施方案中,本申请中所述的方法减少出血性中风后不良继发性神经学后果的数量和/或严重性的程度根据受试者的血清或CSF中促炎性细胞因子的浓度减少来确定,例如,当与治疗前受试者中促炎性细胞因子的浓度相比时,减少至少10%,优选约10%至约20%,优选约15%至约25%,优选约20%至约30%,优选约25%至约35%,优选约30%至约40%,优选约35%至约45%,优选约40%至约50%,优选约45%至约55%,优选约50%至约60%,优选约55%至约65%,优选约60%至约70%,优选约65%至约75%,优选约70%至约80%,优选约75%至约85%,优选约80%至约90%,优选约85%至约95%,或最优选约90%至100%,其中所述促炎分子选自IL-1B、IL-6、IL-8、TNFα、MCP-1和内皮缩血管肽-1。可以测量如本申请中所述的炎性介质的浓度的方法是本领域技术人员熟知的。
也已显示了CSF中的一氧化氮(NO)耗竭贡献了出血性中风后不良继发性神经学后果的发病机制(参见Pluta等人JAMA.2005;293(12):1477-1484)。SAH后CSF中NO水平降低,这归因于:(1)氧合血红蛋白对动脉外膜中含有神经元一氧化氮合酶(NOS)的神经元的毒性;(2)内皮NOS的内源性抑制;以及(3)通过从蛛网膜下凝块释放的氧合血红蛋白清除一氧化氮。因此,在本申请中所公开的一个实施方案中,本申请中所述的方法减少出血性中风后不良继发性神经学后果的数量和/或严重性的程度根据受试者的CSF中NO浓度的增加来确定,例如,当与治疗前受试者的CSF中NO的浓度相比时,增加至少10%,优选约10%至约20%,优选约15%至约25%,优选约20%至约30%,优选约25%至约35%,优选约30%至约40%,优选约35%至约45%,优选约40%至约50%,优选约45%至约55%,优选约50%至约60%,优选约55%至约65%,优选约60%至约70%,优选约65%至约75%,优选约70%至约80%,优选约75%至约85%,优选约80%至约90%,优选约85%至约95%,或最优选约90%至100%。可以测量CSF中NO浓度的方法是本领域技术人员熟知的,其示例性实例描述在Pluta等人(JAMA.2005;293(12):1477-1484)中,其内容通过引用全部并入本申请。
在一个实施方案中,所述不良继发性神经学后果为氧化性组织损伤。如本申请其他部分中所述,本发明人首次证实治疗有效量的Hx可以降低CSF中无细胞血红素的氧化电位。因此,在一个实施方案中,如本申请中所述,使有此需要的受试者的CSF暴露于Hx,减少氧化组织损伤。测定氧化性组织损伤的合适方法是本领域技术人员熟知的,其示例性实例描述在Katerji等人(2019;Oxid.Med.Cell Longey;1279250)中,包括测定脂质过氧化的终产物丙二醛(MDA)的水平。在一个实施方案中,如本申请中所述,使有此需要的受试者的CSF暴露于Hx,减少脂质过氧化。
在一些实施方案中,治疗性Hx可以防止无细胞血红素从CSF隔室渗透到脑的间质空间中,从而抑制无细胞血红素对脑血管系统和脑实质的毒性作用。因此,在一个实施方案中,所述不良继发性神经学后果为脑实质内的不良继发性神经学后果。
血红素结合蛋白
血红素结合蛋白为由单个439个氨基酸长的肽链组成的61kDa血浆β-1B糖蛋白,其由两个四叶β-螺旋桨结构域形成,类似于以90°角锁定在一起并通过结构域间接头肽连接的两个厚盘。由于血管内和血管外溶血而释放到血液中的血红素结合在由结构域间接头肽形成的口袋中的两个四叶β-螺旋桨结构域之间。残基His213和His266配位血红素铁原子,得到稳定的双组氨酰基复合物,类似于血红蛋白。
血红素结合蛋白包含约20%的碳水化合物,包括唾液酸、甘露糖、半乳糖和葡糖胺。在蛋白质序列中发现12个半胱氨酸残基,可能占6个二硫桥。血红素结合蛋白由于其以高亲和力(K
除血红素结合之外,还报道了血红素结合蛋白制剂具有丝氨酸蛋白酶活性(Lin等人,2016;Molecular Medicine 22:22-31)和几种其他功能,例如表现出抗炎和促炎活性、抑制细胞粘附和结合某些二价金属离子。
尽管内源性血红素结合蛋白可以控制游离血红素在生理稳态条件下的不良作用,但它在病理生理条件下维持稳态血红素水平几乎没有作用,例如与溶血相关的那些,其中高水平的血红素导致内源性血红素结合蛋白耗竭,从而导致血红素介导的氧化组织损伤。
应当理解,天然存在的和重组形式的Hx适用于本申请中所述的方法,只要它们能够与无细胞血红素形成复合物,且由此中和无细胞血红素的生物活性即可。Hx的合适天然存在形式是本领域技术人员已知的,其示例性实例描述在UniProtKB P02790中。Koch等人(2002,Clin.Chem.48:1377-1382)和Takahashi等人(PNAS,1985,82(1):73-77),其全部内容通过引用并入本申请。
在一个实施方案中,Hx包含血浆来源的Hx、由血浆来源的Hx组成或基本上由血浆来源的Hx组成。在一个实施方案中,Hx是人Hx。人类Hx的示例性实例是本领域技术人员熟知的,其示例性示例描述在UniProtKB P02790中,并再现如下:
MARVLGAPVA LGLWSLCWSL AIATPLPPTS AHGNVAEGET KPDPDVTERC SDGWSFDATTLDDNGT MLFF KGEFVWKSHK WDRELISERW KNFPSPVDAA FRQGHNSVFL IKGDKVWVYP PEKKEKGYPKLLQDEFPGIP SPLDAAVECH RGECQAEGVL FFQGDREWFW DLATGTMKER SWPAVGNCSS ALRWLGRYYCFQGNQFLRFD PVRGEVPPRY PRDVRDYFMP CPGRGHGHRN GTGHGNSTHH GPEYMRCSPH LVLSALTSDNHGATYAFSGT HYWRLDTSRD GWHSWPIAHQ WPQGPSAVDA AFSWEEKLYL VQGTQVYVFL TKGGYTLVSGYPKRLEKEVG TPHGIILDSV DAAFICPGSS RLHIMAGRRL WWLDLKSGAQ ATWTELPWPH EKVDGALCMEKSLGPNSCSA NGPGLYLIHG PNLYCYSDVE KLNAAKALPQ PQNVTSLLGC TH
在一个实施方案中,Hx包含如前所述的人Hx的序列,由如前所述的人Hx的序列组成或基本上由如前所述的人Hx的序列组成。
用于从Hx-的天然来源(例如,血浆)分离Hx的各种方案将是本领域技术人员熟知的,其示例性实例描述在WO 2014/055552和WO 2019/030262中,其全部内容通过引用并入本申请。
应当理解,如本申请中所用,术语“血红素结合蛋白”(Hx)包括Hx的所有表型(包括所有同种型)。Hx可以是同源的(在其基本上由相同同种型的HX组成的情况下)或异源的(在其包含不同Hx同种型的组合的情况下,包括Hx的人和非人同种型)。用于确定分离物中存在的Hx同种型的合适方法是本领域技术人员熟知的,其示例性实例包括高效尺寸排阻色谱法(HPLC-SEC测定)和Hx ELISA。
Hx可以是天然存在的Hx(例如,血浆来源的),或者它可以作为重组蛋白产生。在一个实施方案中,Hx是血浆来源的。在一个实施方案中,Hx包含重组Hx、由重组Hx组成或基本上由重组Hx组成。
除非另有说明,否则如本申请中所用,术语Hx包括天然或天然存在的Hx的功能类似物。术语“功能性类似物”应理解为意指具有与天然存在的(天然的)Hx基本上相同的生物活性的试剂,只要该生物活性至少是类似物与无细胞血红素形成复合物并由此中和其生物活性的能力。所谓“基本上相同的生物活性”典型地是指功能类似物对无细胞血红素的结合亲和力是天然存在的Hx(包括天然存在的Hx同种型(例如,Hx的人和/或非人同种型))的结合亲和力的至少40%(例如,40%、45%、50%、55%、60%、65%、70%、85%、90%、95%、100%、105%、100%、105%、110%、115%、120%、125%、130%、135%、140%、145%、150%、155%、160%、165%等)。用于确定一种物质是否Hx的功能类似物的合适方法是本领域技术人员熟知的,其示例性实例包括被描述在本申请其他部分中(例如,功能类似物减少无细胞血红素诱导的脑血管痉挛的能力)。
在本申请中所公开的一个实施方案中,Hx的功能类似物为天然Hx的功能片段。天然Hx的功能性片段可以是任何合适的长度,只要该片段保留与无细胞血红素形成复合物且由此中和其生物活性的能力即可。
在另一个实施方案中,功能类似物为具有与天然存在的(天然的)Hx分子不同的氨基酸序列的肽(即,比较物)。功能类似物可以包括具有与天然Hx的α和/或β链的氨基酸序列相差一个或多个(例如,1、2、3、4、5、6、7、8、9个或更多个)氨基酸替代的氨基酸序列的分子,其中所述的差异不会或不会完全消除类似物与无细胞血红素形成复合物和由此中和其生物活性的能力。在一些实施方案中,与天然Hx相比,功能性类似物包含增强类似物与无细胞血红素形成复合物的能力的氨基酸替代。在一个实施方案中,功能类似物具有与天然Hp的α和/或β链的氨基酸序列相差一个或多个保守氨基酸替代的氨基酸序列。如本申请中所用,术语“保守氨基酸替代”是指改变给定位置处的氨基酸同一性以将其替换为大致相等大小、电荷和/或极性的氨基酸。氨基酸的天然保守替代的实例包括以下8个替代组(由常规的单字母代码表示):(1)M,I,L,V;(2)F,Y,W;(3)K,R,(4)A,G;(5)S,T;(6)Q,N;(7)E,D;以及(8)C,S。
在一个实施方案中,功能类似物与天然Hx的α和/或β链的氨基酸序列具有至少85%的序列同一性。提及“至少85%”包括85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性或相似性,例如,在最佳比对或最佳拟合分析后。因此,在一个实施方案中,所述序列与本申请中所鉴定的序列具有至少85%,优选至少86%,优选至少87%,优选至少88%,优选至少89%,优选至少90%,优选至少91%,优选至少92%,优选至少93%,优选至少94%,优选至少95%,优选至少96%,优选至少97%,优选至少98%,优选至少99%,或优选100%的序列同一性或序列同源性,例如,在最佳比对或最佳拟合分析后。
如本申请中所用,术语“同一性”、“相似性”、“序列同一性”、“序列相似性”、“同源性”、“序列同源性”等意指在比对序列中的任何特定氨基酸残基位置处,氨基酸残基在比对序列之间是相同的。如本申请中所用,术语“相似性”或“序列相似性”表示在比对序列中的任何特定位置,氨基酸残基在序列之间具有相似类型。例如,亮氨酸可以替代异亮氨酸或缬氨酸残基。如本申请其他部分中所述,这可以称作保守替代。在一个实施方案中,氨基酸序列可以通过保守替代其中包含的任何氨基酸残基来修饰,使得当与未修饰的(天然)Hx多肽相比时,修饰对修饰的多肽的结合特异性或功能活性无影响。
在一些实施方案中,关于肽序列的序列同一性涉及在比对序列并引入缺口(如果必要)以实现最大百分比同源性并且不考虑任何保守替代作为序列同一性的一部分之后,候选序列中与相应肽序列的残基相同的氨基酸残基的百分比。N-末端或C-末端延伸和插入都不应被解释为降低序列同一性或同源性。用于进行两个或更多个氨基酸序列的比对并确定它们的序列同一性或同源性的方法和计算机程序是本领域技术人员熟知的。例如,两个氨基酸序列的同一性或相似性百分比可以使用算法容易地计算,例如BLAST、FASTA或Smith-Waterman算法。
用于确定氨基酸序列“相似性”的技术是本领域技术人员众所周知的。通常,“相似性”是指两个或更多个肽序列的氨基酸与氨基酸的精确比较或在适当位置,其中氨基酸相同或具有相似的化学和/或物理性质,例如电荷或疏水性。然后可以在比较的肽序列之间确定所谓的“百分比相似性”。通常,“同一性”是指两个肽序列的氨基酸与氨基酸的精确对应性。
还可以通过确定它们的“同一性百分比”来比较两个或更多个肽序列。两个序列的同一性百分比可以描述为两个比对序列之间的精确匹配数除以较短序列的长度并乘以100。核酸序列的近似比对根据Smith和Waterman,Advances在Applied Mathematics 2:482-489(1981)中的局部同源性算法提供。使用由Dayhoff开发的评分矩阵(Atlas ofProtein Sequences and Structure,M.O.Dayhoff编辑,5增刊3:353-358,NationalBiomedical Research Foundation,Washington,D.C.,USA)可以将该算法扩展到与肽序列一起使用,并由Gribskov(Nucl.Acids Res.14(6):6745-6763,1986)归一化。用于计算序列之间的同一性或相似性百分比的合适程序通常是本领域已知的。
用于比对比较窗口的序列的最佳比对可以通过算法的计算机化实施(WisconsinGenetics Software Package Release 7.0中的GAP,BESTFIT、FASTA和TFASTA,GeneticsComputer Group,575Science Drive Madison,WI,USA)或通过检查和由所选择的各种方法中的任一种产生的最佳比对(即,在比较窗口上产生最高百分比同源性)来进行。还可以参考BLAST程序家族,例如Altschul等人(1997,Nucl.Acids Res.25:3389所公开的。序列分析的详细讨论可以在Ausubel等人("Current Protocols in Molecular Biology",JohnWiley&Sons Inc,1994-1998,第15章)的第19.3单元中找到。
在一个实施方案中,功能性类似物包括相对于天然Hx的氨基酸替代和/或其他修饰,以增加该类似物的稳定性或增加该类似物的溶解度。
功能类似物可以是天然存在的化合物/肽,或者其可以使用本领域技术人员已知的方法通过化学合成来合成产生。
Hx可以适当地在微生物中作为重组蛋白产生,其可以被分离,并且如果期望,可以进一步纯化。用于产生重组Hx的合适微生物是本领域技术人员熟知的,其示例性实例包括细菌、酵母或真菌、真核细胞(例如,哺乳动物或昆虫细胞)或重组病毒载体(例如,腺病毒、痘病毒、疱疹病毒、塞母利基森林病毒、杆状病毒、噬菌体、辛德毕斯病毒或仙台病毒)。用于产生重组肽的合适细菌是本领域技术人员熟知的,其示例性实例包括大肠杆菌、枯草芽孢杆菌或能够表达所述肽序列的任何其他细菌。用于产生重组肽的合适酵母类型的示例性实例包括酿酒酵母菌(Saccharomyces cerevisiae)、粟酒裂殖酵母(Schizosaccharomycespombe)、假丝酵母属(Candida)、巴斯德毕赤酵母(Pichia pastoris)或能够表达肽的任何其他酵母。相应的方法是本领域众所周知的。用于分离和纯化重组产生的肽序列的方法也是本领域众所周知的,并且包括例如凝胶过滤、亲和色谱法和离子交换色谱法。
为了促进重组Hx的分离,如本申请中所述,可以制备融合多肽,其中Hx的肽序列或其功能类似物与异源多肽翻译融合(共价连接),这使得能够通过亲和色谱分离。合适的异源多肽的示例性实例为His-Tag(例如His
为了制备重组Hx,噬菌体文库和/或肽文库也是合适的,例如,通过组合化学产生或通过针对最不同结构的高通量筛选技术获得(参见,例如,Carlos F.Barbas(Editor)等人的Display:A Laboratory Manua;以及Willats WG Phage display:practicalitiesand prospects.Plant Mol.Biol.2002年12月;50(6):837-54)。
重组HX的示例性实例包括登录号为NP_005134(如Morishita等人2018,Clin.Chim.Acta 487,84-89所述)的肽和登录号为P00738的肽。
Hx可以融合、偶联或以其他方式附接至作为融合蛋白的一部分的一个或多个异源部分。一个或多个异源部分可以改善、增强或以其他方式延长Hx的活性或稳定性。在一个实施方案中,如本申请中所述的Hx适当地连接至异源部分以延长Hx在体内的半衰期。合适的半衰期延长异源部分是本领域技术人员熟知,其示例性实例包括聚乙二醇(PEG化)、糖基化PEG、羟乙基淀粉(HES化)、聚唾液酸、弹性蛋白样多肽、肝素前体聚合物和透明质酸。因此,在本申请中所公开的一个实施方案中,异源部分选自聚乙二醇(PEG化)、糖基化PEG、羟乙基淀粉(HES化)、聚唾液酸、弹性蛋白样多肽、肝素前体聚合物和透明质酸。在其他实施方案中,异源部分可以是与HX融合的异源氨基酸序列。
或者或此外,异源部分可以与Hx化学缀合,例如共价键。延长半衰期的异源部分可以通过本领域技术人员已知的任何合适的方式融合、缀合或以其他方式附接至Hx,其示例性实例是通过化学接头。该缀合技术的原理已经由Conjuchem LLC(参见,例如美国专利7,256,253)以示例性方式描述,其全部内容通过引用并入本申请。
在其他实施方案中,异源部分为半衰期增强蛋白(HLEP)。合适的半衰期增强蛋白为本领域技术人员熟知的,其示例性实例包括白蛋白或其片段。因此,在一个实施方案中,HLEP为白蛋白或其片段。白蛋白或其片段的N-末端可以与Hx的α和/或β链的C-末端融合。或者或此外,白蛋白或其片段的C-末端可以与Hx的α和/或β链的N-末端融合。一个或多个HLEP可以与Hx的α和/或β链的N-或C-末端部分融合,条件是它们不消除Hx与无细胞血红素的结合。然而,应当理解,Hx与无细胞血红素的结合的一些降低可以是可接受的,只要融合蛋白的Hx成分仍然能够与无细胞血红素形成复合物且由此中和无细胞血红素即可。
融合蛋白可以进一步包含位于Hx和异源部分之间的化学键或接头序列。接头序列可以是由一个或多个氨基酸组成的肽接头,特别是1-50,优选1-30,优选1-20,优选1-15,优选1-10,优选1-5,或更优选1-3(例如1、2或3个)氨基酸,并且它们可以彼此相同或不同。优选地,接头序列不存在于野生型Hx中的相应位置。存在于所述接头序列中的优选氨基酸包括Gly和Ser。在一个优选的实施方案中,接头序列对根据本申请中所公开的方法治疗的受试者基本上无免疫原性。所谓基本上无免疫原性是指接头序列在其施用的受试者中不会产生对接头序列的可检测的抗体应答。优选的接头可以由交替的甘氨酸和丝氨酸残基组成。合适的接头是本领域技术人员熟知的,其示例性实例描述在WO2007/090584中。在一个实施方案中,Hx和异源部分之间的肽接头包含肽序列、由肽序列组成或基本上由肽序列组成,所述肽序列在人蛋白中用作天然结构域间接头。这类肽序列在其天然环境中可以位于靠近蛋白质表面并且可接近免疫系统,使得人们可以推定对该序列的天然耐受性。示例性实例在WO 2007/090584中给出。合适的可裂解接头序列描述在例如WO 2013/120939 A1中。
下文描述了合适的HLEP序列的示例性实例。本申请同样公开了与各HLEP的确切“N末端氨基酸”或确切“C末端氨基酸”的融合,或与各HLEP的“N末端部分”或“C末端部分”的融合,其包括HLEP的一个或多个氨基酸的N末端缺失。融合蛋白可以包含多于一个HLEP序列,例如两个或三个HLEP序列。这些多个HLEP序列可以串联融合至Hp的α和/或β链的C-末端部分,例如作为连续重复。
在一个实施方案中,异源部分是半衰期延长多肽。在一个实施方案中,半衰期延长多肽选自:白蛋白、白蛋白家族的成员或其片段、具有大流体动力学体积的溶剂化随机链(例如XTEN(参见Schellenberger等人2009;Nature Biotechnol.27:1186-1190)、同源氨基酸重复(HAP)或脯氨酸-丙氨酸-丝氨酸重复(PAS)、afamin、甲胎蛋白、维生素D结合蛋白、转铁蛋白或其变体或片段、人绒毛膜促性腺激素-β亚单位的羧基-末端肽(CTP)、能够结合新生儿Fc受体(FcRn)的多肽,特别是免疫球蛋白恒定区及其部分,例如Fc片段、能够在生理条件下结合白蛋白、白蛋白家族成员或其片段或免疫球蛋白恒定区或其部分的多肽或脂质。免疫球蛋白恒定区或其部分优选是免疫球蛋白G1的Fc片段(IgG1)、免疫球蛋白G2的Fc片段(IgG2)或免疫球蛋白A的Fc片段(IgA)。如本申请中所用,半衰期增强多肽可以是全长半衰期增强蛋白或其一个或多个片段,其能够稳定或延长Hx的治疗活性或生物活性,特别是增加Hp的体内半衰期。与不存在HLEP的相应Hx相比,这类片段的长度可以为10个或更多个氨基酸,或者可以包括来自HLEP序列的至少约15个、优选至少约20个、优选至少约25个、优选至少约30个、优选至少约50个、或更优选至少约100个或更多个连续氨基酸,或者可以包括相应HLEP的部分或全部特定结构域,只要HLEP片段提供至少10%、优选至少20%或更优选至少25%的功能性半衰期延长即可。确定异源部分是否在体内或体外为Hx提供功能性半衰期延长的方法是本领域技术人员熟知的,其示例性实例在本申请其他部分中描述。
如本申请中所述,融合蛋白的HLEP部分可以为野生型HELP的变体。术语“变体”包括插入、缺失和/或替代,其可以为保守性或非保守性的,其中这类变化基本上不改变Hx与无细胞血红素形成复合物且由此中和无细胞血红素的能力。HLEP可以适当地衍生自任何脊椎动物,特别是任何哺乳动物,例如人、猴、牛、绵羊或猪。非哺乳动物HLEP包括但不限于母鸡和鲑鱼。
如本申请中所述的融合蛋白可以通过框内连接至少两个编码Hx和异源部分(例如HLEP)的DNA序列来产生。本领域技术人员将理解,融合蛋白DNA序列的翻译将产生单个蛋白质序列。作为编码根据本申请中所公开的实施方案的肽接头的DNA序列的框内插入的结果,可以获得包含Hp、合适的接头和异源部分的融合蛋白。
在本申请中所公开的一个实施方案中,Hx与异源部分融合。在一个实施方案中,异源部分包含选自以下的多肽、由其组成或基本上由其组成:白蛋白或其片段、转铁蛋白或其片段、人绒毛膜促性腺激素的C末端肽、XTEN序列、同型氨基酸重复(HAP)、脯氨酸-丙氨酸-丝氨酸重复(PAS)、afamin、α-甲胎蛋白、维生素D结合蛋白、能够在生理条件下结合白蛋白或免疫球蛋白恒定区的多肽、能够结合新生儿Fc受体(FcRn),特别是免疫球蛋白恒定区及其部分、优选免疫球蛋白的Fc部分的多肽。以及任何前述的组合。在另一个实施方案中,异源部分选自羟乙基淀粉(HES)、聚乙二醇(PEG)、聚唾液酸(PSA)、弹性蛋白样多肽、肝素前体聚合物、透明质酸和白蛋白结合配体,例如脂肪酸链,以及任何前述的组合。
术语“人血清白蛋白”(HSA)和“人白蛋白”(HA)和“白蛋白”(ALB)在本申请中可互换使用。术语“白蛋白”和“血清白蛋白”更宽泛,并且涵盖人血清白蛋白(及其片段和变体),以及来自其他物种的白蛋白(及其片段和变体)。
如本申请中所用,“白蛋白”统称为白蛋白多肽或氨基酸序列,或白蛋白片段或变体,其具有白蛋白的一种或多种功能活性(例如,生物活性)。特别地,“白蛋白”是指人白蛋白或其片段,包括成熟形式的人白蛋白或来自其他脊椎动物的白蛋白或其片段,或这些分子或其片段的类似物或变体。在如本申请所公开的一些实施方案中,替代性术语“FP”用于鉴定HLEP,特别是将白蛋白定义为HLEP。
本申请中所述的融合蛋白可以适当地包含人白蛋白的天然存在的多态变体和/或人白蛋白的片段。一般而言,白蛋白片段或变体的长度为至少10个,优选至少40个,或最优选超过70个氨基酸。
在一个实施方案中,HLEP是与FcRn受体的结合增强的白蛋白变体。与融合至野生型白蛋白的Hx或其功能性片段相比,这类白蛋白变体可以产生Hx或其功能类似物的更长血浆半衰期。本申请中所述融合蛋白的白蛋白部分可以适当地包含人白蛋白的至少一个亚结构域或结构域或其保守修饰物。
在一个实施方案中,异源部分是免疫球蛋白分子或其功能片段。本领域已知免疫球蛋白G(IgG)恒定区(Fc)增加治疗性蛋白质的半衰期(参见,例如Dumont J A等人2006.BioDrugs 20:151-160)。重链的IgG恒定区由3个结构域(CH1-CH3)和铰链区组成。免疫球蛋白序列可以来源于任何哺乳动物,或分别衍生自亚类IgG1、IgG2、IgG3或IgG4。没有抗原结合结构域的IgG和IgG片段也可以用作异源部分,包括作为HLEP。Hp或其功能类似物可以通过抗体的铰链区或肽接头(其甚至可以是可裂解的)适当地与IgG或IgG片段连接。几篇专利和专利申请描述了治疗性蛋白质与免疫球蛋白恒定区的融合物以增强治疗性蛋白质的体内半衰期。例如,US2004/0087778和WO 2005/001025描述了Fc结构域或至少部分免疫球蛋白恒定区与生物活性肽的融合蛋白,其增加肽的半衰期,否则其将在体内快速消除。描述了Fc-IFN-β融合蛋白,其实现了增强的生物活性、延长的循环半衰期和更大的溶解度(WO 2006/000448A2)。公开了具有延长的血清半衰期和增加的体内效力的Fc-EPO蛋白(WO2005/063808 A1),以及与G-CSF(WO 2003/076567A2)、胰高血糖素样肽-1(WO 2005/000892A2)、凝血因子(WO 2004/101740A2)和白细胞介素-10(美国专利号6,403,077)的Fc融合物,所有这些都具有半衰期增强特性。
可以根据本发明使用的合适HLEP的示例性实例也描述在WO 2013/120939A1中,其内容通过引用全部并入本申请。
如本申请中所用,术语“治疗有效量”是指CSF中Hx的量或浓度,其足以允许Hx与CSF中存在的无细胞血红素结合并与其形成复合物,且由此以其他方式中和无细胞血红素的其他不良生物作用。本领域技术人员可以理解,肽的治疗有效量可以根据若干因素而变化,其示例性实例包括Hx是否直接施用于受试者(例如,经鞘内、颅内或脑室内)、待治疗受试者的健康和身体状况、待治疗受试者的分类群、出血的严重程度(例如出血程度)、施用途径、CSF隔室中无细胞血红素的浓度和/或量以及任意上述的组合。
Hx的治疗有效量典型地落入本领域技术人员可以确定的相对宽的范围内。Hx的合适治疗有效量的示例性实例包括约2μM至约1mM,优选约2μM至约400μM,优选约5μM至约400μM,优选约5μM至约200μM,或更优选为约10μM至约200μM。
在一个实施方案中,Hx的治疗有效量为约2μM至约1mM在一个实施方案中,Hx的治疗有效量为约2μM至约400μM。在一个实施方案中,Hx的治疗有效量为约5μM至约200μM。在一个实施方案中,Hx的治疗有效量为约10μM至约200μM。
在一个实施方案中,Hx的治疗有效量为与出血后受试者的CSF中无细胞血红素浓度至少等摩尔的量。在另一个实施方案中,Hx的治疗有效量是足以在CSF中复合约3μM至约1,200μM无细胞Hb的量。在一个实施方案中,Hx的治疗有效量为出血后受试者的CSF中无细胞血红蛋白(Hb)的量的至少四倍。测量CSF中无细胞Hb和血红素浓度的合适方法是本领域技术人员已知的,其示例性实例描述在Nyakundi等人(2020,Oxid Med Cell Longev,2020,8929020),Righy等人(2018,Rev Bras Ter Intestiva,30(1):21-27),Cruickshank AM.(2001,ACP Best Practice No 166,J.Clin.Path.,54(11):827-830),Hugelshofer M.等人(2018.World Neurosurg.;120:e660–e666)和Hugelshofer M.等人(J ClinInvest.2019;129(12):5219-5235)中,其内容通过引用全部并入本申请。
应当理解,如本申请中所述,实现治疗有效量的Hx可取决于Hx或其功能性类似物所暴露于的CSF的最终体积。例如,当将Hx施用于成人受试者(例如,经鞘内)时,并且考虑到成人受试者中CSF的平均体积为约150mL,通过向受试者施用约310μM Hx的5mL溶液可以实现约10μM Hx的治疗有效量。在另一个示例性实例中,本申请中所述的方法包括从受试者中取出50mL的CSF,并将其替换为50mL的包含约30μM Hx的人工CSF,从而在受试者的CSF隔室中实现约10μM Hx的治疗有效量。
还可以调节Hx的剂量以提供最佳治疗反应。例如,可以每天、每周或其他合适的时间间隔施用几个分开的剂量,或者可以根据情况的紧急程度所示按比例减少剂量。
如本申请中所用,术语“暴露”意指使CSF与Hx以允许Hx与CSF中存在的无细胞血红素结合并与其形成复合物的方式接触,由此血红素:Hx复合物的形成基本上中和了无细胞血红素对脑组织的其它不良生物作用。所谓“基本上中和”意指对物细胞血红素对脑组织的不良生物作用的减少,正如主观或定性地表示为与不存在治疗性Hx下无细胞Hb对脑组织的生物作用相比,百分比减少至少10%,优选约10%至约20%,优选约15%至约25%,优选约20%至约30%,优选约25%至约35%,优选约30%至约40%,优选约35%至约45%,优选约40%至约50%,优选约45%至约55%,优选约50%至约60%,优选约55%至约65%,优选约60%至约70%,优选约65%至约75%,优选约70%至约80%,优选约75%至约85%,优选约80%至约90%,优选约85%至约95%,或最优选约90%至100%,包括减少至少10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45,、46,、47,、48、49、50、51、52,、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100%。可以测量或确定(定性或定量)无细胞Hx的不良生物作用的降低的方法是本领域技术人员熟知的,其示例性实例在本申请其他部分中描述。
还如本申请中所述,本发明人还首次证实,治疗有效量的Hx可以防止降低CSF中无细胞血红素的氧化电位,如用硫代巴比妥酸反应物质(TBARS)测定通过丙二醛评估的。
应当理解,如本申请中所述,将有需要的受试者的CSF暴露于治疗有效量的Hx的方式可以改变,这取决于例如所述暴露是在有需要的受试者的CSF室内进行(即,体内)还是在从受试者获得的CSF中体外进行(即,离体)。当所述暴露在有需要的受试者的CSF隔室内进行时(即,在体内),选择Hx的施用途径以允许Hx接触CSF隔室内的无细胞血红素。合适的施用途径是本领域技术人员熟知的,其示例性实例包括鞘内、颅内和脑室内。在一个实施方案中,治疗有效量的Hx通过例如在出血性中风后放置在受试者中的脑室外引流管施用,以暂时引流CSF并降低颅内压。
在一个实施方案中,经颅内向受试者施用Hx。
在一个实施方案中,经鞘内向受试者施用Hx。
在一个实施方案中,经鞘内将Hx施用到椎管内。
在一个实施方案中,经鞘内将Hx施用到蛛网膜下腔中。
在一个实施方案中,经脑室内将Hx施用于受试者。
在一个实施方案中,所述方法包括:经鞘内向受试者施用治疗有效量的Hx。在一个实施方案中,所述方法包括:经鞘内将治疗有效量的Hx施用至受试者的椎管内。在一个实施方案中,所述方法包括:经鞘内将治疗有效量的Hx施用至受试者的蛛网膜下腔中。在一个实施方案中,所述方法包括:经脑室内向受试者施用治疗有效量的Hx。
或者或此外,本申请中所述的方法包括从有需要的受试者中取出CSF,使CSF暴露于治疗有效量的Hx持续足以允许Hx与CSF中的无细胞血红素形成复合物并由此中和CSF中的无细胞血红素的一段时间,除去由此在CSF中形成的血红素:Hx复合物以产生血红素减少的CSF,并将血红素减少的CSF施用于受试者(例如,经鞘内或脑室内)。应当理解,从CSF隔室中除去CSF典型地不会导致CSF隔室完全不含CSF,注意到至少一些CSF会保留在CSF隔室中。任选地,一旦除去CSF,可以用药学上可接受的洗涤溶液冲洗CSF隔室,以除去可能存在于CSF隔室中的至少一些残留Hx。所述洗涤溶液可以任选地包含Hx,以进一步复合并由此中和可能存在于CSF隔室中的至少一些残留的无细胞血红素。在一个实施方案中,所述洗涤溶液为人工CSF,如本申请其他部分中所述。
在一个实施方案中,本申请中所述的方法包括从有需要的受试者的CSF隔室中取出CSF样品,向CSF样品中加入Hx以获得富含Hx的CSF样品,将富含Hx的CSF样品施用于受试者的CSF隔室,从而将CSF隔室暴露于治疗有效量的Hx并持续足以使Hx与受试者的CSF中的无细胞血红素形成复合物并由此中和受试者的CSF中的无细胞血红素的一段时间,并任选地重复上述步骤。优选地,确定添加到CSF样品中的Hx的量,使得在施用于受试者后,将在受试者的CSF内提供治疗有效量的Hx。因此,待添加到CSF样品中的Hx的量取决于取出并重新施用于受试者的CSF样品的体积。
在一个实施方案中,所述方法包括:
(i)出血后从受试者的CSF隔室中得到CSF样品;
(ii)将Hx加到步骤(i)的CSF样品中,得到富含Hx的CSF样品;
(iii)向受试者施用富含Hx的CSF样品,由此使受试者的CSF隔室暴露于治疗有效量的Hx足以允许Hx与受试者的CSF隔室中的无细胞血红素形成复合物的一段时间;以及
(iv)任选地重复步骤(i)~(iii)。
被移除并重新施用于受试者的CSF的体积理想地基本上相同。例如,如果从受试者的CSF隔室中取出50mL CSF样品,则将包含Hx的整个50mL体积的CSF重新施用于受试者。然而,应当理解,体积可以不相似,只要体积的任何差异不会引起显著的不良临床结果即可。在一些实施方案中,再施用于受试者的CSF的体积小于从受试者移除的CSF的体积。在其他实施方案中,再施用于受试者的CSF的体积大于从受试者移除的CSF的体积,其中添加Hx,单独或与任何其他治疗剂组合,构成额外体积。
在另一个实施方案中,本申请中所述的方法包括从有需要的受试者的CSF隔室中取出一定体积的CSF,用一定体积的包含Hx的人工CSF替换从受试者中取出的体积的CSF,从而将受试者的CSF暴露于治疗有效量的Hx并持续足以允许Hx与受试者的CSF中的无细胞血红素形成复合物并从而中和受试者的CSF中的无细胞血红素的一段时间。优选地,确定人工CSF中Hx的量,使得在施用于受试者后,将在受试者的CSF内提供治疗有效量的Hx。因此,添加到人工CSF中的Hx的量取决于将施用于受试者的人工CSF的体积。
在一个实施方案中,所述方法包括:
(i)出血后从受试者的CSF隔室中取出一定体积的CSF;
(ii)提供包含Hx的人工CSF;
(iii)向受试者施用(ii)的人工CSF,由此使受试者的CSF隔室暴露于治疗有效量的Hx足以允许Hx与受试者的CSF隔室中的无细胞血红素形成复合物的一段时间;以及
(iv)任选地重复步骤(i)~(iii)。
施用于受试者的人工CSF的体积理想地与从受试者取出的CSF的体积基本相同。例如,如果从受试者的CSF隔室中取出50mL CSF样品,则将使用约50mL体积的包含治疗有效量的Hx的人工CSF来替代取出的CSF体积。然而,应当理解,体积可以不相似,只要体积的任何差异不会引起显著的不良临床结果即可。在一些实施方案中,施用于受试者的人工CSF的体积小于从受试者中取出的CSF的体积。在其他实施方案中,施用于受试者的人工CSF的体积大于从受试者中取出的CSF的体积。
在一个实施方案中,本申请中所述的方法包括在出血性中风后约21天内使CSF暴露于Hx。在本申请中所公开的另一个实施方案中,所述方法包括在出血性中风后约2天至约4天将CSF暴露于HX。在又一个实施方案中,所述方法包括在出血性中风后约5天至约14天将CSF暴露于Hx。
本发明人令人惊讶地证实,使蛛网膜下腔内的无细胞血红素暴露于治疗有效量的Hx至少约2分钟的期限足以形成CSF中可检测到的血红素:Hx复合物。因此,在一个实施方案中,CSF暴露于治疗有效量的Hx的时间期限为至少约2分钟(例如,2、3、4、5、6、7、8、9、10、11、12、13、14分钟等)。在一个实施方案中,CSF暴露于治疗有效量的Hx的时间期限为至少约4分钟。在另一个实施方案中,CSF暴露于治疗有效量的Hx的时间期限为至少约5分钟。在又一个实施方案中,CSF暴露于治疗有效量的Hx的时间期限为至少约10分钟。在一个实施方案中,CSF暴露于治疗有效量的Hx的时间期限为约2分钟至约45分钟,优选约2分钟至约20分钟,或更优选为约4分钟至约10分钟。
如本申请中所用,术语“受试者”是指需要治疗或预防的哺乳动物受试者。合适的受试者的示例性实例包括灵长类动物,尤其是人,伴侣动物,例如猫和狗等,工作动物,例如马、驴等,家畜动物,例如绵羊、牛、山羊、猪等,实验室试验动物,例如兔、小鼠、大鼠、豚鼠、仓鼠等,以及圈养野生动物,例如动物园和野生动物公园中的那些,鹿、澳洲野狗等。在一个实施方案中,受试者为人。在另一个实施方案中,受试者为儿科患者,年龄为(i)出生至约2岁,(ii)约2至约12岁或(iii)约12至约21岁。
在一个实施方案中,本申请中所述的方法包括使CSF在体外暴露于治疗有效量的Hx。
当CSF在体外(离体)暴露于Hx时,治疗有效量可取决于Hx暴露于的CSF的体积,CSF是否暴露于溶液中或固定在底物上的Hx(例如,用于亲和色谱)以及任意上述组合。例如,当使CSF暴露于Hx以通过亲和色谱复合和除去无细胞血红素时,固定在底物上的Hx的量不需要在初始通过期间导致无细胞血红素的完全复合,并且可能需要多次通过底物以复合,从而从CSF中除去基本上所有的无细胞血红素。
在一个实施方案中,所述方法包括:(i)在出血性中风后且在将CSF暴露于Hx之前从受试者获得CFS样品;(ii)测量步骤(i)中获得的CSF样品中无细胞Hb或无细胞血红素的量;以及(iii)基于来自步骤(ii)的无细胞Hb或无细胞血红素的浓度确定至少等摩尔量的Hx。测量CSF样品中无细胞Hb和无细胞血红素的量的合适方法是本领域技术人员已知的,其示例性实例在本申请其他部分中描述。
如本申请其他部分中所述,无细胞血红素与CSF内的Hx的复合可以中和无细胞血红素对脑组织的其他不良生物活性。虽然通常不需要提取或除去根据本申请中所公开的方法形成的无细胞血红素:Hx复合物,但在一些情况下可能需要除去所述复合物。例如,当本申请中所述的方法包括从受试者中取出CSF并随后将CSF在体外暴露于Hx时,可能需要在将CSF重新施用于受试者之前除去在CSF中形成的无细胞血红素:Hx复合物。因此,在一些实施方案中,所述的方法包括去除CSF中形成的Hx:无细胞血红素复合物。
在一个实施方案中,所述方法包括:
(i)出血后从受试者得到CSF;
(ii)在允许Hx与CSF中的无细胞血红素形成复合物的条件下,使来自步骤(i)的CSF暴露于Hx;
(iii)从步骤(ii)后的CSF中提取Hx:无细胞血红素复合物,得到血红素减少的CSF,当与来自步骤(i)的CSF比较时,其具有更低量的无细胞血红素;
(iv)任选地重复步骤(ii)和(iii),得到血红素-减少的CSF,其基本上不含无细胞血红素;以及
(v)向受试者的CSF隔室施用得自步骤(iii)或步骤(iv)的血红素减少的CSF。
如本申请中所用,“血红素减少的CSF”意指已经从中除去一定量的无细胞血红素的CSF,使得当与步骤(iii)之前的无细胞血红素的量相比时,CSF具有更低量的无细胞血红素。应当理解,术语“血红素减少的CSF”并不意图暗示所有无细胞血红素已从CSF中除去,因此包括其中至少一些无细胞血红素的实施方案。在一个实施方案中,当与在从CSF中提取Hx:无细胞血红素复合物前得自受试者的CSF中的无细胞血红素的量比较时,血红素减少的CSF包含更少至少约5%,优选至少约10%,优选至少约15%,优选至少约20%,优选至少约25%,优选至少约30%,优选至少约35%,优选至少约40%,优选至少约45%,优选至少约50%,优选至少约55%,优选至少约60%,优选至少约65%,优选至少约70%,优选至少约75%,优选至少约80%,优选至少约85%,优选至少约90%,或更优选至少约95%的无细胞血红素。在一个实施方案中,当与在从CSF中提取Hx:无细胞血红素复合物前得自受试者的CSF中的无细胞血红素的量比较时,血红素减少的CSF包含更少约5%至约10%,优选约10%至约20%,优选约20%至约30%,优选约30%至约40%,优选约40%至约50%,优选约50%至约60%,优选约60%至约70%,优选约70%至约80%,优选约80%至约90%,或更优选约90%至约99%的无细胞血红素。
如本申请其他部分中所述,可以任选地通过重复步骤(ii)和(iii)进一步处理血红素减少的CSF,以从CSF中除去另外的无细胞血红素,优选获得基本上不含无细胞血红素的血红素减少的CSF。所谓“基本上不含无细胞血红素”意指当与在从CSF中提取Hx:无细胞血红素复合物前得自受试者的CSF中的无细胞血红素的量比较时,Hb减少的CSF包含更少约70%至约80%,优选约80%至约90%,或更优选约90%至约99%的无细胞血红素。
在一个实施方案中,所述方法包括根据需要重复步骤(ii)和(iii)至少1次(例如,1、2、3、4、5、6、7、8、9、10、11次等)。在一个实施方案中,所述方法包括:重复步骤(ii)和(iii)至少1次,优选2次,优选3次,优选4次,优选5次,优选6次,优选7次,优选8次,优选9次,,或更优选10次,得到Hb减少的CSF,其基本上不含无细胞血红素。
应当理解,需要重复步骤(ii)和(iii)以获得基本上不含无细胞血红素的血红素减少的CSF的次数可取决于若干因素,包括(但不限于)来自受试者的CSF中无细胞血红素的浓度、所用血红素的浓度、提取方法等。在一些情况下,可能期望仅进行步骤(ii)和(iii)一次,特别是如果重复步骤(ii)和(iii)可能使CSF暴露于污染物,例如细菌、酵母、真菌和病毒。
从CSF中提取Hx:无细胞血红素复合物的合适方法是本领域技术人员已知的,其示例性实例包括尺寸排阻色谱法和亲和色谱法。尺寸排阻色谱法允许鉴定Hx:无细胞血红素复合物,并通过其相对于游离血红素和Hx的较大尺寸与CSF中的其他成分分离。亲和色谱法允许通过使用与血红素:Hx复合物特异性结合而与游离血红素的结合可忽略的结合剂来鉴定Hx:无细胞血红素复合物并将其与CSF中的其他成分分离。合适的结合剂包括抗体或其抗结合片段,如本领域技术人员所熟知的。
在一个实施方案中,步骤(ii)包括使来自步骤(i)的CSF通过固定有Hx的底物。这有利地允许CSF中的无细胞血红素与Hx结合,从而将无细胞血红素动员至底物并允许血红素减少的CSF便利地从底物洗脱。因此,在一个实施方案中,将步骤(ii)中的Hx固定在底物上。合适的底物是本领域技术人员熟知的,其示例性实例包括尺寸排阻色谱树脂、亲和色谱树脂、过滤介质或膜。在一个实施方案中,所述底物选自尺寸排阻色谱树脂、亲和色谱树脂、过滤介质和膜。
在一个实施方案中,步骤(ii)包括在允许CSF中的无细胞血红素与树脂结合的条件下使来自步骤(i)的CSF通过亲和色谱树脂;其中步骤(iii)包括在步骤(ii)之后从所述树脂洗脱所述CSF;并且其中步骤(iv)包括回收洗脱的CSF。
在将从步骤(iii)或步骤(iv)获得的血红素减少的CSF施用于步骤(vi)中的受试者的CSF隔室之前,可能期望向血红素减少的CSF中加入治疗有效量的Hp,以清除可能存在于受试者的CSF隔室中并且可能引起不良继发性神经学后果的残留的无细胞Hb,如本申请其他部分中所述。因此,在一个实施方案中,所述方法包括在步骤(v)之前向血红素减少的CSF中加入治疗有效量的Hx,如本申请其他部分中所述。
本领域技术人员可以理解,一旦在出血性中风后从受试者的CSF隔室移除CSF,则CSF隔室中可能存在残留的无细胞Hb。因此,可能期望冲洗CSF隔室(一旦根据上述步骤(i)除去CSF),以除去至少一些残留的无细胞Hb,从而消除或以其他方式减少这种残留的无细胞血红素可能产生的不良继发性神经学后果。因此,在一个实施方案中,所述方法还包括用洗涤溶液洗涤步骤(i)后的CSF隔室。
合适的洗涤溶液是本领域技术人员熟知的。在一个实施方案中,所述洗涤溶液为人工CSF。
人工脑脊液(aCSF)典型地为模拟天然CSF的流体,包括通过盐含量进行模拟。aCSF的合适组合物是本领域技术人员熟知的,其示例性实例描述在US20060057065和Matzneller等人(Pharmacology,2016;97(5-6):233-44)中,其内容通过引用全部并入本申请。aCSF可以包含浓度与天然CSF中发现的浓度相似的NaCl,如本领域技术人员所熟知的,并且可以典型地包括天然CSF中NaCl浓度的约15%之内、更优选约10%之内的浓度。aCSF可以包含浓度与天然CSF中发现的浓度相似的NaHCO
在一个实施方案中,人工CSF/洗涤溶液包含NaCl、KCl、KH
在一个实施方案中,所述洗涤溶液包含Hx。
在一个实施方案中,所述洗涤溶液包含约2μM至约80mM Hx。在一个实施方案中,所述洗涤溶液包含约2μM至约20mM Hx。在一个实施方案中,所述洗涤溶液包含约100μM至约20mM Hx。在一个实施方案中,所述洗涤溶液包含约2μM至约1,200μM Hx。在一个实施方案中,所述洗涤溶液包含约5μM至约200μM Hx。在一个实施方案中,所述洗涤溶液包含约10μM至约120μM Hx。
在一个实施方案中,所述洗涤溶液包含与出血后受试者的CFS中的无细胞血红素浓度至少等摩尔量的Hx。在另一个实施方案中,所述洗涤溶液包含约3μM至约1,200μM Hx。
在一些实施方案中,如本申请中所述,可能期望放弃从受试者的CSF中体外取出无细胞血红素的步骤,而是用人工CSF替代受试者的CSF,如本申请其他部分中所述。因此,在一个实施方案中,所述方法包括:
(i)出血后从受试者取出CSF;
(ii)用包含治疗有效量的Hx的洗涤溶液冲洗步骤(i)后受试者的CSF隔室;
(iii)任选地重复步骤(ii);以及
(iv)在步骤(ii)或步骤(iii)后,向受试者的CSF隔室施用人工CSF。
通过将治疗有效量的Hx掺入洗涤溶液,CSF隔室中残留的无细胞血红素可以与Hx复合,从而中和无细胞血红素对脑组织的不良生物作用。
在一个实施方案中,人工CSF包含NaCl、KCl、KH
在一个实施方案中,人工CSF包含约2μM至约80mM Hx。在一个实施方案中,人工CSF包含约2μM至约20mM Hx。在一个实施方案中,人工CSF包含约100μM至约20mM Hx。在一个实施方案中,人工CSF包含约2μM至约1,200μM Hx。在一个实施方案中,人工CSF包含约5μM至约200μM Hx。在一个实施方案中,人工CSF包含约10μM至约120μM Hx。
在一个实施方案中,人工CSF包含与出血后受试者的CFS中无细胞血红素浓度至少等摩尔量的Hx。在另一个实施方案中,人工CSF包含约3μM至约1,300μM Hx。
辅助疗法
如本申请中所述,治疗或预防出血性中风后受试者的不良继发性神经学后果的方法可以适当地与一种或多种被设计用于减少、抑制、预防或以其他方式减轻出血性中风后受试者的一种或多种不良继发性神经学后果的另一种治疗策略一起、依次或组合(例如,同时)进行。因此,在一个实施方案中,所述方法还包括向所述受试者施用用于治疗或预防出血性中风后的不良继发性神经学后果的第二药剂。用于治疗或预防出血性中风后的不良继发性神经学后果的合适其他治疗策略或第二药剂为本领域技术人员熟知的,其示例性实例包括:
(i)凝血病校正–例如使用维生素K拮抗剂(VKA)、新型口服抗凝血剂(NOAC,例如达比加群、利伐沙班和阿哌沙班)、因子8抑制剂旁路活性(FEIBA)和活化重组因子VII(rFVIIa)、凝血酶原复合体浓缩物、活性炭、抗血小板疗法(APT)和阿司匹林单一疗法;
(ii)降血压–例如抗高血压剂,其示例性实例包括:(i)利尿剂,例如噻嗪类,包括氯噻酮、氯噻嗪、双氯非那胺、氢氟噻嗪、吲达帕胺和氢氯噻嗪;髓袢利尿剂,例如布美他尼、依他尼酸、呋塞米和托拉塞米;保钾剂,例如阿米洛利和三氨蝶呤;以及醛固酮拮抗剂,例如螺内酯、表烯酮等;(ii)β-肾上腺素能阻断剂,例如醋丁洛尔、阿替洛尔、倍他洛尔、贝凡洛尔、比索洛尔、波吲洛尔、卡替洛尔、卡维地洛、塞利洛尔、艾司洛尔、茚诺洛尔、美托洛尔、纳多洛尔、奈必洛尔、喷布洛尔、吲哚洛尔、普萘洛尔、索他洛尔、特他洛尔、替利洛尔和噻吗洛尔等;(iii)钙通道阻断剂,例如氨氯地平、阿雷地平、阿折地平、巴尼地平、贝尼地平、苄普地尔、西那地平、氯维地平、地尔硫
(ii-b)血管扩张剂–例如肼苯哒嗪(apresoline)、可乐定(catapres)、米诺地尔(loniten)、烟醇(roniacol)、悉尼酮和硝普钠。
(iii)癫痫发作、葡萄糖和体温管理–例如抗癫痫药物、控制血糖水平的胰岛素输注液、维持正常体温和治疗性冷却;
(iv)手术治疗–例如血肿清除(手术凝块去除)、去骨瓣减压术(DC)、微创伤手术(MIS;例如基底神经节出血的针吸活组织检查)、使用重组组织型纤溶酶原激活物(rTPA)的MIS;
(v)手术时机–例如症状发作后4-96小时;
(vi)凝血酶抑制–例如水蛭素、阿加曲班、丝氨酸蛋白酶抑制剂(例如甲磺酸萘莫司他);
(vii)预防血红素和铁毒性–例如非特异性血红素加氧酶(HO)抑制剂,例如锡-中卟啉、铁螯合剂,例如去铁胺;
(viii)PPARg拮抗剂和激动剂–例如罗格列酮、15d-PGJ2和吡格列酮;
(ix)小神经胶质活化抑制–例如吞噬作用激素片段1–3(小神经胶质细胞/巨噬细胞抑制因子)或米诺环素(四环素类抗生素);
(x)NF-红细胞系统-2-相关因子2(Nrf2)的上调;
(xi)环氧合酶(COX)抑制–例如塞来昔布(选择性COX-2抑制剂);
(xii)基质金属蛋白酶;
(xiii)TNF-α调节剂-例如腺苷受体激动剂,例如CGS21680、TNF-α-特异性反义寡脱氧核苷酸,例如ORF4-PE;
(xiv)升血压–例如儿茶酚胺;以及
(xv)TLR4信号传导抑制剂-例如抗体Mts510和TAK-242(环己烯衍生物);
在一个实施方案中,第二药剂为血管扩张剂。合适的血管扩张剂是本领域技术人员熟知的,其示例性实例包括悉尼酮和硝普钠。因此,在本申请中所公开的一个实施方案中,第二药剂选自悉尼酮和硝普钠。
第二药剂可以包括触珠蛋白(Hp)。如本申请其他部分中所述,本发明人已经证明外源性触珠蛋白可以用于在临床相关CSF-Hb浓度范围内提供抗血管痉挛和抗氧化作用,且由此推定在aSAH的背景下触珠蛋白和血红素结合蛋白的治疗组合能够提供针对无细胞Hb和无细胞血红素的血管痉挛和氧化作用的协同保护作用。因此,在一个实施方案中,本申请中所述的方法还包括使受试者的CSF暴露于治疗有效量的触珠蛋白(Hp)并持续足以允许Hp与无细胞Hb形成复合物且由此中和无细胞Hb的一段时间。
如本申请其他部分中所述,本发明人已经发现Hp可以在体内减少或以其他方式防止无细胞Hb介导的CV。应当理解,本申请中所公开的方法减少或以其他方式预防血红素介导的CV的程度可以取决于若干因素,例如出血性中风后由无细胞Hb诱导的血管收缩(血管变窄)的程度、出血性中风后受试者的CSF中无细胞Hb的浓度、CSF暴露于Hp的时间期限以及存在或不存在任何持续性出血。评估本申请中所公开的方法是否降低或以其他方式预防受试者中的CV的方式为本领域技术人员熟知的,其示例性实例包括数字减影血管造影术(DSA)、计算机断层扫描(CT)血管造影术(CTA)、磁共振(MR)血管造影术(MRA)和导管血管造影术(CA)。
在一个实施方案中,如本申请中所述,在60分钟暴露期限后使有此需要的受试者的CSF暴露于Hp使收缩的脑血管腔的平均直径恢复至少10%,优选约10%至约20%,优选约15%至约25%,优选约20%至约30%,优选约25%至约35%,优选约30%至约40%,优选约35%至约45%,或更优选为约40%至约50%,其是通过DSA测定的。
在一个实施方案中,如本申请中所述,在60分钟暴露期限后使有此需要的受试者的CSF暴露于Hp使收缩的大脑前动脉腔的平均直径恢复至少10%,优选约10%至约20%,优选约15%至约25%,优选约20%至约30%,优选约25%至约35%,优选约30%至约40%,优选约35%至约45%,或更优选为约40%至约50%,其是通过DSA测定的。
在一个实施方案中,如本申请中所述,在60分钟暴露期限后,使有此需要的受试者的CSF暴露于Hp使收缩的颈内动脉腔的平均直径恢复至少10%,优选约10%至约20%,优选约15%至约25%,优选约20%至约30%,优选约25%至约35%,优选约30%至约40%,优选约35%至约45%,或更优选为约40%至约50%,其是通过DSA测定的。
在一个实施方案中,如本申请中所述,在60分钟暴露期限后使有此需要的受试者的CSF暴露于Hp使收缩的大脑中动脉腔的平均直径恢复至少10%,优选约10%至约20%,优选约15%至约25%,优选约20%至约30%,优选约25%至约35%,优选约30%至约40%,优选约35%至约45%,或更优选为约40%至约50%,其是通过DSA测定的。
在一个实施方案中,如本申请中所述,在60分钟暴露期限后使有此需要的受试者的CSF暴露于Hp使收缩的基底动脉腔的平均直径恢复至少10%,优选约10%至约20%,优选约15%至约25%,优选约20%至约30%,优选约25%至约35%,优选约30%至约40%,优选约35%至约45%,或更优选为约40%至约50%,其是通过DSA测定的。
在一个实施方案中,如本申请中所述,在60分钟暴露期限后,使有此需要的受试者的CSF暴露于Hp使收缩的小实质血管(例如,脑小动脉)的平均管腔面积增加至少10%,优选增加至少20%,优选增加至少25%,优选增加至少30%,优选增加至少35%,优选增加至少40%,优选增加至少45%,优选增加至少55%,优选增加至少60%,优选增加至少65%,优选增加至少70%,优选增加至少75%,,或更优选增加至少80%,其是通过体内灌注成像(例如MRI灌注、CT灌注)测定的。在一个实施方案中,小实质血管为大脑小动脉。在一个实施方案中,如本申请中所述,在60分钟暴露期限后,使有此需要的受试者的CSF暴露于Hp通过预防小实质血管收缩使脑微量灌注恢复至少10%,优选恢复至少20%,优选恢复至少25%,优选恢复至少30%,优选恢复至少35%,优选恢复至少40%,优选恢复至少45%,优选恢复至少55%,优选恢复至少60%,优选恢复至少65%,优选恢复至少70%,优选恢复至少75%,,或更优选恢复至少80%,正如通过体内灌注成像(例如,MRI灌注、CT灌注)测定的。在一个实施方案中,小实质血管为大脑小动脉。
如本申请其他部分中所述,本发明人首次证实治疗有效量的Hp可以降低CSF中无细胞Hb的氧化电位。因此,在一个实施方案中,如本申请中所述,使有此需要的受试者的CSF暴露于Hp减少氧化组织损伤。测定氧化性组织损伤的合适方法是本领域技术人员熟知的,其示例性实例描述在Katerji等人(2019;Oxid.Med.Cell Longey;1279250)中,包括测定脂质过氧化的终产物丙二醛(MDA)的水平。因此,在一个实施方案中,如本申请中所述,使有此需要的受试者的CSF暴露于Hp减少了脂质过氧化。
触珠蛋白
触珠蛋白(Hp)具有包含通过二硫键连接的两个α链和两个β链的四聚体结构。β链(245个氨基酸)具有约40kDa的质量(其中约30%w/w是碳水化合物),并且被所有表型共享。α链以至少两种形式存在:α1(83个氨基酸,9kDa)和α2(142个氨基酸,17.3kDa)。因此,Hp以三种表型出现,称作Hp1-1、Hp2-1和Hp2-2。Hp1-1包含两条α1链,Hp2-2包含两条α2链,并且Hp2-1包含一条α1链和一条α2链。当与Hb复合时,Hp 1-1的分子量为100kDa,或165kDa。Hp1-1作为单一同种型存在,也称作Hp二聚体。Hp2-1具有220kDa的平均分子量并形成线性聚合物。Hp2-2具有400kDa的平均分子量并形成环状聚合物。每种不同的聚合物形式是不同的同种型。为了研究Hp的多态性,已经设计了用于研究Hp多态性的PCR方法(Koch等人2002,Clin.Chem.48:1377-1382)。
对于在染色体16上发现的Hp基因,存在两个主要等位基因Hp1和Hp2。这两个等位基因负责具有结构多态性的三种不同的可能基因型:纯合的(1-1或2-2)和杂合的2-1。在西方人群中,估计Hp 1-1的分布为~16%,Hp 2-1的分布为~48%,Hp 2-2的分布为~36%。Hp被裂解成通过二硫键连接的两个亚单位α和β链。两个等位基因共有相同的β链。β链负责结合Hb,因此两种基因型具有相似的Hb结合亲和力。
应当理解,天然存在的和重组形式的Hp适用于本申请中所述的方法,只要它们能够与无细胞Hb形成复合物,且由此中和无细胞Hb的生物活性即可。Hp的合适天然存在的形式是本领域技术人员已知的,其示例性实例描述在Koch等人(2002,Clin.Chem.48:1377-1382)和Kasvosve等人(2010,第2章–Haptoglobin Polymorphism and Infection;Advances in Clinical Chemistry,50:23-46)中,其全部内容通过引用并入本申请。
在一个实施方案中,Hp包含血浆来源的Hp、由血浆来源的Hp组成或基本上由血浆来源的Hp组成。Hp优选是人Hp。用于从Hp-的天然来源(例如,血浆)分离Hp的各种方案对于本领域技术人员来说是熟知的,其示例性实例描述在美国专利号4,061,735和4,137,307(Funakoshi等人)和美国专利公开号20140094411(Brinkman)中,其全部内容通过引用并入本申请。用于从Hp的天然来源分离Hp的其他合适方法描述中在Katnik&Jadach(1993,Arch.Immunol.Ther.Exp.(Warz)41:303-308)、Tseng等人(2004,Protein Expr Purif 33:265-273)、Katnik等人(1995,Eur J.Clin.Chem.Clin.Biochem.33:727-732)、Yang和Mao(1999,J.Chromatogr.B.Biomed.Sci.Appl.,731:395-402)和Basler&Burrel(1983炎症7(4):387-400)中。
应当理解,如本申请中所用,术语“触珠蛋白”包括Hp的所有表型(包括所有同种型)。Hp可以是同源的(在其基本上由相同同种型的Hp组成的情况下)或异源的(在其包含不同Hp同种型的组合的情况下,包括Hp1-1、Hp1-2和Hp2-2)。应当理解,Hp的组成最终将取决于来源的表型。例如,如果使用合并的血浆样品提取/纯化Hp,则可能分离出一种以上的Hp同种型。用于确定分离物中存在的Hp同种型的合适方法是本领域技术人员熟知的,其示例性实例在Shih等人(2014,Hematology,89(4):443-447)中讨论,其全部内容通过引用并入本申请。确定分离物中存在的Hp同种型的其他合适的方法包括高效尺寸排阻色谱法(HPLC-SEC测定法)、Hp ELISA和浊度读数,不同的Hp同种型典型地在不同的测定中得到不同的信号。
在一个实施方案中,Hp选自Hp1-1同型二聚体、Hp1-2多聚体、Hp2-2多聚体和上述任一项的组合。在一个优选的实施方案中,Hp包含Hp1-1同型二聚体、由其组成或主要由其组成。Hp可以为天然存在的Hp(例如,血浆来源的),或可以作为重组蛋白产生,其示例性实例在本申请其他部分中描述。在一个实施方案中,血浆来源的Hp包含Hp1-1同型二聚体、由其组成或主要由其组成。在一个实施方案中,Hp包含重组Hp、由重组Hp组成或主要由重组Hp组成。
如本申请中所用,除非另有说明,否则术语Hp包括天然或天然存在的Hp的功能类似物。术语“功能类似物”应答理解为是指基本上共有天然存在的(天然)Hp的相同生物活性的试剂,只要该生物活性至少为所述类似物的能力即可,从而与无细胞Hb形成复合物且由此中和其生物活性。所谓“基本上相同的生物活性”典型地是指所述功能类似物对无细胞Hb具有结合亲和力为天然存在的Hp的结合亲和力的至少40%(例如,40%、45%、50%、55%、60%、65%、70%、85%、90%、95%、100%、105%、100%、105%、110%、115%、120%、125%、130%、135%、140%、145%、150%、155%、160%、165%等),包括天然存在的Hp同种型(例如,Hp1-1、Hp1-2和Hp2-2)。用于测定试剂是否为Hp的功能类似物的合适方法为本领域技术人员熟知,其示例性实例在本申请其他部分中描述(例如,功能类似物减少无细胞Hb-诱导的脑血管痉挛的能力)。
在本申请中所公开的一个实施方案中,Hp的功能类似物为天然Hp的功能片段。天然Hp的功能片段可以为任意合适的长度,只要该片段保持与无细胞Hb形成复合物且由此中和其生物活性的能力即可。
在另一个实施方案中,所述功能类似物是具有与天然存在的(天然的)Hp分子(即,比较物)不同的氨基酸序列的肽。功能类似物可以包括具有与天然Hp的α和/或β链的氨基酸序列相差一个或多个(例如,1、2、3、4、5、6、7、8、9或更多个)氨基酸替代的氨基酸序列的分子,其中所述的差异不会或不会完全消除类似物与无细胞Hb形成复合物的能力,从而中和其生物活性。在一些实施方案中,与天然Hp相比,功能性类似物包含增强类似物与无细胞Hb形成复合物的能力的氨基酸置换。在一个实施方案中,功能类似物具有与天然Hp的α和/或β链的氨基酸序列相差一个或多个保守氨基酸替代的氨基酸序列。如本申请中所用,术语“保守氨基酸替代”是指改变给定位置处的氨基酸同一性以将其替换为大致相等大小、电荷和/或极性的氨基酸。氨基酸的天然保守取代的实例包括以下8个替代组(由常规的单字母代码表示):(1)M,I,L,V;(2)F,Y,W;(3)K,R,(4)A,G;(5)S,T;(6)Q,N;(7)E,D;以及(8)C,S。
在一个实施方案中,所述功能类似物与天然Hp的α和/或β链的氨基酸序列具有至少85%的序列同一性。涉及的“至少85%”包括85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性或相似性,例如,在最佳比对或最佳拟合分析后。因此,在一个实施方案中,所述序列与本申请中所鉴定的序列具有至少85%,优选至少86%,优选至少87%,优选至少88%,优选至少89%,优选至少90%,优选至少91%,优选至少92%,优选至少93%,优选至少94%,优选至少95%,优选至少96%,优选至少97%,优选至少98%,优选至少99%,或优选100%的序列同一性或序列同源性,例如,在最佳比对或最佳拟合分析后。
如本申请中所用,术语“同一性”、“相似性”、“序列同一性”、“序列相似性”、“同源性”、“序列同源性”等意指在比对序列中的任何特定氨基酸残基位置处,氨基酸残基在比对序列之间是相同的,如本申请其他部分中所述。如本申请中所用,术语“相似性”或“序列相似性”表示,在比对序列中的任何特定位置,氨基酸残基在序列之间具有相似类型,如本申请其他部分中所述。在一个实施方案中,可以通过保守取代其中所含的任何氨基酸残基来修饰氨基酸序列,使得当与未修饰的(天然)Hp多肽相比时,修饰对修饰的多肽的结合特异性或功能活性无有影响。
在一个实施方案中,功能性类似物包括相对于天然Hp的氨基酸替代和/或其他修饰,以增加类似物的稳定性或增加类似物的溶解度。功能类似物可以是天然存在的化合物/肽,或者其可以使用本领域技术人员已知的方法通过化学合成以合成方式产生。
Hp可以适当地在微生物中作为重组蛋白产生,其可以被分离,并且如果期望,可以进一步纯化。用于产生重组Hp的合适微生物将是本领域技术人员熟知的,其示例性实例包括细菌、酵母或真菌、真核细胞(例如,哺乳动物或昆虫细胞),或在重组病毒载体(例如,腺病毒、痘病毒、疱疹病毒、塞姆利基森林病毒、杆状病毒、噬菌体、辛德毕斯病毒或仙台病毒)中。用于产生重组肽的合适细菌是本领域技术人员熟知的,其示例性实例包括大肠杆菌(E.coli)、枯草芽孢杆菌(B.subtilis)或能够表达肽序列的任何其他细菌。用于产生重组肽的合适酵母类型的示例性实例包括酿酒酵母、粟酒裂殖酵母、假丝酵母属、巴斯德毕赤酵母或能够表达肽的任何其他酵母。相应的方法是本领域众所周知的。用于分离和纯化重组产生的肽序列的方法也是本领域熟知的,并且包括例如凝胶过滤、亲和色谱法和离子交换色谱法。
如本申请中所述,为了促进重组Hp的分离,可以制备融合多肽,其中Hp的肽序列或其功能类似物与异源多肽翻译融合(共价连接),这使得能够通过亲和色谱进行分离。合适的异源多肽的示例性实例为His-Tag(例如,His
为了制备重组Hp,噬菌体文库和/或肽文库也是合适的,例如,通过组合化学产生或通过针对最不同结构的高通量筛选技术获得(参见,例如,Carlos F.Barbas(编辑)等人Display:A Laboratory Manual;以及Willats WG Phage display:practicalities andprospects.Plant Mol.Biol.2002December;50(6):837-54)。
重组Hp的示例性实例包括登录号为NP_005134(如Morishita等人2018,Clin.Chim.Acta 487,84-89所述)和登录号为P00738的肽。
Hp可以融合、偶联或以其他方式附接至作为融合蛋白的一部分的一个或多个异源部分,包括在Hx的上下文中在本申请其他部分中描述的那些。
在Hp的上下文中,本申请所用的术语“治疗有效量”是指当施用于由此需要的受试者时,足以使Hp与受试者的CSF中存在的无细胞Hb结合并与其形成复合物,从而中和无细胞Hb的其他不利生物作用的Hp的量或浓度。本领域技术人员可以理解,肽的治疗有效量可以根据若干因素的不同而改变,其示例性实例包括Hp是否直接施用于受试者(例如,经鞘内、颅内或脑室内)、待治疗的受试者的健康和身体状况、治疗有效量、治疗有效量和/或治疗有效量、待治疗的受试者的分类群、出血的严重程度(例如,出血的程度)、施用途径、CSF隔室中无细胞Hb的浓度和/或量以及任何前述的组合。
Hp的治疗有效量典型地落入本领域技术人员可以确定的相对宽的范围内。Hp的合适治疗有效量的示例性实例包括约2μM至约20mM,优选约2μM至约5mM,优选约100μM至约5mM,优选约2μM至约300μM,优选约5μM至约100μM,优选约5μM至约50μM,或更优选为约10μM至约30μM。
在一个实施方案中,治疗有效量的Hp为约2μM至约20mM。在一个实施方案中,治疗有效量的Hp为约2μM至约5mM。在一个实施方案中,治疗有效量的Hp为约100μM至约5mM。在一个实施方案中,治疗有效量的Hp为约2μM至约300μM。在一个实施方案中,治疗有效量的Hp为约5μM至约50μM。在一个实施方案中,治疗有效量的Hp为约10μM至约30μM。
在一个实施方案中,Hp的治疗有效量为与出血后受试者的CFS中无细胞Hb的浓度至少等摩尔量。在另一个实施方案中,Hp的治疗有效量是足以在CSF中复合约3μM至约300μM无细胞Hb的量。测量CSF中无细胞Hb浓度的合适方法是本领域技术人员已知的,其示例性实例描述在Cruickshank AM.,2001,ACP Best Practice No 166,J.Clin.Path.,54(11):827-830)和Hugelshofer M.等人,2018.World Neurosurg.;120:e660–e666)中,其内容通过引用全部并入本申请。
应当理解,如本申请中所述,实现治疗有效量的Hp可取决于Hp或其功能性类似物所暴露于的CSF的最终体积。例如,在将Hp施用于成人受试者(例如,经鞘内)并且考虑到成人受试者中CSF的平均体积为约150mL的情况下,通过向受试者施用约310μM Hp的5mL溶液可以实现约10μM Hp的治疗有效量。在另一个示例性实例中,本申请中所述的方法包括从受试者中取出50mL的CSF,并将其替换为50mL包含约30μM Hp的人工CSF,从而在受试者的CSF隔室中实现约10μM Hp的治疗有效量。
也可以调节Hp的剂量以提供最佳治疗反应。例如,可以每天、每周或其他合适的时间间隔施用几个分开的剂量,或者可以根据情况的紧急程度指示的按比例减少剂量。
应当理解,在Hp的上下文中,术语“治疗有效量”并不意味着当施用于有需要的受试者时,将与受试者的CSF中存在的所有无细胞Hb复合并中和该无细胞Hb的Hp的量或浓度。在一些实施方案中,当施用于有需要的受试者时,治疗有效量的Hp足以与受试者的CSF中存在的足量的无细胞Hb复合并中和,以便最小化、消除或以其他方式减少受试者中在出血性中风进入受试者的CSF后由无细胞Hb介导的不良继发性神经学后果。如本申请中所述,治疗后受试者的CSF中无细胞Hb浓度的降低是本领域技术人员熟知的,这是最小化、消除或以其他方式减少受试者的CSF中出血性中风后的不良继发性神经学后果所需的。在一个实施方案中,治疗有效量的Hp足以将治疗期间受试者的CSF中无细胞Hb的量降至约水平8μM或更低,优选约7μM或更低,优选约6μM或更低,优选约5μM或更低,优选约4μM或更低,优选约3μM或更低,优选约2μM或更低,或更优选约1μM或更低的。在一个实施方案中,治疗有效量的Hp足以将治疗期间受试者的CSF中无细胞Hb的量降至约的水平7μM或更低。在另一个实施方案中,治疗有效量的Hp足以将治疗期间受试者的CSF中无细胞Hb的量降至约6μM或更低的水平。
在Hp的上下文中,如本申请中所用,术语“暴露”是指使CSF与Hp接触,按照这种方式使得Hp与CSF中存在的无细胞Hb(其主要形式将是OxyHb)结合并与其形成复合物,由此Hb:Hp复合物的形成基本上以其他方式中和了无细胞Hb对脑组织的不良生物作用。所谓“基本上中和”是指减少无细胞Hb对脑组织的不良生物学作用,如主观或定性地表示为与不存在治疗性Hp下无细胞Hb对脑组织的生物学作用相比减少至少10%,优选约10%至约20%,优选约15%至约25%,优选约20%至约30%,优选约25%至约35%,优选约30%至约40%,优选约35%至约45%,优选约40%至约50%,优选约45%至约55%,优选约50%至约60%,优选约55%至约65%,优选约60%至约70%,优选约65%至约75%,优选约70%至约80%,优选约75%至约85%,优选约80%至约90%,优选约85%至约95%,或最优选约90%至100%,包括减少至少10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100%。可以测量或测定(定性或定量地)无细胞Hb的不良生物学作用降低的方法是本领域技术人员熟知的,其示例性实例在本申请其他部分中描述。
应当理解,如本申请中所述,有需要的受试者的CSF暴露于治疗有效量的Hp的方式可以改变,这取决于例如所述暴露是在有需要的受试者的CSF隔室内进行(即,体内)还是在体外在从受试者获得的CSF中进行(即,离体)。当所述暴露在有需要的受试者的CSF隔室内进行时(即,在体内),选择Hp的施用途径以允许Hp接触CSF隔室内的无细胞Hb。合适的施用途径是本领域技术人员熟知的,其示例性实例包括鞘内、颅内和脑室内。在一个实施方案中,治疗有效量的Hp经由脑室外引流管施用,该脑室外引流管例如在出血性中风后放置在受试者中以暂时引流CSF并降低颅内压。
在一个实施方案中,所述方法包括:经颅内向受试者施用治疗有效量的Hp。
在一个实施方案中,所述方法包括:经鞘内向受试者施用治疗有效量的Hp。在一个实施方案中,所述方法包括:经鞘内向受试者施用治疗有效量的Hp到椎管中。在一个实施方案中,所述方法包括:经鞘内向受试者施用治疗有效量的Hp到蛛网膜下腔中。在一个实施方案中,所述方法包括:经脑室内向受试者施用治疗有效量的Hp。
或者或此外,本申请中所述的方法包括从有此需要的受试者中取出CSF,将CSF暴露于治疗有效量的Hp一段时间,该时间足以允许Hp与CSF中的无细胞Hb形成复合物,且由此中和CSF中的无细胞Hb,除去因此在CSF中形成的Hb:Hp复合物以产生Hb减少的CSF,并将Hb减少的CSF施用于受试者(例如,经鞘内或脑室内)。应当理解,从CSF隔室中除去CSF典型地不会导致CSF隔室完全不含CSF,注意到至少一些CSF保留在CSF隔室中。任选地,一旦除去CSF,则可以用药学上可接受的洗涤溶液冲洗CSF隔室,以除去可能存在于CSF隔室中的至少一些残留Hb。洗涤溶液可以任选地包含Hp,以进一步复合并由此中和可能存在于CSF隔室中的至少一些残留的无细胞Hb。在一个实施方案中,所述洗涤溶液为人工CSF,如本申请其他部分中所述。
在一个实施方案中,本申请中所述的方法包括从有此需要的受试者的CSF隔室中取出CSF样品,向CSF样品中加入Hp以获得富含Hp的CSF样品,将富含Hp的CSF样品施用于受试者的CSF隔室,从而将CSF隔室暴露于治疗有效量的Hp并持续足以使Hp与受试者的CSF中的无细胞Hb形成复合物并由此中和受试者的CSF中的无细胞Hb的一段时间,并任选地重复上述步骤。优选地,确定添加到CSF样品中的Hp的量,使得在施用于受试者后,在受试者的CSF内提供治疗有效量的Hp。因此,待添加到CSF样品中的Hp的量取决于取出并重新施用于受试者的CSF样品的体积。
在一个实施方案中,所述方法还包括:
(i)出血后从受试者的CSF隔室中得到CSF样品;
(ii)将Hp加到步骤(i)的CSF样品中,得到富含Hp的CSF样品;
(iii)向受试者施用富含Hp的CSF样品,由此使受试者的CSF隔室暴露于治疗有效量的Hp足以允许Hp与受试者的CSF隔室中的无细胞Hb形成复合物的一段时间;以及
(iv)任选地重复步骤(i)~(iii)。
待移除并重新施用于受试者的CSF的体积理想地基本上相同。例如,如果从受试者的CSF隔室中取出50mL CSF样品,则将包含Hp的整个50mL体积的CSF重新施用于受试者。然而,应当理解,体积可以不相似,只要体积的任何差异不会引起显著的不良临床结果即可。在一些实施方案中,再施用于受试者的CSF的体积将小于从受试者移除的CSF的体积。在其他实施方案中,再施用于受试者的CSF的体积将大于从受试者移除的CSF的体积,其中添加单独或与任何其他治疗剂组合的Hp,构成额外体积。
在另一个实施方案中,本申请中所述的方法包括从有此需要的受试者的CSF隔室中取出一定体积的CSF,用一定体积的包含Hp的人工CSF替换从受试者中取出的体积的CSF,从而将受试者的CSF暴露于治疗有效量的Hp,并持续足以允许Hp与受试者的CSF中的无细胞Hb形成复合物并从而中和受试者的CSF中的无细胞Hb的一段时间Hx。优选地,确定人工CSF中Hp的量,使得在施用于受试者后,在受试者的CSF内提供治疗有效量的Hp。因此,添加到人工CSF中的Hp的量取决于施用于受试者的人工CSF的体积。
在一个实施方案中,所述方法还包括:
(i)出血后从受试者的CSF隔室中取出一定体积的CSF;
(ii)提供包含Hp的人工CSF;
(iii)向受试者施用(ii)的人工CSF,由此使受试者的CSF隔室暴露于治疗有效量的Hp足以允许Hp与受试者的CSF隔室中的无细胞Hb形成复合物的一段时间;以及
(iv)任选地重复步骤(i)~(iii)。
施用于受试者的人工CSF的体积理想地与从受试者取出的CSF的体积基本相同。例如,如果从受试者的CSF隔室中取出50mL CSF样品,则将使用约50mL体积的包含治疗有效量的Hp的人工CSF来替代取出的CSF体积。然而,应当理解,只要体积的任何差异不会引起显著的不良临床结果,则体积可以不相似。在一些实施方案中,施用于受试者的人工CSF的体积小于从受试者中取出的CSF的体积。在其他实施方案中,施用于受试者的人工CSF的体积大于从受试者中取出的CSF的体积。
在一个实施方案中,本申请中所述的方法包括使CSF在出血性中风后约21天内暴露于Hp。在本申请中所公开的另一个实施方案中,所述方法包括:使CSF在出血性中风后暴露于Hp约2天至约4天。在又一个实施方案中,所述方法包括:使CSF在出血性中风后暴露于Hp约5天至约14天。
在一个实施方案中,CSF暴露于治疗有效量的Hp的时间期限为至少约2分钟(例如,2、3、4、5、6、7、8、9、10、11、12、13、14分钟等)。在一个实施方案中,CSF暴露于治疗有效量的Hp的时间期限为至少约4分钟。在另一个实施方案中,CSF暴露于治疗有效量的Hp的时间期限为至少约5分钟。在又一个实施方案中,CSF暴露于治疗有效量的Hp的时间期限为至少约10分钟。在一个实施方案中,CSF暴露于治疗有效量的Hp的时间期限为约2分钟至约45分钟,优选约2分钟至约20分钟,或更优选为约4分钟至约10分钟。
在一个实施方案中,本申请中所述的方法还包括在体外使CSF暴露于治疗有效量的Hp。
当CSF在体外(离体)暴露于Hp时,治疗有效量可以取决于Hp暴露于的CSF的体积,CSF是否暴露于溶液中或固定在底物上的Hp(例如,用于亲和色谱)以及任意上述的组合。例如,当使CSF暴露于Hp以通过亲和色谱复合和除去无细胞血红素时,固定在底物上的Hp的量不需要在初始通过期间导致无细胞血红素的完全复合,并且可能需要多次通过底物以复合,从而从CSF中除去基本上所有的无细胞血红素。
在一个实施方案中,所述方法还包括(i)在出血性中风后且在将CSF暴露于Hp之前从受试者获得CFS样品;(ii)测量步骤(i)中获得的CSF样品中无细胞Hb或无细胞血红素的量;以及(iii)基于来自步骤(ii)的无细胞Hb或无细胞血红素的浓度确定至少等摩尔量的Hp。测量CSF样品中无细胞Hb和无细胞血红素的量的合适方法是本领域技术人员已知的,其示例性实例由Oh等人(2016,Redox Biology,9:167-177)描述,其内容通过引用全部并入本申请。
如本申请其他部分中所述,无细胞血红素与CSF内的Hp的复合会中和无细胞血红素对脑组织的其他不良生物活性。虽然通常不需要根据本申请中所公开的方法提取或除去形成的无细胞Hb:Hp复合物,但在一些情况下可能需要除去所述复合物。例如,当本申请中所述的方法包括从受试者中取出CSF并随后使CSF在体外暴露于Hp时,可能需要在将CSF重新施用于受试者之前除去在CSF中形成的Hb:Hp复合物。因此,在一些实施方案中,所述的方法包括去除CSF中形成的Hp:Hb复合物。
在一个实施方案中,所述方法还包括:
(i)出血后从受试者得到CSF;
(ii)在允许Hp与CSF中的Hb形成复合物的条件下,使来自步骤(i)的CSF暴露于Hp;
(iii)在步骤(ii)之后从CSF提取Hp:无细胞Hb复合物,得到血红素减少的CSF,当与来自步骤(i)的CSF相比时,其具有较低量的Hb;
(iv)任选地重复步骤(ii)和(iii),得到Hb减少的CSF,其基本上不含无细胞Hb;以及
(v)向受试者的CSF隔室施用Hb减少的得自步骤(iii)或步骤(iv)的CSF。
如本申请中所用,“Hb减少的CSF”是指已经除去一定量的无细胞Hb的CSF,使得当与步骤(iii)之前的无细胞Hb的量相比时,CSF具有更低量的无细胞Hb。应当理解,术语“Hb减少的CSF”并不旨在暗示所有无细胞Hb已从CSF中除去,因此包括其中至少一些无细胞Hb的实施方案。在一个实施方案中,当与从受试者获得的CSF中的无细胞Hb的量相比时,Hb减少的CSF包含更少至少约5%,优选至少约10%,优选至少约15%,优选至少约20%,优选至少约25%,优选至少约30%,优选至少约35%,优选至少约40%,优选至少约45%,优选至少约50%,优选至少约55%,优选至少约60%,优选至少约65%,优选至少约70%,优选至少约75%,优选至少约80%,优选至少约85%,优选至少约90%,或更优选至少约95%的无细胞Hb。在一个实施方案中,当与从受试者获得的CSF中的无细胞Hb的量相比时,Hb减少的CSF包含更少约5%至约10%,优选约10%至约20%,优选约20%至约30%,优选约30%至约40%,优选约40%至约50%,优选约50%至约60%,优选约60%至约70%,优选约70%至约80%,优选约80%至约90%,或更优选为约90%至约99%的无细胞Hb。
如本申请另外部分所述,Hb减少的CSF可以任选地通过重复步骤(ii)和(iii)进一步处理,以从CSF中除去另外的无细胞Hb,优选获得基本上不含无细胞Hb的Hb减少的CSF。所谓“基本上不含无细胞Hb”是指当与从受试者获得的CSF中的无细胞Hb的量相比时,Hb减少的CSF包含更少约70%至约80%,优选约80%至约90%,或更优选为约90%至约99%的无细胞Hb。
在一个实施方案中,所述方法包括:重复步骤(ii)和(iii)至少1次(例如,1、2、3、4、5、6、7、8、9、10、11次等)。在一个实施方案中,所述方法包括:根据需要重复步骤(ii)和(iii)至少1次,优选2次,优选3次,优选4次,优选5次,优选6次,优选7次,优选8次,优选9次,或更优选10次,以获得基本上不含无细胞Hb的Hb减少的CSF。
应当理解,需要重复步骤(ii)和(iii)以获得基本上不含无细胞Hb的Hb减少的CSF的次数可取决于若干因素,包括(但不限于)来自受试者的CSF中无细胞Hb的浓度、所用Hb的浓度、提取方法等。在一些情况下,可能期望仅进行步骤(ii)和(iii)一次,特别是其中重复步骤(ii)和(iii)可能使CSF暴露于污染物,例如细菌、酵母、真菌和病毒。
从CSF中提取Hp:无细胞Hb复合物的合适方法是本领域技术人员已知的,其示例性实例包括尺寸排阻色谱和/或亲和色谱。尺寸排阻色谱允许鉴定Hp:无细胞Hb复合物,并通过其相对于游离Hb和Hp更大的尺寸与CSF中的其他成分分离。亲和色谱允许通过使用与Hb:Hp复合物特异性结合而与游离Hb的结合可忽略不计的结合剂来鉴定Hp:无细胞Hb复合物并将其与CSF中的其他成分分离。合适的结合剂包括抗体或其抗结合片段,如本领域技术人员所熟知的。
在一个实施方案中,步骤(ii)包括使来自步骤(i)的CSF通过Hp固定于其上的底物。这有利地允许CSF中的无细胞Hb与Hp结合,从而将无细胞Hb动员至底物并允许Hb减少的CSF便利地从底物洗脱。因此,在一个实施方案中,将步骤(ii)中的Hp固定在底物上。合适的底物是本领域技术人员熟知的,其示例性实例包括尺寸排阻色谱树脂和亲和色谱树脂。在一个实施方案中,底物为亲和色谱树脂。
在一个实施方案中,步骤(ii)包括在允许CSF中的无细胞Hb与树脂结合的条件下使来自步骤(i)的CSF通过亲和色谱树脂;其中步骤(iii)包括在步骤(ii)之后从所述树脂洗脱所述CSF;并且其中步骤(iv)包括回收洗脱的CSF。
在将从步骤(iii)或步骤(iv)获得的Hb减少的CSF施用于步骤(vi)中的受试者的CSF隔室之前,可能期望向Hb减少的CSF中加入治疗有效量的Hp,以便清除可能存在于受试者的CSF隔室中并且可能引起不良继发性神经学后果的残留的无细胞Hb,如本申请其他部分中所述。因此,在一个实施方案中,所述方法包括:如本申请其他部分中所述,在步骤(v)前向Hb减少的CSF中加入治疗有效量的Hp。
本领域技术人员会理解,一旦在出血性中风后从受试者的CSF隔室移除CSF,则CSF隔室中可能存在残留的无细胞Hb。因此,可能期望冲洗CSF隔室(一旦根据上述步骤(i)除去CSF),以除去至少一些残留的无细胞Hb,从而消除或以其他方式减少这种残留的无细胞Hb可能产生的不良继发性神经学后果。因此,在一个实施方案中,所述方法还包括用洗涤溶液洗涤步骤(i)后的CSF隔室。
合适的洗涤溶液为本领域技术人员熟知的。在一个实施方案中,所述洗涤溶液为人工CSF,如本申请其他部分中所述。
在一个实施方案中,所述洗涤溶液还包含Hp。在一个实施方案中,所述洗涤溶液包含约2μM至约20mM Hp。在一个实施方案中,所述洗涤溶液包含约2μM至约5mM Hp。在一个实施方案中,所述洗涤溶液包含约100μM至约5mM Hp。在一个实施方案中,所述洗涤溶液包含约2μM至约300μM Hp。在一个实施方案中,所述洗涤溶液包含约5μM至约50μM Hp。在一个实施方案中,所述洗涤溶液包含约10μM至约30μM Hp。
在一个实施方案中,所述洗涤溶液包含与出血后受试者CFS中无细胞Hb浓度至少等摩尔量的Hp。在另一个实施方案中,所述洗涤溶液包含约3μM至约300μM Hp。
在一些实施方案中,可能希望放弃如本申请中所述从受试者的CSF中体外去除无细胞Hb的步骤,而代之以如本申请其他部分中所述的人工CSF替代受试者CSF。因此,在一个实施方案中,所述方法还包括:
(i)出血后从受试者取出CSF;
(ii)在步骤(i)后用包含治疗有效量的Hp的洗涤溶液冲洗受试者的CSF隔室;
(iii)任选地重复步骤(ii);以及
(iv)在步骤(ii)或步骤(iii)后,向受试者的CSF隔室施用人工CSF。
通过将治疗有效量的Hp掺入洗涤溶液中,CSF隔室中残留的无细胞Hb可以与Hp复合,从而中和无细胞Hb对脑组织的不良生物作用。
人工CSF
在本申请中所公开的另一方面,提供了包含Hx的人工脑脊液(CSF),其如本申请中所述。
人工脑脊液(aCSF)典型地为模拟天然CSF的流体,包括通过盐含量进行模拟。aCSF的合适组合物为本领域技术人员熟知的。其实例描述在US20060057065和Matzneller等人(Pharmacology,2016;97(5-6):233-44,其内容通过引用全部并入本申请)中。aCSF可以包含浓度与天然CSF中发现的浓度相似的NaCl,如本领域技术人员所熟知的,并且典型地包括天然CSF中NaCl浓度的约15%以内、更优选约10%以内的浓度。aCSF可以包含浓度与天然CSF中发现的浓度相似的NaHCO
在一个实施方案中,人工CSF包含约2μM至约80mM Hx。在一个实施方案中,人工CSF包含约2μM至约20mM Hx。在一个实施方案中,人工CSF包含约100μM至约20mM Hx。在一个实施方案中,人工CSF包含约2μM至约1,200μM Hx。在一个实施方案中,人工CSF包含约5μM至约200μM Hx。在一个实施方案中,人工CSF包含约10μM至约120μM Hx。
在一个实施方案中,人工CSF包含与出血后受试者的CFS中的无细胞血红素浓度等摩尔量的Hx。在另一个实施方案中,人工CSF包含约3μM至约1,200μM Hx。
在一个实施方案中,人工CSF还包含Hp。在一个实施方案中,人工CSF包含约2μM至约20mM Hp。在一个实施方案中,人工CSF包含约2μM至约5mM Hp。在一个实施方案中,人工CSF包含约100μM至约5mM Hp。在一个实施方案中,人工CSF包含约2μM至约300μM Hp。在一个实施方案中,人工CSF包含约5μM至约50μM Hp。在一个实施方案中,人工CSF包含约10μM至约30μM Hp。
在一个实施方案中,人工CSF包含与出血后受试者CFS中无细胞Hb浓度至少等摩尔量的Hp。在另一个实施方案中,人工CSF包含约3μM至约300μM Hp。
在一个实施方案中,人工CSF包含约2μM至约80mM Hx和约2μM至约20mM Hp。在一个实施方案中,人工CSF包含约2μM至约20mM Hx和约2μM至约5mM Hp。在一个实施方案中,人工CSF包含约100μM至约20mM Hx和约2μM至约5mM Hp。在一个实施方案中,人工CSF包含约2μM至约1,200μM Hx和约2μM至约300mM Hp。在一个实施方案中,人工CSF包含约5μM至约200μMHx和约2μM至约50mM Hp。在一个实施方案中,人工CSF包含约10μM至约120μM Hx和约2μM至约30mM Hp。
药物组合物
在本申请中所公开的另一方面,提供了用于根据本申请中所述的方法治疗或预防出血性中风后受试者的不良继发性神经学后果的药物组合物,该组合物包含治疗有效量的如本申请中所述的Hx和药学上可接受的载体。
在本申请中所公开的另一方面,提供了用于根据如本申请中所述的方法治疗或预防出血性中风后受试者的不良继发性神经学后果的药物组合物,该组合物包含治疗有效量的如本申请中所述的Hx和药学上可接受的载体。
在一个实施方案中,所述组合物包含约2μM至约80mM Hx。在一个实施方案中,所述组合物包含约2μM至约20mM Hx。在一个实施方案中,所述组合物包含约100μM至约20mM Hx或其功能类似物。在一个实施方案中,所述组合物包含约2μM至约1,200μM Hx。在一个实施方案中,所述组合物包含约5μM至约200μM Hx。在一个实施方案中,所述组合物包含约10μM至约120μM Hx。
在一个实施方案中,所述组合物包含与出血后受试者的CFS中的无细胞血红素浓度等摩尔量的Hx。在另一个实施方案中,所述组合物包含约3μM至约1,200μM Hx。
在一个实施方案中,所述组合物还包含治疗有效量的如本申请中所述的Hp。
在一个实施方案中,所述组合物包含约2μM至约20mM Hp。在一个实施方案中,所述组合物包含约2μM至约5mM Hp。在一个实施方案中,所述组合物包含约100μM至约5mM Hp。在一个实施方案中,所述组合物包含约2μM至约300μM Hp。在一个实施方案中,所述组合物包含约5μM至约50μM Hp。在一个实施方案中,所述组合物包含约10μM至约30μM Hp。
在一个实施方案中,所述组合物包含与出血后受试者CFS中无细胞Hb浓度至少等摩尔量的Hp。在另一个实施方案中,所述组合物包含约3μM至约300μM Hp。
在一个实施方案中,所述组合物包含约2μM至约80mM Hx和约2μM至约20mM Hp。在一个实施方案中,所述组合物包含约2μM至约20mM Hx和约2μM至约5mM Hp。在一个实施方案中,所述组合物包含约100μM至约20mM Hx和约2μM至约5mM Hp。在一个实施方案中,所述组合物包含约2μM至约1,200μM Hx和约2μM至约300mM Hp。在一个实施方案中,所述组合物包含约5μM至约200μM Hx和约2μM至约50mM Hp。在一个实施方案中,所述组合物包含约10μM至约120μM Hx和约2μM至约30mM Hp。
在本申请中所公开的另一方面,提供了治疗有效量的如本申请中所述的Hx在制备用于根据本申请中所述方法治疗或预防出血性中风后受试者的不良继发性神经学后果的药物中的用途。
在一个实施方案中,配制本申请中所公开的药物组合物用于鞘内施用。合适的鞘内递送系统是本领域技术人员熟知的,其示例性示例由Kilburn等人(2013,IntrathecalAdministration.In:Rudek M.,Chau C.,Figg W.,McLeod H.(eds)Handbook ofAnticancer Pharmacokinetics and Pharmacodynamics.Cancer Drug Discovery andDevelopment.Springer,New York,NY)描述,其内容通过引用全部并入本申请。
在另一个实施方案中,配制本申请中所公开的药物组合物用于颅内施用。合适的鞘内递送系统是本领域技术人员熟知的,其示例性实例由Upadhyay等人(2014,PNAS,111(45):16071-16076)描述,其内容通过引用全部并入本申请。
在另一个实施方案中,配制本申请中所公开的药物组合物用于脑室内施用。合适的鞘内递送系统是本领域技术人员熟知的,其示例性实例由Cook等人(2009,Pharmacotherapy.29(7):832-845)描述,其内容通过引用全部并入本申请。
合适的药物组合物及其单位剂型可以包含常规比例的常规成分与或不与另外的活性化合物或成分,并且这类单位剂型可以包含与被采用的预期日剂量范围相称的任何合适的有效量的活性成分。
试剂盒
在本申请中所公开的另一方面,提供了试剂盒,其包含如本申请中所述的人工CSF或如本申请中所述的药物组合物。如本申请中所述的活性剂(包括Hx和任选的Hp)可以以适于允许同时、分开或依次施用活性剂的成分试剂盒的形式存在。每种载体、稀释剂、佐剂和/或赋形剂必须是“药学上可接受的”,只要其与组合物的其他成分相容并且被受试者生理上耐受。组合物可以方便地以单位剂型存在,并且可以通过制药领域众所周知的方法制备。这类方法包括使活性成分与载体结合的步骤,所述载体构成一种或多种辅助成分。通常,组合物通过将活性成分与液体载体、稀释剂、佐剂和/或赋形剂或固体载体细粉或两者均匀且紧密地结合,然后如果必要使产品成形来制备。
诊断方法
如本申请其他部分中所述,本发明人惊奇地发现,心室CSF-Hb的浓度可以用于确定受试者是否处于出血性中风后发生不良继发性神经学后果的风险中。
因此,在本申请中所公开的另一方面,提供了确定受试者是否处于在伴有血管外红细胞溶解和无细胞血红素和/或无细胞血红蛋白(Hb)释放到脑脊液(CSF)中的出血性中风后发生不良继发性神经学后果的风险中的方法,该方法包括(i)从出血性中风后的受试者获得CSF样品;(ii)测量步骤(i)中获得的CSF样品中无细胞Hb的量;以及(iii)将步骤(ii)中测定的CSF样品中无细胞Hb的量与参考值进行比较,其中基于步骤(iii)中的比较确定受试者发生不良继发性神经学后果的风险。
测量CSF样品中无细胞Hb的量的合适方法是本领域技术人员已知的,其示例性实例在本申请其他部分中描述。
在一个实施方案中,“参考值”是代表健康受试者或健康受试者群体的CSF中无细胞Hb的量的值。在这种情况下,来自测试受试者的CSF样品中的无细胞Hb的量大于参考值指示受试者处于出血性中风后的不良继发性神经学后果的风险中。相反,来自测试受试者的CSF样品中的无细胞Hb的量等于或低于参考值指示受试者尚未处于发生出血性中风后的不良继发性神经学后果的风险中。
在一个实施方案中,“参考值”是代表在出血性中风后具有不良继发性神经学后果的受试者或受试者群体的CSF中无细胞Hb的量的值。在这种情况下,来自测试受试者的CSF样品中等于或大于参考值的无细胞Hb的量指示受试者处于发生出血性中风后的不良继发性神经学后果的风险中。相反,在来自测试受试者的CSF样品中无细胞Hb的量低于参考值指示受试者可能不处于在出血性中风后发生不良继发性神经学后果的风险中。
在一个实施方案中,参考值基本上为零,意味着CSF中没有可检测到的生理性无细胞Hb。在另一个实施方案中,参考值代表一个或多个患有出血性中风但没有不良神经学结果的患者的CSF中的无细胞Hb水平。在这种情况下,应当理解,在一些情况下,CSF中可能存在无细胞Hb的阈值水平,其可以被耐受而没有不良神经学后果。
在一个实施方案中,确定受试者处于发生不良继发性神经学后果的风险中,其中步骤(ii)中测定的CSF样品中无细胞Hb的量为至少约7μM。
在一个实施方案中,所述不良继发性神经学后果为血管造影性血管痉挛,并且确定受试者处于发生血管造影性血管痉挛的风险中,其中步骤(ii)中测定的CSF样品中无细胞Hb的量为至少约3μM。
在一个实施方案中,所述不良继发性神经学后果为迟发性脑缺血,并且确定受试者处于发生迟发性脑缺血的风险中,其中步骤(ii)中测定的CSF样品中无细胞Hb的量为至少约5μM。
在一个实施方案中,所述不良继发性神经学后果为迟发性缺血性神经功能缺损,并且确定受试者处于发生迟发性缺血性神经功能缺损的风险中,其中步骤(ii)中测定的CSF样品中无细胞Hb的量为至少约7μM。
所谓“至少约7μM”包括至少约7μM、至少约8μM、至少约9μM、至少约10μM、至少约15μM、至少约20μM、至少约25μM、至少约30μM、至少约35μM、至少约40μM、至少约45μM、至少约50μM等。在一个实施方案中,确定受试者处于在出血性中风后发展不良继发性神经学后果的风险中。确定受试者处于在出血性中风后发生不良继发性神经学后果的风险中,其中步骤(ii)中测定的CSF样品中无细胞Hb的量为至少约7μM,优选至少约8μM,优选至少约9μM,优选至少约10μM,优选至少约15μM,优选至少约20μM,优选至少约25μM,优选至少约30μM,优选至少约35μM,优选至少约40μM,优选至少约45μM,或更优选至少约50μM。
类似地,所谓“至少约3μM”包括至少约3μM、至少约4μM、至少约5μM、至少约6μM、至少约7μM、至少约8μM、至少约9μM、至少约10μM、至少约15μM、至少约20μM、至少约25μM、至少约30μM、至少约35μM、至少约40μM、至少约45μM、至少约50μM等。在一个实施方案中,确定受试者处于在出血性中风后发生不良继发性神经学后果的风险中,其中步骤(ii)中测定的CSF样品中无细胞Hb的量为至少约3μM、至少约4μM、至少约5μM、至少约6μM、至少约7μM,优选至少约8μM,优选至少约9μM,优选至少约10μM,优选至少约15μM,优选至少约20μM,优选至少约25μM,优选至少约30μM,优选至少约35μM,优选至少约40μM,优选至少约45μM,或更优选至少约50μM。
如本申请中所述,确定出血性中风后发生不良继发性神经学后果的风险的方法有利地允许考虑到其确定的风险将受试者分层到适当的治疗方案。例如,如果确定受试者处于出血性中风后发生不良继发性神经学后果的风险中,则可以根据本申请中所述的治疗方法对受试者进行分层。相反,如果确定受试者在出血性中风后不处于发生不良继发性神经学后果的风险中,则可以将受试者分层为不治疗或替代方案和侵入性较小的治疗方案。
确定风险的方法可以适当地包括使用接受者操作特征(ROC)曲线(例如,ROCR包(v1.0-11)(Sing等人,2005)、plotROC包(v2.2.1)(Sachs,2017))、相应的自助法曲线下面积(AUC)(pROC包(v1.16.2)(Robin等人,2011))和/或最佳Youden指数(ROCit包(v1.1.1)(Md Riaz Ahmed,2019))。本申请其他部分还描述了确定出血性中风后发生不良继发性神经学后果的风险的方法的示例性实例。
在一个实施方案中,所述方法还包括治疗被确定处于不良继发性神经学后果的风险中的受试者,其中所述的治疗包括使受试者的CSF暴露于(i)治疗有效量的血红素结合蛋白(Hx)和持续足以允许Hx与无细胞血红素形成复合物并由此中和无细胞血红素的一段时间,其如本申请中所述;以及/或(ii)治疗有效量的触珠蛋白(Hp)并持续足以允许Hp与无细胞Hb形成复合物且由此中和无细胞Hb的一段时间,其如本申请中所述。
在本申请中所公开的另一方面,提供了对受试者进行分层的方法,所述受试者在伴有血管外红细胞溶解和无细胞血红素和/或无细胞血红蛋白(Hb)释放到脑脊液(CSF)中的出血性中风后的受试者中针对不良继发性神经学后果进行治疗,其中所述的方法包括(a)确定受试者是否处于发生不良继发性神经学后果的风险中,如本申请中所述,和(b)根据本申请中所述的方法治疗确定处于不良继发性神经学后果风险中的受试者。
本领域技术人员可以理解,除了具体描述的那些之外,本申请中描述的本发明易于进行变化和变型。应当理解,本发明包括落入精神和范围内的所有这些变化和修改。本发明还包括本说明书中单独或共同提及或指出的所有步骤、特征、组合物和化合物,以及任何两个或更多个所述步骤或特征的任何和所有组合。
现在将参考以下实施例描述本发明的某些实施方案,这些实施例仅用于举例说明的目的,并非意图限制上文所一般性描述的范围。
实施例
实施例1:作为SAH-SBI生物标志物的脑室CSF Hb
本研究在开始前获得了伦理批准。从所有患者或其法定代表人获得了书面知情同意书。所有实验均符合生物安全规定并在适当的工作条件下进行。根据STROBE声明(vonElm等人,2007)报告结果。
研究人群
临床数据和CSF样品获自在3年期间(2017年4月至2020年3月)入住学术三级护理中心的神经重症监护病房的具有aSAH的前瞻性连续患者群组。适格标准包含:(i)年龄>18岁;(ii)放射学诊断蛛网膜下出血;(iii)排除非动脉瘤蛛网膜下出血(例如,创伤、中脑周围蛛网膜下出血);(iv)插入脑室外引流管(EVD)作为标准护理的一部分。
临床数据采集
患者数据收集独立进行,并且盲法进行CSF取样。在诊断时评估基线特征,包括人口统计学特征(年龄、性别)、临床评分和测量值(WFNS等级、Hunt&Hess等级、初始格拉斯科昏迷量表(GCS))和放射学评估(动脉瘤位置、最大动脉瘤直径、血肿体积(参见下文)、脑室内出血(IVH)的存在、Fisher分级、BNI分级)(图7A)。基于神经重症监护病房的标准化多模式监测并作为3个月随访的一部分,在SAH-SBI的14天高风险期期间前瞻性地收集临床数据(图7A)。一般患者管理符合当前的国际指南(Diringer等人,2011;Connolly等人,2012)。基于每天评估DIND、DCI或aVSP的存在。将DIND定义为新的局灶性神经功能缺损或GCS降低至少2个点持续至少2小时,不可归因于任何其他可识别的原因,例如脑积水、癫痫性发作或全身因素。在无法对患者进行临床评估(例如,镇静)的情况下,将临床数据分类为不可用(NA)。将DCI被定义为CT/CTP或MRI上不可归因于手术干预的新缺血或新梗塞。aVSP的定义包含基于数字减影血管造影(DSA)、计算机6体层摄影术(CTA)和磁共振血管造影(MRA)的新的脑动脉狭窄。在相应天无适当的成像程序的情况下,将其记为NA。将SAH-SBI定义为DIND、DCI和aVSP的综合结果。此外,每天使用TCD评估大脑中动脉、大脑前动脉和大脑后动脉中的流速。
评价了并发症(脑膜脑炎、脑性盐耗、尿崩症、肺炎、Takotsubo心肌病、癫痫非痉挛状态、慢性脑积水、死亡)和功能状态(格拉斯哥预后量表扩展(GOSE)和改良Rankin量表(MRS))直到3个月随访。
蛛网膜下血肿的分段和容量分析
基于初始CT扫描,使用3DSlicer手动描绘蛛网膜下血肿的体积(Kikinis等人,2014)。这在47名受试者中的46名中进行,因为一名仅具有初始MRI,因此从该分析中排除。描绘之前的预处理由脑提取组成。从200HU阈值颅骨掩膜提取最大的腔(Weidert等人,2020)。因此,将脑掩模与原始CT扫描相乘,并用5×5×3核进行中值过滤(图7B)。将出血的体积确定为体元尺寸乘以分段体元的数量(图2C)。
CSF取样
在动脉瘤修复后开始,每天从EVD收集CSF样品。计划取样持续时间在第1天(出血后的那一天)和第14天之间。在对临床数据设盲的情况下进行CSF收集。样品收集后,立即将CSF以1500G离心15分钟(Capricorn CEP 2000Benchtop离心机,Capricorn labs,UK),并将上清液储存在-80℃用于进一步分析。
CSF Hb和血红素代谢物的分光光度测定
在Shimadzu UV-1800分光光度计(Shimadzu,Japan)上测量了所有CSF样品在350nm和650nm之间的视觉范围内的吸收光谱。使用光谱反褶积进行了不同Hb种类及其代谢物(oxyHb、metHb、胆红素、胆绿素)的定量。因此,使用如前所述的非负最小二乘算法(Deuel等人,2015),将具有已知浓度的各个物质的消光曲线拟合到CSF的消光曲线。
LC-MSMSCSF蛋白质组分析
使用无标记蛋白质组学定量方法,在观察期的五个连续时间点(0、aSAH后0.5、1、1.5和2周)表征了18名患者的CSF蛋白质组(图7C)。将样品分两批处理以改善泛化性,在归一化后将其组合用于分析(总计85个样品-批次1中48个,批次2中37个)。在分析之前使用触珠蛋白亲和柱选择性地除去大量存在于红细胞裂解的CSF中的Hb,以避免离子抑制并增加灵敏度(Hugelshofer等人,2019)。
在用胰蛋白酶消化Hb耗竭的CSF样品后,在配备有数字PicoView源(NewObjective)并与M-级UPLC(Waters)偶联的Q Exactive HF质谱仪(Thermo Scientific)上进行了质谱分析。
A.样品制备
使用
B.液相色谱-质谱分析
在配备有数字PicoView源(New Objective)并与M级UPLC(Waters)偶联的Orbitrap Fusion Lumos(Thermo Scientific)上进行了质谱分析。两个通道的溶剂组成为通道A为0.1%甲酸,通道B为0.1%甲酸、99.9%乙腈。对于每个样品,将1μL稀释的肽加载到商品MZ Symmetry C18阱柱(
C.蛋白质鉴定和无标记蛋白质定量
通过MaxQuant(1.6.2.3版)处理了获得的原始MS数据,随后使用整合的Andromeda搜索引擎(Cox和Mann,2008)进行了蛋白质鉴定。针对SwissProt智人参考蛋白质组(分类学9606,版本自2019-07-09)检索光谱,并与其反向诱饵fasta数据库和常见蛋白质污染物链接。将半胱氨酸的甲酰胺甲基化设定为固定修饰,而将甲硫氨酸氧化和N-末端蛋白质乙酰化设置为变量。将酶特异性设定为胰蛋白酶/P,允许最小肽长度为7个氨基酸和最多两个错过切割。使用MaxQuant Orbitrap默认搜索设置。将肽的最大错误发现率(FDR)设定为0.01,将蛋白质的最大错误发现率(FDR)设定为0.05。启用无标记定量,并应用2分钟窗口用于运行之间的匹配。在MaxQuant实验设计模板中,每个文件在实验设计中保持分开以获得单独的定量值。将MaxQuant结果加载到Scaffold(Proteome Software Inc.)中以验证肽和蛋白质鉴定。仅考虑用至少2种肽鉴定的蛋白质用于随访分析。
将蛋白质的各个蛋白质强度对相应蛋白质在基线(第0周)时的平均强度进行归一化,并进行log2转化。将总倍数变化计算为每种蛋白质在整个时程中的对数比的总和。此外,对于每个时间点,使用Wilcoxon秩和检验将归一化的蛋白质强度与基线(第0周)进行比较,并使用Metap包(Dewey,2020)在所有时间点上合并p值。使用k均值分析对CSF蛋白质组的暂时性改变进行聚类,其中使用factoextra包(v1.0.7)(Kassambara和Mundt,2020)用肘形图(图7D)目视确定最佳聚类数量。
血红蛋白、触珠蛋白、血红素结合蛋白和rLP
如前所述(Elmer等人,2009),从过期的人血液浓缩物中纯化用于离体实验的Hb。通过如上所述的光谱反褶积测定Hb浓度,并以总血红素的摩尔浓度(1M Hb四聚体相当于4M血红素)给出。Hx以与测试样品中测量的血红素浓度等摩尔的浓度使用。对于在这些研究中使用的所有Hb,如通过分光光度法测定的,亚铁oxyHb(HbFe 2+O2)的分数始终大于98%。从CSL Behring获得了来自人血浆的纯化的触珠蛋白(表型1-1)和血红素结合蛋白。
神经血管功能
使用从当地屠宰场获得的新鲜猪基底动脉(n=12)进行了血管功能测定(图7E)。血管被预拉伸以达到如先前公开的8的最佳被动预张力(Hugelshofer等人,2020)。然后,使用10μM前列腺素F2α(PGF2α;Sigma,Buchs,瑞士)作为预收缩剂。为了确定在不存在内源性NO的情况下的最大可能张力,在本实验结束时以10μM的浓度添加L-N5-(1-亚氨基乙基)鸟氨酸盐酸盐(L-NIO;Sigma-Aldrich,Saint Louis,US-MO)。将记录的张力对相应血管的个体NO储备能力归一化,即加入PGF2α(0%)后的基线张力和在实验结束时加入L-NIO后的张力(100%)(图7F)。从分析中排除在实验持续时间内张力连续损失的受损血管,导致PGF2αmax/L-NIO max比率低于0.7(图7F)。进行第一系列实验以评估aSAH后SAH-SBI高风险期患者CSF的血管收缩潜力,并评估OxyHb在该过程中的特定作用。为此目的,使用触珠蛋白亲和柱选择性地耗竭来自高风险阶段(第4天与第14天之间)的患者CSF中的Hb。在本实验的初始阶段,将容器浸入Hb耗竭的CSF中。随后,将预先耗竭的精确量的Hb加入CSF中,以确定其对血管张力的特定影响。在第二系列实验中,评估了增加暴露于Hb对血管张力的影响。在Krebs-Henseleit缓冲液中进行半log10Hb稀释系列(10
TBARS
在与明确定义的重构脂蛋白(rLP,得自CSL Behring,Bern,瑞士)孵育后通过测量作为脂质过氧化的最终产物的丙二醛(MDA)的形成,定量了CSF样品的氧化电位(图7G)。使用96-孔板,将25μL CSF与5μL rLP(3mg/mL)混合,并在37℃下孵育24小时。随后,使用硫代巴比妥酸反应物质(TBARS)测定法测量MDA的浓度。简言之,将125μL在1M HCl中的750mM三氯乙酸加入样品中,随后短暂涡旋,随后加入100μL在1M NaOH中的25mM 2-硫代巴比妥酸。
在80°下孵育60min后,定量了上清液中的TBARS。对于MDA的绝对定量,从532nm处的吸收减去600nm处的吸收,并用0.156mM-1c m-1的摩尔消光9系数计算浓度。为了实现更灵敏但相对的定量,使用510nm作为激发波长在550nm处测量了荧光发射。
统计分析
使用R 3.6.3(R Core Team,2020)进行了统计分析。分类数据以绝对数(N)和比例(%)提供,连续数据以平均值和标准偏差(SD)提供。对于析因实验,我们使用ez包(v4.4-0)(Lawrence,2016)进行了重复测量ANOVA。用lme4包(v1.1-23)(Bates等人,2015)进行混合线性模型分析。对于基因集富集分析,我们使用基因集富集分析、来自broad institute(Subramanian等人,2005)的GSEA软件和Molecular Signature Database(MSigDB)(Liberzon等人,2015)的标志基因集。作为输入,我们使用鉴定的蛋白质的排序列表,其中排序得分计算为-log10(p值)与蛋白质的总和(对数比)的乘积。基线测量值(动脉瘤位置、动脉瘤大小、血肿体积、IVH的存在)与CSF-Hb之间以及CSF-Hb与SAH-SBI之间的相关性使用mgcv包(v1.8-31)(Wood,2017),应用aSAH后当天的样条拟合和患者ID的随机效应的广义加性模型(GAM)进行分析。使用接受者操作特征(ROC)曲线(ROCR包(v1.0-11)(Sing等人,2005)、plotROC包(v2.2.1)(Sachs,2017))、相应的自助法曲线下面积(AUC)(pROC包(v1.16.2)(Robin等人,2011))和最佳Youden指数(ROCit包(v1.1.1)(Md Riaz Ahmed,2019))分析CSF oxyHb对SAH-SBI的灵敏度和特异性。根据其临床评估(病理或非病理),首先分类使用TCD流速,其用于确定灵敏度和特异性。其次,随着TCD缩放,它们被连续用于与测量的CSF Hb的病理生理学相关性,每个值被缩放到群组的相应血管(大脑前动脉、大脑中动脉或大脑后动脉)上的平均流量。最大TCD标度表示每天测量的最大标度值。由于本研究的探索性特征,没有定义统计学显著性水平,而是基于证据水平解释了结果:p<0.001:非常强的证据;p<0.01:强有力的证据;p<0.05证据;p<0.1弱证据;p>0.1:无证据(Bland,2015)。
结果
A.研究群体
包括了满足适格标准的52名连续筛选的患者中的47名。
5名患者或其法定代表人拒绝了知情同意书。表1总结了患者群组的基线特征。
表1
B.CSF-Hb和血红素-代谢物的分光光度测定
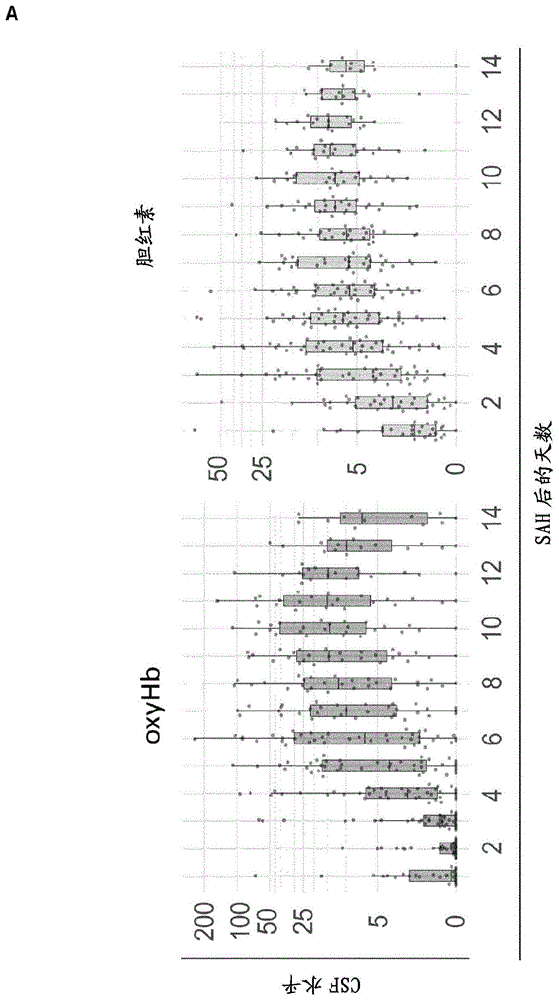
使用具有光谱反褶积的分光光度法定量了无细胞的oxyHb(亚铁HbFe 2+)及其下游代谢物胆绿素和胆红素,以及主要的Hb氧化产物MetHb(高铁HbFe 3+)。OxyHb的个体时间曲线和峰值浓度(0.6μM-242.2μM)是高度可变的(图8)。在大多数患者中,oxyHb在aSAH后的前2至3天期间保持非常低,随后显著增加,在第9天至第12天之间达到平台期,并且在此之后降低(图1A)。胆红素在第1天已经升高,在其达到平台之前的前3至5天表现出最显著的增加(图1A)。该时间过程反映了蛛网膜下腔中巨噬细胞的吞噬作用和血红素代谢。中间代谢物胆绿素在第4天后开始显著升高,并在第12天达到其峰值(图1A)。此外,MetHb遵循延迟增加,在aSAH后11天达到峰值,这与CSF中无细胞oxyHb的缓慢自动氧化一致(图1A)。
C.LC-MSMS CSF蛋白质组分析
对在出血后5个时间点收集的来自18名患者的85个CSF样品进行了定量LC-MS/MS分析。图1B示例了通过k均值聚类分配到四组的757种CSF蛋白的短暂过程。图1C显示了在每名患者的所有样品中求和的归一化的信号强度的火山图,其提供了出血后两周内蛋白质蓄积或消耗的总体视图。簇1(绿色)包括随时间保持不变的蛋白质。簇4(黄色)表示强度随时间降低的蛋白质。这些主要是通过初始出血进入蛛网膜下腔并随后从CSF清除的血浆蛋白。使用Molecular Signature Database(MSigDB)(Liberzon等人,2015)的标志基因集对排序的蛋白质进行基因集富集分析(GSEA),将最高负富集分配至凝血(ES=-0.66,FDR=0.007,图1D)。图1E展示了四种选择的血浆蛋白(Hp、Hpr、HPX和AIB)的短暂过程。簇2(紫色)包括随时间推移具有12显著蓄积的蛋白质,并且簇3(蓝色)蛋白质具有适度增加。
GSEA将糖酵解(ES=0.78,FDR=0.016,图1F)和血红素代谢(ES=0.74,FDR=0.096,图1H)鉴定为最高富集标志,分别代表红细胞(RBC)裂解,同时释放细胞质蛋白和通过巨噬细胞分解Hb。图1G显示了RBC蛋白碳酸酐酶1(CA1)和2(CA2)、过氧化氢酶(CAT)和醛缩酶A(ALDOA)的时程。图1l显示了巨噬细胞蛋白CD163、CSF1R、CD14和TIMP-1。这些蛋白质的蓄积表明在出血后的第一天内巨噬细胞显著流入蛛网膜下腔。总之,aSAH后患者CSF中的蛋白质组动力学强化了红细胞裂解以及适应性巨噬细胞应答是aSAH后CSF腔中发生的两个主要过程。
D.CSF-Hb水平的决定因素
应用广义加性模型(GAM),对aSAH后的当天进行样条拟合和对患者ID进行随机效应以估计CSF-Hb浓度的决定因素。部分依赖性图在图2B中给出。动脉瘤的大小显然不与CSF-Hb的进程相关。在不同的动脉瘤位置中,只有大脑中动脉瘤与Hb水平相关,其为阴性(p=0.0018)。血肿体积显示了与CSF-Hb水平强烈相关。aSAH后当天在前3-5天中具有负相关,随后在随后的几天中具有弱正相关。这种关联最可能反映了蛛网膜下腔中红细胞溶解和CSF-Hb产生的延迟发作。IVH的存在与更高水平的CSF-Hb相关(p<0.0001)。在IVH的情况下,CSF-Hb显示了出早期增加至平台期,而在没有IVH的情况下,增加更延迟且是渐增的,但在第12天左右在相当的峰值浓度下保持水平(图2C)。这最可能是CSF隔室效应(图2D)。
E.增加的CSF-Hb与继发性脑损伤相关
表3总结了代表SAH-SBI(逐个患者和逐日)、救援疗法、并发症、死亡率和3个月随访时的功能状态的群组结果参数。通过SAH-SBI分层的CSF-Hb水平显示了在图3A和图9中。基于aSAH后当天的样条拟合的GAM和患者ID的随机效应,我们发现了SAH-SBI的发生率与CSF-Hb浓度之间的相关性的非常强的证据(p=0.00045)。图3B给出了SAH-SBI对CSF-Hb和SAH后天数的部分依赖性。为了估计每日CSF-Hb作为SAH-SBI的监测标志物的功效,计算了DIND、DCI、aVSP(图9A-C,表2)和复合结果SAH-SBI(图3C,表2)的各自的接受者操作特征(ROC)曲线和相应的ROC曲线下面积(AUC)。在重新计算的模型中,高诊断准确性保持不变,其中数据限于高风险期(第4-14天),避免了由出血后前几天通常低的Hb水平引入的潜在偏差(图9D)。胆红素、胆绿素和高铁血红蛋白具有比oxyHb更低的诊断准确性(图9E-G)。最佳Youden指数的计算得到SAH-SBI的CSF-Hb值为7.1μM(图3C)。对于个体结果aVSP、DCI和DIND,最佳Youden指数分别为3.4、5.5和7.1μM(图9A-C)。
表2
表3
/>
鉴于它们在临床实践中的频繁使用(Diringer等人,2011;Connolly等人,2012),评估了临床和放射学评分的诊断准确性,以及患者群组中的每日TCD测量值。临床和放射学评分表明预测质量差(表2,图9H-K)。TCD测量显示了对SAH-SBI、aVSP、DCI和DIND的高特异性。然而,TCD的灵敏度最低(表2)。
高CSF-Hb水平也与3个月随访时GOSE评分(p=0.0056,图3D)和mRS评分(p=0.0016,图9L)表示的不良临床结果相关。
F.在患者CSF-Hb的浓度范围内发生基底动脉血管收缩和脂质过氧化
数据表明无细胞Hb是SAH-SBI的上游介体。为了增强这种关联的合理性,用匹配患者群组中CSF-Hb浓度范围的Hb暴露检查离体血管收缩和脂质过氧化。建立了用PGF2α预收缩的猪基底动脉的新血管功能模型,并在实验结束时通过内在内皮NOS(eNOS)反应扩张。这种设置允许研究Hb对内源性NO储备能力的影响。未使用补充的NO供体。
图4A显示了S形剂量-响应曲线,其中血管张力在10
总之,血管功能和脂质过氧化研究表明在患有SAH-SBI的患者中与相关CSF-Hb浓度重叠的关键回折点。
G.CSF-Hb的耗竭和中和减轻了病理性血管收缩和脂质过氧化。
为了在机理上使患者中的CSF-Hb与SAH-SBI相关的病理生理学关联,进行了一系列Hb耗竭和中和实验。浸入通过触珠蛋白柱耗竭CSF-Hb的CSF中的猪基底动脉段(图5A)具有比浸入用高度纯化的Hb补充至原始CSF-Hb浓度的相同CSF样品中的猪基底动脉段(图5B)显著更低的收缩力。该实验装置控制了触珠蛋白柱对血管活性物质的潜在非特异性去除。此外,我们重复了Hb剂量反应实验以证实可溶性触珠蛋白1-1(Hp1-1)的抗血管痉挛作用。在Hb浓度范围内,Hp 1-1显著减弱了基底动脉的收缩力(重复测量ANOVA,p<0.001)(图5C)。
还定量了aSAH后来自患者的CSF样品的氧化电位。与基线CSF(第0天)相比,在将脂蛋白暴露于在高风险阶段(第0.5–2周;图5D)期间收集的CSF样品后,发现可变增加的MDA产物。向CSF-Hb中加入等摩尔浓度的Hp1-1有效地减弱了MDA形成。值得注意的是,加入等摩尔浓度的血红素结合蛋白显示了出甚至更强的MDA形成减弱。
实施例2:患者CSF样品中血红蛋白和血红素清除蛋白的定量评估
A.CSF样品中人Hp、Hpx和白蛋白的定量
将10微升CSF样品置于洁净的Eppendorf管中,然后加入80μL MeOH以沉淀蛋白质。离心后除去甲醇,将沉淀风干,此后后重悬于包含重同位素标记肽的50mM NH
通过使用Agilent MassHunter Quant软件计算分析物和内标的峰面积,分析了数据。通过绘制分析物与内标标准物的平均响应比相对于每个标准样品的浓度,在AgilentMassHunter Quant中为每种蛋白质创建了标准曲线。使用标准曲线方程反算了CSF样品中的分析物浓度。
B.CSF中游离和触珠蛋白结合的血红蛋白的测定
使用连接至LPG-3400SD四元泵和光电二极管阵列检测器(DAD)(ThermoFisher)的Ultimate 3000SD HPLC,通过SEC-高效液相色谱法(SEC-HPLC)测定了Hp结合和未结合的Hb级分(无细胞Hb)。在Diol-120(3μm,300X 8.0mm)柱(YMC CO Ltd.)上分离CSF样品和Hb标准品,其中PBS,pH 7.4(Bichsel)作为流动相,流速为1mL/min。对于所有样品,记录两个波长(λ=280nm和λ=414nm)。通过计算两个峰的峰面积(对于Hb:Hp为7-8min保留时间,视Hp表型的不同而定,对于无细胞Hb为10min保留时间)来确定CSF中的结合和未结合Hb。通过基于峰面积生成标准曲线内插来自CSF样品的值,并相对于浓度作图。
C.CSF中血红素结合血红素蛋白的测定
使用连接至LPG-3400SD四元泵和光电二极管阵列检测器(DAD)(ThermoFisher)的Ultimate 3000SD HPLC,通过SEC-高效液相色谱法(SEC-HPLC)测定了血红素结合的血红素蛋白。CSF样品和血红素标准品在Diol-120(3μm,300X 8.0mm)柱(YMC CO Ltd.)上分离,其中PBS,pH 7.4(Bichsel)作为流动相,流速为1mL/min。对于所有样品,记录两个波长(λ=280nm和λ=414nm)。通过计算两个峰的峰面积(血红素结合血红素蛋白的保留时间为9min,游离Hb的保留时间为10min)来确定CSF中的血红素蛋白。通过基于峰面积生成标准曲线内插来自CSF样品的值,并相对于浓度作图。
D.人CSF样品中血红素结合蛋白:血红素复合物的检测
将50微升CSF样品置于洁净的Eppendorf管中,随后加入150μL缓冲液A(MultipleAffinity Removal Systems,Agilent)。在第一色谱步骤中,根据制造商的方案在连接至两个LPG-3400SD四元泵和光电二极管阵列检测器(DAD)(ThermoFisher)的Ultimate 3000SDHPLC上耗竭并完成高丰度人蛋白质。简言之,将稀释的血浆样品注射到耗竭人白蛋白和IgG的多亲和去除柱(人IgG/HSA,4.6×50mm,Agilent)上,并用缓冲液A(Multiple AffinityRemoval Systems,Agilent)作为流动相以0.25mL/min的流速分离。将耗竭的CSF收集到新的HPLC小瓶中,并重新注射并在Diol-300(3μm,300X 8.0mm)柱(YMC CO Ltd.)上分离,其中PBS,pH 7.4(Bichsel)作为流动相,流速为1mL/min。对于所有样品,记录两个波长(λ=280nm和λ=414nm)。通过计算复合物的峰面积(9min保留时间)来确定血红素结合蛋白:血红素复合物的量。通过产生基于峰面积的标准曲线内插来自耗竭的CSF样品的值,并对浓度作图。
结果
在14天的时间期限内收集的来自28名aSAH患者的CSF样品中,评估了无细胞血红蛋白(图11)。尽管定量CSF样品中的无细胞Hb的方法不同于如上文实施例1中所述的在相同群组内应用的方法,但结果完全一致(相关系数(r)=0.96)。再次,数据表明,无细胞Hb水平随时间增加并且在第10天(1.5周)左右达到峰值。相反并且由于血液浸润到CSF中,与健康对照相比,触珠蛋白和血红素结合蛋白浓度在非常早期的时间点增加。两种清除蛋白显示了出与血红蛋白水平相反的动力学,这提示由于正在进行的溶血而耗竭。白蛋白浓度在整个时间过程中保持相差无几,但如果与健康对照CSF样品相比,则显著增加。
在下一步骤中,研究了清除蛋白触珠蛋白和血红素结合蛋白作为与血红蛋白或血红素的复合物的存在。总体上并且如基于两种蛋白质的动力学所预期的,数值非常低,并且大多数数据点在标准曲线外插值。与无细胞Hb数据一起表明,在早期时间点(其中在患者CSF中清楚地检测到两种蛋白质),尚未存在靶标,并且在Hb水平增加的晚期时间点,两种清除剂已经耗竭并从CSF中清除。因此,这些数据提示天然Hb解毒途径是完全饱和的,并且清除蛋白被耗竭。发现白蛋白(一种临时血红素储存蛋白)在整个研究期间升高,并且血红素蛋白(除无细胞Hb或Hp结合Hb之外的血红素结合蛋白)的认为研究揭示了与CSF中的总白蛋白类似的模式。这些数据提示,大多数检测到的血红素蛋白实际上是与白蛋白结合的血红素,因为与血红素结合蛋白结合的血红素被鉴定为非常低乃至不存在。与血红素结合蛋白相反,与白蛋白结合的血红素仍然能够参与铁介导的毒性,因此被认为是aSAH患者继发性脑损伤的主要贡献者之一。这些数据支持使用血红素结合蛋白进一步减少aSAH患者中血红素介导的氧化损伤。
实施例3:血红素毒性/血红素结合蛋白保护
A.纹状体注射模型
野生型雄性C57BL/6J小鼠(10-12周)获自Charles River(Sulzfeld,Germany),并在University of Zurich(LASC)的动物设施饲养,并根据Swiss Federal VeterinaryOffice的指南进行处理。
用在100%氧气中蒸发的异氟烷(4-5%用于诱导,1-2%用于维持;BaxterHealthcare Co.Deerfield,IL,USA)麻醉小鼠。在整个手术过程中,用直肠探针监测体温,并使用电子恒温器控制的加温毯保持恒定。将麻醉的小鼠置于机动立体定位架(Stoelting,Dublin,Ireland)中,并进行1cm长的中线皮肤切口。在移除覆盖颅骨的软组织之后,在目标的进入点上方钻参考前囟和小钻孔的框架。然后将33G针头缓慢推进(0.1mm/s)进入纹状体(前囟坐标:2mm ML,0.5mm AP,3.5mm DV),然后以100nl/s的输注速率注射10μL血红素-白蛋白(1mM)、触珠蛋白(5mM)(蛋白质对照组)或血红素-血红素结合蛋白(1mM)。将针头留在原位5分钟,然后缓慢取出,并用缝合线闭合皮肤切口。在外科手术后,将动物置于加热的唤醒箱中并监测直至它们完全恢复并可以转移回它们的笼中。
B.行为测试
旷场探索实验在由不透明丙烯酸玻璃制成的四个相同的正方形平台(40×40×35cm高)上进行,这些平台位于测试室中,在漫射照明下(在平台的中心测量约35lx)。将数码相机安装在四个场地的正上方。以5Hz的速率捕获图像,并将其传输到运行Ethovision(Noldus,The Netherlands)跟踪系统的PC。为了测量基础运动活性,将动物轻轻地置于场地中心并使其探索15分钟。测量在5分钟适应阶段后开始的10分钟内移动的总距离(以cm计)。
对于旋转杆行为测试,将小鼠放置在旋转圆筒上并因此迫使去步行。这允许评估强制运动活动。在300秒的时间期限内,圆筒的旋转从每分钟5转(开始)加速到每分钟40转(结束)。测量小鼠从量筒上掉落的时间。
对于离散的神经功能缺损,对小鼠进行横梁步行测试。在那里,小鼠必须穿过高架横梁才能到达安全的地点(小庇护所)。横梁具有100cm长度和13mm宽度。在评估期间,由两名对治疗不知情的研究者对运动功能进行评分。
C.MRI方案
用在100%氧气中蒸发的异氟烷(4-5%用于诱导,1-2%用于维持;BaxterHealthcare Co.Deerfield,IL,USA)麻醉小鼠。在整个成像过程中,用直肠探针监测体温并使用加温毯保持恒定,并通过体积描记术记录呼吸速率。将小鼠置于7T小动物MRI扫描仪(Brucker,Germany)中。根据标准化方案记录T2、ASL和DWI图像。
结果
如图12中所示,在纹状体注射后24小时血红素损害小鼠的神经功能,如通过减少的旷场测试(图12A)、旋转杆测试(图12B)和平衡杆步行测试(图12C)所证明的。相反,接受血红素:Hx复合物的纹状体注射的小鼠在相同时间点(24小时)没有显示了神经行为活动的损害。神经功能受损与接受血红素纹状体注射的小鼠的放射学改变相关,包括病变周围水肿,ADC图中的扩散限制和动脉脊柱标记(ASL)图像上的局灶性灌注缺陷(图13)。在接受血红素:Hpx的纹状体注射的小鼠中,仅观察到微小的放射学改变。如图14中所示,放射学改变的定量证实,纹状体注射血红素与脑水肿的形成和局部灌注减少相关,这在注射血红素:Hpx的小鼠中不存在。
讨论
本发明人已经鉴定了脑室CSF-Hb作为SAH-SBI的生物标志物,其令人惊讶地超过了其他已建立的方法的诊断准确性。在临床相关浓度范围内,CSF-Hb离体诱导血管收缩和氧化的不饱和脂质,这提示它在伴有血管外红细胞溶解和无细胞血红素和/或无细胞血红蛋白(Hb)释放到脑脊液(CSF)中的出血性中风后作为不良继发性神经学后果的上游介体起作用。高CSF-Hb与不良临床结果的强烈相关性、潜在的病理生理学原理以及血红素结合蛋白和触珠蛋白的有利作用将CSF-Hb定位为处于SAH-SBI风险中的患者中的合适生物标志物和靶标。
除了其对出血性中风后的不良继发性神经学后果(如DIND、DCI和AVSP)的高诊断准确性之外,CSF-Hb的额外优点在于其简单且可靠的分析。精确的CSF-Hb值可以在ICU上以简单的两步法确定,该方法由离心步骤组成以从CSF中除去细胞和碎片,随后用自动频谱反褶积进行分光光度测定。此外,基于分光光度测定的物理定律允许绝对定量CSF-Hb,而无需平行测量标准曲线或归一化样品。总之,这显著降低了分析成本和周转时间,并且可以增强广泛的适用性和接受度。
本发明人还证实CSF-Hb是患者CSF中的主要血管收缩剂。此外,离体血管痉挛模型中Hb浓度的活性动态范围与临界回折点重叠,所述临界回折点确定大脑动脉中的TCD流速和我们的患者群组中SAH-SBD的存在或不存在。在相同的临床相关浓度范围内,发现CSF-Hb作为脂质氧化剂具有高活性,这提示氧化性Hb毒性有助于非缺血性神经元损伤。患者CSF中的脂质氧化活性至少部分归因于下游Hb代谢物血红素。其用血红素结合蛋白的选择性中和实际上阻断了MDA的形成,而触珠蛋白导致部分抑制。
本申请中所公开的数据证明,CSF-Hb是预防和治疗SAH-SBI的合适药物靶标。CSF-Hb与不良临床结局、合理的病理生理学和CSF-Hb中和与临床相关毒性范围内的血红素结合蛋白和触珠蛋白的有利功能作用的强相关性支持了这一点。迄今为止,在aSAH后减少SAH-SBI发生的唯一药物是钙通道阻断剂尼莫地平(I级,A水平)。虽然尼莫地平对临床结局具有积极作用,但它不能预防aVSP的发生。关于各种药物、CSF引流、蛛网膜下腔灌洗、终板开窗术或头部摇晃的预防效果的先前研究尚未显示了出对SAH-SBI风险的显著影响。在已经有症状的患者中,治疗选择限于非因救援疗法以改善局部脑血流量。
在本申请中所述的CSF分析中,证实了内源性触珠蛋白在aSAH后的前几天内,在相关的无细胞Hb产生之前从CSF中清除。因此,内源性触珠蛋白的保护功能看起来可以忽略,而外源性触珠蛋白在临床相关CSF-Hb浓度范围内提供了抗血管痉挛和抗氧化作用。出乎意料地的是,血红素清除蛋白血红素结合蛋白超过了触珠蛋白的抗氧化功能,这提示一部分血红素可能已经从氧化或降解的CSF-Hb中释放,形成氧化性游离血红素池,其保持与低亲和力血红素结合蛋白结合。这些数据表明,预期在aSAH的背景下触珠蛋白和血红素结合蛋白的治疗组合提供针对出血性中风后的不良继发性神经学后果的协同防护作用。
本发明人还证实了血红素结合蛋白消除了纹状体注射后血红素介导的神经功能损害。这种效果与放射学改变相关联,注意到接受纹状体注射血红素的小鼠显示了病灶周围水肿,ADC图中的扩散限制和动脉脊柱标记(ASL)图像上的局灶灌注缺陷,而在接受纹状体注射血红素:Hpx复合物的小鼠中,这些不良放射学改变基本上不存在。
参考文献
1.Bates D,
2.Behrouz R.The Rise and Fall of Transcranial Doppler Ultrasonographyfor the Diagnosis of Vasospasmin Aneurysmal Subarachnoid Hemorrhage.JNeurosurg Anesthesiol 2019;31:79-80.
3.Bland M.An Introduction to Medical Statistics.Oxford UniversityPress;2015
4.Connolly ES Jr,Rabinstein AA,Carhuapoma JR,Derdeyn CP,Dion J,Higashida RT,et al.Guidelines for the management of aneurysmal subarachnoidhemorrhage:a guideline for healthcare professionals from the American HeartAssociation/american Stroke Association.Stroke 2012;43:1711-37.
5.Deuel JW,Vallelian F,Schaer CA,Puglia M,Buehler PW,SchaerDJ.Different target specificities of haptoglobin and hemopexin define asequential protectior system against vascular haemoglobin toxicity.Free RadicBiol Med 2015;89:931-43.
6.Dewey M.metap:meta-aralysis of significance values.2020
7.Diringer MN,Bleck TP,Claude Hemphill J 3rd,Menon D,Shutter L,VespaP,et al.Critical care management of patients following aneurysmalsubarachnoid hemorrhage:recommendations from the Neurocritical Care Society’sMultidisciplinary Consensus Conference.Neurocrit Care 2011;15:211-40.
8.ElmerJ,Harris DR,Sun G,Palmer AF.Purification of hemoglobin bytangential flow filtration with diafiltration.Biotechnol Prog 2009;25:1402-10.
9.Hugelshofer M,Buzzi RM,Schaer CA,Richter H,Akeret K,Anagnostakou V,et al.Haptoglobin administration into the subarachnoid space preventshemoglobin-induced cerebral vasospasm.J Clin Invest 2019;129:5219-35.
10.Kassambara A,Mundt F.factoextra:Extract and Visualize the Resultsof Multiva riate Data Analyses[Internet].2020;Available from:https://CRAN.R-project.org/package=factoextra
11.Kikinis R,Pieper SD,Vosburgh KG.3D Slicer:A Platform for Subject-Specific Image Analysis,Visualization,and Clinical Support.IntraoperativeImaging and Image-Guided Therapy 2014:277-89.
12.Lawrence MA.ez:Easy Analysis and Visualization of FactorialExperiments[Internet].2016;Available from:https://CRAN.R-project.org/package=ez
13.Liberzon A,Birger C,Thorvaldsdóttir H,Ghandi M,Mesirov JP,TamayoP.The Molecular Signatures Databese(MSigDB)hallmark gene set collection.CellSyst 2015;1:417-25.
14.Md Riaz Ahmed.ROCit-An R Package for Performance Assessment ofBinary Classifier with Visualization[Internet].2019[cited 2020 Sep 17]Available from:https://openprairie.sdstate.edu/datascience_symposium/2019/posters/6/
15.Robin X,Turck N,Hainard A,Tiberti N,Lisacek F,Sanchez J-C,etal.pROC:an open-source package for R and S to analyze and compare ROC curves[Internet].BMC Bioinformatics 2011;Available from:http://dx.doi.org/10.1186/1471-2105-12-77
16.Sachs MC.plotROC:A Tool for Plotting ROC Curves[Internet].J StatSoftw 2017;Available from:http://dx.doi.org/10.18637/jss.v079.c02
17.Sing T,Sander O,Beerenwinkel N,Lengauer T.ROCR:visualizingclassifier performance in R.Bioinformatics 2005;21:3940-1.
18.Sloan MA,Haley EC Jr,Kassell NF,Henry ML,Stewart SR,Beskin RR,etal.Sensitivity and specificity of transcranial Doppler ultrasonography in thediagnosis of vasospasm following subarachnoid hemorrhage.Neurology 1989;39:1514-8.
19.Subramanian A,Tamayo P,Mootha VK,Mukherjee S,Ebert BL,Gillette MA,et al.Gene set enrichment ahalysis:a knowledge-based approach forinterpreting genome-wide expression profiles.Proc Natl Acad Sci U S A 2005;102:15545-50.
20.Weidert S,Andress S,Linhart C,Suero EM,GreinerA,
21.Wood SN.Generalized Additive Models:An Introduction with R,SecondEdition.CRC Press;2017.
- 用于治疗出血性中风后不良继发性神经学后果的触珠蛋白
- 创伤或损伤后中枢神经系统继发性损伤的预防和治疗
