一种植物内生真菌附球菌J4-3及其应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于植物内生真菌技术领域,尤其涉及一种植物内生真菌附球菌J4-3及其应用。
背景技术
小麦(
植物内生真菌是一种潜在的生物防治资源,可防治各种病原体,促进植物生长和健康。这些真菌与其宿主相互依存,而不会引起任何明显的病害症状。植物内生真菌能够适应植物内部的生活,并产生拮抗次生代谢物,这些代谢物对寄主植物的生长和抗病性至关重要。在植物内生真菌中,青霉属(
发明内容
为解决上述技术问题,本发明提出了一种植物内生真菌附球菌J4-3及其应用,附球菌J4-3表现出广谱的抑菌活性,对禾谷镰孢菌、灰霉菌、炭疽病菌和核盘菌具有优异的抑制作用,对小麦生长具有明显的促进作用,对小麦赤霉病都有显著的生物防治效果。
为实现上述目的,本发明提供了一种植物内生真菌附球菌(
本发明还提供了所述的附球菌J4-3在制备小麦赤霉病防治制剂中的应用。
本发明还提供了一种小麦赤霉病防治制剂,包括所述附球菌J4-3。
本发明还提供了所述的附球菌J4-3在制备禾谷镰孢菌(
本发明还提供了所述的附球菌J4-3在制备灰霉菌(
本发明还提供了所述的附球菌J4-3在制备炭疽病菌(
本发明还提供了所述的附球菌J4-3在制备核盘菌(
本发明还提供了所述的附球菌J4-3在制备小麦生长促进剂中的应用。
优选的,所述附球菌J4-3促进小麦植株生长,增加小麦分蘖数,促进小麦穗伸长。
本发明还提供了一种小麦生长促进剂,包括所述附球菌J4-3的孢子悬浮液和/或培养滤液。
与现有技术相比,本发明具有如下优点和技术效果:
本发明提供的附球菌J4-3对禾谷镰孢菌、灰霉菌、炭疽病菌和核盘菌多种病原菌具有优异的抑制作用,具有良好的应用前景。在温室和田间条件下,附球菌J4-3对小麦生长具有明显的促进作用。在田间条件下,将菌株J4-3的孢子悬浮液和培养滤液施用于小麦穗上,或者用J4-3的分生孢子悬浮液处理刚发芽的小麦种子,对小麦赤霉病有显著的生物防治效果。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
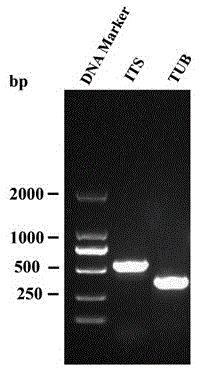
图1为菌株J4-3转录间隔子(ITS)和β-微管蛋白(TUB)基因的PCR扩增电泳图;
图2为菌株J4-3的菌落和分生孢子形态生长图,其中,A为J4-3在PDA培养基培养五天后的正面(Topview)菌落形态,B为J4-3在PDA培养基培养五天后的反面(Bottomview)菌落形态,C为J4-3的分生孢子的形态,标尺为50μm,D为接种后7天pH值对菌株J4-3生长的影响,E为接种后14天pH值对菌株J4-3生长的影响,F为接种后21天pH值对菌株J4-3生长的影响;
图3为菌株J4-3的系统发育树,其中,A为菌株J4-3及其近缘种的基于ITS序列的最大似然法计算出的系统发育树,B为菌株J4-3及其近缘种的基于TUB序列的最大似然法计算出的系统发育树,C为菌株J4-3及其近缘种的基于ITS和TUB序列的最大似然法计算出的系统发育树;
图4为菌株J4-3对病原真菌的广谱抑菌性,其中,A为菌株J4-3在PDA培养基上对植物病原真菌的抗菌活性(F.g为禾谷镰孢菌,B.c为灰霉菌,C.g为炭疽病菌,S.s为核盘菌),B为对峙培养法测定菌落径向生长,C为对峙培养法测定抑制区,D为对峙培养法测定真菌菌落生长抑制率(p≤0.05的显著差异用*表示,显著差异使用不同的小写字母表示);
图5为菌株J4-3在温室和田间条件下对小麦生长的促进作用,其中,A为菌株J4-3的菌丝片段处理小麦植株后在温室生长45天后的图片,B为小麦株高分析,C为小麦根长分析,D为小麦地上部鲜重分析,E为小麦根的鲜重分析;F为播种前用菌株J4-3孢子悬液处理刚萌动的小麦种子,在田间条件下生长至收获时的小麦株高,G为小麦分蘖数,H为小麦穗长度,I为每穗小穗数,J为千粒重(显示值代表平均值±标准误,误差线表示标准误差,*表示差异显著,ns表示差异不显著);
图6为菌株J4-3对小麦赤霉病抗性的测定,其中,A为混合接种PH-1与J4-3的小麦穗部照片,Control为对照组,Conidia为J4-3孢子悬浮液组,Filtrate为J4-3培养滤液;B为在菌株J4-施用1天后接种禾谷镰孢菌PH-1的分生孢子悬浮液的小麦穗部照片,Control为对照组,Conidia为J4-3孢子悬浮液组,Filtrate为J4-3培养滤液;C为在菌株J4-3施用2天后接种禾谷镰孢菌PH-1的分生孢子悬浮液的小麦穗部照片,Control为对照组,Conidia为J4-3孢子悬浮液组,Filtrate为J4-3培养滤液;D为在菌株J4-3施用3天后接种禾谷镰孢菌PH-1的分生孢子悬浮液的小麦穗部照片,Control为对照组,Conidia为J4-3孢子悬浮液组,Filtrate为J4-3培养滤液;E和F为播种前分别用无菌水和菌株J4-3孢子悬液处理刚萌动的小麦种子,小麦扬花期接种禾谷镰孢菌PH-1的小麦穗部照片;G为菌株J4-3孢子悬浮液喷施后接种禾谷镰孢菌PH-1的分生孢子悬浮液的发病小穗数,H为播种前阴性对照和菌株J4-3孢子悬浮液施用后的发病小穗数(*表示在p≤0.05水平差异显著,ns表示差异不显著);
图7为菌株J4-3次生代谢物的LC-MS分析的正离子模式基峰色谱图;
图8为菌株J4-3次生代谢物的LC-MS分析的负离子模式基峰色谱图。
具体实施方式
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
在本发明中,若非特指,所采用的原料和设备等均可从市场购得或是本领域常用的。下述实施例中的方法,如无特别说明,均为本领域的常规方法。
马铃薯葡萄糖琼脂培养基(PDA培养基):土豆200g切成小块放入锅中,加水1000mL,在加热器上加热至沸腾,维持30min,用2层纱布趁热在量杯上过滤,滤渣弃去。滤液加入葡萄糖20g,琼脂20g,补充水分到1000mL。而后放入高温高压灭菌锅中灭菌,灭菌程序为121℃,15min。
PDB培养液:土豆200g切成小块放入锅中,加水1000mL,在加热器上加热至沸腾,维持30min,用2层纱布趁热在量杯上过滤,滤渣弃去。滤液加入葡萄糖20g,补充水分到1000mL。而后放入高温高压灭菌锅中灭菌,灭菌程序为121℃,15min。
保藏证明:附球菌J4-3,拉丁文为
实施例1
菌株的分离方法如下:
在中国黑龙江省采集健康无症状小麦作为小麦样品,将小麦样品在体积分数70%的乙醇水溶液中浸泡1min进行表面消毒,然后转移到质量分数为2%的次氯酸钠中浸泡2min,最后在体积分数70%的乙醇水溶液中浸泡30s。该处理之后,用无菌蒸馏水清洗3次,放于无菌滤纸上干燥。将小麦样品剪成5mm小段,放于马铃薯葡萄糖琼脂培养基(PDA培养基)的表面,PDA培养基中添加50μg/mL氨苄青霉素,用以抑制细菌在PDA培养基中的生长。取表面消毒最后一步所用的用于清洗的无菌蒸馏水100μL同样加于PDA培养基表面,评估表面灭菌的效率。将所有PDA培养基置于25℃黑暗的培养箱中培养,待菌丝长出后,取菌落尖端的菌丝,转移到不含氨苄青霉素抗生素的新的PDA平板上进行初步纯化培养。对菌落进行3次继代纯化,获得菌株命名为J4-3。将菌株保存在4℃的PDA斜面上,并同时放置于体积分数为25%甘油中进行-80℃低温保存,以供进一步使用。
实施例2
菌株J4-3的形态鉴定和分子生物学鉴定,具体如下:
①J4-3形态鉴定
将保存的J4-3菌株在PDA培养基中活化培养,培养条件为25℃黑暗培养5d。之后在活化培养菌落边缘用打孔器取5mm直径菌饼,置于新鲜配置的PDA培养基,同样的培养条件培养5d。观察拍照菌落的正面和反面,如图2中A和B所示,为J4-3在PDA培养基培养五天后的正面(Topview)和反面(Bottomview)菌落形态。
②J4-3在不同pH值的培养基上的生长情况
将菌株J4-3分别培养在pH为5,6,7,8,9,10的PDA培养基上,在培养7d,14d,21d后分别统计菌株的生长率,发现pH值不影响菌株J4-3的生长(如图2中D,E和F所示)。
③DNA提取及PCR扩增
菌株J4-3在PDA培养基培养7天后,用DNeasy Plant Mini kit(购自青岛生科生物科技有限公司)提取基因组DNA。用NanoDrop光谱仪测定所提取DNA浓度。PCR特异扩增内转录间隔子(ITS)和β-微管蛋白(TUB)基因。特异性PCR反应体系总体积为25μL,包含1μL DNA模板,每个引物1μL,2×Taq Mix(全式金,北京,中国)12.5μL和9.5μL ddH
表1 PCR扩增引物序列
表2 PCR反应体系
表3 PCR反应程序
④内生真菌J4-3菌株的系统发育评价
根据测序结果和NCBI比对结果,选择附球菌相关的菌株(如表4所示)构建系统发育树,将ITS、TUB的序列单独或串联,采用基于Tamura 3-参数模型的最大似然方法进行多位点连接比对,1000次重复的bootstrap分析来估计进化距离,系统发育关系表明,如图3中A,B和C所示,A是菌株J4-3及其近缘种的基于ITS序列的最大似然法计算出的系统发育树,B是菌株J4-3及其近缘种的基于TUB序列的最大似然法计算出的系统发育树,C是菌株J4-3及其近缘种的基于ITS和TUB序列的最大似然法计算出的系统发育树,菌株J4-3与附球菌(
表4 用于系统发育树分析的附球菌的GenBank登录号
注:加粗字体为小麦中分离出的菌株J4-3,节点处给出大于60%的最大似然值(1000个重复)。
实施例3
通过平板对峙测定菌株J4-3对禾谷镰孢菌(
对峙培养法测定菌落径向生长、抑制区和真菌菌落生长抑制率,从活化培养5d的病原真菌菌落边缘取直径5mm的菌饼接种在PDA平板的中心。将进行同样活化处理的J4-3菌落边缘取直径5mm的菌饼接种于靠近平板边缘的两侧,接种J4-3菌饼与植物病原真菌菌饼处于一条直线上。所有培养皿放置于25℃培养箱中黑暗培养7d。实验进行3次,每个处理进行3个重复。通过观察统计病原真菌生长的情况,判断内生菌对其的抑制作用。误差线表示均值的标准误差。根据student t检验,p≤0.05的显著差异用*表示,或者根据单因素方差分析和Tukey事后检验分析,显著差异使用不同的小写字母表示。
如图4所示,在马铃薯葡萄糖琼脂培养基(PDA培养基)上,内生真菌J4-3菌株对包括禾谷镰孢菌在内的4种病原真菌都有强烈的抑制作用(图4中A),菌落径向生长和抑制区记录在图4中B和C。内生真菌J4-3对禾谷镰孢菌的抑制率为53.8%;对灰霉菌(
其中,禾谷镰孢菌菌株PH-1:该菌株已在文献(Wang S ,Kondo H ,Liu L ,Guo L,QiuD .A novel virus in the family Hypoviridae from the plant pathogenicfungus Fusarium graminearum .Virus Res .2013 Jun;174 (1-2) :69-77 .doi:10.1016/ j .virusres .2013 .03 .002 .Epub 2013 Mar 14 .PMID:23499998 .)中公开,公众可从申请人获得上述生物材料,所得上述生物材料只为重复本发明的实验所用,不可作为其它用途使用。
实施例4
菌株J4-3分生孢子液的制备,具体如下:
菌株J4-3在PDA培养基25℃生长14d后,滴入含0.01%吐温20的灭菌水,在菌落表面用刮匙轻轻的刮拭。然后将含孢子的混合液体用灭菌滤布过滤,以去除培养基和菌块等杂质。分离得到的液体移入离心管中,以10000×g的离心力离心5min,得到孢子沉淀。用灭菌水将孢子沉淀重悬,得到浓缩孢子液。之后用血球计数板计量孢子浓度,将孢子浓度调制使用浓度(10
实施例5
小麦品种济麦22种子用自来水冲洗,表面用质量分数5%的NaCl溶液消毒5min,然后用无菌蒸馏水冲洗3次。将表面灭菌的种子培养于含有ddH
而后以菌株J4-3菌丝片段悬浮液处理济麦22刚发芽的幼苗,伤根方法如下:
将培养3d后的济麦22发芽幼苗从含滤纸的培养皿中取出,剪去根尖2mm,将济麦22发芽幼苗的根浸泡在菌株J4-3菌丝片段悬浮液中6h(以在PDB培养液中浸泡的幼苗作为对照)。接种后的幼苗移栽到消毒土壤中,在65%的相对湿度下,采用温室中以16h/8h的光周期培养。生长45d后,测定小麦生长参数,并进行统计分析。
结果:与对照植株相比,J4-3处理的小麦植株生长更为旺盛(如图5中A所示)。菌株J4-3处理的平均株高为51.53±2.17cm,显著高于未处理植株40.51±1.77cm(p≤0.05)(如图5中B所示)。菌株J4-3处理植株的平均根长为33.66±1.18cm,与未处理对照植株12.98±1.01cm相比显著增加(p≤0.05)(如图5中C所示)。菌株J4-3处理幼苗的地上部鲜重平均为2.79±0.15g,与未处理对照植株1.25±0.1g相比显著增加(p≤0.05)(如图5中D所示)。J4-3菌株处理幼苗的根鲜根平均为0.24±0.02g,显著大于未处理对照植株0.07±0.007g,(P≤0.05)(如图5中E所示)。实验重复了三次,结果一致,处理组与对照组相比均具有显著性差异。t检验,n=20。
进一步探究J4-3菌剂对小麦的促生长作用,播种前用菌株J4-3分生孢子悬液处理刚萌动的小麦种子,小麦收获时菌株J4-3处理植株的平均株高为60.68±0.86cm,显著高于未处理对照57.63±1.35cm,(p≤0.05)(如图5中F所示),菌株J4-3处理小麦植株的平均分蘖数为10.68±1.26,显著高于未处理对照植株7.26±0.72,(p≤0.05)(如图5中G所示),菌株J4-3处理植株穗长平均值为7.46±0.08cm,显著高于未处理对照植株6.91±0.1 cm,(p≤0.05)(如图5中H所示)。菌株J4-3处理植株每穗平均小穗为15.33±0.21cm,与未处理对照植株15±0.19cm差异不显著(如图5中I所示)。处理组植株千粒重47.14±0.29 g与对照组46.82±0.15g差异不显著(如图5中J所示)。t检验,n=20。
实施例6
菌株J4-3菌剂(即实施例4中制备得到的孢子液)防治小麦赤霉病的功能测定,具体如下:
点接种:将PH-1分生孢子悬浮液(1×10
喷雾点接种:使用手持式雾化器将约5mL J4-3孢子悬浮液(1×10
根据表5记载和如图6所示,菌株J4-3孢子悬浮液或其培养滤液与菌株PH-1分生孢子悬浮液混合接种,可显著降低发病小穗数(p≤0.05),保护水平分别为62.5%和49.375%。提前1天喷施菌株J4-3的孢子悬浮液或其培养滤液,对小麦赤霉病的防治效果显著,分别为49.3%和49.1%(p≤0.05)。此外,提前2天喷施菌株J4-3的孢子悬浮液或培养滤液的防效分别为65.2%和48.57%,提前3天喷施菌株J4-3的孢子悬浮液或培养滤液的防效分别为63.39%和54.7%(p≤0.05)。
研究在播种前对刚萌发的小麦种子进行J4-3孢子悬浮液处理是否能抵抗小麦赤霉病:在中国北京上庄试验田(北纬40°06′25″和东经116°22′26″)用菌株J4-3分生孢子(1×10
田间试验结果显示,与对照相比,J4-3处理的发病小穗数有显著差异(p≤0.05)(如图6中E和F所示),根据表6记载可知,抑制水平为61.6%(如图6中H所示)。
表5 喷施菌株J4-3对小麦发病小穗数的影响统计
注:不同字母表示在p≤0.05水平差异显著,同样字母表示差异不显著。
表6 播种前施用菌株J4-3处理萌发的小麦种子,扬花期接种禾谷镰孢菌PH-1的发病小穗数
注:不同字母表示在p≤0.05水平差异显著。
实施例7
为了鉴定菌株J4-3产生的次生代谢产物,采用LC-MS对其培养滤液进行分析
J4-3培养滤液在正离子和负离子模式下的基峰色谱图如图7和图8所示,J4-3产生的次生代谢产物属于脂类、有机酸类、苯丙类和聚酮类、苯类、有机氧和氮化合物、有机杂环化合物(见表7)。
表7 菌株J4-3培养滤液经LC-MS分析获得的主要次生代谢物
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
- 一株植物内生真菌黑附球菌FZT214及其应用
- 一株植物内生真菌黑附球菌FZT214及其应用
