一种海藻多酚及其制备方法和应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明涉及食品加工技术领域,尤其涉及一种海藻多酚及其制备方法和应用。
背景技术
目前,针对食物过敏的消减措施主要有两种,一种是通过一定的食品加工技术手段降低食物过敏原的致敏性,另一种是利用天然抗过敏活性物质通过免疫调节控制食物过敏反应。然而,鉴于目前食品加工技术还无法完全消除水产品过敏原的致敏性,通过天然抗过敏活性成分抑制食物过敏反应就成为预防和控制食物过敏的有效途径,受到国内外越来越多的关注。
海藻是一种常见食材,海藻品种多样,资源丰富。海藻多酚是从海藻中提取出来的高亲水性多酚类化合物的总称,分子质量范围较广,大约在126~650ku,是海藻中的一种重要的活性物质,主要由间苯三酚聚合而成。研究表明,海藻富含多酚具有抗肿瘤、抗氧化、抗衰老及免疫调节等功能。近年来,越来越多的学者发现海藻中富含具有抗过敏活性的多酚物质,目前韩国已将部分海藻多酚作为抗过敏药物应用于临床。
然而,目前国内外针对抗过敏多酚制备相关的研究主要聚焦于陆生植物中的多酚物质,对于海藻中具有抗过敏功能多酚物质的相关专利还未见报道。
发明内容
本发明的目的在于提供一种海藻多酚及其制备方法和应用,综合采用乙醇浸提、大孔树脂动态洗脱、半制备高效液相色谱分离纯化,获得纯度高、抗过敏活性强的海藻多酚,这对提升海藻精深加工产业具有重要的指导意义。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种海藻多酚的制备方法,包括如下步骤:
(1)将海藻粉用乙醇提取后离心,得到残渣和上清液;
(2)将上清液过滤,得到海藻多酚粗提液;
(3)将海藻多酚粗提液用大孔树脂吸附,洗脱并收集得到海藻多酚。
作为优选,还包括海藻多酚提纯过程:利用分析型高效液相色谱查看洗脱后得到的海藻多酚的出峰情况与趋势,利用半制备型高效液相色谱分离出主要多酚色谱峰,得到纯化的海藻多酚。
作为优选,步骤(1)中所述海藻粉和乙醇的用量比为1g:8~12mL,所述乙醇的浓度为70~80%v/v。
作为优选,步骤(1)中所述海藻粉的粒径为60~100目,所述海藻粉的种类为羊栖菜(Sargassumfusiforme)粉,步骤(1)中所述提取的方法为:将海藻粉和乙醇混合,在23~27℃、800~1200r/min条件下搅拌20~28h,步骤(1)中所述离心的转速为7500~8500r/min,所述离心的时间为8~12min。
作为优选,步骤(2)中所述过滤时采用孔径为30~50μm的滤纸。
作为优选,步骤(3)中所述大孔树脂为AB-8大孔树脂,所述大孔树脂使用前用2~3倍体积的浓度为93~97%v/v的乙醇浸泡20~28h,用去离子水漂洗,至排出的水无白色浑浊,依次用浓度为4~6%w/v的氢氧化钠溶液和4~6%w/v盐酸溶液浸泡,最后用离子水洗涤至中性。
作为优选,步骤(3)中所述吸附前将海藻多酚粗提液中的多酚含量调整至0.8~1.2mg/mL,所述吸附时进样的流速为1.8~2.2mL/min,所述洗脱时采用浓度为70~80%v/v的乙醇,所述洗脱时乙醇的流速为1.3~1.7mL/min,所述收集的方法为:洗脱体积为0mL~90mL时,每8~12mL收集一管,90mL~250mL时,每4~6mL收集一管,250mL~350mL时,每8~12mL收集一管。
作为优选,所述分析型高效液相色谱的条件为:
AgilentXDB C
流动相为的A相为乙腈+0.008~0.012%甲酸,B相为超纯水+0.008~0.012%甲酸;
梯度洗脱程序为0~30min,A相和B相的体积比为5:95~25:75;30min~60min,A相和B相的体积比为25:75~45:55;流速为0.8~1.2mL/min,在270~290nm处检测紫外吸光度;
所述半制备型高效液相色谱的条件为:Agilent 10Prep C
本发明还提供了所述制备方法制备得到的海藻多酚。
本发明还提供了所述的海藻多酚在制备抗过敏产品中的应用。
本发明提供了一种海藻多酚及其制备方法和应用,所述制备方法包括如下步骤:(1)将海藻粉用乙醇提取后离心,得到残渣和上清液;(2)将上清液过滤,得到海藻多酚粗提液;(3)将海藻多酚粗提液用大孔树脂吸附,洗脱并收集得到海藻多酚。本发明通过使用乙醇浸提、大孔树脂动态洗脱实验、半制备高效液相色谱以获取高纯度抗过敏海藻多酚,相较于传统的多酚提取方法具有纯度更高、抗过敏活性更强的优势,减少了海藻本身含有的多糖、脂质的相互作用对终产物抗过敏多酚的影响,提升了所得纯化多酚终产物的抗过敏活性。本发明从海藻中获取天然抗过敏海藻多酚,实现了海藻的高值化精深加工利用。相较于现有的抗过敏活性物质的提取方式,本方法产量更高,制得的抗过敏多酚活性更强,安全性更高,是可在抗过敏领域发挥作用的潜在来源。
附图说明
图1为海藻粗多酚大孔树脂动态洗脱曲线;
图2为半制备高效液相色谱收集海藻多酚色谱峰示意图;
图3为抗过敏海藻多酚的液质联用二级质谱图;
图4为抗过敏海藻多酚对RBL-2H3肥大细胞活力的影响;
图5为抗过敏海藻多酚对RBL-2H3肥大细胞分泌组胺的影响;
图6为抗过敏海藻多酚对RBL-2H3肥大细胞脱颗粒反应的影响;
图7为抗过敏海藻多酚对RBL-2H3肥大细胞脱分析IL-13的影响;
图8为抗过敏海藻多酚对RBL-2H3肥大细胞脱分析IL-4的影响;
图9为抗过敏海藻多酚作用下过敏BALB/c小鼠体重变化情况;
图10为抗过敏海藻多酚作用下BALB/c小鼠过敏反应症状评分;
图11为抗过敏海藻多酚作用下BALB/c小鼠血清IgE特异性抗体变化;
图12为抗过敏海藻多酚作用下BALB/c小鼠血清IgG1特异性抗体变化。
具体实施方式
本发明提供了一种海藻多酚的制备方法,包括如下步骤:
(1)将海藻粉用乙醇提取后离心,得到残渣和上清液;
(2)将上清液过滤,得到海藻多酚粗提液;
(3)将海藻多酚粗提液用大孔树脂吸附,洗脱并收集得到海藻多酚。
在本发明中,还包括海藻多酚提纯过程:利用分析型高效液相色谱查看洗脱后得到的海藻多酚的出峰情况与趋势,利用半制备型高效液相色谱分离出主要多酚色谱峰,得到纯化的海藻多酚。
在本发明中,步骤(1)中所述海藻粉和乙醇的用量比优选为1g:8~12mL,进一步优选为1g:10mL,所述乙醇的浓度为优选70~80%v/v,进一步优选为75%v/v。
在本发明中,步骤(1)中所述海藻粉的粒径优选为60~100目,进一步优选为80目,所述海藻粉的种类优选为羊栖菜(Sargassumfusiforme)粉,步骤(1)中所述提取的方法优选为:将海藻粉和乙醇混合,在23~27℃、800~1200r/min条件下搅拌20~28h,进一步优选为海藻粉和乙醇混合,在25℃、1000r/min条件下搅拌24h,步骤(1)中所述离心的转速优选为7500~8500r/min,进一步优选为8000r/min,所述离心的时间优选为8~12min,进一步优选为10min。
在本发明中,步骤(2)中所述过滤时优选采用孔径为30~50微米的滤纸,进一步优选为采用孔径为40微米的滤纸。
在本发明中,步骤(3)中所述大孔树脂优选为AB-8大孔树脂,所述大孔树脂使用前优选用2~3倍体积的浓度为93~97%v/v的乙醇浸泡20~28h,用去离子水漂洗,至排出的水无白色浑浊,依次用浓度为4~6%w/v的氢氧化钠溶液和4~6%w/v盐酸溶液浸泡,最后用离子水洗涤至中性,进一步优选为用2.5倍体积的浓度为95%v/v的乙醇浸泡24h,用去离子水漂洗,至排出的水无白色浑浊,依次用浓度为5%w/v的氢氧化钠溶液和5%w/v盐酸溶液浸泡,最后用离子水洗涤至中性。
在本发明中,步骤(3)中所述吸附前优选将海藻多酚粗提液中的多酚含量调整至0.8~1.2mg/mL,进一步优选为1mg/mL,所述吸附时进样的流速优选为1.8~2.2mL/min,进一步优选为2mL/min,所述洗脱时采用浓度优选为70~80%v/v的乙醇,进一步优选为75%v/v的乙醇,所述洗脱时乙醇的流速优选为1.3~1.7mL/min,进一步优选为1.5mL/min,所述收集的方法优选为:洗脱体积为0mL~90mL时,每8~12mL收集一管,90mL~250mL时,每4~6mL收集一管,250mL~350mL时,每8~12mL收集一管,进一步优选为洗脱体积为0mL~90mL时,每10mL收集一管,90mL~250mL时,每5mL收集一管,250mL~350mL时,每10mL收集一管。
在本发明中,所述分析型高效液相色谱的条件为:
Agilent XDB C
流动相为的A相优选为乙腈+0.008~0.012%甲酸,进一步优选为乙腈+0.01%甲酸,B相优选为超纯水+0.008~0.012%甲酸,进一步优选为超纯水+0.01%甲酸;
梯度洗脱程序优选为0~30min,A相和B相的体积比为5:95~25:75;30min~60min,A相和B相的体积比为25:75~45:55,进一步优选为0~30min,A相和B相的体积比为15:85;30min~60min,A相和B相的体积比为35:65;流速优选为0.8~1.2mL/min,进一步优选为1mL/min,优选在270~290nm处检测紫外吸光度,进一步优选为在280nm处检测紫外吸光度;
所述半制备型高效液相色谱的条件优选为:Agilent 10Prep C
本发明还提供了所述制备方法制备得到的海藻多酚。
本发明还提供了所述的海藻多酚在制备抗过敏产品中的应用。
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1海藻多酚粗提物的制备
将新鲜采收的海藻风干后置于粉碎机中粉碎,过60目筛后取细粉。称取10g海藻干品粉末,加入100mL 75%乙醇(v/v),在25℃、1000r/min条件下磁力搅拌24h,8000r/min离心10min后收集上清。将残留物转移至锥形瓶,用75%乙醇(v/v)重新浸泡,重复提取并离心过程两次,收集上清,合并上清后使用孔径为40微米的滤纸过滤,收集滤液,即制得海藻多酚粗提液,得到的海藻多酚粗提物于-20℃下保存备用。
实施例2总酚含量测定
采用以没食子酸为标准的福林酚法测定不同海藻中的总酚含量,绘制标准曲线,多酚含量=CV/M(C为提取液中多酚浓度,g/L;V为提取液体积,L;M为海藻称样量,g)。采用Morgan-Elson法测定粗提物透明质酸酶体外抑制活性,设置A(对照溶液吸光值)、B(对照空白溶液吸光值)、C(样品的吸光值)、D(样品空白的吸光值)四个组别。透明质酸酶体外抑制率计算如下:
抑制率(%)=[(A-B)-(C-D)]/(A-B)×100
将海藻多酚粗提物原液进行梯度稀释,以浓度(mg/mL)为X轴,抑制率(%)为Y轴绘制拟合曲线,根据拟合曲线方程,计算出IC
表1
其中羊栖菜多酚的IC
实施例3大孔树脂进一步分离纯化
称取600mLAB-8大孔树脂(弱极性),使用浓度为95%乙醇(v/v)浸泡24h,乙醇用量为被处理树脂体积的两倍,充分溶胀后用去离子水漂洗,至排出的水无白色浑浊为止,再分别使用5%氢氧化钠(w/v)和5%的盐酸(w/v)各浸泡12h,分别用去离子水洗涤树脂至pH值为中性,将树脂保存在去离子水中。采用湿法装柱,将树脂装于玻璃层析柱中(250mm×60mm),保证树脂上方有充足去离子水以防止干柱。
选用多酚浓度为1mg/mL的羊栖菜多酚粗提液,以2mL/min的流速进样,吸附时间大于0.5h,直至达到吸附饱和。再利用75%乙醇(v/v)洗脱,洗脱流速为1.5mL/min。洗脱体积为0mL~90mL时,每10mL收集一管,90mL~250mL时,每5mL收集一管,250mL~350mL时,每10mL收集一管。以洗脱体积为横坐标,多酚含量为纵坐标绘制动态洗脱曲线(图1)。当洗脱体积为150mL~270mL(26管~40管)时,洗脱液中总酚含量较高,峰型单一且无拖尾现象,合并多酚含量较高的试管得到粗提物进一步提纯液,并进行旋转蒸发浓缩至无溶剂析出,用于高效液相色谱分析。
当总酚浓度为0.42mg/mL时,透明质酸酶体外抑制活性为74.28%,进一步提纯液的抑制活性较粗提物提高了1.49倍。
实施例4半制备高效液相色谱纯化海藻多酚
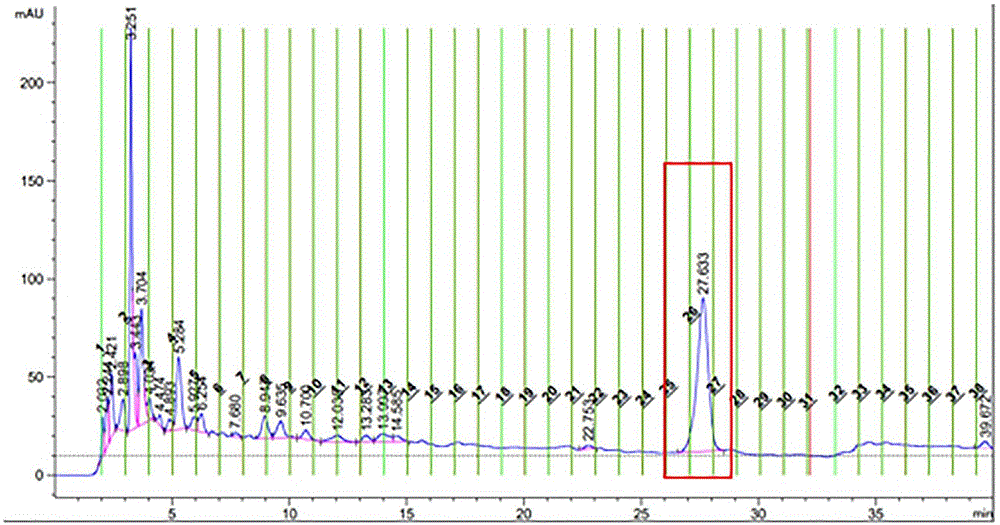
取实施例3制得的羊栖菜多酚提纯液进一步纯化,利用分析型高效液相色谱(Agilent XDB C
特征吸收峰峰面积占比为96.13%,表明制备得到的海藻多酚纯度较高,该纯化过程合理有效。图3为该多酚纯化物母离子二级质谱图,m/z=321.17处碎片对应槲皮素一水合物,m/z=303.16处碎片相当于一个水分子的损失(-18.01),即为槲皮素,槲皮素作为极易与水结合的多酚,其水合物目前已商品化,这更加证实了申请人的推测。
通过RBL-2H3肥大细胞模型和BALB/c小鼠模型实验进一步分析海藻多酚物质的抗过敏活性。结果如图4所示,当多酚浓度≤25μg/mL时,细胞活力均在90%以上,基本未受影响。当多酚含量大于等于30μg/mL时,细胞活力受到严重抑制,故选择≤25μg/mL的多酚含量进行后续测定。图5~8结果显示肥大细胞上清液中组胺、β-氨基己糖苷酶、IL-13、IL-4释放量均有所降低且存在明显的剂量依赖性,且各多酚剂量间均存在显著性差异。
图9~10结果显示空白组小鼠均未出现任何过敏反应症状。致敏组与治疗组小鼠均出现明显的过敏反应症状。其中,原肌球蛋白(Tropomyosin,TM)过敏原致敏组小鼠激发后表现出最强的过敏症状,且一只小鼠死亡,灌胃多酚治疗组小鼠虽出现过敏症状但症状有所减轻,高剂量多酚治疗组过敏反应症状明显减轻,且体重变化趋势与过敏反应症状评分基本吻合。小鼠血清中的IgE抗体和IgG1抗体是评价过敏原致敏性的重要指标。结果如图11~12所示,小鼠血清IgE抗体水平在TM激发后明显增加。与TM致敏组小鼠血清IgE抗体水平(278.94ng/mL)相比,灌胃海藻多酚组小鼠的血清IgE抗体水平(低多酚剂量组:244.91ng/mL、中多酚剂量组:228.52ng/mL、高多酚剂量组:218.12ng/mL)均有不同程度的下降。与空白对照组小鼠相比,TM致敏组(650.69ng/mL)小鼠和灌胃海藻多酚组小鼠(低多酚剂量组:568.38ng/mL,中多酚剂量组:498.41ng/mL,高多酚剂量组:384.40ng/mL)血清中的IgG1抗体水平都明显增加,但灌胃高剂量海藻多酚组的IgG1抗体含量仅为TM致敏组小鼠血清IgG1抗体含量的59%,表明本申请提取纯化所得的海藻多酚具有显著的抗过敏活性。
由以上实施例可知,本发明提供了一种海藻多酚及其制备方法和应用,所述制备方法包括如下步骤:(1)将海藻粉用乙醇提取后离心,得到残渣和上清液;(2)将上清液过滤,得到海藻多酚粗提液;(3)将海藻多酚粗提液用大孔树脂吸附,洗脱并收集得到海藻多酚。本发明通过使用乙醇浸提、大孔树脂动态洗脱实验、半制备高效液相色谱以获取高纯度抗过敏海藻多酚,相较于传统的多酚提取方法具有纯度更高、抗过敏活性更强的优势,减少了海藻本身含有的多糖、脂质的相互作用对终产物抗过敏多酚的影响,提升了所得纯化多酚终产物的抗过敏活性。本发明从海藻中获取天然抗过敏海藻多酚,实现了海藻的高值化精深加工利用。相较于现有的抗过敏活性物质的提取方式,本方法产量更高,制得的抗过敏多酚活性更强,安全性更高,是可在抗过敏领域发挥作用的潜在来源。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 一种疏水改性聚谷氨酸的制备方法及其促进海藻糖载入细胞的应用
- 一种海藻酸钠凝胶缓释型猪背膘替代物的制备方法及其在发酵香肠中的应用
- 一种海藻多酚-卡拉胶寡糖复合物的制作方法
- 一种制备雷酚新内酯和异雷酚新内酯的方法
- 一种提高禽蛋多酚含量的饲料添加剂及其制备方法和应用
- 一种含蜂蜜酵素与海藻多酚的美白制剂及制备方法和应用
- 海藻酸钠复合苹果多酚的光热抗菌敷料及制备方法与应用
