抗氟西汀抗体或其抗原结合片段及其应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明涉及抗体技术领域,尤其是涉及一种抗氟西汀抗体或其抗原结合片段及其应用。
背景技术
氟西汀(Fluoxetine)是一种选择性血清素(5羟色胺,5-HT)再吸收抑制剂(SSRI)型的抗忧郁药,其药物形态为盐酸氟西汀(Fluoxetine hydrochloride),商品名为“百忧解”或“百优解”(Prozac)。盐酸氟西汀(Fluoxetine Hydrochloride,FLX)是一种具有选择性的神经递质抑制剂(SSRI),即(±)N-甲基-3-苯基-3(4-三氟甲基苯氧基)丙胺盐酸盐(C17H 18F 3NO·HCl),分子式是C17H19ClF3NO,分子量为345.787,外观为白色至灰白色结晶性固体,熔点158.4~158.9℃。易溶于甲醇或乙醇,溶于乙腈、丙酮或氯仿,微溶于乙酸乙酯、二氯甲烷或水(pH l.2,4.5,7.0),几乎不溶于环己烷、己烷或甲苯,其化学结构式如式(Ⅰ)所示。
盐酸氟西汀选择性抑制5-羟色胺的吸收,多用于治疗抑郁症,也常用于治疗强迫症、焦虑症等精神疾病和代谢紊乱。FLX多用于治疗中度抑郁症患者,且毒副作用小,常见副作用有恶心、呕吐,副作用发作频率随着用药剂量的增加而上升,医生根据患者病情调整药量可减轻副作用。盐酸氟西汀口服,在胃肠道内吸收良好,生物利用度不受胃肠道内消化物影响,与食物同时服用时血药峰浓度不变,达峰时间延迟3~5小时。血浆蛋白结合率高(可达95%),全身广泛性分布。FLX的消除半衰期为1~4天,代谢产物去氟西汀为7~15天,80%的FLX随尿液排出,15%随粪便排泄。FLX药动学特征呈非线性,肝功能低下等代谢能力弱(肾功能障碍病患除外,不同程度肾损伤患者FLX代谢均无明显差异)的患者应在医生建议下慎重使用FLX。与其他抗抑郁药物不同,盐酸氟西汀代谢并不受年龄和性别的限制,且与三环类抗抑郁药物相比,FLX的耐受性较好同时副作用小,所以特别适合老年抑郁症患者使用。
氟西汀及其代谢产物去甲氟西汀分别是肝微粒体酶CYP2D6、CYP2C9、CYP2C19和CYP3A4的抑制剂,且同一剂量的氟西汀在不同的个体中的血药浓度相差几倍至几十倍。鉴于氟西汀的血浆浓度和临床反应的非相关性以及个体之间血药浓度的较大差异,临床上使用氟西汀时,对其进行血药浓度监测是非常必要的。
目前,对氟西汀的检测主要依靠用电子捕获检测或质谱检测的气相色谱法,紫外或荧光检测的高效液相色谱法。这些方法通常灵敏度较低,使用血浆样品0.5~2ml,最低定量限为≥15nmol/L。且均存在仪器昂贵,检测费时,并且需要专业技术人员进行操作,不能达到现代检测对快速、准确的要求。因此建立快速、灵敏、准确的检测技术是很有必要的。
为了解决现场大规模应用的问题,免疫学法由于其检测速度快,成本低,通量高,部分免疫学检测方法(胶体金纸层析法)还具有操作简单,不需要额外设备等优点,倍受重视。因此,开发出优良的氟西汀诊断用的抗体成为了决定免疫学法应用前景的关键。
有鉴于此,特提出本发明。
发明内容
本发明的目的在于提供一种抗氟西汀抗体或其抗原结合片段,通过以氟西汀-BSA为抗原筛选获得一株单克隆抗体,通过克隆、鉴定与基因结构的分析,确定了其CDR区序列,本发明的另一目的是提供关于该抗体或其抗原结合片段的生物材料和它们的应用。
为解决上述技术问题,本发明特采用如下技术方案:
根据本发明的一个方面,提供了一种抗氟西汀抗体或其抗原结合片段,该抗体或其抗原结合片段包括重链可变区和轻链可变区;重链可变区包含SEQ ID NO.1所示氨基酸序列N末端第31~35位氨基酸残基的VHCDR1、第50~66位氨基酸残基的VHCDR2和第99~107位氨基酸残基的VHCDR3;
轻链可变区包含SEQ ID NO.2所示氨基酸序列N末端第24~38位氨基酸残基的VLCDR1、第54~60位氨基酸残基的VLCDR2和第93~101位氨基酸残基的VLCDR3。
根据本发明的一个方面,还提供了一种生物材料,该生物材料选自(ⅰ)~(ⅲ)中任一项:
(ⅰ)多核苷酸,包括编码权利要求1~4任一项所述的抗氟西汀抗体或其抗原结合片段的核苷酸序列;
(ⅱ)载体,所述载体携带前述(ⅰ)多核苷酸。
(ⅲ)细胞,所述细胞携带(ⅰ)中多核苷酸,或含有(ⅱ)中载体,或表达前述抗氟西汀抗体或其抗原结合片段。
根据本发明的一个方面,还提供了上述抗氟西汀抗体或其抗原结合片段,或上述生物材料在非诊断和治疗目的的检测氟西汀,或制备用于检测氟西汀的产品中的应用。
根据本发明的一个方面,还提供了一种用于检测氟西汀的试剂或试剂盒,该试剂或试剂盒包含上述抗氟西汀抗体或其抗原结合片段。
与现有技术相比,本发明具有如下有益效果:
本发明运用氟西汀-BSA免疫Balb/c小鼠,取小鼠脾细胞与骨髓瘤细胞融合,通过特异性的高通量筛选得到具有高度特异性的杂交瘤细胞,通过培养和再免疫获得大量小鼠腹水,再经多步分离及纯化获得高纯度、高灵敏度和高特异性的抗氟西汀的单克隆抗体anti-Fluoxetine-mab1,为开发检测氟西汀的免疫试纸条提供了所需的原料。本发明的抗氟西汀的单克隆抗体anti-Fluoxetine-mab1可用于免疫印迹、免疫荧光等免疫学检测,所获抗体经验证具有良好的特异性结合能力。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
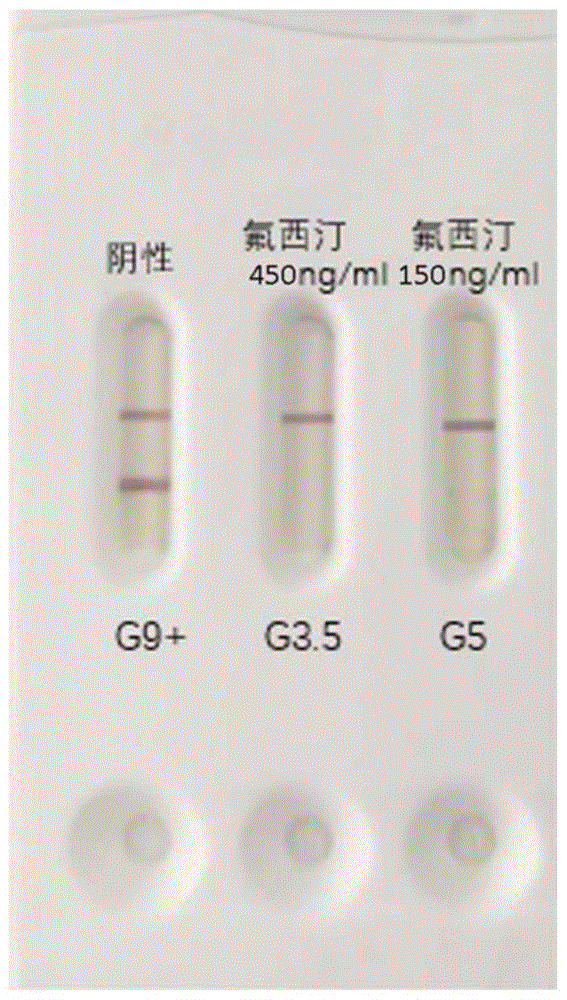
图1为本发明实施例2提供的包被有73#抗体的免疫层析试纸的检测结果。
具体实施方式
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
一般地,连同本文描述的细胞和组织培养、分子生物学、免疫学、微生物学、遗传学以及蛋白和核酸化学和杂交使用的命名法和其技术是本领域众所周知和通常使用的那些。除非另有说明,本发明的方法和技术一般根据本领域众所周知,且如各种一般和更具体的参考文献中所述的常规方法来进行,所述参考文献在本说明书自始至终引用和讨论。酶促反应和纯化技术根据制造商的说明书、如本领域通常实现的或如本文所述来进行。连同本文描述的分析化学、合成有机化学以及医学和药物化学使用的命名法、以及其实验室程序和技术是本领域众所周知和通常使用的那些。
在本文中“抗体或其抗原结合片段”是指结合特定抗原的蛋白,其泛指包含互补决定区(CDR区)的一切蛋白及蛋白片段。此外,“抗体或其抗原结合片段”也包括天然发生的抗体以及非天然发生的抗体。在本文中“抗原结合片段”是包含抗体CDR的物质,其缺乏至少一些存在于全长链中的氨基酸但仍能够特异性结合至抗原。此类片段具生物活性,因为其结合至靶抗原,且可与其他抗原结合分子(包括完整抗体)竞争结合至给定表位。本发明中抗原结合片段具有特异性识别并结合氟西汀的作用。
抗体或其抗原结合片段的“可变区(variable region)”或“可变结构域”是指抗体的重链或轻链的氨基端识别并结合抗原的结构域,该区段氨基酸的组成和排列决定了抗体识别抗原的特异性。重链可变区可以被称为“VH”。轻链可变区可以被称为“VL”。这些结构域通常是抗体的最可变的部分,并含有抗原结合位点。重链和轻链的可变区各自由通过4个框架(framework region,FR)连接的3个互补性决定区(complementarity-determiningregion,CDR)(也被称作高变区)组成。框架和CDR的范围已被精确定义,例如在Kabat(参见《免疫重要的蛋白质的序列》((Sequences of Proteins of Immunological Interest),E.Kabat等)和Chothia中,本领域众所周知的任何CDR确定方法,包括方法的组合,可以鉴别可变结构域的CDR。每个链中的CDR通过FR保持紧密靠在一起构成可变区,通常情况下,重链和轻链的可变区VL/VH可由以下编号的CDR与FR按如下组合排列连接获得:FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4。
本文中术语“多核苷酸”指的是任何长度的核苷酸的聚合物形式,多核苷酸包括核糖核苷酸和/或脱氧核糖核苷酸。多核苷酸的实例包括但不限于单链、双链或多链DNA或RNA、基因组DNA、cDNA、DNA-RNA杂合体或者包含嘌呤和嘧啶碱基或其他天然、化学或生化修饰、非天然或衍生的核苷酸碱基的聚合物。多核苷酸包含编码上述抗体或其抗原结合片段的部分,编码可选地为编码正义链或反义链。多核苷酸可以是天然存在的、合成的、重组的或它们的任意组合。
术语“载体(vector)”是指,可将多核苷酸插入其中的一种核酸运载工具。当载体能使插入的多核苷酸编码的蛋白获得表达时,载体称为表达载体。载体可以通过转化,转导或者转染导入宿主细胞,使其携带的遗传物质元件在宿主细胞中获得表达。
所述载体是本领域技术人员公知的,包括但不限于:质粒;噬菌粒;柯斯质粒;人工染色体,例如酵母人工染色体(YAC)、细菌人工染色体(BAC)或P1来源的人工染色体(PAC);噬菌体如λ噬菌体或M13噬菌体及动物病毒等。可用作载体的动物病毒包括但不限于,逆转录酶病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒、乳头多瘤空泡病毒。在一些实施方式中,本发明所述载体中包含基因工程中常用的调控元件,例如增强子、启动子、内部核糖体进入位点(IRES)和其他表达控制元件(例如转录终止信号,或者多腺苷酸化信号和多聚U序列等)。
本文使用的表述“细胞”、“细胞系”和“细胞培养物”可互换使用,并且所有这类名称都包括后代。后代可以由于天然的、偶然的或故意的突变不一定与原代细胞完全相同,例如在形态学上和/或在基因组DNA上与原代细胞存在差异。“转化体”和“转化细胞”包括原代受试细胞和由其衍生的培养物。
除非另有其它明确表示,否则在整个说明书和权利要求书中,术语“包括”或其变换如“包含”或“包括有”等将被理解为包括所陈述的元件或组成部分,而并未排除其它元件或其它组成部分。
根据本发明的一个方面,提供了一种抗氟西汀抗体或其抗原结合片段,该的抗体或其抗原结合片段包括重链可变区和轻链可变区;重链可变区包含SEQ ID NO.1所示氨基酸序列N末端第31~35位氨基酸残基的VHCDR1(SYYIH)、第50~66位氨基酸残基的VHCDR2(WIYPGNVNTKYNEKFKG)和第99~107位氨基酸残基的VHCDR3(LSYDYSFAY);
轻链可变区包含SEQ ID NO.2所示氨基酸序列N末端第24~38位氨基酸残基的VLCDR1(RASQSVSTSTYTYMH)、第54~60位氨基酸残基的VLCDR2(YASNLES)和第93~101位氨基酸残基的VLCDR3(QHSWEVPPT)。
可选的实施方式中,重链可变区的结构为VHFR1-VHCDR1-VHFR2-VHCDR2-VHFR3-VHCDR3-VHFR4;其中VHFR1的氨基酸序列如SEQ ID NO.3所示(QVQLQQSGPELVKPGASVRISCKASGYTFT),和/或VHFR2的氨基酸序列如SEQ ID NO.4所示(WVKQRPGQGLEWIG),和/或VHFR3的氨基酸序列如SEQ ID NO.5所示(KATLTADKSSSTAYMQLSSLTSEDSAVYFCAS),和/或VHFR4的氨基酸序列如SEQ ID NO.6所示(WGQGTSVTVSS)。
可选的实施方式中,轻链可变区的结构为VLFR1-VLCDR1-VLFR2-VLCDR2-VLFR3-VLCDR3-VLFR4;其中VLFR1的氨基酸序列如SEQ ID NO.7所示(DIMLTQSPASLPVSLGQRATISC),和/或VLFR2的氨基酸序列如SEQ ID NO.8所示(WYQQKPGQPPKLLIK),和/或VLFR3的氨基酸序列如SEQ ID NO.9所示(GVPARFSGSGSGTDFTLNIHPVEEEDTATYYC),和/或VLFR4的氨基酸序列如SEQ ID NO.10所示(FGGGTKLEIK)。
可选的实施方式中,重链可变区的氨基酸序列如SEQ IN NO.1所示。
可选的实施方式中,轻链可变区的氨基酸序列如SEQ IN NO.2所示。
可选的实施方式中,所述抗体或其抗原结合片段还包含IgG1、IgG2、IgG3、IgG4、IgA、IgM、IgE或IgD任何其中之一的部分或全部恒定区的序列。
可选的实施方式中,所述抗原结合片段包括F(ab’)
可选的实施方式中,所述抗体或其抗原结合片段除去CDR区域,其余部分序列来源物种包括但不限于小鼠、大鼠、豚鼠、仓鼠、兔、雪貂、猫、狗、山羊、绵羊、奶牛、猪、马、猴和人中的一种或多种。
可选的实施方式中,所述抗体还包括重链恒定区和轻链恒定区。可选的实施方式中,重链恒定区和/或轻链恒定区来源于小鼠。
可选的实施方式中,抗体的轻链为κ链。
可选的实施方式中,所述抗体为IgG抗体。
根据本发明的另一个方面,还提供了一种生物材料,所述生物材料选自(ⅰ)~(ⅲ)中任一项:
(ⅰ)多核苷酸,包括编码前述抗体或其抗原结合片段的核苷酸序列;可选的实施方式中,所述多核苷酸编码所述重链可变区,核苷酸序列如SEQ ID NO.11所示;可选的实施方式中,所述多核苷酸编码所述轻链可变区,核苷酸序列如SEQ ID NO.12所示。
(ⅱ)载体,所述载体携带前述(ⅰ)多核苷酸。
(ⅲ)细胞,所述细胞携带所述(ⅰ)多核苷酸,或含有所述(ⅱ)载体,或表达前述抗氟西汀抗体或其抗原结合片段。
根据本发明的另一个方面,还提供了上述抗氟西汀抗体或其抗原结合片段,或上述生物材料在非诊断和治疗目的的检测氟西汀,或制备用于检测氟西汀的产品中的应用。
根据本发明的另一个方面,还提供了一种用于检测氟西汀的试剂或试剂盒,其中包含上述抗氟西汀抗体或其抗原结合片段。
可选的实施方式中,还包括标记物,所述标记物包括酶、荧光分子标记、荧光微球、彩色微球、胶体金、生物素或链霉亲和素中的一种或多种。
可选的实施方式中,所述试剂或试剂盒用于免疫检测。可选的实施方式中,所述试剂或试剂盒包括免疫层析检测试剂或试剂盒、ELISA检测试剂或试剂盒、免疫磁微粒检测试剂或试剂盒、免疫荧光检测试剂或试剂盒或免疫印记检测试剂或试剂盒。
可选的实施方式中,所述试剂盒包括免疫层析试纸,所述免疫层析试纸为竞争免疫层析试纸。所述竞争免疫层析试纸包被有上述任一实施方式中的抗体或其抗原结合片段,用于捕获待测样本中的氟西汀。
可选的实施方式中,所述免疫层析试纸沿样本流动方向包括样品垫、结合垫和检测垫,检测垫设置检测线和质控线;结合垫包被标记物标记的所述抗氟西汀抗体或其抗原结合片段;检测线包被氟西汀半抗原;质控线包被与所述抗氟西汀抗体或其抗原结合片段特异性结合的抗体;当样本中含有氟西汀,结合垫上的抗氟西汀抗体或其抗原结合片段,被样本中的氟西汀与检测线上包被的氟西汀半抗原竞争性结合。样本中氟西汀含量越高,与检测线结合的抗氟西汀抗体或其抗原结合片越少,检测线越浅。标记物标记的所述抗氟西汀抗体或其抗原结合片段流经至质控线被质控线包被的抗体捕获显色,说明免疫层析试纸可用。
可选的实施方式中,结合垫包被胶体金标记的所述抗氟西汀抗体或其抗原结合片段。
可选的实施方式中,所述免疫层析试纸包被有标记物标记的与氟西汀结合的抗体,所述与氟西汀结合的抗体的重链可变区氨基酸序列如SEQ ID NO.1所示,轻链可变区氨基酸序列如SEQ ID NO.2所示。
下面通过具体的实施例进一步说明本发明,但是,应当理解为,这些实施例仅仅是用于更详细地说明之用,而不应理解为用于以任何形式限制本发明。
实施例1抗体制备
1.氟西汀-BSA半抗原的准备
(1)在干燥的100毫升单口瓶中加入100毫克氟西汀,氮气保护,再加入10毫升吡啶溶解原料,搅拌至溶清,再加入丁二酸酐,升温回流反应16小时;氟西汀与丁二酸酐的摩尔比为1:1.2-1.5。
(2)反应结束后,55度水浴浓缩晾干溶剂,残留物加二氯甲烷溶解,并加入硅胶拌样,过柱;淋洗剂比例为DCM:MeOH=100:1,得产物一95mg。
(3)取50毫克产物一溶解于1毫升DMF中,配置成50mg/ml溶液,并加入NHS、EDC活化室温反应过夜,产物一与NHS、EDC的摩尔比为1:(1.2~1.5):(1.2~1.5)。
(4)称取100毫克BSA溶解在10毫升PBS缓冲液中,配置成10mg/ml溶液,并将活化好的小分子缓慢加入到蛋白中,反应8小时。
(5)将偶联好的抗原装入透析袋中,每两小时换液一次,共换液六次以上,收样,Lowry测浓度,得到合成抗原氟西汀-BSA。
(二)制备单克隆抗体
2.1选用6-8周龄Balb/c健康雌性小鼠,按照如下免疫方案进行免疫注射。作为免疫原,免疫BALB/c小鼠,提取免疫成功的小鼠脾脏淋巴细胞,通过细胞融合技术将淋巴细胞与小鼠骨髓瘤细胞SP2/0进行融合,经过二轮亚克隆筛选后获得稳定分泌抗氟西汀的单克隆抗体的杂交瘤细胞株,从而获得抗氟西汀的单克隆抗体。
将上一步骤化学合成的氟西汀半抗原,对实验小鼠进行阶段性免疫,具体步骤包括:
(1)将体重、周龄均值一致的Balb/c小鼠随机分为2组,加铝佐剂(氢氧化铝佐剂)组和不加铝佐剂组。
(2)实验开始前,小鼠各收集免疫前血清(第五天收集免疫前血清,通过眼球取血,适量取血,保证小鼠正常状态),收集好的血清存于-80℃。
(3)加铝佐剂(氢氧化铝佐剂)组配制方式:免疫前,每一抗原在75μL PBS中分别稀释至对应剂量(75μg/只小鼠),并与明矾佐剂(1mg/只小鼠)混合,按照体积抗原:佐剂=3:1(即75μl免疫原稀释液中加入25μl佐剂);佐剂使用前摇匀,将注射佐剂(25μl)缓慢滴加至免疫原溶液中;佐剂与免疫原稀释液充分混合后,两者充分混合30分钟。使佐剂有效吸附抗原;后续根据免疫动物实验操作进行。
(4)不加铝佐剂组:抗原在100μL PBS中分别稀释至上述表中的对应剂量(75μg/只小鼠),100μL的免疫原,后续根据免疫动物实验操作进行。
(5)以2周的间隔皮下注射:实验设计为4次免疫方式,但分别在每一次免疫注射4天后眼球取血,离心法获得部分小鼠上清,先进行血清滴度检测,最后一次免疫结束7天后,心脏取血取最大血量,离心获得上清,存于-80℃
2.2检测血清效价,结果如表1所示:用氟西汀半抗原作包被抗原进行间接ELISA检测免疫小鼠血清效价,用氟西汀半抗原和氟西汀小分子做间接竞争ELISA检测免疫小鼠血清效价。
间接ELISA法酶标板每孔加1μg/ml的用包被液稀释的包被抗原50μl,4℃包被过夜后,用洗涤液(PBST)洗板3次(下同),每孔加入封闭液200μl(5%脱脂奶粉),于37℃温箱中放置2h,取出洗涤后,每孔再加入稀释的血清50μl,再在37℃温箱中反应30min,洗涤后,加入羊抗鼠IgG-HRP溶液50μl,37℃温箱中反应30min。洗涤后加入底物液100μl,37℃温箱中避光显色10min,最后加2mol/L H
间接竞争ELISA的过程与间接ELISA过程大部分相同,不同之处在于用封闭液封闭,洗酶标板之后,加入稀释的200ng/mL小分子氟西汀标准液50μl,再加入稀释的血清抗体50μl,使小分子的最终浓度达到100ng/mL,其余的步骤相同。100ng/ml小分子氟西汀竞争检测,在1:12500时均能达到80%以上,进行融合。
表1血清效价检测数据
2.3免疫脾细胞与骨髓瘤细胞系SP2/0细胞融合,通过HAT选择培养基(HAT选择培养基含有次黄嘌呤、氨基喋呤和胸腺嘧啶)筛选融合细胞,并对融合细胞进行ELISA阳性筛选及亚克隆;筛选出的阳性单克隆,取腹水,用Protein A/G抗体纯化柱纯化抗体,纯化后的抗体ELISA效价>1:128,000,纯度>90%。
(三)酶联反应ELISA检测识别氟西汀的结合活性
IgG抗体滴度检测步骤如下:
(1)底板包被:将所用抗原用包被稀释液稀释到3μg/ml,每孔各加入配好的包被液100μl,置4℃冰箱,放置24h。
(2)24h后,从冰箱取出后置于37℃平衡30min,之后弃去孔中液体;用洗涤液满孔洗涤3遍,每遍3min。
(3)封闭酶标反应孔:每孔加入200μl 5%小牛血清后置37℃封闭90min,封闭结束后用洗涤液满孔洗涤3遍,每遍3min。
(4)加入待检测样品:将样本按照需要的比例进行稀释,将稀释好的样品加入酶标反应孔中,每孔100μl,置于37℃,90min;用洗涤液满孔洗涤3遍,每遍3min。
(5)加入酶标抗体:按照说明书加入适宜浓度的二抗;37℃,90min之间,每孔加100μl洗涤同前。
(6)加入底物液:底物加入量每孔100μl,置37℃避光放置15~30min。
(7)终止反应:每孔加入终止液50μl终止反应,于20min内测定实验结果。
(四)检测单克隆抗体识别氟西汀的结合活性:
4.1细胞融合和克隆筛选数据:
小鼠编号依次为A0,A1,A2,A3,共完成了四轮融合。
A0小鼠融合筛选共挑出185个阳性孔,进行亚克隆,最终完全了2个细胞株。第一次亚克隆筛选,共挑选出153个OD450值>2.2以上的阳性克隆进行倍比稀释检测效价。再进行第二次亚克隆筛选,完全了47个阳性细胞株,挑选22个细胞株进行第三次亚克隆,细胞未长。
A1小鼠融合筛选共挑出14个阳性孔,最终完全了43个细胞株。第一次亚克隆筛选,共挑选出126个OD450值>2.2以上的阳性克隆。再进行第二次亚克隆筛选,完全了28个细胞株,挑选36个细胞株进行第三次亚克隆,完全了15个细胞株。
A2和A3号小鼠融合失败,无阳性值。
四次细胞融合后总共得到90个完全细胞株。
4.2腹水制备和检测数据
每个完全细胞株各打1只F1小鼠,共制备了90个腹水,部分腹水检测效价数据如表2所示。
表2腹水效价检测数据
4.3抗体纯化和检测数据:
以上腹水经3.3%正辛酸-硫胺沉淀法纯化,共得到81个抗体,18#、30#、42#、71#、76#、77#、79#、89#和90#共9个细胞腹水量少,未纯化。部分抗体的效价检测数据如表3所示:
表3纯化抗体效价检测数据
经腹水效价和抗体效价检测显示81个细胞株的单克隆抗体对氟西汀抗原具有良好的特异性结合能力,用小分子氟西汀做竞争实验,结果均有良好竞争,因此,将81个抗体用于氟西汀胶体金产品的测试。
实施例2单克隆抗体在产品上的应用。
通过免疫胶体金平台对氟西汀81个抗体进行验证。
具体的,实验组为使用上述实验得到的氟西汀抗体1#至88#共81个抗体,对杭州安旭生物科技有限公司的氟西汀标准品Fluoxetine进行检测。所述免疫层析试纸包括样品垫、结合垫和检测垫,检测垫设置检测线和质控线。结合垫包被胶体金标记的筛选出的anti-Fluoxetine-mab1单克隆抗体,检测线包被氟西汀抗原,质控线包被羊抗鼠IgG抗体。
阴性对照为尿液样本。将上述试剂进行加样,之后使用杭州安旭生物科技有限公司的POCT检测仪器ACG1000(ID-A003)对结果进行检测,筛选出73#抗体阴性和梯度较好,实验数据结果见下表:
表4抗体初评结果
注:上表中G3-G9表示试纸条的条带颜色深浅的级别,数值越高,表示颜色越深,+/-表示比该级别的颜色稍深或稍浅。加入氟西汀标准品数值变低说明小分子有竞争作用,抗体可以和氟西汀标准品结合。
结果显示,73#号抗体梯度较好,可用于氟西汀产品中,cut-off值做到300ng/ml,之后做73#号抗体的稳定性评估,制备3个批次的抗体小样,评估结果如下表和图1所示:
表5 73#抗体3批稳定性评估结果
根据产品的评估结果将73号抗体命名为anti-Fluoxetine-mab1,该抗体可以用于氟西汀抗原检测试剂盒的检测。
实施例3单克隆抗体anti-Fluoxetine-mab1重链V区(VH)及轻链V区(VL)序列分析
(一)分析方法:
(1)设计扩增重链V区(VH)及轻链V区(VL)基因的引物。
(2)取anti-Fluoxetine-mab1对数生长期的杂交瘤细胞株(约107个细胞),按照Trizol RNA提取试剂盒的说明书抽提细胞的总RNA,以总RNA为模板反转录合成cDNA第一链,以上述扩增产物为模板PCR扩增抗体的VH/VL基因。
(3)回收取anti-Fluoxetine-mab1的重链VH(约360bp)、轻链VL(约300bp)片段,送公司测序。
(4)然后分析VH/VL基因序列
(二)分析结果:
(1)重链可变区:
重链可变区氨基酸序列为:
其中下划线部分分别依次表示VHCDR1~3)。
重链可变区核苷酸序列为:
(SEQ ID NO.11,其中下划线部分分别依次表示VHCDR1~3)。
(2)轻链可变区:
轻链可变区氨基酸序列为:
其中下划线部分分别依次表示VLCDR1~3)。
轻链可变区核苷酸序列为:
(SEQ ID NO.12,其中下划线部分分别依次表示VLCDR1~3)。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 特异结合CD3的抗体、抗原结合片段和单链抗体可变区片段及其应用
- 全人源抗PCSK9抗体、其抗原结合片段及其应用
