针对表达通用嵌合抗原受体的免疫细胞的靶向模块及其用途
文献发布时间:2024-04-18 19:58:26
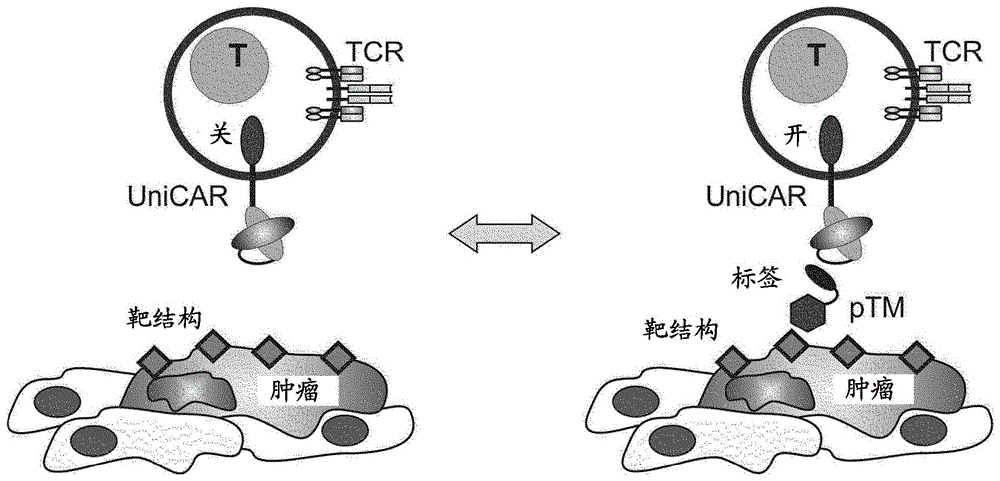
本申请是分案申请,其对应的母案申请的申请号为201880035239.9,申请日期为2018年6月8日,优先权日期为2017年6月9日,发明名称为“针对表达通用嵌合抗原受体的免疫细胞的靶向模块及其在治疗癌症、感染和自身免疫性病症中的用途”。
技术领域
本发明涉及包含对人细胞表面蛋白质或蛋白质复合物具有特异性的化学合成的肽结合部分的靶向模块、包含所述靶向模块的试剂盒和包含编码通用嵌合抗原受体的核酸的载体或细胞以及它们在治疗癌症、感染和自身免疫性病症中的用途。
背景技术
嵌合抗原受体(CAR)是由提供抗原特异性的结合部分和一个或多个源自免疫受体的信号传导链组成的人工受体(Cartellieri等人,2010)。这两个主要的CAR结构域通过包含跨膜结构域的连接肽链连接,所述连接肽链将CAR锚定在细胞质膜中。免疫细胞,特别是T淋巴细胞和NK淋巴细胞,可以进行基因修饰以表达插入至其质膜的CAR。如果这种经CAR修饰的免疫细胞遇到表达CAR结合部分的适当靶标或被用CAR结合部分的适当靶标修饰的其他细胞或组织结构,则在CAR结合部分与靶抗原结合后,经CAR修饰的免疫细胞会与靶标交联。交联通过CAR信号传导链引起信号通路的诱导,这将改变植入CAR的免疫细胞的生物学特性。采用嵌合抗原受体(CAR)改造的免疫细胞的过继转移目前被认为是治疗其他无法治愈的恶性、感染性或自身免疫性疾病的极有前途的治疗选择。最初的临床试验证明了这种治疗策略的安全性和可行性(Lamers等人,2006,Kershaw等人,2006)。但是,常规的CAR技术伴随着许多关键的安全问题。对患者输注后,用常规CAR改造的T细胞的免疫反应难以控制,特别是在健康组织上意想不到的靶基因的表达可能会激发经改造的T细胞针对健康细胞的免疫反应,这可能导致严重的副作用(Lamers等人,2006,Morgan等人,2010)。常规CAR技术的另一个缺点是经改造的T细胞重新靶向至单个抗原的限制。这种单一治疗方法暗示发生肿瘤逃逸变体的风险,在治疗过程中肿瘤逃逸变体丢失了靶抗原。在临床试验中,已经观察到在常规CAR T细胞治疗几个月后出现了肿瘤逃逸变体(Grupp等人,2013)。
WO 2012082841 A2公开了表达通用抗标签嵌合抗原受体的T细胞和治疗细胞相关病症(例如癌症)的方法。此外,WO 2013044225 A1公开了由T细胞表达的用于靶向多种多样的抗原的通用免疫受体。两种方法都描述了表达通用抗标签免疫受体的经修饰的T细胞的用途。通过额外应用结合这些表面抗原并带有相应标签的模块,可以将这些T细胞重定向至疾病相关的细胞表面抗原。缺点是使用外源标签重定向基因修饰的T细胞,这些外源标签可能具有免疫原性,因此使患者处于危险之中并对治疗效果产生负面影响。
备选地,EP 2 990 416 A1公开了基因修饰的免疫细胞,特别是基于T细胞和NK细胞的治疗,其允许使用基于核蛋白的内源标签以安全有效的方式针对多种病症进行重定向。特别地,EP 2 990 416 A1公开了一种编码通用嵌合抗原受体(UniCAR)的核酸和由对某些人细胞表面蛋白质或蛋白质复合物具有特异性的结合部分和标签(其中所述标签源自任何人核蛋白)组成的靶向模块以及它们在刺激哺乳动物免疫反应中的用途。与常规CAR相比,通用CAR中的scFv不识别细胞表面抗原,而是识别源自人核蛋白的短的非免疫原性肽基序。因此,经改造以表达UniCAR的T细胞在重新输注后仍保持无活性,因为在生理条件下完整细胞表面上没有该UniCAR靶标(图1)。靶向模块基于包括抗体片段(即scFV或Fab)、配体或可溶性受体的重组蛋白。
所公开的方法的缺点是需要建立和执行高度复杂的制备和纯化程序才能获得临床级的靶向模块。这包括在原核或哺乳动物细胞培养系统中的重组表达、用于纯化的复杂多步色谱程序以及用于质量控制的大量分析板。此外,靶向模块的稳定性通常是有限的,并且长期的储存条件是不利的。
发明内容
在第一方面,本发明提供了特定的靶向模块,其可以在临床级别上容易、快速且经济地制造。
此外,本发明提供了具有改善的药学特性和改善的稳定性的特异性靶向模块。
本发明的实施方案涉及靶向模块,其包含标签和对人细胞表面蛋白质或蛋白质复合物具有特异性的化学合成的肽结合部分,其中所述标签为源自任何蛋白质的肽,其中所述靶向模块为包含10至120个氨基酸的肽。
在实施方案中,线性肽表位源自人蛋白质以使免疫原性的风险最小化。
在另一个实施方案中,线性肽表位源自人核蛋白,以使免疫原性的风险最小化并防止表达UniCAR的免疫细胞的脱靶活性。人核蛋白的肽不会被呈递在细胞表面上,因此,在没有靶向模块的情况下,植入UniCAR的免疫细胞不能被激活(图1)。
有利地是,根据本发明的靶向模块可以容易地合成。另外有利地是,根据本发明的靶向模块能够结合至通用嵌合抗原受体(UniCAR)并且能够结合至人细胞表面蛋白质或蛋白质复合物。
根据本发明的靶向模块为使得经基因修饰的免疫细胞能够到达其靶标(特别是细胞表面蛋白质或细胞外结构)的分子。
如本文所使用的,术语“化学合成”是指通过化学合成,特别是通过将第一氨基酸的羧基与第二氨基酸的氨基偶联来生产肽的方法。在一个实施方案中,化学合成选自液相合成或固相合成。
如本文所使用的,术语“特异性”是指肽或蛋白质专门结合至某一靶标或某组靶标的能力。
如本文所使用的,术语“细胞表面蛋白质或蛋白质复合物”是指细胞表面蛋白质或细胞外结构。如本文所使用的,术语“蛋白质复合物”是指两个或更多个缔合的蛋白质链的组。
Brady等人公开了对人细胞表面蛋白质或蛋白质复合物以及在人肿瘤细胞中过表达的相应受体类型或亚型具有特异性的肽(Brady等人,2014)。
如本文所使用的,术语“标签”是指连接至肽或蛋白质以使所述肽或蛋白质能够结合至特定原子、离子或分子的肽序列。
根据本发明的人蛋白质为在人生物体中发现的蛋白质。
根据本发明的核蛋白为在细胞核中发现的蛋白质。
在另一个的实施方案中,靶向模块是化学合成的靶向模块。
根据本发明,化学合成的肽结合部分选自生长抑素和生长抑素类似物、生长抑素拮抗剂、铃蟾肽和铃蟾肽类似物、胃泌素释放肽(GRP)和GRP类似物、神经调节肽B和神经调节肽B类似物、血管活性分泌素家族、促黑素细胞激素(MSH)和MSH类似物、胆囊收缩素(CCK)、胃泌素、神经降压肽和神经降压肽类似物、促性腺激素释放激素家族、神经节细胞因子、毒蜥外泌肽或艾塞那肽(exenatides)、Arg-Gly-Asp(RGD)肽、Asn-Gly-Arg(NGR)肽、神经调节蛋白,或其中化学合成的肽结合部分对膜受体具有结合特异性。
如本文所使用的,术语“类似物”是指展现的氨基酸序列与肽具有至少75%同一性,优选与肽具有至少80%同一性,特别优选与肽具有至少85%同一性的化合物。
如本文所使用的,术语“拮抗剂”是指结合肽受体而不触发信号级联的化合物。
Merlo等人、Raderer等人和Kaltsas等人描述了生长抑素类似物,特别是奥曲肽(octreotide)、奥曲肽酸(octreotate)和兰瑞肽(lanreotide)及其与生长抑素受体的结合(Merlo等人,1999,Raderer等人,2000,Kaltsas等人,2005)。在一个实施方案中,生长抑素类似物为奥曲肽、octreotate或兰瑞肽。
Wild等人(2011年)描述了生长抑素拮抗剂,特别是pNO
Gonzalez等人描述了铃蟾肽、胃泌素释放肽(GRP)、神经调节肽B及其类似物(Gonzalez等人,2008)。此外,Ohki-Hamazaki等人描述了铃蟾肽、胃泌素释放肽(GRP)、神经调节肽B及其类似物,特别是铃蟾肽类似物阿利特辛(alytesin)(Ohki-Hamazaki等人,2005)。
Hessenius等人和Raderer等人(2000年)描述了血管活性肠肽(VIP)及其与VIP受体的结合(Hessenius等人,2000,Raderer等人,2000)。
Chen等人和Yang等人描述了α-促黑素细胞激素(α-MSH)、α-MSH类似物及其受体结合(Chen等人,2002,Yang等人,2009)。在一个实施方案中,MSH类似物选自环化的α-MSH、美拉诺坦(melanotan)I或美拉诺坦II。
Froberg等人和Kolenc-Peitl等人描述了DOTA缀合的胆囊收缩素(CCK)-2和胃泌素及其受体结合(Froberg等人,2009,Kolenc-Peitl等人,2011)。
De Visser等人和Buchegger等人描述了神经降压肽类似物,特别是DOTA和DTPA缀合的神经降压肽类似物和神经降压肽的羧基末端的六肽类似物(de Visser等人,2003,Buchegger等人,2003)。
Reubi等人描述了神经肽Y(NPY)和神经肽Y类似物及其在癌症中的受体结合(Reubi等人,2001)。
Nagy和Schally和Popovics等人描述了促黄体激素释放激素(LHRH)和细胞毒性LHRH缀合物及其受体,它们作为癌症治疗的特异性靶标(Nagy和Schally 2005,Popovics等人,2014)。
Beaujouan等人分别描述了速激肽或神经激肽,特别是P物质、神经激肽A和B(NKA和NKB)和神经肽Y和K(NPY和NPK)及其受体(Beaujouan等人,2004)。
Wild等人和Brom等人描述了毒蜥外泌肽-3、毒蜥外泌肽-4、其缀合物及其与胰高血糖素样肽-1(GLP-1)受体的结合(Wild等人,2006,Wild等人,2010,Brom等人,2010)。
Haubner等人、Decristoforo等人和Dumont等人描述了用于结合avβ3整联蛋白的Arg-Gly-Asp(RGD)肽缀合物(Haubner等人,2005,Decristoforo等人,2008,Dumont等人,2011)。
Arap等人描述了Arg-Gly-Asp(RGD)肽和Asn-Gly-Arg(NGR)肽,与这些肽的缀合物及其在癌细胞上的结合(Arap等人,1998)。
在一个实施方案中,对膜受体具有结合特异性的肽对选自下列各项的膜受体具有结合特异性:分化(CD)分子簇、细胞因子和趋化因子受体、酪氨酸激酶受体家族成员、表皮生长因子受体家族成员、肝配蛋白受体家族成员、所谓的前列腺特异性抗原、胚胎和癌胚抗原、血管内皮生长因子受体家族成员、粘蛋白家族成员、叶酸结合蛋白和受体、NKG2D受体的配体、上皮糖蛋白(EGP)家族成员、双唾液酸神经节苷脂、碳酸酐酶家族成员和碳水化合物抗原家族成员、凝集素、凝集素样分子、肿瘤坏死因子受体家族成员、角蛋白家族成员以及膜受体的突变体。
如本文所使用的,术语“突变体”是指在细胞外区域具有至少75%同一性、优选至少90%的膜受体。
在一个优选的实施方案中,对膜受体具有结合特异性的肽对选自下列各项的膜受体具有结合特异性:CD2、CD3、CD4、CD8、CD10、CD13、CD19、CD20、CD22、CD23、CD30、CD25、CD33、CD38、CD44、CD52、CD90、CD99、CD123、CD181、CD182、CD184、CD223、CD269、CD274、CD276、CD279和CD366、白介素受体、特别优选IL-8Rα(CXCR1)、IL-8Rβ(CXCR2)、IL-11Rα、IL-11Rβ、IL-13Rα1和2、CXCR4;c-Met、转化生长因子β受体、ErbB1、ErbB2、ErbB3、ErbB4及其突变体、肝配蛋白受体(特别优选EphA1-10或EphB1-6);前列腺干细胞抗原(PSCA)、前列腺特异性膜抗原(PSMA)、胚胎抗原(例如癌胚抗原CEA、胎儿乙酰胆碱受体)、癌胚抗原、肿瘤特异性聚糖【例如丝氨酸或苏氨酸连接的N-乙酰半乳糖胺(Tn)或类似唾液酸基-Tn的衍生物】;VEGFR 1、VEGFR 2或VEGFR 3、神经毡蛋白-1,上皮细胞粘附分子(EpCAM)、表皮生长因子受体(EGFR)、甲胎蛋白(AFP)、粘蛋白(尤其优选MUC1、MUC16或MUC18);卵泡刺激素受体(FSHR)、人高分子量黑素瘤相关抗原(HMW-MAA)、叶酸结合蛋白(FBP)、叶酸受体、NKG2D、主要组织相容性复合物(MHC)I类分子(尤其优选MHC I类链相关基因A(MICA)或B(MICB))、UL16结合蛋白(ULPB)1、ULPB 2、ULPB 3、核糖核酸输出1(Rae-1)家族成员或组织相容性60(H-60);伴侣蛋白和热休克蛋白(尤其优选热休克蛋白(HSP)90或78kDa葡萄糖调节蛋白(GRP78));EGP-2或EGP-4、双无唾液酸神经节苷脂2(GD2)或GD3、碳酸酐酶9(CAIX)、Lewis Y(LeY)、C型凝集素样分子-1(CLL-1)、肿瘤坏死因子相关的凋亡诱导配体(TRAIL)受体,细胞凋亡抗原1(APO-1、Fas、CD95)、Notch配体(例如Delta-样1和4)、角蛋白家族成员或整联蛋白(尤其优选avβ3或avβ5)、氨肽酶A、氨肽酶N或神经/神经胶质抗原2(NG2)。
Clark-Lewis等人描述了白介素-8(IL-8)和IL-8类似物及其与中性粒细胞上特定膜受体的结合能力(Clark-Lewis等人,1991)。
Cardó-Vila等人描述了白细胞介素-11(IL-11)和IL-11类似物及其与IL-11受体(例如在肿瘤细胞的表面上)的结合能力(Cardó-Vila等人,2008)。
Sai等人描述了特异性结合至白介素-13受体亚基α2的肽(Sai等人,2017)。
Hanaoka等人描述了作为趋化因子受体CXCR4抑制剂的14个残基的肽的设计、所述肽的DTPA缀合物的合成和受体结合(Hanaoka等人,2006)。此外,Jacobson等人描述了基于短肽的高度选择性CXCR4拮抗剂的开发(Jacobson等人,2010)。Laverman等人公开了受体结合肽,特别是靶向在肿瘤细胞上过表达的受体。Laverman等人公开了CKK肽、GLP-1肽、CXCR4结合肽和胃泌素释放肽受体靶向肽(BN、GRP和BN类似物)(Laverman等人,2012)。
Broda等人描述了c-Met结合肽cMBP2和选择合适的与受体(特别是在肿瘤细胞上的受体)结合的肽的方法(Broda等人,2015)。
Wang等人描述了erbB2结合肽(LTVSPWY)的缀合物(Wang等人,2007a)。
Kolonin等人和Staquicini等人描述了肝配蛋白受体EphA5的肽配体,其用于靶向人癌细胞(Kolonin等人,2006,Staquicini等人,2015)。
Barrett等人、Vallabhajosula等人和Afshar-Oromieh等人描述了结合前列腺特异性膜抗原(PSMA)的肽(Barrett等人,2013,Vallabhajosula等人,2014,Afshar-Oromieh等人,2015)。此外,WO 2010/108125 A2和WO 2015/055318 A1公开了PSMA结合肽。
De Rosa等人描述了显示与受体VEGFR2的VEGF样受体结合的肽的设计和合成(DeRosa等人,2016)。Michaloski等人描述了与所有VEGFR结合的肽(Michaloski等人,2016)。
Karjalainen等人描述了结合神经毡蛋白-1的肽(Karjalainen等人,2011)。
Iwasaki等人(2015年)描述了结合上皮细胞粘附分子(EpCAM)胞外域的14-聚体大环肽(Iwasaki等人,2015)。
Cardó-Vila等人(2010年)描述了结合EGFR的肽(Caro-Vila等人,2010)。
Staquicini等人(2008年)描述了结合MUC18的MUC18衍生的9-聚体肽和10-聚体肽,模仿了其嗜同性相互作用(Staquicini等人,2008)。
Arap等人描述了应激反应伴侣GRP78结合肽基序和包含GRP78结合基序的合成嵌合肽,它们用于靶向肿瘤细胞(Arap等人,2004),Vidal等人描述了结合HSP90的肽(Vidal等人,2004)。
Kajiwara等人描述了设计与受体结合的合成肽的方法,特别是设计和合成与肿瘤坏死因子受体家族的成员、TRAIL(肿瘤坏死因子相关的凋亡诱导配体受体)、TNFR1或Fas(凋亡抗原1、APO-1、CD95)结合的合成肽(Kajiwara等人,2004)。
Soudy等人描述了结合角蛋白1(角蛋白家族成员)的两种肽(12-聚体和10-聚体)及其缀合物(Soudy等人,2017)。
Cardo-Vila等人描述了αvβ5结合肽(Cardo-Vila等人,2003)。
Marchio等人描述了靶向氨肽酶A的肽(Marchio等人,2004)。Pasqualini等人描述了通过NGR肽标签将药物靶向至氨肽酶N(CD13)(Pasqualini等人,2000)。
Burg等人描述了靶向在新血管系统上的NG2的肽(Burg等人,1999)。
优选地,对膜受体具有结合特异性的肽选自下列公开的组:Clark-Lewis等人、Cardó-Vila等人(2003/2008/2010)、Sai等人、Hanaoka等人、Jacobson等人、Laverman等人、Broda等人、Wang等人、Kolonin等人、Staquicini等人(2008/2015)、Barrett等人、Vallabhajosula等人、Afshar-Oromieh等人、De Rosa等人、Michaloski等人、Karjalainen等人、Iwasaki等人、Arap等人、Kajiwara等人、Soudy等人、Marchio等人、Pasqualini等人或Burg等人。
在一个优选实施方案中,化学合成的肽结合部分选自生长抑素、铃蟾肽、胃泌素释放肽(GRP)、血管活性肠肽(VIP)、α-促黑素细胞激素(α-MSH)、美拉诺坦2(α-M2)、胆囊收缩素(CCK)或胃泌素、神经降压肽、神经肽Y、促黄体激素释放激素(LHRH)、P物质、毒蜥外泌肽、Arg-Gly-Asp(RGD)肽或Asn-Gly-Arg(NGR)肽。
在一个实施方案中,靶向模块为包含13至85个氨基酸的肽,特别优选20至60个氨基酸的肽。
在一个实施方案中,化学合成的肽结合部分为具有3至75个氨基酸的肽,优选10至50个氨基酸的肽。
在另一个实施方案中,化学合成的肽结合部分包含一种肽(单特异性)、两种、三种或更多种肽(双特异性和多特异性)。
在另一个实施方案中,化学合成的肽结合部分包含至少两种选自下列各项的肽:生长抑素和生长抑素类似物、生长抑素拮抗剂、铃蟾肽和铃蟾肽类似物、胃泌素释放肽(GRP)和GRP类似物、神经调节肽B和神经调节肽B类似物、血管活性分泌素家族、促黑素细胞激素(MSH)和MSH类似物、胆囊收缩素(CCK)、胃泌素、神经降压肽和神经降压肽类似物、促性腺激素释放激素家族、神经节细胞因子、毒蜥外泌肽或艾塞那肽、Arg-Gly-Asp(RGD)肽和Asn-Gly-Arg(NGR)肽、神经调节蛋白或对膜受体具有结合特异性的肽。
具有至少两个肽的化学合成的肽结合部分的实例包括但不限于:结合至相同细胞表面蛋白质(例如IL-11R、IL-13RA2、ErbB2、PSCA、PSMA、VEGFR或GD2)的两种不同肽的组合、PSMA结合肽和结合VEGFR-2、PSCA、IL-11R或MUC1的肽的组合、结合GD2和CD90的肽的组合或美拉诺坦I和II、其类似物或环化肽的组合。
在另一个实施方案中,化学合成的肽结合部分和/或标签包含D氨基酸、假肽键、氨基醇、非蛋白质氨基酸、具有修饰的侧链的氨基酸,和/或化学合成的肽结合部分和/或标签为环化肽。
根据本发明,标签为来自任何蛋白质的肽,针对其可获得抗体或其他结合结构域。
在另一个实施方案中,标签为来自任何人蛋白质的肽,针对其可获得抗体或其他结合结构域。
在另一个实施方案中,标签为来自人核蛋白的肽,针对其可获得抗体或其他结合结构域。
本发明进一步包括根据本发明的靶向模块在制备用于治疗和/或诊断癌症或自身免疫性疾病的药物中的用途。
本发明还包括通过施用根据本发明的靶向模块来治疗患有癌症、感染性、炎性或自身免疫性疾病的人的方法。
对于治疗应用,将包含药理学有效量的根据本发明的靶向模块的无菌药物组合物施用至患者,以治疗上述疾病。
将借助于以下附图和实施方案更详细地解释本发明,而不将本发明限制于它们。
附图说明
现在将通过以下非限制性附图和实施例进一步解释本发明。
图1显示了UniCAR平台的模块组成和UniCAR平台通过将靶标特异性肽靶向模块(pTM)与靶细胞(例如示意图中的肿瘤细胞)表面的靶结构结合的作用方式的示意图。
图2显示了具有三个结构域的通用嵌合抗原受体(UniCAR)的示意图,其中第一结构域为标签结合结构域(例如scFv抗标签),第二结构域为细胞外铰链(ECD)和跨膜结构域(TMD)以及第三结构域为信号转导结构域(ICD),并且可选的第四结构域为受体细胞外部分中的短肽接头(未显示)。
图3显示了载体pLVX-EF1αUniCAR 28/ζ(Clontech,Takara Bio Group),其具有5'长末端重复序列(5'LTR)、引物结合位点(PBS)、包装信号(Ψ)、Rev反应元件(RRE)、中央多嘌呤束/中央终止序列(cPPT/CTS)、人延伸因子1α启动子(PEF1α)、多克隆位点(MCS)、内部核糖体进入位点(IRES)、人密码子优化(ZsGreen1)、土拨鼠肝炎病毒转录后调控元件(WPRE)、3'长末端重复序列(3'LTR)、复制起点(pUC)、氨苄青霉素抗性基因(Ampr)、β-内酰胺酶。
图4显示了编码组特异性抗原(gag)和聚合酶(pol)的质粒psPAX2,其具有CMV增强子和启动子(CMVenh)、剪接供体(SD)、剪接接受体(SA)、组特异性抗原(Gag)、编码蛋白酶蛋白的前体蛋白(Pro)、编码逆转录酶和整合酶的蛋白(Pol)、rev响应元件(RRE)、氨苄青霉素(Amp)。
图5显示了编码包膜的质粒pMD2.G,其具有CMV增强子和启动子(CMV)、β-珠蛋白内含子(β-珠蛋白内含子)、β-珠蛋白聚腺苷尾(β-珠蛋白pA)。
图6显示了在PSMA特异性肽靶向模块(TM-pPSMA)的存在下,经基因改造以表达UniCAR的人天然T细胞对表达前列腺特异性膜抗原(PSMA)的靶细胞(经基因改造以表达PSMA的OCI-AML3)的肽靶向模块剂量依赖性细胞毒活性。显示了在24h和48h孵育时间后,相对于仅具有靶细胞的对照样品的裂解。为了控制同种异体反应性,在不存在TM-pPSMA的情况下将UniCAR-T与靶细胞(仅细胞)一起孵育。
图7显示了在通过肽靶向模块建立针对靶细胞的免疫突触后,经基因改造以表达UniCAR的人天然T细胞的T细胞特异性细胞因子(粒细胞-巨噬细胞集落刺激因子GM-CSF、干扰素γIFN-γ、白介素2IL-2和肿瘤坏死因子αTNFα)的肽靶向模块剂量依赖性分泌。
图8显示了通过肽靶向模块建立针对靶细胞的免疫突触后的活化标志物CD25表面表达所确定的经基因改造以表达UniCAR的人天然T细胞的肽靶向模块剂量依赖性活化。
图9描绘了根据本发明的与PSMA结合的靶向模块,其包括与PSMA结合的谷氨酸-尿素-赖氨酸基序,随后的Z为单个螯合剂【即N,N-双(2-羟基苄基)乙二胺-N,N-二乙酸(HBED)螯合剂】或芳香族氨基酸或其多个以及O为与La 5B9表位相连的2个或更多个重复的接头(即PEG接头)。
图10描绘了根据本发明的与PSMA结合的靶向模块,其包括与PSMA结合的谷氨酸-尿素-赖氨酸基序,随后的Z为单个螯合剂【即N,N-双(2-羟基苄基)乙二胺-N,N-二乙酸(HBED)螯合剂】或芳香族氨基酸或其多个以及O为与La 7B6表位相连的2个或更多个重复的接头(即PEG接头)。
具体实施方式
在优选的实施方案中,标签为来自人核La蛋白的肽。在一个实施方案中,来自人核La蛋白的肽选自通过单克隆抗La抗体5B9或7B6识别的短的线性表位。优选地,标签为来自人核La蛋白的SEQ.ID NO.25所示的短的线性表位(E5B9)或SEQ.ID NO.27所示的E7B6表位。
在另一个的实施方案中,根据本发明的靶向模块还包含至少一种附加配体。附加配体不参与靶抗原的结合。在一个实施方案中,至少一种附加配体选自与靶向模块的N或C末端融合的共刺激性配体或细胞因子,优选为CD28、CD137(41BB)、CD134(OX40)、CD27或IL-2、IL-7、IL-12、IL-15、IL-17和IL-21的细胞外结构域。在进一步的实施方案中,至少一种附加配体选自在靶细胞和邻近细胞中诱导细胞死亡的化合物。
在另一个实施方案中,根据本发明的靶向模块还包括螯合剂。如本文所使用的,术语“螯合剂”是指与一个金属离子形成两个或更多个单独的配位键的化合物。在一个实施方案中,螯合剂选自二乙烯三胺五乙酸(DTPA)、1,4,7,10-四氮杂环十二烷-N,N',N”,N”'-四乙酸(DOTA)、巯基乙酰基三甘氨酸(MAG3)、6-肼基吡啶-3-羧酸(Hynic)、羟基苄基乙二胺(HBED)、N,N'-双[2-羟基-5-(羧乙基)苄基]乙二胺-N,N'-二乙酸(HBED-CC)或2-(3-(1-羧基-5-[(6-氟吡啶-3-羰基)-氨基]-戊基)-脲基)-戊二酸(DCFPyL)。
在优选的实施方案中,根据本发明的靶向模块在C末端包含螯合剂。
在实施方案中,根据本发明的包含螯合剂的靶向模块还包含金属或金属离子,优选放射性核素。术语“放射性核素”是指具有使其不稳定的过量核能的原子。在一个实施方案中,放射性核素选自
在实施方案中,根据本发明的包含螯合剂的靶向模块用于制备放射性标记的化合物。
在实施方案中,根据本发明的靶向模块结合PSMA并具有根据式(I)的结构,其包括结合PSMA的谷氨酸-尿素-赖氨酸基序,随后为短接头和N,N-双(2-羟基苄基)乙二胺-N,N-二乙酸(HBED)螯合剂。PEG接头与螯合剂连接,随后为La 5B9表位。
在实施方案中,根据本发明的靶向模块结合PSMA并具有根据式(II)的结构,其包括结合PSMA的谷氨酸-尿素-赖氨酸基序,随后为短接头和N,N-双(2-羟基苄基)乙二胺-N,N-二乙酸(HBED)螯合剂。PEG接头与螯合剂连接,随后为La 7B6表位。
在实施方案中,根据本发明的靶向模块与IL13RA2结合并具有SEQ.ID NO.26所示的结构,其包括IL13RA2结合基序,随后为接头和La 5B9表位。
靶向模块产生
肽靶向模块(pTM)包含两个结构域,即标签和对某种人细胞表面蛋白质或蛋白质复合物具有特异性的结合部分,其被UniCAR的结合部分识别。可以通过本领域技术人员已知的技术来制造pTM。这些技术包括但不限于多肽链的人工合成或固相和液相化学合成。
一方面,可以以单个、两个或多个液相化学合成程序合成pTM。第一步,将1-(9-芴基甲氧基羰基-氨基)-4,7,10-三氮杂-13-十三胺盐酸盐(Fmoc-TOTA*HCL)接头分子与N,N二异丙基乙胺(DIPEA)溶解在二氯甲烷(DCM)中并装载在2-氯三苯甲基聚苯乙烯树脂(2-氯三苯甲基PS)上。由此,将Fmoc-TOTA*HCl共价连接至树脂以进行进一步处理。为了封闭2-氯三苯甲基氯树脂的未反应的两个氯三苯甲基氯,可以使用由在DCM中的甲醇和DIPEA组成的封端溶液。然后,使用在二甲基甲酰胺(DMF)中的20%哌啶,将随后在最终分子中用作接头的共价连接的结构4,7,10-三氮杂-13-十三胺(TOTA)从其芴基甲氧基羰基(Fmoc)保护基脱保护。接下来,可使用芴基甲氧基羰基/叔丁基(Fmoc/tBu)-策略将氨基酸按顺序加入固定的TOTA中。单个氨基酸通过相应的保护基保护。偶联可以在DMC/N-甲基-2-吡咯烷酮(NMP)中用N,N'-二异丙基碳二亚胺(DIC)和2-氰基-2-(羟亚胺基)乙酸乙酯(Oxyma Pure)进行或使用Boc-O-叔丁基L-丝氨酸(二环己基铵)盐(Boc-Ser(tBu)-OH*DCHA)和苯并三唑-1-基-氧基三吡咯烷基磷六氟磷酸(PyBOP)作为偶联剂进行。以这种方式,可以产生2至100个氨基酸的不同长度的氨基酸链。使用在碳酸二甲酯(DCM)中的六氟异丙醇(HFIP)从树脂上切割出具有TOTA接头的构建肽。侧基的保护基和N-末端叔丁氧羰基(Boc)不受影响。DCM用作溶剂。
使用HPLC方法以用乙酸根抗衡离子替代三氟乙酸(TFA)抗衡离子,然后进行最终的冷冻干燥。
可以使用高效液相色谱(HPLC)纯化最终产物。具体地,反相HPLC可能是有用的。常用的纯化缓冲剂是TFA。备选地或另外地,可以应用离子交换色谱来纯化最终的肽产物。
在另一个实施方案中,根据本发明的靶向模块用于治疗癌症、感染、炎性病症和自身免疫性病症。
在另一方面,本发明进一步包括试剂盒,其包含
a)至少一个根据本发明的靶向模块,以及
b)包含编码通用嵌合抗原受体的核酸的载体或细胞,
其中通用嵌合抗原受体包含三个结构域,
其中
-第一结构域为标签结合结构域,
-第二结构域为细胞外铰链和跨膜结构域,以及
-第三结构域为信号转导结构域,
其中标签结合结构域与根据本发明的靶向模块的标签结合。
如本文所使用的,术语“通用嵌合抗原受体”是指人工嵌合融合蛋白,特别是包含标签结合结构域、细胞外铰链和跨膜结构域以及信号转导结构域的受体(图2)。这些结构域可以源自不同的来源,因此,所述受体被称为嵌合体。有利地,所述受体可以以标签结合结构域结合至不同的靶向模块,因此是通用的。
有利地,包含编码通用嵌合抗原受体(UniCAR)的核酸的细胞表达UniCAR,其对靶向模块的标签具有结合特异性,靶向模块又与细胞表面蛋白质或细胞外结构结合。
如本文所使用的,术语“结构域”是指蛋白质序列的一部分,其可以独立于蛋白质的其余部分而存在和起作用。
在实施方案中,试剂盒包含至少两个根据本发明的靶向模块,其中所述至少两个靶向模块包含对人细胞表面蛋白质或蛋白质复合物具有特异性的不同的化学合成的肽结合部分,以及相同的标签,其中所述标签为来自人核蛋白的肽。
在实施方案中,试剂盒包含1至5个根据本发明的靶向模块,优选1至3个靶向模块。
在实施方案中,标签结合结构域存在于包含UniCAR的多肽的氨基末端。有利地,将标签结合结构域定位在氨基末端允许标签结合结构域不受阻碍地接近结合至靶细胞的加标签的靶向模块。
在另一个实施方案中,标签结合结构域为抗体或抗原结合片段。如本文所使用的,术语“抗体”是指经由Fab的可变区结合抗原的蛋白质。抗原结合片段(Fab)是抗体上与抗原结合的区域。它由每条重链和每条轻链的一个恒定结构域和一个可变结构域组成。如本文所使用的,术语“抗原结合片段”是指至少包含抗体的轻链或重链的可变结构域的蛋白质。在一个实施方案中,抗原结合片段选自单链可变片段(scFv)、单链抗体,F(ab')2片段、Fab片段和由Fab表达文库产生的片段。
在实施方案中,标签结合结构域获自动物物种,优选获自哺乳动物,例如人、猿猴、小鼠、大鼠、兔、豚鼠、马、牛、绵羊、山羊、猪、狗或猫。优选地,所述标签结合结构域为人抗体或人源化抗体。
在实施方案中,标签结合结构域为多克隆抗体、单克隆抗体或嵌合抗体,其中通过重组DNA技术将非人抗体的抗原结合区域转移至人抗体的框架中。
在实施方案中,可以通过注射特定蛋白质或保留蛋白质免疫原性的任何部分、片段或寡肽免疫各种宿主(包括但不限于山羊、兔、大鼠、小鼠、人),从而产生针对所选择的标签的抗体。
在实施方案中,标签结合结构域与来自人核La蛋白的标签结合,优选地,标签结合结构域为抗体或抗原结合片段,其中所述标签结合结构域构成抗La表位scFv,更优选地,SEQ ID NO.21和22或23和24所示的抗La表位scFv。
有利地,标签为来自核抗原的肽序列,其在生理条件下,在天然蛋白质时不能被相应的标签结合结构域接近和结合。此外有利地,所述标签不具有免疫原性。这将使表达UniCAR的免疫细胞的不受控制的靶点外毒性的风险(如释放毒性水平的细胞因子,被称为细胞因子风暴或细胞因子释放综合症(CRS))最小化。
如本文所使用的,术语“单链可变片段(scFv)”是指包含经共价连接的抗体的轻链和重链的可变结构域的人工抗原结合片段。在一个实施方案中,抗体的轻链可变结构域(VL)和重链可变结构域(VH)通过10至25个氨基酸的短肽共价连接。在另一个实施方案中,短肽将VH的N-末端和VL的C-末端连接,反之亦然。
如本文所使用的,术语“细胞外铰链”是指连接标签结合结构域和跨膜结构域的柔性肽序列,其允许UniCAR从细胞表面突出从而最佳结合其特定标签。
如本文所使用的,术语“跨膜结构域”是指在膜中为热力学稳定的并且因此将UniCAR锚定至细胞的细胞膜中的肽序列。
在另一个实施方案中,细胞外铰链和跨膜结构域选自以下各项的铰链和跨膜结构域:人CD28分子、CD8a链、NK细胞受体,优选天然杀伤基团NKG2D的铰链和跨膜结构域;或抗体恒定区的一部分和它们的组合。如本文所使用的,术语“它们的组合”是指不同的铰链和跨膜结构域的组合。
Pinthus等人(2003)、PINTHUS等人(2004)、Cartellieri等人(2014)和Cartellieri等人(2016)描述了人CD28分子的铰链和跨膜结构域在CAR中的用途(Pinthus等人,2003,Pinthus等人,2004,Cartellieri等人,2014,Cartellieri等人,2016)。
Carpentino等人、Milone等人和Zhao等人描述了人CD8α分子的铰链和跨膜结构域在CAR中的用途(Carpentino等人,2009,Milone等人,2009,Zhao等人,2009)。
Zhang等人(2005)和ZHANG等人(2006)描述了NKG2D的铰链和跨膜结构域在CAR中的用途(Zhang等人,2005,Zhang等人,2006)。
Hombach等人、Frigault等人和Wang等人描述了免疫球蛋白G1(IgG)恒定区部分的铰链和跨膜结构域的用途(Hombach等人,2007,Frigault等人,2015,Wang等人,2007b)。Frigault等人描述了IgG4恒定区的铰链结构域的用途。
细胞外铰链和跨膜结构域的组合的实例是但不限于CD28细胞外铰链和跨膜结构域、CD8α细胞外铰链和跨膜结构域、与CD28或CD137跨膜结构域组合的IgG1或IgG4恒定区。
如本文所使用的,术语“信号转导结构域”是指通过表达UniCAR的细胞(效应细胞)与人细胞表面蛋白质或蛋白复合物(靶细胞)的交联而将信号传递至细胞内的氨基酸序列。效应细胞与靶细胞之间的交联由根据本发明的靶向模块介导。
在另一个实施方案中,信号转导结构域选自以下各项的细胞质区域:CD28、CD137(4-1BB)、CD134(OX40)、DAP10和CD27、程序性细胞死亡-1(PD-1)、细胞毒性T淋巴细胞抗原4(CTLA-4)、CD3链、DAP12和激活性Fc受体。
Hombach等人、Maher等人和Cartellieri等人描述了CD28的细胞质区域在CAR中作为信号转导结构域的用途(Hombach等人,2001,Maher等人,2002,Cartellieri等人,2014,Cartellieri等人,2016)。
Milone等人和Finney等人描述了CD137(4-1BB)的细胞质区域作为信号转导结构域的用途(Finney等人,2004,Milone等人,2009)。
Finney等人、Hombach和Abken(2011)和Hombach和Abken(2013)描述了CD134(OX40)的细胞质区域在CAR中作为信号转导结构域的用途(Finney等人,2004,Hombach和Abken 2011,Hombach和Abken2013)。
Zhang等人描述了DAP10作为信号转导结构域的用途(Zhang等人,2005)。
Fedorov等人描述了程序性细胞死亡1(PD-1)和细胞毒性T淋巴细胞抗原4(CTLA-4)在CAR中作为信号转导结构域的用途(Fedorov等人,2013)。
Gong等人和Gade等人描述了CD3链的细胞质区域、特别是CD3Cζ链的细胞质区域在CAR中作为信号转导结构域的用途(Gong等人,1999,Gade等人,2005)。
等人描述了DAP12在CAR中作为信号转导结构域的用途(/>
Lamers等人和Kershaw等人描述了激活性Fc受体、特别是Fcε受体γ链作为信号转导结构域的用途(Lamers等人,2004,Kershaw等人,2006)。
在一个实施方案中,通用嵌合抗原受体包含至少一个信号转导结构域,优选两个、三个、四个或更多个信号转导结构域,特别优选选自以下各项的细胞质区域:CD28、CD137(4-1BB)、CD134(OX40)、DAP10和CD27、程序性细胞死亡1(PD-1)、细胞毒性T淋巴细胞抗原4(CTLA-4)、CD3链、DAP12和激活性Fc受体。
在另一个实施方案中,提供了SEQ.ID NO.1所示的编码被称为UniCAR01的通用嵌合抗原受体的核酸。SEQ.ID NO.2所示的核酸序列编码人IL-2m前导肽,SEQ.ID NO.3所示的核酸序列编码抗La 5B9scFv的人源化重链,SEQ.ID NO.4所示的核酸序列编码抗La 5B9scFv的人源化轻链,SEQ.ID NO.5至7所示的核酸序列编码人CD28部分(包括SEQ.ID NO.5所示的具有突变结合基序的人CD28细胞外部分、SEQ.ID NO.6所示的CD28跨膜结构域以及SEQ.ID NO.7所示的包括突变内化基序的人CD28细胞内部分)以及SEQ.ID NO.8所示的核酸序列编码人CD3ζ细胞内结构域。
SEQ.ID NO.1所示的核酸的蛋白质表达产物可以在SEQ.ID NO.17中获得。
SEQ.ID NO.3所示的人源化抗La 5B9可变区重链的核酸序列编码SEQ.ID NO.21所示的蛋白质,而SEQ.ID NO.4所示的人源化抗La 5B9可变区轻链编码SEQ.ID NO.22所示的蛋白质。
在另一个实施方案中,提供了SEQ.ID NO.9所示的编码被称为UniCAR02的通用嵌合抗原受体的核酸序列。SEQ.ID NO.2所示的核酸序列编码人IL-2m前导肽,SEQ.ID NO.3所示的核酸序列编码抗La 5B9scFv的人源化重链,SEQ.ID NO.4所示的核酸序列编码抗La5B9 scFv的人源化轻链,SEQ.ID NO.10和11所示的核酸序列编码人CD8α链的细胞外铰链和跨膜区,SEQ.ID NO.12所示的核酸序列编码人CD137细胞内信号结构域以及SEQ.ID NO.8所示的核酸序列编码人CD3ζ细胞内结构域。
SEQ.ID NO.9所示的经分离的核酸序列的蛋白质表达产物可以在SEQ.ID NO.18中可获得。
在另一个的实施方案中,提供了SEQ.ID NO.13所示的编码被称为UniCAR03的通用嵌合抗原受体的核酸。SEQ.ID NO.2所示的核酸序列编码人IL-2m前导肽,SEQ.ID NO.14所示的核酸序列编码抗La 7B6scFv的人源化重链,SEQ.ID NO.15所示的核酸序列编码抗La7B6 scFv的人源化轻链,SEQ.ID NO.5至7所示的核酸序列编码人CD28部分(包括SEQ.IDNO.5所示的具有突变结合基序的人CD28细胞外部分、SEQ.ID NO.6所示的CD28跨膜结构域以及SEQ.ID NO.7所示的包括突变内化基序的人CD28胞内部分)以及SEQ.ID NO.8所示的核酸序列编码人CD3ζ胞内结构域。
SEQ.ID NO.13所示的核酸的蛋白质表达产物可以在SEQ.ID NO.19中获得。
SEQ.ID NO.14所示的人源化抗7B6可变区重链的核酸序列编码SEQ.ID NO.23所示的蛋白质,而SEQ.ID NO.15所示的人源化抗7B6可变区轻链的核酸序列编码SEQ.ID NO.24所示的蛋白质。
在另一个实施方案中,提供了SEQ.ID NO.16所示的编码被称为UniCAR04的反向通用嵌合抗原受体的核酸序列。SEQ.ID NO.2所示的核酸序列编码人IL-2m前导肽,SEQ.IDNO.14所示的核酸序列编码抗La 7B6 scFv的人源化重链,SEQ.ID NO.15所示的核酸序列编码抗La7B6 scFv的人源化轻链,SEQ.ID NO.10和11所示的核酸序列编码人CD8α链的细胞外铰链和跨膜区,SEQ.ID NO.12所示的核酸序列编码人CD137细胞内信号结构域以及SEQ.IDNO.8所示的核酸序列编码人CD3ζ细胞内结构域。
SEQ.ID NO.16所示的经分离的核酸序列的蛋白质表达产物可以在SEQ.ID NO.20中获得。
在另一个实施方案中,通用嵌合抗原受体包含第四结构域,其中第四结构域为受体细胞外部分中的短肽接头。
在另一个实施方案中,第四结构域形成特异性结合第四结构域的单克隆抗体(mab)的线性表位。在一个实施方案中,第四结构域包含至少一个线性表位。
在另一个实施方案中,第四结构域位于标签结合结构域中,在标签结合结构域和细胞外铰链结构域或细胞外铰链结构域的组成部分之间。
有利地,与非植入的免疫细胞相比,在体外或体内,植入具有第四结构域的UniCAR的免疫细胞可被特异性刺激以优先增殖并持续更长的时间。进一步有利地,第四结构域还可以用于从混合细胞群体中纯化植入UniCAR的免疫细胞,或用于在体内抑制植入UniCAR的免疫细胞介导的免疫反应并消除植入UniCAR的免疫细胞。
在另一个实施方案中,通用嵌合抗原受体包含信号肽。有利地,信号肽允许在效应细胞的细胞表面上表达。在一个实施方案中,信号肽在标签结合结构域前面的UniCAR核苷酸序列的N-末端。在一个实施方案中,信号肽共翻译或翻译后将蛋白质靶向分泌途径,并且信号肽选自蛋白质(例如CD28、CD8α、IL-2或人源抗体的重链或轻链)的前导肽以避免免疫原性反应。
在另一个实施方案中,核酸为cDNA。术语cDNA(互补DNA)是指在逆转录酶催化的反应中从单链RNA(例如mRNA)合成的双链DNA。
在一个实施方案中,细胞选自自体细胞、同系细胞或同种异体细胞,这取决于要治疗的疾病和治疗可用的手段。在一个实施方案中,细胞选自具有细胞溶解、吞噬细胞溶解或免疫抑制活性的免疫细胞,例如T细胞(包括调节性T细胞)、天然杀伤(NK)细胞和巨噬细胞。在一个优选的实施方案中,细胞选自T细胞,包括α/β和γ/δT细胞或T细胞的亚群(如干细胞样记忆性T细胞或中央记忆T细胞、细胞毒性T细胞、调节性T细胞);或NK细胞。一方面,效应细胞来自某种HLA背景并用于自体或同种异体系统。效应细胞可以从任何来源分离,包括从被治疗受试者的肿瘤外植体或被治疗受试者的瘤内细胞中分离。在一个实施方案中,可以在对各个细胞进行基因操作以表达UniCAR之前或之后,通过从多能或多潜能干细胞或祖细胞体外分化来产生效应细胞。在下文中,术语“效应细胞”是指经过基因改变以在其细胞表面上表达UniCAR的任何种类的上述免疫细胞。
UniCAR细胞产生
可以通过多种方法对免疫细胞进行基因改造以表达UniCAR。编码UniCAR和确保其在基因改造的免疫细胞中表达的所有必需元件的多核苷酸载体被转移到免疫细胞中。可以通过核酸的电穿孔或转染或借助病毒载体系统(如腺病毒、腺相关病毒、逆转录病毒、泡沫病毒或慢病毒基因转移)来进行载体的转移。
首先通过构建编码所选UniCAR的慢病毒载体,将慢病毒基因转移应用于UniCAR在免疫细胞中的稳定表达。慢病毒载体为如图3所示的pLVX-EF1αUniCAR 28/ζ(Clontech,Takara Bio Group),其中,载体的慢病毒部分源自人免疫缺陷病毒(HIV)并且MSC/IRES/ZxGreenI部分被UniCAR构建体取代。
通过用编码UniCAR慢病毒载体质粒瞬时转染人胚肾(HEK)293T(ACC 635)细胞并与如图4所示的编码组特异性抗原(gag)和聚合酶(pol)的质粒(psPAX2)加上如图5所示的编码包膜的质粒(pMD2.G)共转染产生慢病毒颗粒。转染后,包装质粒表达HIV-1的Gag和Pol蛋白。质粒MD2.G编码水泡性口炎病毒的糖蛋白(VSV-G)。VSV-G蛋白用于慢病毒载体以转导广泛的哺乳动物细胞。来自不同病毒种类的各种包膜可用于此目的。慢病毒载体可以成功地用双嗜性鼠白血病病毒(MLV)的包膜糖蛋白(Env)或水泡性口炎病毒的G蛋白(VSV-G)、原型泡沫状病毒(PFV)的改良包膜或源自长臂猿白血病病毒(GaLV)和MLV的嵌合包膜糖蛋白变体进行假型化。
转染后24小时至96小时收获经转染的HEK293T细胞的上清液,并通过超速离心或其他方法从上清液中浓缩病毒颗粒。对于免疫细胞的慢病毒转导,以溶液或包被在塑料细胞培养皿或磁珠上的方式给予对CD3复合物具有特异性的mab(例如克隆OKT3或UCHT1)来激活外周血单核细胞(PBMC)或经分离的T细胞。通过单独或组合使用对CD27、CD28、CD134或CD137具有特异性的mab或配体并供应外源性重组细胞因子(如白介素(IL)-2、IL-7、IL-12、IL-15和IL-21)来刺激共刺激途径进一步增强PBMC或经分离的T细胞的活化。在以单剂量或多剂量初始施用激活性CD3抗体和/或重组细胞因子后24小时至96小时,将浓缩或非浓缩病毒颗粒加入PBMC或T细胞培养物中。
在最终施用病毒上清液后的第3天起,用针对UniCAR表面表达的包含标签的靶向模块或用直接针对UniCAR第四结构域的mab进行染色后,可以通过流式细胞术确定T细胞的稳定转导。经UniCAR转导的T细胞可通过在重组细胞因子和激活性抗CD3 mab的供应下进行培养而进行体外繁殖。
如果UniCAR带有可选的第四结构域,即形成mab所针对的线性表位的肽序列,则可以通过将与第四UniCAR结构域结合的mab或其抗体片段包被至培养皿的表面或任何种类的珠子(以1个珠子对1至4个植入UniCAR的效应细胞的确定比例加入细胞培养物),从而在体外特异性繁殖经基因修饰以表达UniCAR的免疫细胞。表面包被的mab与UniCAR肽结构域的结合诱导细胞表面表达的UniCAR的交联以及免疫突触的形成,这导致由UniCAR的信号结构域特异性触发的信号通路的激活。取决于诱导的信号途径,这可能导致提高增殖以及对带有UniCAR的免疫细胞的激活诱导细胞死亡的持续的抵抗力,并因此导致混合群体中UniCAR基因修饰免疫细胞的富集。
可选的第四结构域,即形成针mab所针对的线性表位的肽序列,可进一步用于从混合群体中富集和纯化表达UniCAR的免疫细胞。在与第四UniCAR结构域结合的mab或其抗体片段的帮助下进行富集和纯化,以标记表达UniCAR的细胞用于细胞分选或将表达UniCAR的免疫细胞瞬时连接至小颗粒,其可用于细胞分离。一方面,将植入UniCAR的免疫细胞与识别第四结构域的mab一起孵育。接下来,添加磁珠,所述磁珠缀合有针对结合至可选的第四结构域的mab的种类特异性和同种型特异性重链和轻链的抗体或其片段。因此,表达UniCAR的免疫细胞和磁珠在磁场中连接并被捕获并与其他免疫细胞分离。
本发明进一步包括包含根据本发明的试剂盒的药物组合物。
药物组合物优选胃肠外施用,特别优选静脉内施用。在一个实施方案中,药物组合物以适合于静脉内施用的形式存在。优选地,药物组合物为溶液、乳液或混悬液。
在一个实施方案中,药物组合物为包含0.1μg/ml至50mg/ml的靶向模块的可注射缓冲溶液,优选包含0.5μg/ml至5mg/ml的靶向模块的可注射缓冲溶液。
在一个实施方案中,药物组合物还包含药学上可接受的稀释剂或运载体。在一个实施方案中,运载体为水、缓冲水、0.4%盐溶液、0.3%甘氨酸或类似溶剂。在一个实施方案中,缓冲水选自pH值为pH 5.0至pH7.0(特别优选pH 6.0的pH)的组氨酸缓冲水;或琥珀酸钠、柠檬酸钠、磷酸钠或磷酸钾缓冲水。在一个实施方案中,缓冲剂的浓度为1mmol/l(mM)至500mM,优选1mM至50mM,特别优选5mM至10mM。在一个实施方案中,载体包含氯化钠,其浓度优选0mM至300mM,特别优选150mM。在一个实施方案中,药物组合物还包含稳定剂,优选浓度为1mM至50mM,特别优选5mM至10mM。在一个实施方案中,稳定剂为L-甲硫氨酸。
在一个实施方案中,药物组合物还包含药学上可接受的赋形剂。术语“药学上可接受的赋形剂”是指提供近似生理条件和/或增加稳定性的化合物,例如用于调节pH值的试剂和缓冲剂、用于调节毒性的试剂等。在一个实施方案中,药学上可接受的赋形剂选自乙酸钠、氯化钠、氯化钾、氯化钙和乳酸钠。
在一个优选的实施方案中,药物组合物包含靶向模块,其剂量为每次施用0.1μg/kg体重至1mg/kg体重,优选1μg/kg体重至100μg/kg体重的剂量。
在另一个实施方案中,药物组合物是无菌的。药物组合物通过常规公知技术灭菌。
在一个实施方案中,包含根据本发明的试剂盒的药物组合物用于施用至受试者。
本发明进一步包括根据本发明的试剂盒或根据本发明的药物组合物用于治疗癌症、感染和自身免疫性病症。术语“自身免疫性病症”是指身体针对通常存在于体内的物质和组织的异常免疫反应(自身免疫)。
在一个实施方案中,根据本发明的试剂盒或根据本发明的药物组合物用于制备在癌症或自身免疫性疾病的情况下用于治疗和/或诊断用途的药物。
本发明还包括通过施用根据本发明的试剂盒或根据本发明的药物组合物来治疗患有癌症或自身免疫性疾病或炎性疾病的人的方法。对于治疗应用,向患者施用包含药理学有效量的根据本发明的靶向模块和包含编码通用嵌合抗原受体的核酸的载体或细胞的根据本发明的无菌试剂盒或根据本发明的药物组合物以治疗上述疾病。
在一个实施方案中,根据本发明的试剂盒或根据本发明的药物组合物用于在哺乳动物中刺激通用嵌合抗原受体介导的免疫反应。
在哺乳动物中刺激通用嵌合抗原受体介导的免疫反应的方法,所述方法包括:
-给哺乳动物施用有效量的包含编码通用嵌合抗原受体的核酸的载体或细胞,其中所述通用嵌合抗原受体包含三个结构域,其中第一结构域为标签结合结构域,第二结构域为细胞外铰链和跨膜结构域,第三结构域为信号转导结构域,其中标签结合结构域与来自人核蛋白的标签结合;
-施用根据本发明的靶向模块,
其中靶向模块在施用表达通用嵌合抗原受体的效应细胞之前、同时或之后施用给受试者。
在一个优选的实施方案中,将根据本发明的试剂盒,特别是靶向模块和载体或细胞或根据本发明的药物组合物施用给人。
在其他实施方案中,可以组合最近描述的各个实施方案。
本发明提供以下实施方案:
1.一种靶向模块,其包含标签和对人细胞表面蛋白质或蛋白质复合物具有特异性的化学合成的肽结合部分,其中所述标签为来自蛋白质的肽,其中所述靶向模块为包含10至120个氨基酸的肽,其中所述化学合成的肽结合部分选自生长抑素和生长抑素类似物、生长抑素拮抗剂、铃蟾肽和铃蟾肽类似物、胃泌素释放肽(GRP)和GRP类似物、神经调节肽B和神经调节肽B类似物、血管活性分泌素家族、促黑素细胞激素(MSH)和MSH类似物、胆囊收缩素(CCK)、胃泌素、神经降压肽和神经降压肽类似物、促性腺激素释放激素家族、神经节细胞因子、毒蜥外泌肽或艾塞那肽、Arg-Gly-Asp(RGD)肽和Asn-Gly-Arg(NGR)肽、神经调节蛋白或其中所述化学合成的肽结合部分对膜受体具有结合特异性。
2.根据实施方案1所述的靶向模块,其中所述标签为来自人蛋白质的肽。
3.根据实施方案1或2所述的靶向模块,其中所述标签为来自人核蛋白的肽。
4.根据实施方案1至3中任一项所述的靶向模块,其中所述化学合成的肽结合部分选自生长抑素、铃蟾肽、胃泌素释放肽(GRP)、血管活性肠肽(VIP)、α-促黑素细胞激素(α-MSH)、美拉诺坦2(α-M2)、胆囊收缩素(CCK)、胃泌素、神经降压肽、神经肽Y、促黄体激素释放激素(LHRH)、P物质、毒蜥外泌肽、Arg-Gly-Asp(RGD)肽、Asn-Gly-Arg(NGR)肽。
5.根据实施方案1至4中任一项所述的靶向模块,其中所述化学合成的肽结合部分包含至少两种选自下列各项的肽:生长抑素和生长抑素类似物、生长抑素拮抗剂、铃蟾肽和铃蟾肽类似物、胃泌素释放肽(GRP)和GRP类似物、神经调节肽B和神经调节肽B类似物、血管活性分泌素家族、促黑素细胞激素(MSH)和MSH类似物、胆囊收缩素(CCK)、胃泌素、神经降压肽和神经降压肽类似物、促性腺激素释放激素家族、神经节细胞因子、毒蜥外泌肽或艾塞那肽、Arg-Gly-Asp(RGD)肽和Asn-Gly-Arg(NGR)肽、神经调节蛋白或其中所述化学合成的肽结合部分对膜受体具有结合特异性。
6.根据实施方案1至5中任一项所述的靶向模块,其中所述化学合成的肽结合部分和/或标签包含D氨基酸、假肽键、氨基醇、非蛋白质氨基酸、具有修饰的侧链的氨基酸和/或所述化学合成的肽结合部分和/或所述标签为环化的肽。
7.根据实施方案1至6中任一项所述的靶向模块,其中所述标签为来自人核La蛋白的肽,优选地,所述标签为SEQ.ID NO.25或SEQ.ID NO.27所示的来自人核La蛋白的短线性表位。
8.根据实施方案1至3中任一项所述的靶向模块,其为SEQ.ID NO.26、式(I)或式(II)所示。
9.根据实施方案1至8中任一项所述的靶向模块,其还包含螯合剂。
10.根据实施方案1至9中任一项所述的靶向模块,其用于治疗癌症、感染、炎性病症和自身免疫性病症。
11.试剂盒,其包含:
a)根据实施方案1至10中任一项所述的靶向模块,以及
b)包含编码通用嵌合抗原受体的核酸的载体或细胞,
其中所述通用嵌合抗原受体包含三个结构域,
其中
-第一结构域为标签结合结构域,
-第二结构域为细胞外铰链和跨膜结构域,以及
-第三结构域为信号转导结构域,
其中,根据实施方案1至10所述的靶向模块的标签与所述标签结合结构域结合。
12.根据实施方案11所述的试剂盒,其中所述标签结合结构域与来自人核La蛋白的标签结合,优选所述标签结合结构域为抗体或抗原结合片段,其中所述标签结合结构域构成抗La表位scFv,更优选SEQ.ID NO.21和22或SEQ.ID NO.23和24所示的抗La表位scFv。
13.根据实施方案11或12中任一项所述的试剂盒,其中所述细胞外铰链和跨膜结构域选自以下各项的铰链和跨膜结构域:人CD28分子、CD8a链、NK细胞受体,优选天然杀伤基团NKG2D的铰链和跨膜结构域;或抗体恒定区的一部分和它们的组合。
14.根据实施方案11至13中任一项所述的试剂盒,其中所述信号转导结构域选自以下各项的细胞质区域:CD28、CD137(4-1BB)、CD134(OX40)、DAP10和CD27、程序性细胞死亡-1(PD-1)、细胞毒性T淋巴细胞抗原4(CTLA-4)、CD3链、DAP12和激活性Fc受体。
15.根据实施方案11至14中任一项所述的试剂盒,其中所述核酸为编码具有SEQ.ID NO.17、18、19或20所示的氨基酸序列的通用嵌合抗原受体的SEQ.ID NO.1、9、13或16。
16.药物组合物,其包含根据实施方案11至15中任一项所述的试剂盒。
17.根据实施方案11至15中任一项所述的试剂盒或根据实施方案16所述的药物组合物,其用于治疗癌症、感染、炎性病症和自身免疫性病症。
引用的非专利文献
Afshar-Oromieh A,Avtzi E,Giesel FL,Holland-Letz T,Linhart HG,Eder M,Eisenhut M,Boxler S,Hadaschik BA,Kratochwil C,Weichert W,Kopka K,Debus J,Haberkorn U(2015)The diagnostic value of PET/CT imaging with the(68)Ga-labelled PSMA ligand HBED-CC in the diagnosis of recurrent prostatecancer.Eur J Nucl Med Mol Imaging.42(2):197-209.
Arap MA,Lahdenranta J,Mintz PJ,Hajitou A,Sarkis AS,Arap W,PasqualiniR(2004)Cell surface expression of the stress response chaperone GRP78 enablestumor targeting by circulating ligands.Cancer Cell 6(3):275-284.
Arap W,Pasqualini R,Ruoslahti E(1998)Cancer treatment by targeteddrug delivery to tumor vasculature in a mouse model.Science 279:377-380.
Barrett JA,Coleman RE,Goldsmith SJ,Vallabhajosula S,Petry NA,Cho S,Armor T,Stubbs JB,Maresca KP,Stabin MG,Joyal JL,Eckelman WC,Babich JW(2013)First-in-man evaluation of 2 high-affinity PSMA-avid small molecules forimaging prostatecancer.J Nucl Med.54:380-387.
Beaujouan JC,Torrens Y,Saffroy M,Kemel M-L,Glowinski J(2004)A 25 yearadventure in the field of tachykinins.Peptides 25:339-357.
Brady LW,Heilmann H-P,Molls M,Nieder C,Ed.Baum RP(2014)TherapeuticNuclear Medicine.Springer.DOI 10.1007/978-3-540-36719-2.
Broda E,Mickler FM,
Brom M,Oyen WJ,Joosten L,Gotthardt M,Boerman OC(2010)
Buchegger F,Bonvin F,Kosinski M,Schaffland AO,Prior J,Reubi JC,
Burg MA,Pasqualini R,Arap W,Ruoslahti E,Stallcup WB(1999)NG2proteoglycan-binding peptides target tumor neovasculature.Cancer Res.59:2869-2874.
Cardó-Vila M,Arap W,Pasqualini R(2003)Alpha v beta 5 integrin-dependent programmed cell death triggered by a peptide mimic of annexin V.MolCell.11(5):1151-1162.
Cardó-Vila M,Zurita AJ,Giordano RJ,Sun J,Rangel R,Guzman-Rojas L,Anobom CD,Valente AP,Almeida FC,Lahdenranta J,Kolonin MG,Arap W,Pasqualini R(2008)Aligand peptide motif selected from a cancer patient is a receptor-interacting site withinhuman interleukin-11.PLoS One.3,e3452.
Cardó-Vila M,Giordano RJ,Sidman RL,Bronk LF,Fan Z,Mendelsohn J,ArapW,Pasqualini R(2010)From combinatorial peptide selection to drug prototype(II):targetingthe epidermal growth factor receptorpathway.Proc.Natl.Acad.Sci.107:5118-5123.
Carpenito C,Milone MC,Hassan R,Simonet JC,Lakhal M,Suhoski,MM,Varela-Rohena A,Haines KM,Heitjan D,Albelda SM,Carrol RG,Riley JL,Pastan,I,June CH(2009)Control of large,established tumor xenografts with geneticallyretargetedhuman T cells containing CD28 and CD137 domains.Proc Natl Acad SciUSA.106(9):3360-3365.
Cartellieri M,Bachmann M,Feldmann A,Bippes C,Stamova S,Wehner R,TemmeA,Schmitz M(2010)Chimeric antigen receptor-engineered T cells forimmunotherapy ofcancer.J Biomed Biotechnol.doi:10.1155/2010/956304.
Cartellieri M,Feldmann A,Koristka S,Arndt,Loff S,Ehninger A,von BoninM,Bejestani EP,Ehninger G,Bachmann MP(2016)Switching CAR T cells on and off:anovelmodular platform for retargeting of T cells to AML blasts.Blood CancerJ.:6(8):e458.
Cartellieri M,Koristka S,Arndt C,Feldmann A,Stamova S,von Bonin M,
Chen J,Cheng Z,Miao Y,Jurisson SS,Quinn TP(2002)α-melanocyte-stimulatinghormone peptide analogs labeled with technetium-99m and indium-111for malignantmelanoma targeting.Cancer 94(4):1196-1201.
Clark-Lewis I,Schumacher C,Baggiolini M,Moser B(1991)Structure-activityrelationships of interleukin-8 determined using chemicallysynthesized analogs.Critical roleof NH
De Rosa L,Finetti F,Diana D,Di Stasi R,Auriemma S,Romanelli A,Fattorusso R,Ziche M,Morbidelli L,D’Andrea LD(2016)Miniaturizing VEGF:Peptides mimicking thediscontinuous VEGF receptor-binding site modulate theangiogenic response.ScientificReports 6,31295.
de Visser M,Janssen PJ,Srinivasan A,Reubi J C,Waser B,Erion J L,Schmidt M A,Krenning E P,de Jong M(2003)Stabilised
Decristoforo C,Hernandez Gonzalez I,Carlsen J,Rupprich M,Huisman M,VirgoliniI,Wester H-J,Haubner R(2008)
Dumont RA,Deininger F,Haubner R,Maecke HR,Weber WA,Fani M(2011)Novel
Frigault MJ,Lee J,Basil MC,Carpenito C,Motohashi S,Scholler J,Kawalekar OU,Guedan S,McGettigan SE,Posey AD Jr,Ang S,Cooper LJ,Platt JM,Johnson FB,PaulosCM,Zhao Y,Kalos M,Milone MC,June CH(2015)Identification ofchimeric antigenreceptors that mediate constitutive or inducibleproliferation of T cells.Cancer ImmunolRes.3(4):356-367.
Fedorov VD,Themeli M,Sadelain M(2013)PD-1-and CTLA-4-basedinhibitorychimeric antigen receptors(iCARs)divert off-target immunotherapyresponses.Sci TranslMed.5(215):215ra172.
Finney HM,Akbar AN,Lawson AD(2004)Activation of resting human primaryTcells with chimeric receptors:costimulation from CD28,induciblecostimulator,CD134,and CD137 in series with signals from the TCR zeta chain.JImmunol.172(1):104-113.
AC,de Jong M,Nock BA,Breeman WAP,Erion JL,Maina T,Verdijsseldonck M,de Herder WW,van der Lugt A,Kooij PPM,Krenning EP(2009)Comparison of three radiolabelled peptide analogues for CCK-2 receptorscintigraphy inmedullary thyroid carcinoma.Eur J Nucl Med Mol Imaging 36:1265-1272.
Gade TP,Hassen W,Santos E,Gunset G,Saudemont A,Gong MC,Brentjens R,Zhong XS,Stephan M,Stefanski J,Lyddane C,Osborne JR,Buchanan IM,Hall SJ,HestonWD,Rivière I,Larson SM,Koutcher JA,Sadelain M(2005)Targeted eliminationofprostate cancer by genetically directed human T lymphocytes.Cancer Res.65(19):9080-9088.
Gong MC,Latouche JB,Krause A,Heston WDW,Bander NH,Sadelain M(1999)Cancer patient T cells genetically targeted to prostate-specific membraneantigenspecifically lyse prostate cancer cells and release cytokines inresponse to prostate-specificmembrane antigen.Neoplasia.1(2):123-127.
Gonzalez N,Moody TW,Igarashi H,Ito T,Jensen RT(2008)Bombesin-relatedpeptides and their receptors:recent advances in their role inphysiology and disease states.Curr Opin Endocrinol Diabetes Obes 15:58-64.
Grupp SA,Kalos M,Barrett D,Aplenc R,Porter DL,Rheingold SR,TeacheyDT,Chew A,Hauck B,Wright F,Milone MC,Levine BL,June CH(2013)ChimericAntigenReceptor-Modified T Cells for Acute Lymphoid Leukemia.N Engl JMed.368,1509-1518.
Hanaoka H,Mukai T,Tamamura H,Mori T,Ishino S,Ogawa K,Iida Y,Doi R,FujiiN,Saji H(2006)Development of a
Haubner R,Weber WA,Beer AJ,Vabuliene E,Reim D,Sarbia M,Becker K-F,GoebelM,Hein R,Wester H-J,Kessler H,Schwaiger M(2005)Noninvasivevisualization of theactivated avβ3 integrin in cancer patients by positronemission tomography and[
Hessenius C,
Hombach A,Sent D,Schneider C,Heuser C,Koch D,Pohl C,Seliger B,Abken H(2001)T-cell activation by recombinant receptors:CD28 costimulation isrequired forinterleukin 2 secretion and receptor-mediated T-cellproliferation but does not affectreceptor-mediated target cell lysis.CancerRes.61(5):1976-1982.
Hombach AA,Kofler D,Hombach A,Rappl G,Abken H(2007)Effectiveproliferationof human regulatory T cells requires a strong costimulatory CD28signal that cannot be substituted by IL-2.J Immunol.179(11):7924-7931.
Hombach AA,Abken H(2011)Costimulation by chimeric antigen receptorsrevisited the T cell antitumor response benefits from combined CD28-OX40signalling.Int J Cancer.129(12):2935-2944.
Hombach AA,Abken H(2013)Of chimeric antigen receptors and antibodies:OX40 and 41BB costimulation sharpen up T cell-based immunotherapy ofcancer.Immunotherapy.5(7):677-681.
Iwasaki K,Goto Y,Katho T,Yamashita T,Kaneko S,Suga H(2015)AFluorescent Imaging Probe Based on a Macrocyclic Scaffold That Binds toCellular EpCAM.J Mol Evol.81(5-6):210-217.
Jacobson O,Weiss ID,Kiesewetter DO,Farber JM,Chen X(2010)PET of tumorCXCR4 expression with 4-
Kajiwara K,Saito A,Ogata S,Tanihara M(2004)Synthetic peptidescorresponding to ligand-binding region of death receptors,DR5,Fas,and TNFR,specifically inhibit cell death mediated by the death ligands,respectively.Biochim Biophysica Acta-Proteins and Proteomics.1699(1-2):131-137.
Kaltsas GA,Papadogias D,Makras P,Grossman AB(2005)Treatment ofadvanced neuroendocrine tumours with radiolabelled somatostatinanalogues.Endocr Relat Cancer12:683-699.
Karjalainen K,Jaalouk DE,Bueso-Ramos CE,Zurita AJ,Kuniyasu A,EckhardtBL,Marini FC,Lichtiger B,O'Brien S,Kantarjian HM,Cortes JE,Koivunen E,Arap W,Pasqualini R(2011)Targeting neuropilin-1in human leukemia andlymphoma.Blood.117:920-927M.
Kershaw MH,Westwood JA,Parker LL,等人,(2006)A phase I study onadoptive immunotherapy using gene-modified T cells for ovarian cancer.ClinCancer Res.12(20):6106-15.
Kolenc-Peitl P,Mansi R,Tamma M,Gmeiner-Stopa T,Sollner-Dolenc M,WaserB,Baum RP,Reubi,JC,Maecke HR(2011)Highly improved metabolic stability andpharmacokinetics of indium-111-DOTA-gastrin conjugates for targeting of thegastrin receptor.J Med Chem 54:2602-2609.
Kolonin MG,Bover L,Sun J,Zurita AJ,Do KA,Lahdenranta J,Cardó-Vila M,Giordano RJ,Jaalouk DE,Ozawa MG,Moya CA,Souza GR,Staquicini FJ,Kunyiasu A,Scudiero DA,Holbeck SL,Sausville EA,Arap W,Pasqualini R(2006)Ligand-directedsurface profiling of human cancer cells with combinatorial peptidelibraries.Cancer Res.66:34-40.
Lamers CH,Sleijfer S,Willemsen RA,Debets R,Kruit WHJ,Gratama JW,Stoter G(2004)Adoptive immuno-gene therapy of cancer with single chainantibody[scFv(Ig)]gene modified T lymphocytes.J Biol Regul Homeost Agents.18(2):134-140.
Lamers CH,Sleijfer S,Vulto AG,Kruit WH,Kliffen M,Debets R,Gratama JW,Stoter G,Oosterwijk E.(2006)Treatment of metastatic renal cell carcinoma withautologous T-lymphocytes genetically retargeted against carbonic anhydraseIX:first clinical experience.J Clin Oncol.24,e20-e22.
Laverman P,Sosabowski JK,Boerman OC,Oyen WJG(2012)Transforming growthfactor beta receptor as example fur surface-expressed serine/threonine kinasereceptors:Radiolabelled peptides for oncological diagnosis.Eur J Nucl Med MolImaging 39(Suppl 1):78-92.
Maher J,Brentjens RJ,Gunset G,Rivière I,Sadelain M(2002)Human T-lymphocyte cytotoxicity and proliferation directed by a single chimericTCRzeta/CD28 receptor.Nat Biotechnol.20(1):70-75.
MarchiòS,Lahdenranta J,Schlingemann RO,Valdembri D,Wesseling P,ArapMA,Hajitou A,Ozawa MG,Trepel M,Giordano RJ,Nanus DM,Dijkman HB,Oosterwijk E,Sidman RL,Cooper MD,Bussolino F,Pasqualini R,Arap W(2004)Aminopeptidase A isafunctional target in angiogenic blood vessels.Cancer Cell.5:151-162.
Merlo A,Hausmann O,Wasner M等人,(1999)Locoregional regulatory peptidereceptor targeting with the diffusible somatostatin analogue
Michaloski JS,Redondo AR,Magalhaes LS,Cambui CC,Giordano RJ(2016)Discovery of pan-VEGF inhibitory peptides directed to the extracellularligand-bindingdomains of the VEGF receptors.Sci Adv.2(10):e1600611.
Milone MC,Fish JD,Carpenito C,Carroll RG,Binder GK,Teachey D,SamantaM,Lakhal M,Gloss B,Danet-Desnoyers G,Campana D,Riley JL,Grupp SA,June CH(2009)Chimeric receptors containing CD137 signal transduction domains mediateenhancedsurvival of T cells and increased antileukemic efficacy in vivo.MolTher.17(8):1453-1464.
Morgan RA,Yang JC,Kitano M,Dudley ME,Laurencot CM,Rosenberg SA(2010)Case report of a serious adverse event following the administration of Tcells transducedwith a chimeric antigen receptor recognizing ERBB2.MolTher.18,843-851.
Nagy A,Schally AV(2005)Targeting of cytotoxic luteinizing hormone-releasinghormone analogs to breast,ovarian,endometrial,and prostatecancers.Biol.Reprod.73(5):891-859.
Ohki-Hamazaki H,Iwabuchi M,Maekawa F(2005)Development and functionofbombesin-like peptides and their receptors.Int J Dev Biol.49:293-300.
Pasqualini R,Koivunen E,Kain R,Lahdenranta J,Sakamoto M,Stryhn A,AshmunRA,Shapiro LH,Arap W,Ruoslahti E(2000)Aminopeptidase N is a receptorfortumor-homing peptides and a target for inhibiting angiogenesis.CancerRes.60:722-727.
Pinthus JH,Waks T,Kaufman-Francis K,Schindler DG,Harmelin A,Kanety H,Ramon J,Eshhar Z(2003)Immuno-gene therapy of established prostate tumorsusingchimeric receptor-redirected human lymphocytes.Cancer Res.63(10):2470-6.
Pinthus JH,Waks T,Malina V,Kaufman-Francis K,Harmelin A,Aizenberg I,KanetyH,Ramon J,Eshhar Z(2004)Adoptive immunotherapy of prostate cancer bonelesionsusing redirected effector lymphocytes.J Clin Invest.114(12):1774-81.
Popovics P,Schally AV,Szalontay L,Block NL,Rick FG(2014)Targetedcytotoxicanalog of luteinizing hormone-releasing hormone(LHRH),AEZS-108(AN-152),inhibitsthe growth of DU-145 human castration-resistant prostate cancerin vivo and in vitrothrough elevating p21 and ROS levels.Oncotarget 5(12):4567-4578.
Raderer M,Kurtaran A,Leimer M,Angelberger P,Niederle B,Vierhapper H.,Vorbeck F,Hejna MHL,Scheithauer W.,Pidlich J.,Virgolini I(2000)Value ofpeptidereceptor scintigraphy using
Reubi JC,Gugger M,Waser B,Schaer J-C(2001)Y
Sai KKS,Sattiraju A,Almaguel FG,Xuan A,Rideout S,Krishnaswamy RS,Zhang J,Herpai DM,Debinski W,Mintz A(2017)Peptide-based PET imaging of thetumorrestricted IL13RA2 biomarker.Oncotarget 8(31):50997-51007.
Soudy R,Etayash H,Bahadorani K,Lavasanifar A,Kaur K(2017)BreastCancerTargeting Peptide Binds Keratin 1:A New Molecular Marker for TargetedDrug Deliveryto Breast Cancer.Molecular Pharmaceutics 14(3):593-604.
Staquicini FI,Tandle A,Libutti SK,Sun J,Zigler M,Bar-Eli M,AlipertiF,Pérez EC,Gershenwald JE,Mariano M,Pasqualini R,Arap W,Lopes JD(2008)Asubset of host Blymphocytes controls melanoma metastasis through a melanomacell adhesionmolecule/MUC18-dependent interaction:evidence from mice andhumans.Cancer Res.68(20):8419-8428.
Staquicini FI,Qian MD,Salameh A,Dobroff AS,Edwards JK,Cimino DF,Moeller BF,Kelly B,Nunez MI,Tang X,Liu DD,Lee JJ,Hong WK,Ferrara F,BradburyAR,Lobb RR,Edelman MJ,Sidman RL,Wistuba II,Arap W,Pasqualini R(2015)Receptortyrosinekinase EphA5 is a functional molecular target in human lungcancer.J.Biol.Chem.290:7345-7359.
K,Cartellieri M,Michen S,Wiedemuth R,Müller N,Lindemann D,BachmannM,Füssel M,Schackert G,Temme A(2015)DAP12-based activating chimericantigenreceptor for NK cell tumor immunotherapy.J Immunol.194(7):3201-3212.
Vallabhajosula S,Nikolopoulou A,Babich JW,Osborne JR,Tagawa ST,LipaiI,Solnes L,Maresca KP,Armor T,Joyal JL,Crummet R,Stubbs JB,Goldsmith SJ(2014)
Vidal CI,Mintz PJ,Lu K,Ellis LM,Manenti L,Giavazzi R,Gershenson DM,Broaddus R,Liu J,Arap W,Pasqualini R(2004)An HSP90-mimic peptide revealed byfingerprinting the pool of antibodies from ovarian cancerpatients.Oncogene.23:8859-8867.
Wang X-F,Birringer M,Dong L-F,Veprek P,Low P,Swettenham E,Stantic M,Yuan L-H,Zobalova R,Wu K,Ledvina M,Ralph SJ,Neuzil J(2007a)A PeptideConjugate of Vitamin E Succinate Targets Breast Cancer Cells with High ErbB2Expression.Cancer Res.67(7):3337-3344.
Wang J,Jensen M,Lin Y,Sui X,Chen E,Lindgren CG,Till B,Raubitschek A,Forman SJ,Qian X,James S,Greenberg P,Riddell S,Press OW(2007b)Optimizingadoptive polyclonal T cell immunotherapy of lymphomas,using a chimeric T cellreceptor possessing CD28 and CD137 costimulatory domains.Hum Gene Ther.18(8):712-725.
Wild D,Behe M,Wicki A,Storch D,Waser B,Gotthardt M,Keil B,ChristoforiG,Reubi JC,
Wild D,Wicki A,Mansi R,BéhéM,Keil B,Bernhardt P,Christofori G,Ell PJ,
Wild D,Fani M,Behe M等人,(2011)First clinical evidence that imagingwith somatostatin receptor antagonists is feasible.J Nucl Med 52:1412-1417.
Yang J,Guo H,Gallazzi F,Berwick M,Padilla RS,Miao Y(2009)Evaluationof ANovel Arg-Gly-Asp-Conjugated Alpha-Melanocyte Stimulating Hormone HybridPeptide for Potential Melanoma Therapy.Bioconjug Chem.20(8):1634-1642.
Zhang T,Lemoi BA,Sentman CL(2005)Chimeric NK-receptor-bearing T cellsmediate antitumor immunotherapy.Blood.106(5):1544-1551.
Zhang T,Barber A,Sentman CL(2006)Generation of antitumor responses bygenetic modification of primary human T cells with a chimeric NKG2Dreceptor.Cancer Res.66(11):5927-5933.
Zhao Y,Wang QJ,Yang S,Kochenderfer JN,Zheng Z,Zhong X,Sadelain M,Eshhar Z,Rosenberg SA,Morgan RA(2009)A herceptin-based chimeric antigenreceptor with modified signaling domains leads to enhanced survival oftransduced T lymphocytes and antitumor activity.J Immunol.183(9):5563-5574.
附图标记
1第一结构域,标签结合结构域。
2第二结构域,细胞外铰链和跨膜结构域。
3第三结构域,信号转导结构域。
4可选的第四结构域,短肽接头。
- 一种靶向全人源化mesothelin的嵌合抗原受体的方法和用途
- 靶向CD19的嵌合抗原受体及其用途
- 靶向人源化mesothelin的嵌合抗原受体的方法和用途
- 一种靶向人源化mesothelin的嵌合抗原受体的方法和用途
- BAFF-R靶向嵌合抗原受体修饰的T细胞及其用途
- 针对表达通用嵌合抗原受体的免疫细胞的靶向模块及其在治疗癌症、感染和自身免疫性病症中的用途
- 用于靶向不同的多种抗原的表达反向通用嵌合抗原受体的免疫细胞及其制备方法和用于治疗癌症、感染和自身免疫性病症的用途
