一种连续诱变筛选多黏菌素E菌株的方法
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于微生物领域,具体涉及一种连续诱变筛选多黏菌素E菌株的方法。
背景技术
多黏菌素E(Colistin),是从多黏类芽胞杆菌(Bacillus polymyxa)的发酵液中提取出的环脂肽类抗生素。多黏菌素E为抗革兰氏阴性菌的兽用抗生素,对大多数革兰氏阴性菌均有较强的抑制或杀菌作用,尤其是绿脓杆菌效果极为显著,对副大肠杆菌、肺炎克雷白杆菌、大肠杆菌、绿脓杆菌、嗜酸杆菌、百日咳杆菌及痢疾杆菌等也有较好的杀菌效果。
发酵生产水平是衡量产品行业竞争力的重要指标,多黏菌素E的发酵水平提高需要符合工业生产标准的高产菌株支撑,虽然基因工程技术已经普遍用于构建工业生产高产菌株,但是常规物理诱变因子如紫外线、微波、常温常压等离子体等因其安全、操作简单等特点广受应用,传统育种在工业微生物育种上不可或缺。为了筛选高产菌株,经常采取各种措施,诱变后高产菌株的筛选效率,人们设计了各种筛选方案,如采取培养基中添加某些因子,如前体、前体结构类似物等,可以定向筛选具有某些特性的菌株,从而提发酵水平或高突变率,如郑万静等公开的《一种选育多粘菌素E低耗糖菌株的方法》通过诱变筛选低耗糖的多黏菌素E生产目标菌株,何敏等公开了《一种混检筛选高产菌株的方法》,是以多黏菌素E生产菌株为实验菌株,通过诱变处理菌群进行抗性能力测试,提高菌株生产水平。
虽然对于多黏菌素E的菌种选育研究工作已经较多,但是对于诱变策略上采用的方法较少,一般的,复合诱变是选育中常用的策略,并且在许多抗生素的产生菌的选育中取得较好的效果,但是这些方法较难克服多黏芽孢杆菌的突变效率不高、重现性不好的问题,对此需要建立完善的流程,从菌种诱变阶段建立菌种适宜的方法,增加菌种筛选率,以提高效率,降低成本。
发明内容
本发明提供一种连续诱变筛选多黏菌素E的方法,目的在于克服目前对于多黏芽孢杆菌表型延迟、对诱变剂敏感度低、突变概率小、重现性差的问题,本方法采用连续诱变策略,可以提高多黏菌素E效价水平和重现率。
一种连续诱变筛选多黏菌素E的方法,步骤如下:1)以生产多黏菌素E的多黏芽孢杆菌作为出发菌株;2)制备菌种菌悬液,选择诱变方法对菌悬液进行处理;3)经过诱变的菌悬液进行扩培;4)扩培后的菌体重新制备菌悬液,进行诱变;5)重复步骤3)和步骤4)2-5次;6)经扩培的菌悬液分离平板单菌落,挑选单菌落进行效价测试,根据测试结果筛选出效价更高的多黏菌素E菌株;
步骤2)和步骤4)中,所述诱变为紫外诱变或/和常温常压等离子体诱变。
本发明中以生产多黏菌素E的多黏芽孢杆菌作为出发菌株制备菌悬液,制备方法包括斜面培养菌体生理盐水打散制备或菌种恒温振荡培养离心收集菌体后生理盐水打散制备;
优选的,所述诱变为紫外诱变或/和常温常压等离子体诱变;
优选的,所述扩培是指菌悬液细胞扩增的方法,包括但不限于斜面恒温静置扩培或菌液恒温振荡扩培;
作为优选,所述步骤3)、步骤4)连续操作2次及以上,优选3~5次;优选的,所述连续是指步骤3、步骤4)的重复,扩培包括斜面恒温静置扩培或菌液恒温振荡扩培;优选的,菌悬液制备包括斜面培养菌体生理盐水打散制备方法或摇瓶液体培养离心收集菌体后生理盐水打散制备方法,诱变包括紫外诱变和/或常温常压等离子体诱变;
作为优选,所述筛选的菌株应高于出发菌株最高效价的5%。
作为优选,所述诱变方法使用适宜的剂量,所述剂量随操作次数改变,优选剂量不变或减弱或增强,优选剂量增强;
作为优选,所述剂量是指诱变的强度,紫外诱变剂量包括照射功率和照射时间,常温常压等离子体剂量包括照射距离,照射功率,处理气量和处理时间;
作为优选,物理诱变方法使用适宜剂量,剂量随重复操作次数的改变范围包括,进一步优选,紫外诱变照射功率为18~36w,照射时间15-90s,常温常压等离子体照射功率80~120W,处理气量8~12SLM,处理时间30~200s。
作为优选,诱变次数和剂量如下:
第一次诱变:紫外诱变照射功率为18~22w,照射时间15~20s;
第二次诱变:紫外诱变照射功率为32~36w,照射时间85~90s;
第三次诱变:常温常压等离子照射功率80~85W,处理气量8~9SLM,处理时间45~50s;
第四次诱变:常温常压等离子照射功率115~120W,处理气量11~12SLM,处理时间195~200s。
作为优选,诱变次数和剂量如下:
第一次诱变:常温常压等离子照射功率80~85W,处理气量8~9SLM,处理时间30~35s;
第二次诱变:常温常压等离子照射功率95~100W,处理气量11~12SLM,处理时间100~105s;
第三次诱变:常温常压等离子照射功率115~120W,处理气量9~10SLM,处理时间195~200s。
作为优选,诱变次数和剂量如下:
第一次诱变:紫外诱变照射功率为18~22w,照射时间25~30s;
第二次诱变:常温常压等离子照射功率95~100W,处理气量9~10SLM,处理时间100~105s;
第三次诱变:紫外诱变照射功率为32~36w,照射时间30~35s;
第四次诱变:常温常压等离子照射功率95~100W,处理气量9~10SLM,处理时间100~105s。
实验结果表明,采用上述诱变方法,有效增加了筛菌率,并且,突变后的最高效价也更高。
同现有技术相比,本发明的有益效果体现:
本发明以生产多黏菌素E的多黏芽孢杆菌作为出发菌株,采用特定的诱变方式和诱变程序进行诱变,克服了多黏芽孢杆菌表型延迟问题严重、对诱变剂敏感度低、筛菌效率低、重现性差的问题,提高了多黏菌素E效价水平和重现率。
附图说明
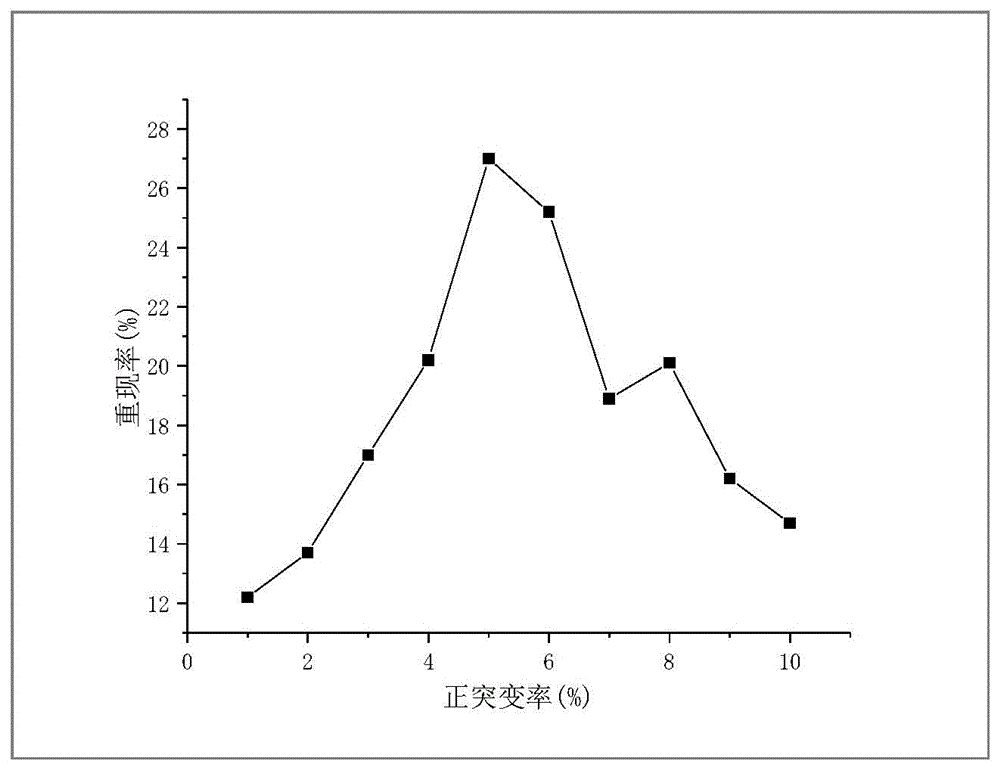
图1为多黏菌素E生产菌株正突变率与培养重现性的关系曲线。
具体实施方式
下面对本发明的实施例对本发明进行描述,所描述的实施例仅仅为本发明的一部分。本发明的实例用于说明本发明,但不能用来限制本发明的范围。
本发明中,如无特殊说明,实验方法为常规方法,所使用的实验材料为常规生化试剂。
本发明中,使用的菌种是公开专利CN 115466775A菌株编号为3-2-24的多黏类芽孢杆菌;
本发明中,除非特殊说明,试管斜面培养基的制备方法为,试管斜面培养基成分为:酵母抽提物0.4%,胰蛋白胨1.0%,氯化钠1.0%,琼脂粉2.0%,余量为水,pH调至7.2,试管规格20mm*220mm,装量20ml,经121℃灭菌30min。
本发明中,除非特殊说明,平板培养基的制备方法为,平板培养基成分为:酵母抽提物0.4%,胰蛋白胨1.0%,氯化钠1.0%,琼脂粉2.0%,余量为水,pH调至7.2,经121℃灭菌30min,分装至直径9cm的无菌平板,装量30ml。
本发明中,除非特殊说明,种子培养基的制备方法为,种子培养基成分:大豆蛋白胨1%,可溶性淀粉1%,硫酸铵0.5%,磷酸氢二钾0.1%,余量的水,pH调节7.0,分装30ml每250ml三角摇瓶,经121℃灭菌30min。
本发明中,除非特殊说明,发酵培养基的制备方法为,发酵培养基成分:玉米淀粉5%,黄豆饼粉2%,硫酸铵1%,磷酸氢二钾0.1%,余量的水,pH调节7.0,分装30ml每250ml三角摇瓶,经121℃灭菌30min。
本发明中,定义多黏菌素正突变株高于出发菌株的效价,即效价
本发明中紫外诱变用UV表示,常温常压等离子体诱变用ARTP表示。
对比例1
将多黏芽孢杆菌菌种3-2-24接到试管斜面培养基上,30℃静置培养1天。吸取10ml生理盐水洗脱表面菌体,振荡打散30min,得菌悬液1。
将菌悬液1接到试管斜面培养基上,30℃静置培养1天。吸取10ml生理盐水洗脱表面菌体,振荡打散30min,得菌悬液2。
将菌悬液2按1%接菌量接种子培养基,30℃摇床振荡培养16h,吸取10ml菌液4000rpm离心10min,弃上清,菌体用无菌生理盐水定容至10ml,振荡打散30min,得菌悬液3。
将菌悬液3按照菌悬液2的处理方式重复进行2次,分别得到菌悬4,菌悬液5。
分别将3-2-24菌种和菌悬液1~5分离涂布平板培养基,30℃静置培养2天得单菌落,挑取单菌落于种子培养基中,每组50瓶,30℃摇床振荡培养24h得种子液,种子液以10%接种量接于发酵,发酵30℃摇床振荡培养48h。检测效价,效价分布和筛菌率统计结果见下表。
以出发菌株(0)的最高效价26.5万u/ml为基准进行计算,统计高于26.5*1.05=27.825万u/ml以上的菌株数目,进而计算得到筛菌率,下同。
实施例1
将实施例1的菌悬液1使用UV处理,剂量为功率18W,时间15s,将处理后的菌液接到试管斜面培养基上,30℃静置暗培养1天。吸取10ml生理盐水洗脱表面菌体,振荡打散30min,得菌悬液1-1。
将菌悬液1-1使用UV处理,功率18W,时间15s,将处理后的菌液接到试管斜面培养基上,30℃静置暗培养1天。吸取10ml生理盐水洗脱表面菌体,振荡打散30min,得菌悬液1-2。
将菌悬液1-2使用UV处理,剂量为功率36W,时间30s,将处理后的菌液接到试管斜面培养基上,30℃静置暗培养1天。吸取10ml生理盐水洗脱表面菌体,振荡打散30min,得菌悬液1-3。
将菌悬液1-3使用UV处理,剂量为功率36W,时间45s,将处理后的菌液接到试管斜面培养基上,30℃静置暗培养1天。吸取10ml生理盐水洗脱表面菌体,振荡打散30min,得菌悬液1-4。
将菌悬液1-4使用UV处理,剂量为功率36W,时间90s,将处理后的菌液接到试管斜面培养基上,30℃静置暗培养1天。吸取10ml生理盐水洗脱表面菌体,振荡打散30min,得菌悬液1-5。
分别对菌悬液1-1,1-2……1-5分离涂布平板培养基,30℃静置培养2天得单菌落,挑取单菌落于种子培养基中,每组50瓶,30℃摇床振荡培养24h得种子液,种子液以10%接种量接于发酵,发酵30℃摇床振荡培养48h。检测效价,效价分布和筛菌率统计结果见下表。
实施例2
将对比例1的菌悬液1使用ARTP处理,剂量为功率80W,气量8SLM,时间30s,将处理后的菌液接到试管斜面培养基上,30℃静置培养1天。吸取10ml生理盐水洗脱表面菌体,振荡打散30min,得菌悬液2-1。
将菌悬液2-1使用ARTP处理,剂量为功率100W,气量12SLM,时间100s,将处理后的菌液接到种子培养基上,30℃振荡培养1天。吸取10ml菌液4000rpm离心10min,弃上清,菌体用无菌生理盐水定容至10ml,振荡打散30min,得菌悬液2-2。
将菌悬液2-2使用ARTP处理,剂量为功率120W,气量10SLM,时间200s,将处理后的菌液接到种子培养基上,30℃振荡培养1天。吸取10ml菌液4000rpm离心10min,弃上清,菌体用无菌生理盐水定容至10ml,振荡打散30min,得菌悬液2-3。
分别对菌悬液2-1,2-2……2-3分离涂布平板培养基,30℃静置培养2天得单菌落,挑取单菌落于种子培养基中,每组50瓶,30℃摇床振荡培养24h得种子液,种子液以10%接种量接于发酵,发酵30℃摇床振荡培养48h。检测效价,效价分布和筛菌率统计结果见下表。
实施例3
将对比例1的菌悬液1使用UV处理,剂量为功率18W,时间30s,将处理后的菌液接到试管斜面培养基上,30℃振荡暗培养1天。吸取10ml菌液4000rpm离心10min,弃上清,菌体用无菌生理盐水定容至10ml,振荡打散30min,得菌悬液3-1。
将菌悬液3-1使用ARTP处理,剂量为功率100W,气量10SLM,时间100s,将处理后的菌液接到种子培养基上,30℃振荡培养1天。吸取10ml菌液4000rpm离心10min,弃上清,菌体用无菌生理盐水定容至10ml,振荡打散30min,得菌悬液3-2。
将菌悬液3-2使用UV处理,剂量为功率36W,时间30s,将处理后的菌液接到种子培养基上,30℃振荡暗培养1天。吸取10ml菌液4000rpm离心10min,弃上清,菌体用无菌生理盐水定容至10ml,振荡打散30min,得菌悬液3-3。
将菌悬液3-3使用ARTP处理,剂量为功率100W,气量10SLM,时间100s,将处理后的菌液接到种子培养基上,30℃摇床暗培养1天。吸取10ml菌液4000rpm离心10min,弃上清,菌体用无菌生理盐水定容至10ml,振荡打散30min,得菌悬液3-4。
分别对菌悬液3-1,3-2……3-4分离涂布平板培养基,30℃静置培养2天得单菌落,挑取单菌落于种子培养基中,每组50瓶,30℃摇床振荡培养24h得种子液,种子液以10%接种量接于发酵,发酵30℃摇床振荡培养48h。检测效价,效价分布和筛菌率统计结果见下表。
实施例4
将对比例1的菌悬液1使用UV处理,剂量为功率18W,时间15s,将处理后的菌液接到试管斜面培养基上,30℃静置暗培养1天。吸取10ml生理盐水洗脱表面菌体,振荡打散30min,得菌悬液4-1。
将菌悬液4-1使用UV处理,功率36W,时间90s,将处理后的菌液接到试管斜面培养基上,30℃静置暗培养1天。吸取10ml生理盐水洗脱表面菌体,振荡打散30min,得菌悬液4-2。
将菌悬液4-2使用ARTP处理,剂量为功率80W,气量8SLM,时间50s,将处理后的菌液接到试管斜面培养基上,30℃静置暗培养1天。吸取10ml生理盐水洗脱表面菌体,振荡打散30min,得菌悬液4-3。
将菌悬液4-3使用ARTP处理,剂量为功率120W,气量12SLM,时间200s,将处理后的菌液接到试管斜面培养基上,30℃静置培养1天。吸取10ml生理盐水洗脱表面菌体,振荡打散30min,得菌悬液4-4。
对菌悬液4-4分离涂布平板培养基,30℃静置培养2天得单菌落,挑取单菌落于种子培养基中,共300瓶,30℃摇床振荡培养24h得种子液,种子液以10%接种量接于发酵三角瓶,发酵瓶30℃摇床振荡培养48h。检测效价。发酵效价分布24.3~30.2万u/ml,筛菌率5.7%。
将筛选的菌株接种子培养基中,每组5瓶,30℃摇床振荡培养24h得种子液。种子液以10%接种量分别接于发酵三角瓶,发酵瓶30℃摇床振荡培养48h。检测效价。发酵效价分布25.8~29.3万u/ml,重现率29.4%。
- 一种快速筛选黏细菌航天诱变变异菌株的方法
- 一种黑牛肝菌诱变菌株的快速筛选方法
