一种具有α-淀粉酶抑制作用的刺参活性肽及其应用
文献发布时间:2024-04-18 19:58:53
技术领域
本发明涉及生物活性肽技术领域,更具体的说是涉及一种具有α-淀粉酶抑制作用的刺参活性肽及其在制备降血糖制品中的应用。
背景技术
随着城市化发展以及人们饮食结构的改变,糖尿病(diabetes mellitus,DM)及其并发症已成为危害人类健康的主要疾病之一。据国际糖尿病联盟(IDF)估计,到2045年,大约7.83亿人可能受到DM的影响,其中2型糖尿病(Type 2diabetes mellitus,T2DM)占绝大多数,约90%。研究表明,α-淀粉酶和α-葡萄糖苷酶是治疗T2DM的靶点,通过抑制其活性,可降低多糖转化为单糖的速度,进而缓解葡萄糖的生成速率是防治糖尿病的一个重要手段。目前,基于α-淀粉酶和α-葡萄糖苷酶的降糖药物已经开发出来,但这些抑制剂都有副作用,长期服用会导致各种不良反应,如:胃肠道不适、低血糖、体重增加、肝肾功能受损、血糖漂移等。
临床上常用的碳水化合物水解酶抑制剂主要是通过可逆性的与α-葡萄糖苷酶结合,进而减缓寡糖水解成葡萄糖的速度。对α-淀粉酶抑制效果不明显,无法减缓碳水化合物水解为寡糖的速度。近年来,针对碳水化合物水解酶来研究特定的药物,尤其是从天然产物中寻找高效、低毒且廉价的活性成分,已成为糖尿病新药研究的热点。特别是从优质蛋白质中制备具有α-淀粉酶抑制活性的血糖调节肽可作为一种新型天然的降血糖成分进行膳食干预,辅助解决糖尿病人饮食与血糖控制的问题,具有较高的潜在价值。
海参纲仿刺参属,又称刺参。由于刺参特殊的进化地位、独特的繁殖生活史以及夏眠、排脏与再生、自溶等生物学现象,使其具有重要的科学研究价值。此外,刺参体壁的蛋白质含量在85%以上,其中胶原蛋白占40%-70%。而且,刺参体壁还含有多种活性肽,具有抗氧化、降血压、免疫调节、降血脂和降血糖等多种生理活性,但其在糖尿病改善中的作用机制尚未完全阐明。因此,有必要对刺参活性肽进行筛选并进一步分析探讨其降血糖机制,获得其中的降糖活性物质对于新的将糖食品、保健品及生物医药制品的研发具有重要意义。
发明内容
针对上述问题,本发明利用虚拟筛选结合网络药理学筛选刺参活性肽并分析刺参胶原蛋白肽中降血糖机制,获得其中的降糖活性物质对于新的降糖食品、保健食品及生物医药制品的研发具有重要意义。
本发明公开了具有α-淀粉酶抑制作用的刺参活性肽,其氨基酸序列分别为:
Asn-Gly-Asp-Pro-Gly-Leu,SEQ ID NO.9;
或Gly-Asp-Pro-Val-Gly-Ala-Gly-Arg,SEQ ID NO.19;
或Ser-Gly-Asn-Pro-Gly-Lys,SEQ ID NO.20。
本发明的具有α-淀粉酶抑制作用的刺参活性肽,可用于制备有助于降低血糖的食品、保健品及生物医药制品。
优选的,在上述应用中,刺参活性肽Asn-Gly-Asp-Pro-Gly-Leu的IC50值为0.102mg/ml。
优选的,在上述应用中,刺参活性肽Ser-Gly-Asn-Pro-Gly-Lys的IC50值为0.319mg/mL。
优选的,在上述应用中,刺参活性肽Gly-Asp-Pro-Val-Gly-Ala-Gly-Arg肽的IC50值为0.141mg/mL。
为了实现上述目的,本发明采用如下技术方案:
(1)刺参活性肽的筛选
本发明借助在线酶切工具PeptideCutter对刺参胶原蛋白序列(来自NCBI网站,登录号为APA22677.1)进行虚拟酶切,筛选从二肽到九肽的活性肽段,并消除重复肽后,获得106条肽序列片段。对所得到的肽片段使用PeptideRanker工具、ToxinPred工具和PeptidesHGAT-Search数据库对活性肽进行生物活性概率打分、毒性预测和未知作用的活性肽筛选,得到26条具有良好生物活性且无毒性的生物活性肽。
通过Swiss Target Prediction平台,对筛选出的26条潜在活性肽段进行靶点预测,基于GeneCards、OMIM-GENE-MAP和Therapeutic Target Database数据库筛选T2DM靶点,汇总药物和疾病基因靶点,通过Venny.2.1.0获取潜在活性肽段与T2DM的272个共同靶点,绘制韦恩图。将上述筛选的272个交集靶点导入STRING数据库,构建PPI网络,进一步得到57个关键靶点。
利用DAVID Bioinformatics Resources数据库对57个关键靶点进行GO和KEGG通路富集分析,研究关键靶点投射的GO功能及KEGG信号通路与T2DM之间的相互关系,明确刺参活性肽可能的药理机制和在体内可能的生物过程。并进行了分子对接验证,得到了3条与糖尿病关键靶点的受体蛋白结合能力强的刺参活性肽NGDPGL、SGNPGK和GDPGVAGR。
(2)体外α-淀粉酶抑制活性测定
通过分光光度法测定刺参活性肽NGDPGL、SGNPGK和GDPGVAGR对α-淀粉酶的抑制活性。用pH6.9的磷酸盐缓冲溶液(0.02M)稀释不同浓度的肽溶液,加入等体积的α-淀粉酶溶液,37℃孵育10min,然后加入可溶淀粉溶液,沸水浴10min。然后加入3,5-二硝基水杨酸颜色指示剂终止反应,沸水浴10min后加入10mL蒸馏水稀释混合液,于540nm波长初测定吸光度值。
利用下列公式下面公式计算多糖样品对于α-淀粉酶的抑制率:
α-淀粉酶抑制率(%)=[1-(A
其中,A
本发明与现有技术相比,具有以下有益效果:
本发明从刺参胶原肽蛋白中筛选得到了能够有效抑制α-淀粉酶活性的肽NGDPGL、SGNPGK和GDPGVAGR,并明确了活性肽与α-淀粉酶活性位点的分子作用机制。活性肽NGDPGL、SGNPGK和GDPGVAGR能够高效抑制α-淀粉酶的活性,减缓碳水化合物水解为寡糖的速度,因此可作为降血糖功能成分用于食品、保健品和生物医药制品中,具有良好的应用前景。
附图说明
图1为:26条潜在的刺参活性肽段对应的潜在靶点图;
图2为:刺参活性肽-T2DM交集靶点的韦恩图;
图3为:刺参活性肽-T2DM的272个共同靶点构建的蛋白质互作网络(PPI)图;
图4为:刺参活性肽-T2DM的57个关键靶点构建的蛋白质互作网络(PPI)图,黄色为刺参活性肽的57个关键靶点,绿色为degree值小于二倍中位数的靶点;
图5为:刺参活性肽-T2DM的57个关键靶点GO通路富集分析图;
图6为:刺参活性肽-T2DM的57个关键靶点KEGG通路富集分析图;
图7a为:刺参活性肽NGDPGL与糖尿病关键靶点3CQW分子的对接模式图;
图7b为:刺参活性肽NGDPGL与糖尿病关键靶点5AX3分子的对接模式图;
图7c为:刺参活性肽SGNPGK与糖尿病关键靶点5VZU分子的对接模式图;
图7d为:刺参活性肽GDPGVAGR与糖尿病关键靶点2SRC分子的对接模式图;
图7e为:刺参活性肽GDPGVAGR与糖尿病关键靶点4IZ5分子的对接模式图;
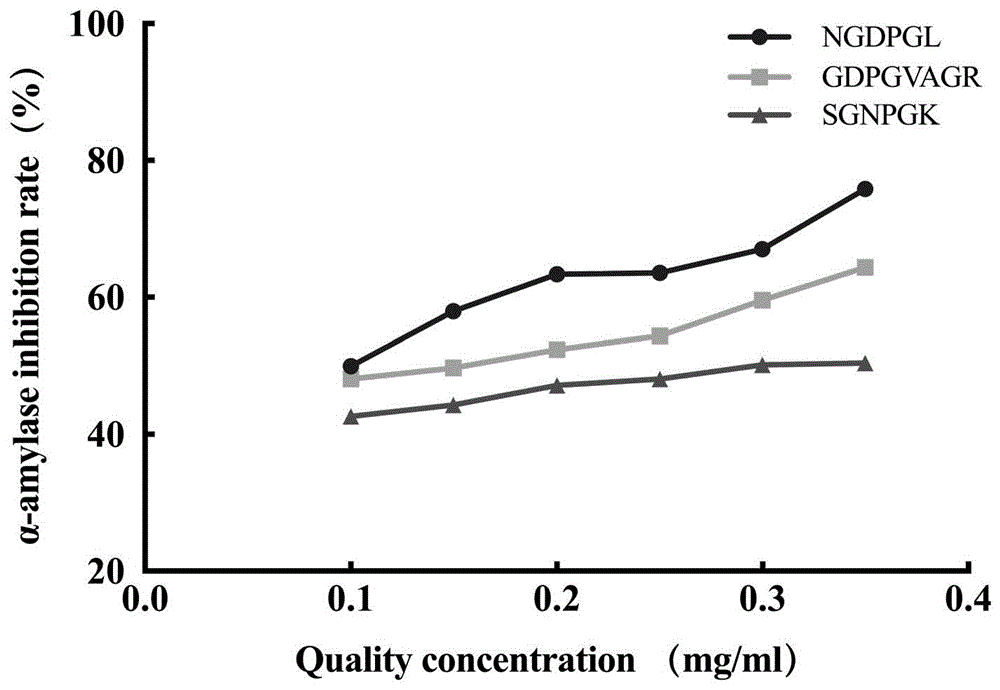
图8为:刺参活性肽NGDPGL、SGNPGK和GDPGVAGR对α-淀粉酶的抑制活性试验结果图。
具体实施方式
下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明实施例所涉及的试剂均为市售渠道采购,未提及的方法为常规实验方法,在此不再一一赘述。
实施例1具有α-淀粉酶的抑制作用的刺参活性肽的筛选
1.潜在生物活性肽筛选及性质预测
从NCBI网站(https://www.ncbi.nlm.nih.gov/)获得刺参胶原蛋白的氨基酸序列(1400个氨基酸,登录号APA22677.1),通过Peptide Cutter在线工具进行蛋白质的模拟酶切,具体为:将胶原蛋白的氨基酸序列输入到Peptide Cutter的对话框中,选择pepsinph1.3,trypsin,chymotrypsin-low specificity(C-term to[FYW],notbefore P)3种酶对该蛋白进行模拟酶解,筛选从二肽到九肽的活性肽段,并消除重复肽后,获得106条肽序列片段。
使用Peptide Ranker工具对虚拟酶解后所得到的肽片段进行分析,筛选Score大于0.5的活性肽(即,活性良好的肽);使用ToxinPred工具对活性肽进行毒性预测,进一步筛选出无毒活性肽;同时为避免与其他已知的活性肽进行重复性研究,使用Peptides HGAT-Search数据库再进一步筛选未知作用的无毒活性肽,最终得到肽段26条,如表1所示。
表1
2.PPI网络构建与关键靶点筛选
通过Swiss Target Prediction平台,对实施例1筛选出的26条潜在活性肽段进行靶点预测,具体为:选择“Homo sapiens”种属,其他参数默认,筛选结果包括蛋白质名称、Uniprot ID等信息,结果表明26条潜在活性肽段对应的潜在靶点共有359个(见图1);基于Gene Cards、OMIM-GENE-MAP和Therapeutic Target Database数据库筛选T2DM靶点,共得T2DM靶点5206个,以“Type 2diabetes mellitus”为关键词进行筛选,将上述的数据库收集的与T2DM相关的靶点取并集。汇总药物和疾病基因靶点,通过在线网站Venny.2.1.0获取26条潜在活性肽段与T2DM的共同靶点,得272个,绘制韦恩图,见图2。
将上述筛选的272个交集靶点导入STRING数据库,构建PPI网络,结果见图3。选取交集靶点PPI网络中各节点连接度的2倍中位数值为最低阈值进行靶点筛选,共得到关键靶点57个,对57个关键靶点进行PPI网络构建,结果见图4。
由图4可知,刺参酶解肽治疗T2DM的57个关键靶点中,CCND1(G1/S-特异性周期蛋白-D1,细胞周期蛋白依赖性激酶CDKs的调控者)连接度最高。
PPI网络中各靶点之间分布统计见表2。
表2
由表2可知,与其他靶点的连接数量排名前5的靶点蛋白分别为CCND1、SRC、STAT3、AKT1、MAPK1,其在PPI网络中与其他靶点的连接数量分别为38、35、28、27、27个,在PPI网络中连接度较高。
靶点蛋白CCND1、SRC、STAT3、AKT1、MAPK1与其他靶点的相互作用值,见表3.1-表3.2。
表3.1
表3.2
CCND1是人类疾病中一个关键的细胞周期主控因子,而细胞周期蛋白依赖性激酶(CDK2、CDK4、CDK6)是调控细胞周期进程的重要蛋白,其活性受CCND1调节。由表3.1-表3.2可知,在蛋白互作PPI中,细胞周期蛋白依赖性激酶(CDK2、CDK4、CDK6)与CCND1相互作用值为0.999,表明其相互作用程度较高。推测CCND1通过调节CDK2、CDK4和CDK6等靶点,进而作用于胰岛素受体,降低血糖水平。
3.GO和KEGG通路富集分析
将上述57个关键靶点输入DAVID Bioinformatics Resources数据库(https://david.ncifcrf.gov/),标识符限定为“OFFICIAL-GENE-SYMBOL”,物种限定为“Homospaiens”,列表类型限定为“Gene List”,以P<0.05为基本标准,分别进行GO功能富集分析和KEGG通路富集。
1)GO富集分析结果按P值从小到大排序,选取前20条GO条目,绘制柱状图(如图5),GO分析包括生物学过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molec-ular function,MF)3个方面,各得到20个条目。对于生物学过程,主要涉及蛋白质分解代谢过程(protein catabolic process)、蛋白质分解的调节(regulationof proteolysis)、细胞对化学压力的反应(cellularresponse to chemical stress)、对肽类激素的反应(response to peptide hormone)、信号受体活动的调节(regulationofsignaling receptor activity)、对生长因子的反应(response to growth factor)等生物过程;对于细胞组分,主要涉及蛋白酶体复合体(proteasome complex)、内肽酶复合体(endopeptidase complex)、肽酶复合体(peptidase complex)、蛋白酶体核心复合物(proteasome core complex)、细胞内含蛋白复合物(intracellularprotein-containingcomplex)等组分;对于分子功能,主要涉及作用于内肽酶活性(endopeptidase activity)、激酶结合(kinase binding)、蛋白丝氨酸/苏氨酸/酪氨酸激酶活性(protein serine/threonine/tyrosine kinase activity)、胰岛素受体底物结合(insulin receptorsubstrate binding)等功能。
通过GO富集分析可知,刺参活性肽在生物过程、细胞成分及分子功能水平会调节蛋白酶体等通路及其相关途径,而内肽酶活性、激酶结合、蛋白丝氨酸/苏氨酸/酪氨酸激酶活性和胰岛素受体底物结合等功能,也说明可对胰岛素受体作用,从而影响糖尿病相关途径及其并发症。
2)按照P值从小到大筛选出前20条KEGG功能富集通路(见图6),其中,蛋白酶体(Proteasome),广泛分布于细胞质和细胞核中,具有多种蛋白水解酶活性,并且具有泛素依赖性,其中“泛素-蛋白酶体”系统(UPS)的分子功能是细胞蛋白质降解,去除受损的蛋白质,这种功能应用于许多生物过程,包括炎症、增殖和细胞凋亡。越来越多的证据也表明,UPS在糖尿病的胰腺β细胞转分化中也发挥着关键作用,可以作为糖尿病疾病的靶向治疗药物。
催乳素信号通路(Prolactin signaling pathway)是神经内分泌和免疫系统之间双向通讯的介质之一。它参与许多免疫调节活动,影响B和T淋巴细胞的分化和成熟,并增强炎症反应和免疫球蛋白的产生。催乳素(PRL)在增加β细胞增殖、刺激胰岛素的分泌、阻止胰岛细胞凋亡通路上蛋白水解酶的活性以及调节免疫系统对胰岛素的敏感性方面发挥着重要作用。因此,PRL在葡萄糖代谢紊乱中可以发挥重要作用。
AGE-RAGE信号通路是糖尿病肾病的形成和进展中非常重要的一环,在调节T2DMTNF-α的产生和表达、氧化应激和内皮功能中起重要作用。在衰老的过程中,以及肾衰竭、炎症,特别是糖尿病情况下,晚期糖基化终末产物(advanced glycation end products,AGEs)的形成和沉积都会加速。针对RAGE信号通路调节剂的治疗,可能具有减轻糖尿病并发症发生的作用。TNF-α信号传导途径通过活化的内皮介导炎性细胞黏附的迁移参与T2DM肾病患者慢性肾脏疾病的发展。
通过KEGG富集分析可知,在已发现的57个关键靶点中,CCND1、CDK4、SRC、STAT3等已被证明可通过参与生物过程来调节体内的葡萄糖代谢,调节免疫系统对胰岛素的敏感性,进而,有效降低血糖水平,缓解胰岛素抵抗。
综上,海参活性肽可通过调控多个生物学过程、多条信号通路作用与T2MD。
4.分子对接验证
将筛选出的26条刺参活性肽片段的.sdf格式的结构信息,通过ChemDraw 19.0软件在分子力学(molecular mechanics,MM2)立场下使之能量最小化,得到成分的.mol2格式的3D结构信息。
使用DiscoveryStudio2017软件对配体小分子进行添加极性氢原子后保存相应的.pdbqt格式。再从PDB数据库(http://www.rcsb.org/)获得蛋白质受体的晶体结构,去除水分子和配体,并进行“Clean Protein”以及“Prepare Protein”的前处理操作,以.pdb格式保存。利用DiscoveryStudio2017软件将处理好的配体与蛋白进行批量对接。
将上述信息处理的26条肽段分别与导致机体出现糖尿病的主要受体二肽基肽酶-4(PDB ID:2OQV)、α-葡萄糖苷酶(PDB ID:2QMJ)和α-淀粉酶(PDB ID:1IR3)进行DS分子对接,通过其结合能大小对刺参中活性肽段作用于糖尿病受体的程度进行预测打分,结果见表4。
表4
结合能越低,表明受体与配体间的亲和力越高,按结合能高低顺序,将表3中分数前十的活性肽段与糖尿病关键靶点CCND1(PDBID:5VZU),SRC(PDBID.2SRC),STAT3(PDBID:5AX3),AKT1(PDBID:3CQW)和MAPK1(PDBID:4IZ5)进行对接,根据活性肽的结合能大小对其进行评分,以预测其对糖尿病受体的作用程度,结果如表5。
表5
由表5可见,肽段NGDPGL与关键靶点受体蛋3CQW和5AX3结合能最低的分别为-102.568kcal/mol和-102.48kcal/mol,分子对接结合模式分别见图7a-7b;肽段SGNPGK与关键靶点受体蛋白5VZU结合能最低,且为-96.312kcal/mol,分子对接结合模式见图7c;肽段GDPGVAGR虽然与5VZU、3CQW和5AX3未对接成功(结合能为0,可能是由于肽段结构过大,无法与受体蛋白口袋对接),但其与关键靶点受体蛋白2SRC和4IZ5结合能最低分别为-108.52kcal/mol和-122.357kcal/mol,分子对接结合模式分别见图7d-7e,说明这三条肽段与受体蛋白结合能力强于其他活性肽段,进而抑制T2MD潜在能力较强。
由图7a可知,活性肽段NGDPGL和受体3CQW发生相互作用,并与GLU234发生疏水作用。重要的是,它与LYS179、LYS158、PHE161、THR1690、GLY162、GLY159等残基形成氢键,并与PHE 442和VAL164等关键氨基酸形成其他分子间作用力。
由图7b可知,活性肽段NGDPGL和受体5AX3发生相互作用,肽段NGDPGL与残基ASP140、ASN145、GLU24、ASP102和GLU360分别形成氢键,这是肽段NGDPGL与受体蛋白5AX3的主要作用。进一步说明活性活性肽段NGDPGL与靶点具有良好的结合能力。
由图7c可知,活性肽段SGNPGK和受体5VZU发生相互作用,肽段SGNPGK与残基TRP249、LYS273、GLU253、LEU314、HIS312、GLY209和TYR208分别形成氢键,这是肽段SGNPGK与受体蛋白5VZU的主要作用。
由图7d可知,活性肽段GDPGVAGR和受体2SRC发生相互作用,肽段GDPGVAGR与残基PRO246、GLU320、LYS152、SER372和GLU157分别形成氢键,这是肽段GDPGVAGR与受体蛋白2SRC的主要作用。
由图7e可知,活性肽段GDPGVAGR和受体4IZ5发生相互作用,GDPGVAGR与TYR113、SER153等具有疏水作用,这些残基构成疏水口袋;最重要的是肽段GDPGVAGR与残基ASN154、CYS166、ALA35L、YS114和TYR30分别形成氢键,这是肽段GDPGVAGR与受体蛋白4IZ5的主要作用。以上的作用力可以很好帮助活性肽段结合在受体蛋白上,进而发挥其抑制作用。
经分子对接后与对接受体结合作用较强,分析可知,活性肽NGDPGL、GDPGVAGR和SGNPGK对T2MD有潜在的抑止作用,可进一步应用于对二型糖尿病的治疗等过程。
实施例2验证刺参活性肽对α-淀粉酶的抑制作用
肽段NGDPGL、SGNPGK和GDPGVAGR由南京肽谷生物科技有限公司合成,可提供合成检验合格报告。
用pH6.9的磷酸盐缓冲溶液(0.02M)将肽段NGDPGL、SGNPGK和GDPGVAGR分别进行稀释(梯度为0.1mg/ml、0.15mg/ml、0.2mg/ml、0.25mg/ml、0.2mg/ml、0.35mg/ml)备用,分别取各稀释梯度的对应肽段溶液500μL与6U/ml的a-淀粉酶溶液等体积混合均匀,37℃条件下孵育10min,向混合液中加入1mL浓度为1%的可溶淀粉溶液,沸水浴10min。然后加入3.5-二硝基水杨酸颜色指示剂终止反应,沸水浴10min后加入10mL蒸馏水稀释混合液,于540nm波长处测定吸光度值。利用下列公式下面公式计算多糖样品对于α-淀粉酶的抑制率:
α-淀粉酶抑制率(%)=[1-(A
其中,A
利用Graphpad Prism软件将上述各浓度梯度的活性肽的α-淀粉酶抑制率计算数值带入Y=100/(1+10^((LogIC50-X)*HillSlope)),将浓度作为X轴数据,α-淀粉酶抑制率作为Y轴数据,对横坐标浓度进行log10对数处理,经软件非线性拟合后即得函数图。
如图8所示的肽段NGDPGL、SGNPGK和GDPGVAGR对α-淀粉酶的抑制活性试验检测结果图可知:活性肽对α-淀粉酶的抑制呈剂量依赖趋势,随质量浓度增加对该酶的抑制率也逐渐增加,NGDPGL、SGNPGK与GDPGVAGR对α-淀粉酶抑制率的IC50值分别为0.102mg/ml、0.319mg/mL和0.141mg/mL。
实施例3α-淀粉酶的抑制肽NGDPGL、SGNPGK、GDPGVAGR的应用
在实际生产中,α-淀粉酶的抑制肽NGDPGL、SGNPGK、GDPGVAGR可通过固相合成法或定向生物酶解及纯化获得,制备成颗粒状、粉末状或溶于水的液体添加到食品、保健品及生物医药制品中,有助于降低血糖水平,制备减肥类食品、保健品及降血糖药品。
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- 一种具有淀粉酶抑制活性基团的新型抗性淀粉的制备方法及应用
- 一种具有抗氧化活性的裂壶藻肽螯合钙的制备方法
- 一种具有α-葡萄糖苷酶和α-淀粉酶抑制活性的六肽及其应用
- 一种具有α-淀粉酶抑制活性的降血糖海参肽及其制备方法和应用
