一种调控细胞成骨分化的调控方法
文献发布时间:2024-04-18 19:58:53
技术领域
本发明涉及细胞成骨分化技术领域,尤其涉及一种调控细胞成骨分化的调控方法。
背景技术
间充质干细胞(MSC)是干细胞家族的重要成员,来源于发育早期的中胚层,属于一种多功能干细胞,主要存在于结缔组织和器官间质中,以骨髓组织中含量最为丰富,由于骨髓是其主要来源,因此又称为骨髓间充质干细胞。它具有干细胞的所有共性,即自我更新和多向分化能力,间充质干细胞最初在骨髓中发现,因其具有多向分化潜能、造血支持和促进干细胞植入、免疫调控和自我复制等特点而日益受到人们的关注,间充质干细胞在体内或体外特定的诱导条件下,可分化为骨骼、软骨、脂肪、肌腱、韧带、神经、肝、心肌等多种组织细胞,连续传代培养和冷冻保存后仍具有多向分化潜能,可作为理想的种子细胞用于衰老和病变引起的组织器官损伤修复,
骨缺损在骨科中相当常见,创伤、炎症和骨肿瘤等原因导致的骨缺损难以自身愈合,骨缺损是骨科医师经常需要面对的重要挑战,目前骨缺损的治疗主要以骨移植为主。随着组织工程和再生医学的快速发展,通过诱导间充质干细胞成骨分化的治疗方式受到越来越大的关注,可诱导间充质干细胞成骨分化并促进缺损处骨再生,由此,一些调控间充质干细胞成骨分化的方法开始不断出现,例如公开号为CN107075476B的中国专利申请,其公开了“使用水凝胶诱导干细胞三维成骨分化的方法”,但是该方法是通过化学诱导的方式进行调控,这种采用诱导的方式调控间充质干细胞成骨分化的方式需要从外界获取信息,其成骨分化方向取决于所在的诱导方式的准确性以及成骨环境的稳定性,没有实现明确的成骨诱导效果,因此其调控过程比较漫长,操作难度大,存在着一定的不确定性,调控时间和成骨分化成本较高。
发明内容
为解决现有技术存在的采用化学诱导的方式调控间充质干细胞成骨分化的方式调控过程比较漫长,操作难度大,存在着一定的不确定性,调控时间和成骨分化成本较高的技术问题,本发明提供了如下技术方案。
本发明一种调控细胞成骨分化的调控方法,包括如下步骤:
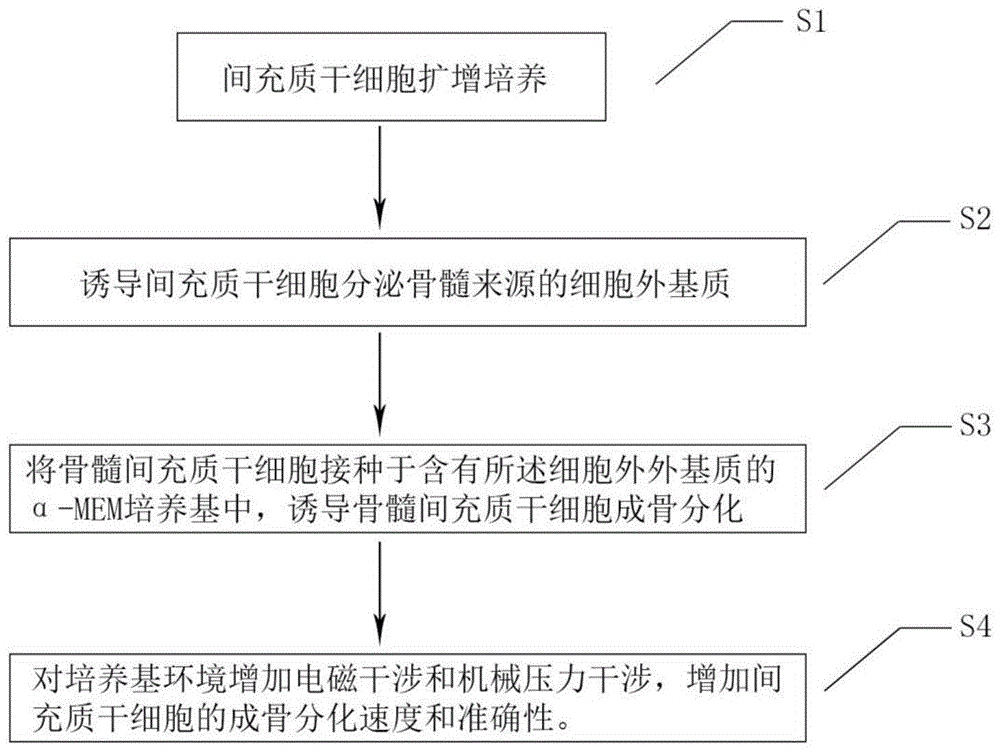
S1:间充质干细胞扩增培养;取骨髓间充质干细胞在α-MEM培养基中加入3%-10%的胎牛血清、链霉素100mg/L、青霉素100U/L,在满足36.8℃-37.5℃以及4%-5%CO2的条件下培养扩增骨髓间充质干细胞;
S2:将骨髓间充质干细胞在六孔板中以每孔1×104个细胞的密度接种,用含5%-10%的无胎牛血清FBS和抗坏血酸30mg/L-50mg/L的培养基诱导间充质干细胞分泌骨髓来源的细胞外基质(ECM),之后用非离子型表面活性剂及20mM NH4OH的磷酸缓冲盐溶液PBS进行脱细胞步骤,获得脱细胞后的骨髓来源的细胞外基质(ECM);
S3:将骨髓间充质干细胞接种于含有所述细胞外外基质(ECM)的α-MEM培养基中,诱导骨髓间充质干细胞成骨分化。
S4:对培养基环境增加电磁干涉和机械压力干涉,增加间充质干细胞的成骨分化速度。
作为进一步的技术方案,所述S1的步骤中每3-4天更换一次培养基。
作为进一步的技术方案,所述步骤S1中,每2-3天采用0.25%胰酶消化方式进行传代培养。
作为进一步的技术方案,在S3步骤中为了诱导成骨分化,在细胞达到80-90%融合时,培养基中加入10mMβ-甘油磷酸、100nM地塞米松和200μM抗坏血酸。
作为进一步的技术方案,所述步骤S4中,通过每12小时改变外加磁场引起细胞所处磁电微环境改变。
作为进一步的技术方案,所述外加磁场为动态变化的磁场,使细胞接受动态电磁微环境刺激。
作为进一步的技术方案,所述步骤S4中,所述机械压力干涉采用外部加压方式进行。
作为进一步的技术方案,所述机械压力模拟体内骨骼微环境的机械压力且持续供压。
作为进一步的技术方案,所述步骤S3中,用小干扰RNA转染骨髓间充质干细胞,小干扰RNA混合物转移到6孔板为36.8℃-37.5℃孵箱中孵育8小时,置换培养基后,将骨骼间充质干细胞培养在含有细胞外基质(ECM)的α-MEM培养基中。
作为进一步的技术方案,所述步骤S3中,骨髓间充质干细胞成骨分化培养在二维平面上。
本发明的有益效果,本发明通过扩增间充质干细胞后,再培养间充质干细胞成骨分化所需的细胞外基质(ECM),使间充质干细胞在成骨分化所需的微环境内生长并定向成骨分化;在成骨分化微环境内提供动态磁电微环境和机械应力环境,诱导间充质干细胞定向成骨分化的同时,使调控细胞成骨分化的过程相对缩短,提高成骨分化的调控效率;且间充质干细胞在细胞外基质(ECM)微环境内的动态磁电微环境和机械应力环境的作用下,其成骨分化准确性较高,且减小了操作难度,降低了调控时间和成骨分化的成本,使间充质干细胞定向成骨分化具有较佳的安全性及可控性。
附图说明
图1是本发明调控细胞成骨分化的调控方法的流程图;
图2示出实施例1的细胞成骨分化的电镜图。
图3示出实施例2的细胞成骨分化的电镜图。
图4示出实施例3的细胞成骨分化的电镜图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
细胞外基质(ECM)是细胞成骨分化的重要组成部分,向间充质干细胞(MSC)提供重要的力学和化学信号;同时,间充质干细胞(MSC)也通过分泌基质中的蛋白水解修饰基质蛋白和生长因子来影响细胞外基质(ECM)的性质。
由此,本发明一种调控细胞成骨分化的调控方法,包括如下步骤:
S1:间充质干细胞扩增培养;取骨髓间充质干细胞在α-MEM培养基中加入3%-10%的胎牛血清、链霉素100mg/L、青霉素100U/L,在满足36.8℃-37.5℃以及4%-5%CO2的条件下培养扩增骨髓间充质干细胞;
在本步骤S1中,每3-4天更换一次培养基。为提供骨髓间充质干细胞的扩增速度,所述步骤S1中,对骨髓间充质干细胞每2-3天采用0.25%胰酶消化方式进行传代培养。
S2:将骨髓间充质干细胞在六孔板中以每孔1×104个细胞的密度接种,用含5%-10%的无胎牛血清FBS和抗坏血酸30mg/L-50mg/L的培养基诱导间充质干细胞分泌骨髓来源的细胞外基质(ECM),之后用非离子型表面活性剂及20mM NH4OH的磷酸缓冲盐溶液PBS进行脱细胞步骤,获得脱细胞后的骨髓来源的细胞外基质(ECM);
S3:将骨髓间充质干细胞接种于含有所述细胞外外基质(ECM)的α-MEM培养基中,诱导骨髓间充质干细胞成骨分化。
在所述步骤S3中,用小干扰RNA转染骨髓间充质干细胞,小干扰RNA混合物转移到6孔板为36.8℃-37.5℃孵箱中孵育8小时,置换培养基后,将骨骼间充质干细胞培养在含有细胞外基质(ECM)的α-MEM培养基中。所述步骤S3中,骨髓间充质干细胞成骨分化培养在二维平面上,当然也可以定向培养的三维结构上,例如生物相容性支架上,模拟骨骼结构促进细胞的定向成骨分化的准确性。在S3步骤中为了诱导成骨分化,在细胞达到80-90%融合时,培养基中加入10mMβ-甘油磷酸、100nM地塞米松和200μM抗坏血酸。
S4:对培养基环境增加电磁干涉和机械压力干涉,增加间充质干细胞的成骨分化速度。所述步骤S4中,通过每12小时改变外加磁场引起细胞所处磁电微环境改变。优选的是,所述外加磁场为动态变化的磁场,使细胞接受动态电磁微环境刺激。所述步骤S4中,所述机械压力干涉采用外部加压方式进行。所述机械压力模拟体内骨骼微环境的机械压力且持续供压。
实施例1:
S1:用骨片贴壁法培养小鼠骨片来源的间充质干细胞(MSC)。对间充质干细胞(MSC)扩增培养,采用无诱导因子的α-MEM培养基,加入10%的胎牛血清、链霉素100mg/L、青霉素100U/L,在满足37.5℃以及5%CO2的条件下培养扩增骨髓间充质干细胞;对骨髓间充质干细胞每2天采用0.25%胰酶消化方式进行传代培养,每4天更换一次培养基。
S2:将骨髓间充质干细胞在六孔板中以每孔1×104个细胞的密度接种,用含10%的无胎牛血清FBS和抗坏血酸50mg/L的培养基诱导间充质干细胞分泌骨髓来源的细胞外基质(ECM),之后用非离子型表面活性剂及20mM NH4OH的磷酸缓冲盐溶液PBS进行脱细胞步骤,获得脱细胞后的骨髓来源的细胞外基质(ECM)。
S3:将骨髓间充质干细胞接种于含有所述细胞外外基质(ECM)的α-MEM培养基中,诱导骨髓间充质干细胞成骨分化。操作时,用小干扰RNA转染骨髓间充质干细胞,小干扰RNA混合物转移到6孔板为37.5℃孵箱中孵育8小时,置换培养基后,将骨骼间充质干细胞培养在含有细胞外基质(ECM)的α-MEM培养基中。在S3步骤中为了诱导成骨分化及保证成骨分化微环境的稳定性,在细胞达到80-90%融合时,培养基中加入10mMβ-甘油磷酸、100nM地塞米松和200μM抗坏血酸。
S4:细胞贴壁后,接受每12小时变换一次的动态电磁微环境刺激(通过外加磁场进行动态调控),通过改变外加磁场引起细胞所处磁电微环境改变。同时,外部施加机械应力于所述微环境,所述机械压力模拟体内骨骼微环境的机械压力且持续供压。
成骨分化完成后,检测间充质干细胞(MSC)成骨分化情况,使用茜素红染色:加入适量茜素红染液染3~5min,吸去茜素红染液,用1×PBS清洗两次,并加入适量1×PBS避免细胞干燥。
图1示出实施例1的细胞成骨分化的电镜图。
实施例2:
S1:用骨片贴壁法培养小鼠骨片来源的间充质干细胞(MSC)。对间充质干细胞(MSC)扩增培养,采用无诱导因子的α-MEM培养基,加入3%的胎牛血清、链霉素100mg/L、青霉素100U/L,在满足36.8℃以及4%CO2的条件下培养扩增骨髓间充质干细胞;对骨髓间充质干细胞每3天采用0.25%胰酶消化方式进行传代培养,每3天更换一次培养基。
S2:将骨髓间充质干细胞在六孔板中以每孔1×104个细胞的密度接种,用含5%的无胎牛血清FBS和抗坏血酸50mg/L的培养基诱导间充质干细胞分泌骨髓来源的细胞外基质(ECM),之后用非离子型表面活性剂及20mM NH4OH的磷酸缓冲盐溶液PBS进行脱细胞步骤,获得脱细胞后的骨髓来源的细胞外基质(ECM)。
S3:将骨髓间充质干细胞接种于含有所述细胞外外基质(ECM)的α-MEM培养基中,诱导骨髓间充质干细胞成骨分化。操作时,用小干扰RNA转染骨髓间充质干细胞,小干扰RNA混合物转移到6孔板为36.8℃孵箱中孵育8小时,置换培养基后,将骨骼间充质干细胞培养在含有细胞外基质(ECM)的α-MEM培养基中。在S3步骤中为了诱导成骨分化及保证成骨分化微环境的稳定性,在细胞达到80-90%融合时,培养基中加入10mMβ-甘油磷酸、100nM地塞米松和200μM抗坏血酸。
S4:细胞贴壁后,接受每12小时变换一次的动态电磁微环境刺激(通过外加磁场进行动态调控),通过改变外加磁场引起细胞所处磁电微环境改变。同时,外部施加机械应力于所述微环境,所述机械压力模拟体内骨骼微环境的机械压力且持续供压。
成骨分化完成后,检测间充质干细胞(MSC)成骨分化情况,使用茜素红染色:加入适量茜素红染液染3~5min,吸去茜素红染液,用1×PBS清洗两次,并加入适量1×PBS避免细胞干燥。
图2示出实施例2的细胞成骨分化的电镜图。
实施例3:
S1:用骨片贴壁法培养小鼠骨片来源的间充质干细胞(MSC)。对间充质干细胞(MSC)扩增培养,采用无诱导因子的α-MEM培养基,加入6%的胎牛血清、链霉素100mg/L、青霉素100U/L,在满足37℃以及4.5%CO2的条件下培养扩增骨髓间充质干细胞;对骨髓间充质干细胞每2天采用0.25%胰酶消化方式进行传代培养,每4天更换一次培养基。
S2:将骨髓间充质干细胞在六孔板中以每孔1×104个细胞的密度接种,用含8%的无胎牛血清FBS和抗坏血酸50mg/L的培养基诱导间充质干细胞分泌骨髓来源的细胞外基质(ECM),之后用非离子型表面活性剂及20mM NH4OH的磷酸缓冲盐溶液PBS进行脱细胞步骤,获得脱细胞后的骨髓来源的细胞外基质(ECM)。
S3:将骨髓间充质干细胞接种于含有所述细胞外外基质(ECM)的α-MEM培养基中,诱导骨髓间充质干细胞成骨分化。操作时,用小干扰RNA转染骨髓间充质干细胞,小干扰RNA混合物转移到6孔板为37℃孵箱中孵育8小时,置换培养基后,将骨骼间充质干细胞培养在含有细胞外基质(ECM)的α-MEM培养基中。在S3步骤中为了诱导成骨分化及保证成骨分化微环境的稳定性,在细胞达到80-90%融合时,培养基中加入10mMβ-甘油磷酸、100nM地塞米松和200μM抗坏血酸。
S4:细胞贴壁后,接受每12小时变换一次的动态电磁微环境刺激(通过外加磁场进行动态调控),通过改变外加磁场引起细胞所处磁电微环境改变。同时,外部施加机械应力于所述微环境,所述机械压力模拟体内骨骼微环境的机械压力且持续供压。
成骨分化完成后,检测间充质干细胞(MSC)成骨分化情况,使用茜素红染色:加入适量茜素红染液染3~5min,吸去茜素红染液,用1×PBS清洗两次,并加入适量1×PBS避免细胞干燥。
图3示出实施例3的细胞成骨分化的电镜图。
证据表明,细胞外基质(ECM)通过其独特的机械和电磁性质在调节细胞功能方面起着特殊的作用。由骨髓细胞(BM)衍生的细胞外基质(ECM)代表了独特的微环境,其生物分子、结构和机械性能有着显著差异。更重要的是,组织特异性的微环境对间充质干细胞(MSC)行为有各种影响,如增殖、形态以及对成骨诱导的敏感性。此外,成骨细胞培养产生的细胞外基质(ECM)促进间充质干细胞(MSC)向成骨细胞分化,其效果优于单独化学诱导制备的细胞外基质(ECM)。
上面结合附图对本发明优选的具体实施方式和实施例作了详细说明,但是本发明并不限于上述实施方式和实施例,在本领域技术人员所具备的知识范围内,还可以在不脱离本发明构思的前提下做出各种变化或等效替换,因此,本发明不受此处所公开的具体实施例的限制,所有落入本申请的权利要求范围内的实施例都属于本发明所保护的范围内。
- 一种调控细胞成骨分化的转录因子及成骨分化细胞
- 一种基于细胞外基质的调控牙周膜干细胞成骨分化的方法
