一种人体胃癌成体干细胞的同源胃癌类器官培养方法
文献发布时间:2024-04-18 19:58:53
技术领域
本发明涉及生物医药技术领域,特别涉及一种人体胃癌成体干细胞的同源胃癌类器官培养方法。
背景技术
类器官(organoids)培养是一种利用成体干细胞在体外培养出3D细胞培养物的技术,是近十年来发展最快最重要的体外培养方法之一。类器官不仅能高度保留对应器官体内生长时高度相似的3D组织结构,同时在多次传代后依旧保留患者的生物遗传信息及其异质性,可以为患者的病理诊断、后续治疗策略的预判和制定提供强有力的依据和支持。
类器官3D培养体系是介于传统2D细胞系培养体系及动物模型体系之间的一种体外培养模式,不仅兼备了这两种模型的优势,且保留了分子及组织层次的患者个体化生物特征。与动物模型相比,类器官体系可以直接避免动物模型带来的动物伦理福利争议、高经济和时间成本投入等缺陷。尤其是在涉及需要应用基因编辑手段满足研究需求的体外模型改造时,直接对类器官进行基因编辑的成功率远高于转基因小鼠,且无需花费大量时间和金钱对转基因鼠进行后续繁育和维护。建立转基因类器官模型的周期通常在1个月,并且可以同时进行多种不同基因的编辑,且直接对患者来源的类器官进行基因编辑可以直接直观的提供患者相关的研究数据,弥补了不同物种间基因差异带来的模型遗憾。类器官的优势和特点奠定了其在基础科研及临床前研究中越来越重要的地位,例如将其应用于测序诊断等分子生物学诊断,可帮助患者进行靶向药物选择,进一步用类器官模型确认候选药物的具体药效和最优选。这充分弥补了2D细胞系培养体系在长期培养过程中肿瘤的异质性易丢失,及其无法模拟患者体内肿瘤的复杂结构、病理特征、基因型以及细胞间的信号通路等多种缺憾。源自患者的异种移植模型(PDX)虽然能够模拟亲本肿瘤的特征,维持肿瘤异质性和基因组稳定性,但其构建效率低、耗时长、费用昂贵、存在种属差异,也不适合高通量药物筛选。综上所述,肿瘤类器官的培养与技术为肿瘤研究带来了全新的临床前研究模型。与传统的模型相比,肿瘤类器官的标本可以来源于手术或穿刺活检,灵活便捷,还能在培养过程中维持基因组稳定性,重现原始肿瘤的异质性;类器官培养周期较短,1-2周即可进行传代,时效性强,可操作性高,克服了2D细胞系模型在肿瘤异质性丧失以及PDX在高通量不适用的巨大痛点。
根据胃癌患者的不同分期和临床特点,手术切除肿瘤组织及后续的放化疗依旧是常规治疗手段。由于缺乏足够且有力的胃癌临床肿瘤标记物,其早期诊断和发现依旧极具挑战,且易导致较差的预后和较短的生存期。随着靶向药物的迅速崛起和发展,目前包括曲妥珠单抗、阿帕替尼等新一代胃癌治疗药物也逐渐被纳入胃癌的临床治疗过程。但是,目前的临床数据显示,靶向药物的疗效存在较大的个体化差异且脱靶效应不容忽视,因此如何为适配的患者选择合适的靶向药物是目前的主要挑战。与此同时近年来以CAR-T为代表的细胞免疫治疗快速发展,如何为患者选择合适的细胞免疫治疗方法也引发了广泛的思考。基于胃癌临床治疗存在的急需解决问题和类器官模型自身的优势,将胃癌类器官灵活高效地应用于胃癌肿瘤标记物筛选、胃癌患者的临床早期诊断、基因测序、靶向药物筛选及细胞免疫治疗手段的筛选等方面,将会为患者带来较大的价值且有望延长其生存时间、提高其生存质量。除了临床治疗相关领域,基础科研的机制探索也将是胃癌类器官优势发挥的另一重大领域。
中国专利(CN111411083A)公开了一种胃癌类器官的培养基及培养方法,通过将胃癌组织进行预处理成细胞团沉淀,再将所制备的培养基与基质胶混合均匀后重悬细胞团沉淀,获得混有细胞的凝胶,将该凝胶接种培养得到类器官,培养的胃癌类器官维持了原发组织的形态结构和基因特征。该专利所公开的技术方案只能单一实现胃癌类器官的相关研究,而在一些样本消耗大的细胞和类器官的研究中其培养条件与时间成本相对较高,没有实现2D到3D之间的灵活转化,无法短时间获得大规模的实验样本。
中国专利(CN 114908039 A)公开了一种胃癌类器官的培养基及其无支架培养方法,其针对3D培养限制了类器官与外界的气体交换和物质代谢,当类器官形成较大的组织后,循环系统的缺乏和氧气养分交换的局限性影响类器官所需营养物质的吸收以及代谢废物的清除的问题,采用了一种胃癌类器官的无支架培养方法。但是该种培养方式需要用超低吸附表面的培养盘,低吸附性表面促使细胞团的形成,但与此同时,降低了干细胞活性及其分化潜力,处于细胞团中央的部分细胞因缺乏养分几乎全部坏死,此外其特殊表面材质大大提高了其培养成本,为类器官在实际应用中增加困难。
另外,单纯的3D培养体系所培育的类器官,在多次传代培养后,会产生类器官状态出现下降,逐渐无法继续传代生长的问题。
发明内容
本发明提供一种人体胃癌成体干细胞的同源胃癌类器官培养方法,可以保护纯干细胞的干性基础上进行扩增,可以最大限度的保证培养物与患者源组织的各类生物学特性的一致性前提下大量培养所需类器官,优化了类器官培养基组分在保证培养效率的前提下降低培养成本。
一种人体胃癌成体干细胞的同源胃癌类器官培养方法,包括:
S1,用预冷HBSS冲洗胃癌组织至表面无血迹等杂质,去除脂肪及连接组织,得到样本;
S2,将样本剪成5mm直径的组织碎片,用预冷HBSS清洗8~10次至上清变清澈后,置于37℃的摇床中消化30分钟;
S3,弃去上清,将组织碎片转移至培养皿并碾压组织碎片以分离胃癌腺体,使用含10%血清的培养基重悬胃癌腺体,将混合物收集于第一离心管中并静置1分钟;
S4,将第一离心管中的上清转移至第二离心管中,清洗5次后,重悬胃癌腺体并在显微镜下进行计数并离心,然后用ADF清洗3次,得到含有干细胞的胃癌腺体;
S5,将胃癌腺体与基质胶混合并接种于预热的培养板中,将培养板置于培养箱中,在37℃,5%CO
更优地,所述S5中,每4ml基质胶中含30个腺体。
更优地,所述培养板中,每孔含有3D培养基500ul。
更优地,所述S5包括:
S51,将部分胃癌腺体用2D培养基重悬,进行细胞扩大培养;
S52,将其余部分胃癌腺体与基质胶混合并接种于预热的培养板中,将培养板置于培养箱中,在37℃,5%CO
更优地,所述2D培养基包括:ADF、5%胎牛血清、20ng/mL人表皮生长因子、7.5mM的ROCK抑制剂。
更优地,所述3D培养基包括:ADF、50%conditionedWnt3A-medium、25%conditionedR-spondinmedium、10mMHEPES、1%谷氨酰胺、2%B27、1%N2、20ng/mL表皮生长因子、150ng/mLhumannoggin、150ng/mL肝素结合生长因子、1.25mMN-acetyl-L-cystein、10mM烟酰胺、10nM人胃泌素、2mMp38MAPK抑制剂、1mMTGF-β抑制剂、7.5mM的ROCK抑制剂。
本发明提供一种人体胃癌成体干细胞的同源胃癌类器官培养方法,通过3D培养和2D培养相结合的方式,通过2D培养体系保护纯干细胞的干性基础上进行扩增,当3D培养基中的类器官出现干性下降或传代异常,该2D干细胞可再一次应用于3D培养基的类器官培养和传代,提高了技术人员的容错性,降低实际应用场景中患者类器官培养的失败率。另外,本发明还通过优化类器官培养基组分,在保证培养效率的前提下降低了培养成本。
附图说明
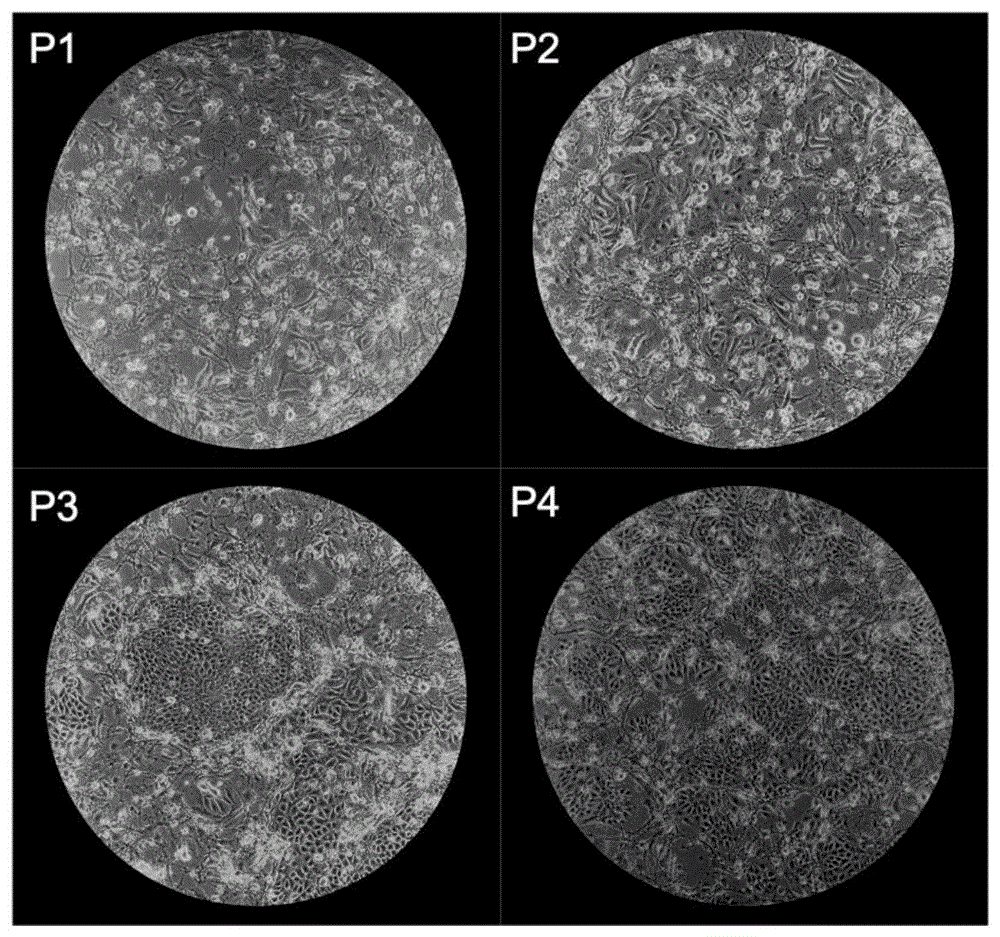
图1为1-4代胃癌干细胞培养7天后光学显微镜下成像。
图2为1-4代胃癌类器官培养14天后光学显微镜下成像。
图3为胃癌类器官经过免疫荧光染色标记CDX1和MUC2后共聚焦显微镜下成像。
图4为胃癌类器官经过免疫荧光染色标记CDX2和MUC2后共聚焦显微镜下成像。
图5为不同药物处理后胃癌及健康类器官光镜下成像。
图6为14例胃癌患者的样本与连续传代次数图。
具体实施方式
下面结合附图,对本发明的一个具体实施方式进行详细描述,但应当理解本发明的保护范围并不受具体实施方式的限制。
一种人体胃癌成体干细胞的同源胃癌类器官培养方法,包括:
S1,用预冷HBSS冲洗胃癌组织至表面无血迹等杂质,去除脂肪及连接组织,得到样本;
S2,将样本剪成5mm直径的组织碎片,用预冷HBSS清洗8~10次至上清变清澈后,置于37℃的摇床中消化30分钟;
S3,弃去上清,将组织碎片转移至培养皿并碾压组织碎片以分离胃癌腺体,使用含10%血清的培养基重悬胃癌腺体,将混合物收集于第一离心管中并静置1分钟;
S4,将第一离心管中的上清转移至第二离心管中,清洗5次后,重悬胃癌腺体并在显微镜下进行计数并离心,然后用ADF清洗3次,得到含有干细胞的胃癌腺体;
S5,将胃癌腺体与基质胶混合并接种于预热的培养板中,将培养板置于培养箱中,每4ml基质胶中含30个腺体,每孔含有3D培养基500ul,在37℃,5%CO
进一步地,S5包括:
S51,将部分胃癌腺体用2D培养基重悬,进行细胞扩大培养;其中,2D培养基包括:ADF、5%胎牛血清、20ng/mL人表皮生长因子、7.5mM的ROCK抑制剂。
S52,将其余部分胃癌腺体与基质胶混合并接种于预热的培养板中,将培养板置于培养箱中,在37℃,5%CO
下面以胃癌腺体为例,阐述方案内容。
步骤一:取胃癌组织,用预冷Hank’s平衡盐溶液(HBSS Gibco
步骤二:将上述胃癌腺体及干细胞用10mlADF重悬,并等量移至两个15ml离心管中再次离心,将离心后的其中一管胃癌腺体和干细胞用2D培养基重悬,接种于1%I型胶原包被的T25培养皿中,将其置于37℃,5%CO2培养箱中进行培养,每2-3天换液一次,直至细胞生长稳定可以进行传代及冻存。
具体的,步骤二中的2D培养基,每100ml 2D培养基含有95ml的ADF、5ml的5%胎牛血清(FCS Gibco
步骤三:将上述离心后的另一管包含干细胞的胃癌腺体与基质胶混合(大约300个腺体/40ml基质胶),并将该混合物接种于预热的24孔板(培养板)中,然后将培养板置于培养箱中15分钟,并将预热的3D培养基加入培养孔中,每孔含有500ul的3D培养基,ROCK抑制剂在最初三天加入培养基,将培养板在37℃,5%CO2培养箱中进行培养。每2-4天补充培养基,传代周期为10-21天,传代比例为1:8(P0)。
具体的,步骤三中的3D培养基中,每100ml 3D培养基含有25ml的ADF、50ml的50%conditioned Wnt3A-medium(HumanKine HZ-1296)、20ml的25%conditioned R-spondinmedium(bio-techne 4645-RS)、1mmol的HEPES(Thermo Scientific
步骤四:类器官的传代(P1):首先移除培养基,用预冷ADF溶解基质胶,将类器官收集至15ml离心管中,随后应用玻璃移液头用力吸取8-10次将类器官机械性分解,在4℃下离心(250g)5分钟收集分解后的碎片,并用TrypLE消化5分钟,消化结束后用含10%血清的ADF终止消化并再次离心;
步骤五:步骤四中再次离心后的一半类器官消化后的细胞悬液,再次通过上述步骤2)所述的方法进行2D干细胞培养;
步骤六:步骤四中再次离心后的另一半类器官消化后的细胞悬液,根据传代比例加入一定体积的基质胶混合均匀,并按照上述步骤3)方法种植在24孔板中,且加入3D培养基进行培养。选取状态良好的胃癌干细胞和类器官进行冻存,并存进生物银行。
P1后的类器官传代描述:
移除孔中原有培养基,加入500ul预冷的PBS,吹打并移至离心管中离心(400g 5分钟),弃上清,加入500ul TryplE(Gibco)于37℃消化20分钟,终止消化后400g离心5分钟。弃上清,根据传代比例向(1:4-1:8)消化后的细胞团中加入适当体积基质胶并重悬混匀,将50ul混合物滴在24孔板的每孔中央,待基质胶凝固后每孔加500ul 3D培养基。每2-3天换液,传代周期为14-21天。
P0(初代)与后续传代的区别:
P0是从人体来源的组织碎片消化成单细胞及腺体混合物后,一半直接与基质胶混合,凝固后加培养基进行类器官培养。另一半接种于培养瓶中进行2D干细胞培养。
P1后的类器官是首先将前一代类器官进行消化成单细胞与腺体混合物后按比例与基质胶混合再接着培养。
应用2D干细胞进行3D类器官培养与类器官传代培养的区别:
将干细胞从培养瓶消化下来后,形成单细胞,离心后将单细胞与基质胶混合后再培养。
实施例1:胃癌患者干细胞2D长期培养(参见图1)
(1)胃癌患者干细胞2D长期培养和生物银行建立
a.J2-3T3(购自ATCC)使用添加了10%胎牛血清的高糖DMEM培养基培养,培养条件为5%CO2及37℃。当其生长到所需数量时,使用胰蛋白酶于37℃消化5分钟,终止消化后400g离心5分钟,用培养基重悬细胞使终细胞浓度达到10^6/ml。将其置于γ射线下接受25Gy反射失去生殖能力后种植于培养皿中作为饲养细胞层为胃癌干细胞持续生长保持干性提供营养。
b.将胃癌干细胞接种于预包被T25培养皿中,待其生长融合至约70%,应用TryplE(Gibco)于37℃消化10分钟,终止消化后400g离心5分钟,弃上清。使用2D培养基重悬细胞,按照1:2-1:4的传代比例种植于已铺好的J2-3T3饲养细胞层上。每2-3天换液,通常7天可生长融合至70%-80%,可以进行后续实验或传代或冻存至生物银行。如图1所示,2D胃癌干细胞在早期生长相对较慢,集落较小,随着代数增加,干细胞生长速度加快且趋于稳定,集落清晰较大。
实施例2:3D类器官长期培养及生物银行建立(参见图2)
胃癌干细胞及腺体于基质胶中(大约300个腺体/40ml基质胶)生长分化14天后,用预冷PBS去除基质胶,并用TryplE(Gibco)于37℃消化20分钟,终止消化后400g离心5分钟。按照1:4-1:8传代比例用新的基质胶重悬消化后的单细胞,将细胞混合物滴在24孔板的孔中央,每孔加500ul 3D培养基。每2-3天换液,传代周期为14-21天。当类器官生长至预期尺寸时可以进行后续实验或冻存至生物银行。通常胃癌类器官可以稳定传代20代以上,如图2从P1代类器官直径相对较小,其中一小部分类器官生长不足够稳定,随着传代过程淘汰干性不足的类器官后,类器官的生长速度加快且趋于稳定,直径相对变大,但达到一定代数(约15代)后类器官状态出现下降,逐渐无法继续传代生长。
实施例3:胃癌类器官标记物免疫荧光染色
a.将培养14天的胃癌类器官用预冷的PBS从基质胶中分离出来后,离心(300g5min)收集类器官.用加入1ml 4%福尔马林溶液重悬胃癌类器官,固定30分钟。用PBS清洗且离心已固定的类器官3次,此时类器官可以置于4度冰箱冷藏至染色前;
b.取出已固定好的胃癌类器官,用破膜剂孵育20分钟后,加入含1%BSA的封闭溶液封闭2小时。与此同时按照1:200比例用封闭溶液稀释及混合CDX1(小鼠抗人)和MUC2(兔抗人)一抗,一抗于4度孵育过夜。次日,以PBS洗脱一抗2次,并以1:150比例稀释山羊抗小鼠-Cy5和山羊抗兔-Cy3二抗,二抗孵育2小时后PBS洗脱二抗3次,将完成染色的类器官转移至载玻片,在上方放置盖玻片后封片于共聚焦显微镜下观察(参见图3);
c.取出已固定好的胃癌类器官,用破膜剂孵育20分钟后,加入含1%BSA的封闭溶液封闭2小时。与此同时按照1:200比例用封闭溶液稀释及混合CDX2(小鼠抗人)和MUC2(兔抗人)一抗,一抗于4度孵育过夜。次日,以PBS洗脱一抗2次,并以1:150比例稀释山羊抗小鼠-Cy2和山羊抗兔-Cy3二抗,二抗孵育2小时后PBS洗脱二抗3次,将完成染色的类器官转移至载玻片,在上方放置盖玻片后封片于共聚焦显微镜下观察(参见图4);
实施例4:基于药物高通量筛选目的健康及胃癌3D类器官培养
a.药物筛选时需要检测药物对正常细胞和组织的副作用,因此在培养胃癌类器官的同时需要培养同一患者来源的健康胃类器官。根据需要筛选药物的数量于24孔板中进行培养,40ul基质胶(20000细胞)/孔,每孔加入500ul 3D培养基。对其生长速度和大小每天进行检测,当直径达到100um-200um(大约7天左右)给予所需筛选的药物处理。以对胃癌目前市场上的靶向药物筛选为例:
阴性对照组:不给予任何药物
阳性对照组:顺铂
试验组1:阿帕替尼
试验组2:赫赛汀
由于不同患者对药物敏感性不同,顺铂,阿帕替尼,赫赛汀均需根据临床药物剂量进行剂量的梯度检测摸索适合药物浓度,最终确定其终浓度为4.6umol/L并于显微镜下观察,观察时间持续3-7天。经预实验药物浓度摸索后顺铂剂量,阿帕替尼,赫赛汀。
实施例5:形态学观察比较药效
如图5所示,阴性对照组胃癌类器官及健康类器官长势均良好,在药物作用7天后顺铂组对胃癌和健康类器官均有杀伤效果;对比健康和胃癌类器官给予阿帕替尼后发现阿帕替尼对胃癌类器官影响远大于健康类器官,提示阿帕替尼在对胃癌患者的治疗靶向准确性较高;给予赫赛汀后该患者的健康和胃癌类器官均未出现明显缩小,提示其对该患者无效。
本案具有以下优势:
高成功率阐述:
参见图6,14例胃癌患者的样本被采集并进行类器官培养,所有样本类器官均被成功培养,且可以连续传代10代以上只有GC8在传代4次后停止生长。由此可见我们的类器官培养成功率接近100%,稳定长期传代能力超过93%。
低时间和经济成本阐述:
根据现有已发表文献及材料显示,平均将胃癌类器官培养至直径200-400um(可以用来后续研究和药敏实验)需要21-28天,而用我们改进后的培养基,培养至相似大小需要10-16天。
由于我们将2D干细胞培养系统引入3D类器官培养体系,大大减少了Matrigel等昂贵耗材(3000RMB/10ml)的使用,且2D干细胞(无需Matrigel)每次培养T25长满可获得2百万-3百万可应用细胞,而仅用类器官培养系统则需要至少消耗约5ml Matrigel(1500RMB)。
由类器官转培养2D干细胞:
在胃癌类器官生长分化10-14天后,用预冷PBS去除基质胶,并用TyplE(Gibco)于37℃消化20分钟,并反复吹打至大部分细胞团成为单细胞,终止消化后400g离心5分钟并进行计数。根据细胞数量选择合适面积的培养瓶并将细胞用培养基(5x10^5细胞/ml)进行重悬后种于培养瓶中培养。每2-3天观察一次看是否贴壁,并根据生长情况适时传代及后续实验。
以上公开的仅为本发明的几个具体实施例,但是,本发明实施例并非局限于此,任何本领域的技术人员能思之的变化都应落入本发明的保护范围。
- 一种胃癌类器官的无血清专用培养基与类器官培养方法
- 一种胃癌类器官培养基及培养方法
