一种促进伤口愈合的双金属MOF水凝胶敷料及其制备方法和应用
文献发布时间:2024-04-18 19:58:53
技术领域
本申请涉及抗菌材料技术领域,具体来讲,涉及一种促进伤口愈合的双金属MOF水凝胶敷料及其制备方法和应用。
背景技术
伤口愈合是通常被认为是一个动态的过程,而理想的伤口敷料应保持适当的湿润环境,有一定的吸收伤口渗液和防止微生物侵入的功能,还要拥有一定的气体交换功能,这可以显著的促进伤口愈合。传统的创伤敷料,如:无菌纱布、灭菌脱脂棉、绷带等可为伤口提供简单的物理保护屏障,但对伤口渗出物的吸收与引流效果有限,易导致伤口感染,且不利于保持湿性愈合环境,使用抗感染的伤口敷料已成为促进伤口愈合的主要方法。
近年来,水凝胶伤口敷料得到了广泛的研究,水凝胶具有适当的孔隙和良好的透气性,并且水凝胶可以使伤口附近保持湿润的环境,能够有效促进伤口愈合。水凝胶还具有良好的机械强度,可用于关节伤口,适合作为敷料基材。然而,虽然水凝胶伤口敷料具有良好的生物相容性,但是其在抗菌方面的性能并不能达到预期需求。
发明内容
发明人研究发现:天然生物材料具有降解性和良好的兼容性。良好的生物材料包括胶原蛋白、淀粉、壳聚糖(简称CS)等,其中CS在生物医学方面具有良好的附着力、止血和抗菌作用,是最有前途的伤口敷料材料之一,通过添加改性材料,可以扩展CS的性能,使其具有抗菌、止血、生物兼容性等功能。
金属有机框架(简称MOF)是一种新型的无机杂化聚合物,MOF的多孔、规则的结构性质使其在生物医学和药物输送等方面都表现出了其潜在的应用价值。与传统的杀菌剂相比,MOF抗菌剂具有广谱抗菌、效力高、作用时间长、结构可调、热稳定性好等优点,但MOF结构的生物相容性较差。MOF的抗菌机制包括两种:一种是MOF表面的活性位点与细菌表面的相互作用从而达到杀菌的目的;另一种是从MOF晶体中浸出的金属离子破坏细菌细胞膜的通透性从而达到杀菌效果。MOF中大量的三维空间结构和较大的表面积在表面提供了许多金属活性位点,增强了MOF的亲脂性,可以使细菌细胞膜中脂质的过氧化,从而导致细菌的细胞膜受损,展现出良好的抗菌性能。
发明人经过多次研究发现:伤口愈合过程需要促进血管生成、胶原蛋白沉积和伤口的再上皮化,含铜材料具有促进血管生成和抗菌的作用,过渡金属纳米颗粒,特别是银纳米颗粒,对多重耐药细菌有突出的影响。然而,金属纳米粒子中金属离子的过度浸出对人体中的正常细胞有害,并可能会导致人体正常细胞的损伤,无法有效地实现缓释灭菌。将金属离子与MOF相结合可以使金属离子在生理环境中缓慢释放,选择具有的生物活性Ag
为了解决上述问题,本申请第一方面提供了一种促进伤口愈合的双金属MOF水凝胶敷料,所述双金属MOF水凝胶敷料(简称PCbM)由双金属有机金属骨架负载在多功能水凝胶上构成。
本申请第二方面提供了一种双金属MOF水凝胶敷料的制备方法,所述制备方法包括以下步骤:
S1:将双金属与配体进行混合并加热得到双金属有机金属骨架。
S2:将双金属有机金属骨架添加到PVA溶液中进行混合和加热。
S3:向步骤S2中加入壳聚糖溶液,进行加热处理得到粘稠样品溶液。
S4:将粘稠样品溶液进行循环冷冻和解冻处理,得到双金属MOF水凝胶敷料。
其中,所述步骤S1中加热温度为100-120℃。
所述步骤S2中加热温度为80-100℃。
所述步骤S3中加热温度为45-60℃。
本申请第三方面提供了一种双金属MOF水凝胶敷料在抗菌材料上的应用。
与现有技术相比,本申请至少取得以下有益效果中的一项:
(1)本申请双金属MOF水凝胶敷料具有良好的抗菌性、保水性、肿胀性、水蒸气渗透性和生物相容性。MOF的缓释特性与其结构密切相关,渗出的金属离子浓度低,降低了对人体的毒性。由于MOF的特殊结构使其具有优异的抗菌性能。抗菌敷料隔离外界细菌与创面的接触,短时间内破坏细菌的生理结构。金属离子与水凝胶的协同作用可以促进血小板和红细胞凝聚并表现出组织粘附,可用于伤口的快速止血。具有一定离子释放量的敷料表现出更好的红细胞相容性,可以降低对红细胞的破坏作用。
(2)本申请双金属MOF水凝胶敷料具有多重功能,能够同时具有优异的抗菌性、促愈合功能和生物相容性,在生物医学方面具有广阔的应用前景。
(3)本申请双金属MOF水凝胶敷料中选择PVA和CS作为水凝胶材料,具有良好的组织粘附能力和止血能力,能够显著地促进伤口愈合,而且具有较好的生物相容性。
(4)本申请择具有的生物活性Ag
(5)本申请双金属MOF水凝胶敷料中bMOF的存在降低了水凝胶敷料CS的交联密度,使得水凝胶具有良好的保水性,它能吸收伤口的组织液并迅速排出,防止伤口液体滞留,为伤口创造湿润的环境。使最终制备得到的PCbM伤口敷料具有生物兼容性好、溶血率低、细胞毒性低的特点,为新型伤口敷料研究提供了思路。
附图说明
此处所说明的附图用来提供对本申请的进一步理解,构成本申请的一部分,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。在附图中:
图1示出了本申请实施例1与对比例2-4抗菌性能的对比图;
图2示出了本申请实施例1与对比例2-4细胞活力的对比图;
图3示出了本申请实施例1与对比例2-4水蒸气透过率和保水性的对比图;
图4示出了本申请实施例1小鼠断尾后涂覆本申请PCbM敷料止血性能的测试图;
图5示出了本申请实施例1小鼠断尾后涂覆本申请PCbM敷料止血性能的对照图;
图6出了本申请实施例1小鼠肝脏伤口涂覆本申请PCbM敷料止血性能的测试图;
图7示出了本申请实施例1小鼠伤口促愈合效果的对照图;
图8示出了本申请实施例1小鼠伤口面积的测试图;
图9示出了本申请PCbM EDS能谱图。
具体实施方式
为了更清楚的阐释本申请的整体构思,下面结合说明书附图以示例的方式进行详细说明。
在下面的描述中阐述了很多具体细节以便于充分理解本申请,但是,本申请还可以采用其他不同于在此描述的其他方式来实施,因此,本申请的保护范围并不受下面公开的具体实施例的限制。
另外,在本申请的描述中,需要理解的是,术语“顶”、“底”、“内”、“外”、“轴向”、“径向”、“周向”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本申请和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本申请的限制。
在本申请中,除非另有明确的规定和限定,术语“安装”、“相连”、“连接”、“固定”等术语应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或成一体;可以是机械连接,也可以是电连接,还可以是通信;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通或两个元件的相互作用关系。对于本领域的普通技术人员而言,可以根据具体情况理解上述术语在本申请中的具体含义。
在本申请中,除非另有明确的规定和限定,第一特征在第二特征“上”或“下”可以是第一和第二特征直接接触,或第一和第二特征通过中间媒介间接接触。在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本申请的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。
在本申请的一个示例性实施例中,双金属MOF水凝胶敷料由双金属有机金属骨架负载在多功能水凝胶上构成。
可选的,双金属有机金属骨架可以以3,5-吡啶二羧酸(简称H
可选的,所述双金属有机金属骨架中双金属为Ag
可选的,所述多功能水凝胶可以是胶原蛋白、淀粉、CS、PVA中的一种或多种。优选的,所述多功能水凝胶由PVA和壳聚糖组成。
具体的,双金属MOF水凝胶敷料的制备方法包括以下步骤:
S1:将双金属与配体进行混合并加热得到双金属有机金属骨架;
S2:将双金属有机金属骨架添加到PVA溶液中进行混合和加热;
S3:向步骤S2中加入CS溶液,进行加热处理得到粘稠样品溶液;
S4:将粘稠样品溶液进行循环冷冻和解冻处理,得到双金属MOF水凝胶敷料;
其中,所述步骤S1中加热温度为100-120℃;若步骤S1中温度过低会导致无法自组装形成bMOF晶体,步骤S1中温度过高,反应釜内压力升高会影响实验的安全性。
所述步骤S2中加热温度为80-100℃;若步骤S2中温度过低影响PVA的溶解性,温度过高会导致溶液的沸腾,影响实验的安全性。
所述步骤S3中加热温度为45-60℃。若步骤S3中温度过低影响CS的溶解分散,温度过高导致CS变性。
可选的,步骤S1中加热温度为110-117℃;
和/或所述步骤S2中加热温度为85-95℃;
和/或所述步骤S3中加热温度为50-55℃。
优选的,所述步骤S1中加热温度为120℃;
和/或所述步骤S2中加热温度为100℃;
所述步骤S3中加热温度为45℃。
可选的,所述S1步骤中双金属为银离子和铜离子,按质量比,所述银离子:铜离子:配体为0.17~0.96:0.18~0.57:0.14。优选的,所述银离子:铜离子:配体为0.3~0.5:0.4~0.55:0.14。
按质量比,bMOF:PVA:CS为0.1~2%:5~10%:1~2%。
具体的,在bMOF的合成过程中若某种金属离子含量过高,会导致MOF晶体的组装倾向于生成大量单一金属离子的MOF结构,影响bMOF的合成率。双金属MOF水凝胶敷料中,若bMOF的含量过高,会导致敷料中金属离子含量过高,会影响敷料安全性。若水凝胶的含量过高会对敷料成型产生影响,水凝胶含量过低导致敷料硬度过高,不易贴合伤口。此外,MOF材料的加入能够减小了水凝胶的胶连密度,增大孔隙率,提高水凝胶的溶胀率,使制备得到的PCbM敷料有较好的吸水性,进而提高敷料止血和促愈合功能。
具体的,所述双金属MOF水凝胶敷料的制备方法包括以下步骤:
S1:制备bMOF:将0.1-0.55gAgNO
S2:将PVA进行80-100℃下加热溶解得到PVA溶液,在氮气保护中将bMOF添加到PVA溶液中,使溶液中bMOF的含量为1-1.2mg/g。
S3:将0.2-0.3g壳聚糖溶解在10-20ml水中,然后加入步骤S2中,加入5-15ml乙酸溶液得到粘稠样品溶液;
S4:将制得的粘稠样品溶液浇铸在塑料模具上,进行真空处理,然后将模具在-20℃至-15℃下冷冻,并在20-30℃下解冻,连续循环4-5个周期,得到PCbM。
参考图9EDS能谱图所示,图9中上方左侧图示出了PCbM的结构图,上方右侧图示出了PCbM中C元素分布,下方左侧图示出了PCbM中Ag元素的分布,下方右侧图示出了PCbM中Cu元素的分布。可以看出,PCbM中确实负载上了Ag和Cu离子。
实施例1
双金属MOF水凝胶敷料的制备方法包括以下步骤:
S1制备bMOF:将0.34gAgNO
合成PCbM:
S2:将PVA溶解到蒸馏水中,并在100℃下连续搅拌2h,形成PVA溶液。在氮气保护下将bMOF添加到PVA溶液中,使最终水凝胶中bMOF含量为1.2mg/g。
S3:将0.2g壳聚糖溶解在10ml水中,并加入步骤S2中,然后滴加5ml乙酸溶液,形成粘稠样品溶液,将粘稠溶液在45℃下搅拌45min,浇铸在塑料磨具上,进行真空处理,然后将在-20℃下冷冻10h,并在20℃下解冻5h,连续循环4个周期。
将实施例1制备得到的双金属MOF水凝胶敷料分别在500μg ml
皮肤渗透量在24h为45.23μg/cm
实施例2
双金属MOF水凝胶敷料的制备方法包括以下步骤:
S1制备bMOF:将0.272gAgNO
合成PCbM:
S2:将PVA溶解到蒸馏水中,并在80℃下连续搅拌2h,形成PVA溶液。在氮气保护下将bMOF添加到PVA溶液中,使最终水凝胶中bMOF含量为1.2mg/g。
S3:将0.2g壳聚糖溶解在10ml水中,并加入步骤S2中,然后滴加5ml乙酸溶液,形成粘稠样品溶液,将粘稠溶液在45℃下搅拌45min,浇铸在塑料磨具上,进行真空处理,然后将在-20℃下冷冻10h,并在20℃下解冻5h,连续循环4个周期。
将实施例2制备得到的双金属MOF水凝胶敷料在500μg ml
皮肤渗透量在24h为47.68μg/cm
实施例3
双金属MOF水凝胶敷料的制备方法包括以下步骤:
S1制备bMOF:将0.17gAgNO
合成PCbM:
S2:将PVA溶解到蒸馏水中,并在90℃下连续搅拌2h,形成PVA溶液。在氮气保护下将bMOF添加到PVA溶液中,使最终水凝胶中bMOF含量为1.2mg/g。
S3:将0.2g壳聚糖溶解在10ml水中,并加入步骤S2中,然后滴加5ml乙酸溶液,形成粘稠样品溶液,将粘稠溶液在45℃下搅拌45min,浇铸在塑料磨具上,进行真空处理,然后将在-20℃下冷冻10h,并在20℃下解冻5h,连续循环4个周期。
将实施例3制备得到的双金属MOF水凝胶敷料在500μg ml
皮肤渗透量在24h为46.22μg/cm
实施例4
双金属MOF水凝胶敷料的制备方法包括以下步骤:
S1制备bMOF:将0.408gAgNO
合成PCbM:
S2:将PVA溶解到蒸馏水中,并在100℃下连续搅拌2h,形成PVA溶液。在氮气保护下将bMOF添加到PVA溶液中,使最终水凝胶中bMOF含量为1.2mg/g。
S3:将0.2g壳聚糖溶解在10ml水中,并加入步骤S2中,然后滴加10ml乙酸溶液,形成粘稠样品溶液,将粘稠溶液在45℃下搅拌45min,浇铸在塑料磨具上,进行真空处理,然后将在-15℃下冷冻10h,并在30℃下解冻5h,连续循环5个周期。
将实施例4制备得到的双金属MOF水凝胶敷料在500μg ml
皮肤渗透量在24h为47.88μg/cm
实施例5
双金属MOF水凝胶敷料的制备方法包括以下步骤:
S1制备bMOF:将0.51gAgNO
合成PCbM:
S2:将PVA溶解到蒸馏水中,并在100℃下连续搅拌2h,形成PVA溶液。在氮气保护下将bMOF添加到PVA溶液中,使最终水凝胶中bMOF含量为1.2mg/g。
S3:将0.2g壳聚糖溶解在10ml水中,并加入步骤S2中,然后滴加10ml乙酸溶液,形成粘稠样品溶液,将粘稠溶液在45℃下搅拌45min,浇铸在塑料磨具上,进行真空处理,然后将在-15℃下冷冻10h,并在30℃下解冻5h,连续循环5个周期。
将实施例5制备得到的双金属MOF水凝胶敷料在1000μg ml
皮肤渗透量在24h为48.08μg/cm
对比例1
在实施例1的基础上,区别在于,未加入CS。
将对比例1制备得到的双金属MOF水凝胶敷料在500μg ml
保水性为40.7%,水接触角接近21%,水蒸气透过率为1766.7g/m
对比例2
在实施例1的基础上,区别在于,未加入bMOF,制备得到PC敷料。
将对比例2制备得到的PC敷料在500μg ml
保水性为47.1%,水接触角接近16%,水蒸气透过率为1698.1g/m 24h,测试生物相容性时细胞活力为99.2%,凝血时间371.04s,小鼠断尾失血量为79.0mg。
对比例3
在实施例1的基础上,区别在于,未加入硝酸银,制备得到PCCuM敷料。
对比例4
在实施例1的基础上,区别在于,未加入硝酸铜,制备得到PCAgM敷料。
将实施例1-5和对比例1-4制备得到的敷料进行抗菌性能、透气性能、生物相容性能试验,测试结果参考表1所示。
其中:
①抗菌实验具体方法为:将PC水凝胶、PCAgM水凝胶、PCCuM水凝胶和PCbM水凝胶分别与细菌悬液在37℃、120rpm下孵育12h,探讨水凝胶的抗菌性能。孵育12h后,用100uL菌悬液铺LB固体培养基。37℃孵育过夜,Image J计算平板菌落数。
②水接触角具体测试方法为:用高速摄像机测量样品的水接触角,用探针将约3μL的超纯水滴至清洁的水凝胶敷料表面。采用软件计算水接触角,并进行3组重复实验,取其平均值。
③保水性具体测试方法为:将样品在PBS缓冲液中置于37℃烘箱中达到平衡。将样品取出并定期称重直到样品质量不再减少。保水性(WR)计算如下:
WR(%)=W
W
④水蒸气透过率具体测试方法为:将35mm直径的样品固定于含有10mL水的25mm直径烧杯容器的口中,并置于37℃、35%相对湿度的培养箱中,间隔一定时间称量系统重量。由下式计算水蒸气透过率(WVTR):
WVTR(%)=(WV
WV
⑤小鼠断尾实验具体测试方法为:选取12只8周龄雄性BALB/c小鼠,分为4组。实验前采用异氟醚麻醉小鼠。将样品应用于小鼠断尾出血模型,验证样品的组织粘连及止血情况。断尾模型在距尾尖3cm处断尾;在肝脏出血模型中。样品暴露创面后立即应用,并在不同时间对出血区域拍照。称量每次出血试验后滤纸上的出血量并记录止血时间。同时设置空白对照组。
⑥细胞活力实验具体测试方法为:小鼠L929细胞以1×10
表1性能测试表
参考表1所示,本申请制备得到的PCbM敷料抗菌率不低于99.9%,皮肤渗透量不低于40μg/cm,保水性25-30%,水接触角17-20%,水蒸气透过率1800-2200g/m 24h;细胞活力不低于90%,细胞毒性几乎忽略不计,凝血时间不高于290s,小鼠断尾实验失血量不高于70mg。
参考图1所示,图1示出了实施例1与对比例2-4抗菌性能的对比图,经测试,PCbM抗菌率为99.9%,对比例2中PC敷料抗菌率为6%,对比例4中PCAgM敷料抗菌率为95.3%,对比例3中PCCuM抗菌率为95.1%,PC敷料较PCbM敷料相比,抗菌性能明显不佳,虽然PCAgM敷料和PCCuM敷料的抗菌率比PCbM略低,但PCAgM促愈合作用差,PCCuM中单负载时,铜金属离子析出多,毒性较大,细胞毒性99.4%。
参考图2所示,图2示出了本申请实施例1与对比例2-4细胞活力的对比图,同时设置空白对照组(Control),纵坐标表示细胞活力。从图中,可以看出实施例1中PCbM敷料的细胞活力为99.6%,对比例2中PC敷料的细胞活力为99.2%,对比例3中PCCuM敷料细胞活力仅为92.7%,对比例4中PCAgM敷料细胞活力仅为92.9%,虽然PC敷料的细胞活力与PCbM敷料的差不多,但是PC敷料的抗菌性较差,其伤口敷料抗菌率不到本申请的十分之一。
参考图3所示,图3示出了本申请实施例1与对比例2-4水蒸气透过率(Waterretention rate)和保水性(WVTR)的对比图,参考图3所示,实施例1中PCbM敷料的保水性为29.1%,对比例2中PC敷料的保水性为47.1%,对比例3中PCCuM敷料保水性为47.9%,对比例4中PCAgM敷料保水性为42.2%,保水性过大或是过小都不利于伤口愈合,本申请PCbM敷料保水性适中25-30%,且水蒸气透过率大于PC、PCAgM、PCCuM敷料,可以为伤口提供湿润的促愈合环境,同时在一定程度上促进气体交换,加速伤口愈合,是一种理想的伤口敷料。
参考图4所示,图4中示出了本申请实施例1小鼠断尾后涂覆本申请PCbM敷料止血性能的测试图,图5示出了本申请实施例1小鼠断尾后涂覆本申请PCbM敷料止血性能的对照图,同时设置了空白对照组。图4中左侧纵坐标表示失血量,右侧纵坐标表示凝血时间。在小鼠断尾实验中,PCbM敷料的失血量仅为23.0mg,空白对照组中失血量可以达到230.0-240.0mg。参考图4和图5,可以看出,本申请采用PCbM敷料失血量明显减少,说明本申请有良好的止血功能,黏附性好,有利于伤口愈合;在小鼠断尾实验中,PCbM的凝血时间仅为240-255s,若不使用本申请,凝血时间则为360s-370s,由此可见本申请可以大大提高伤口凝血速率,缩短伤口愈合时间。
参考图6所示,图6中示出了本申请实施例1小鼠肝脏伤口涂覆本申请PCbM敷料止血性能的测试图,同时设置空白对照组。左侧纵坐标表示失血量,右侧纵坐标表示凝血时间。小鼠肝脏伤口实验中,PCbM敷料的失血量仅为105mg,空白对照组中失血量可以达到580-600mg,本申请采用PCbM敷料失血量明显减少,说明本申请有良好的止血功能,黏附性好,有利于伤口愈合。在小鼠肝脏伤口实验中,PCbM敷料的凝血时间仅为200-230s,若不使用本申请,凝血时间则为310s-350s。
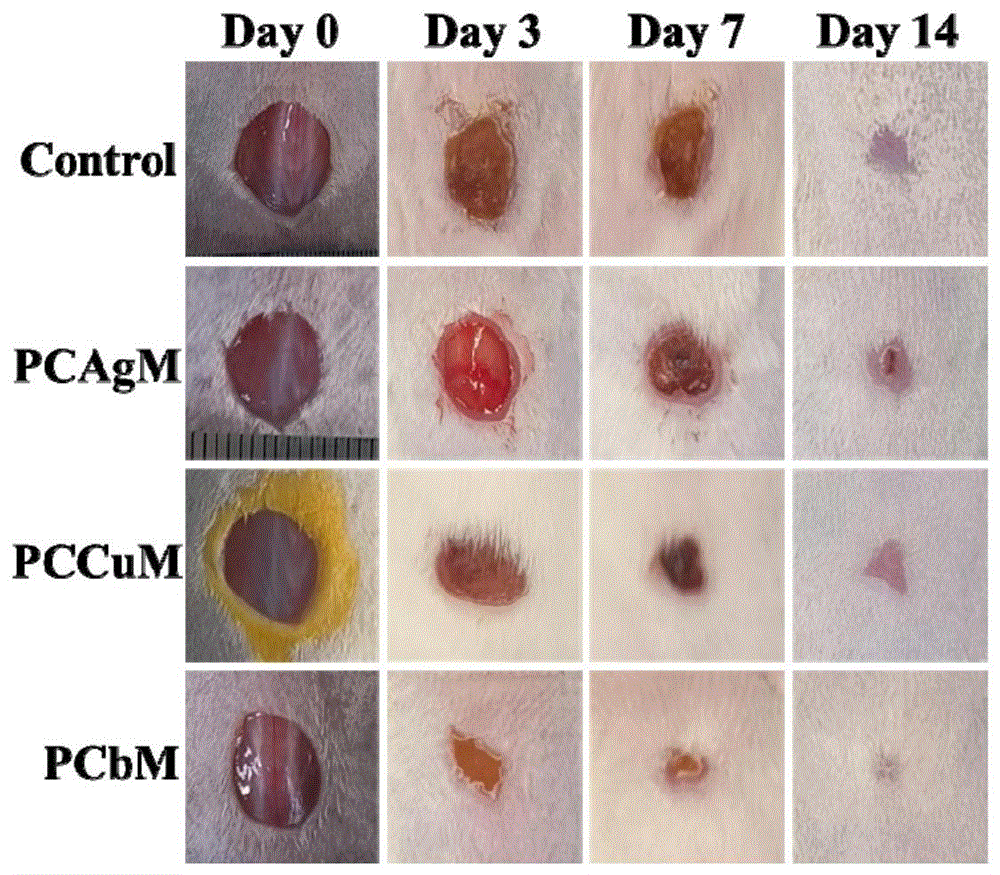
图7示出了本申请实施例1小鼠伤口促愈合效果的对照图,图8示出了本申请实施例1小鼠伤口面积的测试图,7天小鼠伤口面积不大于21%,14天小鼠伤口面积不大于6%,可以看出,本申请PCbM敷料有良好的伤口促愈合功能。
综上所述,本申请PCbM敷料在抗菌性、黏附性、促愈合性能、生物相容性等发面均表现出优异的性能。
以上所述仅为本申请的实施例而已,并不用于限制本申请。对于本领域技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原理之内所作的任何修改、等同替换、改进等,均应包含在本申请的权利要求范围之内。
- 一种具有抗菌和促进伤口愈合功能的热诱导不可逆复合水凝胶的制备方法及其应用
- 一种与皮肤高贴合度及可促进伤口愈合的水凝胶膜的制备方法
- 一种Cu-Ag双金属水凝胶的制备方法与一种晶体的制备方法
- 可快速降解的强韧型水凝胶伤口敷料及其制备方法
- 一种用于促进伤口愈合的水凝胶医用敷料的制备方法
- 一种促进伤口愈合的金属/水凝胶复合敷料及其制备方法
