托品烷生物碱转运蛋白及使用其制造托品烷生物碱的方法
文献发布时间:2024-04-18 19:58:53
政府权利
本发明是在国立卫生研究院授予的合同AT007886的政府支持下完成的。政府拥有本发明的某些权利。
相关申请的交叉引用
根据35U.S.C.§119(e),本申请要求2021年3月25日提交的美国临时专利申请序列号63/166,117的申请日的优先权;所述申请的公开内容通过引用并入本文。
背景技术
托品烷生物碱(TA)是由茄科(nightshade family)(茄科(Solanaceae))的某些植物产生的一类生物碱(含氮有机分子)。由于它们的抗胆碱能(乙酰胆碱受体调节)性质,TA可作为神经药物,从而受到关注。包含阿托品、莨菪碱和东莨菪碱在内的几种TA被世界卫生组织列为以下的基本药物:用于治疗神经系统病症,如有机磷酸盐和神经毒剂中毒、胃肠痉挛和心律失常;以及用于控制呼吸系统疾病期间的唾液和粘液分泌并用于减轻帕金森病的症状。因此,可供研究人员和医生使用的这些TA分子的充足和稳定的供应是令人感兴趣的。当前药用TA的供应链依赖于从不可持续的且地理上受限的植物单一培养物中提取,在这些培养物中,TA仅积累0.2-4%干重,并且培养物易受害虫、土地使用和气候变化的影响。由于TA立体化学方面存在的困难,还没有从简单原料中提取TA的全化学合成被证明在工业应用中具有足够的经济性。此外,由于规模经济性差、生成时间长,具有提高的TA产量的转基因植物或植物培养物的工程改造迄今仍是一种不可行的获取这些化合物的策略。因此,用于制备TA的方法是令人感兴趣的。
基于经遗传工程改造的非植物细胞(如微生物)的生物合成平台是一种有效的策略,其可在降低经济和环境成本的同时合成植物源性天然产物,例如TA。由于其遗传和代谢可追溯性,微生物平台可以扩大获得具有独特生物活性的天然和非天然TA衍生物的途径,这些衍生物可能以其它方式在天然植物中微量产生,或者只能通过使用危险化学品进行衍生而获得。然而,由于酶对非天然底物或化学转化的耐受性较低,这阻碍了将简单的构建要素(糖、氨基酸)转化为复杂的植物分子(例如,TA)的非植物细胞工程改造工作。因此,通过经工程改造的代谢途径优化通量的新方法对于高效产生TA及其衍生物很有意义。由于植物生物碱的天然代谢途径已经进化到可利用在不同组织和细胞器中发现的独特生物化学特性,因此用于在非植物细胞中重现这些途径的空间组织的特定方法和工具特别令人感兴趣。
发明内容
本发明包括被工程改造成用于由前体和糖产生多种托品烷生物碱(TA)的非植物生物体,其中分子的移动由源自其它生物体的一种或多种转运蛋白指导。例如,本发明包含用于产生药用TA的含有这种异源转运蛋白的经工程改造的微生物菌株,所述药用TA由此被定义为在当前医学实践中具有确定用途的天然存在的TA,包括莨菪碱、阿托品、山莨菪碱和东莨菪碱以及其前体和衍生物。本发明还包括用于产生非药用TA的含有这种异源转运蛋白的经工程改造的微生物菌株,所述非药用TA由此被定义为在当前医学实践中没有确定用途但可能具有有药用价值的生物活性的天然存在的TA,包括打碗花精、可卡因以及其前体和衍生物。本发明进一步包括用于产生非天然TA的含有这种异源转运蛋白的经工程改造的微生物菌株,所述非天然TA由此被定义为不由未修饰的生物体产生的TA,如经由在天然存在的生物体中未酯化的酰基供体和酰基受体化合物的酯化而产生的TA,包括药用TA的衍生物和非药用TA的衍生物。本发明中包括的方案的实例在图1至图3中详细描述。
本发明涵盖使用被工程改造以表达至少一种异源酶和至少一种异源转运蛋白的微生物体作为微生物催化剂来产生假托品碱和衍生自假托品碱的生物碱(例如,打碗花精)的方法。本发明进一步包括使用被工程改造以表达至少一种异源酶和至少一种异源转运蛋白的微生物体作为微生物催化剂来产生多种化合物的方法,所述化合物可以用作酰基供体用于TA支架的生物合成。本发明还包括使用被工程改造以表达至少一种异源酶和至少一种异源转运蛋白的微生物体作为微生物催化剂来酯化酰基供体和受体以产生TA支架的方法。本发明进一步包括修饰和培养经工程改造的微生物菌株来产生如莨菪碱和东莨菪碱等药用TA、如打碗花精等非药用TA以及非天然TA(如衍生自托品碱与除3-苯基乳酸(PLA)之外的酰基供体化合物的酯化的那些)的方法。本发明还涵盖通过转运蛋白改变、增强或调节参与微生物体中的药用TA、非药用TA和非天然TA的产生的分子的移动的方法。本发明进一步包括使用微生物体产生药用TA、非药用TA和非天然TA的衍生物的方法,所述微生物体被工程改造以表达至少一种异源转运蛋白和以化学方式将一个或多个官能团固定到TA分子上或从TA分子上去除一个或多个官能团的至少一种酶。
提供了被工程改造以产生感兴趣的托品烷生物碱(如莨菪碱和东莨菪碱)的宿主细胞。还提供了被工程改造以产生感兴趣的TA衍生物(如去甲托品烷生物碱和托品烷N-氧化物)的宿主细胞。感兴趣的TA可以包括TA前体、TA和TA修饰,包括TA衍生物。宿主细胞可以具有一种或多种选自以下的修饰:酶基因中的反馈抑制缓解突变;生物合成酶或转运蛋白基因的转录调节修饰;酶或转运蛋白中的失活突变;其表达影响一种或多种TA、TA前体或TA衍生物在细胞内或细胞间的移动的异源转运蛋白;和任何其它异源编码序列。还提供了使用宿主细胞和组合物(例如,在本发明的方法中使用的试剂盒、系统等)产生感兴趣的TA的方法。
本发明的一个方面提供了一种用于形成具有TA产物的产物流的方法。所述方法包括向分批反应器提供经工程改造的非植物细胞和包含营养物和水的原料,其中经工程改造的非植物细胞具有至少一种修饰,其选自由以下组成的群组:细胞天然的生物合成酶基因中的反馈抑制缓解突变;细胞天然的生物合成酶或转运蛋白基因的转录调节修饰;细胞天然的酶或转运蛋白中的失活突变;其表达影响一种或多种TA、TA前体或TA衍生物在细胞内或细胞间的移动的异源转运蛋白;和任何其它异源编码序列。此外,所述方法包括,在分批反应器中,通过将经工程改造的非植物细胞孵育至少约5分钟的时间段来使经工程改造的非植物细胞进行发酵,以产生包括TA产物和细胞材料的溶液。所述方法还包括使用至少一个分离单元将TA产物与细胞材料分离,以提供包括TA产物的所述产物流。
在另一个方面中,本发明提供了一种用于形成具有TA产物的产物流的方法。所述方法包括向反应器提供经工程改造的非植物细胞和包含营养物和水的原料。所述方法还包括,在反应器中,通过将经工程改造的酵母细胞孵育至少约5分钟(例如,5分钟或更长时间)的时间段来使经工程改造的非植物细胞进行发酵,以产生包括细胞材料和TA产物的溶液。此外,所述方法包括使用至少一个分离单元将TA产物与细胞材料分离,以提供包括TA产物的产物流。
本发明的另一个方面提供了一种产生托品烷生物碱(TA)产物的经工程改造的非植物细胞,所述经工程改造的非植物细胞具有至少一种修饰,其选自由以下组成的群组:细胞天然的生物合成酶基因中的反馈抑制缓解突变;细胞天然的生物合成酶或转运蛋白基因的转录调节修饰;和细胞天然的酶或转运蛋白中的失活突变。所述经工程改造的非植物细胞包括编码至少一种酶的至少一个异源编码序列,所述酶选自以下群组:精氨酸脱羧酶、胍丁胺脲水解酶、胍丁胺酶、腐胺N-甲基转移酶、N-甲基腐胺氧化酶、吡咯烷酮合酶、托品酮合酶、细胞色素P450还原酶、托品酮还原酶、苯丙酮酸盐还原酶、3-苯基乳酸UDP-葡糖基转移酶84A27、利托林合酶、利托林变位酶、莨菪碱脱氢酶、莨菪碱6β-羟化酶/双加氧酶、可卡因合酶、后生动物肝细胞色素P450、千里光碱N-加氧酶、吡咯里西啶N-加氧酶和TA解毒酶。在一些实例中,所述经工程改造的非植物细胞包括编码一种酶的多个异源编码序列,所述酶选自以下群组:精氨酸脱羧酶、胍丁胺脲水解酶、胍丁胺酶、腐胺N-甲基转移酶、N-甲基腐胺氧化酶、吡咯烷酮合酶、托品酮合酶、细胞色素P450还原酶、托品酮还原酶、苯丙酮酸盐还原酶、3-苯基乳酸UDP-葡糖基转移酶84A27、利托林合酶、利托林变位酶、莨菪碱脱氢酶、莨菪碱6β-羟化酶/双加氧酶、可卡因合酶、后生动物肝细胞色素P450、千里光碱N-加氧酶、吡咯里西啶N-加氧酶和TA解毒酶。所述经工程改造的非植物细胞还包括编码至少一种转运蛋白的至少一个异源编码序列,所述转运蛋白选自以下群组:ATP结合盒(ABC)转运蛋白、多药和毒素挤出(MATE)转运蛋白、嘌呤摄取通透酶样(PUP)转运蛋白、乳糖通透酶样(LP)转运蛋白或其它硝酸盐转运蛋白1/肽转运蛋白(NPF/NRT)和主要促进因子超家族(MFS)转运蛋白。在一些实例中,所述经工程改造的非植物细胞包括编码一种转运蛋白的多个异源编码序列,所述转运蛋白选自以下群组:ATP结合盒(ABC)转运蛋白、多药和毒素挤出(MATE)转运蛋白、嘌呤摄取通透酶样(PUP)转运蛋白、乳糖通透酶样(LP)或其它硝酸盐转运蛋白1/肽转运蛋白(NPF/NRT)和主要促进因子超家族(MFS)转运蛋白。在一些实例中,所述异源编码序列可以可操作地连接。可操作地连接的异源编码序列可以在产生特定TA产物的相同途径内。在一些实例中,所述经工程改造的非植物细胞包括细胞内区室化的一种或多种修饰,其选自包含但不限于以下的群组:修饰的酶的细胞内运输、修饰的酶的细胞内定位和修饰的代谢物的细胞内运送。
在本发明的另一个方面中,提供了一种治疗剂。所述治疗剂包括托品烷生物碱产物。
附图说明
当结合附图阅读时,从下面的详细描述中可最好地理解本发明。需要强调的是,根据惯例,附图的各个特征不是按比例绘制的。相反,为了清楚起见,各个特征的尺寸被任意扩大或缩小。在附图中包括了下面的图。
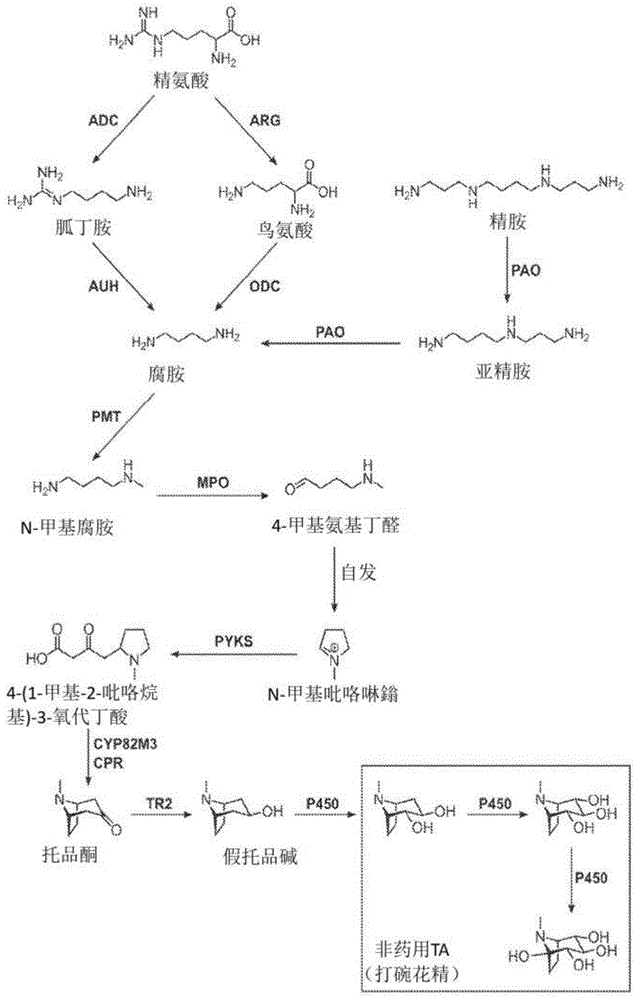
图1示出了将L-精氨酸转化为非药用TA的示例性生物合成方案。ADC,精氨酸脱羧酶;ARG,精氨酸酶;AUH,胍丁胺脲水解酶;ODC,鸟氨酸脱羧酶;PAO,多胺氧化酶;PMT,腐胺N-甲基转移酶;MPO,N-甲基腐胺氧化酶;spont.,自发(非酶促)步骤;PYKS,吡咯烷酮合酶;CYP82M3,托品酮合酶;CPR,细胞色素P450-NADP
图2示出了氨基酸可以被转化为感兴趣的药用TA分子及其前体分子的示例性生物合成途径。本实例示出了L-精氨酸和L-苯丙氨酸向药用TA的转化。ADC,精氨酸脱羧酶;ARG,精氨酸酶;AUH,胍丁胺脲水解酶;ODC,鸟氨酸脱羧酶;PAO,多胺氧化酶;PMT,腐胺N-甲基转移酶;MPO,N-甲基腐胺氧化酶;spont.,自发(非酶促)步骤;PYKS,吡咯烷酮合酶;CYP82M3,托品酮合酶;CPR,细胞色素P450-NADP+还原酶;TR1,托品酮还原酶1;ArAT,芳香族氨基转移酶;PPR,苯丙酮酸盐还原酶;UGT84A27,3-苯基乳酸UDP-葡糖基转移酶;LS,利托林合酶;CYP80F1,利托林变位酶;HDH,(S)-莨菪碱脱氢酶;H6H,(S)-莨菪碱6β-羟化酶/双加氧酶。精氨酸、鸟氨酸、精胺、亚精胺、腐胺、苯丙氨酸、3-苯丙酮酸和微量的3-苯基乳酸是在酵母中自然合成的。示出的所有其它代谢物并非是在酵母中自然产生的。方框内指示的最终产物是药用TA的实例。
图3示出了氨基酸可以被转化为非天然TA及其前体分子的示例性生物合成途径。在本实例中,L-精氨酸和L-苯丙氨酸被转化为非天然TA。ADC,精氨酸脱羧酶;ARG,精氨酸酶;AUH,胍丁胺脲水解酶;ODC,鸟氨酸脱羧酶;PAO,多胺氧化酶;PMT,腐胺N-甲基转移酶;MPO,N-甲基腐胺氧化酶;spont.,自发(非酶促)步骤;PYKS,吡咯烷酮合酶;CYP82M3,托品酮合酶;CPR,细胞色素P450-NADP
图4示出了由氨基酸和其它多胺分子产生腐胺的示例性生物合成途径。本图示出了如何使用内源酵母和异源生物合成途径来由中心代谢物制造腐胺。
图5示出,被工程改造成用于过表达参与精氨酸和多胺代谢的内源生物合成酶的酵母菌株可以在液体培养物中产生腐胺。天然基因的额外拷贝由野生型酵母(CEN.PK2)中的低拷贝质粒表达。在LC-MS/MS分析之前,将转化菌株在含2%右旋糖的选择性培养基中于30℃下培养48小时。所有数据代表至少三个生物重复的平均值,并且误差条表示标准偏差。学生双尾t检验:*P<0.05,**P<0.01,***P<0.001。除非另有指示,否则统计显著性相对于相对应的对照(即CEN.PK2)示出。
图6示出,被工程改造成用于异源表达来自除酵母之外的生物体的参与精氨酸和多胺代谢的生物合成酶的酵母菌株可以在液体培养物中产生腐胺产量。在本实例中,酵母菌株被工程改造以表达来自植物和细菌的异源生物合成途径。异源酶由野生型酵母中的低拷贝质粒表达。在LC-MS/MS分析之前,将转化菌株在含2%右旋糖的选择性培养基中于30℃下培养48小时。所有数据代表至少三个生物重复的平均值,并且误差条表示标准偏差。学生双尾t检验:*P<0.05,**P<0.01,***P<0.001。除非另有指示,否则统计显著性相对于相对应的对照(即CEN.PK2)示出。
图7示出,被工程改造成用于异源表达来自除酵母之外的生物体的参与精氨酸和多胺代谢的生物合成酶的酵母菌株可以在液体培养物中产生TA前体以及中间体胍丁胺、N-氨甲酰基腐胺和腐胺。本图示出了酵母中的胍丁胺/腐胺生物合成途径基因的功能验证。野生型酵母菌株CEN.PK2用三个低拷贝质粒转化,以共表达所指示的生物合成基因中的零个(阴性对照)至三个。表达蓝色荧光蛋白(BFP)的质粒用作三种营养缺陷型选择标志物URA3、TRP1和LEU2中的每一种的阴性对照。在对代谢物产量进行LC-MS/MS分析之前,将转化菌株在含2%右旋糖的选择性培养基中于30℃下培养48小时。所有数据表现为滴度,如通过相对于阴性对照(CEN.PK2)的LC-MS/MS峰面积所测量。数据代表在三个生物重复的平均值,并且误差条表示标准偏差。
图8示出了在正常酵母生长期间严格控制细胞内腐胺水平的内源调节途径。
图9示出了破坏内源多胺生物合成调节机制的酵母菌株中的腐胺产量的热图。对于天然或异源腐胺途径的过表达,所指示的基因由野生型酵母(WT)或每个单一破坏菌株中的低拷贝质粒表达。在LC-MS/MS分析之前,将菌株在含2%右旋糖的选择性(YNB-DO)培养基中于30℃下培养72小时。所有数据代表至少三个生物重复的平均值。本图示出,具有多胺代谢基因的单一破坏和过表达的内源或异源腐胺生物合成途径的酵母菌株可以在液体培养物中产生腐胺。
图10提供了增加酵母中的腐胺产量的工程改造工作的总结。“+”符号指示所述途径表达至少一个基因,而“–”指示所述途径不表达任何基因。在LC-MS/MS分析之前,将菌株在含2%右旋糖的选择性培养基中于30℃下培养48小时。所有数据代表至少三个生物重复的平均值,并且误差条表示标准偏差。学生双尾t检验:*P<0.05,**P<0.01,***P<0.001。除非另有指示,否则统计显著性相对于相对应的对照(即CEN.PK2)示出。
图11示出了根据本发明的实施例的LC-MS/MS色谱图,其示出了经工程改造的酵母中的腐胺经由中间体NMP和4MAB向TA中间体NMPy和副产物4MAB酸的逐步转化。示出了所提出的经由内源酵母酶(ALD)的活性形成4MAB酸副产物的机制。使用每种代谢物的最高前体离子/产物离子跃迁,示出了途径中的每种代谢物和真实标准品的提取离子色谱图MRM迹线。对照代表在低拷贝质粒上表达SPE1、AsADC和speB的菌株CSY1235(参见实例1.5)。色谱图迹线代表三个生物复制。酶符号:PMT,腐胺N-甲基转移酶;MPO,N-甲基腐胺氧化酶;ALD,醛脱氢酶。
图12示出了根据本发明的实施例的LC-MS/MS色谱图,其示出了表达AbPMT1和MPO酶的经工程改造的酵母的液体培养物中的TA前体(A)腐胺、(B)NMP、(C,E)4MAB和(D,F)NMPy的相对产量。(A)是用于过量产生腐胺的携带pCS4239的CSY1235的腐胺(m/z+89→72)的MRM色谱图。(B)是携带pCS4239并由低拷贝质粒表达AbPMT1的CSY1235的NMP(m/z+103→72)的MRM色谱图。(C,D)分别是携带pCS4239并由低拷贝质粒表达AbPMT1和NtMPO1的CSY1235的4MAB(m/z+102→71)和NMPy(m/z+84→57)的MRM色谱图。(E,F)分别是携带pCS4239并由低拷贝质粒表达AbPMT1和DmMPO1ΔC-PTS1的CSY1235的4MAB(m/z+102→71)和NMPy(m/z+84→57)的MRM色谱图。迹线的y轴是原始MRM离子计数。在含2%右旋糖的选择性培养基中于30℃下生长48小时之后,通过细胞外培养基的LC-MS/MS分析生成所有色谱图。迹线代表至少三个生物复制。
图13示出了MEU1破坏对AbPMT1引起的SAM依赖性腐胺N-甲基化的影响。将野生型菌株CEN.PK2或meu1破坏菌株CSY1229与表达SPE1、AsADC和speB的低拷贝质粒及AbPMT1共转化。数据指示相对于CEN.PK2对照的平均NMP滴度,如在含2%右旋糖的选择性培养基中于30℃下生长48小时之后通过三个生物重复的LC-MS/MS峰面积所定量。误差条表示标准偏差。学生双尾t检验:*P<0.05,**P<0.01,***P<0.001。
图14示出了使用SherLoc2网络服务器对植物和酵母/真菌细胞中的NMPy生物合成基因的亚细胞定位的计算机预测。数值和颜色指示定位到每个区室的概率分数(0至1):CYT,胞质溶胶;NUC,细胞核;VAC,液泡;CHL,叶绿体;MIT,线粒体;POX,过氧化物酶体。
图15示出了根据本发明的实施例的(A)N端和C端GFP标记的NtMPO1与PEX3过氧化物酶体标志物的共定位和(B)NtMPO1的N端和C端GFP标记对经工程改造的酵母的液体培养物中的TA前体4MAB和NMPy的产量的影响。本图示出了NtMPO1亚细胞定位的实验验证。(A)是野生型酵母(CEN.PK2)中的与过氧化物酶体标志物mCherry-PEX3共表达的NtMPO1 N端和C端GFP融合体的荧光显微术。白色箭头指示GFP标记的NtMPO1与过氧化物酶体的共定位。比例尺标尺,10μm。(B)是强制进行NtMPO1的胞质溶胶定位对4MAB或NMPy产量的影响。将野生型酵母(CEN.PK2)与表达野生型NtMPO1或N端或C端GFP融合体的低拷贝质粒以及表达SPE1、AsADC和speB的低拷贝质粒及AbPMT1共转化。在含2%右旋糖的选择性培养基中于30℃下生长48小时之后,进行LC-MS/MS分析。数据代表三个生物重复的平均值;误差条表示标准偏差。最可能的亚细胞区室基于(a)中的显微术数据指示。
图16提供了荧光显微术数据,其描绘了AbPMT1和NtMPO1在酵母中异源表达时的亚细胞定位。对由低拷贝质粒表达N端或C端GFP标记的AbPMT1或NtMPO1的野生型酵母进行显微术。比例尺标尺,10μm。
图17示出了根据本发明的实施例的(A)从植物转录组数据标识的NtMPO1和推定MPO酶AbMPO1和DmMPO1的序列比对,(B)表达NtMPO1、AbMPO1或DmMPO1的经工程改造的酵母菌株的液体培养物中的TA前体4MAB和NMPy的产量的比较,和(C)从同源建模确定的NtMPO1、AbMPO1和DmMPO1的预测三维结构的比较。(A)是查询NtMPO1序列与来自1000株植物项目数据库的AbMPO1和DmMPO1候选物的比对。蓝色指示氨基酸结构的保守;红色指示错配。(B)是MPO直向同源物的相对活性的比较。将腐胺过量产生菌株CSY1235(参见实例1.5)与表达SPE1、AsADC和speB的低拷贝质粒、AbPMT1及三种MPO变体中的一种共转化。在选择性培养基中于30℃下生长48小时之后,进行LC-MS/MS分析。数据代表三个生物重复的平均值;误差条表示标准偏差。(C)是使用RaptorX网络服务器基于豌豆含铜氨基氧化酶(PDB:1KSI,蓝色)的晶体结构构建的MPO酶(粉色)的同源模型。上图:NtMPO1;中图:AbMPO1;下图:DmMPO1。
图18示出了过量产生腐胺并表达AbPMT1以及NtMPO1和DmMPO1的N端和C端截短的经工程改造的酵母菌株的液体培养物中的4MAB产量。本图示出了甲基腐胺氧化酶的N端和C端截短对经工程改造的酵母中的4MAB产量的影响。野生型(WT)酶和所指示的截短由腐胺过量产生菌株CSY1235(参见实例1.5)中的低拷贝质粒表达。在LC-MS/MS分析之前,将菌株在含2%右旋糖的选择性培养基中于30℃下培养48小时。所有数据代表至少三个生物重复的平均值,并且误差条表示标准偏差。学生双尾t检验:*P<0.05,**P<0.01,***P<0.001。
图19示出了携带四个天然醛脱氢酶基因中的一个的单一破坏的经工程改造的酵母菌株的液体培养物中的TA前体4MAB和NMPy以及副产物4MAB酸的产量。本图示出了破坏单独的醛脱氢酶对4MAB酸积累的影响。将腐胺过量产生菌株CSY1235(对照)或具有hfd1、ald4、ald5或ald6的无义突变破坏的子代菌株用表达SPE1、AsADC和speB的低拷贝质粒、AbPMT1及DmMPO1
图20示出了携带对天然醛脱氢酶的一个或多个破坏的经工程改造的酵母菌株的液体培养物中的(A)4MAB酸副产物以及(B)TA前体4MAB和NMPy的产量。本图示出了醛脱氢酶基因破坏对经工程改造的酵母中的(A)4MAB酸副产物以及(B)4MAB和NMPy的产量的影响。“+”和“–”符号分别指示功能酶的存在或不存在。在LC-MS/MS分析之前,将菌株在含2%右旋糖的选择性(YNB-DO)培养基中于30℃下培养48小时。所有数据代表至少三个生物重复的平均值,并且误差条表示标准偏差。学生双尾t检验:*P<0.05,**P<0.01,***P<0.001。除非另有指示,否则统计显著性相对于相对应的对照(CSY1235)示出。
图21示出了根据本发明的实施例的具有腐胺过量产生基因AbPMT1和DmMPO1截短的基于低拷贝质粒的表达或基因组表达的经工程改造的酵母菌株的液体培养物中的TA前体NMPy的产量的比较。本图提供了NMPy生物合成基因的基于质粒的表达(CSY1241)和基因组表达(CSY1243)的4MAB和NMPy产量的比较。将菌株CSY1241用表达腐胺过量产生基因(SPE1、AsADC、speB)的低拷贝质粒、AbPMT1及DmMPO1
图22示出了根据本发明的实施例的由NMPy和MPOB产生副产物古豆碱的生物合成途径。酵母中的推定主要和次要副反应分别由粗体和虚线箭头指示。
图23示出了表达基于低拷贝质粒的AbPYKS、AbCYP82M3、DsTR1和四种不同CPR中的一种的经工程改造的酵母菌株的液体培养物中的TA前体托品酮和托品碱以及副产物古豆碱的产量的比较。本图示出了经工程改造的酵母中的托品碱和具有AbPYKS、AbCYP82M3和DsTR1的表达的相关中间体的产量。所指示的基因由CSY1246中的低拷贝质粒表达;“+”和“–”符号指示酶的存在或不存在。在LC-MS/MS分析之前,将菌株在含2%右旋糖的选择性培养基中于30℃下培养48小时。数据代表三个生物重复的平均值,并且误差条表示标准偏差。学生双尾t检验:*P<0.05,**P<0.01,***P<0.001。
图24示出了(A)LC-MS/MS色谱图,其示出了经工程改造的酵母菌株的液体培养物中产生的TA前体MPOB的特征三重峰,和(B)被工程改造以由质粒表达AbPYKS、AbCYP82M3和四种CPR中的一种的酵母菌株的液体培养物中的TA前体NMPy和MPOB的产量。本图示出了表达AbPYKS的经工程改造的菌株的培养基中的NMPy和MPOB的积累。(A)是用于检测仅由低拷贝质粒表达AbPYKS的CSY1246的细胞外培养基中的MPOB的代表性LC-MS/MS多反应监测(MRM)色谱图。三个特征MPOB异构体峰用(I)、(II)和(III)标记。在选择性培养基中于30℃下生长48小时之后,进行LC-MS/MS分析。(B)是在选择性培养基中于30℃下生长48小时之后的由低拷贝质粒表达AbPYKS、AbCYP82M3和四种CPR中的一种的CSY1246的细胞外培养基中的NMPy和MPOB(所有3个峰)的相对丰度。“+”和“–”符号指示基因的存在或不存在。数据代表三个生物重复的平均值;误差条指示标准偏差。
图25示出了生长温度对经工程改造的酵母的液体培养物中的TA前体托品碱和副产物古豆碱的产量的影响。本图示出了生长温度对产托品碱酵母菌株(CSY1248)中的自发古豆碱产量的影响。相对选择性代表相对托品碱滴度与相对古豆碱滴度的比率。在LC-MS/MS分析之前,将菌株在含2%右旋糖的非选择性培养基中于30℃或25℃下培养48小时。数据代表三个生物重复的平均值,并且误差条表示标准偏差。学生双尾t检验:*P<0.05,**P<0.01,***P<0.001。
图26示出了(A)根据本发明的实施例的ALD4和ALD6重建对有或没有乙酸盐补充的培养基上的产托品碱的经工程改造的酵母菌株的生长的影响,和(B)消除乙酸盐营养缺陷对产托品碱的经工程改造的酵母菌株的液体培养物中的副产物4MAB酸和古豆碱的产量的影响。本图示出了乙酸盐营养缺陷的消除在经工程改造的产托品碱酵母菌株中的作用。(A)是重建功能性ALD4或ALD6基因对有或没有乙酸盐补充的产NMPy酵母菌株(CSY1246)的生长的影响。ALD4和ALD6由低拷贝质粒表达。“WT”指示具有对照(BFP)质粒的CSY1246。相邻列示出十倍稀释。(B)是经工程改造的酵母中的具有重建的乙酸盐代谢的4MAB酸和古豆碱副产物的产量。“+”和“–”符号指示供给的代谢物(乙酸盐)或由低拷贝质粒表达的ALD4和ALD6基因的存在或不存在。在LC-MS/MS分析之前,将菌株在含2%右旋糖的选择性(YNB-DO)培养基中于30℃下培养48小时。数据代表三个生物重复的平均值,并且误差条表示标准偏差。学生双尾t检验:*P<0.05,**P<0.01,***P<0.001。
图27示出了(A)根据本发明的实施例的乙酸盐营养缺陷对被工程改造以产生托品碱的酵母菌株的液体培养物中的NMPy和托品酮之间的TA前体的积累的影响,和(B)有和没有乙酸盐营养缺陷的被工程改造以产生托品碱的酵母菌株的液体培养物中产生的TA前体MPOB的代表性LC-MS/MS色谱图。本图示出了重建ALD6活性对经工程改造的酵母中的NMPy至托品碱的代谢物通量的影响。(A)是有和没有功能性Ald6p的经工程改造的菌株中的NMPy和托品酮之间的中间体的产量。通过在补充有0.1%w/v乙酸钾的非选择性培养基中生长的整合产托品碱菌株(CSY1248)(灰色)或在没有乙酸盐补充的非选择性培养基中于25℃下生长48小时的具有重建ALD6的产托品碱菌株(CSY1249)(粉色)的细胞外培养基中的LC-MS/MSMRM测量中间体丰度。数据代表三个生物重复的平均值;误差条指示标准偏差。学生双尾t检验:*P<0.05,**P<0.01,***P<0.001。(B)是来自如(a)中所述培养的CSY1248(灰色)和CSY1249(红色)的MPOB产量的代表性MRM色谱图。
图28示出了经工程改造的酵母菌株的液体培养物中的TA前体托品碱和副产物古豆碱的产量的改进进程。本图提供了被工程改造以增加酵母中的托品碱产量的菌株的总结。“–”符号指示基因不存在;“p”和“i”分别指示来自低拷贝质粒或基因组整合的基因表达。在LC-MS/MS分析之前,将菌株在含2%右旋糖的选择性或非选择性培养基中于30℃或25℃下培养48小时。数据代表三个生物重复的平均值,并且误差条表示标准偏差。学生双尾t检验:*P<0.05,**P<0.01,***P<0.001。
图29示出了根据本发明的实施例的表达异源生物合成酶PMT、MPO、PYKS和CYP82M3的额外拷贝对经工程改造的酵母的液体培养物中的腐胺和托品碱之间的每种TA前体的产量的影响。本图标识了优化的产托品碱菌株(CSY1249)中的代谢瓶颈。将菌株CSY1249用表达BFP(“无过表达”)的对照质粒或表达AbPMT1、DmMPO1
图30示出了瓶颈酶PMT和PYKS的额外拷贝对经工程改造的酵母中的托品碱产量的影响。本图示出通过PMT和PYKS酶的额外拷贝的基因组整合对代谢瓶颈的缓解。在对生长培养基进行LC-MS/MS分析之前,将产托品碱菌株CSY1249和CSY1251在非选择性培养基中于25℃下培养48小时。数据代表三个生物重复的平均值,并且误差条表示标准偏差。学生双尾t检验:*P<0.05,**P<0.01,***P<0.001。
图31示出了表达异源乳酸盐脱氢酶和苯丙酮酸盐还原酶的经工程改造的酵母菌株的液体培养物中的TA前体酰基供体化合物PLA的产量。本图示出了被工程改造以将L-苯丙氨酸转化为3-苯基乳酸的酵母菌株的LC-MS/MS分析。酵母菌株被工程改造以具有低拷贝CEN/ARS质粒,所述质粒携带LEU2选择标志物、TDH3启动子和作为阴性对照的BFP编码序列;来自凝结芽孢杆菌(BcLLDH)、干酪乳杆菌(LcLLDH)、植物乳杆菌(LpLLDH)的LDH变体;或来自颠茄(AbPPR)、植物乳杆菌(LpPPR)、大肠杆菌(hcxB)或荧光威克酵母(WfPPR)的PPR变体。在96孔深孔微量滴定板中的300μL选择性培养基(-Leu)中,从新鲜转化的菌落中生长酵母。在25℃和460rpm的振荡培养箱中生长72小时之后,将酵母沉淀,并通过LC-MS/MS分析培养基上清液。数据基于提取离子色谱图(铵加合物,EIC m/z
图32示出了LC-MS/MS色谱图,其示出了表达苯丙氨酸解氨酶的经工程改造的酵母菌株的液体培养物中的TA前体酰基供体化合物肉桂酸的产量。本图示出了被工程改造以将L-苯丙氨酸转化为肉桂酸的酵母菌株的LC-MS/MS分析。酵母菌株被工程改造以具有低拷贝CEN/ARS质粒,所述质粒携带TRP1选择性标志物、TEF1启动子和(i)BFP或(ii)拟南芥苯丙氨酸解氨酶(AtPAL1)的编码序列。在96孔深孔微量滴定板中的300μL选择性培养基(-Trp)中,从新鲜转化的菌落中生长酵母。在30℃和460rpm的振荡培养箱中生长48小时之后,将酵母沉淀,并通过LC-MS/MS分析培养基上清液。色谱图迹线基于肉桂酸的最丰富的多反应监测(MRM)跃迁(m/z+149→131)示出了由这些菌株产生的肉桂酸。每条迹线代表三个样品。
图33示出了在经工程改造的酵母中表达的来自产TA茄科的UDP-葡糖基转移酶84A27(UGT84A27)直向同源物的底物特异性。本图示出了UGT84A27直向同源物对在经工程改造的酵母中表达的三种不同的类苯丙酸化合物的活性的比较。(A)是经工程改造的酵母中的作为UGT84A27的葡萄糖(Glu)受体测试的类苯丙酸化合物。上图,(D)-3-苯基乳酸(PLA);中图,反式肉桂酸(CA);下图,反式阿魏酸(FA)。(B)是被工程改造成用于UGT84A27表达的酵母将供给的类苯丙酸转化为葡糖苷的百分比的热图。UGT84A27直向同源物或BFP阴性对照由CSY1251中的低拷贝质粒表达。在LC-MS/MS分析之前,将转化的细胞在补充有500μM PLA、CA或FA的选择性培养基中培养72小时。数据代表n=3个生物独立样品的平均值±标准偏差。
图34示出了UGT84A27活性的色谱和质谱分析的实例。本图描绘了代表性LC-MS/MS迹线,其示出了如图33B中培养120小时的CSY1251中的AbUGT将PLA、CA和FA转化为同源葡糖苷以实现更完全的葡糖基化。对于PLA,酸(每幅图中的上迹线)和葡糖苷(每幅图中的下迹线)通过不同的NH
图35示出了用以改变底物特异性的AbUGT的结构导向活性位点工程改造。本图示出了AbUGT 3D结构的结构分析,以标识增加对PLA的活性的潜在突变。(A)是基于拟南芥水杨酸盐UDP-葡糖基转移酶UGT74F2及结合的UDP(PDB:5V2K)的晶体结构构建的AbUGT84A27的同源模型。基于对接模拟,PLA(橙色)以与UDP-葡萄糖(粉色)的优选结合姿态被示出。(B)是具有对接的D-PLA和UDP-葡萄糖的AbUGT活性位点的放大视图。示出了被标识成提高PLA选择性的潜在突变(F130Y、L205F、I292Q);虚线指示推定极性/氢键相互作用。
图36示出了AbUGT84A27活性位点突变体的底物特异性。本图示出了被工程改造成用于表达AbUGT突变体的酵母将供给的类苯丙酸转化为葡糖苷的百分比的热图。AbUGT野生型、活性位点突变体或BFP阴性对照由CSY1251中的低拷贝质粒表达。在LC-MS/MS分析之前,将转化的细胞在补充有500μM PLA、CA或FA的选择性培养基中培养72小时。数据代表n=3个生物独立样品的平均值±标准偏差。
图37示出了LC-MS/MS色谱图,其验证了被工程改造成用于托品碱产生的酵母中的PLA葡糖苷的逐步生物合成。本图示出了来自被工程改造成用于逐步重建PLA葡糖苷的酵母菌株的培养基的多反应监测(MRM)和提取离子色谱图(EIC)迹线。在对培养物上清液进行LC-MS/MS分析之前,将菌株在非选择性培养基中生长72小时。色谱图迹线代表三个生物复制。
图38示出了酵母中的葡萄糖的双重代谢归宿的生物合成途径示意图。本图示出了柠檬酸盐经由抑制糖酵解对葡糖苷产量的影响。缩写:HXK,己糖激酶;GPI,葡萄糖-6-磷酸盐异构酶;PFK,磷酸果糖激酶;PGM,磷酸葡萄糖变位酶;UGP,UDP-葡萄糖焦磷酸化酶。
图39示出了柠檬酸盐补充对经工程改造的酵母中的异源葡糖苷产量的影响。本图示出了2%柠檬酸盐补充对被工程改造成用于AbUGT表达的酵母将类苯丙酸转化为葡糖苷的影响。将菌株CSY1288在含或不含2%柠檬酸盐且没有额外补充的非选择性培养基中培养以评估内源产生的PLA的葡糖基化,或在补充500μM反式肉桂酸(CA)或反式阿魏酸(FA)的非选择性培养基中培养。在LC-MS/MS分析之前,将培养物生长72小时。数据代表n=3个生物独立样品(空心圆)的平均值,并且误差条表示标准偏差。学生双尾t检验:*P<0.05,**P<0.01,***P<0.001。
图40示出了被工程改造成用于UDP-葡萄糖生物合成酶的过表达的酵母菌株中的相对PLA葡糖苷产量。本图示出了过表达参与葡糖苷前体UDP-葡萄糖生物合成的天然酶对经工程改造的酵母中的PLA葡糖苷的产量的影响。酶或阴性对照(BFP)由菌株CSY1288中的低拷贝质粒表达。在对培养物上清液中的代谢物进行LC-MS/MS分析之前,将菌株在选择性培养基中培养72小时。数据代表n=3个生物独立样品(空心圆)的平均值,并且误差条表示标准偏差。学生双尾t检验:*P<0.05,**P<0.01,***P<0.001。统计显著性相对于相对应的对照示出。
图41示出了破坏内源葡糖苷酶的CSY1288中的相对PLA葡糖苷产量。本图示出了破坏三个天然糖苷酶基因中的每一个对经工程改造的酵母中的PLA葡糖苷的积累的影响。在对培养物上清液进行LC-MS/MS分析之前,将菌株在非选择性培养基中培养72小时。数据代表n=3个生物独立样品(空心圆)的平均值,并且误差条表示标准偏差。学生双尾t检验:*P<0.05,**P<0.01,***P<0.001。统计显著性相对于相对应的对照示出。
图42示出了LC-MS/MS色谱图,其示出了表达AbCYP80F1的经工程改造的酵母细胞的液体培养物中的由利托林产生药用TA前体莨菪碱醛。本图示出了被工程改造以将(R)-利托林转化为莨菪碱醛的酵母菌株的LC-MS/MS分析。酵母菌株被工程改造以具有低拷贝CEN/ARS质粒,所述质粒携带LEU2选择标志物、TDH3启动子和来自颠茄的利托林变位酶CYP80F1的编码序列(AbCYP80F1)。菌株额外具有第二个低拷贝质粒,所述质粒携带TRP1选择标志物、TDH3启动子和(i)作为阴性对照的BFP、(ii)酿酒酵母CPR(NCP1)或(iii)拟南芥CPR(AtATR1)的编码序列。在96孔深孔微量滴定板中的补充有1mM利托林的300μL选择性培养基(-Leu–-Trp)中,从新鲜转化的菌落中生长酵母。在30℃和460rpm的振荡培养箱中生长48小时之后,将酵母沉淀,并通过LC-MS/MS分析培养基上清液。色谱图迹线基于最丰富的MRM跃迁(m/z+288→124)示出了由这些菌株产生的莨菪碱醛。箭头指示推定莨菪碱醛峰。每条迹线代表三个样品。
图43示出了表达莨菪碱6β-羟化酶/双加氧酶(H6H)的直向同源物的经工程改造的酵母细胞的液体培养物中的从药用TA莨菪碱产生药用TA东莨菪碱。本图示出了表达H6H直向同源物的经工程改造的酵母菌株将(S)-莨菪碱转化为(S)-东莨菪碱。酵母菌株被工程改造以具有低拷贝CEN/ARS质粒,所述质粒携带LEU2选择标志物、TDH3启动子和作为阴性对照的BFP或来自曼陀罗(DsH6H)、三分三(AaH6H)、木本曼陀罗(BaH6H)或白曼陀罗(DmH6H)的H6H变体的编码序列。在96孔深孔微量滴定板中的补充有1mM莨菪碱的300μL选择性培养基(-Leu)中,从新鲜转化的菌落中生长酵母。在30℃和460rpm的振荡培养箱中生长48小时之后,将酵母沉淀,并通过LC-MS/MS分析培养基上清液。数据代表三个生物重复的平均值,并将其相对于供给的莨菪碱中的东莨菪碱污染物的量归一化。误差条代表标准偏差。基于m/z+304→138MRM跃迁的峰面积对相对东莨菪碱滴度进行定量。
图44示出了培养基中的辅因子可用性和补充对表达DsH6H的经工程改造的酵母细胞的液体培养物中的莨菪碱转化为东莨菪碱的影响。本图示出了辅因子补充对经工程改造的酵母中的(S)-莨菪碱转化为(S)-东莨菪碱的影响。酵母菌株被工程改造以具有低拷贝CEN/ARS质粒,所述质粒携带LEU2选择标志物、TDH3启动子和(i)作为阴性对照的BFP或(iii)来自曼陀罗的莨菪碱6β-羟化酶/双加氧酶(DsH6H)的编码序列。在96孔深孔微量滴定板中的补充有指示底物和/或辅因子的300μL选择性培养基(-Leu)中,从新鲜转化的菌落中生长酵母。在30℃和460rpm的振荡培养箱中生长48小时之后,将酵母沉淀,并通过LC-MS/MS分析培养基上清液。基于m/z+304→138MRM跃迁的积分峰面积对相对(S)-东莨菪碱滴度进行定量,并将其相对于表达DsH6H以及含所有补充的辅因子和底物的菌株归一化。数据代表三个生物重复的平均值,并且误差条指示标准偏差。Hyo,(S)-莨菪碱;2-OG,2-氧代戊二酸盐;L-AA,L-抗坏血酸。
图45示出了经由组织共表达数据的分析从颠茄转录组中标识的莨菪碱脱氢酶基因候选物的层次聚类热图。本图示出了颠茄转录组中的可能编码具有莨菪碱脱氢酶活性的酶的转录物的组织特异性表达谱的聚类。使用正态分布逐行缩放每种候选物的转录物表达。树状图通过组织特异性表达谱指示候选物的层次聚类。已知的TA途径基因通过名称标识;推定HDH候选物用基因座ID指示。黑色三角形指示针对活性进行筛选的候选物;双黑色三角形指示具有实验证实的HDH活性的候选物。
图46示出了表达莨菪碱脱氢酶(HDH)候选物的经工程改造的酵母细胞的液体培养物中的由利托林产生药用TA东莨菪碱。本图示出了从经工程改造的酵母中的颠茄转录组标识的HDH候选物的针对活性的实验筛选。酵母菌株被工程改造以由整合到基因组中的表达盒内的组成型启动子表达颠茄利托林变位酶(AbCYP80F1)和曼陀罗莨菪碱6β-羟化酶/双加氧酶(DsH6H),以及由携带TRP1选择标志物和TDH3启动子的低拷贝CEN/ARS质粒表达13种HDH候选物中的每一种中的一个。在96孔深孔微量滴定板中的补充有1mM利托林的300μL选择性培养基(-Trp)中,从新鲜转化的菌落中生长酵母。在30℃和460rpm的振荡培养箱中生长72小时之后,将酵母沉淀,并通过LC-MS/MS分析培养基上清液。基于m/z
图47示出了来自颠茄的莨菪碱脱氢酶的三维结构。本图示出了作为同源模型的AbHDH的结构的卡通示意图,所述同源模型基于作为模板的美洲颤杨芥子醇脱氢酶(PtSAD;PDB:1YQD)来构建。NADPH和Zn
图48示出了UniProt/SwissProt数据库中三种标识HDH直向同源物(AbHDH、DiHDH、DsHDH)以及最接近的蛋白质命中的系统发生树。本图示出了基于UniProt/SwissProt数据库的BLAST搜索的具有密切相关蛋白质序列的三种标识HDH酶直向同源物的聚类。所示出的序列包含基于E值的前50个BLASTp命中,以及从接下来的100条中选择的10个附加命中。在ClustalX2中,经由n=1000次试验的自展邻接推导出系统发生关系,并用FigTree软件将所得的树可视化。缩写:ADH,醇脱氢酶;CADH,肉桂醇脱氢酶;MTDH,甘露醇脱氢酶;DPAS,脱氢前骨节心蛤碱(dehydroprecondylocarpine)乙酸盐合酶;8HGDH,8-羟基香叶醇脱氢酶;GDH,香叶醇脱氢酶;GS,缝籽嗪合酶;REDX,未指明的氧化还原蛋白。
图49示出了表达莨菪碱脱氢酶直向同源物的经工程改造的酵母细胞的液体培养物中的由利托林产生药用TA东莨菪碱。本图示出了在经工程改造的酵母中表达的标识HDH酶直向同源物之间的活性的比较。酵母菌株被工程改造以由整合到基因组中的表达盒内的组成型启动子表达颠茄利托林变位酶(AbCYP80F1)和曼陀罗莨菪碱6β-羟化酶/双加氧酶(DsH6H),由携带TRP1选择标志物和TDH3启动子的低拷贝CEN/ARS质粒表达三种HDH直向同源物(AbHDH、DiHDH、DsHDH)中的每一种中的一个,以及由携带LEU2选择标志物和TDH3启动子的低拷贝CEN/ARS质粒表达DsH6H的额外拷贝。在96孔深孔微量滴定板中的补充有1mM利托林的300μL选择性培养基(-Leu-Trp)中,从新鲜转化的菌落中生长酵母。在30℃和460rpm的振荡培养箱中生长72小时之后,将酵母沉淀,并通过LC-MS/MS分析培养基上清液。基于m/z
图50示出了被工程改造成用于表达CYP80F1、HDH和H6H的酵母将供给的利托林转化为东莨菪碱的实验验证。本图示出了来自被工程改造成用于将利托林转化为东莨菪碱的酵母菌株的培养基的多反应监测(MRM)LC-MS/MS迹线。在对培养物上清液中的代谢物进行LC-MS/MS分析之前,将菌株在补充有1mM利托林的非选择性培养基中培养72小时。右下图中的深色迹线(CSY1294,东莨菪碱)代表125nM(38μg/L)东莨菪碱标准品。色谱图迹线代表三个生物复制
图51示出了SCPL酰基转移酶(SCPL-AT)的经典植物ER-液泡运输和成熟途径。本图示出了植物中的SCPL-AT所遵循的典型ER-液泡蛋白质运输途径的示意图,其中颠茄利托林合酶(AbLS)作为实例示出。带圆圈的数字指示SCPL-AT表达和活性中的主要步骤,包括(1)ER腔和(2)高尔基体的成熟,(3)向液泡的运输,和液泡的(4)底物输入和(5)产物输出。
图52示出了在经工程改造的酵母中表达的来自颠茄的野生型利托林合酶的共定位。本图示出了被工程改造成用于表达N端GFP标记的AbLS(GFP-AbLS)并用液泡膜染色剂FM4-64染色的酵母的落射荧光显微术。对由低拷贝质粒表达GFP-AbLS的CSY1294进行显微术。比例尺标尺,5μm。
图53示出了经由信号序列替换将利托林合酶强制定位于不同的酵母亚细胞区室的策略。本图示出了一种蛋白质工程改造方法,用于修饰AbLS的亚细胞定位,以解决不同区室中的底物可用性的潜在限制。(A)是经由信号序列交换进行AbLS定位所靶向的酵母亚细胞区室的示意图。为每个区室都指示了信号序列源蛋白质。(B)是被选择用于AbLS信号序列替换的末端和残基。基于UniProt/SwissProt数据库中的结构注释选择包括每个信号序列结构域的残基。
图54示出了在烟草中表达并用去糖基化酶处理的野生型AbLS的蛋白质印迹。本图示出了在植物中表达的AbLS的糖基化修饰类型的标识。C端HA标记的AbLS经由农杆菌渗入在本特哈曼烟草叶中瞬时表达。粗叶提取物未经处理(泳道1:“--”),或者用肽N-糖苷酶F(PNG酶F;泳道2:“N”)或O-糖苷酶(泳道3:“O”)处理以分别去除N-或O-连接的糖基化。通过在NuPAGE 4-12%Bis-Tris凝胶上电泳分离粗提取物,然后转移到硝酸纤维素膜,以使用嵌合的兔IgGκ抗HA HRP缀合抗体进行免疫检测。所有电泳和印迹步骤都在二硫键还原条件下进行(参见在线方法)。泳道“L”,Bio-Rad Precision Plus Dual Color蛋白质梯。
图55示出了在酵母和烟草中表达的AbLS糖基化位点突变体的蛋白质印迹。本图示出了在酵母和烟草中表达的AbLS所存在的N-糖基化模式的比较。C端HA标记的野生型AbLS、单糖基化位点突变体(N→Q)或四重突变体经由农杆菌渗入在本特哈曼烟草(“Nb”)中瞬时表达(A)或由CSY1294(“酵母”)的低拷贝质粒表达(B)。烟草和酵母粗提物的制备在变性、二硫键还原条件下进行(参见在线方法)。通过在NuPAGE 4-12%Bis-Tris凝胶上电泳分离粗提取物,然后转移到硝酸纤维素膜,以使用嵌合的兔IgGκ抗HA HRP缀合抗体进行免疫检测。所有电泳和印迹步骤都在二硫键还原条件下进行(参见在线方法)。对于(A)和(B),包含相对应的酵母和烟草表达的对照,以进行比较。泳道“L”,Bio-Rad Precision Plus DualColor蛋白质梯。
图56示出了利托林合酶中的推定内切蛋白酶解前肽去除的系统发生标识。本图示出了AbLS与已知具有(AtSCT、AsSCPL1、TaCBP2)或缺乏(AtSMT、yPRC1)蛋白酶解去除的内部前肽连接子(粗体,灰色)的经表征的丝氨酸羧肽酶和SCPL酰基转移酶的序列比对。推定N端信号肽以粗体(黑色)指示;二硫键指示为连接线。AtSCT,拟南芥芥子酰基葡萄糖:胆碱芥子酰基转移酶;AtSMT,拟南芥芥子酰基葡萄糖:苹果酸盐芥子酰基转移酶;AbLS,颠茄利托林合酶;AsSCPL1,糙伏毛燕麦燕麦根皂苷合酶;TaCBP2,小麦羧肽酶2;yPRC1,酵母羧肽酶Y。
图57示出了利托林合酶中的推定内切蛋白酶解前肽去除的结构标识。本图示出了两种SCPL-AT(其中一种已知含有蛋白酶解去除的内部前肽序列)的三维结构的比较。左侧:TaCBP2(PDB:1WHT)的晶体结构的卡通示意图(上图)和示出了二硫键和内部前肽去除位点的表面示意图(下图)。右侧:基于TaCBP2的晶体结构的AbLS同源模型的卡通示意图(上图)和示出了N端信号肽、二硫键和看似阻断活性位点通路的推定内部前肽的表面示意图(下图)。
图58示出了酵母中的AbLS分裂对照和推定前肽交换变体的蛋白酶解切割模式的分析。本图示出了由在经工程改造的酵母中表达的AbLS分裂对照和前肽变体产生的蛋白质片段大小的蛋白质印迹分析。C端HA标记的AbLS变体由CSY1294中的低拷贝质粒表达(泳道1-6);在本特哈曼烟草(Nb)中表达的HA标记的野生型AbLS被示出为附加对照(泳道7)。在二硫键还原条件下进行凝胶电泳和印迹,并且使用抗HA抗体进行检测(参见在线方法)。泳道符号:L,蛋白质分子量梯;WT,野生型AbLS;SPL,两个片段上都具有信号肽的推定前肽处的AbLS分裂;SPL-T,任一片段上没有信号肽的推定前肽处的AbLS分裂;GS,野生型前肽交换为柔性Gly-Ser连接子的AbLS变体;SCT,野生型前肽交换为AtSCT前肽序列的AbLS变体;CUT,野生型前肽交换为被Kex2p蛋白酶识别和切割的合成多聚精氨酸位点的AbLS变体。
图59示出了被工程改造成用于表达AbLS N端融合体的酵母菌株中的从头莨菪碱和东莨菪碱产量。本图示出了表达具有融合到N端的不同可溶性蛋白质结构域的AbLS的酵母菌株中的从头莨菪碱和东莨菪碱产量的比较。野生型(对照)或AbLS融合体由CSY1294中的低拷贝质粒表达。在对培养物上清液中的代谢物进行LC-MS/MS分析之前,将转化菌株在选择性培养基中培养96小时。数据代表n=3个生物独立样品(空心圆)的平均值,并且误差条表示标准偏差。学生双尾t检验:*P<0.05,**P<0.01,***P<0.001。
图60示出了用于缓解液泡TA运送限制的CSY1296中表达的烟草生物碱转运蛋白的荧光显微术。本图示出了表达烟草生物碱转运蛋白的经工程改造的酵母的荧光显微术图像,所述转运蛋白在其C端处融合到GFP,以能够标识其亚细胞定位。(A)NtJAT1和(B)NtMATE2的C端GFP融合体由CSY1296中的低拷贝质粒表达。比例尺标尺,5μm。
图61示出了被工程改造成用于表达异源生物碱转运蛋白的CSY1296中的托品碱、莨菪碱和东莨菪碱的产量。本图示出了不同的植物生物碱转运蛋白在缓解被工程改造成用于TA产生的酵母中的细胞内底物运送限制中的实用。烟草茉莉酮酸盐诱导型生物碱转运蛋白1(NtJAT1)、多药和毒素挤出(MATE)转运蛋白1或2或阴性对照(BFP)由CSY1296中的低拷贝质粒表达。在对培养物上清液中的代谢物进行LC-MS/MS分析之前,将转化菌株在选择性培养基中培养96小时。数据代表n=3个生物独立样品(空心圆)的平均值,并且误差条表示标准偏差。学生双尾t检验:*P<0.05,**P<0.01,***P<0.001。
图62示出了(A)产物离子模式和(B)多反应监测模式下的LC-MS/MS色谱图,其示出了经工程改造的酵母中的非天然TA肉桂酰托品碱的从头产量。本图示出了产生非天然TA肉桂酰托品碱的经工程改造的酵母菌株的LC-MS/MS分析。(A)是(i)产托品碱菌株CSY1251;(ii)表达苯丙氨酸解氨酶(AtPAL1)、4-香豆酸盐-CoA连接酶5(At4CL5)和可卡因合酶(EcCS)的CSY1251(注释为CSY1282)或(iii)母体质量m/z+=272的真正的肉桂酰托品碱标准品的细胞外培养基的串联MS/MS谱。蓝色菱形指示母体化合物峰。(B)是经由底物供给验证EcCS酰基转移酶对肉桂酸和α-托品碱的活性。用表达AtPAL1(低拷贝质粒pCS4252)和/或At4CL5和EcCS(高拷贝质粒pCS4207)的质粒的组合转化菌株,然后在具有如下不同补充底物的培养基中培养:(i)CEN.PK2+At4CL5+EcCS+0.1mM反式肉桂酸;(ii)CEN.PK2+At4CL5+EcCS+0.5mMα-托品碱;(iii)CEN.PK2+AtPAL1+At4CL5+EcCS;(iv)CEN.PK2+AtPAL1+At4CL5+EcCS+0.5mMα-托品碱;(v)CSY1251+At4CL5+EcCS;(vi)CSY1251+At4CL5+EcCS+0.2mM反式肉桂酸;(vii)CSY1251+AtPAL1+At4CL5+EcCS;(viii)25nM肉桂酰托品碱标准品。对于(A)和(B),在LC-MS/MS分析之前,将酵母菌株在选择性培养基(YNB-DO+2%右旋糖+5%甘油)中于25℃下培养72小时。
图63示出了不同碳源(A)单独供给或(B)与右旋糖一起供给对经工程改造的酵母的液体培养物中的托品碱和相关TA前体的产量的影响。本图示出了对碳源的优化以提高经工程改造的酵母中的托品碱产量。将产托品碱菌株CSY1249(参见实例3.3.4)的过夜培养物在非选择性丰富培养基(YPD)中生长。将过夜培养物沉淀,并重悬在含所有氨基酸和(A)2%每种碳源或(B)2%右旋糖和2%每种额外碳源(包含右旋糖)的非选择性限定培养基(YNB-SC)中。在通过LC-MS/MS分析生长培养基之前,将培养物在25℃下生长48小时。数据示出了每种代谢物的相对于(A)2%右旋糖或(B)2%+2%右旋糖归一化的相对滴度。数据代表三个生物重复的平均值,并且误差条指示标准偏差。
图64示出了产东莨菪碱菌株CSY1296的代谢瓶颈分析。本图示出了表达通量限制酶的额外拷贝对经工程改造的酵母中的TA和TA前体的产量的影响。托品碱和东莨菪碱之间的每种生物合成酶的额外拷贝由菌株CSY1296中的以下低拷贝质粒表达:(A)WfPPR,pCS4436;(B)AbUGT,pCS4440;(C)DsRed-AbLS,pCS4526;(D)AbCYP80F1,pCS4438;(E)DsHDH,pCS4478;(F)DsH6H,pCS4439;或对应于与每种生物合成基因质粒相同的营养缺陷型标志物的BFP对照(pCS4208、pCS4212或pCS4213)。在通过LC-MS/MS对生长培养基中的代谢物进行定量之前,将转化菌株在适当的选择性培养基中于25℃下培养96小时。数据指示n=3个生物独立样品(空心圆)的平均值,并且误差条表示标准偏差。学生双尾t检验:*P<0.05,**P<0.01,***P<0.001。
图65示出了缓解通量和运送限制对经工程改造的酵母中的莨菪碱和东莨菪碱产量的影响。本图示出了酵母菌株CSY1296和CSY1297(其中后者具有通量限制酶的额外基因组拷贝(WfPPR和DsH6H)以及烟草液泡生物碱输入子(NtJAT1))中的从头莨菪碱和东莨菪碱产量的比较。在对培养物上清液中的代谢物进行LC-MS/MS分析之前,将菌株在非选择性培养基中培养96小时。数据代表n=3个生物独立样品(空心圆)的平均值,并且误差条表示标准偏差。学生双尾t检验:*P<0.05,**P<0.01,***P<0.001。
图66示出了经由线性回归和层次聚类策略标识推定TA转运蛋白候选物的实例。本图提供了热图和树状图,其示出了经由相对于诱饵基因的斜率系数P<0.01的线性回归分析从颠茄转录组标识的所有TA转运蛋白候选物的层次聚类。指示了已知的TA相关基因和经实验验证的两种新型TA转运蛋白候选物中的一种,即AbPUP1;所有其它行代表未经表征的转运蛋白候选物。第二种经实验验证的候选物AbLP1与诱饵基因的相关性不够强,因此未在本分析中标识。组织缩写:FL,花;MS,成熟种子;PT,初生主根;SS,无菌苗;CA,愈伤组织;SR,次生根;ST,茎;RF,成熟果实;GF,未成熟果实;LF,叶;FB,花蕾。
图67描绘了用于训练、优化和测试二元分类器模型以预测来自颠茄转录组的新型TA相关基因的数据分类策略。本图示出了用于在数据集预处理后生成颠茄转录物的训练输出值的流程图。“TA”:转录物编码在TA生物合成中具有已知作用的基因产物;“non-TA”:转录物编码已知不参与TA生物合成的基因产物;“未知”:转录物编码在TA生物合成中具有未知作用的基因产物。数值指示转录物的数量。
图68示出了二进制分类器模型在训练、交叉验证和测试中的性能。本图描绘了在颠茄转录组上训练和交叉验证的三个监督二元分类器模型的TA相关基因预测性能的比较。使用四种不同的过采样方法(无:未进行过采样;ROSE:随机过采样实例:SMOTE:合成少数类过采样技术;升采样,随机过采样)中的一种和两种不同性能度量(精度:正确预测样品占样品总数的分数;ROC:接收者操作特征曲线下面积(其可绘出真阳性率及假阳性率))中的一种来训练三个二元分类器模型。
图69也示出了二进制分类器模型在训练、交叉验证和测试中的性能。本图描绘了三个监督二进制分类器模型在与图68相同的数据集上进行训练、交叉验证和测试所需的计算时间的比较。使用四种不同的过采样方法(无:未进行过采样;ROSE:随机过采样实例:SMOTE:合成少数类过采样技术;升采样,随机过采样)中的一种和两种不同性能度量(精度:正确预测样品占样品总数的分数;ROC:接收者操作特征曲线下面积(其可绘出真阳性率及假阳性率))中的一种来训练三个二元分类器模型。
图70示出了二元分类器模型在测试中的性能。本图描绘了混淆矩阵,其示出了三个优化的二元分类器模型中的每一个在测试数据(与图66-图69中相同的数据集)上的预测性能。使用过采样技术和性能度量来训练和交叉验证逻辑回归(glm)、随机森林(ranger)和神经网络(nnet)二元分类器,这得到了图68-图69中的最大平衡精度和最小计算时间。注意,圆楔形仅在每个矩阵行内按比例示出。
图71示出了用于预测来自颠茄转录组的TA相关基因的最终优化神经网络的简化示意图。本图示出了具有11-5-1架构的神经网络,其预测性能在图70(nnet)中示出。
图72示出了颠茄推定TA转运蛋白的系统发生分析。本图描绘了系统发生树,其示出了颠茄推定TA转运蛋白(AbPUP1、AbLP1、AbCT1)、经实验表征的植物生物碱转运蛋白和所选择的经表征的小分子转运蛋白之间的关系。每个分叉点处的数值表示n=1000次迭代中的自展次数。比例尺标尺,每个氨基酸位点的取代数。物种:At,拟南芥;Nt,烟草;Ps,罂粟;Ec,大肠杆菌;Cr,长春花;Os,水稻。
图73示出了被工程改造成用于从头产生TA的酵母中的细胞代谢物运送限制。本图示出了示意图,其示出了本说明书中描述的经工程改造的酵母中的代谢模块和关键代谢物运送步骤。TA生物合成分布于五个代谢模块(I-V)和五个细胞区室:线粒体、过氧化物酶体、内质网(ER)、液泡和胞质溶胶。由托品碱和苯基乳酸(PLA)葡糖苷组装TA支架的中心酯化反应由液泡中的具有N端融合荧光蛋白DsRed的利托林合酶(AbLS)催化。对于本反应,底物(托品碱和PLA葡糖苷)必须输入到液泡腔,并且产物(利托林)必须输出到胞质溶胶。针对每个模块示出了主要的起始材料和产物。指示了与运送有关的关键中间体和产物的电荷(“+”,正电;无符号,不带电)。蛋白质名称:NtJAT1,烟草茉莉酮酸盐诱导型生物碱转运蛋白1;NtMATE2,烟草多药和毒素挤压转运蛋白2;AbPUP1,颠茄嘌呤摄取通透酶样转运蛋白1;AbLP1,颠茄乳糖通透酶样转运蛋白1;PdrXp,酵母多向耐药性转运蛋白。
图74示出了用于在酵母中经由染色体整合进行途径构建的遗传模块。本图是示意图,其描绘了用于酵母菌株构建的代谢基因的基因组布局。框箭头代表带有启动子(线箭头)和终止子(线“T”)的基因表达盒。异源基因的属和种来源由基因名称前的两个字母指示;无来源符号指示天然酵母基因(如果全部大写)或大肠杆菌基因(speB)。基因名称上标注释指示N端或C端修饰;短横线符号(-)指示融合蛋白。
图75示出了用于在酵母中从头生物合成药用托品烷生物碱和衍生物的经工程改造的途径。本图示出了可以用于将简单前体转化为药用托品烷生物碱和N-取代衍生物的经工程改造的生化途径的示意图。酶符号:Arg2p,谷氨酸盐N-乙酰基转移酶;Car1p,精氨酸酶;AsADC,燕麦精氨酸脱羧酶;speB,大肠杆菌胍丁胺脲水解酶;Spe1p,鸟氨酸脱羧酶;Fms1p,多胺氧化酶;Meu1p,甲硫腺苷磷酸化;Oaz1p,鸟氨酸脱羧酶抗酶-1;AbPMT1,颠茄腐胺N-甲基转移酶1;DsPMT1,曼陀罗腐胺N-甲基转移酶1;DmMPO1
图76示出了推定TA转运蛋白表达对经工程改造的酵母中的TA滴度的影响。本图示出了被工程改造成用于表达推定TA转运蛋白的酵母中的TA产量。转运蛋白候选物或蓝色荧光蛋白(BFP)对照由CSY1300中的低拷贝质粒表达,并且在选择性培养基中生长96小时之后,通过LC-MS/MS对上清液中的代谢物进行定量。数据代表n=3个生物独立样品(空心圆)的平均值,并且误差条表示标准偏差。学生双尾t检验:*P<0.05,**P<0.01,***P<0.001。
图77示出了经工程改造的酵母中的TA转运蛋白C端GFP融合体的亚细胞定位。本图描绘了被工程改造成用于表达用荧光蛋白标记的TA转运蛋白的酵母的荧光显微术图像。AbPUP1-GFP和AbLP1-GFP由CSY1300中的低拷贝质粒表达(参考实例方法)。比例尺标尺,2mm。
图78示出了颠茄推定TA转运蛋白的结构分析。本图示出了AbPUP1(a,c)和AbLP1(b,d)的Kyte-Doolittle亲水性图(a,b)和预测膜跨膜拓扑图(c,d)。本图还提供了(e)基于酵母中的计算机结构分析和实验表征的AbPUP1(左侧)和AbLP1(右侧)的预测定向和细胞功能。示出了转运蛋白同源模型的圆柱体表示。
图79示出了推定TA转运蛋白的基因本体论(GO)分析。本图描绘了颠茄推定TA转运蛋白的基因本体论预测图。在同源建模(参见图78e)的同时,进行了AbPUP1(a-c)和AbLP1(d-f)的细胞组分(a,d)、生物过程(b,e)和分子功能(c,f)的GO分析。方框阴影指示相对应GO术语的置信度评分(C评分)。
图80示出了酵母中的推定TA转运蛋白底物的说明。本图提供了生长曲线,其示出了AbPUP1和AbLP1对酵母中生物碱耐受性的影响。将由低拷贝质粒表达蓝色荧光蛋白(对照)、AbPUP1或AbLP1的菌株AD1-8在补充有0-20mM生物碱的选择性培养基中培养;因为较高的测试浓度会严重阻滞AD1-8的生长,从而使生长测量不可行,所以托品碱仅以1mM补充在培养基中。实线和阴影/影线条分别指示n=3个生物学独立样品的平均值和标准偏差。
图81也示出了酵母中的推定TA转运蛋白底物的说明。本图示出了转运蛋白底物特异性(θ
图82示出了酵母中的推定TA转运蛋白运送机制的说明。本图提供了生长曲线,其示出了酵母中的AbPUP1和AbLP1的TA运送的H
图83也示出了酵母中的推定TA转运蛋白运送机制的说明。本图提供了生长曲线,其示出了单价阳离子对酵母中的AbPUP1和AbLP1的TA运送的影响。将由低拷贝质粒表达蓝色荧光蛋白(对照)、AbPUP1或AbLP1的菌株AD1-8在补充有20mM莨菪碱和0-100mM NaCl或KCl的选择性培养基中培养。“--”指示盐补充量未超过酵母氮基中已经存在的盐量。实线和阴影/影线条分别指示n=3个生物学独立样品的平均值和标准偏差。
图84示出了氧化还原辅因子可用性、细胞内运送、原养型和培养条件的优化提高了酵母中的TA产量。本图提供了用以增加经工程改造的酵母中的莨菪碱和东莨菪碱的从头产量的菌株优化的图解总结。在通过LC-MS/MS对上清液中的TA进行定量之前,将菌株在适当的选择性或非选择性培养基中培养96小时。符号:--,酶的缺乏和/或编码基因的破坏;P,由低拷贝质粒表达;+,由染色体基因拷贝表达;++,由天然基因拷贝加上额外的染色体拷贝表达;ub,无缓冲生长培养基;5.8,用0.1M磷酸钾缓冲至pH 5.8的生长培养基。数据代表n=3个生物独立样品(空心圆)的平均值,并且误差条表示标准偏差。学生双尾t检验:*P<0.05,**P<0.01,***P<0.001。
图85示出了在酵母中测试的NADPH再生酶候选物催化的经典反应。
图86示出了NADPH再生酶过表达对经工程改造的酵母中的TA滴度的影响。本图示出了表达不同的NADPH再生酶的经工程改造的产TA酵母中的TA产量。酶编码基因或BFP对照由菌株CSY1300中的低拷贝质粒过表达,并且在选择性培养基中生长96小时之后,通过LC-MS/MS对上清液中的代谢物进行定量。数据代表n=3个生物独立样品(空心圆)的平均值,并且误差条表示标准偏差。
图87示出了尿嘧啶原养型并不提高CSY1323中的TA产量。本图示出了被工程改造成用于尿嘧啶原养型的酵母菌株中的TA产量。通过由CSY1323中的低拷贝质粒表达Ura3p来赋予尿嘧啶原养型。在对上清液中的TA滴度进行LC-MS/MS分析之前,将转化菌株在选择性培养基中培养96小时。指示了如图84中示出的CSY1323(具有尿嘧啶和色氨酸营养缺陷型)产生的TA滴度,以用于比较。数据代表n=3个生物独立样品(空心圆)的平均值,并且误差条表示标准偏差。
图88示出了培养基pH缓冲对经工程改造的酵母中的TA滴度的影响。本图示出了优化曲线,其描绘了细胞外培养基pH对经工程改造的酵母中的TA产量的影响。将菌株CSY1324在用0.1M磷酸钾(K
图89示出了用0.1M磷酸钾进行培养基pH缓冲对CSY1323中的TA产量的影响。本图示出了优化曲线,其描绘了细胞外培养基pH对经工程改造的酵母中的TA产量的影响。将菌株CSY1323在用0.1M磷酸钾(K
图90示出了使用ATLASx预测与莨菪碱和东莨菪碱相差一步的TA衍生物的计算机生物合成网络扩展的实例。本图示出了代谢图,其使用莨菪碱和东莨菪碱作为查询并使用默认保守原子比(CAR)阈值0.34从ATLASx chemATLAS数据库的一代搜索中生成。ATLASx化合物ID号示出在每个结构的下方。箭头代表预测的一步酶促反应;箭头颜色指示CAR。
图91示出了在经工程改造的酵母中产生去甲托品烷生物碱的示例性策略。本图示出了针对酵母中的去甲托品烷生物碱(norTA)的从头产量使用ATLASx扩展的TA生物合成途径的简化示意图。虚线箭头指示缩略的途径步骤。H6H,莨菪碱6β-羟化酶/双加氧酶;HsCYP,人肝细胞色素P450;CPR,酵母NADPH-CYP450还原酶(Ncp1p);CYB5,人细胞色素b5。
图92示出了用于酵母NADPH:细胞色素P450还原酶(NCP1)、人细胞色素B5(HsCYB5A)和人肝CYP450候选物(HsCYPXXX)在酵母中的异源共表达的遗传构建体的示意图。构建体1由具有TRP1营养缺陷型标志物的低拷贝质粒表达,其编码融合蛋白,所述融合蛋白包括Ncp1p的完整开放阅读框,所述开放阅读框使用Arg-Arg-Ala三肽连接子融合到在残基104后截短以去除其C端ER膜锚的HsCYB5A的N端。构建体2由具有URA3营养缺陷型标志物的低拷贝质粒表达,其编码八种HsCYP候选物中的一种。
图93示出了用于明确标识TA和衍生物的LC-MS/MS方法的开发的示例性结果。本图描绘了10μM水性标准品的代表性色谱图。每种TA和衍生物可以使用多反应监测(MRM)质量跃迁和保留时间的独特组合来标识;没有两种具有相同母体质量(或共享质量跃迁)的化合物以相同的保留时间洗脱。色谱法和MRM检测参数的溶剂梯度在表8-表10中提供。
图94示出了人肝CYP表达对经工程改造的酵母中的去甲托品烷生物碱产量的影响。本图示出了经工程改造的酵母中的去甲莨菪碱(上图)和去甲东莨菪碱(下图)的滴度和摩尔产量比。CYP或BFP对照由CSY1324中的低拷贝质粒表达,并且在用0.1M磷酸钾缓冲至pH5.8(上图)或未缓冲(下图)的选择性培养基中生长96小时之后,通过LC-MS/MS对上清液中的代谢物进行定量。数据代表n=3个生物独立样品(空心圆)的平均值,并且误差条表示标准偏差。学生双尾t检验:*P<0.05,**P<0.01,***P<0.001。
图95示出了经工程改造的酵母中的去甲托品烷生物碱产量的分析验证。本图描绘了由表达HsCYP2D6并如图94中培养的CSY1324或真实化学标准品从头产生的norTA的代表性LC-MS/MS多反应监测(MRM)色谱图。色谱图代表n=3个生物独立样品。
图96示出了使用BridgIT在经工程改造的酵母中实现TA N-氧化物的从头生物合成的计算机酶预测的结果。本图示出了千里光碱N-加氧酶(SNO)和吡咯里西啶N-加氧酶(PNO)(二者是通过BridgIT预测的实现TA N-加氧评分最高的酶)的天然反应(左侧)和目标反应(中间、右侧)的比较。示出了天然SNO/PNO转化的KEGG反应ID、ATLASx反应ID和目标转化的BridgIT最接近的KEGG反应匹配。目标反应箭头旁边的数值指示BridgIT评分。
图97示出了经工程改造的酵母中的托品烷N-氧化物产量的分析验证。本图描绘了分析表达SNO/PNO的CSY1324或真实化学标准品从头产生TA N-氧化物的LC-MS/MS MRM色谱图。来自朱砂蛾(TjSNO)、内华达虎蛾(GgPNO)和臭腹腺蝗(ZvPNO)的SNO/PNO候选物由CSY1324中的低拷贝质粒表达,并且在用0.1M磷酸钾缓冲至pH 5.8(对于莨菪碱N-氧化物)或未缓冲(对于东莨菪碱N-氧化物)的选择性培养基中生长96小时之后,分析上清液中的代谢物。色谱图代表n=3个生物独立样品。
定义
在更详细地描述示例性实施例之前,阐述了以下定义来说明和定义说明书中使用的术语的含义和范围。
除非另有定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。Singleton等人,DICTIONARY OF MICROBIOLOGY ANDMOLECULAR BIOLOGY,第2版,John Wiley and Sons,纽约(1994)以及Hale和Markham,THEHARPER COLLINSDICTIONARY OF BIOLOGY,Harper Perennial,纽约(1991)为技术人员提供了本文使用的许多术语的一般含义。然而,为了清楚和便于参考,下面定义了某些术语。
注意,如本文和所附权利要求中所使用,单数形式“一个(a)/一种(an)”和“所述”包含复数指示物,除非上下文另有明确规定。例如,术语“引物”是指一个或多个引物,即单个引物和多个引物。还应注意,权利要求被起草为排除任何任选的元素。因此,本陈述旨在用作与权利要求元素的叙述或“负面”限制的使用相关的如“仅仅”、“仅”等排他性术语的使用的前提基础。
如本文使用,术语“确定”、“测量”、“评定”和“测定”可互换使用,并且包括定量和定性确定。
如本文使用,术语“多肽”是指任何长度的氨基酸的聚合形式,包括长度范围为2-50个氨基酸的肽和长度大于50个氨基酸的多肽。术语“多肽”和“蛋白质”在本文中可互换使用。术语“多肽”包括编码和非编码氨基酸的聚合物,化学或生物化学修饰或衍生的氨基酸以及具有修饰的肽主链的多肽(其中常规主链被非天然存在的或合成的主链取代)。多肽可以是任何方便的长度,例如2个或更多个氨基酸,如4个或更多个氨基酸、10个或更多个氨基酸、20个或更多个氨基酸、50个或更多个氨基酸、100个或更多个氨基酸、300个或更多个氨基酸,如至多500或1000个或更多个氨基酸。“肽”可以是2个或更多个氨基酸,如4个或更多个氨基酸、10个或更多个氨基酸、20个或更多个氨基酸,如至多50个氨基酸。在一些实施例中,肽的长度在5和30个氨基酸之间。
如本文使用,术语“分离的”是指在纯化之前,感兴趣的部分至少60%游离、至少75%游离、至少90%游离、至少95%游离、至少98%游离、甚至至少99%游离于与所述部分相关的其它组分。
如本文使用,术语“由……编码”是指编码多肽序列的核酸序列,其中所述多肽序列或其部分含有来自所述核酸序列编码的多肽的3个或更多个氨基酸,如5个或更多个、8个或更多个、10个或更多个、15个或更多个、或20个或更多个氨基酸的氨基酸序列。所述术语还涵盖可用所述序列编码的多肽免疫标识的多肽序列。
“载体”能够将基因序列转移到靶细胞。如本文使用,术语“载体构建体”、“表达载体”和“基因转移载体”可互换使用以意指能够指导感兴趣的基因的表达并且可以将基因序列转移到靶细胞的任何核酸构建体,这通过载体的全部或部分的基因组整合或载体作为染色体外元件的瞬时或遗传性维持来实现。因此,所述术语包括克隆和表达媒剂以及整合载体。
“表达盒”包含能够指导感兴趣的基因/编码序列的表达的任何核酸构建体,其与表达盒的启动子可操作地连接。这种表达盒被构建成“载体”、“载体构建体”、“表达载体”或“基因转移载体”,以便将表达盒转移到靶细胞中。因此,所述术语包括克隆和表达媒剂以及病毒载体。
“多个”含有至少2个成员。在某些情况下,多个可以具有10个或更多个,如100个或更多、1000个或更多、10,000个或更多个、100,000个或更多个、106个或更多个、107个或更多个、108个或更多个、或109个或更多个成员。在任何实施例中,多个可以具有2-20个成员。
术语“托品烷生物碱产物”旨在指其骨架含有8-氮杂双环[3.2.1]辛烷核心基团的任何分子,所述核心基团包括环庚烷环和连接碳原子1和5的氮桥,其中8-氮杂双环[3.2.1]辛烷基通过3位的酯键与酰基共价结合,并且/或者其中8-氮杂双环[3.2.1]辛烷基用3位的羟基和2、4、5、6和/或7位的一个或多个羟基官能化。托品烷生物碱产物包括但不限于利托林、莨菪碱、阿托品、山莨菪碱、东莨菪碱、可卡因和任何其它类似的托品碱/假托品碱+酰基天然或非天然托品烷生物碱(例如,打碗花精)。
术语“托品烷生物碱产物前体”旨在指可以由生物体由碳源和氮源生物合成并且可以在一个或多个(例如,一个或两个)生物合成步骤中转化为托品烷生物碱产物的任何分子;其中所述碳源是碳水化合物、非碳水化合物糖、糖醇、脂质、脂肪酸或通过代谢途径转化为上述碳源中的一种或多种的底物;并且其中氮源是氨、尿素、硝酸盐、亚硝酸盐、除谷氨酸、精氨酸、鸟氨酸和瓜氨酸之外的任何氨基酸、肽、蛋白质或通过代谢途径转化为上述氮源中的一种或多种的任何底物。
术语“托品烷生物碱产物衍生物”旨在指不是由未修饰的生物体天然产生的任何分子,其中所述分子的骨架包括托品烷生物碱产物,并且其与所述托品烷生物碱产物的不同之处在于连接和/或去除官能团而不修饰骨架本身。如本文使用,官能团的连接和去除包括但不限于羟基化和N-加氧(也称为N-氧化)、烷基化和N-烷基化、脱烷基化和N-脱烷基化、乙酰化和N-乙酰化、酰化和N-酰化、卤化和N-卤化。
表述“TA生物合成途径”旨在指遗传元件、其多肽产物和/或小分子的任何集合,它们一起构成一系列化学步骤,通过这些步骤,托品烷生物碱产物前体可以转化为托品烷生物碱产物或托品烷生物碱产物衍生物。如本文使用,术语“TA生物合成途径”、“TA途径”、“经工程改造的TA途径”、“TA生物合成补体”以及此类术语的合理变型可互换使用。在一些实施例中,TA生物合成途径或TA生物合成补体旨在指任何多种酶,其能够将TA产物的一种或多种前体转化为一种或多种TA产物或TA产物衍生物,使得被描述为表达TA生物合成途径或补体的宿主细胞可以被理解为具有这种能力。
“小分子”是总分子量小于1000道尔顿的分子,并且在本说明书中通常被解释为指在生物系统内发现的并且不是多肽的分子。如本文使用,术语“小分子”和“代谢物”可互换。因此,所述术语包括在生物系统内发现的分子和由这种生物系统产生的分子,这些分子具有小于1000道尔顿的总分子量并且不是多肽。
“转运蛋白”是能够跨生物膜转运小分子的多肽。如本文使用,术语“小分子转运蛋白”、“代谢物转运蛋白”和“有机分子转运蛋白”可互换使用。所述术语包括但不限于能够跨一种或多种生物膜转运一种或多种不同的小分子的多肽,并且这种转运由小分子浓度梯度、pH梯度、另一种小分子的水解或另一种小分子的同时运送提供动力。
数值范围包含定义所述范围的数值。
本文描述的方法包括多个步骤。根据需要,每个步骤可以在步骤之间经过预定量的时间之后进行。因此,进行每个步骤之间的时间可以是1秒或更长时间、10秒或更长时间、30秒或更长时间、60秒或更长时间、5分钟或更长时间、10分钟或更长时间、60分钟或更长时间,并且包括5小时或更长时间。在某些实施例中,每个后续步骤在前一步骤完成之后立即进行。在其它实施例中,某一步骤可以在完成前一步骤之后的孵育或等待时间(例如,几分钟至过夜等待时间)后进行。
术语的其它定义可能出现在整个说明书中。
具体实施方式
提供了被工程改造以产生如莨菪碱和东莨菪碱等感兴趣的TA的宿主细胞。还提供了被工程改造以产生如去甲托品烷生物碱和托品烷N-氧化物等感兴趣的TA衍生物的宿主细胞。宿主细胞可以具有选自以下的一种或多种经工程改造的修饰:酶基因中的反馈抑制缓解突变;生物合成酶或转运蛋白基因的转录调节修饰;酶或转运蛋白中的失活突变;和异源编码序列。还提供了使用宿主细胞和组合物(例如,在本发明的方法中使用的试剂盒、系统等)产生感兴趣的TA的方法。
在更详细地描述本发明之前,应理解,本发明不限于所描述的特定实施例,并且因此可以有所变化。还应理解,本文使用的术语仅仅是为了描述特定实施例的目的,而不旨在是限制性的,因为本发明的范围将仅由所附权利要求来限定。
在提供数值范围的情况下,应理解,除非上下文另有明确规定,否则所述范围的上限和下限之间的每个中间值(直到下限单位的十分之一)以及在所述规定范围中的任何其它规定值或中间值都涵盖在本发明内。这些较小范围的上限和下限可以独立地包含在较小范围内,并且也涵盖在本发明内,可能会受规定范围内的任何具体排除的限制的影响。当规定范围包括一个或两个极限时,排除这些所包括的极限中的一个或两个的范围也包括在本发明中。
本文给出的某些范围的数值前面带有术语“约”。术语“约”在本文中用于为其后面的确切数字以及与所述术语后面的数字接近或近似的数字提供文字支持。在确定一个数字是否与一个具体列举的数字接近或近似时,接近或近似的未列举的数字可以是一个数字,该数字在其出现的上下文中提供了所述具体列举的数字的基本等同物。
除非另有定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员所通常理解相同的含义。尽管类似于或等同于本文描述的那些的任何方法和材料也可以用于本发明的实践或测试,但现在描述有代表性的说明性方法和材料。
本说明书中引证的所有出版物和专利通过引用并入本文,如同每个单独的出版物或专利被具体地和单独地指示为通过引用并入,并且所有出版物和专利通过引用并入本文,以公开和描述与出版物引证相关的方法和/或材料。任何出版物的引证都是针对其在申请日之前的公开内容,并且不应被解释为承认本发明无权凭借在先发明而先于此出版物。此外,所提供的出版日期可能与实际出版日期不同,这可能需要独立确认。
如本领域技术人员在阅读本公开内容时将会明白,在不脱离本发明的范围或精神的情况下,本文描述和示出的单独实施例中的每一个具有离散的部件和特征,这些部件和特征可以容易地与其它几个实施例中的任一个的特征分开或组合。任何列举方法以所列举的事件顺序或逻辑上可能的任何其它顺序执行。
在进一步描述本发明时,首先更详细地描述了感兴趣的TA前体、TA和TA的修饰,包括TA衍生物,然后再描述用于产生它们的宿主细胞。接下来,对可使用宿主细胞的感兴趣的方法进行综述。还描述了可以用于实践本发明的方法的试剂盒。
托品烷生物碱TA前体
如上所汇总,提供了产生托品烷生物碱前体(TA前体)的宿主细胞。TA前体可以是产生感兴趣的TA(例如,如本文所述)的合成途径(例如,如本文所述)中的任何中间体或前体化合物。在一些情况下,TA前体具有可以被表征为TA或其衍生物的结构。在某些情况下,TA前体具有可以被表征为TA片段的结构。在一些情况下,TA前体是早期TA。如本文使用,“早期TA”意指细胞中的感兴趣的TA的合成中的早期中间体,其中早期TA由宿主细胞从宿主细胞原料或简单起始化合物产生。在一些情况下,早期TA是无需向细胞中加入起始化合物而由主题宿主细胞仅从宿主细胞原料(例如,碳和营养物源)产生的TA中间体。术语早期TA可以指感兴趣的TA终产物的前体,无论早期TA本身是否可以被表征为托品烷生物碱。
在一些情况下,TA前体是早期TA,如前托品碱托品烷生物碱或前利托林托品烷生物碱。因此,提供了产生前托品碱托品烷生物碱(前托品碱TA)和前利托林托品烷生物碱(前利托林TA)的宿主细胞。托品碱是经由细胞工程改造工作合成下游TA以产生如衍生自利托林的药用TA产物等终产物的主要分支点中间体(图2)。主题宿主细胞可以由简单且廉价的起始材料产生TA前体,这些起始材料可以用于产生托品碱、利托林和下游TA终产物。
如本文使用,术语“预酯化托品烷生物碱”、“预酯化TA”和“预酯化TA前体”可互换使用,并且是指利托林、肉桂酰托品碱或酰基供体和酰基受体酯化的其它产物的生物合成前体,无论酯化前体本身的结构是否被表征为托品烷生物碱。术语预酯化TA意指包括宿主细胞生物合成途径的任何方便成员的生物合成前体、中间体及其代谢物,所述生物合成途径可以产生如利托林等酯化产物。在一些情况下,预酯化TA包括如托品碱片段等托品烷生物碱片段、类苯丙酸片段或其前体或衍生物。在某些实例中,预酯化TA具有可以被表征为托品烷生物碱或其衍生物的结构。
感兴趣的TA前体包括但不限于托品碱和苯基乳酸(PLA)以及托品碱和PLA前体,如精氨酸、鸟氨酸、胍丁胺、N-氨甲酰基腐胺(NCP)、腐胺、N-甲基腐胺(NMP)、4-甲基氨基丁醛、N-甲基吡咯啉鎓(NMPy)、4-(1-甲基-2-吡咯烷基)-3-氧代丁酸(MPOB)、托品酮、苯丙氨酸、预苯酸和苯丙酮酸(PPA)。在一些实施例中,所述一种或多种TA前体是托品碱和PLA。在某些实例中,所述一种或多种TA前体是托品碱和除PLA之外的苯丙氨酸羧酸,如肉桂酸。图1、图2和图3示出了分别由各种TA和非TA前体分子生物合成非药用、药用和非天然TA。
TA前体的合成途径可以在宿主细胞中生成,并且可以以任何方便的起始化合物或材料开始。图1-图4示出了从氨基酸开始的TA前体的感兴趣的合成途径。起始材料可以是非天然存在的,或者起始材料可以是宿主细胞中天然存在的。基于宿主细胞中存在的合成途径,任何方便的化合物和材料都可以用作起始材料。起始材料的来源可以来自宿主细胞本身,例如精氨酸或苯丙氨酸,或者起始材料可以从外源加入或补充到宿主细胞中。因此,在一些情况下,起始化合物是指细胞合成途径中的化合物,所述化合物从不是生长原料或细胞生长培养基的一部分的外源加入到宿主细胞中。感兴趣的起始化合物包括但不限于N-甲基腐胺、4-甲基氨基丁醛、托品酮、托品碱、PLA、肉桂酸以及图1-图4示出的任何化合物。例如,如果宿主细胞在液体培养物中生长,则可以用起始材料补充细胞培养基,所述起始材料被运送到细胞中并被细胞转化为所需产物。感兴趣的起始材料包括但不限于廉价的原料和简单的前体分子。在一些情况下,宿主细胞利用包含简单碳源的原料作为起始材料,宿主细胞利用所述起始材料产生细胞的合成途径的化合物。宿主细胞生长原料可以包含一种或多种组分,如碳源(如纤维素、淀粉、游离糖);和氮源(如铵盐或廉价的氨基酸)。在一些情况下,用作起始材料的生长原料可以源于可持续来源,如边缘土地上生长的生物质,包括柳枝稷和藻类;或来自其它工业或农业活动的生物质废物。
托品烷生物碱(TA)
如上所汇总,提供了产生感兴趣的托品烷生物碱(TA)的宿主细胞。在一些实施例中,本发明的经工程改造的菌株将提供用于产生其跨多个类别的感兴趣的托品烷生物碱及修饰的平台,所述类别包括但不限于药用TA,如衍生自托品碱和PLA的那些;非药用TA,如衍生自托品酮、假托品碱、去甲假托品碱的那些或衍生自向TA中加入官能团和/或从TA去除官能团的那些;和非天然TA,如衍生自除托品碱和PLA之外的TA前体(例如,酰基供体和酰基受体化合物)的酯化的那些或衍生自向TA中加入官能团和/或从TA去除官能团的那些。这些类别中的每一个旨在包括可以产生所述类别的成员的宿主细胞生物合成途径的任何方便成员的生物合成前体、中间体及其代谢物。下面针对这些类别中的每一个给出了化合物的非限制性实例。在一些实施例中,给定实例的结构本身可以被或不被表征为托品烷生物碱。本化学实体旨在包括所有可能的异构体,包括单一对映体、外消旋混合物、光学纯形式、非对映体混合物和中间体混合物。
药用TA可以包括但不限于由植物天然产生的利托林、莨菪碱、阿托品、山莨菪碱、东莨菪碱及其衍生物。
非药用TA可以包括但不限于由植物天然产生的或通过非植物生物体中的TA代谢产生的打碗花精、可卡因、去甲利托林、去甲莨菪碱、去甲山莨菪碱、去甲东莨菪碱、利托林N-氧化物、莨菪碱N-氧化物、山莨菪碱N-氧化物、东莨菪碱N-氧化物、N-甲基利托林、N-甲基莨菪碱、N-甲基山莨菪碱、N-甲基东莨菪碱及其衍生物。
非天然TA可以包括但不限于肉桂酰托品碱、肉桂酰-3β-托品碱、香豆酰托品碱、香豆酰-3β-托品碱、苯甲酰托品碱、苯甲酰-3β-托品碱、咖啡酰托品碱、咖啡酰-3β-托品碱、阿魏酰托品碱、阿魏酰-3β-托品碱、芥子酰托品碱和芥子酰-3β-托品碱。
包含衍生物在内的TA的修饰
如上所归总,提供了产生修饰的感兴趣的TA衍生物的宿主细胞。在一些实施例中,本发明的经工程改造的菌株将提供用于衍生感兴趣的TA(包括衍生由经工程改造的宿主细胞产生或被供给到生长培养基中的经工程改造的宿主细胞的TA前体、药用TA、非药用TA和非天然TA)的平台。
如本文使用,术语“衍生化”、“官能化”、“通过衍生化修饰”和“通过官能化修饰”是指在不修饰骨架本身的情况下,经由连接和/或去除官能团对TA或TA前体进行修饰。如本文使用,官能团的连接和去除包括但不限于羟基化和N-加氧(也称为N-氧化)、烷基化和N-烷基化、脱烷基化和N-脱烷基化、乙酰化和N-乙酰化、酰化和N-酰化、卤化和N-卤化。
在本发明的一些实施例中,感兴趣的TA的衍生化可以通过将预官能化的TA前体(例如,卤化或烷基化的氨基酸)供给到被工程改造以进行摄取并随后将供给的TA前体转化为感兴趣的TA的宿主细胞来以酶促方式实现。在本发明的其它实施例中,除了产生未修饰的TA所需的酶和细胞修饰之外,还可以通过工程改造宿主细胞来表达在将官能团连接到靶TA方面具有期望活性的酶,从而以酶促方式实现感兴趣的TA的衍生化。在本发明的其它实施例中,感兴趣的TA的衍生化可以通过用能够连接期望官能团的纯化的酶或用被工程改造以表达具有期望的衍生化活性的酶的宿主细胞的粗裂解物处理由经工程改造的宿主细胞产生的未修饰的TA来以酶促方式实现。在本发明的其它实施例中,感兴趣的TA的衍生化可以通过用具有连接期望官能团的化学试剂处理由经工程改造的宿主细胞产生的未修饰的TA来以非酶促方式实现。
修饰的TA衍生物包括但不限于对羟基阿托品、对羟基莨菪碱、对氟莨菪碱、对氯莨菪碱、对溴莨菪碱、对氟东莨菪碱、对氯东莨菪碱、对溴东莨菪碱、N-甲基利托林、N-丁基利托林、N-甲基莨菪碱、N-丁基莨菪碱、N-甲基山莨菪碱、N-丁基山莨菪碱、N-甲基东莨菪碱、N-丁基东莨菪碱、N-乙酰基利托林、N-乙酰基莨菪碱、N-乙酰基山莨菪碱、N-乙酰基东莨菪碱、N-甲酰基利托林、N-甲酰基莨菪碱、N-甲酰基山莨菪碱、N-甲酰基东莨菪碱、去甲利托林、去甲莨菪碱、去甲山莨菪碱、去甲东莨菪碱、利托林N-氧化物、莨菪碱N-氧化物、山莨菪碱N-氧化物和东莨菪碱N-氧化物。
宿主细胞
如上所汇总,本发明的一个方面是一种产生一种或多种感兴趣的TA的宿主细胞。任何方便的细胞都可以在主题宿主细胞和方法中使用。在一些情况下,宿主细胞是非植物细胞。在一些实例中,宿主细胞可以被表征为微生物细胞。在某些情况下,宿主细胞是昆虫细胞、哺乳动物细胞、细菌细胞或真菌细胞。任何方便类型的宿主细胞都可以用于产生主题产TA细胞,参见例如US2008/0176754现在公开为美国专利第8,975,063号、US2014/0273109和WO2014/143744);其公开内容通过引用整体并入。感兴趣的宿主细胞包括但不限于细菌细胞,如枯草芽孢杆菌、大肠杆菌、链霉菌、鱼腥藻、节杆菌、醋杆菌、醋酸杆菌、芽孢杆菌、双歧杆菌、短状杆菌、短杆菌、肉杆菌、梭状芽孢杆菌、棒状杆菌、肠杆菌、埃希氏杆菌、葡糖醋杆菌、葡糖杆菌、哈夫尼菌、盐单胞菌、克雷伯氏菌、考克氏菌、乳杆菌、明串珠菌、大球菌、甲基单胞菌、甲基杆菌、甲基细胞菌、甲基球菌、微杆菌、微球菌、微囊藻、穆尔氏菌、酒球菌、片球菌、原绿球藻、丙酸杆菌、变形杆菌、假交替单胞菌、假单胞菌、嗜冷杆菌、红细菌、红球菌、红假单胞菌、沙雷氏菌、葡萄球菌、链球菌、链霉菌、聚球藻、集胞藻、四联球菌、魏斯氏菌、发酵单胞菌和鼠伤寒沙门氏菌细胞;昆虫细胞,如黑腹果蝇S2和草地夜蛾Sf9细胞;和酵母细胞,如酿酒酵母、粟酒裂殖酵母、巴斯德毕赤酵母、解脂耶氏酵母、白色念珠菌、曲霉属某些种、根霉属某些种、青霉属某些种和里氏木霉细胞。在一些实施例中,宿主细胞是酵母细胞或大肠杆菌细胞。在一些情况下,宿主细胞是酵母细胞。在一些实例中,宿主细胞来自被工程改造以产生感兴趣的TA的酵母菌株。US2008/0176754(现已公布为美国专利第8,975,063号)、US2014/0273109和WO2014/143744中所述的宿主细胞中的任一种可以适用于主题细胞和方法。在某些实施例中,酵母细胞可以是酿酒酵母(S.cerevisiae)物种的细胞。在某些实施例中,酵母细胞可以是粟酒裂殖酵母物种的细胞。在某些实施例中,酵母细胞可以是巴斯德毕赤酵母物种的细胞。酵母作为宿主细胞是令人感兴趣的,因为参与一些感兴趣的生物合成途径的细胞色素P450蛋白能够适当折叠到内质网膜中,从而维持其活性。
可用于本发明的感兴趣的酵母菌株包括但不限于CEN.PK(基因型:MATa/αura3-52/ura3-52 trp1-289/trp1-289 leu2-3_112/leu2-3_112his3Δ1/his3Δ1MAL2-8C/MAL2-8C SUC2/SUC2)、S288C、W303、D273-10B、X2180、A364A、∑1278B、AB972、SK1和FL100。在某些情况下,酵母菌株是S288C(MATα;SUC2 mal mel gal2CUP1 flo1 flo8-1 hap1)、BY4741(MATα;his3Δ1;leu2Δ0;met15Δ0;ura3Δ0)、BY4742(MATα;his3Δ1;leu2Δ0;lys2Δ0;ura3Δ0)、BY4743(MATa/MATα;his3Δ1/his3Δ1;leu2Δ0/leu2Δ0;met15Δ0/MET15;LYS2/lys2Δ0;ura3Δ0/ura3Δ0)和WAT11或W(R)中的任一种,WAT11和W(R)分别是表达拟南芥NADPH-P450还原酶ATR1和酵母NADPH-P450还原酶CPR1的W303-B菌株的衍生物(MATa;ade2-1;his3-11,-15;leu2-3,-112;ura3-1;canR;cyr+)。在另一个实施例中,酵母细胞是W303α(MATα;his3-11,15trp1-1 leu2-3 ura3-1 ade2-1)。另外的感兴趣的酵母菌株的标识和基因型可以在EUROSCARF(web.uni-frankfurt.de/fb15/mikro/euroscarf/col_index.html)找到。
在一些实例中,宿主细胞是真菌细胞。在某些实施例中,真菌细胞可以是曲霉属物种的细胞,并且菌株包括黑曲霉(ATCC 1015,ATCC 9029,CBS 513.88)、米曲霉(ATCC56747,RIB40)、土曲霉(NIH 2624,ATCC 20542)和构巢曲霉(FGSC A4)。
在某些实施例中,可以针对在曲霉属某种中的表达对异源编码序列进行密码子优化并由适当的启动子表达。在某些实施例中,启动子可以选自磷酸甘油酸盐激酶启动子(PGK)、MbfA启动子、细胞色素c氧化酶亚基启动子(CoxA)、SrpB启动子、TvdA启动子、苹果酸盐脱氢酶启动子(MdhA)、β-甘露糖苷酶启动子(ManB)。在某些实施例中,终止子可以选自葡糖淀粉酶终止子(GlaA)或TrpC终止子。在某些实施例中,由启动子、异源编码序列和终止子组成的表达盒可以由质粒表达或整合到宿主的基因组中。在某些实施例中,维持质粒或整合盒的细胞的选择可以通过抗生素选择,如潮霉素;或氮源利用,如使用乙酰胺作为唯一氮源来进行。在某些实施例中,可以使用建立的转化方法,如原生质体转化、乙酸锂或电穿孔,将DNA构建体引入到宿主细胞中。在某些实施例中,细胞可以在液体ME或固体MEA(3%麦芽提取物、0.5%蛋白胨和±1.5%琼脂)中培养或者在含或不含选择的Vogel基本培养基中培养。
在一些实例中,宿主细胞是细菌细胞。细菌细胞可以选自任何细菌属。细菌细胞可以来自的属的实例包括鱼腥藻属、节杆菌属、醋杆菌属、醋酸杆菌属、芽孢杆菌属、双歧杆菌属、短状杆菌属、短杆菌属、肉杆菌属、梭状芽孢杆菌属、棒状杆菌属、肠杆菌属、埃希氏杆菌属、葡糖醋杆菌属、葡糖杆菌属、哈夫尼菌属、盐单胞菌属、克雷伯氏菌属、考克氏菌属、乳杆菌属、明串珠菌属、大球菌属、甲基单胞菌属、甲基杆菌属、甲基细胞菌属、甲基球菌属、微杆菌属、微球菌属、微囊藻属、穆尔氏菌属、酒球菌属、片球菌属、原绿球藻属、丙酸杆菌属、变形杆菌属、假交替单胞菌属、假单胞菌属、嗜冷杆菌属、红细菌属、红球菌属、红假单胞菌属、沙雷氏菌属、葡萄球菌属、链球菌属、链霉菌属、聚球藻属、集胞藻属、四联球菌属、魏斯氏菌属和发酵单胞菌属。可以用于本公开的方法的细菌物种的实例包括烟草节杆菌、醋化醋杆菌、阿氏节杆菌、蜡样芽孢杆菌、凝结芽孢杆菌、地衣芽孢杆菌、短小芽孢杆菌、球形芽孢杆菌、嗜热脂肪芽孢杆菌、枯草芽孢杆菌、青春双歧杆菌、奶酪发酵短状杆菌、扩展短杆菌、广布肉杆菌、微黄棒状杆菌、屎肠球菌、欧洲葡糖醋杆菌、乔安娜葡糖醋杆菌、氧化葡糖杆菌、蜂房哈夫尼菌、伸长盐单胞菌、嗜根考克氏菌、酸面粉乳杆菌、詹氏乳杆菌、乳酸乳球菌、山梨县乳杆菌、柠檬明串珠菌、溶酪大球菌、叶片微杆菌、莱拉微球菌、酒酒球菌、乳酸片球菌、丙酸丙酸杆菌、普通变形杆菌、荧光假单胞菌、速生嗜冷杆菌、调料葡萄球菌、嗜热链球菌、灰色链霉菌、嗜盐四联球菌、食物魏斯氏菌、韩国魏斯氏菌、运动发酵单胞菌、谷氨酸棒状杆菌、两歧双歧杆菌/短双歧杆菌/长双歧杆菌、变铅青链霉菌、天蓝色链霉菌、植物乳杆菌、清酒乳杆菌、干酪乳杆菌、柠檬黄假交替单胞菌、恶臭假单胞菌、永达尔梭状芽孢杆菌/醋酸梭状芽孢杆菌/丙酮丁醇梭状芽孢杆菌/丁酸梭状芽孢杆菌和热纤穆尔氏菌(Moorellathemocellum)/产醋酸穆尔氏菌。
在某些实施例中,细菌细胞可以是大肠杆菌菌株。在某些实施例中,大肠杆菌菌株可以选自BL21、DH5α、XL1-Blue、HB101、BL21和K12。在某些实施例中,可以针对在大肠杆菌中的表达对异源编码序列进行密码子优化并由适当的启动子表达。在某些实施例中,启动子可选自T7启动子、tac启动子、trc启动子、四环素诱导型启动子(tet)、lac操纵子启动子(lac)、lacO1启动子。在某些实施例中,由启动子、异源编码序列和终止子组成的表达盒可以由质粒表达或整合到基因组中。在某些实施例中,质粒选自pUC19或pBAD。在某些实施例中,维持质粒或整合盒的细胞的选择可以通过抗生素选择(如卡那霉素、氯霉素、链霉素、壮观霉素、庆大霉素、红霉素或氨苄青霉素)来进行。在某些实施例中,可以使用建立的转化方法,如接合、热休克化学转化或电穿孔,将DNA构建体引入到宿主细胞中。在某些实施例中,细胞可以在含或不含抗生素的约37℃的液体Luria–Bertani(LB)培养基中培养。
在某些实施例中,细菌细胞可以是枯草芽孢杆菌菌株。在某些实施例中,枯草芽孢杆菌菌株可以选自1779、GP25、RO-NN-1、168、BSn5、BEST195、1A382和62178。在某些实施例中,可以针对在芽孢杆菌属某种中的表达对异源编码序列进行密码子优化并由适当的启动子表达。在某些实施例中,启动子可以选自grac启动子、p43启动子或trnQ启动子。在某些实施例中,由启动子、异源编码序列和终止子组成的表达盒可以由质粒表达或整合到基因组中。在某些实施例中,质粒选自pHP13pE194、pC194、pHT01或pHT43。在某些实施例中,可以使用如pDG364或pDG1730等整合载体将表达盒整合到基因组中。在某些实施例中,维持质粒或整合盒的细胞的选择可以通过抗生素选择(如红霉素、卡那霉素、四环素和壮观霉素)来进行。在某些实施例中,可以使用建立的转化方法,如天然感受态、热休克或化学转化,将DNA构建体引入到宿主细胞中。在某些实施例中,细胞可以在37℃的液体Luria–Bertani(LB)培养基或M9培养基加葡萄糖和色氨酸中培养。
对宿主细胞的遗传修饰
宿主细胞可以被工程改造以包括提供感兴趣的TA的产生的一种或多种修饰(如两种或更多种、三种或更多种、四种或更多种、五种或更多种、或甚至更多种修饰)。在一些情况下,修饰意指遗传修饰,如基因或其片段的突变、添加或缺失或基因或其片段的转录调节。在一些情况下,所述一种或多种(如两种或更多种、三种或更多种、或四种或更多种)修饰选自:细胞天然的生物合成酶基因中的反馈抑制缓解突变;细胞天然的生物合成酶或转运蛋白基因的转录调节修饰;细胞天然的酶或转运蛋白中的失活突变;编码酶的异源编码序列;和编码蛋白质的异源编码序列,该蛋白质修饰酶或代谢物(如转运蛋白)的亚细胞运输和/或定位。包含一种或多种修饰的细胞可以被称为修饰的细胞。
修饰的细胞可以过量产生一种或多种前体TA、TA或修饰的TA分子。过量产生意指相对于对照细胞(例如,未修饰的细胞),所述细胞具有感兴趣的TA分子的提高或增加的产量。提高或增加的产量意指两种情况:在对照没有产生TA前体的情形下,产生了一定量的感兴趣的TA;以及在对照具有一定的感兴趣的TA产量的情形下,增加了约10%或更多,如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,如2倍或更多倍,如5倍或更多倍,包括10倍或更多倍。
在一些情况下,相对于缺乏所述一种或多种修饰(例如,如本文所述)的对照宿主细胞,所述宿主细胞能够产生增加量的腐胺。在某些实例中,腐胺的增加量相对于对照宿主细胞为约10%或更多,如相对于对照宿主细胞为约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多、2倍或更多倍、5倍或更多倍、或甚至10倍或更多倍。
在一些情况下,相对于缺乏所述一种或多种修饰(例如,如本文所述)的对照宿主细胞,所述宿主细胞能够产生增加量的N-甲基吡咯啉鎓。在某些实例中,N-甲基吡咯啉鎓的增加量相对于对照宿主细胞为约10%或更多,如相对于对照宿主细胞为约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多、2倍或更多倍、5倍或更多倍、或甚至10倍或更多倍。
在一些情况下,相对于缺乏所述一种或多种修饰(例如,如本文所述)的对照宿主细胞,所述宿主细胞能够产生增加量的托品碱。在某些实例中,托品碱的增加量相对于对照宿主细胞为约10%或更多,如相对于对照宿主细胞为约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多、2倍或更多倍、5倍或更多倍、或甚至10倍或更多倍。
在一些情况下,相对于缺乏所述一种或多种修饰(例如,如本文所述)的对照宿主细胞,所述宿主细胞能够产生增加量的苯丙酮酸。在某些实例中,苯丙酮酸的增加量相对于对照宿主细胞为约10%或更多,如相对于对照宿主细胞为约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多、2倍或更多倍、5倍或更多倍、或甚至10倍或更多倍。
在一些情况下,相对于缺乏所述一种或多种修饰(例如,如本文所述)的对照宿主细胞,所述宿主细胞能够产生增加量的苯基乳酸。在某些实例中,苯基乳酸的增加量相对于对照宿主细胞为约10%或更多,如相对于对照宿主细胞为约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多、2倍或更多倍、5倍或更多倍、或甚至10倍或更多倍。
在一些情况下,相对于缺乏所述一种或多种修饰(例如,如本文所述)的对照宿主细胞,所述宿主细胞能够产生增加量的利托林。在某些实例中,利托林的增加量相对于对照宿主细胞为约10%或更多,如相对于对照宿主细胞为约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多、2倍或更多倍、5倍或更多倍、或甚至10倍或更多倍。
在一些情况下,相对于缺乏所述一种或多种修饰(例如,如本文所述)的对照宿主细胞,所述宿主细胞能够产生增加量的莨菪碱。在某些实例中,莨菪碱的增加量相对于对照宿主细胞为约10%或更多,如相对于对照宿主细胞为约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多、2倍或更多倍、5倍或更多倍、或甚至10倍或更多倍。
在一些情况下,相对于缺乏所述一种或多种修饰(例如,如本文所述)的对照宿主细胞,所述宿主细胞能够产生增加量的东莨菪碱。在某些实例中,东莨菪碱的增加量相对于对照宿主细胞为约10%或更多,如相对于对照宿主细胞为约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多、2倍或更多倍、5倍或更多倍、或甚至10倍或更多倍。
在一些情况下,相对于缺乏所述一种或多种修饰(例如,如本文所述)的对照宿主细胞,所述宿主细胞能够产生增加量的去甲托品烷生物碱,如去甲莨菪碱或去甲东莨菪碱。在某些实例中,去甲托品烷生物碱的增加量相对于对照宿主细胞为约10%或更多,如相对于对照宿主细胞为约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多、2倍或更多倍、5倍或更多倍、或甚至10倍或更多倍。
在一些情况下,相对于缺乏所述一种或多种修饰(例如,如本文所述)的对照宿主细胞,所述宿主细胞能够产生增加量的托品烷N-氧化物,如莨菪碱N-氧化物或东莨菪碱N-氧化物。在某些实例中,托品烷N-氧化物的增加量相对于对照宿主细胞为约10%或更多,如相对于对照宿主细胞为约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多、2倍或更多倍、5倍或更多倍、或甚至10倍或更多倍。
在一些实施例中,宿主细胞能够由起始化合物(如精氨酸)产生10%或更多产率的托品碱,如由起始化合物产生20%或更多、30%或更多、40%或更多、50%或更多、60%或更多、70%或更多、80%或更多、或甚至90%或更多产率的托品碱。
在一些实施例中,宿主细胞能够由起始化合物(如苯丙氨酸)产生10%或更多产率的苯基乳酸,如由起始化合物产生20%或更多、30%或更多、40%或更多、50%或更多、60%或更多、70%或更多、80%或更多、或甚至90%或更多产率的苯基乳酸。
在一些实施例中,宿主细胞能够由起始化合物(如精氨酸或苯丙氨酸)产生10%或更多产率的莨菪碱,如由起始化合物产生20%或更多、30%或更多、40%或更多、50%或更多、60%或更多、70%或更多、80%或更多、或甚至90%或更多产率的莨菪碱。
在一些实施例中,宿主细胞能够由起始化合物(如精氨酸或苯丙氨酸)产生10%或更多产率的东莨菪碱,如由起始化合物产生20%或更多、30%或更多、40%或更多、50%或更多、60%或更多、70%或更多、80%或更多、或甚至90%或更多产率的东莨菪碱。
在一些实施例中,宿主细胞能够由起始化合物(如精氨酸或苯丙氨酸)产生10%或更多产率的去甲托品烷生物碱(如去甲莨菪碱或去甲东莨菪碱),如由起始化合物产生20%或更多、30%或更多、40%或更多、50%或更多、60%或更多、70%或更多、80%或更多、或甚至90%或更多产率的去甲托品烷生物碱。
在一些实施例中,宿主细胞能够由起始化合物(如精氨酸或苯丙氨酸)产生10%或更多产率的托品烷N-氧化物(如莨菪碱N-氧化物或东莨菪碱N-氧化物),如由起始化合物产生20%或更多、30%或更多、40%或更多、50%或更多、60%或更多、70%或更多、80%或更多、或甚至90%或更多产率的托品烷N-氧化物。
在一些实施例中,宿主细胞过量产生一种或多种感兴趣的TA分子,其选自由以下组成的群组:精氨酸、鸟氨酸、胍丁胺、腐胺、N-甲基腐胺、4-甲基氨基丁醛、N-甲基吡咯啉鎓、4-(1-甲基-2-吡咯烷基)-3-氧代丁酸、托品酮、托品碱、去甲托品碱、托品碱N-氧化物、苯丙氨酸、预苯酸、苯丙酮酸、苯基乳酸、葡萄糖-1-O-苯基乳酸盐、利托林、去甲利托林、利托林N-氧化物、莨菪碱醛、莨菪碱、去甲莨菪碱、莨菪碱N-氧化物、山莨菪碱、去甲山莨菪碱、山莨菪碱N-氧化物、东莨菪碱、去甲东莨菪碱和东莨菪碱N-氧化物。
所述一种或多种修饰的任何方便组合都可以包含在主题宿主细胞中。在一些情况下,包含两种或更多种(如两种或更多种、三种或更多种、或四种或更多种)不同类型的修饰。在某些实例中,在主题细胞中包含相同类型的修饰的两种或更多种(例如,三种或更多种、四种或更多种、五种或更多种、或甚至更多种)不同的修饰。
在宿主细胞的一些实施例中,当细胞包含编码一种或多种酶或转运蛋白的一个或多个异源编码序列时,它包含选自由以下组成的群组的至少一种另外的修饰:细胞天然的生物合成酶基因中的反馈抑制缓解突变;细胞天然的生物合成酶或转运蛋白基因的转录调节修饰;和细胞天然的酶或转运蛋白中的失活突变。在宿主细胞的某些实施例中,当细胞包含细胞天然的一个或多个生物合成酶基因中的一种或多种反馈抑制缓解突变时,它包含选自由以下组成的群组的至少一种另外的修饰:细胞天然的生物合成酶或转运蛋白基因的转录调节修饰;细胞天然的酶或转运蛋白中的失活突变;和编码酶或转运蛋白的异源编码序列。在宿主细胞的一些实施例中,当细胞包含细胞天然的一个或多个生物合成酶或转运蛋白基因的一种或多种转录调节修饰时,它包含选自由以下组成的群组的至少一种另外的修饰:细胞天然的生物合成酶基因中的反馈抑制缓解突变;细胞天然的酶或转运蛋白中的失活突变;编码酶的异源编码序列;和编码蛋白质的异源编码序列,所述蛋白质修饰酶或代谢物(如转运蛋白)的亚细胞运输和/或定位。在宿主细胞的某些实例中,当细胞包含细胞天然的一种或多种酶或转运蛋白中的一种或多种失活突变时,它包含选自由以下组成的群组的至少一种另外的修饰:细胞天然的生物合成酶基因中的反馈抑制缓解突变;细胞天然的生物合成酶或转运蛋白基因的转录调节修饰;编码酶的异源编码序列;和编码蛋白质的异源编码序列,所述蛋白质修饰酶或代谢物(如转运蛋白)的亚细胞运输和/或定位。
在宿主细胞的某些实施例中,细胞包含细胞天然的一个或多个生物合成酶基因中的一种或多种反馈抑制缓解突变;和细胞天然的一个或多个生物合成酶或转运蛋白基因的一种或多种转录调节修饰。在宿主细胞的某些实施例中,细胞包含细胞天然的一个或多个生物合成酶基因中的一种或多种反馈抑制缓解突变;和细胞天然的酶或转运蛋白中的一种或多种失活突变。在宿主细胞的某些实施例中,细胞包含细胞天然的一个或多个生物合成酶基因中的一种或多种反馈抑制缓解突变;和一个或多个异源编码序列。在一些实施例中,宿主细胞包含一种或多种修饰(例如,如本文所述),其包含表1中描述的感兴趣的基因中的一个或多个。
反馈抑制缓解突变
在一些实例中,宿主细胞是包含细胞的一个或多个生物合成酶基因中的一种或多种反馈抑制缓解突变(如两种或更多种、三种或更多种、四种或更多种、五种或更多种、或甚至更多种)的细胞。在一些情况下,所述一个或多个生物合成酶基因是细胞天然的(例如,存在于未修饰的细胞中)。如本文使用,术语“反馈抑制缓解突变”是指缓解宿主细胞的反馈抑制控制机制的突变。反馈抑制是细胞的一种控制机制,其中当受调节化合物积累到某一水平时,所述化合物合成途径中的酶被抑制,从而平衡细胞中的所述化合物的量。在一些实例中,所述一种或多种反馈抑制缓解突变存在于图1-图4的生物合成途径或图8的示意图中描述的酶中。相对于对照细胞,缓解反馈抑制的突变降低了感兴趣的细胞中的受调节酶的抑制,并且提供了增加水平的受调节化合物或其下游生物合成产物。在一些情况下,缓解受调节酶的抑制意指抑制的IC
可以靶向宿主细胞天然的被定向TA前体水平调节的多种反馈抑制控制机制和生物合成酶以在宿主细胞中进行缓解。宿主细胞可以包含细胞天然的一个或多个生物合成酶基因中的一种或多种反馈抑制缓解突变。所述突变可以定位在宿主细胞天然的任何方便的生物合成酶基因中,其中生物合成酶经受调节控制。在一些实施例中,所述一个或多个生物合成酶基因编码选自鸟氨酸脱羧酶(ODC)、鸟氨酸脱羧酶抗酶和腐胺N-甲基转移酶的一种或多种酶。在一些实施例中,所述一个或多个生物合成酶基因编码鸟氨酸脱羧酶。在一些实例中,所述一个或多个生物合成酶基因编码鸟氨酸脱羧酶抗酶。在一些实施例中,所述一个或多个生物合成酶基因编码腐胺N-甲基转移酶。在某些实例中,所述一种或多种反馈抑制缓解突变存在于选自SPE1、OAZ1和PMT的生物合成酶基因中。在某些实例中,所述一种或多种反馈抑制缓解突变存在于生物合成酶基因SPE1中。在某些实例中,所述一种或多种反馈抑制缓解突变存在于生物合成酶基因OAZ1中。在某些实例中,所述一种或多种反馈抑制缓解突变存在于生物合成酶基因PMT中。在一些实施例中,宿主细胞包含一个或多个生物合成酶基因中的一种或多种反馈抑制缓解突变,如表1中描述的那些基因中的一个。
任何方便数量和类型的突变都可以用来缓解反馈抑制控制机制。如本文使用,术语“突变”是指相对于参考序列或基序的氨基酸残基或核苷酸残基的缺失、插入或取代。突变可以作为原始基因座处的天然基因的定向突变并入。在一些情况下,突变可以作为基因的额外拷贝(作为不同基因座处的遗传整合引入),或作为附加体载体(如2μ或着丝粒质粒)上的额外拷贝并入。在某些实例中,酶的反馈抑制拷贝受天然细胞转录调节。在一些实例中,通过将酶置于合成启动子的控制下,用经工程改造的蛋白质表达的组成型或动态调节来引入酶的反馈抑制拷贝。
在某些实施例中,本发明的宿主细胞可以包含宿主细胞天然的一个或多个生物合成酶基因中的1种或多种、2种或更多种、3种或更多种、4种或更多种、5种或更多种、6种或更多种、7种或更多种、8种或更多种、9种或更多种、10种或更多种、11种或更多种、12种或更多种、13种或更多种、14种或更多种、或甚至15种或更多种反馈抑制缓解突变,如1、2、3、4、5、6、7、8、9、10、11、12、13、14或15种反馈抑制缓解突变。
转录调节修饰
宿主细胞可以包含细胞的一个或多个生物合成酶或转运蛋白基因的一种或多种转录调节修饰(例如,两种或更多种、三种或更多种、四种或更多种、五种或更多种、或甚至更多种修饰)。在一些情况下,所述一个或多个生物合成酶或转运蛋白基因是细胞天然的。可以靶向细胞的任何方便的生物合成酶或转运蛋白基因以进行转录调节。转录调节意指相对于对照细胞(例如,未修饰的细胞),修饰的细胞中的感兴趣基因的表达被调节,例如增加或减少、增强或阻遏。在一些情况下,感兴趣的基因的转录调节包括增加或增强表达。增加或增强表达意指与对照(即未修饰的相同细胞中的表达)相比,感兴趣的基因的表达水平增加2倍或更多倍,如增加5倍或更多倍,有时增加25倍、50倍或100倍或更多倍,并且在某些实施例中增加300倍或更多倍或更高的倍数(例如,通过使用任何方便的基因表达测定)。可替代地,在细胞中的感兴趣的基因的表达很低以致于无法检测的情况下,如果表达增加到容易检测的水平,则认为感兴趣的基因的表达水平增加。在某些实例中,感兴趣的基因的转录调节包括减少或阻遏表达。减少或阻遏表达意指与对照相比,感兴趣的基因的表达水平减少至2分之一或更少,如减少至5分之一或更少,有时减少至25分之一、50分之一或100分之一或更少,并且在某些实施例中减少至300分之一或更少,或更少。在一些情况下,表达减少到无法检测的水平。可以适用于主题宿主细胞的感兴趣的宿主细胞过程的修饰描述于Smolke等人的美国公开号20140273109(14/211,611)和Smolke等人的世界公开号WO2020185626A1中,所述文献的公开内容通过引用整体并入本文。
任何方便的生物合成酶基因都可以被转录调节,并且包括但不限于图1-图3和图75中描述的那些生物合成酶,如ARG2、CAR1、SPE1、FMS1、PHA2、ARO8、ARO9和UGP1。在一些实例中,所述一个或多个生物合成酶基因选自ARG2、CAR1、SPE1和FMS1。在一些情况下,所述一个或多个生物合成酶基因是ARG2。在某些实例中,所述一个或多个生物合成酶基因是CAR1。在一些实施例中,所述一个或多个生物合成酶基因是SPE1。在一些实施例中,所述一个或多个生物合成酶基因是FMS1。任何方便的转运蛋白基因也都可以被转录调节,并且包括但不限于表1、表4和表6中描述的转运蛋白,如SNQ2、PDR1、PDR3、PDR5、PDR7、PDR8、PDR9、PDR10、PDR11、PDR12、PDR15、PDR16、PDR17、PDR18、YCF1、YNR070W、ADP1、VMR1、NFT1、BPT1、YBT1、YOR1、TPO1、TPO2、TPO3、TPO4、TPO5、FLR1、QDR1、QDR2、QDR3、YHK8、HOL1、DTR1和AQR1。在一些实施例中,宿主细胞包含对一个或多个基因(如表1中描述的那些基因中的一个)的一种或多种转录调节修饰。在一些实施例中,宿主细胞包含对一个或多个基因(如图1-图4中的一个的生物合成途径中或图8的示意图中描述的那些基因中的一个)的一种或多种转录调节修饰。
在一些实施例中,转录调节修饰包括用强启动子取代所述一个或多个生物合成酶或转运蛋白基因的天然启动子,或在强启动子控制下表达所述基因的额外拷贝。驱动感兴趣的基因的表达的启动子可以是组成型启动子或诱导型启动子,前提是这些启动子在宿主细胞中可以有活性。感兴趣的基因可以由它们的天然启动子表达,或者可以使用非天然启动子。虽然非必需,但是这种启动子在使用它们的宿主中应是中到高强度的。启动子可以是受调节的或组成型的。在一些实施例中,使用不被葡萄糖阻遏或仅被培养基中葡萄糖的存在轻度阻遏的启动子。存在多种合适的启动子,其实例包括糖酵解基因的启动子,如枯草芽孢杆菌tsr基因的启动子(编码果糖二磷酸盐醛缩酶)或来自酵母酿酒酵母的GAPDH启动子(编码甘油醛-磷酸盐脱氢酶)(Bitter G.A.,Meth.Enzymol.152:673 684(1987))。其它感兴趣的强启动子包括但不限于面包酵母的ADHI启动子(Ruohonen L.等人,J.Biotechnol.39:193 203(1995))、磷酸盐饥饿诱导的启动子,如酵母的PHO5启动子(Hinnen,A.等人,Yeast Genetic Engineering,Barr,P.J.等人编,Butterworths(1989),来自地衣芽孢杆菌的碱性磷酸酶启动子(Lee.J.W.K.等人,J.Gen.Microbiol.137:11271133(1991))、GPD1和TEF1。感兴趣的酵母启动子包括但不限于诱导型启动子,如Gal1-10、Gal1、GalL、GalS、阻遏型启动子Met25、tetO、以及组成型启动子,如甘油醛3-磷酸盐脱氢酶启动子(GPD)、醇脱氢酶启动子(ADH)、翻译延伸因子-1-α启动子(TEF)、细胞色素c-氧化酶启动子(CYC1)、MRP7启动子、磷酸甘油酸盐激酶(PGK)、磷酸丙糖异构酶(TPI)等。在一些实例中,强启动子是GPD1。在某些实例中,强启动子是TEF1。含有可被激素(如糖皮质激素、类固醇和甲状腺激素)诱导的启动子的自主复制酵母表达载体也是已知的,并且包括但不限于糖皮质激素反应元件(GRE)和甲状腺激素反应元件(TRE),参见例如在美国专利号7,045,290中描述的那些启动子。可以使用含有组成型或诱导型启动子(如α因子、醇氧化酶和PGH)的载体。此外,任何启动子/增强子组合(根据真核启动子数据库EPDB)也可以用于驱动感兴趣的基因的表达。应理解,可以选择对宿主细胞具有特异性的任何方便的启动子,例如大肠杆菌。在一些情况下,可以使用启动子选择来优化转录,从而优化酶水平,以最大化产量并同时最小化能量资源。
失活突变
宿主细胞可以包含对细胞的酶或转运蛋白的一种或多种失活突变(如两种或更多种、三种或更多种、四种或更多种、五种或更多种、或甚至更多种)。一种或多种失活突变的包含可以修饰宿主细胞的合成途径的通量或宿主细胞的合成途径的空间定位,以增加感兴趣的TA的水平或增加期望的酶或前体的水平(以实现相同结果)。在一些情况下,所述一种或多种失活突变针对细胞天然的酶或转运蛋白。图8示出了酵母中的作用于多胺产生途径的天然调节机制,并且图9示出了破坏这些天然调节系统对腐胺的产量的影响。如本文使用,“失活突变”意指对细胞的基因或调节DNA序列的一种或多种突变,其中突变使所述感兴趣的基因表达的蛋白质的生物活性失活。在一些情况下,所述基因是细胞天然的。在一些实例中,基因编码被失活的酶或转运蛋白,并且是宿主细胞产生的感兴趣的TA的合成途径的一部分或与之相连。在一些实例中,失活突变定位在控制感兴趣的基因的调节DNA序列中。在某些情况下,失活突变针对基因的启动子。任何方便的突变(例如,如本文所述)都可以用于使感兴趣的基因或调节DNA序列失活。“失活的”或“失活”意指相对于由未突变的对照基因表达的对照蛋白质,由突变基因表达的蛋白质的生物活性降低10%或更多,如降低20%或更多、30%或更多、40%或更多、50%或更多、60%或更多、70%或更多、80%或更多、90%或更多、95%或更多、97%或更多、或99%或更多。在一些情况下,蛋白质是酶,并且失活突变降低了酶的催化活性。在其它情况下,蛋白质是转运蛋白,并且失活突变降低了转运蛋白的运送活性。
在一些实施例中,细胞包含细胞天然的酶或转运蛋白中的失活突变。可以靶向任何方便的酶或转运蛋白以进行失活。感兴趣的酶包括但不限于图1-图4、图8、图11、图22和图41中描述的那些酶,它们在宿主细胞的生物合成途径中的作用往往会降低感兴趣的TA的水平。在一些情况下,酶具有甲硫腺苷磷酸化酶活性。在某些实施例中,包含失活突变的酶是MEU1(参见例如图8、图9和图13)。在一些情况下,酶具有鸟氨酸脱羧酶抗酶活性。在某些实施例中,包含失活突变的酶是OAZ1。在一些情况下,酶具有亚精胺合酶活性。在某些实施例中,包含失活突变的酶是SPE3。在一些情况下,酶具有精胺合酶活性。在一些实施例中,包含失活突变的酶是SPE4。在一些情况下,蛋白质是具有多胺输出活性的膜转运蛋白。在某些实施例中,包含失活突变的酶或蛋白质是TPO5。在一些情况下,蛋白质是具有生物碱输出活性的膜转运蛋白。在某些实施例中,包含失活突变的酶或蛋白质是多药耐药性转运蛋白,包括但不限于PDR1、PDR5、PDR10、PDR11、PDR12、PDR15、SNQ2、YOR1、FLR1、QDR1、QDR2、QDR3、YHK8、HOL1、DTR1和AQR1。在一些情况下,酶具有苯基丙烯酸脱羧酶活性。在某些实施例中,包含失活突变的酶是PAD1。在一些情况下,酶具有醇脱氢酶活性。在一些实施例中,包含失活突变的酶选自ADH2、ADH3、ADH4、ADH5、ADH6、ADH7和SFA1。在某些实施例中,包含失活突变的酶是ADH2。在某些实施例中,包含失活突变的酶是ADH3。在某些实施例中,包含失活突变的酶是ADH4。在某些实施例中,包含失活突变的酶是ADH5。在某些实施例中,包含失活突变的酶是ADH6。在某些实施例中,包含失活突变的酶是ADH7。在一些情况下,酶具有醛氧化还原酶活性。在某些实施例中,包含失活突变的酶选自HFD1、ALD2、ALD3、ALD4、ALD5和ALD6。在某些实施例中,包含和失活突变的酶是HFD1。在某些实施例中,包含失活突变的酶是ALD2。在某些实施例中,包含失活突变的酶是ALD3。在某些实施例中,包含失活突变的酶是ALD4。在某些实施例中,包含失活突变的酶是ALD5。在某些实施例中,包含失活突变的酶是ALD6。在一些情况下,酶具有葡糖苷酶活性。在某些实施例中,包含失活突变的酶选自EXG1、SPR1和EGH1。在某些实施例中,包含失活突变的酶是EXG1。在某些实施例中,包含失活突变的酶是SPR1。在某些实施例中,包含失活突变的酶是EGH1。在一些实施例中,宿主细胞包含对表1中描述的一个或多个基因的一种或多种失活突变。
用于使用酰基转移酶在非植物宿主中的功能性表达进行TA酰基转移反应的方法
本文提供的一些方法、过程和系统描述了包括酰基供体基团的一种或多种TA前体与包括酰基受体基团的一种或多种TA前体在非植物细胞内产生一种或多种TA的协同反应(下文称为TA酰基转移反应)。这些方法、过程和系统中的一些可以包括经工程改造的宿主细胞。在一些实例中,TA酰基转移反应是将底物转化为各种生物碱的关键步骤。在一些实例中,TA酰基转移反应包括缩合反应。
在一些实例中,TA酰基转移可以涉及至少一个缩合反应。在一些情况下,缩合反应中的至少一个是在酶的存在下进行的。在一些情况下,缩合反应中的至少一个是由酶催化的。在一些情况下,至少一种酶可用于催化缩合反应。
在本文描述的一些方法、过程和系统中,缩合反应可以在酶的存在下进行。在一些实例中,酶可以是酰基转移酶。酰基转移酶可以使用带有醇或羧酸根官能团的TA作为底物。酰基转移酶可以使用含有羧酸根基团的TA作为底物,所述羧酸根基团经由与糖(下文称为糖苷)的1-O-β糖苷键活化。酰基转移酶可以将TA醇和羧酸根/糖苷官能团转化为相对应的酯衍生物。在本公开中,适用于TA前体的缩合的酶的非限制性实例包括丝氨酸羧肽酶样酰基转移酶(SCPL-AT)。例如,利托林合酶(EC 2.3.1.-)可以将托品碱和含有醇官能团的其它TA前体与1-O-β-苯基乳酰-葡萄糖和其它TA糖苷前体缩合为利托林和其它相对应的酯产物。在一些实例中,包括前述实例中的任一个的SCPL-AT结构域的蛋白质可以进行缩合。在一些实例中,SCPL-AT可以催化宿主细胞(如本文所述的经工程改造的宿主细胞)内的缩合反应。在又其它实例中,SCPL-AT可以催化宿主细胞(如本文所述的经工程改造的宿主细胞)内部的亚细胞区室内的缩合反应。
在本发明的一些实施例中,用于进行TA酰基转移反应的酰基转移酶(如SCPL-AT酶)的氨基酸序列经受一种或多种修饰,这些修饰改变了酶的翻译后加工、运输、折叠、寡聚化和/或亚细胞定位。由于包括SCPL-AT酶在内的一些酰基转移酶从未被证明可在活的非植物细胞中表现出催化活性,因此这种修饰对于在非植物宿主细胞中的活性可能是有用的或者可能是必需的。这种修饰的实例包括但不限于:N端信号肽序列的添加、去除或替换;内部前肽序列的添加、去除或替换;天冬酰胺连接的N-糖基化位点的添加或去除;丝氨酸连接的O-糖基化位点的添加或去除;和蛋白质结构域与酰基转移酶结构域的N端和/或C端的融合。
在本发明的一个实施例中,SCPL-AT酶结构域通过融合可溶性蛋白质结构域在其N端被修饰。该可溶性结构域掩蔽酰基转移酶结构域中的任何内部信号序列,从而修饰融合SCPL-AT结构域的运输和/或亚细胞定位。在一些实例中,N端融合的结构域诱导SCPL-AT结构域向亚细胞区室(包括但不限于ER膜、ER腔、顺式高尔基体、反式高尔基体、溶酶体、液泡膜和液泡腔)的运输。N端融合的可溶性结构域还可以将SCPL-AT结构域的寡聚化状态从其天然状态(单体)修饰为任何状态,包括但不限于同源二聚体、异源二聚体、同源三聚体、异源三聚体、同源四聚体、异源四聚体、同源六聚体、异源六聚体、同源八聚体、异源八聚体或更高程度的寡聚化。
在一个实例中,N端融合的可溶性蛋白质结构域是选自以下群组的荧光蛋白,所述群组包括但不限于源于多管水母属某种的荧光蛋白和源于圆盘海葵属某种的荧光蛋白。在一个实例中,N端融合的可溶性蛋白质结构域是来自盘圆盘海葵属某种的红色荧光蛋白(DsRed)。在其它实例中,N端融合的可溶性蛋白质结构域是TA生物合成途径中的另一种酶,包括但不限于鸟氨酸脱羧酶、腐胺N-甲基转移酶、吡咯烷酮合酶、托品酮还原酶、苯丙酮酸盐还原酶、苯基乳酸UDP-葡糖基转移酶84A27和莨菪碱脱氢酶。
在表3中提供了可溶性蛋白质结构域的氨基酸序列的实例,这些可溶性蛋白质结构域可以融合到SCPL-AT结构域的N端,然后可以用于在非植物细胞内进行TA酰基转移反应。包括融合N端结构域并用于非植物细胞中的TA酰基转移反应的SCPL-AT酶的氨基酸序列可以与表3中列出的给定氨基酸序列具有50%或更多同一性。例如,这种酰基转移酶的氨基酸序列可以包括与本文提供的氨基酸序列具有至少50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、81%或更多、82%或更多、83%或更多、84%或更多、85%或更多、86%或更多、87%或更多、88%或更多、89%或更多、90%或更多、91%或更多、92%或更多、93%或更多、94%或更多、95%或更多、96%或更多、97%或更多、98%或更多、或99%或更多同一性的氨基酸序列。此外,在某些实施例中,“同一性”氨基酸序列在氨基酸水平上与特定氨基酸序列含有至少80%-99%同一性。在一些情况下,“同一性”氨基酸序列在氨基酸水平上含有至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%同一性,并且在某些情况下含有更多的至少95%、96%、97%、98%和99%同一性。在一些情况下,氨基酸序列可能是完全相同的,但是DNA序列被改变,以例如优化宿主生物体的密码子使用。
可以提供产生催化TA酰基转移反应的酰基转移酶的经工程改造的非植物宿主细胞,其中酰基转移酶包括N端与选自由表3中的那些序列组成的群组的可溶性蛋白质结构域的氨基酸序列融合的氨基酸序列。在经工程改造的宿主细胞内产生的酰基转移酶可以被回收和纯化以形成生物催化剂。从产生酰基转移酶的经工程改造的宿主细胞中回收的所述一种或多种酶可以用于进行TA酰基转移反应的过程中。所述过程可以包括使具有醇和/或羧酸根/糖苷官能团的TA前体与酰基转移酶接触,所述酰基转移酶的量足以将醇和/或羧酸根/糖苷基团转化为相对应的酯基团。在实例中,具有醇和/或羧酸根/糖苷官能团的TA前体可以与足量的所述一种或多种酶接触,使得至少5%的所述TA前体转化为相对应的酯。在另外的实例中,具有醇和/或羧酸根/糖苷官能团的TA可以与足量的所述一种或多种酶接触,使得至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少82%、至少84%,至少86%、至少88%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.7%或100%的所述TA前体转化为相对应的酯。
可以用于进行TA酰基转移反应的所述一种或多种酶可以在体外接触TA前体。此外或可替代地,可以用于进行TA酰基转移反应的所述一种或多种酶可以在体内接触TA前体。此外,可以用于进行TA酰基转移反应的所述一种或多种酶可以被提供给其内具有TA前体的细胞,或者可以在经工程改造的非植物宿主细胞内产生。
在一些实例中,所述方法提供了产生生物碱产物的经工程改造的非植物宿主细胞,其中TA酰基转移反应可以包括生物碱产物产生中的关键步骤。在一些实例中,所产生的生物碱是药用TA。在又其它实施例中,所产生的生物碱衍生自药用TA,包括例如非天然TA。在又其它实施例中,生物碱产物选自由以下组成的群组:药用TA、非药用TA和非天然TA。
在一些实例中,底物是选自由以下组成的群组的TA前体:托品碱、假托品碱、芽子碱、甲基芽子碱、苯基乳酸、肉桂酸、阿魏酸、香豆酸和所列化合物的糖苷。
在一些实例中,所述方法提供了由托品碱和1-O-β-苯基乳酰葡萄糖产生生物碱产物的经工程改造的非植物宿主细胞。将托品碱和1-O-β-苯基乳酰葡萄糖缩合为利托林可以包括由前体产生多种生物碱产物中的关键步骤。在一些实例中,前体是L-氨基酸或糖(例如,葡萄糖)。多种生物碱产物可以包括但不限于药用TA、非药用TA和非天然TA。
任何合适的碳源都可以用作TA酰基转移反应的前体。合适的前体可以包括但不限于单糖(例如,葡萄糖、果糖、半乳糖、木糖)、寡糖(例如,乳糖、蔗糖、棉子糖)、多糖(例如,淀粉、纤维素)或其组合。在一些实例中,可以使用来自可再生原料的未纯化混合物(例如,玉米浆、糖甜菜糖蜜、大麦芽、生物质水解产物)。在又其它实施例中,碳前体可以是单碳化合物(例如,甲醇、二氧化碳)或双碳化合物(例如,乙醇)。在又其它实施例中,可以使用其它含碳化合物,例如甲胺、葡糖胺和氨基酸(例如,L-精氨酸和L-苯丙氨酸)。在一些实例中,可以将具有醇和/或羧酸根/糖苷官能团的TA或TA前体直接加入到本发明的经工程改造的宿主细胞中,包括例如托品碱、假托品碱、芽子碱、甲基芽子碱、苯基乳酸、肉桂酸、阿魏酸、香豆酸和所列化合物的糖苷。
在一些实施例中,用于进行液泡TA酰基转移反应的底物可以包括一个或多个醇和/或羧酸根/糖苷官能团,其中所述官能团中的仅一个被缩合为相对应的酯。
TA醇-醛相互转化
本文提供的一些方法、过程和系统描述了将具有醛官能团的TA转化为具有醇(羟基)官能团的TA以及将具有醇官能团的TA转化为具有醛官能团的TA(下文称为TA醇-醛相互转化)。这些方法、过程和系统中的一些可以包括经工程改造的宿主细胞。在一些实例中,TA醇-醛相互转化是将底物转化为多种生物碱中的关键步骤。在一些实例中,将TA醛基转化为TA醇基包括还原反应。在一些情况下,可以通过将醛底物还原为相对应的四面体氧阴离子中间体,然后将该中间体质子化为羟基,来将底物TA醛还原为醇,如图2中所提供并如方案1中所一般表示。如方案1中所提供,R
方案1
在一些实例中,TA醇-醛相互转化可以涉及至少一个氧化反应或至少一个还原反应。在一些情况下,氧化或还原反应中的至少一者在酶的存在下进行。在一些情况下,氧化或还原反应中的至少一者是由酶催化的。在一些情况下,氧化和还原反应都在至少一种酶的存在下进行。在一些情况下,至少一种酶可用于催化氧化和还原反应。氧化和还原反应可以由同一种酶催化。
在本文描述的一些方法、过程和系统中,氧化或还原反应可以在酶的存在下进行。在一些实例中,酶可以是脱氢酶。脱氢酶可以使用具有醇或醛官能团的TA作为底物。脱氢酶可以将TA醇或醛官能团转化为相对应的醛或醇衍生物。脱氢酶可以被称为莨菪碱脱氢酶(HDH)。在本公开中适用于氧化和/或还原TA的酶的非限制性实例包括细胞色素P450氧化酶、2-氧代戊二酸盐依赖性氧化酶、黄素蛋白氧化酶、短链脱氢酶-还原酶(SDR)、中链脱氢酶-还原酶(MDR)、肉桂醇脱氢酶(CAD)和醛-酮还原酶(AKR)。例如,托品酮还原酶1(EC1.1.1.206)可以将托品酮和具有酮官能团的其它TA前体氧化为托品碱(3α-托品醇)和其它相对应的醇产物。在一些实例中,包括前述实例中的任一个的脱氢酶结构域的蛋白质可以进行氧化或还原。在一些实例中,脱氢酶可以催化宿主细胞(如本文所述的经工程改造的宿主细胞)内的氧化和/或还原反应。
在表2中提供了可以用于进行TA醇-醛相互转化的脱氢酶的氨基酸序列的实例。用于TA醇-醛相互转化的脱氢酶的氨基酸序列可以与表2中列出的给定氨基酸序列具有50%或更多同一性。例如,这种脱氢酶的氨基酸序列可以包括与本文提供的氨基酸序列具有至少50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、81%或更多、82%或更多、83%或更多、84%或更多、85%或更多、86%或更多、87%或更多、88%或更多、89%或更多、90%或更多、91%或更多、92%或更多、93%或更多、94%或更多、95%或更多、96%或更多、97%或更多、98%或更多、或99%或更多同一性的氨基酸序列。此外,在某些实施例中,“同一性”氨基酸序列在氨基酸水平上与特定氨基酸序列含有至少80%-99%同一性。在一些情况下,“同一性”氨基酸序列在氨基酸水平上含有至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%同一性,并且在某些情况下含有更多的至少95%、96%、97%、98%和99%同一性。在一些情况下,氨基酸序列可能是完全相同的,但是DNA序列被改变,以例如优化宿主生物体的密码子使用。
可以提供产生催化TA醇-醛相互转化的脱氢酶的经工程改造的宿主细胞,其中脱氢酶包括选自由表2中的那些序列组成的群组的氨基酸序列。在经工程改造的宿主细胞中产生的脱氢酶可以被回收和纯化以形成生物催化剂。从产生脱氢酶的经工程改造的宿主细胞中回收的所述一种或多种酶可以用于进行TA醇-醛相互转化的过程中。所述过程可以包括使具有醇和/或醛官能团的TA与脱氢酶接触,所述脱氢酶的量足以将TA的醇和/或醛基转化为相对应的醛和/或醇基。在实例中,具有醇和/或醛官能团的TA可以与足量的所述一种或多种酶接触,使得至少5%的所述TA转化为其相对应的醛和/或醇基。在另外的实例中,具有醇和/或醛官能团的TA可以与足量的所述一种或多种酶接触,使得至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少82%、至少84%、至少86%、至少88%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.7%或100%的所述TA转化为其相对应的醛和/或醇基。
可以用于进行TA醇-醛相互转化的所述一种或多种酶可以在体外接触TA。此外或可替代地,可以用于进行TA醇-醛相互转化的所述一种或多种酶可以在体内接触TA。此外,可以用于进行TA醇-醛相互转化的所述一种或多种酶可以被提供给其内具有TA的细胞,或者可以在经工程改造的宿主细胞中产生。
在一些实例中,所述方法提供了产生生物碱产物的经工程改造的宿主细胞,其中TA醇-醛相互转化可以包括生物碱产物产生中的关键步骤。在一些实例中,所产生的生物碱是药用TA。在又其它实施例中,所产生的生物碱衍生自药用TA,包括例如非天然TA。在另一个实施例中,具有醇和/或醛官能团的TA是经工程改造的宿主细胞产物的中间体。在又其它实施例中,生物碱产物选自由以下组成的群组:药用TA、非药用TA和非天然TA。
在一些实例中,底物是选自由以下组成的群组的TA或TA的前体:利托林、莨菪碱醛、莨菪碱、山莨菪碱和东莨菪碱。
在一些实例中,所述方法提供了由莨菪碱醛产生生物碱产物的经工程改造的宿主细胞。将莨菪碱醛还原为莨菪碱可以包括由前体产生多种生物碱产物中的关键步骤。在一些实例中,前体是L-氨基酸或糖(例如,葡萄糖)。多种生物碱产物可以包括但不限于药用TA、非药用TA和非天然TA。
任何合适的碳源都可以用作TA醇-醛相互转化的前体。合适的前体可以包括但不限于单糖(例如,葡萄糖、果糖、半乳糖、木糖)、寡糖(例如,乳糖、蔗糖、棉子糖)、多糖(例如,淀粉、纤维素)或其组合。在一些实例中,可以使用来自可再生原料的未纯化混合物(例如,玉米浆、糖甜菜糖蜜、大麦芽、生物质水解产物)。在又其它实施例中,碳前体可以是单碳化合物(例如,甲醇、二氧化碳)或双碳化合物(例如,乙醇)。在又其它实施例中,可以使用其它含碳化合物,例如甲胺、葡糖胺和氨基酸(例如,L-精氨酸和L-苯丙氨酸)。在一些实例中,可以将具有醇和/或醛官能团的TA或TA前体直接加入到本发明的经工程改造的宿主细胞中,包括例如托品碱、假托品碱、芽子碱、甲基芽子碱、利托林、莨菪碱醛、莨菪碱、山莨菪碱和东莨菪碱。
在一些实施例中,用于进行TA醇-醛相互转化的底物可以包括一个或多个醇和/或醛官能团,其中所述官能团中的仅一个被氧化或还原为相对应的醛或醇基。
用于调节细胞代谢物运送的方法
本文提供的一些方法、过程和系统描述了使用蛋白质(下文称为“转运蛋白”,如先前所定义)来跨脂质或脂质-蛋白质膜转运代谢物(下文称为“跨膜运送”)。这些方法、过程和系统中的一些可以包括经工程改造的宿主细胞。在一些实例中,跨膜运送是将底物转化为多种生物碱中的关键步骤。
在某些实施例中,宿主细胞包含一种或多种转运蛋白或其活性片段的一个或多个异源编码序列,所述转运蛋白或其活性片段定位于脂质或脂质-蛋白质膜并跨同一膜转运TA或TA前体。在一些实例中,膜是液泡膜。在其它实例中,膜是ER膜。在一些实例中,膜是过氧化物酶体膜。在一些实例中,膜是线粒体膜。在其它实例中,膜是细胞质膜。
在一些实例中,以这种方式运送的TA和TA前体包括但不限于腐胺、N-甲基腐胺、4-甲基氨基丁醛、N-甲基吡咯啉鎓、托品酮、托品碱、去甲托品碱、托品碱N-氧化物、苯基乳酸、1-O-β-苯基乳酰葡萄糖、利托林、去甲利托林、利托林N-氧化物、莨菪碱、去甲莨菪碱、莨菪碱N-氧化物、山莨菪碱、去甲山莨菪碱、山莨菪碱N-氧化物、东莨菪碱、去甲东莨菪碱和东莨菪碱N-氧化物。这种TA或TA前体在特定亚细胞区室中的积累可以阻止不同区室中的可操作连接的生物合成酶的进入;因此,使用将TA或TA前体从一个区室转运到另一个区室的转运蛋白可以缓解这种运送限制。在某些情况下,宿主细胞内的一种或多种转运蛋白的异源编码序列的表达可以增加TA或TA前体的产量。
在一些实施例中,转运蛋白或其活性片段是多药和毒素挤出(MATE)转运蛋白。运送上述TA或TA前体中的一种或多种的任何方便的MATE转运蛋白都可用于主题宿主细胞。感兴趣的转运蛋白包括但不限于酶,如烟草茉莉酮酸盐诱导型生物碱转运蛋白1(NtJAT1)、烟草茉莉酮酸盐诱导型生物碱转运蛋白2(NtJAT2)、烟草MATE1、烟草MATE2或表1和表4中描述的任何其它酶。
在某些实施例中,转运蛋白或其活性片段是硝酸盐转运蛋白1/肽转运蛋白家族(NPF/NRT)转运蛋白。运送上述TA或TA前体中的一种或多种的任何方便的NPF/NRT转运蛋白都可用于主题宿主细胞。感兴趣的转运蛋白包括但不限于酶,如颠茄乳糖通透酶样转运蛋白1(AbLP1)、长春花NPF转运蛋白2.9(CrNPF2.9)或表1、表4和表6中描述的任何其它酶。
在一些实施例中,转运蛋白或其活性片段是嘌呤摄取通透酶样(PUP)家族转运蛋白。运送上述TA或TA前体中的一种或多种的任何方便的PUP转运蛋白都可用于主题宿主细胞。感兴趣的转运蛋白包括但不限于酶,如烟草烟碱摄取通透酶1(NtNUP1)、颠茄嘌呤摄取通透酶样转运蛋白1(AbPUP1)或表1、表4和表6中描述的任何其它酶。
在其它实施例中,转运蛋白或其活性片段是ATP结合盒(ABC)转运蛋白。运送上述TA或TA前体中的一种或多种的任何方便的ABC转运蛋白都可用于主题宿主细胞。在一些实施例中,转运蛋白或其活性片段是多向耐药性(PDR)转运蛋白。运送上述TA或TA前体中的一种或多种的任何方便的PDR转运蛋白都可用于主题宿主细胞。
在某些实施例中,转运蛋白或其活性片段是将托品碱或托品碱衍生物从主题宿主细胞的胞质溶胶转运到液泡腔的转运蛋白,如NtJAT1、NtJAT2、NtMATE1或NtMATE2。在一些实施例中,转运蛋白或其活性片段是将酰基-O-β-葡糖苷(如苯基乳酰基-O-β-葡糖苷)从主题宿主细胞的胞质溶胶转运到液泡腔的转运蛋白。在某些其它实施例中,转运蛋白或其活性片段是将利托林或利托林衍生物从主题宿主细胞的液泡腔转运到胞质溶胶的转运蛋白,如AbPUP1或AbLP1。在其它实施例中,转运蛋白或其活性片段是将TA、TA前体或TA衍生物在胞质溶胶和主题宿主细胞周围的细胞外空间之间转运的转运蛋白,如AbPUP1或AbLP1。
在某些实施例中,宿主细胞包含转运蛋白或其活性片段的异源编码序列。在本发明的一些实施例中,转运蛋白的氨基酸序列经受一种或多种修饰,这些修饰改变了酶的亚细胞定位、底物转运方向和/或拓扑定向。这种修饰的实例包括但不限于:N端、C端或内部信号序列的添加、去除或替换;跨膜螺旋的添加、去除、替换或重排;和蛋白质结构域与转运蛋白N端和/或C端的融合。
在表1、表4和表6中提供了可以用于减轻底物运送限制和/或增加特定细胞区室中的TA或TA前体积累的转运蛋白的氨基酸序列的实例。在非植物细胞中以这种方式利用的转运蛋白的氨基酸序列可以与表1、表4和表6中列出的给定氨基酸序列具有50%或更多同一性。例如,这种转运蛋白的氨基酸序列可以包括与本文提供的氨基酸序列具有至少50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、81%或更多、82%或更多、83%或更多、84%或更多、85%或更多、86%或更多、87%或更多、88%或更多、89%或更多、90%或更多、91%或更多、92%或更多、93%或更多、94%或更多、95%或更多、96%或更多、97%或更多、98%或更多、或99%或更多同一性的氨基酸序列。此外,在某些实施例中,“同一性”氨基酸序列在氨基酸水平上与特定氨基酸序列含有至少80%-99%同一性。在一些情况下,“同一性”氨基酸序列在氨基酸水平上含有至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%同一性,并且在某些情况下含有更多的至少95%、96%、97%、98%和99%同一性。在一些情况下,氨基酸序列可能是完全相同的,但是DNA序列被改变,以例如优化宿主生物体的密码子使用。
可以提供产生将一种或多种TA或TA前体或TA衍生物从一个细胞区室转运到另一个细胞区室的转运蛋白的经工程改造的非植物宿主细胞,其中转运蛋白包括选自由表1、表4和表6中的那些序列组成的群组的氨基酸序列。在一些实例中,所述方法提供了产生生物碱产物的经工程改造的非植物宿主细胞,其中TA跨膜运送可以包括生物碱产物产生中的关键或必要步骤。在一些实例中,所产生的生物碱是药用TA。在又其它实施例中,所产生的生物碱衍生自药用TA,包括例如非天然TA。在又其它实施例中,生物碱产物选自由以下组成的群组:药用TA、非药用TA和非天然TA。
异源编码序列
在一些实例中,宿主细胞是携带一个或多个异源编码序列(例如,两个或更多个、三个或更多个、四个或更多个、五个或更多个、或甚至更多个)的细胞,所述异源编码序列编码使宿主细胞能够产生期望的感兴趣的TA(例如,如本文所述)的活性。如本文使用,术语“异源编码序列”用于指示编码或最终编码肽或蛋白质或其等同氨基酸序列(例如,酶或转运蛋白)的任何多核苷酸,所述肽或蛋白质或其等同氨基酸序列通常不存在于宿主生物体中,但可以在适当条件下在宿主细胞中表达。因此,“异源编码序列”包括通常存在于宿主细胞中的编码序列的多个拷贝,使得细胞表达通常不存在于细胞中的编码序列的额外拷贝。异源编码序列可以是RNA或其任何类型(例如,mRNA)、DNA或其任何类型(例如,cDNA)或RNA/DNA的杂交体。感兴趣的编码序列包括但不限于全长转录单位,其包含如编码序列、内含子、启动子区、3'-UTR和增强子区等特征。
在实例中,经工程改造的宿主细胞包括多个异源编码序列,每个异源编码序列编码酶或转运蛋白。在一些实例中,由所述多个异源编码序列编码的所述多种酶和转运蛋白可以彼此不同。在一些实例中,由所述多个异源编码序列编码的所述多种酶和转运蛋白中的一些可以彼此不同,并且由所述多个异源编码序列编码的所述多种酶和转运蛋白中的一些可以是重复拷贝。
在一些实例中,异源编码序列可以可操作地连接。可操作地连接的异源编码序列可以位于产生特定TA产物的相同途径内。在一些实例中,可操作地连接的异源编码序列可以是沿着产生特定TA产物的途径直接连续的。在一些实例中,可操作地连接的异源编码序列可以在由所述多个异源编码序列编码的酶或转运蛋白中的一种或多种之间具有一种或多种天然酶或一个或多个运送步骤。在一些实例中,异源编码序列可以在由所述多个异源编码序列编码的酶或转运蛋白中的一种或多种之间具有一种或多种异源酶或转运蛋白。在一些实例中,异源编码序列可以在由所述多个异源编码序列编码的酶或转运蛋白中的一种或多种之间具有一种或多种非天然酶或转运蛋白。
在一些实施例中,宿主细胞包含腐胺N-甲基转移酶(PMT)活性。任何方便的PMT酶都可用于主题宿主细胞。感兴趣的PMT酶包括但不限于酶,如表1中描述的EC 2.1.1.53。在某些实施例中,宿主细胞包含PMT或其活性片段的异源编码序列。
在一些实例中,宿主细胞包含将NMP转化为4MAB的一种或多种酶或其活性片段的一个或多个异源编码序列。在某些情况下,所述一种或多种酶选自植物甲基腐胺氧化酶(MPO)、真核MPO和真核多胺氧化酶(例如,EC 1.4.3.22)。
在某些实施例中,细胞包含将NMPy转化为MPOB的一种或多种酶或其活性片段的一个或多个异源编码序列。在某些情况下,所述一种或多种酶是III型聚酮合酶(例如,EC2.3.1.-)。所述一个或多个异源编码序列可以源于任何方便的物种(例如,如本文所述)。在一些情况下,所述一个或多个异源编码序列可以源于表1中描述的物种。在一些情况下,所述一个或多个异源编码序列存在于选自表1中描述的那些的基因或酶中。
在某些实施例中,宿主细胞包含托品酮合酶活性。任何方便的托品酮合酶(例如,CYP82M3)都可用于主题宿主细胞。感兴趣的托品酮合酶包括但不限于酶,如表1中描述的EC1.14.14.-。在某些实施例中,宿主细胞包含托品酮合酶或其活性片段的异源编码序列。
在某些实施例中,宿主细胞包含托品酮还原酶活性。任何方便的托品酮还原酶都可用于主题宿主细胞。感兴趣的托品酮还原酶包括但不限于酶,如表1中描述的EC1.1.1.206。在某些实施例中,宿主细胞包含托品酮还原酶或其活性片段的异源编码序列。
在一些实例中,宿主细胞包含苯丙酮酸盐还原酶(PPR)活性。任何方便的PPR酶都可用于主题宿主细胞。一些感兴趣的PPR酶包括但不限于酶,如表1中描述的EC 1.1.1.237。在某些实施例中,宿主细胞包含PPR或其活性片段的异源编码序列。
在某些实施例中,宿主细胞包含苯基乳酸盐糖基转移酶活性。任何方便的苯基乳酸盐糖基转移酶都可用于主题宿主细胞。糖基转移酶包括但不限于酶,如表1中描述的2.4.1.-,其通过糖苷酯键将葡萄糖部分从UDP-葡萄糖转移到苯基乳酸盐。在某些实施例中,宿主细胞包含苯基乳酸盐糖基转移酶或其活性片段的异源编码序列。
在某些实施例中,细胞包含将托品碱和1-O-β-苯基乳酰葡萄糖转化为利托林的一种或多种酶或其活性片段的一个或多个异源编码序列。在一些实施例中,宿主细胞包含利托林合酶活性。任何方便的利托林合酶或包括利托林合酶活性片段的酶都可用于主题宿主细胞。感兴趣的利托林合酶包括但不限于酶,如表1中描述的EC 2.3.1.-,以及包括N端融合到表3中描述的可溶性蛋白质结构域的利托林合酶的酶。在某些实施例中,宿主细胞包含利托林合酶或其活性片段的异源编码序列。
在某些实例中,宿主细胞包含利托林变位酶活性。任何方便的利托林变位酶都可用于主题宿主细胞。感兴趣的利托林变位酶包括但不限于酶,如表1中描述的EC1.14.19.-。在某些实施例中,宿主细胞包含利托林变位酶或其活性片段的异源编码序列。
在一些实施例中,宿主细胞包含莨菪碱脱氢酶(HDH)活性。任何方便的HDH酶都可用于主题宿主细胞。一些感兴趣的HDH酶包括但不限于表2中描述的那些序列。在某些实施例中,宿主细胞包含HDH或其活性片段的异源编码序列。
在某些实施例中,宿主细胞包含莨菪碱6β-羟化酶/双加氧酶(H6H)活性。任何方便的H6H酶都可用于主题宿主细胞。一些感兴趣的H6H酶包括但不限于酶,如表1中描述的EC1.14.11.11。在某些实施例中,宿主细胞包含H6H或其活性片段的异源编码序列。
在某些实例中,经工程改造的宿主细胞包括多个异源编码序列,每个异源编码序列编码跨膜代谢物转运蛋白。在一些实例中,由所述多个异源编码序列编码的所述多种转运蛋白可以彼此不同。在一些实例中,由所述多个异源编码序列编码的所述多种转运蛋白中的一些可以彼此不同,并且由所述多个异源编码序列编码的所述多种转运蛋白中的一些可以是重复拷贝。在一些实施例中,宿主细胞包含液泡托品碱输入活性。能够将托品碱从胞质溶胶运送到液泡腔的任何方便的转运蛋白都可用于主题宿主细胞。这种转运蛋白的实例包含NtJAT1、NtJAT2、NtMATE1和NtMATE2。在一些实施例中,宿主细胞包含液泡1-O-β-苯基乳酰葡萄糖输入活性。能够将1-O-β-苯基乳酰葡萄糖从胞质溶胶运送到液泡腔的任何方便的转运蛋白都可用于主题宿主细胞。在一些实施例中,宿主细胞包含液泡利托林输出活性。能够将利托林从液泡腔运送到胞质溶胶的任何方便的转运蛋白都可用于主题宿主细胞。这种转运蛋白的实例包括AbPUP1和AbLP1。在其它实施例中,宿主细胞包含细胞TA输入活性。能够将利托林、莨菪碱醛、莨菪碱、山莨菪碱、东莨菪碱或其衍生物从细胞外空间运送到胞质溶胶中的任何方便转运蛋白都可用于主题宿主细胞。这种转运蛋白的实例包括AbPUP1和AbLP1。
如本文使用,术语“异源编码序列”还包含肽或酶的编码部分,即肽或酶的cDNA或mRNA序列,以及全长转录单位的编码部分,即包含内含子和外显子的基因,以及编码酶或转运蛋白或编码其等同氨基酸序列的“密码子优化”序列、截短序列或其它形式的改变序列,前提是等同氨基酸序列产生功能性蛋白质。这种等同氨基酸序列可以具有一个或多个氨基酸的缺失,其中缺失发生在N端、C端或内部。截短形式是可设想的,只要它们具有本文指示的催化或运送能力。还可设想两种或更多种酶或一种或多种酶与转运蛋白的融合体,以促进代谢物在途径中的转移,前提是维持催化和运送活性。还包含了一种或多种酶或催化蛋白质结构域与一种或多种非催化蛋白质结构域的融合体,通过此融合方式,非催化蛋白质结构域促进了融合催化结构域的溶解、折叠、成熟和/或活性。
可操作的片段、突变体或截短形式可以通过建模和/或筛选来标识。这可以通过以逐步方式添加或缺失例如蛋白质的N端、C端或内部区域,然后与原始序列相比分析所得衍生物对期望反应的活性来实现。如果所讨论的衍生物以这种能力起作用,则认为构成了合适的等同酶衍生物。
本发明的各方面还涉及异源编码序列,其编码的氨基酸序列等同于各种酶的天然氨基酸序列。“等同”氨基酸序列被定义为与特定氨基酸序列不完全相同,但含有至少一些氨基酸变化(缺失、取代、倒置、插入等)的氨基酸序列,当用于期望目的时,所述氨基酸变化基本上不影响蛋白质的生物活性(与特定氨基酸序列的类似活性相比)。在脱羧酶的实例中,生物活性是指其催化活性。等同序列还意指包含已经被工程改造和/或进化以具有不同于原始氨基酸序列的性质的那些。感兴趣的可变性质包括催化活性、底物特异性、选择性、稳定性、溶解性、定位等。在某些实施例中,“等同”氨基酸序列在氨基酸水平上与特定氨基酸序列含有至少80%-99%同一性,在一些情况下在氨基酸水平上含有至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%同一性,并且在某些情况下含有更多的至少95%、96%、97%、98%和99%同一性。在一些情况下,氨基酸序列可能是完全相同的,但是DNA序列被改变,以例如优化宿主生物体的密码子使用。
宿主细胞也可以被修饰,从而具有一种或多种遗传改变,以适应异源编码序列。天然宿主基因组的改变包括但不限于修饰基因组以减少或消除可能干扰期望途径的特定蛋白质的表达。这种天然蛋白质的存在可以将所述途径的中间体或终产物中的一种迅速转化为代谢物或在期望途径中不可用的其它化合物。可替代地,这种天然蛋白质的存在可以将所述途径的中间体或终产物中的一种迅速运送到不同的细胞区室或细胞外,使得其在期望途径中不可用。因此,如果天然酶或转运蛋白的活性降低或完全不存在,所产生的中间体将更容易并入到期望产物和/或期望细胞区室中。
在一些实例中,在对蛋白质表达的消除感兴趣时,改变发生在参与多向药物反应的蛋白质中,包括但不限于ATP结合盒(ABC)转运蛋白、多药耐药性(MDR)泵和相关联的转录因子。这些蛋白质参与TA分子和TA前体向培养基中的输出,因此缺失会控制化合物向培养基中的输出,从而使它们更可并入到期望产物中。在一些实施例中,感兴趣的宿主细胞基因缺失包括与未折叠蛋白反应和内质网(ER)增殖相关联的基因。这种基因缺失可以导致TA产量的提高。细胞色素P450的表达可以诱导未折叠蛋白反应,并且可以导致ER增殖。与这些应激反应相关联的基因的缺失可以控制或减少宿主细胞上的总体负担并提高途径性能。在其它实施例中,感兴趣的宿主细胞基因缺失包括与溶酶体成熟以及液泡成熟和增殖途径相关联的基因。这种基因缺失可以导致TA产量的提高。一种或多种天然或异源蛋白质在分泌区室(如溶酶体)或液泡膜中的高水平表达可以破坏这些区室的正常成熟(增殖、生长和发育、融合/分裂等)。与这些机制相关联的基因的缺失可以控制区室的形态,从而启动子酶或转运蛋白在区室膜中的表达、稳定性或活性。遗传改变还可以包括修饰内源基因的启动子以增加表达和/或引入内源基因的额外拷贝。这方面的实例包括构建/使用过表达内源酵母NADPH-P450还原酶Ncp1p的菌株,以增加异源P450酶的活性。此外,还可以过表达直接参与中间代谢物的合成的内源酶,如Spe1p、Fms1p、Car1p、Arg2p、Aro8p、Aro9p、Pha2p、Ugp1p、Pdc6p、Idp3p、Leu2p、Ura3p和Trp1p。
感兴趣的异源编码序列包括但不限于编码酶的序列(野生型或等同序列),其通常负责在植物中产生TA和前体。在一些情况下,异源序列编码的酶可以是TA途径中的酶中的任一种,并且可以来自任何方便的来源。特定合成途径的由异源编码序列编码的酶的选择和数量可以基于期望产物来选择。在某些实施例中,本发明的宿主细胞可以包含1个或多个、2个或更多个、3个或更多个、4个或更多个、5个或更多个、6个或更多个、7个或更多个、8个或更多个、9个或更多个、10个或更多个、11个或更多个、12个或更多个、13个或更多个、14个或更多个、或甚至15个或更多个异源编码序列,如1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个异源编码序列。
在一些情况下,由异源编码序列编码的多肽序列在GENBANK中有报道。感兴趣的酶包括但不限于本文描述的那些酶和表1中示出的那些。宿主细胞可以包含来自任何来源的所列酶或转运蛋白的任何组合。除非另有指示,否则表1中的登录号是指GenBank。一些登录号是指酵母基因组数据库(SGD),其可在万维网www.yeastgenome.org上获得。
在一些实施例中,通过将一种或多种酶定位于细胞中的区室,宿主细胞(例如,酵母菌株)被工程改造成用于选择性产生感兴趣的TA。在一些情况下,酶可以定位在宿主细胞中,使得由该酶产生的化合物自发重排,或者在达到可以将所述化合物转化为不期望的代谢物的定位酶之前被另一种酶转化为期望的代谢物。可以选择两种酶之间的空间距离,以防止所述酶中的一种直接作用于化合物而产生不期望的代谢物并限制不期望的终产物(例如,不期望的类鸦片副产物)的产生。在一些其它情况下,酶可以定位在宿主细胞中,使得其所定位的亚细胞区室提供比酶所天然存在的区室更适宜的pH、辅因子浓度、氧化还原电位、底物浓度和/或其活性的其它生化参数。在某些情况下,酶可以定位于宿主细胞内的特定区室,使得将酶运送到所述区室的细胞内运输途径为酶表现出活性而提供必要的翻译后修饰。这种翻译后修饰包括但不限于乙酰化、乙酰糖基化、酰胺化、羧基化、甲基化、谷胱甘肽化、羟基化、糖基化、磷酸化、磺化、二硫键形成、信号序列切割和多酶复合物形成。在某些实施例中,本文描述的酶中的任一种可以单独地或与第二种酶一起定位于宿主细胞中的任何方便的区室,包括但不限于细胞器、内质网、高尔基体、液泡、细胞核、质膜、线粒体、过氧化物酶体、周质、上述细胞器中的任一个的腔、或包围上述细胞器中的任一个或与其相关联的膜。在一种或多种酶定位于与上述细胞器中的任一个相关联的膜的情况下,酶可以被定向,使得酶的催化结构域面向胞质溶胶、细胞器的腔和/或任何其它细胞内空间。在一些实施例中,宿主细胞包含所述酶中的一种或多种,其包含定位标记。可以使用任何方便的标记。在一些情况下,定位标记是连接在酶的N端和/或C端处的肽序列。
可以利用任何方便的方法将标记连接到酶上。在一些情况下,定位标记源于内源酵母蛋白。这种标记可以提供到达多种酵母细胞器(包括但不限于内质网(ER)、高尔基器(GA)、线粒体(MT)、质膜(PM)、过氧化物酶体(POX)和液泡(V))的路线。在某些实施例中,标记是ER路由标记(例如,ER1)。在某些实施例中,标记是液泡标记(例如,V1)。在某些实施例中,标记是质膜标记(例如,P1)。在某些实施例中,标记是过氧化物酶体靶向序列(例如,PTS1)。在某些实例中,标记包含或源于尾锚定类蛋白质内的跨膜结构域。在一些实施例中,定位标记将酶定位在细胞器的外部上。在某些实施例中,定位标记将酶定位在细胞器的内部上。在一些实施例中,定位标记定位酶,使得酶的一个或多个部分可见于细胞器的内部和外部。
在本发明的一些实施例中,通过表达编码包括上述定位标记的一种或多种酶的一个或多个编码序列来修饰宿主细胞。在某些实施例中,通过表达一个或多个异源编码序列,使得在胞质溶胶中表达一种或多种酶来修饰宿主细胞。这种酶的实例包括但不限于精氨酸脱羧酶、腐胺N-甲基转移酶、吡咯烷酮合酶、托品酮还原酶、苯丙酮酸盐还原酶、UDP-葡糖基转移酶、2-氧代戊二酸盐依赖性双加氧酶(如莨菪碱6β-羟化酶/双加氧酶)和吡咯里西啶N-加氧酶。在某些实施例中,通过表达一个或多个异源编码序列,使得在ER膜中表达一种或多种酶来修饰宿主细胞。这种酶的实例包括但不限于细胞色素P450,如托品酮合酶(CYP82M3)利托林变位酶(CYP80F1);人肝CYP450,包括(但不限于)CYP2D6、CYP2C19和CYP3A4;和NADP
在一些实例中,每种类型的酶的表达通过额外的基因拷贝(即多个拷贝)而增加,这增加了中间积累和/或感兴趣的TA的产量。本发明的实施例包括通过单种或多种酶或转运蛋白的多种物种变体的同时表达来增加宿主细胞中的感兴趣的TA的产量。在一些情况下,在宿主细胞中包含单种或多种酶或转运蛋白的额外基因拷贝。可以使用包含宿主细胞中的酶或转运蛋白的异源编码序列的多个拷贝的任何方便的方法。
在一些实施例中,宿主细胞包含酶或转运蛋白的异源编码序列的多个拷贝,例如2个或更多个、3个或更多个、4个或更多个、5个或更多个、或甚至10个或更多个拷贝。在某些实施例中,宿主细胞包含一种或多种酶或转运蛋白(如两种或更多种、三种或更多种、四种或更多种等)的异源编码序列的多个拷贝。在一些情况下,酶的异源编码序列的多个拷贝源于相较于宿主细胞的两种或更多种不同的来源生物体。例如,宿主细胞可以包含一个异源编码序列的多个拷贝,其中拷贝中的每一个源于不同的来源生物体。因此,基于由异源编码序列编码的感兴趣的酶的物种间差异,每个拷贝可以包含一些显式序列变异。
在宿主细胞的一些实施例中,异源编码序列来自选自由以下组成的群组的来源生物体:大肠杆菌、凝结芽孢杆菌、干酪乳杆菌、植物乳杆菌、乳杆菌属某些种、荧光威克酵母、多管水母属某些种、圆盘海葵属某些种、智人、臭腹腺蝗、拟南芥、燕麦、番茄、马铃薯、烟草、本特哈曼烟草、颠茄、天仙子、纯天仙子、曼陀罗、白曼陀罗、毛曼陀罗、软木树、铃铛子、山莨菪、三分三、木本曼陀罗、白花木曼陀罗、红花木曼陀罗、古柯树、辣根菜、茄属某些种、烟草属某些种、颠茄属某些种、天仙子属某些中、曼陀罗属某些种、澳洲毒茄属某些种、山莨菪属某些种、木曼陀罗属某些种、古柯属某些种或辣根属某些种。在某些实例中,异源编码序列来自选自颠茄、天仙子和曼陀罗的来源生物体。在一些实施例中,宿主细胞包含来自表1中描述的来源生物体中的一种或多种的异源编码序列。
可以对经工程改造的宿主细胞培养基采样并监测感兴趣的TA的产量。可以使用任何方便的方法观察和测量感兴趣的TA。感兴趣的方法包括但不限于LC-MS方法(例如,如本文所述),其中通过与已知量的标准化合物进行比较来分析感兴趣的样品。例如,可以通过m/z和MS/MS片段化模式来确认标识,并且可以经由已知保留时间的LC痕量峰和/或EIC MS峰分析,通过参考已知量的化合物标准品的相对应的LC-MS分析来实现化合物的定量或测量。
方法
流程步骤
如上所汇总,本发明的各方面包括制备感兴趣的托品烷生物碱(TA)的方法。因此,本发明的各方面包括在所述一种或多种宿主细胞修饰(例如,如本文所述)被功能性表达的条件下培养宿主细胞,使得细胞将感兴趣的起始化合物转化为感兴趣的产物TA或其前体(例如,预酯化TA)。还提供了方法,所述方法包括在适于蛋白质产生的条件下培养宿主细胞,使得一个或多个异源编码序列被功能性表达并将感兴趣的起始化合物转化为感兴趣的产物TA。在一些实例中,所述方法是制备托品烷生物碱(TA)的方法,包括培养宿主细胞(例如,如本文所述);向细胞培养物中加入起始化合物;和从细胞培养物中回收TA。在所述方法的一些实施例中,起始化合物、TA产物和宿主细胞由表1的条目中的一个描述。
发酵培养基可以含有合适的碳底物。适于进行本公开的方法的碳源可以涵盖多种含碳底物。合适的底物可以包括但不限于单糖(例如,葡萄糖、果糖、半乳糖、木糖)、寡糖(例如,乳糖、蔗糖、棉子糖)、多糖(例如,淀粉、纤维素)或其组合。在一些情况下,可以使用来自可再生原料的未纯化混合物(例如,玉米浆、糖甜菜糖蜜、大麦芽)。在一些情况下,碳底物可以是单碳底物(例如,甲醇、二氧化碳)或双碳底物(例如,乙醇)。在其它情况下,可以使用其它含碳化合物,例如甲胺、葡糖胺和氨基酸。
培养宿主细胞的任何方便的方法都可以用于产生感兴趣的TA前体和下游TA。所采用的具体方案可以有所变化,例如取决于宿主细胞、异源编码序列、期望的感兴趣的TA前体和下游TA等。细胞可以存在于任何方便的环境中,如细胞能够表达一种或多种功能性异源酶的环境。如本文使用,体外简单地意指活细胞的外部,而不考虑细胞的位置。如本文使用,术语体内指示活细胞的内部,而不考虑细胞的位置。在一些实施例中,细胞在有助于酶表达的条件下并且使用可允许在体内产生感兴趣的TA前体和下游TA的合适底物来培养。在一些实施例中,从用于在体外条件下产生TA的宿主中提取功能性酶。在一些实例中,宿主细胞被放回多细胞宿主生物体中。宿主细胞处于任何生长阶段,包括但不限于稳定期和对数生长期等。此外,培养物本身可以是连续培养物,也可以是分批培养物。
细胞可以在适当的发酵培养基中于20-40℃的温度下生长。细胞可以以任何方便的速度(例如,200-500rpm)振荡生长。细胞可以在合适的pH下生长。用于发酵的合适pH范围可以在pH 4-9之间。发酵可以在需氧、厌氧或微需氧条件下进行。可以使用任何合适的生长培养基。合适的生长培养基可以包括但不限于常见的商业制备的培养基,如合成限定(SD)基本培养基或酵母提取物蛋白胨右旋糖(YEPD)丰富培养基。可以使用适合微生物的任何其它丰富、限定或合成生长培养基。
细胞可以在基本上任何大小和形状的容具中培养。适于进行本公开的方法的容具的实例可以包括但不限于多孔振荡板、试管、烧瓶(挡板式和非挡板式)和生物反应器。培养物的体积范围可以为10微升至大于10,000升。
可以包含向生长培养基中加入已知以生物碱产生所期望的方式调节代谢的试剂。在一个非限制性实例中,可以向生长培养基中加入环状腺苷2’3’-单磷酸盐来调节分解代谢物阻遏。
可以利用特定细胞类型的任何方便的细胞培养条件。在某些实施例中,在标准或容易优化的条件下,用标准细胞培养基和补充物培养包含一种或多种修饰的宿主细胞。作为一个实例,在不需要用于质粒维持的选择性压力时,标准生长培养基可以含有20g/L酵母提取物、10g/L蛋白胨和20g/L右旋糖(YPD)。含有质粒的宿主细胞在合成完全(SC)培养基中生长,所述培养基含有1.7g/L酵母氮碱、5g/L硫酸铵和20g/L右旋糖并补充有生长和选择所需的适当氨基酸。可以用于诱导型酶表达的替代碳源包括但不限于蔗糖、棉子糖和半乳糖。细胞在实验室中在任何方便的温度(例如,30℃)下通过在容具中(例如,在体积范围为1-1000mL或更大的试管或烧瓶中)以任何方便的速率(例如,200rpm)振荡生长。
培养体积可以放大,以在更大的发酵容具中生长,例如作为工业过程的一部分。工业发酵过程可以在封闭分批、补料分批或连续恒化条件下,或在任何合适的发酵模式下进行。在一些情况下,细胞可以作为全细胞催化剂固定在底物上并经受生物碱产生的发酵条件。
分批发酵是封闭的系统,其中培养基的组成在发酵开始时就已设定,并且在发酵过程期间不会改变。在发酵开始时,将期望生物体接种到培养基中。在一些实例中,分批发酵是通过对系统作出改变以控制如pH和氧浓度等因素(但不控制碳)来运行的。在这种类型的发酵系统中,系统的生物质和代谢物组成在发酵过程中不断变化。细胞典型地经历滞后期,然后进入对数期(高生长速率),然后进入稳定期(生长速率降低或停止),并最终进入死亡期(如果不处理的话)。
补料分批发酵类似于分批发酵,只是在发酵过程中间歇地向系统中加入底物。补料分批系统用于减少分解代谢物阻遏对宿主细胞代谢的影响,并且在生长培养基中需要具有限量的底物的其它情况下使用。
连续发酵是开放的系统,其中向生物反应器中连续地加入限定发酵培养基,并且从容具中连续地去除等量的发酵培养基以进行加工。连续发酵系统通常被操作以维持稳态生长条件,使得由于培养基被去除而导致的细胞损失必须被发酵中的生长速率所平衡。连续发酵通常在细胞处于恒定的高细胞密度的条件下操作。连续发酵允许影响目标产物浓度和/或细胞生长的一种或多种因素的调节。
液体培养基可以包括但不限于具有上述添加剂组分的丰富的或合成限定培养基。培养基组分可以溶解在水中,并通过加热、加压、过滤、辐射、化学药品或其任何组合来灭菌。多种培养基组分可以分别制备并灭菌,然后在发酵容具中混合。培养基可以被缓冲以有助于在整个发酵过程中维持恒定的pH。
包括温度、溶解氧、pH、搅拌、通气速率和细胞密度在内的过程参数可以在发酵过程中监测或控制。例如,发酵过程的温度可以通过浸入培养基中的温度探针来监测。可以通过调节夹套温度将培养温度控制在设定点。水可以在外部冷却器中冷却,然后流到生物反应器控制塔中,并以维持容具中的设定点温度所需的温度循环到夹套。
此外,可以在发酵过程中监测气流参数。例如,气体可以通过喷雾器流到培养基中。适用于本公开的方法的气体可以包括压缩空气、氧气和氮气。气流可以是固定速率或被调节以维持溶解氧设定点。
还可以监测培养基的pH。在实例中,可以通过浸入容具内部的培养基中的pH探针来监测pH。如果正在进行pH控制,则可以通过酸和碱泵调节pH,所述酸和碱泵将每种溶液以所需的速率加入到培养基中。用于控制pH的酸溶液可以是硫酸或盐酸。用于控制pH的碱溶液可以是氢氧化钠、氢氧化钾或氢氧化铵。
此外,可以通过浸入培养基中的溶解氧探针来在培养基中监测溶解氧。如果正在进行溶解氧调节,则可以通过增加或减少搅拌速度来调节氧水平。溶解氧水平也可以通过增加或减少气体流速来调节。气体可以是压缩空气、氧气或氮气。
发酵过程中还可以监测搅拌速度。在实例中,搅拌器马达可以驱动搅动机。搅拌器速度可以在整个发酵过程中设定为一致的rpm,或者可以动态调节以维持设定的溶解氧水平。
此外,可以在发酵过程中监测浊度。在实例中,可以使用浊度探针测量细胞密度。可替代地,可以通过从生物反应器中采样并在分光光度计中对其进行分析来测量细胞密度。此外,可以通过无菌采样设备以一定的时间间隔从生物反应器中取出样品。可以针对由宿主细胞产生的生物碱对样品进行分析。还可以针对其它代谢物和糖、培养基组分的损耗或细胞密度对样品进行分析。
在另一个实例中,可以在发酵过程期间监测原料参数。特别地,可以使用外部泵加入到发酵中的包含糖和其它碳源、营养物和辅因子在内的原料。在发酵期间还可以加入其它组分,包括但不限于消泡剂、盐、螯合剂、表面活性剂和有机液体。
用于优化异源多核苷酸在宿主细胞中的表达的任何方便密码子优化技术可以适用于主题宿主细胞和方法,参见例如Gustafsson,C.等人(2004)Trends Biotechnol,22,346-353,其通过引用整体并入。
主题方法还可以包括向细胞培养物中加入起始化合物。任何方便的加入方法都可以适用于主题方法。细胞培养物可以补充有足量的感兴趣的起始材料(例如,如本文所述),例如,mM至μM量,如约1-5mM的起始化合物。应理解,所加入的起始材料的量、加入的时间和速率、所加入的材料的形式等可能因各种因素而有所不同。起始材料可以纯地加入或预先溶解在合适的溶剂中(例如,细胞培养基、水或有机溶剂)。起始材料可以以浓缩形式加入(例如,超过期望浓度10倍),以使加入时细胞培养基的稀释最小化。起始材料可以一批或多批加入,或者在长时间(例如,数小时或数天)内连续加入。
用于从发酵培养基分离产物的方法
主题方法还可以包括从细胞培养物中回收感兴趣的TA。任何方便的分离和隔离方法(例如,色谱法或沉淀法)都可以适用于主题方法,以从细胞培养物中回收感兴趣的TA。可以使用过滤法将细胞培养物的可溶部分与不溶部分分离。在一些情况下,可以使用液相色谱法(例如,反相HPLC、尺寸排阻、正相色谱法)将感兴趣的TA与细胞培养物的其它可溶组分分离。在一些情况下,可以使用提取方法(例如,液体提取、基于pH的纯化等)将感兴趣的TA与细胞培养物的其它组分分离。
可以使用本领域已知的方法从发酵培养基分离所产生的生物碱。可以在发酵后立即(或在一些实例中,在发酵期间)进行多个回收步骤,以初步回收期望产物。通过这些步骤,可以将生物碱(例如,TA)与细胞、细胞碎片和废物分离,而其它营养物、糖和有机分子可以保留在用过的培养基中。本过程可以用于产生富含TA的产物。
在一个实例中,通过向分批反应器提供经工程改造的酵母细胞和包含营养物和水的原料来形成具有托品烷生物碱(TA)产物的产物流。经工程改造的酵母细胞可以具有选自由以下组成的群组的至少一种修饰:细胞天然的生物合成酶基因中的反馈抑制缓解突变;细胞天然的生物合成酶基因的转录调节修饰;和细胞天然的酶中的失活突变。当经工程改造的酵母细胞存在于分批反应器中时,经工程改造的酵母细胞可以进行发酵。特别地,可以通过将经工程改造的酵母细胞孵育至少约5分钟的时间段来对经工程改造的酵母细胞进行发酵,以产生包括TA产物和细胞材料的溶液。一旦经工程改造的酵母细胞已经经历发酵,可以使用至少一个分离单元将TA产物与细胞材料分离,以提供包括TA产物的产物流。特别地,产物流可以包含TA产物以及另外的组分,如澄清的酵母培养基。此外,TA产物可以包括一种或多种感兴趣的TA,如一种或多种TA化合物。
可以使用不同的方法从包含感兴趣的TA的生物反应器培养基中去除细胞。在实例中,随着时间的推移,细胞可以通过沉降被去除。这种沉降过程可以通过冷却或加入澄清剂(如二氧化硅)来加速。然后,可以从反应器的顶部对用过的培养基进行虹吸,或者可以从反应器的底部倾析细胞。可替代地,可以通过过滤器、膜或其它多孔材料进行过滤来去除细胞。也可以通过离心,例如通过连续流动离心或通过使用连续提取器来去除细胞。
如果在细胞内部存在一些感兴趣的有价值的TA,则可以通过上述方法中的任一种透化或裂解细胞并去除细胞碎片。用于透化细胞的试剂可以包括但不限于有机溶剂(例如,DMSO)或盐(例如,乙酸锂)。裂解细胞的方法可以包括加入表面活性剂(如十二烷基硫酸钠),或通过珠磨或超声处理进行机械破坏。
通过加入与水性培养基不混溶的有机液体,可以通过液-液提取从澄清的用过的培养基中提取感兴趣的TA。合适的有机液体的实例包括但不限于肉豆蔻酸异丙酯、乙酸乙酯、氯仿、乙酸丁酯、甲基异丁基酮、油酸甲酯、甲苯、油醇、丁酸乙酯。有机液体的加入可以为水性培养基的体积的少至10%或多至100%。
在一些情况下,有机液体可以在发酵开始时或发酵期间的任何时候加入。这种提取发酵过程可以通过连续地将TA前体或TA移至有机相来增加宿主细胞感兴趣的TA的产率。
搅动可以使有机相与水性培养基形成乳液。促进两相分离成不同层的方法可以包括但不限于加入破乳剂或成核剂,或调节pH。也可以对乳液进行离心以分离两相,例如通过连续锥形板离心。
可替代地,可以将有机相从水性培养基中分离,以便可以在提取后将其物理去除。例如,溶剂可以封装在膜中。
在实例中,可以使用吸附方法从发酵培养基中提取感兴趣的TA。特别地,可以通过加入树脂(如
也可以使用过滤从发酵培养基中提取感兴趣的TA。在高pH下,感兴趣的TA可能在生物反应器中形成晶体状沉淀物。这种沉淀物可以通过过滤器、膜或其它多孔材料进行过滤而直接去除。沉淀物也可以通过离心和/或倾析来收集。
上述提取方法可以原位(在生物反应器中)或异位(例如,在外部回路中,培养基通过所述外部回路流出生物反应器并接触提取剂,然后再循环回到容具中)进行。可替代地,提取方法可以在发酵终止后使用从生物反应器容具中取出的澄清培养基进行。
用于从富含生物碱的溶液中纯化产物的方法
随后的纯化步骤可以涉及使用本领域已知的方法处理发酵后富含TA前体或TA的产物,以将感兴趣的单个产物物种回收至高纯度。
在一个实例中,在有机相中提取的TA前体或TA可以被转移到水溶液中。在一些情况下,可以通过加热和/或真空蒸发有机溶剂,并且可以将所得粉末溶解在合适pH的水溶液中。在另一个实例中,可以通过加入促进将TA前体或TA提取到水相中的合适pH的水溶液从有机相中提取TA前体或TA。然后,可以通过倾析、离心或另一种方法去除水相。
可以例如通过用合适的螯合剂进一步处理含TA前体或TA的溶液以去除金属。可以通过沉淀进一步处理含TA前体或TA的溶液以去除其它杂质,如蛋白质和DNA。在一个实例中,用适当的沉淀剂(如乙醇、甲醇、丙酮或异丙醇)处理含TA前体或TA的溶液。在一个替代实例中,DNA和蛋白质可以通过透析或其它尺寸排阻方法去除,这些方法将较小的生物碱与污染性生物大分子分离。
在另外的实例中,可以使用本领域已知的方法通过连续错流过滤将含TA前体、TA或修饰的TA的溶液提取至高纯度。
如果溶液含有TA前体或TA的混合物,可以使用本领域已知的方法对其进行酸-碱处理,以产生单个感兴趣的TA物种。在本过程中,调节水溶液的pH,以使各种TA前体或TA以其相应的pKa沉淀。
对于高纯度、小规模的制备,TA前体或TA可以通过液相色谱在单一步骤中纯化。
酵母源性生物碱AI及植物源性AP
澄清的酵母培养基(CYCM)可能含有多种杂质。澄清的酵母培养基可以通过真空和/或加热脱水以产生富含生物碱的粉末。本产物类似于茄科植物叶浓缩物(CNL),活性药物成分(API)制造商会使用其来提取托品烷生物碱,以进行进一步的化学加工和纯化。出于本发明的目的,CNL是任何类型的纯化植物提取物的代表性实例,其中的期望生物碱产物最终可以进一步纯化。表11强调了这两种产物中的杂质,这些杂质可能是CYCM或CNL特有的,也可能在二者中皆有存在。通过分析未知来源的产物中的这些杂质的子集,本领域技术人员可以确定所述产物是否源自酵母或植物产生宿主。
API级药物成分是高度纯化的分子。因此,可以指示API源自植物或酵母的杂质(如表2和表3中所列的那些)可能不存在于所述产物的所述API阶段。事实上,源于本发明的酵母菌株的API产物中的多种可能很难与传统的植物源性API进行区分。然而,在一些情况下,常规的生物碱化合物可以使用化学合成方法进行化学修饰,这可能会在需要这种化学修饰的植物基产物中表现为化学杂质。例如,化学衍生化通常会产生一系列与化学合成过程相关的杂质。在某些情形下,这些修饰可以在酵母产生平台中以生物学方式进行,从而避免与化学衍生相关联的杂质中的一些存在于酵母源性产物中。特别地,来自化学衍生产物的这些杂质可能存在于使用化学合成过程产生的API产物中,但是可能不存在于使用酵母源性产物产生的API产物中。可替代地,如果酵母源性产物与化学衍生产物混合,则可能存在所得杂质,但含量会低于仅含或主要含化学衍生产物的API的预期含量。在本实例中,通过分析API产物中的这些杂质的子集,本领域技术人员可以确定所述产物是源自酵母产生宿主还是源自传统的化学衍生路线。
可能存在于化学衍生的托品烷生物碱API中但不存在于生物合成的API中的杂质的非限制性实例包括卤化氢,如通过化学N-烷基化(如莨菪碱和东莨菪碱的N-甲基化和N-丁基化)形成的氯化氢、碘化氢和溴化氢。
然而,在酵母源性化合物和植物源性化合物都通过化学合成方法进行化学修饰的情况下,可以预期在产物中存在相同的与化学合成过程相关联的杂质。在这种情形下,起始材料(例如,CYCM或CNL)可以如上所述进行分析。
工程改造宿主细胞的方法
还包括为了产生感兴趣的TA或其前体而工程改造宿主细胞的方法。可以使用任何方便的方法将DNA插入到宿主细胞中。所述方法用于将异源编码序列插入到宿主细胞中,使得宿主细胞功能性表达酶并将感兴趣的起始化合物转化为感兴趣的产物TA。
任何方便的启动子都可以用于主题宿主细胞和方法。驱动异源编码序列的表达的启动子可以是组成型启动子或诱导型启动子,前提是这些启动子在宿主细胞中有活性。异源编码序列可以由它们的天然启动子表达,或者可以使用非天然启动子。此类启动子在使用它们的宿主中可以是低到高强度的。启动子可以是受调节的或组成型的。在某些实施例中,使用不被葡萄糖阻遏或仅被培养基中的葡萄糖的存在轻度阻遏的启动子。感兴趣的启动子包括但不限于糖酵解基因的启动子,如枯草芽孢杆菌tsr基因的启动子(编码果糖二磷酸盐醛缩酶基因的启动子域)或来自酵母酿酒酵母基因的编码甘油醛3-磷酸盐脱氢酶的启动子(GPD、GAPDH或TDH3)、面包酵母的ADH1启动子、磷酸盐饥饿诱导的启动子,如酵母的PHO5启动子、来自地衣芽孢杆菌的碱性磷酸酶启动子、酵母诱导型启动子,如Gal1-10、Gal1、GalL、GalS、阻遏型启动子Met25、tetO、以及组成型启动子,如甘油醛3-磷酸盐脱氢酶启动子(GPD)、醇脱氢酶启动子(ADH)、翻译延伸因子-1-α启动子(TEF)、细胞色素c-氧化酶启动子(CYC1)、MRP7启动子、磷酸甘油酸盐激酶(PGK)、磷酸丙糖异构酶(TPI)等。也可以使用含有可被激素(如糖皮质激素、类固醇和甲状腺激素)诱导的启动子的自主复制酵母表达载体,并且其包括但不限于糖皮质激素反应元件(GRE)和甲状腺激素反应元件(TRE)。这些和其它实例描述于美国专利号7,045,290中,其通过引用并入(包括其中引证的参考文献)。可以使用含有组成型或诱导型启动子(如α因子、醇氧化酶和PGH)的另外的载体。此外,任何启动子/增强子组合(根据真核启动子数据库EPDB)也可用于驱动基因的表达。对于宿主细胞(例如,大肠杆菌),可以选择任何方便的适当启动子。还可以使用启动子选择来优化转录物,从而优化酶水平,以最大化产量并同时最小化能量资源。
任何方便的载体都可以用于主题宿主细胞和方法中。感兴趣的载体包括用于酵母和其它细胞的载体。酵母载体的类型可以分为4大类:整合载体(YIp)、自主复制高拷贝数载体(YEp或2μ质粒)、自主复制低拷贝数载体(YCp或着丝粒质粒)和用于克隆大片段的载体(YAC)。载体DNA经由任何方便的转化或转染技术引入到原核或真核细胞中。
实用
本发明的宿主细胞和方法(例如,如上所述)可用于多种应用。感兴趣的应用包括但不限于:研究应用和治疗应用。本发明的方法可用于各种不同的应用,包括对TA产生感兴趣的任何方便的应用。
主题宿主细胞和方法可用于多种治疗应用。感兴趣的治疗应用包括对包含TA的药物产物的制备感兴趣的那些应用。本文描述的宿主细胞产生托品烷生物碱前体(TA前体)和感兴趣的TA。托品酮和托品碱是合成TA(包含产生如药用TA产物等终产物的工程改造工作)的主要分支点中间体。主题宿主细胞可以用于由简单且廉价的起始材料产生TA前体,这些起始材料可以产生感兴趣的TA,包括托品酮、托品碱、TA终产物和这些材料中的任一种的衍生物。因此,主题宿主细胞可用于具有治疗活性的TA或其前体的供应。
在一些实例中,宿主细胞和方法可用于产生商业规模量的TA或其前体,其中这些化合物的化学合成具有较低的产率并且不是大规模产生的可行手段。在某些情况下,宿主细胞和方法在发酵设施中使用,所述发酵设施会包括例如5,000-200,000升容量的生物反应器(发酵罐),允许快速产生用于治疗产物的感兴趣的TA或其前体。此类应用可以包括由可发酵碳源(如纤维素、淀粉和游离糖)工业规模产生感兴趣的TA。
主题宿主细胞和方法可用于多种研究应用。主题宿主细胞和方法可以用于分析多种酶对多种感兴趣的TA或其前体的生物合成途径的影响。此外,宿主细胞可以被工程改造以产生TA或其前体或衍生物,这些物质可用于测试尚未证明的治疗功能中的感兴趣的生物活性。例如,在氮杂原子上添加或去除了官能团的TA(N-取代的TA),如去甲托品烷生物碱(N-去甲基化)和托品烷N-氧化物(N-氧化),具有药学意义,因为它们相对于未修饰的TA在溶解性、生物利用度和血脑屏障通透性(即神经系统毒性)方面有所不同。在一些情况下,对宿主细胞进行工程改造以使其包含编码多种酶的多个异源编码序列说明了感兴趣的TA或其前体的高产率生物合成途径。在某些情况下,研究应用包括产生前体,以用于感兴趣的治疗分子,所述治疗分子然后可以进一步化学修饰或衍生化成期望产物;或用于筛选感兴趣的增加的治疗活性。在一些实例中,宿主细胞菌株用于筛选在此类途径中的感兴趣的酶活性,这可能会经由这些菌株中产生的TA代谢物的转化而发现酶。
主题宿主细胞和方法可以用作植物特有代谢物的产生平台。主题宿主细胞和方法可以用作药物文库开发以及植物酶发现的平台。例如,通过采用产生感兴趣的支架分子(如莨菪碱和东莨菪碱)的酵母菌株并通过组合生物合成或通过化学手段进一步功能化化合物结构,主题宿主细胞和方法可用于开发基于天然产物的药物文库。通过以这种方式产生药物文库,任何潜在的药物命中已经与适合大规模培养和产生的产生宿主相关联。作为另一个实例,这些主题宿主细胞和方法可用于植物酶的发现。主题宿主细胞提供了限定代谢物的清晰背景,以表达植物表达序列标记(EST)文库,从而标识新的酶活性。主题宿主细胞和方法为酵母中的植物酶的功能性表达和增加的活性提供了表达方法和培养条件。
试剂盒和系统
本发明的各方面进一步包括试剂盒和系统,其中试剂盒和系统可以包含本发明的方法中使用的一种或多种组分,例如宿主细胞、起始化合物、异源编码序列、载体、培养基等。如本文所述。在一些实施例中,主题试剂盒包含宿主细胞(例如,如本文所述)和选自以下的一种或多种组分:起始化合物、异源编码序列和/或包含所述序列的载体、载体、生长原料、适用于表达系统的组分(例如,细胞、克隆载体、多克隆位点(MCS)、双向启动子、内部核糖体进入位点(IRES)等)和培养基。
本文描述的组分中的任一种可以在试剂盒中提供,例如,包含一种或多种修饰的宿主细胞、起始化合物、培养基等。适用于制造和使用异源编码序列、克隆载体和表达系统的多种组分可用于主题试剂盒中。试剂盒可能还包括管、缓冲液等以及使用说明。试剂盒的各种试剂组分可以存在于单独的容器中,或者根据需要,它们中的一些或全部可以在单一容器中预组合成试剂混合物。
还提供了用于产生感兴趣的TA的系统,其中所述系统可以包括包含一种或多种修饰(例如,如本文所述)的经工程改造的宿主细胞、起始化合物、培养基、发酵罐和发酵装备,例如适于维持宿主细胞生长条件的设备、采样和监测装备和组件等。适用于酵母细胞的大规模发酵的多种组件可用于主题系统。
在一些情况下,所述系统包括用于经工程改造的宿主细胞的大规模发酵以及由发酵的宿主细胞产生的TA化合物的监测和纯化的组件。在某些实施例中,在发酵罐中的经工程改造的宿主细胞产生一种或多种期望的TA产物或其前体的条件下,将一种或多种起始化合物(例如,如本文所述)加入到系统中。在一些实例中,宿主细胞产生感兴趣的TA(例如,如本文所述)。在某些情况下,感兴趣的TA产物是药用TA产物,如莨菪碱、N-甲基莨菪碱、山莨菪碱、东莨菪碱、N-甲基东莨菪碱和N-丁基东莨菪碱。
在一些情况下,所述系统包括用于监测和/或分析由主题宿主细胞产生的一种或多种TA化合物或其前体的手段。例如,如本文所述的LC-MS分析系统、色谱系统或任何方便的系统,其中样品可以被分析并与例如本文所述的标准品进行比较。可以在发酵前和发酵期间的任何方便的时间通过采样和分析来监测发酵培养基。当起始化合物向感兴趣的TA产物或前体的转化完成时,可以停止发酵,并且可以进行TA产物的纯化。因此,在一些情况下,主题系统包括适于从产生TA产物或前体的宿主细胞培养基中纯化TA产物或前体的纯化组件。纯化组件可以包括可以用于纯化发酵的TA产物或前体的任何方便的手段,包括但不限于硅胶色谱、反相色谱、离子交换色谱、HIC色谱、尺寸排阻色谱、液体提取和pH提取方法。在一些情况下,主题系统提供了将一种或多种起始化合物输入系统后的感兴趣的TA发酵产物的产生和分离。
提出了以下实例是为了向本领域普通技术人员提供如何制造和使用本发明的完整公开和描述,并且不旨在限制被发明人视为其发明的内容的范围,也不旨在表示以下实验是所进行的全部或仅有实验。已努力确保所用数字的准确性(如量、温度等),但是应考虑到一些实验误差和偏差。除非另有指示,否则份是重量份,分子量是重均分子量,温度是摄氏度,并且压力是大气压或接近大气压。
示例性方法
以下部分提供了可以用于构建、培养和测试用于产生TA前体和TA的微生物菌株(如酵母菌株)以及进行此类菌株的发酵以产生TA前体和TA的方法和程序的实例。还包括可以用于生成修饰微生物宿主所需的DNA序列以及将期望DNA序列引入到微生物宿主中的方法、程序和材料的实例。
化学化合物和标准品。用于证实经工程改造的宿主细胞产生的代谢物的标识并对其进行定量的TA前体和TA的化学标准品可从商业供应商购买。例如,腐胺二盐酸盐、N-甲基腐胺、古豆碱、托品酮、托品碱、(S)-莨菪碱氢溴酸盐、山莨菪碱和(S)-东莨菪碱氢溴酸盐可以从Santa Cruz Biotechnology(得克萨斯州达拉斯(Dallas,TX))购买。4-(甲氨基)丁酸盐酸盐可以从Sigma(密苏里州圣路易斯(St.Louis,MO))购买。γ-甲基氨基丁醛(4MAB)二乙基乙缩醛和(R)-利托林盐酸盐可以从Toronto Research Chemicals(安大略省多伦多(Toronto,ON))购买。NMPy的化学标准品可以如下合成:用五体积的2M HCl在60℃下脱保护一体积的二乙基乙缩醛30分钟,如前所述(参见Feth,F.、Wray,V.和Wagner,K.G.Determination of methylputrescine oxidase by high performance liquidchromatography.Phytochemistry 24,1653–1655(1985)),在室温下孵育过夜,然后用三体积的二乙醚洗涤所得浓缩物两次以去除残留的有机杂质。去甲莨菪碱(去甲阿托品)、去甲东莨菪碱和莨菪碱N-氧化物盐酸盐可以从Sigma购买。东莨菪碱N-氧化物氢溴酸盐一水合物可以从Selleck Chem购买。
质粒构建。用于通过聚合酶链式反应(PCR)生成新的DNA序列和用于DNA测序的寡核苷酸可以从DNA合成公司(如IDT DNA、Twist Bioscience或斯坦福蛋白质和核酸研究所(加利福尼亚州斯坦福(Stanford,CA)))获得。天然酵母基因可以经由菌落PCR从酿酒酵母基因组DNA扩增(参见Kwiatkowski,T.J.、Zoghbi,H.Y.、Ledbetter,S.A.、Ellison,K.A.和Chinault,A.C.Rapid identification of yeast artificial chromosome clones bymatrix pooling and crude iysate PCR.Nucleic Acids Res.18,7191(1990))。可以使用合适的密码子优化软件(如GeneArt GeneOptimizer软件(Thermo Fisher Scientific)),对异源酶的基因序列进行密码子优化,以提高酿酒酵母中的表达。然后,异源基因序列可以由商业DNA合成公司合成为线性双链DNA片段。两种类型的质粒可以用于酵母中的基因表达:用于测试感兴趣的生物合成基因的直接表达(DE)质粒和为所选启动子-基因-终止子盒的基因组整合提供模板的酵母整合(YI)保持质粒。
DE质粒包括感兴趣的基因,其侧翼为组成型启动子和终止子、低拷贝CEN6/ARS4酵母复制起点和营养缺陷型选择标志物。DE质粒可以通过PCR扩增感兴趣的基因以使用引物突出端附加5’和3’限制性位点,用适当的限制性酶对(例如,SpeI、BamHI、EcoRI、PstI或XhoI)消化PCR产物或合成的基因片段,然后使用T4 DNA连接酶将基因片段连接到具有合适的酵母启动子、终止子和复制序列(如质粒pAG414GPD-ccdB、pAG415GPD-ccdB或pAG416GPD-ccdB(参见Alberti,S.、Gitler,A.D.和Lindquist,S.A suite of Gateway cloningvectors for high-throughput genetic analysis in Saccharomycescerevisiae.Yeast 24,913–9(2007))的类似消化的载体中来构建。
YI质粒包括感兴趣的基因,其侧翼为组成型启动子和终止子,但缺乏酵母复制起点或营养缺陷型选择标志物。YI质粒可以通过使用用被设计成分别在启动子和终止子的3’和5’端结合的引物进行的“绕角(around-the-horn)”PCR,用合适的启动子和终止子线性化空保持载体来构建。也可以对感兴趣的基因进行PCR扩增,以将具有35-40bp同源性的5’和3’突出端附加到线性化的载体主链的末端。然后,可以使用吉布森组装将基因组装到YI载体中。表达生物合成酶的GFP融合体的DE质粒可以如下制备:首先使用吉布森组装来组装分别编码GFP、靶酶和YI载体主链的PCR扩增的DNA片段,随后使用所述的限制性酶和连接克隆将融合构建体从YI质粒亚克隆到DE载体中。
可以使用可从商业供应商获得的任何高保真重组DNA聚合酶进行PCR扩增,并且可以使用合适的DNA柱纯化试剂盒纯化线性DNA。可以在Luria-Bertani(LB)肉汤中或含羧苄青霉素(100μg/mL)、卡那霉素(50μg/mL)或另一种抗生素选择的LB琼脂平板上使用热休克转化和选择,在任何化学感受态的大肠杆菌菌株中繁殖组装的质粒。可以根据制造商的方案,使用质粒纯化柱,通过碱性裂解从在选择性LB培养基中于37℃和250rpm下生长的过夜大肠杆菌培养物中分离质粒DNA。质粒序列应通过桑格测序进行证实。
酵母菌株构建。任何合适的实验室酵母菌株都可以用作宿主生物体。实验部分的实例中描述的酵母菌株源于亲本菌株CEN.PK2-1D(参见Entian,K.D.和
可以使用CRISPRm方法进行酵母基因组修饰(参见Ryan,O.W.等人Selection ofchromosomal DNA libraries using a multiplex CRISPR system.Elife 3,1–15(2014))。CRISPRm质粒表达化脓性链球菌Cas9和靶向酵母基因组中的感兴趣的基因座的单向导RNA(sgRNA),并且可以通过编码SpCas9的DNA片段、tRNA启动子和HDV核酶、20-nt向导RNA序列以及tracrRNA和终止子的组装PCR和吉布森组装来构建。对于基因插入,可以使用PCR扩增构建包括一个或多个感兴趣的基因(侧翼为独特的启动子和终止子)的整合片段,并通过吉布森组装将其克隆到保持载体中。使用合适的高保真DNA聚合酶对整合片段进行PCR扩增,在整合位点处将40bp微同源区侧接于相邻片段和/或酵母基因组。对于基因破坏,整合片段在所有三个阅读框中包括6-8个终止密码子,侧翼与破坏位点具有40bp的微同源性,其被定位在开放阅读框的前半部分内。对于完全基因缺失,整合片段包括营养缺陷型标志物基因,其侧翼与缺失位点具有40bp的微同源性。将每个整合片段与靶向期望基因组位点的CRISPRm质粒共转化。阳性整合体可以通过酵母菌落PCR、桑格测序和/或通过液相色谱法和串联质谱法(LC-MS/MS)进行的功能性筛选来标识。
酵母转化。可以使用任何合适的方法转化酵母菌株,包含热休克、电穿孔和化学转化。例如,使用冷冻-EZ酵母转化II试剂盒(Zymo Research)对实验部分的实例中描述的酵母菌株进行化学转化。将各酵母菌落接种到YP(A)D或YNB-SC培养基中,并在30℃和250-460rpm下生长过夜。将饱和培养物在新鲜培养基中以1:10至1:50回稀释,并再生长5-7小时以达到指数期。通过以500×g离心4分钟沉淀培养物,然后通过将沉淀重悬于50mM Tris-HCl缓冲液(pH 8.5)中洗涤两次。每次转化时,将洗涤的沉淀重悬于20μL的EZ2溶液中,然后与100-600ng的总DNA和200μL的EZ3溶液混合。将酵母悬浮液在30℃下温和旋转孵育一小时。对于质粒转化,将转化的酵母直接平铺到YNB(A)-DO琼脂平板上。对于Cas9介导的染色体修饰,将酵母悬浮液改为与1mL YP(A)D或YNB-SC培养基混合,通过以500×g离心4分钟沉淀,然后重悬于250μL的新鲜YP(A)D或YNB-SC培养基中。然后,将悬浮液再在30℃下温和旋转孵育两小时以产生G418抗性蛋白,然后铺到含有400mg/LG418(遗传霉素)硫酸盐的YP(A)D或YNB-SC平板上。然后,将平板在30℃下孵育48-96小时以允许菌落形成。
点稀释测定。将菌株接种到YNB(A)-DO培养基中,并在30℃和250rpm下生长过夜。通过以500×g离心4分钟沉淀饱和的过夜培养物,并重悬于pH为8.0的无菌Tris-HCl缓冲液中至基于OD
用于代谢物测定的生长条件。小规模代谢物产生测试可以在YNB(A)-SC或YNB(A)-DO培养基中进行。可以在补充有2%右旋糖和5%甘油(YNB-G)的YNB-SC或YNB-DO培养基中进行代谢物产量测定,以在至少三个重复中获得最佳TA产量(参见P.Srinivasan、C.D.Smolke,Biosynthesis of medicinal tropane alkaloids in yeast.Nature 585,614–619(2020))。由于更高的起始细胞密度显著增强了TA生物合成(参见前面的参考文献),最初可以将多个酵母菌落一式三份接种到1.5ml选择性或非选择性YNB-G中,并在30℃和460rpm下生长至饱和(约20–24小时),通过以500g离心4分钟并以3,000g离心1分钟沉淀,重悬于1ml新鲜的选择性或非选择性YNB-G培养基(补充有15mg来自硫酸亚铁(II)的l
代谢物产量的分析。可以使用液相色谱法和串联质谱法(LC-MS/MS)来分析代谢物谱和滴度。为了从培养基中分离细胞进行分析,可以通过在12℃下以3,500×g离心5分钟来沉淀发酵培养物,然后可以取出100-200μL等份上清液进行直接分析。代谢物产量可以通过LC-MS/MS使用与三重四极杆质谱仪配对的任何合适的HPLC装置(如Agilent 1260Infinity二元HPLC和Agilent 6420三重四极杆质谱仪)进行分析。可以使用C18反相柱(如ZorbaxEclipsePlus C18柱(2.1x 50mm,1.8μm;Agilent Technologies)),以0.1%v/v甲酸的水溶液作为流动相溶剂A并以0.1%v/v甲酸的乙腈溶液作为溶剂B进行色谱分析。柱在40℃下以0.4mL/分钟的恒定流速操作,进样体积为5μL。可以使用任何合适的反相梯度进行化合物分离;一种此类示例性梯度如下:0.00-0.75分钟,1%B;0.75-1.33分钟,1-25%B;1.33-2.70分钟,25-40%B;2.70-3.70分钟,40-60%B;3.70-3.71分钟,60-95%B;3.71-4.33分钟,95%B;4.33-4.34分钟,95-1%B;4.34-5.00分钟,用1%B平衡。在以电喷雾电离(ESI)处于正模式、源气体温度为350℃、气体流速为11L/分钟并且雾化器压力为40psi进行操作的0.01-5分钟内将LC洗脱液导入MS。代谢物可以通过基于多反应监测(MRM)参数和标准曲线的积分峰面积来定量。
荧光显微术。将用编码融合到荧光蛋白报道基因的生物合成酶的质粒转化的各酵母菌株菌落接种到1mL YNB-SC或YNB-DO培养基中,并在30℃和250-460rpm下生长过夜(约14-18小时)。通过以500×g离心4分钟沉淀过夜培养物,并重悬于含2%w/v右旋糖的2mLYNB-DO培养基中,然后在30℃和250rpm下再生长4-6小时以达到指数期并使表达的荧光蛋白完全折叠。为了成像,将大约5-10μl的细胞悬浮液点到玻璃显微镜载玻片上,并用盖玻片(Thermo Fisher)覆盖,然后使用合适的立式落射荧光显微镜(如Zeiss AxioImager落射荧光/宽视野显微镜,具有×64油浸物镜)成像。使用任何合适的照明源(如EXFO X-Cite 120照明源)和合适的滤光片设置(示出的是Semrock Brightline滤光片的示例性设置:GFP,472/30激发和520/35发射;mCherry/DsRed/Cy3/TexasRed,562/40激发和624/40发射)。发射光用单色相机和适当的控制软件(如Zeiss Axiocam 503单色相机和Zen Pro软件)捕获,并且随后的图像分析可以使用任何适当的图像分析套装(包括ImageJ/Fiji(NIH))进行。图像分析方案的一个实例提供如下。使用“合并通道”和“分割通道”功能将图像转换为伪彩色。对于每个样品,如果被用于提高对比度,则必须对给定通道的所有图像应用线性直方图拉伸。为了在对亚细胞细胞器成像时减少来自其它焦平面的光的干扰,可以应用2D数字去卷积分析。首先,必须计算理论点扩散函数(PSF),所述点扩散函数在特定成像设置中以数学方式描述了来自点光源的光的衍射,例如使用ImageJ中的“衍射PSF 3D”插件,针对绿色和红色通道使用以下示例性参数:介质的折射率,1.518(透镜油);数值孔径,1.40;波长(nm),520(绿色)或624(红色);最大孔径处的纵向球面像差(nm),0.00(默认);图像像素间距(nm),72;片层间距(nm),0;宽度(像素),240;高度(像素),242;深度(片层),1;归一化,像素值之和=1。接下来,使用ImageJ的“并行光谱去卷积2D”插件,使用默认设置和自动正则化,针对相对应的PSF分别对绿色和红色通道图像进行去卷积。
酵母毒性测定和生长曲线。用于非植物细胞中以增强或调节代谢物定位为目的的候选转运蛋白可以在感兴趣的非植物生物体的任何合适的菌株中表征。然而,转运蛋白活性在异型生物质(外源)化合物分泌不足的菌株中得到最好的表征,因为异源转运蛋白的作用可以更容易区分。用于表征酵母中的TA转运蛋白的示例性方案提供如下。在AD12345678(AD1-8)酵母菌株中表征推定TA转运蛋白候选物,所述酵母菌株中的与多药和异型生物质抗性有关的主要ATP结合盒转运蛋白(ABC)中的七种及其主要转录调节因子PDR3已被破坏(参见A.Decottignies等人,ATPase and multidrug transport activities of theoverexpressed yeast ABC protein Yor1p.J.Biol.Chem.273,12612–12622(1998);也参见M.Morita等人,Vacuolar transport of nicotine is mediated by a multidrug andtoxic compound extrusion(MATE)transporter in Nicotiana tabacum.Proc.Natl.Acad.Sci.U.S.A.106,2447–2452(2009))。如前所述,用携带作为阴性对照的组成型表达的转运蛋白候选物或蓝色荧光蛋白的低拷贝质粒和合适的营养缺陷型标志物(如URA3、LEU2、TRP1或HIS2)转化菌株AD1-8。将转化体接种到1mL的选择性YNB-G培养基中,并在30℃和460rpm下生长过夜(约14–18小时)。然后,将过夜培养物一式三份稀释至OD
从转录组数据库标识新型的基因变体。可以使用转录组和基因组数据库的基于序列比对的搜索来标识新型的基因及其变体。例如,在1000株植物项目数据库中使用对白曼陀罗和颠茄的转录组的tBLASTn搜索来标识烟草N-甲基腐胺氧化酶(NtMPO1)的直向同源物(参见Matasci,N.等人Data access for the 1,000Plants(1KP)project.Gigascience 3,17(2014))。然后,使用这些搜索策略标识的推定基因的编码序列可以针对酵母表达进行优化,然后克隆到如前所述的表达载体中。
经由线性回归和聚类进行转录物共表达分析。本领域技术人员熟悉的线性回归分析和层次聚类策略可以用于从以某种方式(组织、激发子、刺激、生长条件等)描述的植物转录组(RNA测序)数据集中标识新型的基因候选物。这种用于标识TA转运蛋白候选物的方案的一个实例描述如下。从颠茄转录组中标识的43,861种特有转录物中的每一种的组织特异性丰度(每百万作图读长的每千碱基重叠群的片段数,FPKM)和推定蛋白质结构和功能注释可以从MSU药用植物基因组资源或任何合适的转录组学信息储存库获得。过滤转录物,以选出用以下转运蛋白家族(PFAM)ID中的任一个注释的转录物:PF00854、PF16974、PF01554、PF00664、PF00005;或用以下功能注释关键词中的任一个注释的转录物:外排、转运蛋白、ABC。此外,可以在过滤器中包含具有关键词为腐胺或托品酮的功能注释或具有基因座ID4635(对应于莨菪碱脱氢酶)的任何转录物作为阳性对照TA相关基因,以验证与诱饵基因的聚类。接下来,针对作为诱饵基因的CYP80F1和H6H生成平均组织特异性表达谱。对于两个基因中的每一个,构建线性回归模型以将诱饵基因表达谱表达为每个候选基因谱的线性函数,并且为每个候选物提取相关性P值(零假设:斜率=0;斜率系数估计值的学生t检验)。将使用两个诱饵基因中的每一个标识的候选物合并,并且应去除重复。每个候选物的组合P值被计算为与两个诱饵基因中的每一个的相关性的log10(P值)之和。将候选物按组合P值进行排序;然后,P<0.01的那些可以经由组织特异性表达谱的层次聚类根据与诱饵基因的距离进一步排列。
TA转运蛋白候选物的系统发生分析。可以使用本领域技术人员熟悉的普通系统发生分析(如系统发生树的构建)进一步评估使用前述计算方法标识的基因候选物;对三种推定TA转运蛋白候选物(AbPUP1、AbCT1和AbLP1)的这种分析的实例提供如下。系统发生树的构建基于使用AbPUP1、AbCT1和AbLP1作为查询项对UniProt/SwissProt数据库(仅注释序列)的BLASTp搜索。被选择用于树构建的序列可以包含任何经实验表征的植物生物碱转运蛋白和任何其它所选的经表征的小分子转运蛋白。在ClustalX2中,经由n=1,000(或足以收敛的任何合适的数)次迭代的自展邻接推导出系统发生关系。
酶结构分析。通过检查使用任何合适的同源建模或从头结构预测软件(如RaptorX、C-I-TASSER、Rosetta)构建的同源模型,可以分析异源酶以找出可被证明在酵母中的表达期间存在问题的结构特征,如大的非结构化区域。感兴趣的蛋白质或酶中的跨膜结构域的预测可以使用TMHMM v.2.0网络服务器进行(参见A.Krogh等人,Predictingtransmembrane protein topology with a hidden Markov model:Application tocomplete genomes.J.Mol.Biol.305,567–580(2001)),并且应对照使用EMBOSS Pepwindow网络服务器生成的亲水性图进行确证(参见F.Madeira等人,The EMBL-EBI search andsequence analysis tools APIs in 2019.Nucleic Acids Res.47,W636–W641(2019))。可以使用任何三维分子查看软件(如PyMOL(Schrodinger)或UCSF Chimera)将所得蛋白质模型可视化。可以使用任何合适的配体对接模拟软件(如AutoDock、SwissDock、GOLD或Glide)分析酶对特定底物的亲和力。
使用植物组织证实全长TA转运蛋白cDNA序列。可以通过与真实植物组织样品进行比较来证实编码源于植物的感兴趣的蛋白质、转运蛋白或酶的序列。作为一个示例性方案,可以使用真实的颠茄组织样品来证实AbPUP1和AbLP1的全长cDNA序列。颠茄植物可以从任何合适的苗圃或供应商购买,并且在16:8(或类似的)光照:避光循环下在适当的盆栽土壤中养护。用干净的剃刀片切下次生根,在蒸馏水下彻底洗涤,并根据制造商的说明,使用任何合适的试剂盒(如RNeasy植物迷你试剂盒(Qiagen))提取总RNA。然后,按照制造商的说明,使用逆转录酶试剂盒(如SuperScript III逆转录酶)和oligo-dT12-18引物将1μg的提取总RNA中的polyA部分转化为cDNA。AbPUP1和AbLP1的开放阅读框从根cDNA PCR扩增,并使用合适的DNA引物进行桑格测序。
通过蛋白质印迹分析酵母中的蛋白质表达。为了对酵母表达的蛋白质进行免疫印迹分析,用携带感兴趣的表位标记的蛋白质的表达载体转化合适的菌株。在转化后三天,将转化的菌落接种到2mL YNB-DO培养基中,并在30℃和460rpm下生长过夜(约16-20小时)至稳定期。通过以3,000×g离心5分钟沉淀细胞,重悬于200μL H
实验
一系列特定遗传修饰提供了酿酒酵母中的由简单、廉价的原料或前体分子产生TA的生物合成过程。描述了用于构建能够由非TA前体或简单原料产生早期TA分子腐胺、N-甲基腐胺、4-甲基氨基丁醛、N-甲基吡咯啉鎓(NMPy)、托品酮、托品碱、苯基乳酸(PLA)和1-O-β-苯基乳酰葡萄糖(PLA葡糖苷)的新型菌株的方法。NMPy是所有已知TA分子的天然前体。还描述了操纵酵母生物合成途径的调节和优化氨基酸衍生的TA前体的产生的方法。描述了用于构建能够由简单原料产生非药用TA(如假托品碱生物碱和打碗花精)的新型菌株的方法。此外,描述了用于构建能够由非TA前体或简单原料产生药用TA(如莨菪碱、山莨菪碱和东莨菪碱)的新型菌株的方法。此外,描述了用于构建能够由非TA前体或简单原料产生非天然TA(如肉桂酰托品碱)的新型菌株的方法。
实例1.将平台酵母菌株工程改造成用于高水平产生腐胺
TA的托品碱部分经由多胺分子腐胺由氨基酸精氨酸衍生而来。为了增加包含腐胺、NMP、4MAB和NMPy在内的TA前体分子的细胞内浓度,酿酒酵母菌株被开发成具有提高的精氨酸和多胺生物合成途径通量。一般是为了增加从中心代谢至精氨酸和多胺生物合成的碳和氮通量,这些菌株组合了遗传修饰,并且包括引入关键的异源酶以额外产生TA前体腐胺。采用了遗传修饰,包括引入编码天然生物合成酶和调节蛋白的基因的反馈抑制缓解突变、协调天然生物合成酶的转录调节、缺失或破坏编码使前体分子偏离预期途径的酶的基因、以及引入用于将内源分子转化为TA前体分子的异源酶。
1.1)经工程改造的菌株中的生物合成途径并入了参与精氨酸代谢和多胺生物合成的天然酵母基因的过表达(图4)。
1.1.1)酵母中过表达的天然基因的实例包括但不限于:谷氨酸盐N-乙酰基转移酶(Arg2p),其催化由谷氨酸盐生物合成精氨酸的第一步;精氨酸酶(Car1p),其去除精氨酸的胍基以在线粒体基质中产生鸟氨酸;线粒体膜转运蛋白(Ort1p),其将鸟氨酸从线粒体基质输出到胞质溶胶;鸟氨酸脱羧酶(Spe1p),其将胞质鸟氨酸脱羧为腐胺;和多胺氧化酶(Fms1p),其将精胺和亚精胺脱烷基为腐胺。
1.1.2)通过将酵母菌株与三种低拷贝质粒的不同组合共转化来检查这些天然酶的过表达对腐胺产量的影响,每种低拷贝质粒表达以下之一:SPE1、ORT1、CAR1、ARG2、FMS1或作为阴性对照的蓝色荧光蛋白(BFP)。在选择性培养基中生长48小时后的共转化细胞的细胞外培养基中积累的腐胺的滴度通过LC-MS/MS定量(图5)。仅SPE1的过表达导致腐胺滴度增加到13.4倍,达到23mg/L。尽管CAR1或ARG2与SPE1的共过表达导致腐胺产量相对于仅SPE1增加27%和12%,但与SPE1相比,ORT1与SPE1的过表达导致腐胺滴度降低35%。SPE1、CAR1、ARG2和FMS1中的任三种的过表达共同将细胞外腐胺滴度增加到34-35mg/L。
1.2)经工程改造的菌株中的生物合成途径并入了来自除酵母之外的生物体中发现的多胺产生途径的异源酶的表达以进一步增加腐胺产量(图4)。
1.2.1)除了在大多数植物、动物和真菌中发现的鸟氨酸依赖性途径(即腐胺经由精氨酸脱胍基化及随后的鸟氨酸脱羧的合成途径)之外,许多细菌和植物还表达一个替代路线,通过所述路线,精氨酸首先被精氨酸脱羧酶(ADC)脱羧以产生胍丁胺。在植物中,胍丁胺的胍基随后被亚氨基水解酶(AIH)转化为尿素以产生N-氨甲酰基腐胺(NCP),然后由酰胺酶(CPA)从其中去除酰胺基以产生腐胺(参见Patel,J.等人Dual functioning of plantarginases provides a third route for putrescine synthesis.Plant Sci.262,62–73(2017))。一些细菌已经进化出胍丁胺脲水解酶(AUH),所述酶能够直接从胍丁胺中去除胍基以产生腐胺,而不需要N-氨甲酰基化的中间体(参见Klein,R.D.等人.Reconstitutionof a bacterial/plant polyamine biosynthesis pathway in Saccharomycescerevisiae.Microbiology 145(第2部分,301–7(1999))。
1.2.2)为了在酵母中重建异源腐胺生物合成途径,可以使用以下酶:ADC、AIH、CPA和AUH。作为具有这些酶活性的经工程改造的菌株的一个实例,在酿酒酵母中具有先前被证明的活性的来自燕麦的ADC(燕麦;AsADC)(参见Klein,R.D.等人.Reconstitution of abacterial/plant polyamine biosynthesis pathway in Saccharomycescerevisiae.Microbiology 145(第2部分,301–7(1999))、来自拟南芥的AIH(AtAIH)、来自番茄(番茄;SlCPA)和拟南芥(AtCPA)的两种CPA直向同源物、以及来自大肠杆菌(speB)和拟南芥(AtARGAH2)的两种AUH被选择用于在酵母中表达。
1.2.3)为了确定酵母中每种异源酶的功能,通过将野生型酵母菌株与表达AsADC、AtAIH和SlCPA或AtCPA;或AsADC和speB或AtARGAH2的低拷贝质粒共转化,逐步重建三步(精氨酸→胍丁胺→NCP→腐胺)或两步(精氨酸→胍丁胺→腐胺)腐胺途径。为了消除由不同水平的营养缺陷引起的对细胞生长和代谢物产量的影响,所有的转化都用携带不同营养缺陷标志物的三种低拷贝质粒进行,用BFP作为阴性对照代替空白或缺失质粒。在选择性培养基中生长48小时后的转化细胞的细胞外培养基中的胍丁胺、NCP和腐胺的相对积累通过LC-MS/MS分析,这表明除了SlCPA和AtARGAH2之外的所有酶在酵母中保留了活性(图6、7)。包括AsADC、AtAIH和AtCPA的植物特异性途径的重建使得腐胺产量达到23mg/L的滴度,相对于野生型滴度提高到22倍。当与AsADC和AtAIH组合时,来自番茄的直向同源CPA(SlCPA)使得腐胺产量达到4.5mg/L的滴度,类似于表达AsADC和AtAIH的细胞中的腐胺水平。经由AsADC和大肠杆菌脲水解酶(speB)重建细菌快捷途径使得腐胺产量达到34mg/L的滴度,是野生型的32倍。
1.3)经工程改造的菌株中的生物合成途径并入了参与精氨酸和多胺生物合成的天然酵母基因的过表达和来自除酵母之外的生物体中发现的多胺产生途径的异源生物合成酶的表达以进一步增加腐胺产量。
1.3.1)通过将野生型酵母菌株与编码SPE1、AsADC和speB的低拷贝质粒和编码ARG2和CAR1的低拷贝质粒共转化,将用于腐胺生物合成的过表达的天然基因中表现最佳的三个(SPE1、ARG2、CAR1;1.1.2)与表现最佳的异源腐胺途径(AsADC、speB;1.2.3)组合。在48小时之后,通过LC-MS/MS分析测量转化细胞的培养基中的腐胺滴度。所得菌株以47mg/L的滴度产生腐胺(图10)。
1.4)酵母中的多胺生物合成受多种机制调节(图8)。经工程改造的菌株中的生物合成途径并入了这些调节机制中的一种或多种的破坏以减少腐胺产生的反馈抑制。
1.4.1)参与多胺生物合成调节并因此可以被破坏以提高细胞内腐胺积累的天然酵母基因包括但不限于以下实例(图8)。甲硫腺苷磷酸化酶(Meu1p)催化脱羧S-腺苷基甲硫氨酸(dcSAM)再循环途径中的驱动步骤,所述脱羧S-腺苷基甲硫氨酸构成烷基供体以用于由亚精胺合酶(Spe3p)和精胺合酶(Spe4p)催化的腐胺向亚精胺和精胺的转化(参见Chattopadhyay,M.K.、Tabor,C.W.和Tabor,H.Methylthioadenosine and polyaminebiosynthesis in a Saccharomyces cerevisiae meu1Δmutant.Biochem.Biophys.Res.Commun.343,203–207(2006))。已知甲硫腺苷抑制亚精胺合酶的活性(参见Chattopadhyay,M.K.、Tabor,C.W.和Tabor,H.Studies on the regulation of ornithine decarboxylasein yeast:Effect of deletion in the MEU1 gene.Proc.Natl.Acad.Sci.102,16158–16163(2005))。多胺生物合成通过真菌和后生动物中保守的抗酶介导的负反馈回路来调节(参见Pegg,A.E.Regulation of ornithine decarboxylase.Journal of BiologicalChemistry 281,14529–14532(2006))。在酵母中,OAZ1基因包括由单个核苷酸分开的两个外显子,它们共同编码抗酶-1(一种鸟氨酸脱羧酶(Spe1p)的竞争性抑制剂)。多胺诱导的核糖体移码机制使得全长抗酶只能在高多胺水平下翻译,从而对它们的生物合成施加反馈抑制。最后,多胺从细胞外环境的摄取由涉及Agp2p(一种对肉毒碱、亚精胺和精胺具有亲和力的质膜通透酶)和Sky1p(一种被认为与Agp2p相互作用的蛋白激酶)的信号转导通路介导。
1.4.2)通过在野生型酵母中的每个开放阅读框的前三分之一内插入一系列串联无义突变来构建MEU1、OAZ1、SPE4、SKY1和AGP2中的每一个的酵母单基因破坏菌株。为了在天然和异源腐胺产生途径的背景下表征每种调节破坏的影响,由单基因破坏菌株中的每一种中的低拷贝质粒过表达酵母ODC(SPE1)或共表达AsADC和speB。在生长72小时之后,经由LC-MS/MS测量细胞外培养基中的腐胺滴度(图9)。当经由SPE1的天然腐胺产生途径被过表达时,MEU1的破坏将腐胺滴度提高了68%。类似地,当与SPE1的过表达组合时,OAZ1的破坏显著提高了腐胺产量(提高174%)。OAZ1的破坏导致天然或异源的腐胺途径都没有过表达的未转化细胞中的腐胺滴度增加到21倍。当与SPE1过表达时,SKY1和AGP2的破坏导致腐胺滴度分别增加29%和14%。当与AsADC和speB的异源表达组合时,SKY1的破坏导致腐胺滴度降低41%。
1.5)经工程改造的菌株中的生物合成途径将MEU1和OAZ1调节基因敲除与天然和异源腐胺生物合成基因的过表达组合,以便进一步增加经工程改造的菌株中的腐胺产量。将天然精氨酸和多胺生物合成基因ARG2、CAR1和FMS1的额外拷贝整合到meu1/oaz1双破坏菌株的基因组中。本菌株用表达SPE1、AsADC和speB的低拷贝质粒转化。本转化菌株的细胞外培养基的LC-MS/MS分析表明,在选择性培养基中生长48小时之后,腐胺滴度达到86mg/L(图10)。
实例2.将酵母菌株工程改造成用于产生NMPy
通过修饰实例1中开发的用于产生TA前体NMPy的腐胺过量产生菌株来开发酿酒酵母菌株。为了增加从腐胺至NMPy生物合成的碳和氮通量,这些菌株组合了遗传修饰,并且包括引入关键的异源酶以产生TA前体NMP、4MAB和NMPy。采用了遗传修饰,包括修饰感兴趣的酶的N端和/或C端结构域以提高在异源宿主中的活性,以及缺失或破坏编码使前体分子潜水员预期途径的酶的基因。
2.1)经工程改造的菌株中的生物合成途径能够由内源腐胺产生NMPy。腐胺首先通过SAM依赖性N-甲基转移酶(PMT)转化为N-甲基腐胺(NMP),随后通过铜依赖性二胺氧化酶(MPO)氧化为4-甲基氨基丁醛(4MAB)。4MAB像许多醛类化合物一样,在水溶液中不稳定,并且经由碱催化的亲核攻击自发环化以形成NMPy(图11)。
2.1.1)将携带表达用于过量产生腐胺的SPE1、AsADC和speB的低拷贝质粒的实例1.5的腐胺过量产生菌株先后与表达来自颠茄的PMT(AbPMT1)和随后来自烟草的MPO酶(NtMPO1)的额外低拷贝质粒共转化。在生长48小时之后,经由LC-MS/MS分析比较表达腐胺和NMPy之间的每种连续酶的转化细胞的细胞外培养基中的中间体的积累。随着AbPMT1和NtMPO1(图11)以及它们的前体NMP和腐胺(图12)的表达,产生了NtMPO1的直接产物(4MAB)及其自发环化产物(NMPy)。
2.1.2)通过LC-MS/MS分析,在破坏和不破坏MEU1基因(如实例1.4.2所述)的情况下,在腐胺过量产生酵母菌株的生长培养基中测量NMP的积累。本分析表明,腐胺过量产生菌株中的MEU1的预先破坏及其对SAM再循环的伴随影响没有抑制AbPMT1的腐胺N-甲基化(图13)。
2.2)当异源表达时,酶可以定位于不同的亚细胞区室,而不是定位在它们的原始宿主生物体中,从而导致功能降低。经工程改造的菌株中的生物合成途径可以并入对天然和异源酶的多肽序列的修饰,以诱导这些修饰的酶定位于亚细胞区室(非天然定位的亚细胞区室)。例如,先前的研究表明,尽管NtPMT在烟草细胞的胞质溶胶中表达,但NtMPO1定位于过氧化物酶体腔(参见Naconsie,M.、Kato,K.、Shoji,T.和Hashimoto,T.Molecularevolution of n-methylputrescine oxidase in Tobacco.Plant Cell Physiol.55,436–444(2014))。
2.2.1)通过使用用于信号肽检测的SherLoc2实用程序进行酶亚细胞定位的计算机预测来检查NtMPO1的亚细胞定位(参见Briesemeister,S.等人.SherLoc2:Ahigh-accuracy hybrid method for predicting subcellular localization ofproteins.J.Proteome Res.8,5363–5366(2009))。本分析表明,NtMPO1在其C端携带强酵母共有过氧化物酶体靶向序列(PTS)(Ala-Lys-Leu,注释为PTS1),这表明当在酵母中异源表达时,NtMPO1可以定位于过氧化物酶体(图14)。
2.2.2)由低拷贝质粒表达N端或C端GFP标记的AbPMT1和NtMPO1的野生型酵母细胞的荧光显微术表明,尽管AbPMT1主要在胞质溶胶中发现,但是NtMPO1在过氧化物酶体的定位取决于暴露的C端PTS(图15a、16)。
2.2.3)通过用GFP融合体掩蔽C端PTS实现的NtMPO1的胞质溶胶表达没有显著影响细胞外4MAB或NMPy水平(图15b)。
2.3)经工程改造的菌株中的生物合成途径可以并入非表1中列出的生物合成酶的直向同源物。当在异源宿主中表达时,酶的不同直向同源物可能表现出显著的活性差异。因此,在本文中作为实例提供并列于表1中的生物合成酶的直向同源物也可以用于经工程改造的非植物细胞中,以进行相同的生物化学转化。
2.3.1)使用NtMPO1的氨基酸序列作为查询项并使用10
2.3.2)获得AbMPO1和DmMPO1的酵母密码子优化序列,并将其克隆到低拷贝表达质粒中。为了评估它们的活性,由实例1.5的腐胺过量产生菌株中的低拷贝质粒将三种MPO变体中的每一种与AbPMT1共表达,并且在选择性培养基中生长48小时之后,通过LC-MS/MS测量细胞外培养基中的4MAB和NMPy积累。DmMPO1表现出与原始NtMPO1变体相当的4MAB和NMPy产量水平(图17b)。
2.3.3)直向同源酶之间的活性差异可能通常至少部分归因于它们活性位点的结构差异。使用RaptorX网络服务器,基于豌豆含铜氨基氧化酶(PDB:1KSI)的晶体结构,构建NtMPO1、AbMPO1和DmMPO1的基于模板的同源模型(参见
2.3.4)测试两种活性直向同源物NtMPO1和DmMPO1的截短在经工程改造的酵母中的活性。N端截短分别去除了两种直向同源物的前84和81个残基。C端截短去除了后21个残基。还构建了C端截短,其中去除了非结构化的尾部,但保留了PTS(注释为
2.4)经工程改造的菌株中的生物合成途径并入了一种或多种遗传修饰,以减少或消除不期望的副反应的代谢通量。在异源宿主中表达的生物合成酶可能参与不期望的副反应,这些副反应从期望化合物的生物合成中抽取代谢物通量。例如,酵母醛脱氢酶可以将异源醛分子(如4MAB)氧化为它们的同源羧酸。基于LC-MS/MS分析,当由低拷贝质粒共表达AbPMT1和DmMPO1
2.4.1)六个酵母基因(ALD2-ALD6和HFD1)已在文献中被证明可编码具有醛脱氢酶活性的酶(参见Datta,S.、Annapure,U.S.和Timson,D.J.Different specificities of twoaldehyde dehydrogenases from Saccharomyces cerevisiae var.boulardii.Biosci.Rep.37,BSR20160529(2017);也参见Nakahara,K.等人.The
2.4.2)尽管ALD4-6由于其在乙酸盐和乙酰-CoA产生中的作用而被认为是必需基因,但是先前的研究已经证明这三个基因是至少部分冗余的,并且双重和三重敲除的致死表型可以通过向培养基中补充乙酸盐来挽救(参见Saint-Prix,F.、
2.4.3)通过从实例2.4.2的四重敲除菌株的基因组中缺失串联ALD2-ALD3基因,并由低拷贝质粒共表达AbPMT1和DmMPO1
2.4.4)通过将先前质粒带有的腐胺过量产生基因盒(SPE1、AsADC、speB)整合到实例2.4.3的ALD无效菌株的基因组中,并额外整合AbPMT1和DmMPO1
实例3.用于由单糖和营养物产生托品碱的经工程改造的酵母菌株
III型聚酮合酶(PKS)和细胞色素P450能够通过TA前体MPOB将NMPy转化为托品酮。托品酮可以通过立体定向还原酶还原(注释为托品酮还原酶1(TR1))以产生托品碱(参见Kim,N.、Estrada,O.、Chavez,B.、Stewart,C.和D’Auria,J.C.Tropane and GranataneAlkaloid Biosynthesis:A Systematic Analysis.Molecules 21,(2016))(图22)。
3.1)经工程改造的菌株中的生物合成途径并入了吡咯烷酮合酶、托品酮合酶CYP82M3、一种或多种细胞色素P450还原酶和托品酮还原酶1,以将NMPy转化为托品碱。
3.1.1)获得编码颠茄吡咯烷酮合酶(AbPYKS)、托品酮合酶(AbCYP82M3)和曼陀罗托品酮还原酶1(DsTR1)的酵母密码子优化的DNA序列。由于P450酶需要NADP
3.2)代谢瓶颈被定义为其低活性会限制通过部分生物合成途径的通量的生物合成酶或自发步骤,其存在可能导致期望TA和前体的非最佳产量。
3.2.1)例如,对实例3.1.1的经工程改造的菌株的培养基中的TA中间体的积累的分析表明,尽管AbCYP82M3的产物托品酮的积累是最小的,但是由AbPYKS产生的大部分MPOB仍未被AbCYP82M3消耗(图24)。
3.2.2)将托品碱生物合成基因整合到酵母基因组中可以通过实现更稳定的AbCYP82M3表达来提高托品碱产量。通过将AtATR1与AbPYKS和AbCYP82M3一起整合到实例3.1.1的产NMPy菌株的基因组中来构建产托品碱平台菌株。在48小时之后,经由LC-MS/MS分析,将整合菌株的托品碱和古豆碱积累与相同基因的基于质粒的表达进行比较(图28)。相对于基于质粒的表达(189μg/L),AbPYKS、AbCYP82M3和AtATR1的基因组表达使托品碱滴度增加到近三倍(565μg/L)。所述经工程改造的菌株还表现出古豆碱积累增加到2.6倍。
3.3)经工程改造的菌株生物合成途径中的副产物的积累可能导致期望TA和前体的非最佳产量。
3.3.1)例如,对实例3.1.1的经工程改造的菌株的培养基中的TA中间体的积累的分析表明,古豆碱(一种NMPy的衍生物)大量积累,其滴度几乎是托品碱的四倍(775-900μg/L)。在相关文献中,观察到古豆碱可经由MPOB的自发脱羧而积累(参见Bedewitz,M.A.、Jones,A.D.、D’Auria,J.C.和Barry,C.S.Tropinone synthesis via an atypicalpolyketide synthase and P450-mediated cyclization.Nat.Commun.9,5281(2018))(图22)。作为另一个实例,对实例3.1.1的经工程改造的菌株的生长培养基的LC-MS/MS分析表明,由于与NMPy的脱羧缩合,古豆碱也在缺乏AbPYKS和AbCYP82M3的阴性对照菌株中积累(图22)。
3.3.2)可以使用生长温度的调节来减少经工程改造的菌株的生物合成途径中的副产物的积累,以增加通至期望TA和前体的通量。在一个实例中,通过利用酶促反应和自发反应的速率在较低温度下降低的动力学原理来评估温度对自发古豆碱产量的影响。由于颠茄和其它产TA的茄科适合在较冷的气候下最佳生长,所以表达茄科基因的酵母菌株在25℃下的生长可以提高酶的折叠和/或活性,从而使得酶促生成的托品碱的产量与在30℃下的生长相当,同时降低了自发产生古豆碱的速率。将实例3.2.2的产托品碱菌株的培养物在非选择性限定培养基中于30℃和25℃下生长,并且在48小时之后,经由生长培养基的LC-MS/MS分析比较托品碱和古豆碱的积累。托品碱滴度受温度降低的影响最小。与30℃下相比,25℃下的古豆碱的积累减少了42%,导致所产生的托品碱与古豆碱的比率增加了60%(图25)。
3.3.3)可以使用不期望的副反应的减少或消除来提高经工程改造的菌株的生物合成途径中通至期望的TA和TA前体的代谢物通量。在一个实例中,可以通过减少由与乙酸盐的自发脱羧缩合产生的古豆碱产量来提高通至TA前体托品碱的通量。评估了从实例2.4.4的产NMPy菌株的培养基中去除供给的乙酸盐对古豆碱和托品碱产量的影响。通过在低拷贝质粒上表达ALD4和ALD6的功能拷贝,然后在生长48小时之后经由LC-MS/MS分析监测古豆碱和4MAB酸的积累,来评估在实例2.4.4的经工程改造的菌株中消除乙酸盐营养缺陷的效果。尽管ALD4或ALD6的重建使得能够在没有供给乙酸盐的选择性培养基上生长(图26a),但是ALD4的添加导致4MAB酸的积累增加到五倍,而ALD6没有产生显著的增加(图26b)。此外,用ALD4或ALD6消除乙酸盐供给分别导致古豆碱积累减少38%和59%(图26b)。
3.3.4)将ALD6基因的功能拷贝重新整合到实例3.2.2的产托品碱菌株中先前被破坏的ald6基因座处。在非选择性培养基中生长48小时之后,经由LC-MS/MS分析测量这种整合对NMPy和托品碱之间所有代谢物的积累的影响。经由Ald6p恢复乙酸盐代谢导致托品碱滴度增加到2.7倍,以及古豆碱积累增加到1.6倍(图28)。此外,ALD6整合导致NMPy和托品酮的产量的显著增加以及MPOB消耗的增加(图27)。
3.3.5)由实例3.3.4的经工程改造的菌株中的低拷贝质粒表达腐胺和托品碱之间的每个生物合成酶基因(即AbPMT1、DmMPO1
实例4:被工程改造成用于由L-精氨酸产生假托品碱生物碱的酵母。
酵母菌株可以被工程改造成用于由早期氨基酸前体(如L-精氨酸)产生非药用TA。作为一个实例,实例3中描述的平台酵母菌株可以被进一步工程改造以由L-精氨酸产生假托品碱生物碱(图1)。
由L-精氨酸产生托品酮的平台酵母菌株(参见实例3中的描述)可以被进一步工程改造以并入立体定向还原酶(例如,托品酮还原酶2(TR2;EC 1.1.1.236)),从而将生物合成的托品酮转化为假托品碱。可以将携带强组成型启动子(如TDH3)和TR2变体(例如,来自曼陀罗的TR2(DsTR2))编码序列的表达盒整合到产托品酮平台酵母菌株的基因组中。通过整合携带强组成型启动子(如PGK1)和羟基化酶(如作用于假托品碱支架的细胞色素P450)的一个或多个表达盒,可以将所得菌株进一步工程改造以产生假托品碱的羟基化衍生物,例如打碗花精。通过并入多种P450酶(每种酶作用于假托品碱骨架的不同位置),可以生物合成多种打碗花精及其衍生物。然后,可以将经工程改造的菌株在非选择性合成完全培养基中于30℃或25℃下培养48至96小时,之后可以通过LC-MS/MS分析培养基中的假托品碱生物碱的积累。
实例5:被工程改造成用于过量产生苯丙酮酸盐和相关联的TA前体的酵母。
为了增加从中心代谢至期望TA和TA前体的碳和氮通量,酵母菌株可以被工程改造成用于过量产生苯丙酮酸盐,所述苯丙酮酸盐代表了产生药用TA所需的酰基供体分子的前体(图2)。可以通过并入遗传修饰将酵母菌株工程改造成用于过量产生苯丙酮酸盐,所述遗传修饰包括但不限于协调天然生物合成酶的转录调节、缺失或破坏编码使前体分子偏离预期途径的酶的基因、以及引入用于将内源分子转化为TA前体分子的异源酶。
在一个实例中,可以通过并入编码生物合成酶的天然基因的额外拷贝来将酵母菌株工程改造成用于增加苯丙酮酸盐产量,所述生物合成酶由氨基酸或其它中心代谢物产生苯丙酮酸盐。这些额外拷贝可以由强组成型启动子(如GPD、TEF1或PGK1)控制。天然基因靶标的实例包括但不限于芳香族酸氨基转移酶ARO8和ARO9以及脱水酶PHA2。在一个实例中,ARO8的一个或多个额外拷贝可以在强组成型启动子的控制下并入到经工程改造的菌株中。在一个实例中,ARO9的一个或多个额外拷贝可以在强组成型启动子的控制下并入到经工程改造的菌株中。在另一个实例中,PHA2的一个或多个额外拷贝可以在强组成型启动子的控制下并入到经工程改造的菌株中。在本发明的一个实施例中,选自包括ARO8、ARO9和PHA2的群组的一个或多个基因的一个或多个额外拷贝可以在独特的强组成型启动子的控制下并入到经工程改造的菌株中。
实例6:被工程改造成用于由L-苯丙氨酸或IL-酪氨酸产生酰基供体以用于TA支架生物合成的酵母。
酵母菌株可以被工程改造成用于由L-苯丙氨酸和L-酪氨酸产生多种类苯丙酸酰基供体化合物,包括PLA、肉桂酸、香豆酸、阿魏酸、苯甲酸和辅酶A硫酯以及这些化合物的糖苷衍生物,它们可以与托品碱、假托品碱或其衍生物进行酯化,以生物合成药用TA、非药用TA和非天然TA(图1-3)。
6.1)由于野生型酵母仅产生痕量水平的PLA,因此必须增加这种TA前体的产量,以允许下游TA的充分积累。为了提高PLA产量,可以将异源苯丙酮酸盐还原酶(PPR)在经工程改造的宿主细胞中表达。通过由CSY1251中的低拷贝质粒表达每种酶,并在选择性培养基中生长72小时之后通过LC-MS/MS测量PLA产量,针对酵母中的活性,对来自大肠杆菌、乳杆菌、颠茄和荧光威克酵母的PPR直向同源物以及对3-苯丙酮酸盐具有报道活性的来自芽孢杆菌和乳杆菌的乳酸盐脱氢酶(LDH)(表1)进行筛选。相对于对照,所有LDH候选物以及来自植物乳杆菌、大肠杆菌和颠茄的PPR在PLA产量方面得到适度(1.3至3.5倍)提高,而来自荧光威克酵母的PPR的表达导致PLA产量增加到近80倍,达到约250mg/L(图31)。因此,WfPPR被选择用于整合到CSY1251中以制造菌株CSY1287。
6.2)作为另一个实例,可以将酵母菌株工程改造成用于产生肉桂酸和香豆酸,所述肉桂酸和所述香豆酸是类苯丙酸化合物,可以用作酰基供体化合物,以与托品碱或假托品碱酯化,从而分别由L-苯丙氨酸和L-酪氨酸形成非天然TA。通过并入解氨酶(如苯丙氨酸解氨酶(PAL;EC 4.3.1.24)),可以将酵母工程改造成用于由L-苯丙氨酸产生肉桂酸。类似地,通过并入解氨酶(如酪氨酸解氨酶(TAL;EC 4.3.1.23)),可以将酵母工程改造成用于由L-酪氨酸产生香豆酸。通过用具有TRP1选择性标志物、TEF1启动子和来自拟南芥的PAL变体(AtPAL1)的编码序列的低拷贝CEN/ARS质粒进行转化,将酵母菌株工程改造以由L-苯丙氨酸产生肉桂酸。将携带低拷贝质粒的所得菌株在含适当氨基酸成分缺除溶液(-Ura)的合成完全培养基中于30℃下生长。在生长48小时之后,通过LC-MS/MS分析对培养基进行肉桂酸含量分析(图32)。
6.3)在颠茄中,PLA被活化,用于经由UDP-葡糖基转移酶84A27(AbUGT)的葡糖基化将酰基转移到托品碱(参见Qiu,F.等人,Functional genomics analysis reveals twonovel genes required for littorine biosynthesis.New Phytol.,nph.16317(2019))。由于植物UGT参与多种类苯丙酸化合物的生物合成并且通常表现出广泛的底物范围(参见Ross,J.、Li,Y.、Lim,E.-K.、D.J.Bowles,Higher plant glycosyltransferases.GenomeBiol.2,3004.1–3004.6(2001)),所以有必要选择对期望酰基供体具有足够高的活性的UGT。
6.3.1)作为一个实例,通过由CSY1251中的低拷贝质粒表达AbUGT,并测量三种类苯丙酸酰基供体(PLA、肉桂酸、阿魏酸)向其相应的葡糖苷的转化,来评估AbUGT对不同类苯丙酸酰基供体(包含经典底物PLA)的活性。尽管AbUGT分别葡糖基化了约60%和90%的肉桂酸和阿魏酸,但PLA的葡糖基化是测试底物中最低的,转化率<3%(图33)。
6.3.2)可以评估来自其它产TA茄科的AbUGT直向同源物对PLA和其它类苯丙酸的活性。在本实例中,使用tBLASTn搜索,编码来自1000株植物数据库中的红花木曼陀罗(BsUGT)和白曼陀罗(DmUGT)的转录组的UGT84A27的转录物。通过由CSY1251中的低拷贝质粒表达AbUGT、BsUGT、DmUGT或BFP阴性对照,针对活性对编码这些直向同源UGT的酵母密码子优化序列进行筛选。在补充有500μMPLA、肉桂酸(CA)或阿魏酸(FA)作为葡萄糖受体的选择性培养基中生长72小时之后,经由LC-MS/MS在转化菌株的培养物中测量葡糖苷产量。所有三种UGT直向同源物都表现出CA(34-65%转化率)和FA(85-90%转化率)的大量葡糖基化,并且对PLA只有痕量活性(转化率<3%),其中AbUGT表现出PLA的最大转化率(2.7%)(图33、34)。
6.3.3)鉴于AbUGT在结构相似的底物肉桂酸盐、阿魏酸盐和PLA上的活性存在不成比例的差异,可以实施结构导向的合理诱变方法来工程改造AbUGT的活性位点,以提高PLA上的活性。在本实例中,首先使用RaptorX网络服务器基于拟南芥水杨酸盐UDP-葡糖基转移酶UGT74F2(PDB:5V2K)的晶体结构构建与UDP-葡萄糖结合的AbUGT的同源模型(图35)。接下来,使用Maestro/GlideXP软件套装模拟D-PLA在活性位点中的对接。基于能量最小化结合模式,D-PLA的芳环可能通过与F130的π堆积相互作用而稳定,而其α-羟基和羧酸根基团分别通过与Q151和H24的氢键结合而稳定,使得亲核羧基氧位于UDP-葡萄糖的亲电C1碳的
6.3.4)基于部分6.1和6.3中描述的结果,通过将酵母密码子优化的WfPPR和AbUGT整合到CSY1251的基因组中来构建菌株CSY1288,通过证实PLA产量(66mg/L)和最小PLA葡糖苷积累来验证(图37)。
6.4)由于AbUGT在PLA上的较低活性可能会限制TA前体至下游TA的通量,因此可以通过并入促进UDP-葡萄糖积累并减少糖苷降解的遗传修饰来增加苯丙氨酸至PLA葡糖苷的通量。
6.4.1)UDP-葡萄糖对储存多糖、细胞壁葡聚糖和糖蛋白的形成至关重要,因此其生物合成受到严格调节(参见Nishizawa,M.、Tanabe,M.、Yabuki,N.、Kitada,K.、Toh-e,A.Pho85 kinase,a yeast cyclin-dependent kinase,regulates the expression ofUGP1 encoding UDP-glucose pyrophosphorylase.Yeast.18,239–249(2001))。在葡萄糖上生长期间,酵母沿着两个主要代谢路线(糖酵解和淀粉生物合成)指导葡萄糖-6-磷酸盐。因为柠檬酸盐是糖酵解限速酶磷酸果糖激酶的变构抑制剂(参见Li,Y.等人,Productionof Rebaudioside A from Stevioside Catalyzed by the Engineered Saccharomycescerevisiae.Appl.Biochem.Biotechnol.178,1586–1598(2016)),所以经由柠檬酸盐补充对糖酵解的部分遏制可能会增加UDP-葡萄糖可用性和葡糖苷产量(图38)。将编码用于内源PLA葡糖苷产生的基因组WfPPR和AbUGT的菌株CSY1288在补充有2%柠檬酸盐和500μM CA或FA的培养基中培养,并且在生长72小时之后通过LC-MS/MS比较葡糖苷产量。柠檬酸盐补充将PLA、CA和FA的糖基化分别降低了83%、56%和78%(图39)。
6.4.2)可以使用PGM2和UGP1(二者的基因产物分别催化葡萄糖-6-磷酸盐异构化为葡萄糖-1-磷酸盐和葡萄糖-1-磷酸盐转化为UDP-葡萄糖)的过表达来增加UDP-葡萄糖供应。
6.4.2.1)由CSY1288中的低拷贝质粒表达PGM2和UGP1的额外拷贝,并且在选择性培养基中生长72小时后测量PLA葡糖苷产量。尽管PGM2过表达相对于对照没有得到提高,但UGP1的过表达导致PLA葡糖苷产量增加到约1.8倍(图40),从而支持了增加UDP-葡萄糖池可提高AbUGT的PLA利用。
6.4.2.2)天然葡糖苷酶可以作用于PLA和其它TA前体葡糖苷以减少积累,因为其它异源葡糖苷已被证明可在酵母中以这种方式水解(参见Schmidt,S.、Rainieri,S.、Witte,S.、Matern,U.、Martens,S.,Identification of a Saccharomyces cerevisiaeglucosidase that hydrolyzes flavonoid glucosides.Appl.Environ.Microbiol.77,1751–1757(2011);也参见Wang,H.等人,Engineering Saccharomyces cerevisiae withthe deletion of endogenous glucosidases for the production of flavonoidglucosides.Microb.Cell Fact.15,1–12(2016))。在本实例中,在CSY1288中破坏三种天然葡糖苷酶基因(EXG1、SPR1和EGH1),并且在破坏突变体在非选择性培养基中生长72小时后测量PLA葡糖苷产量。EGH1的破坏使PLA葡糖苷产量增加了一倍多(图41),表明Egh1p的水解构成了TA前体通量的大量损失。
实例7:被工程改造成用于将利托林转化为莨菪碱醛的酵母
酵母菌株可以被工程改造成用于将利托林转化为莨菪碱醛(图2)。例如,实例6中描述的产托品碱和PLA葡糖苷的酵母菌株可以被进一步工程改造以表达用以催化利托林重排为莨菪碱醛的细胞色素P450 CYP80F1(EC 1.14.19.-)和用以支持P450酶的活性的细胞色素P450还原酶(CPR;EC 1.6.2.4)。通过用具有LEU2选择标志物、TDH3启动子和来自颠茄的CYP80F1变体(AbCYP80F1)的编码序列的低拷贝CEN/ARS质粒转化;以及用具有TRP1选择标志物、TEF1启动子和来自酿酒酵母(NCP1)或拟南芥(AtATR1)的细胞色素P450还原酶(CPR)的编码序列的低拷贝CEN/ARS质粒转化,将酵母菌株工程改造以将供给的利托林转化为莨菪碱醛。将携带低拷贝质粒的所得菌株在补充有1mM利托林的含适当氨基酸成分缺除溶液(-Leu-Trp)的合成完全培养基中于30℃下生长。在生长48小时之后,通过LC-MS/MS分析来分析培养基的莨菪碱醛含量(图42)。
实例8:被工程改造成用于将茛菪碱转化为东茛菪碱的酵母。
酵母菌株可以被工程改造成用于将莨菪碱转化为东莨菪碱(图2)。例如,实例7中描述的酵母菌株可以被进一步工程改造以并入用以形成山莨菪碱的在莨菪碱的6β位具有羟化酶活性的酶和用以形成东莨菪碱的在山莨菪碱的6β-羟基位具有双加氧酶活性的酶、或同时具有这两种活性的酶(EC 1.14.11.11)。通过用具有LEU2选择标志物、TDH3启动子和来自曼陀罗(DsH6H)、三分三(AaH6H)、木本曼陀罗(BaH6H)或白曼陀罗(DmH6H)的莨菪碱6β-羟化酶/双加氧酶(H6H)的编码序列的低拷贝CEN/ARS质粒转化,将酵母菌株工程改造以将供给的莨菪碱转化为东莨菪碱。将携带低拷贝质粒的所得菌株在含适当氨基酸成分缺除溶液(-Leu)并补充有1mM莨菪碱的合成完全培养基中于30℃下生长。在生长72小时之后,通过LC-MS/MS分析来分析培养基的东莨菪碱含量(图43)。尽管所有测试变体都在体内表现出H6H活性,但表达来自曼陀罗的H6H变体的菌株表现出供给的莨菪碱向东莨菪碱的最大转化。通过在这种经工程改造的酵母菌株的培养基中补充不同的辅因子,并在生长72小时之后通过LC-MS/MS分析培养基,进行辅因子要求的进一步优化。本分析标识了亚铁补充会增加莨菪碱向东莨菪碱的转化(图44)。
实例9.茛菪碱脱氢酶候选物的标识和经工程改造的非植物细胞中的茛菪碱醛向茛菪碱的还原
为了标识适于进行本文公开的方法的TA醇-醛相互转化的脱氢酶,特别是为了将莨菪碱醛还原为莨菪碱,从公开可得的植物RNA测序数据中标识了莨菪碱脱氢酶(HDH)开放阅读框。
9.1)从密歇根州立大学药用植物基因组资源(参见http://medicinalplantgenomics.msu.edu/)获得从颠茄转录组中标识的43,861种特有转录物中每一种的组织特异性丰度(每百万作图读长的每千碱基重叠群的片段数,FPKM)和推定蛋白质结构和功能注释。使用以下计算过滤算法,基于组织特异性表达谱与诱饵基因CYP80F1(利托林变位酶)和H6H(莨菪碱6β-羟化酶/双加氧酶)的组织特异性表达谱的聚类,标识编码莨菪碱脱氢酶候选物的转录物,所述诱饵基因分别在TA生物合成途径中的脱氢酶步骤之前和之后。
首先,从43,861种转录物的完整列表中过滤出用任何以下蛋白质家族(PFAM)ID中的任一个注释的转录物:PF00106、PF13561、PF08659、PF08240、PF00107、PF00248、PF00465、PF13685、PF13823、PF13602、PF16884、PF00248;或用以下功能注释关键词中的任一个注释的转录物:醇脱氢酶、醛还原酶、短链、醛/酮。此外,可以在过滤器中包含具有关键词为腐胺、托品酮和托品碱的功能注释的任何转录物作为阳性对照TA相关基因,以验证与诱饵基因的聚类。接下来,针对CYP80F1和H6H诱饵基因生成平均组织特异性表达谱。对于两个诱饵基因中的每一个,构建线性回归模型以将诱饵基因表达谱(以FPKM为单位)表达为每个候选基因谱的线性函数,并且为每个候选物计算相关性p值。将使用两个诱饵基因中的每一个标识的候选物合并,并去除重复。每个候选物的组合p值被计算为与两个诱饵基因中的每一个的相关性的log10 p值之和。去除与TA生物合成途径中的已知脱氢酶(即托品酮还原酶I和II)匹配的转录物,并且经由组织特异性表达谱的层次聚类,根据组合p值和与诱饵基因的距离对剩余的候选物进行排序(图45)。
9.2)实例9.1中标识的几乎所有候选物都表现出针对已知TA生物合成基因观察到的相同的次生根特异性表达模式。在UniPROT/SwissPROT数据库中对所得的约30种候选物进行的BLASTp搜索表明,许多转录物缺少末端或内部序列区域。为了解决这个问题,使用Trinity软件包从保藏的原始RNAseq读长(参见http://medicinalplantgenomics.msu.edu/)重复从头转录组装配(参见Haas,B.J.等人,De novotranscript sequence reconstruction from RNA-seq using the Trinity platformfor reference generation and analysis.Nat.Protoc.8,1494–512(2013)),并且通过对新组装的转录组进行不完整序列区域的BLAST比对来重建HDH候选物中的十二种的所有缺少的序列片段(表2)。
9.3)通过在酵母中筛选实例9.1和9.2中生成的候选物来标识缺少的HDH活性。
9.3.1)由于莨菪碱醛的真实商业标准品的缺乏以及化学合成的产率不足,因此对于经由供给的利托林的体内活性筛选,有必要进行HDH候选物与上游生物合成酶(细胞色素P450利托林变位酶(CYP80F1))的共表达(参见实例7)。由于利托林表现出与HDH产物莨菪碱相似的色谱和质谱性质,因此通过将酵母密码子优化的AbCYP80F1和DsH6H(参见实例8)整合到CSY1251的基因组中来构建HDH筛选菌株(CSY1292),从而能够通过对经由三步生物合成途径由供给的利托林(m/z
9.3.2)由菌株CSY1292中的低拷贝质粒表达编码十二种HDH候选物中的每一种的酵母密码子优化序列,并且在补充有1mM利托林的培养基中生长72小时后测量东莨菪碱产量。十二种候选物中的一种,HDH2(称为AbHDH),显示出莨菪碱醛水平降低35%和东莨菪碱的可测量的积累(7.2μg/L),表明它编码缺少的HDH活性(图46)。
9.4)结构和系统发生分析为HDH的催化机制和进化史提供了进一步的见解。
9.4.1)基于美洲颤杨芥子醇脱氢酶(PtSAD;PDB:1YQD)的晶体结构构建AbHDH的同源模型(图47)。AbHDH是中链脱氢酶/还原酶(MDR)超家族内的锌依赖性醇脱氢酶(ZADH)家族的成员。作为这个家族的典型代表,AbHDH表现出具有保守的核苷酸结合结构域和更易变的底物结合结构域的双叶结构。AbHDH核苷酸结合结构域内的残基S216、T217、S218和K221与PtSAD中的磷酸盐稳定残基S214、T215、S216和K219的比对表明AbHDH是一种NADPH依赖性氧化还原酶。还作为ZADH的典型代表,AbHDH似乎使用蛋白质表面附近的一组四个半胱氨酸残基(C105、C108、C111和C119)和活性位点内的催化Zn
9.4.2)使用Maestro/Glide软件包,经由底物莨菪碱醛分子对接到活性位点中,说明了AbHDH的催化机制(图47)。最有利的结合模式将底物的醛基定位在催化Zn
9.5)为了确认直向同源氧化还原酶是否在其它产TA茄科中催化莨菪碱生物合成,使用tBLASTx搜索从毛曼陀罗和曼陀罗的转录组(参见https://medplantrnaseq.org)中标识了AbHDH编码序列的变体(图48)。通过由CSY1292中的低拷贝质粒将酵母密码子优化序列与通量限制DsH6H的额外拷贝共表达,并测量补充有1mM利托林的培养基中的东莨菪碱产量,验证两种标识的直向同源物(DiHDH、DsHDH)的HDH活性。DsHDH表现出测试变体的最高底物消耗和产物积累(图49)。
9.6)将包括最佳酶变体和通量限制酶的过表达的药用TA生物合成分支整合到平台酵母菌株中。通过将酵母密码子优化的WfPPR和AbUGT、DsHDH和DsH6H的第二个拷贝整合到CSY1292中来构建菌株CSY1294。在CSY1294中证实由供给的利托林产生东莨菪碱(图50)。
实例10:被工程改造成用于酯化酰基供体和受体以产生TA支架的酵母。
酵母菌株可以被工程改造以表达催化活化的酰基供体化合物和酰基受体化合物的酯化的酶,从而产生不同的TA支架(图2、3)。如实例6中所述,酰基供体基团的活化可以通过工程改造产酰基供体酵母菌株以并入将具有高基团转移潜力的化学部分(如辅酶A(CoA))或葡萄糖(葡糖苷)附加到酰基供体的羧基的酶来实现。可以用于这种能力的酰基供体活化酶的实例包括CoA连接酶和UDP-糖基转移酶。可以用于催化活化的酰基供体化合物和酰基受体(如托品碱和假托品碱)的酯化的酯化酶的实例是酰基转移酶,包括丝氨酸羧肽酶样酰基转移酶(SCPL-AT)和BAHD型酰基转移酶。当在异源宿主(如酵母)中表达时,可以修饰这种酰基转移酶的编码序列以提高其活性。
10.1)在SCPL-AT通常天然存在的植物中,SCPL-AT的编码序列包含N端信号肽,其将新生多肽导向内质网(ER)。一旦定位于ER,SCPL-AT多肽就经分泌运输途径通过高尔基体被运送到液泡腔,其在液泡腔中被发现表现出活性。在这种ER-液泡运输过程期间,它们经历了几种翻译后修饰(图51),包括但不限于信号肽切割、N-糖基化、内部前肽序列的去除和二硫键形成(参见Stehle,F.、Stubbs,M.T.、Strack,D.和Milkowski,C.Heterologousexpression of a serine carboxypeptidase-like acyltransferase andcharacterization of the kinetic mechanism,FEBS Journal,275,(2008))。然而,由于细胞内运输途径和翻译后修饰的模式在生物体之间有所不同,所以SCPL-AT在异源宿主中的表达可能导致不正确的亚细胞定位和/或不正确的活性翻译后修饰。作为一个实例,当在酵母中表达时,可以修饰SCPL-AT(如利托林合酶(LS))(表1)的编码序列以提高活性。
10.1.1)信号肽序列可能影响酵母中的SCPL-AT的加工和定位。
10.1.1.1)推定N端信号肽在AbLS中的存在表明,它遵循在植物体内预期的SCPLER-液泡运输途径。通过由CSY1294中的低拷贝质粒表达AbLS的N端和C端GFP融合体来检查AbLS在酵母中的定位。荧光显微术表明,N端融合体(GFP-AbLS)与液泡膜染色剂FM4-64共定位(图52)。对于C端融合体(AbLS-GFP),没有检测到荧光,这与天然C端对于SCPL酰基转移酶的稳定性至关重要的报道相一致(参见Stehle,F.、Stubbs,M.T.、Strack,D.和Milkowski,C.Heterologous expression of a serine carboxypeptidase-like acyltransferaseand characterization of the kinetic mechanism,FEBS Journal,275,(2008))。
10.1.1.2)SCPL-AT在酵母中的液泡隔离可能会阻止进入胞质溶胶底物池,因为酵母可能缺乏植物中存在的与胞质溶胶交换次生代谢物所必需的液泡膜转运蛋白。为了确定AbLS与其它酵母区室的强制定位是否能够实现活性(假设提高了触及胞质溶胶代谢物的能力),将野生型N端SP序列用一组N端信号序列取代,这些信号序列取自靶向液泡腔(Prc1p和Pep4p)、面向腔的液泡膜(Dap2p)、反面高尔基体网(Och1p)、面向腔的ER膜(Mns1p)和线粒体基质(Cit1p)的酵母蛋白(图53)。野生型SP也被完全去除,并且对于另一种变体,将经典的过氧化物酶体靶向序列(PTS1)附加到C端。由CSY1294中的高拷贝质粒表达这些嵌合AbLS变体,并且在选择性培养基中生长96小时之后,通过LC-MS/MS对转化体进行活性筛选。对于变体中的任一种,都没有观察到利托林或下游中间体的产生(图53)。
10.1.2)酵母中的SCPL-AT的不正确的翻译后加工可能会阻止活性酶的表达。
10.1.2.1)蛋白质N-糖基化模式在酵母和植物之间有所不同,并且先前的报告表明,不同植物酶的正确的N-糖基化对它们的折叠、稳定性和/或活性很重要(参见Kar,B.、Verma,P.、den Haan,R.、Sharma,A.K.,Effect of N-linked glycosylation on theactivity and stability of aβ-glucosidase from Putranjiva roxburghii.Int.J.Biol.Macromol.112,490–498(2018);也参见Podzimek,T.等人,N-glycosylation of tomatonuclease TBN1 produced in N.benthamiana and its effect on the enzymeactivity.Plant Sci.276,152–161(2018);也参见Strasser,R.,Plant proteinglycosylation.Glycobiology.26,926–939(2016))。AbLS多肽的计算机分析预测了四个N-糖基化位点(N152、N320、N376、N416),并且在本特哈曼烟草中没有检测到这种蛋白质的O-糖基化(图54)。将C端HA标记的野生型AbLS、四种N→Q突变体(其中N到Q的突变消除了N-糖基化(23))中的每一种或四重N→Q突变体在CSY1294和本特哈曼烟草中表达,并且通过蛋白质印迹比较糖基化谱。然而,野生型AbLS、N→Q单突变体和四重突变体在本特哈曼烟草中都表现为单一条带,表明单一糖基化状态,只有四重N→Q突变体在酵母中产生单一条带;所有其它变体都表现为双条带或三条带,表明多种糖基化状态的组合(图55)。然而,由于酵母中两个野生型AbLS条带中的较密集条带与烟草中野生型AbLS的条带部分重叠,所以至少一些部分的酵母表达的AbLS必须处于正确的糖基化状态,并且错误糖基化不可能解释酵母中的AbLS活性的完全缺乏。(图54-55)。
10.1.2.2)包括来自拟南芥的芥子酰基葡萄糖:胆碱芥子酰基转移酶(AtSCT)和来自糙伏毛燕麦的燕麦根皂苷合酶(AsSCPL1)的SCPL酰基转移酶的子集已被证明含有内部前肽连接子,所述连接子被蛋白酶解去除以产生由二硫键连接的活性异二聚体(参见Shirley,A.M.、Chapple,C.,Biochemical characterization of sinapoylglucose:choline sinapoyltransferase,a serine carboxypeptidase-like protein thatfunctions as an acyltransferase in plant secondarymetabolism.J.Biol.Chem.278,19870–19877(2003);也参见Mugford,S.T.等人,A serinecarboxypeptidase-like acyltransferase is required for synthesis ofantimicrobial compounds and disease resistance in oats.Plant Cell.21,2473–2484(2009))。AbLS氨基酸序列与先前表征的植物丝氨酸羧肽酶和SCPL酰基转移酶的氨基酸序列的比较表明了内部的25至30个残基的序列的存在,所述序列与AtSCT、AsSCPL1和小麦羧肽酶2(TaCBP2)的高度可变前肽对齐,表明AbLS也经历内切蛋白酶解切割以形成异二聚体(图56)。此外,AbLS的同源模型表明,预测的内部前肽阻断了活性位点,因此需要去除活性(图57)。然而,在本特哈曼烟草中表达的野生型AbLS似乎不经历蛋白酶解切割,因为在二硫键还原条件下通过蛋白质印迹没有检测到预期的约20-25kDa C端片段(图54、55)。由于推定前肽在植物体内似乎不被切割或去除,AbLS可能在植物中采用将前肽从活性位点移离的天然构象,但酵母分泌途径和/或液泡的生物化学环境的差异阻止了这种移位,从而阻断活性。
为了解决这种失效模式,构建了拆分式AbLS对照,其中侧接推定前肽连接子的N端和C端结构域在有或没有单独的信号肽的情况下都独立地表达。此外,构建了AbLS变体,其中推定前肽用柔性(GGGGS)
为了解决蛋白质表达的问题,由CSY1294中的低拷贝质粒表达上述C端HA标记的AbLS变体中的每一种,并且通过蛋白质印迹将表观蛋白质尺寸与拆分式AbLS对照进行比较(图58)。AtSCT和多聚精氨酸连接子都不产生蛋白酶解切割所预期的20-25kDa C端片段。在后一种情况下,多聚精氨酸AbLS变体不能被切割,表明所述蛋白在反面高尔基体网(TGN;在酵母中也称为晚期高尔基体)上游的分泌途径中停滞,这可以解释在表达野生型或高尔基体靶向(Och1p SP融合的)AbLS的CSY1294中观察到的严重生长缺陷。
10.1.3)SCPL-AT在酵母中的功能性表达可以通过工程改造N端融合体来实现,所述融合体改变了TGN的分选。可溶性酵母蛋白从TGN向液泡的运送需要由液泡蛋白分选(Vps)货物运送蛋白识别典型的N端信号序列,而到达酵母TGN的整合膜蛋白似乎默认被分选至液泡(参见Stack,J.H.,Receptor-Mediated Protein Sorting to the Vacuole inYeast:Roles for Protein Kinase,Lipid Kinase and GTP-BindingProteins.Annu.Rev.Cell Dev.Biol.11,1–33(1995);也参见Roberts,C.J.、Nothwehr,S.F.、Stevens,T.H.,Membrane protein sorting in the yeast secretory pathway:Evidence that the vacuole may be the default compartment.J.Cell Biol.119,69–83(1992))。因此,通过用N端融合的可溶性结构域掩蔽SP来将SCPL-AT转化为跨膜蛋白可以解决TGN分选中的障碍。
10.1.3.1)在一个实例中,AbLS变体用一组N端融合的可溶性结构域构建,包括来自多管水母(GFP、BFP、mVenus)和圆盘海葵(mCherry、DsRed)科的荧光蛋白;具有突变蛋白酶切割位点(SUMO*)的小泛素相关修饰物(Smt3p);和TA途径中的上游酶AbUGT。由CSY1294中的低拷贝质粒表达这些变体和野生型AbLS,并且在选择性培养基中生长96小时后针对利托林合酶活性进行筛选。所有N端融合的AbLS变体都表现出莨菪碱和东莨菪碱的可测量的积累。多管水母GFP源性荧光蛋白与AbLS的融合分别产生约1μg/L的莨菪碱和约0.1μg/L的东莨菪碱;而圆盘海葵源性荧光蛋白的融合导致大幅升高的TA产量,其中经由DsRed融合获得最高滴度(10.3μg/L莨菪碱,0.87μg/L东莨菪碱)(图59)。AbLS活性的增强似乎与N端结构域的寡聚化状态相关,其中东莨菪碱产量以从单体(GFP、BFP、mVenus、mCherry、SUMO*)到同二聚体(AbUGT)再到同四聚体(DsRed)结构域的顺序依次增加。
10.2)为了生成能够进行完整的TA生物合成的菌株,将酵母密码子优化的DsRed-AbLS和UGP1的第二个拷贝整合到CSY1294的基因组中破坏EGH1位点处以生成CSY1296。CSY1296表现出滴度分别为10.2μg/L和1.0μg/L的从头莨菪碱和东莨菪碱产量。
实例11.使用异源转运蛋缓解细胞内底物运送限制
由于进行TA生物合成的酶分布在多个亚细胞区室(胞质溶胶、ER膜、过氧化物酶体、液泡、线粒体),并且酵母不可能具有植物中发现的能够在不同区室之间动员TA生物合成中间体的转运蛋白,所以细胞内代谢物运送可能会限制TA产量。
11.1)通过在非植物宿主细胞中功能性表达植物转运蛋白,可以解决区室间运送限制。DsRed-AbLS的液泡区室化(图60)需要将胞质溶胶托品碱和PLA葡糖苷输入到液泡腔,并将液泡利托林输出到胞质溶胶。已经在茄科中标识了负责液泡生物碱和糖苷隔离的几种多药和毒素挤出(MATE)转运蛋白,包含在TA上具有观察到的或预测的活性的三种(参见Morita,M.等人,Vacuolar transport of nicotine is mediated by a multidrug andtoxic compound extrusion(MATE)transporter in Nicotiana tabacum.Proc.Natl.Acad.Sci.U.S.A.106,2447–2452(2009);也参见Shoji,T.等人,Multidrug and toxiccompound extrusion-type transporters implicated in vacuolar sequestration ofnicotine in tobacco roots.Plant Physiol.149,708–718(2009))。在一个实例中,由CSY1296中的低拷贝质粒表达烟草茉莉酮酸盐诱导型生物碱转运蛋白1(NtJAT1)和两种MATE(NtMATE1、NtMATE2),并且在选择性培养基中生长96小时后测量TA的积累。NtJAT1和NtMATE2的表达提高了TA产量,前者分别导致莨菪碱和东莨菪碱滴度增加74%和18%(图61)。
11.2)为了评估这些转运蛋白的亚细胞定位并确定可能的作用机制,对由低拷贝质粒表达NtJAT1或NtMATE2的C端GFP融合体的CSY1296进行荧光显微术。分析支持NtJAT1几乎只定位于液泡膜(与DsRed-AbLS共定位),而NtMATE2分裂于液泡膜和质膜之间(图60),表明两种转运蛋白可能都具有消除液泡底物运送限制的功能,而后者还可以提高细胞TA输出。
实例12:被工程改造成用于由L-苯丙氨酸或L-酪氨酸和L-精氨酸产生非天然TA的酵母
除了被工程改造成用于产生生物体中天然存在的药用和非药用TA之外,酵母也可以被工程改造成用于产生非天然TA(图3)。例如,可以将酵母工程改造以表达用于产生酰基供体化合物的生物合成途径,所述酰基供体化合物不能被植物天然并入到TA中。
12.1)在一个实例中,实例3中描述的平台产托品碱酵母菌株可以被进一步工程改造以产生酰基供体化合物肉桂酸(如实例6中所述)并表达肉桂酸盐活化酶和酯化酶以产生非天然TA(如肉桂酰托品碱)。
12.1.1)肉桂酸盐可以经由苯丙氨酸解氨酶(例如,来自拟南芥的PAL1(AtPAL1))由苯丙氨酸产生。因为EcCS需要辅酶A(CoA)活化的酰基供体,所以可以表达在肉桂酸盐上具有确定活性的4-香豆酸盐-CoA连接酶(如来自拟南芥的4CL5(At4CL5))(参见Eudes,A.等人.Exploiting members of the BAHD acyltransferase family to synthesizemultiple hydroxycinnamate and benzoate conjugates in yeast.Microbial CellFactories,15,(2016))以使得能够在酵母中进行肉桂酰-CoA生物合成。如实例6中所述,用能够实现肉桂酸产生的低拷贝质粒转化实例3中所述的平台产托品碱酵母菌株。
12.1.2)通过用具有URA3选择性标志物、HXT7和PMA1启动子以及来自拟南芥的4-香豆酸盐-CoA连接酶变体(At4CL5)和来自古柯树的可卡因合酶(EcCS)的编码序列的高拷贝2μ质粒转化,实例12.1.1的经工程改造的菌株被进一步修饰以产生肉桂酰托品碱。将携带低拷贝和高拷贝质粒的所得菌株在含适当氨基酸成分缺除溶液(-Ura-Trp)的合成完全培养基中于25℃下生长。在生长72小时之后,通过LC-MS/MS分析对培养基进行肉桂酰托品碱分析(图62)。使用串联MS/MS和片段化分析来检测和证实肉桂酰托品碱的标识。对应于肉桂酰托品碱的母体质量(m/z
12.1.3)基于实例12.1.2中描述的肉桂酰托品碱的272→124LC-MS/MS跃迁,开发了一种多反应监测(MRM)LC-MS/MS方法来测量从头肉桂酰托品碱产量。肉桂酰托品碱在实例12.1.2的经工程改造的菌株的细胞外培养基中积累至显著水平,但在不存在AtPAL1、At4CL5和EcCS的情况下并非如此(图62b)。基于标准曲线,从头产生的肉桂酰托品碱的滴度估计为6.0μg/L。
实例13:修饰生长培养基以提高TA和TA前体的产量
TA前体和TA的产生滴度可以通过改变培养基组成来提高。例如,培养基类型可以在培养基基础(例如,酵母蛋白胨、酵母氮基础)、碳源(例如,葡萄糖、麦芽糖糊精)和氮源(例如,氨基酸、硫酸铵、尿素)方面有所不同。培养基类型也可以在每种组分的相对比例(如碳源的浓度和氮源的浓度或每种单独氨基酸的浓度)上有所不同。
13.1)将产托品碱酵母菌株(如实例3中所述)最初在具有不同碳源的限定培养基(即具有硫酸铵和所有氨基酸的YNB)中生长,并在25℃下生长48小时之后测定托品碱产量。对于2%半乳糖观察到最高的托品碱产量(图63a)。然而,一些经工程改造的菌株在某些碳源(如甘油、阿拉伯糖和山梨醇)下不能生长或生长严重下降,这可能是由于不能将这些碳源同化到中心代谢中。
13.2)将产托品碱酵母菌株(如实例3中所述)在含2%右旋糖的限定培养基中培养生长并补充2%的额外碳源,并且在25℃生长48小时之后测定托品碱产量。对于2%右旋糖和2%甘油观察到最高的托品碱产量(图63b)。甘油是一种非糖碳源,它可以通过几种机制促进TA前体和TA的更高产量,包括细胞脂质膜的稳定、异源蛋白质的折叠和稳定性的改善以及细胞色素P450和一些短链脱氢酶/还原酶的活性所需的NADPH辅因子的再生(参见Li,Y.等人.Complete biosynthesis of noscapine and halogenated alkaloids in yeast.Proc.Natl.Acad.Sci.U.S.A.2018,115(17)E3922-E3931)。
13.3)经由缓解通量瓶颈和运送限制,可以实现经工程改造的酵母中的从头药用TA生物合成的改善。
13.3.1)经由瓶颈酶的过表达和培养基优化实现了TA产量的提高。由于CSY1296中的托品碱产量(约mg/L)不可能限制通至东莨菪碱(约μg/L)的通量,所以通过由CSY1296中的低拷贝质粒表达苯丙酮酸盐和东莨菪碱之间的每种异源酶的额外拷贝(图2)并测量TA和中间体的产量来标识限制东莨菪碱产量的代谢瓶颈。WfPPR和DsH6H的额外拷贝分别导致莨菪碱和东莨菪碱滴度增加64%和89%,表明这些酶是途径通量的主要限制因子(图64)。
13.3.2)通过将NtJAT1以及WfPPR和DsH6H的第二个拷贝整合到CSY1296中来构建改良的产东莨菪碱菌株。相对于CSY1296,所得菌株CSY1297表现示出莨菪碱和东莨菪碱积累分别增加到2.4倍和7.1倍(图65)。
实例14:使用监督学习模型预测推定TA转运蛋白。
尽管先前实例中描述的MATE转运蛋白(NtJAT1、NtMATE2)可以用于促进托品碱和托品碱样TA中间体输入到液泡中以通过利托林合酶进行酯化,但组装的托品烷酯从液泡向胞质溶胶的输出是代谢途径通量的关键限制。因此,在组装的TA酯(例如,利托林)上具有潜在活性的新TA转运蛋白的标识可能会提高经工程改造的非植物真核细胞(如酵母)中的TA产量。
14.1)经由常规的共表达分析策略,从可公开获得的颠茄转录组(参见密歇根州立大学药用植物基因组资源)中标识TA转运蛋白候选物。本数据集包括11个不同组织中的超过40,000种转录物中的每一种的丰度。在过滤数据集以仅保留按BLAST和蛋白质家族(PFAM)搜索注释为起小分子运送作用的转录物之后,生成线性回归模型以将每种转录物的组织特异性表达谱与诱饵基因利托林变位酶(CYP80F1)和莨菪碱6β-羟化酶/双加氧酶(H6H)的表达谱进行比较,然后将候选物经由层次聚类通过表达谱相似性进一步排列(图66)。发现近100种转运蛋白候选物与已知的TA生物合成基因共表达(P<0.01)并聚类。
14.2)由于常规回归/聚类分析产生的候选物列表太大,无法进行有效的实验验证,因此针对是否可在搜索空间提供大幅缩减,对监督分类方法进行评估。针对在从与实例14.1相同的转录组数据集中标识参与TA生物合成的基因的预测性能,对多个监督学习模型进行训练和评估。
14.2.1)使用BLAST功能注释,通过初始过滤步骤以去除不完整或零丰度转录物的约27,000种转录物中的每一种被赋予三个先验输出值中的一个,取决于它们在TA生物合成中的参与程度(图67);将已知参与(注释为“TA”)或不参与(注释为“nonTA”)所述途径的15,351种转录物用于模型训练、交叉验证和测试。使用两种不同的训练目标、四种不同的数据重采样技术(旨在用于高度类不平衡数据集)和两种性能度量(平衡精度和计算时间),对三个二元分类器模型(逻辑回归,LR;随机森林,RF;前馈神经网络,NN)进行训练、交叉验证和测试,以从组织丰度谱中预测TA相关基因。NN模型在训练参数的维持测试数据上表现出最大的平均预测精度(图68),而LR模型需要最少的平均计算时间,但人工重采样技术使RF和NN模型能够在相似的持续时间内进行训练和测试(图69)。
14.2.2)由于实例14.2.1中的具有最佳训练参数的所有三个分类器类型在测试数据上表现出可比较的平衡精度(>0.99)和计算时间(<3分钟),接下来针对三个最佳分类器中的每一个评估假阳性率和假阴性率(图70)。所有三个模型都正确预测了100%的“TA”基因(即零假阴性),而NN模型产生的假阳性比LR或RF分类器少得多;NN分类器预测的参与TA生物合成的转录物中有50%对应于已知的TA相关基因,相比之下,LR和RF模型则分别为11%和14%。在图71示出了具有五个节点的一个隐藏层的优化NN模型的架构。
14.3)经训练的NN分类器用于标识在TA生物合成(包括TA运送)中具有未表征作用的基因。
14.3.1)将最初被标识为编码基因且因是否参与TA途径“未知”(图67)而不用于模型训练或测试的11,409种转录物呈现给NN分类器,其预测33种转录物编码新型的TA相关基因产物(表5)。与侧根中的茄科TA生物合成的定位相一致,33个基因中的大多数在次生根中表现出强表达,在初生主根和愈伤组织中表现出中等表达,并且在茎、花、果实和叶中表现出低表达。三种转录物(注释为颠茄乳糖通透酶样1(AbLP1)、碳水化合物转运蛋白样1(AbCT1)和嘌呤摄取通透酶样1(AbPUP1))含有按同源性和蛋白质家族(PFAM)搜索注释的氨基酸序列,以编码有机小分子转运蛋白(表5)。AbPUP1示出了与已知TA酶编码基因高度相似的根特异性表达谱,而AbLP1和AbCT1在根中更丰富,但也在气生组织中表达。
14.3.2)由于序列比对表明了这些转录物中的一些的开放阅读框中的缺失区域,所以经由对更完整的转录组装配进行BLAST搜索,为来自实例14.3.1的推定TA转运蛋白候选物生成完整蛋白质序列(参见P.Srinivasan、C.D.Smolke,Biosynthesis of medicinaltropane alkaloids in yeast.Nature 585,614–619(2020)),并且针对从颠茄侧根组织合成的cDNA进行证实(表6)。
14.3.3)系统发生分析表明,三种推定TA转运蛋白中的每一种都属于不同的小分子转运蛋白家族(图72)。AbPUP1类似于嘌呤摄取通透酶(PUP)家族的成员,包括两种先前被证明在烟草中进行烟碱(NtNUP1)的细胞输入的转运蛋白(参见S.B.Hildreth等人,Tobacconicotine uptake permease(NUP1)affects alkaloid metabolism.Proc.Natl.Acad.Sci.U.S.A.108,18179–18184(2011))和罂粟中的苄基异喹啉生物碱(BIA)(PsBUP1)(参见M.Dastmalchi等人,Purine Permease-Type Benzylisoquinoline AlkaloidTransporters in Opium Poppy.Plant Physiol.181,916–933(2019))。相比之下,AbLP1属于NPF家族,其包括涉及长春花MIA生物合成的液泡膜定位的异胡豆苷输出物(CrNPF2.9)(参见R.M.E.Payne等人,An NPF transporter exports a central monoterpene indolealkaloid intermediate from the vacuole.Nat.Plants 3,1–9(2017));尽管AbCT1最初被注释为碳水化合物转运蛋白,但其似乎与拟南芥中的锌诱导的促进因子(ZIF)家族的液泡金属阳离子转运蛋白更密切相关。
实例15:酵母中的推定TA转运蛋白的表征。
针对TA产量会受限于细胞内运送的经工程改造的生物合成途径的背景下的活性,最初对实例14中标识的三种TA转运蛋白候选物进行筛选。如前述实例中所述,通过表达21种不同的酶并破坏五个代谢模块和五个亚细胞区室中的八种内源蛋白,将酵母菌株(CSY1297)工程改造成用于从头生物合成莨菪碱和东莨菪碱(参见P.Srinivasan、C.D.Smolke,Biosynthesis of medicinal tropane alkaloids in yeast.Nature585,614–619(2020))(图73-图75):模块I,其被设计成用于增加TA前体腐胺的积累;模块II,其被设计成用于使腐胺转化为TA酰基受体托品碱;模块III,其被设计成用于将苯丙氨酸转化为TA酰基供体苯基乳酸(PLA)葡糖苷;模块IV,其被设计成用于将TA酯化产物利托林转化为下游的TA莨菪碱和东莨菪碱;和模块V,其包括中心TA酯化反应,其中颠茄利托林合酶(先前观察到其作为与荧光蛋白DsRed的N端融合体(DsRed-AbLS)经由在液泡膜中的表达而在酵母中发挥功能)缩合托品碱和PLA葡糖苷以在液泡腔中产生利托林。由于不带电的PLA葡糖苷相对具有膜通透性,所以质子化的托品碱和利托林的液泡输入和输出分别是通至此模块的通量的主要限制(图73)。在实例11中观察到烟草液泡烟碱输入物NtJAT1和NtMATE2在产TA菌株(CSY1297)中单独表达时提高了此途径中的液泡托品碱输入。然而,还没有标识出有助于液泡利托林输出的转运蛋白。
15.1)评估了三种新标识的推定TA转运蛋白(参见实例14)影响本酵母平台中的TA积累的能力。AbPUP1、AbCT1和AbLP1各自由菌株CSY1300中的低拷贝质粒表达,所述菌株通过将NtMATE2的表达盒和选择标志物LEU2(被证明增加东莨菪碱积累;参见P.Srinivasan、C.D.Smolke,Biosynthesis of medicinal tropane alkaloids in yeast.Nature 585,614–619(2020))整合到TA产生菌株CSY1297的基因组中而构建;并且将转化体在选择性培养基中培养96小时。培养物上清液的液相色谱和串联质谱(LC-MS/MS)分析表明,AbPUP1和AbLP1增加TA产量,而AbCT1则不增加(图76)。相对于蓝色荧光蛋白(BFP)对照,AbPUP1表达使莨菪碱和东莨菪碱的积累分别增加到2.4倍和1.5倍(41μg/l和102μg/l),而AbLP1表达使这些产物的积累增加到2.0倍和1.3倍(35μg/l和88μg/l)。如先前对于实例11中的NtJAT1和NtMATE2的表达所观察,托品碱的积累没有任何显著增加,这表明AbPUP1和AbLP1可能反而运送液泡托品碱酯化下游的底物。
15.2)使用由低拷贝质粒表达AbPUP1和AbLP1 C端GFP融合体的CSY1300的荧光显微术评估推定TA转运蛋白的亚细胞定位(图77)。两种转运蛋白都与酵母液泡膜中的DsRed融合的利托林合酶强共定位,表明在液泡底物运送中起作用。
15.3)为了说明这些转运蛋白的结构和功能,我们使用TMHMM构建了蛋白质亲水性图和推定膜拓扑图,并使用C-I-TASSER生成了同源模型和基因本体(GO)图(图78、图79)。AbPUP1和AbLP1分别包括10个和12个跨膜α-螺旋(图78a-d),并且预测这两种转运蛋白都以面向胞质溶胶的N端和C端定向在液泡膜中(图78e)。对于真核嘌呤通透酶,此拓扑与底物从液泡腔(或细胞外空间)运送到胞质溶胶相一致(参见Y.Alguel等人,Structure ofeukaryotic purine/H+symporter UapA suggests a role for homodimerization intransport activity.Nat.Commun.7,1–9(2016))。GO预测确证,AbPUP1可能是对含氮有机化合物(例如,嘌呤或生物碱)具有特异性的细胞内转运蛋白(图79a-c),而AbLP1表现出与有机底物和阳离子的同向转运相一致的特征(图79d-f)。
15.4)为了确证它们作为液泡生物碱转运蛋白的预测作用,将AbPUP1和AbLP1的底物特异性和运送机制经由酵母中的生长和毒性测定进行表征。使用AD12345678(缩写为AD1-8)来进行这些测定,其是一种被工程改造成用于增加对异型生物质的敏感性(由于破坏了七种主要多药耐药性ABC及其转录调节因子)的酵母菌株。尽管AbPUP1和AbLP1主要在酵母液泡膜中发现,但细胞AbPUP1的一部分以及更小程度的AbLP1似乎也定位于质膜(图77)。基于液泡腔和细胞外空间的拓扑等价,当位于质膜中时,将底物从液泡输出到胞质溶胶的转运蛋白也应能够输入相同的细胞外底物,从而导致对高底物浓度的敏感性增加。
15.4.1)在补充有浓度在0和20mM之间的各种生物碱的液体选择性培养基中监测由低拷贝质粒表达AbPUP1、AbLP1或BFP对照的菌株AD1-8的生长(图80)。AbPUP1或AbLP1的表达赋予了对莨菪碱的高敏感性(θ
15.4.2)非由ATP水解驱动的许多植物生物碱转运蛋白反而依赖于质子梯度进行底物转运(参见N.Shitan、K.Kato、T.Shoji,Alkaloid transporters in plants.PlantBiotechnol.31,453–463(2014))。通过监测表达转运蛋白或BFP对照的AD1-8在补充有10mM莨菪碱的pH缓冲培养基中的生长,来研究酵母中的AbPUP1和AbLP1介导的生物碱敏感性的质子依赖性(图82)。通过增加缓冲液的pH,AbPUP1赋予的莨菪碱敏感性被消除,这表明AbPUP1的细胞莨菪碱输入(以及等效的液泡输出)是经由质子依赖性同向转运机制发生的。相反,AbLP1的莨菪碱运送似乎不是pH依赖性的。
15.4.3)为了确定AbPUP1或AbLP1的运送是否可以由其它常见同向转运阳离子中的梯度提供动力,在补充有莨菪碱和氯化钠或氯化钾的培养基中监测表达转运蛋白的酵母菌株的生长(图83)。AbPUP1的运送被Na
实例16.用于增加TA产量的酵母菌株工程改造和培养基优化。
先前实例中描述的经工程改造的酵母平台中的经典TA和新型的TA衍生物的产生都受到通至莨菪碱和东莨菪碱的低途径通量的阻碍。因此,组合几种代谢工程改造策略(包括运送工程改造、辅因子再生和培养基优化)来开发适合从头衍生研究的改良TA产生平台。
16.1)将先前确定的液泡托品碱输入物NtJAT1和NtMATE2并入到单一酵母菌株中作为TA梯度优化的起点。来自低拷贝质粒的NtMATE2与菌株CSY1299中的染色体NtJAT1的共表达将东莨菪碱产量增加了29%(24μg/l至31μg/l),并且CSY1300中的转运蛋白和LEU2选择标志物的染色体表达进一步增加了26%(38μg/l)(图84)。
16.2)前述实例中描述的经工程改造的TA途径并入了利用NADPH进行电子转移的五种酶(AbCYP82M3、DsTR1、WfPPR、AbCYP80F1和DsHDH)。由于过表达的酶对NADPH的消耗可能会限制途径通量,所以扩展细胞NADPH可用性可能会增加TA的积累。
16.2.1)在经由底物氧化(Ald6p、Idp1p-3p、Pdc6p、Zwf1p)或NAD(H)磷酸化(Pos5p、Yef1p、Utr1p)标识在中心代谢中驱动NADPH再生的天然酵母酶(图85)后,由CSY1300中的低拷贝质粒过表达每个相对应的基因,并且在转化菌株生长96小时后测量培养基中的TA积累(图86)。过氧化物酶体异柠檬酸盐脱氢酶(Idp3p)和丙酮酸盐脱羧酶(Pdc6p)的过表达分别使莨菪碱的产量相对于对照增加到2.5倍(29μg/l)和3.5倍(41μg/l),但东莨菪碱产量没有变化。
16.2.2)为了进一步增加TA产量,将实例16.2.1中描述的NADPH再生机制与液泡输出优化一起并入菌株CSY1323的构建中。将AbPUP1、AbLP1、IDP3和PDC6的表达盒与TPO5(其编码负责TA前体腐胺的高尔基体介导的胞吐作用的转运蛋白(参见K.Tachihara等人,Excretion of putrescine and spermidine by the protein encoded by YKL174c(TPO5)in Saccharomyces cerevisiae.J.Biol.Chem.280,12637–12642(2005)))的破坏同时整合到CSY1300的基因组中。在选择性培养基中生长96小时后,CSY1323产生的莨菪碱和东莨菪碱的滴度是CSY1300的26倍(56μg/l)和1.5倍(59μg/l)(图84)。
16.3)检查了氨基酸原养型对CSY1323中的TA产量的影响。先前已经观察到,经由LEU2过表达消除亮氨酸营养缺陷和增强NADH再生可促进东莨菪碱积累(参见P.Srinivasan、C.D.Smolke,Biosynthesis of medicinal tropane alkaloids inyeast.Nature 585,614–619(2020))。由于前述实例中描述的产TA菌株源于组氨酸原养型,所以通过由CSY1323中的低拷贝质粒过表达URA3和TRP1基因,来构建尿嘧啶和色氨酸原养型菌株(剩余的两种营养缺陷型)。来自野生型和原养型CSY1323菌株的96小时培养物的培养基上清液的LC-MS/MS分析表明,尽管尿嘧啶原养型并不提高TA产量(图87),但色氨酸原养型(注释为CSY1324)促进了莨菪碱(降低36%;56μg/l至36μg/l)向东莨菪碱(增加到2.9倍;59μg/l至172μg/l)的转化(图84)。
16.4)用于调节不同TA产物的相对积累的方法可能有助于特定衍生物的发现和产生。由于AbPUP1以质子依赖和钾抑制的方式运送莨菪碱但不运送东莨菪碱,所以可以使用培养基pH缓冲及其对细胞TA运送的伴随效应来影响莨菪碱:东莨菪碱产量比。在用0.1M磷酸钾(K
实例17.计算预测的药用TA衍生物在酵母中的从头生物合成。
PNP衍生物的异源产生受到大多数生物合成酶的非天然底物耐受性和活性的有限信息的挑战。因此,可以使用用于计算机生物合成途径扩展的计算工具来扩展经工程改造的TA途径,以在非植物细胞(如酵母)中进行有用的衍生物的从头产生。
17.1)使用ATLASx途径预测实用程序(参见H.Mohammadi-peyhani等人.ATLASx:acomputational map for the exploration of biochemical space.bioRxiv,1–34(2021)),生成可以通过已知的酶活性在一个生物合成步骤中由莨菪碱和东莨菪碱产生的所有可能的衍生物的图(图90)。由于季胺表现出降低的血脑屏障通透性和中枢神经系统(CNS)毒性(参见K.L.Kohnen-Johannsen、O.Kayser,Tropane alkaloids:Chemistry,pharmacology,biosynthesis and production.Molecules 24,1–23(2019)),大多数市售TA衍生药物是托品烷酯的N-官能化衍生物(例如,曲司铵(trospium)、异丙托铵、噻托铵(tiotropium)、氧托铵(oxitropium)、N-丁基东莨菪碱)。由于仲胺TA的微生物产生可能有助于无N-甲基的药物衍生物(例如,曲司铵)的筛选、发现和从头生物合成,所以在ATLASx生成的图中搜索仲胺和季胺TA衍生物。预计可经由一步转化获得两类感兴趣的衍生物:N-去甲基化去甲托品烷生物碱(norTA)和托品烷N-氧化物(图90)。
17.2)N-去甲基化衍生物是包含TA可卡因在内的各种生物碱药物的肝分解代谢的副产物(参见B.W.LeDuc等人,Norcocaine and N-hydroxynorcocaine formation inhuman liver microsomes:Role of cytochrome P-450 3A4.Pharmacology 46,294–300(1993))。因此,一种或多种人肝CYP450酶(HsCYP)可能能够在酵母中进行莨菪碱和东莨菪碱N-去甲基化(图91)。由于先前在酵母中表达HsCYP的尝试观察到当与融合到人细胞色素b5(HsCYB5A)的酵母NADPH:CYP450还原酶(Ncp1p)配对时异源活性增加(参见H.Inui等人,Molecular characterization of specifically active recombinant fused enzymesconsisting of CYP3A4,NADPH-cytochrome P450oxidoreductase,and cytochromeb5.Biochemistry 46,10213–10221(2007)),所以由实例16中描述的优化TA产生菌株(CSY1324)中的低拷贝质粒将共同负责>80%的肝药物代谢的八种HsCYP中的每一种(参见U.M.Zanger、M.Schwab,Cytochrome P450enzymes in drug metabolism:Regulation ofgene expression,enzyme activities,and impact of geneticvariation.Pharmacol.Ther.138,103–141(2013))与Ncp1p-HsCYB5A融合蛋白共表达(图92)。使用为明确标识TA及其衍生物而开发的扩展LC-MS/MS方法(图93),分别在pH缓冲或无缓冲培养基中生长96小时后,分析每种HsCYP表达菌株的培养基的去甲莨菪碱和去甲东莨菪碱的产量(图94)。在阴性对照中观察到两种衍生物的低(≤5μg/l)积累,表明在本经工程改造的酵母平台中存在norTA合成的途径。在缓冲培养基(pH 5.8)和无缓冲培养基中,HsCYP2D6的表达分别将去甲莨菪碱和去甲东莨菪碱的产量提高到高于三倍(5μg/l至18μg/l)和近四倍(3μg/L至11μg/l),而HsCYP2C19的表达仅在无缓冲培养基中提高了去甲东莨菪碱的产量(3μg/l至9μg/l),这反映了norTA:TA产量比率从≤3%增加至近10%(图94、图95)。
17.3)与游离碱相比,衍生自生物碱N-氧化物的药物的水溶性更高且膜通透性更低,因此其可以具有更低的CNS破坏风险。尽管N-氧化物也被认为是哺乳动物中的生物碱分解代谢的痕量副产物(参见J.D.Phillipson等人,Metabolic N-oxidation of atropine,hyoscine and the corresponding nor-alkaloids by guinea-pig liver microsomalpreparations.J.Pharm.Pharmacol.28,687–691(1976),但尚未标识出TA N-加氧酶,并且在表达HsCYP的产TA酵母菌株中也未观察到N-氧化物积累(参见实例17.2)。使用集成到ATLASx网络服务器中的计算酶预测工具BridgIT(参见N.Hadadi等人,Enzyme annotationfor orphan and novel reactions using knowledge of substrate reactive sites.Proc.Natl.Acad.Sci.U.S.A.116,7298–7307(2019))来标识将莨菪碱和东莨菪碱转化为同源N-氧化物的推定酶候选物(表7)。两种TA的评分最高的酶预测是千里光碱N-加氧酶(SNO;KEGG R07373,EC 1.14.13.101),其是一种在一些食草昆虫中负责植物吡咯里西啶生物碱的解毒和武器化的NADPH和黄素依赖性单加氧酶(参见T.Hartmann、D.Ober,Defense bypyrrolizidine alkaloids:Developed by plants and recruited byinsects.Induc.Plant Resist.To Herbiv.213-231,(2008))。千里光碱的吡咯里西啶部分是SNO和相关吡咯里西啶N-加氧酶(PNO)的经典底物,其与在托品烷环中发现的官能团和原子连接性非常相似,这表明这些酶也可能具有对TA进行N-加氧的能力(图96)。由于PNO的底物范围似乎与其宿主昆虫的膳食生物碱多样性共同进化(参见M.Macel,Attract anddeter:A dual role for pyrrolizidine alkaloids in plant-insectinteractions.Phytochem.Rev.10,75–82(2011)),所以选择来自三种不同昆虫物种的PNO直向同源物在我们的酵母TA产生平台中进行测试:来自专食性动物朱砂蛾(Tyriajacobaeae朱砂蛾(cinnabar moth))的TjSNO;来自食野花的泛食性食草动物内华达虎蛾(Grammia geneura内华达虎蛾(Nevada tiger moth))的GgPNO;和来自全食草农业害虫臭腹腺蝗(Zonocerus variegatus臭腹腺蝗(harlequin locust))的ZvPNO(参见C.Naumann等人,Evolutionary recruitment of a flavin-dependent monooxygenase for thedetoxification of host plant-acquired pyrrolizidine alkaloids in thealkaloid-defended arctiid moth Tyria jacobaeae.Proc.Natl.Acad.Sci.U.S.A.99,6085–6090(2002);也参见S.Sehlmeyer等人,Flavin-dependent monooxygenases asadetoxification mechanismin insects:New insights from the arctiids(Lepidoptera).PLoS One 5(2010);也参见L.Wang等人,Independent recruitment of aflavin-dependent monooxygenase for safe accumulation of sequesteredpyrrolizidine alkaloids in grasshoppers and moths.PLoS One 7,(2012))。由CSY1324中的低拷贝质粒表达三种候选物中的每一种,并且在转化菌株在pH缓冲或无缓冲培养基中生长96小时之后,通过LC-MS/MS分析培养基。观察到表达ZvPNO的菌株从头产生莨菪碱N-氧化物(71μg/l,在缓冲培养基,pH 5.8中)和东莨菪碱N-氧化物(14μg/l,在无缓冲培养基中)(图97),这确证了ATLASx/BridgIT预测,即SNO/PNO酶可以对TA进行N-加氧。
表1:作为经工程改造的代谢途径的组分的感兴趣的基因
/>
/>
/>
/>
/>
表2:莨菪胺脱氢酶(HDH)候选物和经实验验证的酶的示例性全长氨基酸序列。
/>
/>
表3:可以融合到丝氨酸羧肽酶样酰基转移酶的N端以实现非植物细胞中的功能性酰基转移酶表达的可溶性蛋白质结构域的示例性全长氨基酸序列。
表4:可以在经工程改造的非植物细胞中表达以跨细胞脂质膜转运TA、TA衍生物和/或TA前体的异源转运蛋白的示例性全长氨基酸序列。
表5.经由神经网络二元分类器标识的在TA生物合成中具有推定作用的未经表征的颠茄基因的实例。以下基因最初被归类为在参与TA生物合成方面“未知”,后来被经训练的神经网络分类器预测为参与TA生物合成。基于统一功能注释的推定TA代谢物转运蛋白为阴影。数值指示每个组织中的转录物丰度,示出为每百万作图读长的每千碱基转录物的片段数的以2为底的对数,即log2(FPKM)。组织缩写:FL,花;MS,成熟种子;PT,初生主根;SS,无菌苗;CA,愈伤组织;SR,次生根;ST,茎;RF,成熟果实;GF,未成熟果实;LF,叶;FB,花蕾。
表6.来自颠茄的经实验验证的推定TA转运蛋自的示例性cDNA和氨基酸序列。
/>
表7.被预测为催化莨菪胺和/或东莨菪碱的N-氧化的前十种酶候选物的BridgIT评分和最接近的数据库匹配的实例。
表8.快速LC-MS/MS(方法1)中的用于标识和定量托品碱、莨菪碱和东莨菪碱的示例性溶剂梯度。溶剂A是0.1%v/v甲酸水溶液;溶剂B是0.1%v/v甲酸的乙腈溶液。
表9.扩展LC-MS/MS(方法2)中的用于标识和定量TA衍生物的示例性溶剂梯度。溶剂A是0.1%v/v甲酸水溶液;溶剂B是0.1%v/v甲酸的乙腈溶液。
表10.用于标识和定量TA和衍生物的示例性LC-MS/MS多反应监测(MRM)参数。
表11:茄科植物叶浓缩物和澄清酵母培养基中可能存在的杂质的比较。尽管有附加条款,但本公开可以由以下条款限定:
条款1.一种产生托品烷生物碱产物、托品烷生物碱产物前体或托品烷生物碱产物衍生物的经工程改造的非植物细胞。
条款2.根据条款1所述的细胞,其中所述细胞是微生物细胞。
条款3.根据条款1或2所述的细胞,其中所述经工程改造的细胞包括用于编码多种酶的多个异源编码序列,其中所述酶中的至少一种选自由以下组成的群组:精氨酸脱羧酶、胍丁胺脲水解酶、胍丁胺酶、腐胺N-甲基转移酶、N-甲基腐胺氧化酶、吡咯烷酮合酶、托品酮合酶、细胞色素P450还原酶、托品酮还原酶、苯丙酮酸盐还原酶、3-苯基乳酸UDP-葡糖基转移酶84A27、利托林合酶、利托林变位酶、莨菪碱脱氢酶、莨菪碱6β-羟化酶/双加氧酶、可卡因合酶、后生动物肝细胞色素P450、千里光碱N-加氧酶、吡咯里西啶N-加氧酶和托品烷生物碱解毒酶。
条款4.根据条款1至3中任一项所述的细胞,其中所述经工程改造的细胞包括编码一种或多种转运蛋白的一个或多个异源编码序列,所述转运蛋白选自以下群组:多药耐药性转运蛋白、多向耐药性转运蛋白、ATP结合盒转运蛋白、多药和毒素挤出转运蛋白、硝酸盐转运蛋白1/肽转运蛋白家族转运蛋白、嘌呤摄取通透酶样转运蛋白和主要促进因子超家族转运蛋白。
条款5.根据条款1至4中任一项所述的细胞,其中在所述细胞中修饰内源精氨酸代谢。
条款6.根据条款1至5中任一项所述的细胞,其中条款所述细胞修饰内源苯丙氨酸和类苯丙酸代谢。
条款7.根据权利要求1至6中任一项所述的细胞,其中在所述细胞中破坏内源多胺调节机制。
条款8.根据条款1至7中任一项所述的细胞,其中在所述细胞中修饰内源乙酸盐代谢。
条款9.根据条款1至8中任一项所述的细胞,其中在所述细胞中修饰内源糖苷代谢。
条款10.根据条款1至9中任一项所述的细胞,其中所述细胞产生托品烷生物碱产物、托品烷生物碱产物前体或托品烷生物碱产物衍生物,所述托品烷生物碱产物选自由以下组成的群组:利托林、莨菪碱、阿托品、山莨菪碱、东莨菪碱、打碗花精、可卡因或非天然托品烷生物碱。
条款11.根据条款1至10中任一项所述的细胞,其中所述细胞产生托品烷生物碱产物衍生物,其选自由以下组成的群组:去甲托品烷生物碱和托品烷N-氧化物。
条款12.根据条款1至11中任一项所述的细胞,其中所述经工程改造的细胞包括编码多种酶的多个异源编码序列,所述酶包括融合到丝氨酸羧肽酶样酰基转移酶结构域的N端的一个或多个可溶性蛋白质结构域。
条款13.根据条款1至12中任一项所述的细胞,其中在所述细胞中修饰TA、TA前体和/或TA衍生物跨细胞内膜或跨质膜的转运。
条款14.一种用于产生托品烷生物碱、托品烷生物碱产物前体或托品烷生物碱产物衍生物的方法,其包括
(a)在适合于蛋白质产生的条件下培养根据条款1至13中任一项所述的细胞;
(b)向所述细胞培养物中加入起始化合物;和
(c)从所述培养物中回收所述托品烷生物碱或所述托品烷生物碱产物前体。
尽管出于清楚理解的目的已经通过图示和实例详细描述了前述发明,但显而易见的是,对于本领域普通技术人员来说,根据本发明的教导,在不脱离所附权利要求的精神或范围的情况下,可以对其进行某些改变和修改。
因此,前述内容仅仅说明了本发明的原理。将了解,本领域的技术人员将能够设计出各种布置,这些布置尽管没有本文中明确描述或示出,但其体现了本发明的原理并且应包含在其精神和范围内。此外,本文引用的所有实例和条件语言主要旨在帮助读者理解本发明的原理和发明人为促进本领域所贡献的概念,并且应被解释为不限于这些具体引用的实例和条件。此外,本文中叙述本发明的原理、方面和实施例及其具体实例的所有陈述旨在涵盖其结构和功能等同物。此外,此类等同物旨在包括当前已知的等同物和将来开发的等同物,即所开发的进行相同功能(不管结构如何)的任何元件。因此,本发明的范围并不旨在限于本文示出和描述的示例性实施例。相反,本发明的范围和精神由所附权利要求体现。
- 发光器件以及制造具有该发光器件的显示面板的方法
- 有机电致发光器件用材料及包含其的有机电致发光器件
- 发光器件、包括该发光器件的封装件及其制造方法
- 发光器件和发光器件封装
- 发光器件、包括发光器件的发光器件封装以及包括发光器件封装的发光装置
- 发光器件、包括发光器件的发光器件封装以及包括发光器件封装的发光装置
